用于预防和治疗炎症性肠病的生物多糖及其应用的制作方法
本发明涉及生物技术领域,尤其涉及一种具有预防和治疗炎症性肠病功效的生物多糖及其应用。
背景技术:
炎症性肠病是一类位于小肠和大肠由炎症和溃疡引起的慢性疾病,是种很难治愈的炎症疾病,主要有溃疡性结肠炎和克罗恩病两种类型。其临床特征是慢性发作性、症状多变和不可预测的消化道炎性病变。流行病学数据显示,全世界范围内炎症性肠病的发病率有明显增加趋势。
目前,炎症性肠病的治疗仍然是临床上一大难题,对炎症性肠病的治疗以三类药物(水杨酸类、类固醇激素和免疫抑制剂)为主,但是这三类药物对炎症性肠病的缓解率在80%左右,最佳的维持缓解方案也仅能使复发降低50%左右,约有1/3的病例最终需手术治疗。此外,这三类药不良反应较大,严重影响了其广泛运用。如水杨酸类药物柳氮磺吡啶,能够起到抗菌消炎和免疫抑制的作用,但常引起胃肠道反应、头痛、皮疹等不良反应,甚至抑制造血系统;而免疫抑制剂类药物如硫唑嘌呤,不仅起效慢,且毒性大,尤其是硫嘌呤s-甲基转移酶缺乏的患者,严重时甚至造成骨髓抑制及白细胞大量减少。此外,市场上也有针对细胞炎症因子(如肿瘤坏死因子tnf-α、白细胞介素il-12和il-23)的抗体类药物和活化抑炎因子tgf-β的smad7抑制剂等靶向性生物药,其效果优于免疫抑制剂,但总体不良反应发生率与免疫抑制剂无明显差异,且由于费用昂贵,不适于长期使用。因此,寻找新的治疗药物已是当今ibd研究领域的一大热点,本领域迫切需要开发新的、副作用小、治疗效果好的治疗炎症性肠病的药物。
技术实现要素:
本发明的目的是提供一种具有预防和治疗炎症性肠病功效的生物多糖及其应用。
本发明的第一方面,提供了一种β-葡聚糖的用途,用于制备一制剂或组合物,所述制剂或组合物用于预防和/或治疗炎症性肠病,和/或改善肠道菌群多样性和/或丰度。
在另一优选例中,所述预防和/或治疗炎症性肠病包括:
增加炎症性肠病患者体重、增加炎症性肠病患者结肠长度、改善炎症性肠病患者脾脏系数、改善肠道菌群多样性和/或丰度、抑制炎症因子的过表达、或其组合。
在另一优选例中,所述改善肠道菌群多样性和/或丰度,包括改善正常人群的肠道菌群多样性和/或丰度、改善肠道疾病患者的肠道菌群多样性和/或丰度。
在另一优选例中,所述改善肠道菌群多样性和/或丰度包括:
提高肠道微生物分类单元数、增加肠道微生物种类、提高肠道微生物的数量或丰度、提高肠道微生物多样性,或其组合。
在另一优选例中,所述的肠道微生物选自下组:
拟杆菌门、厚壁菌门、疣微菌门、saccharibacteria、或其组合。
在另一优选例中,所述的拟杆菌门包括:拟杆菌目s24-7组、普雷沃氏菌科、理研菌科。
在另一优选例中,所述的厚壁菌门包括:瘤胃菌科、毛螺旋菌科、消化球菌科、克里斯滕森菌科。
在另一优选例中,所述的疣微菌门包括阿克曼菌。
在另一优选例中,所述的β-葡聚糖还用于激活基础状态下巨噬细胞的免疫功能和/或抑制炎症状态下巨噬细胞的过度免疫反应。
在另一优选例中,所述的激活基础状态下巨噬细胞的免疫功能包括:促进巨噬细胞no分泌、促进巨噬细胞免疫相关的各种细胞因子mrna的表达、激活mapk信号通路、激活nf-κb信号通路、或其组合。
在另一优选例中,所述的炎症状态为脂多糖诱导的炎症状态,但不限于此。
在另一优选例中,所述的抑制炎症状态下巨噬细胞的过度免疫反应包括:抑制炎症状态下no异常增加、抑制炎症状态下细胞因子表达的异常增加、抑制炎症状态下mapk信号通路的活化、抑制炎症状态下nf-κb信号通路的活化、或其组合。
在另一优选例中,所述β-葡聚糖为β-d-葡聚糖。
在另一优选例中,所述β-葡聚糖为β-1,3-葡聚糖,优选地,具有β-1,6-分支的β-1,3-葡聚糖。
在另一优选例中,所述β-葡聚糖的结构如式i所示,
其中,l为≥0的整数,较佳地0-50,较佳地0-10,更佳地0-3,更佳地1-2,更佳地1;m为≥0的整数,较佳地为0-19,较佳地为0-4,更佳地为0-1,更佳地为0;n为≥3的整数,较佳地为30-60000,更佳地100-10000。
在另一优选例中,所述β-葡聚糖的分支度(db)为0.02-0.8,较佳地0.1-0.5,较佳地0.2-0.4。
在另一优选例中,所述β-葡聚糖包括具有三螺旋立体结构的β-葡聚糖。
在另一优选例中,所述三螺旋立体结构的β-葡聚糖的含量为80%,90%,95%,按β-葡聚糖的总摩尔量计。
在另一优选例中,所述β-葡聚糖的β-1,3-主链为三螺旋立体结构的主体。
在另一优选例中,所述β-葡聚糖的β-1,6-分支位于三螺旋立体结构的外侧。
在另一优选例中,所述β-葡聚糖的分子量≥2kd,较佳地2kd-40000kd,更佳地20kd-20000kd。
在另一优选例中,所述β-葡聚糖的分子量可以为5kd-35000kd;10kd-30000kd;50kd-25000kd;100kd-20000kd;200kd-18000kd;400kd-16000kd;500kd-14000kd;1000kd-12000kd;2000kd-4000kd;3000kd-5000kd;4000kd-6000kd;5000kd-7000kd;6000kd-8000kd;7000kd-9000kd;或者8000kd-10000kd。
在另一优选例中,所述β-葡聚糖选自下组:裂褶菌β-葡聚糖、香菇β-葡聚糖、小核菌β-葡聚糖、灰树花β-葡聚糖、侧耳多糖、蘑菇β-葡聚糖、酵母β-葡聚糖、燕麦β-葡聚糖、或其组合。
在另一优选例中,所述β-葡聚糖为裂褶菌β-葡聚糖。
在另一优选例中,所述香菇β-葡聚糖为每5个β-1,3-的主链,带有2个β-1,6-的分支,且每个分支1个葡萄糖残基的β-葡聚糖。
在另一优选例中,所述β-葡聚糖的纯度≥70%,较佳地≥90%,更佳地≥95%,更佳地≥99%。
在另一优选例中,所述β-葡聚糖具有良好的稳定性。
在另一优选例中,所述β-葡聚糖呈固态形式或液态形式,如β-葡聚糖固体颗粒或粉末、或β-葡聚糖水溶液。
在另一优选例中,所述β-葡聚糖颗粒或粉末的粒径≤20mm,较佳地0.001-10mm,更佳地0.01-5mm,更佳地0.1-2mm。
在另一优选例中,所述β-葡聚糖为完全水溶的β-葡聚糖。
在另一优选例中,所述β-葡聚糖(颗粒或粉末)具有良好的水溶性和/或天然可溶性。
在另一优选例中,所述β-葡聚糖(颗粒或粉末)在25℃水(100g)中的溶解度≥0.0001g,较佳地0.01-50g,更佳地0.1-10g。
在另一优选例中,所述β-葡聚糖(颗粒或粉末)在25℃水(100g)中的溶解度可以为0.1-100g;0.2-90g;0.5-80g;1-50g;或者,所述溶解度可以为0.1-0.3g;0.2-0.4g;0.3-0.5g;0.4-0.6g;0.5-0.7g;0.6-0.8g;0.7-0.9g;0.8-1g;或者1-3g;2-4g;3-5g;4-6g;5-7g;6-8g;7-9g;8-10g。
在另一优选例中,所述β-葡聚糖溶液为β-葡聚糖在水中的溶液,即β-葡聚糖水溶液。
在另一优选例中,所述β-葡聚糖(水)溶液粘度大;较佳地,质量浓度为0.5%的β-葡聚糖水溶液(25℃时)粘度≥40mpa·s,更佳地100-10000mpa·s,更佳地500-2000mpa·s。
在另一优选例中,所述质量浓度为0.5%的β-葡聚糖水溶液(25℃)粘度可以为50-10000mpa·s;100-9000mpa·s;200-8000mpa·s;300-7000mpa·s;400-6000mpa·s;450-5000mpa·s;500-5000mpa·s;550-4000mpa·s;600-3000mpa·s;650-2000mpa·s;700-1500mpa·s。
在另一优选例中,所述质量浓度为1%的β-葡聚糖的水溶液具有高澄清度或高透光率,所述质量浓度为1%的β-葡聚糖水溶液的透光率≥50%,较佳地≥80%,较佳地≥85%,更佳地≥95%;
在另一优选例中,所述β-葡聚糖溶液具有良好的稳定性。
本发明的第二方面,提供了一种制剂,所述制剂包含β-葡聚糖。
在另一优选例中,所述制剂含有(a)β-葡聚糖;以及任选的(b)药学上、食品学上、化妆品学上、或器械类可接受的载体或赋形剂。
在另一优选例中,所述制剂含有(a)裂褶菌β-葡聚糖;以及任选的(b)药学上、食品学上、化妆品学上、或器械类可接受的载体或赋形剂。
在另一优选例中,所述β-葡聚糖选自下组:裂褶菌β-葡聚糖、香菇β-葡聚糖、小核菌β-葡聚糖、灰树花β-葡聚糖、侧耳多糖、蘑菇β-葡聚糖、酵母β-葡聚糖、燕麦β-葡聚糖、或其组合。
在另一优选例中,所述β-葡聚糖为完全水溶的β-葡聚糖。
在另一优选例中,所述β-葡聚糖为裂褶菌β-葡聚糖。
在另一优选例中,所述制剂为裂褶菌β-葡聚糖,且所述β-葡聚糖具有良好的水溶性、天然可溶性和/或复溶性。
在另一优选例中,所述制剂中的β-葡聚糖呈固态形式或液体形式。
在另一优选例中,所述制剂含有0.0001-99wt%,较佳地0.001-90wt%,更佳地0.01-50wt%,更佳地0.05-10wt%的β-葡聚糖,按制剂的总重量计。
在另一优选例中,所述β-葡聚糖在所述制剂中的质量浓度为≥1μg/ml,具体可以为1μg/ml-200mg/ml,或者1μg/ml-5mg/ml,或者1μg/ml-1mg/ml。
在另一优选例中,所述制剂中包含β-葡聚糖水溶液,所述β-葡聚糖的质量浓度为0.0001-50wt%,较佳地0.02-10wt%,更佳地0.05-5wt%,按β-葡聚糖水溶液的总重量计。
在另一优选例中,所述制剂中β-葡聚糖水溶液的含量≥80wt%,较佳地≥90wt%,更佳地≥95wt%,更佳地≥99wt%,更佳地≥99.5wt%,按制剂的总重量计。
在另一优选例中,所述制剂中的β-葡聚糖具有选自下组一个或多个特征:
(1)所述β-葡聚糖的纯度≥70%,较佳地≥90%,更佳地≥95%,更佳地≥99%;
(2)所述β-葡聚糖具有良好的水溶性、复溶性和/或天然可溶性;
(3)所述β-葡聚糖(固体颗粒或粉末)在25℃水中的溶解度≥0.0001g/100g水,较佳地0.01-50g/100g水,更佳地0.1g-10g/100g水;
(4)所述β-葡聚糖的水溶液具有高澄清度或高透光率;优选地,所述质量浓度为1%的β-葡聚糖水溶液的透光率≥50%,较佳地≥80%,较佳地≥85%,更佳地≥95%;
(5)所述β-葡聚糖溶液粘度大;优选地,质量浓度为0.5%的β-葡聚糖水溶液(25℃时)粘度≥40mpa·s,更佳地100-10000,更佳地600-2000mpa·s;
(6)所述β-葡聚糖的水溶液具有良好的稳定性;和/或
(7)所述β-葡聚糖的分子量≥2kd,较佳地2kd-40000kd,更佳地20kd-20000kd。
在另一优选例中,所述制剂还含有(c)第二活性成分,所述第二活性成分为不同于所述β-葡聚糖的预防和/或治疗炎症性肠病的活性成分。
较佳地,所述的第二活性成分选自下组:非特异性抗炎药物(包括氨基水杨酸及其类似物、类固醇激素和免疫抑制剂)、生物制品(包括炎症因子靶向抗体药物、抗白细胞黏附分子制剂、小分子抑制剂)、抗生素、益生菌、中药和/或中药活性成分、或其组合。
所述氨基水杨酸及其类似物,包括柳氮磺吡啶(sulfasalazine)、5-氨基水杨酸(5-aminosalicylicacid)、美沙拉秦(mesalazine)、巴柳氮(baisaiazide)、奥柳氮(olsalazine)、及其组合;
所述类固醇激素,包括氢化可的松、强的松、强的松龙、地塞米松、硫氢可的松、酸氯地米松、二丙酸倍氯米松、布地奈德、二丙布地奈德、及其组合;
所述免疫抑制剂,包括硫唑嘌呤(azathioprine)、6-巯基嘌呤(6-mercaptopurine)、甲氨蝶呤(methotrexate)、环磷酰胺(cyclophosphamide)、环孢素(cyclosporin)、来氟米特(leflunomide)、沙利度胺(thalidomide)、他克莫司(tacrolimus)、及其组合;
所述抗炎症因子靶向药物,包括抗tnf-α、il-1、il-12、il-23作用的抗体,具体包括英夫利昔单抗(infliximab)、依那西普(etanercrpt)、阿达木单抗(adalimumab)、戈利木单抗(golimumab)、优特克单抗(ustekinumab)、briakinumab、古赛库单抗(guselkumab)、蒂尔他昔单抗(tildrakizumab)、risankizumab(原名bi655066)、阿那白滞素(anakinra)、及其组合;
所述抗白细胞黏附分子制剂,包括维多珠单抗(vedolizumab)、那他珠单抗(natalizumab)、etrolizumab、carotegrast、及其组合;
所述小分子抑制剂,包括托法替尼(tofacitinib)、upadacitinib、filgotinib、蒙格森(mongersen)、己酮可可碱(pentoxifylline)、阿普斯特(apremilast)、及其组合;
所述生物制品还包括、ozanimod、fingolimod、奈米布单抗(namilumab)、赛妥珠单抗(certolizumab)、及其组合;
所述抗生素,包括甲硝唑、氯醇硝唑、环丙沙星、克拉霉素、利福昔明、及其组合;
所述益生菌,包括乳杆菌、双歧杆菌、芽孢杆菌、地衣芽孢杆菌、枯草杆菌、肠球菌、嗜热链球菌、酪酸梭菌、及其组合;
所述中药,包括健脾补肾类、益气固肠类、活血化瘀类、清热解毒类中药,具体包括黄芪、白术、茯苓、人参、莲子、山药、知母、槐耳、党参、木香、刺五加、五味子、乌梅、五倍子、陈皮、诃子、肉豆蔻、石榴皮、白扁豆、砂仁、蜂蜜、川芎、当归、三七、香附、干姜、丹参、苦参、黄芩、黄连、黄精、枸杞子、桑葚、白芍、车前子、白头翁、秦皮、败酱草、茯苓、薏苡仁、雷公藤、半夏、甘草、防风、桔梗、柚皮、冬凌草、马齿苋、细辛、肉桂、荔枝核、及其组合;
所述中药活性成分,是指提取或合成的中药活性成分,来源于包括健脾补肾类、益气固肠类、活血化瘀类、清热解毒类中药,具体包括黄芪、白术、茯苓、人参、莲子、山药、知母、槐耳、党参、木香、刺五加、五味子、乌梅、五倍子、陈皮、诃子、肉豆蔻、石榴皮、白扁豆、砂仁、蜂蜜、川芎、当归、三七、香附、干姜、丹参、苦参、黄芩、黄连、黄精、枸杞子、桑葚、白芍、车前子、白头翁、秦皮、败酱草、茯苓、薏苡仁、雷公藤、半夏、甘草、防风、桔梗、柚皮、冬凌草、马齿苋、细辛、肉桂、荔枝核、及其组合的提取物。
在另一优选例中,所述组合物或制剂的剂型为固体剂型、半固体剂型、或液体剂型。
在另一优选例中,所述制剂(含漱剂)可以是液体制剂、胶囊制剂、凝胶制剂、粉剂、片剂、颗粒剂、浓缩剂。
在另一优选例中,所述制剂可以是溶液剂、混悬剂、乳剂、灌肠剂、栓剂、膜剂。
在另一优选例中,所述制剂为口服制剂或粘膜给药制剂。
在另一优选例中,所述制剂用于预防和/或治疗炎症性肠病,和/或改善肠道菌群多样性和/或丰度。
本发明的第三方面,提供了一种组合物产品,所述组合物产品包括:
(1)第一组合物,所述第一组合物含有(a)第一活性成分,所述第一活性成分为β-葡聚糖;和(b)药学上、食品学上、化妆品学上、或器械类可接受的载体或赋形剂;以及
(2)第二组合物,所述第二组合物为炎症性肠病治疗药物或其他肠胃道疾病的治疗药物。
在另一优选例中,所述β-葡聚糖选自下组:裂褶菌β-葡聚糖、香菇β-葡聚糖、小核菌β-葡聚糖、灰树花β-葡聚糖、侧耳多糖、蘑菇β-葡聚糖、酵母β-葡聚糖、燕麦β-葡聚糖、或其组合。
在另一优选例中,所述β-葡聚糖为裂褶菌的β-葡聚糖。
在另一优选例中,所述第一组合物含有0.0001-99wt%,较佳地0.001-90wt%,更佳地0.01-50wt%,更佳地0.05-10wt%的β-葡聚糖,按第一组合物的总重量计。
在另一优选例中,所述炎症性肠病治疗药物或其他肠胃道疾病的治疗药物含有(a)第二活性成分,所述第二活性成分为不同于所述β-葡聚糖的活性成分;和(b)药学上、食品学上、化妆品学上、或器械类可接受的载体或赋形剂。
在另一优选例中,所述活性成分选自下组:非特异性抗炎药物(包括氨基水杨酸及其类似物、类固醇激素和免疫抑制剂)、生物制品(包括炎症因子靶向抗体药物、抗白细胞黏附分子制剂、小分子抑制剂)、抗生素、益生菌、中药和/或中药活性成分、或其组合。
所述氨基水杨酸及其类似物,包括柳氮磺吡啶(sulfasalazine)、5-氨基水杨酸(5-aminosalicylicacid)、美沙拉秦(mesalazine)、巴柳氮(baisaiazide)、奥柳氮(olsalazine)、及其组合;
所述类固醇激素,包括氢化可的松、强的松、强的松龙、地塞米松、硫氢可的松、酸氯地米松、二丙酸倍氯米松、布地奈德、二丙布地奈德、及其组合;
所述免疫抑制剂,包括硫唑嘌呤(azathioprine)、6-巯基嘌呤(6-mercaptopurine)、甲氨蝶呤(methotrexate)、环磷酰胺(cyclophosphamide)、环孢素(cyclosporin)、来氟米特(leflunomide)、沙利度胺(thalidomide)、他克莫司(tacrolimus)、及其组合;
所述抗炎症因子靶向药物,包括抗tnf-α、il-1、il-12、il-23作用的抗体,具体包括英夫利昔单抗(infliximab)、依那西普(etanercrpt)、阿达木单抗(adalimumab)、戈利木单抗(golimumab)、优特克单抗(ustekinumab)、briakinumab、古赛库单抗(guselkumab)、蒂尔他昔单抗(tildrakizumab)、risankizumab(原名bi655066)、阿那白滞素(anakinra)、及其组合;
所述抗白细胞黏附分子制剂,包括维多珠单抗(vedolizumab)、那他珠单抗(natalizumab)、etrolizumab、carotegrast、及其组合;
所述小分子抑制剂,包括托法替尼(tofacitinib)、upadacitinib、filgotinib、蒙格森(mongersen)、己酮可可碱(pentoxifylline)、阿普斯特(apremilast)、及其组合;
所述生物制品还包括、ozanimod、fingolimod、奈米布单抗(namilumab)、赛妥珠单抗(certolizumab)、及其组合;
所述抗生素,包括甲硝唑、氯醇硝唑、环丙沙星、克拉霉素、利福昔明、及其组合;
所述益生菌,包括乳杆菌、双歧杆菌、芽孢杆菌、地衣芽孢杆菌、枯草杆菌、肠球菌、嗜热链球菌、酪酸梭菌、及其组合;
所述中药,包括健脾补肾类、益气固肠类、活血化瘀类、清热解毒类中药,具体包括黄芪、白术、茯苓、人参、莲子、山药、知母、槐耳、党参、木香、刺五加、五味子、乌梅、五倍子、陈皮、诃子、肉豆蔻、石榴皮、白扁豆、砂仁、蜂蜜、川芎、当归、三七、香附、干姜、丹参、苦参、黄芩、黄连、黄精、枸杞子、桑葚、白芍、车前子、白头翁、秦皮、败酱草、茯苓、薏苡仁、雷公藤、半夏、甘草、防风、桔梗、柚皮、冬凌草、马齿苋、细辛、肉桂、荔枝核、及其组合;
所述中药活性成分,是指提取或合成的中药活性成分,来源于包括健脾补肾类、益气固肠类、活血化瘀类、清热解毒类中药,具体包括黄芪、白术、茯苓、人参、莲子、山药、知母、槐耳、党参、木香、刺五加、五味子、乌梅、五倍子、陈皮、诃子、肉豆蔻、石榴皮、白扁豆、砂仁、蜂蜜、川芎、当归、三七、香附、干姜、丹参、苦参、黄芩、黄连、黄精、枸杞子、桑葚、白芍、车前子、白头翁、秦皮、败酱草、茯苓、薏苡仁、雷公藤、半夏、甘草、防风、桔梗、柚皮、冬凌草、马齿苋、细辛、肉桂、荔枝核、及其组合的提取物。
在另一优选例中,所述第一组合物和第二组合物为各自独立的、或合二为一的。
在另一优选例中,所述组合物为药物组合物。
在另一优选例中,所述组合物产品为药物、辅助治疗药物、食品、或特殊食品。
在另一优选例中,所述组合物产品用于预防和/或治疗炎症性肠病。
在另一优选例中,所述组合物产品用于改善肠道菌群多样性和/或丰度。
本发明的第四方面,提供了一种预防和/或治疗炎症性肠病的方法,包括步骤:(a)给需要的对象施用β-葡聚糖。
在另一优选例中,所述β-葡聚糖选自下组:裂褶菌β-葡聚糖、香菇β-葡聚糖、小核菌β-葡聚糖、灰树花β-葡聚糖、侧耳多糖、蘑菇β-葡聚糖、酵母β-葡聚糖、燕麦β-葡聚糖、或其组合。
在另一优选例中,所述β-葡聚糖为裂褶菌β-葡聚糖。
在另一优选例中,所述的对象包括炎症性肠病患者、或正常人群。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
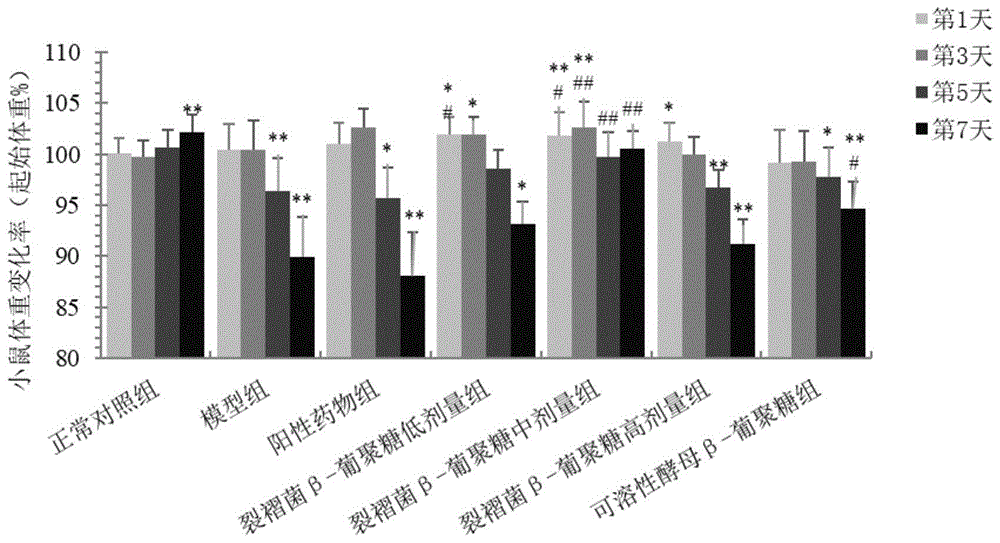
图1显示了裂褶菌β-葡聚糖具有增加溃疡性结肠炎模型小鼠体重的作用。具体地,c57bl/6小鼠适应性喂养一周后,将小鼠随机分为正常对照组、模型组、阳性药物组(柳氮磺吡啶150μg/g)、不同剂量的裂褶菌β-葡聚糖组(浓度分别为10、50和100μg/g),以及可溶性酵母β-葡聚糖组(50μg/g)等7组,每组10只,并灌胃给药16天,期间自由饮水;之后建溃疡性结肠炎小鼠模型,将饮水换成新鲜配制的3%dss溶液,自由饮用5天,期间继续按原分组灌胃给药;撤去dss溶液,改成正常饮用水,自由饮用2天,期间继续按原分组灌胃给药。检测建模期(第1-5天)以及建模结束后2日(第6-7天)小鼠的体重。以各组小鼠建模(自由饮用3%硫酸葡聚糖钠)第0天的体重为标准(100%),统计建模期(第1-5天)以及建模结束后2日(6-7天)小鼠的标准化体重。柱状图显示了第1天、第3天、第5天、第7天各组小鼠的标准化体重,数据以各组内小鼠的标准化平均体重±标准误表示,n=10(阳性药物组n=9)。与所在组内第0天的标准化平均体重相比,*p<0.05,**p<0.01;与同一天模型组小鼠的标准化平均体重相比,#p<0.05,##p<0.01,n=9~10。
图2显示裂褶菌β-葡聚糖具有恢复溃疡性结肠炎小鼠结肠长度的作用。具体地,各组药物处理的溃疡性结肠炎模型小鼠,处死后,收集结肠,并测量长度。其中图2a为结肠照片,图2b为结肠长度统计图,数据以组内小鼠结肠长度的平均值±标准误表示,n=10(阳性药物组n=9);与正常对照组相比,**p<0.01;与模型组相比,##p<0.01。。
图3显示了裂褶菌β-葡聚糖具有降低溃疡性结肠炎小鼠脾脏系数的作用。具体地,各组药物处理的溃疡性结肠炎模型小鼠,处死后取脾脏称重。各组数据,均以组内小鼠脾脏系数的平均值±标准误表示,n=10(阳性药物组n=9);与正常对照组相比,*p<0.05,**p<0.01;与模型组相比,#p<0.05,##p<0.01。
图4显示了裂褶菌β-葡聚糖具有增加正常小鼠肠道微生物的分类单元的作用。具体地,各组正常小鼠,药物预处理16天后,取粪便进行16srrna测序分析。其中,图4a为各组小鼠每一只独立个体的分类单元(otu)数值,图4b为对每组分类单元进行统计分析的结果,图4c为所有分类单元中细菌总数。图4b和图4c中数据以组内小鼠的平均值±标准误表示,n=9~10;与正常对照组相比,**p<0.01。
图5显示了裂褶菌β-葡聚糖具有增加溃疡性结肠炎模型小鼠肠道微生物分类单元的作用。具体地,各组溃疡性结肠炎模型小鼠,在处死前取粪便,进行16srrna测序分析。其中,图5a为各组小鼠每一只独立个体的分类单元(otu)数值,图5b为对每组分类单元进行统计分析的结果,图5c为所有分类单元中细菌总数。图5b和图5c中数据以组内小鼠的平均值±标准误表示,n=4~6;与正常对照组相比,**p<0.01,与模型组相比,#p<0.05,##p<0.01。
图6显示了建模前后同一只小鼠肠道菌群otu和细菌总数的变化。具体地,各组小鼠,在药物预处理16天时(建模前)和处死前,分别取粪便,进行16srrna测序分析。其中,图6a为各组中同一只小鼠独立个体的分类单元(otu)数值,图6b为各组中同一只小鼠独立个体的细菌总数。
图7显示了裂褶菌β-葡聚糖对建模前小鼠肠道微生物物种结构的影响。具体地,各组正常小鼠,在药物预处理的第16天,取粪便2-3粒,保存于stooldnastabilizer中送检,进行16srrna测序分析。其中,图7a、图7b、图7c、图7d、图7e分别为每只独立小鼠肠道微生物otu的门、纲、目、科、属水平的分析。展示前15个物种在每个样本中的比例关系,同时展示这15个物种在该样本中所占比例。每个柱子代表一个样本,不同色块代表相应层次的不同的类,色块的长度为该类序列占该样本的总序列数的比例。
图8显示了裂褶菌β-葡聚糖对溃疡性结肠炎模型小鼠肠道微生物物种结构的影响。具体地,各组溃疡性结肠炎模型小鼠,在处死前取粪便,进行16srrna测序分析。其中,图8a、图8b、图8c、图8d、图8e分别为每只独立小鼠肠道微生物otu的门、纲、目、科、属水平的分析。展示前15个物种在每个样本中的比例关系,同时展示这15个物种在该样本中所占比例。每个柱子代表一个样本,不同色块代表相应层次的不同的类,色块的长度为该类序列占该样本的总序列数的比例。
图9显示了裂褶菌β-葡聚糖对拟杆菌目s24-7组微生物丰度的影响。其中,图9a为拟杆菌目s24-7组,图9b为拟杆菌目s24-7组中未培养部分。
图10显示了裂褶菌β-葡聚糖对拟杆菌目s24-7组中ambiguous_taxa和肠道宏基因组微生物丰度的影响。其中图10a为建模前药物预防对ambiguous_tax的影响,图10b为建模后药物治疗对ambiguous_taxa的影响,图10c为建模前药物预防对肠道宏基因组的影响,图10d为建模后药物治疗对肠道宏基因组的影响。
图11显示了裂褶菌β-葡聚糖对普雷沃氏菌科微生物丰度的影响。其中图11a为建模前药物预处理的影响,图11b为建模后药物治疗的影响。
图12显示了裂褶菌β-葡聚糖对普雷沃氏菌科拟普雷沃菌属、paraprevotella和普雷沃氏菌科ga6a1组等属微生物丰度的影响。其中图12a为拟普雷沃菌属,图12b为paraprevotella,图12c为普雷沃氏菌科ga6a1组,图12d为普雷沃氏菌科其他属。
图13显示了裂褶菌β-葡聚糖对理研菌科微生物丰度的影响。其中图13a为建模前药物预处理对理研菌科的影响,图13b为建模后药物治疗对理研菌科的影响。
图14显示了裂褶菌β-葡聚糖对理研菌科alistipes和理研菌科rc9肠道组等属微生物丰度的影响。其中图14a为建模前药物预处理对alistipes的影响,图14b为建模后药物治疗对alistipes的影响,图14c为建模前药物预处理对理研菌科rc9肠道组的影响,图14d为建模后药物治疗对理研菌科rc9肠道组的影响。
图15显示了裂褶菌β-葡聚糖预处理对正常小鼠肠道微生物中瘤胃菌科颤杆菌克、ruminiclostridium9、anaerotruncus和瘤胃菌科ucg-003等属微生物丰度的影响。其中图15a为颤杆菌克的结果,图15b为ruminiclostridium9的结果,图15c为anaerotruncus的结果,图15d为瘤胃菌科ucg-003的结果。
图16显示了裂褶菌β-葡聚糖对瘤胃菌科ruminiclostridium6和ucg-005等属微生物丰度的影响。其中图16a为建模前药物预处理对ruminiclostridium6的影响,图16b为建模后药物治疗对ruminiclostridium6的影响,图16c为建模前药物预处理对瘤胃菌科ucg-005的影响,图16d为建模后药物治疗对瘤胃菌科ucg-005的影响。
图17显示了裂褶菌β-葡聚糖对瘤胃菌科ucg-014和ucg-010属微生物丰度的影响。其中图17a为建模前药物预处理对瘤胃菌科ucg-014的影响,图17b为建模后药物治疗对瘤胃菌科ucg-014的影响,图17c为建模前药物预处理对瘤胃菌科ucg-010的影响,图17d为建模后药物治疗对瘤胃菌科ucg-010的影响。
图18显示了裂褶菌β-葡聚糖对毛螺旋菌科微生物丰度的影响。其中图18a为建模前药物预处理对毛螺旋菌科的影响,图18b为建模后药物治疗对毛螺旋菌科的影响。
图19显示了裂褶菌β-葡聚糖对毛螺旋菌科罗氏菌属、毛螺旋菌科fcs020组、marvinbryantia和tyzzerella等属微生物丰度的影响。其中图19a为建模前药物预处理对罗氏菌属的影响,图19b为建模后药物治疗对罗氏菌属的影响,图19c为建模前药物预处理对毛螺旋菌科fcs020组的影响,图19d为建模后药物治疗对毛螺旋菌科fcs020组的影响,图19e为建模后药物治疗对marvinbryantia的影响,图19f为建模后药物治疗对tyzzerella的影响。
图20显示了裂褶菌β-葡聚糖对毛螺旋菌科断链真杆菌组和acetatifactor等属微生物丰度的影响。其中图20a为建模前药物预处理对断链真杆菌组的影响,图20b为建模后药物治疗对断链真杆菌组的影响,图20c为建模前药物预处理对acetatifactor的影响,图20d为建模后药物治疗对acetatifactor的影响。
图21显示了裂褶菌β-葡聚糖对消化球菌科微生物丰度的影响。其中图21a为建模前药物预处理对消化球菌科的影响,图21b为建模后药物治疗对消化球菌科的影响,图21c为建模前药物预处理对消化球菌属的影响,图21d为建模后药物治疗对消化球菌属的影响。
图22显示了裂褶菌β-葡聚糖对克里斯滕森菌科微生物丰度的影响。其中图22a为建模前药物预处理对克里斯滕森菌科的影响,图22b为建模后药物治疗对克里斯滕森菌科的影响。
图23显示了裂褶菌β-葡聚糖对saccharibacteria微生物丰度的影响。其中图23a为建模前药物预处理对saccharibacteria的影响,图23b为建模后药物治疗对saccharibacteria的影响。
图24显示了溃疡性结肠炎小鼠组间otu韦恩图。其中,a为正常对照组、b为模型组、e为裂褶菌β-葡聚糖中剂量组、f为裂褶菌β-葡聚糖高剂量组,g为可溶性酵母β-葡聚糖组。
图25显示了裂褶菌β-葡聚糖对正常小鼠肠道微生物的alpha多样性指数分组比较箱形图。其中图25a为反映样本out数量的指数observedspecies,图25b为丰富度指数chao1,图25c为均匀度指数shannon,图25d为均匀度指数simpson。
图26显示了裂褶菌β-葡聚糖对溃疡性结肠炎小鼠肠道微生物的alpha多样性指数分组比较箱形图。其中图26a为反映样本out数量的指数observedspecies,图26b为丰富度指数chao1,图26c为均匀度指数shannon,图26d为均匀度指数simpson。
图27显示了基于unweightedunifrac距离的主坐标分析图。其中,图27a为正常小鼠的分析图,图27b为溃疡性结肠炎小鼠的分析图。图中每个点代表一个样本,横轴表示主坐标分析中的第一主坐标,纵轴表示第二主坐标。图中点之间的距离越近,表示对应的样品间组成越相似。
图28显示裂褶菌β-葡聚糖抑制溃疡性结肠炎小鼠结肠组织il-6的mrna水平。具体地,各组数据以平均值±标准误表示,n=6;与正常对照组相比,**p<0.01;与模型组相比,#p<0.05,##p<0.01。
图29为裂褶菌β-葡聚糖对raw264.7巨噬细胞存活率的影响。与未经β-葡聚糖处理的空白对照组相比,*p<0.05,n=6。
图30为裂褶菌β-葡聚糖对raw264.7巨噬细胞inos和no水平的影响。其中图30a显示了inosmrna表达水平(n=3),图30b显示了no标准曲线,图30c显示了no释放量(n=4)。与空白对照组相比,*p<0.05,**p<0.01。
图31为裂褶菌β-葡聚糖对raw264.7细胞因子tnf-α、il-1β、il-6、il-10和趋化因子mcp-1、cxcl10mrna表达的影响。其中图31a为tnf-α、图31b为il-1β、图31c为il-6、图31d为il-10,图31e为mcp-1、图31f为cxcl10。与空白对照组相比,*p<0.05,**p<0.01,***p<0.001;n=3。
图32为市售水分散性酵母β-葡聚糖对raw264.7细胞因子tnf-α和il-1βmrna表达的影响。其中图32a为tnf-α、图32b为il-1β。与空白对照组相比,*p<0.05;n=3。
图33为裂褶菌β-葡聚糖对raw264.7巨噬细胞mapk信号通路的影响。
图34为裂褶菌β-葡聚糖对raw264.7巨噬细胞nf-κb信号通路的影响。
图35为裂褶菌β-葡聚糖预防后,脂多糖对raw264.7细胞no生成的影响。其中图35a为no标准曲线,图35b为细胞no生成量。与空白对照组相比,**p<0.01;与脂多糖刺激组相比,##p<0.01;n=4。
图36为β-葡聚糖预防后,脂多糖对raw264.7细胞因子表达的影响。其中图36a和图36b分别为裂褶菌β-葡聚糖预防后,脂多糖对tnf-α和il-1βmrna表达的影响,图36c和图36d分别为市售可溶性酵母β-葡聚糖预防后,脂多糖对tnf-α和il-1βmrna表达的影响。与空白对照组相比,**p<0.01;与脂多糖刺激组相比,#p<0.05,##p<0.01,###p<0.001;n=3。
图37为裂褶菌β-葡聚糖预防后,脂多糖对raw264.7巨噬细胞mapk信号通路的影响。
图38为裂褶菌β-葡聚糖预防后,脂多糖对raw264.7巨噬细胞nf-κb信号通路的影响。
图39为β-葡聚糖对脂多糖刺激后raw264.7细胞因子表达的治疗作用。其中图39a、图39c和图39e分别为裂褶菌β-葡聚糖对脂多糖刺激后巨噬细胞tnf-α、il-1β和il-6mrna表达的治疗作用,图39b、图39d和图39f分别为市售分散性酵母β-葡聚糖对脂多糖刺激后巨噬细胞tnf-α、il-1β和il-6mrna表达的治疗作用。与空白对照组相比,*p<0.05,**p<0.01;与脂多糖刺激组相比,#p<0.05,##p<0.01;n=3。
图40显示了制备实施例中制备的裂褶菌β-葡聚糖的傅里叶变换红外光谱图。
具体实施方式
本发明人经过广泛而深入的研究,首次意外地发现,β-葡聚糖,尤其是具有天然可溶性、高分子量、高粘度的β-葡聚糖(如裂褶菌β-葡聚糖),能够非常有效地预防和/或治疗炎症性肠病。实验表明,裂褶菌β-葡聚糖能够改善肠道菌群多样性,增加患病小鼠的体重和结肠长度、降低脾脏系数,抑制炎症因子的过表达,激活小鼠免疫,从而预防和/或治疗炎症性肠病,在此基础上,完成了本发明。
术语说明
除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。
如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换言之,所述术语也包括“基本上由…构成”、或“由…构成”。
如本文所用,术语“完全水溶”指所述固态形式的β-葡聚糖,可以在水中完全溶解成为β-葡聚糖水溶液,即在25℃100g水中β-葡聚糖的溶解度≥0.0001g,较佳地0.01-50g,更佳地0.1g-10g。
如本文所用,术语“天然可溶性”指天然状态的β-葡聚糖本身所具有的、在水中完全溶解形成水溶液的性质。所述“天然状态的β-葡聚糖”,是指使用天然方法生产得到(如生物发酵)的β-葡聚糖,所述β-葡聚糖没有经过任何化学改性、并且没有经过任何物理的和/或化学的和/或生物的方法将其长链分子打断而降低其分子质量。在另一优选例中,本发明β-葡聚糖为天然状态的β-葡聚糖。
β-葡聚糖
β-葡聚糖是一种天然多糖,在自然环境中可以找到相当多种类的β-葡聚糖,通常存在于特殊种类的细菌、酵母菌、真菌(灵芝)的细胞壁中,也可存在于高等植物种子的包被中。β-葡聚糖的生产方法主要有两种,其一是从燕麦等谷物或蘑菇等子实体真菌中直接提取;其二是通过真菌或细菌的液体发酵,经由对发酵液进行提取加工,以获得β-葡聚糖。
如本文所用,“本发明β-葡聚糖”、“本发明生物多糖”可互换使用,主要是指本发明第一方面所述的β-葡聚糖,所述β-葡聚糖选自下组:裂褶菌β-葡聚糖、香菇β-葡聚糖、小核菌β-葡聚糖、灰树花β-葡聚糖、侧耳多糖、蘑菇β-葡聚糖、酵母β-葡聚糖、燕麦β-葡聚糖、或其组合;优选地裂褶菌β-葡聚糖。
如本文所用,“裂褶菌β-葡聚糖”指来源于裂褶菌的β-葡聚糖。
在另一优选例中,所述β-葡聚糖的结构如式i所示。
在另一优选例中,所述β-葡聚糖的分子量≥2kd,较佳地2kd-40000kd,更佳地20kd-20000kd。
在另一优选例中,所述β-葡聚糖的分子量可以为5kd-35000kd;10kd-30000kd;50kd-25000kd;100kd-20000kd;200kd-18000kd;400kd-16000kd;500kd-14000kd;1000kd-12000kd;2000kd-4000kd;3000kd-5000kd;4000kd-6000kd;5000kd-7000kd;6000kd-8000kd;7000kd-9000kd;或者8000kd-10000kd。
在另一优选例中,所述β-葡聚糖的纯度≥70%,较佳地≥90%,更佳地≥95%,更佳地≥99%。
在另一优选例中,所述β-葡聚糖具有良好的稳定性。
在另一优选例中,所述β-葡聚糖呈固态形式或液态形式,如β-葡聚糖固体颗粒或粉末、或β-葡聚糖水溶液。
在另一优选例中,所述β-葡聚糖颗粒或粉末的粒径≤20mm,较佳地0.001-10mm,更佳地0.01-5mm,更佳地0.1-2mm。
在另一优选例中,所述β-葡聚糖(颗粒或粉末)具有良好的水溶性和/或天然可溶性。
在另一优选例中,所述β-葡聚糖(颗粒或粉末)在25℃水(100g)中的溶解度≥0.0001g,较佳地0.01-50g,更佳地0.1-10g。
在另一优选例中,所述β-葡聚糖(颗粒或粉末)在25℃水(100g)中的溶解度可以为0.1-100g;0.2-90g;0.5-80g;1-50g;或者,所述溶解度可以为0.1-0.3g;0.2-0.4g;0.3-0.5g;0.4-0.6g;0.5-0.7g;0.6-0.8g;0.7-0.9g;0.8-1g;或者1-3g;2-4g;3-5g;4-6g;5-7g;6-8g;7-9g;8-10g。
在另一优选例中,所述β-葡聚糖溶液为β-葡聚糖在水中的溶液,即β-葡聚糖水溶液。
在另一优选例中,所述β-葡聚糖(水)溶液粘度大;较佳地,质量浓度为0.5%的β-葡聚糖水溶液(25℃时)粘度≥40mpa·s,更佳地100-10000mpa·s,更佳地500-2000mpa·s。
在另一优选例中,所述质量浓度为0.5%的β-葡聚糖水溶液(25℃)粘度可以为50-10000mpa·s;100-9000mpa·s;200-8000mpa·s;300-7000mpa·s;400-6000mpa·s;450-5000mpa·s;500-5000mpa·s;550-4000mpa·s;600-3000mpa·s;650-2000mpa·s;700-1500mpa·s。
在另一优选例中,所述质量浓度为1%的β-葡聚糖的水溶液具有高澄清度或高透光率,所述质量浓度为1%的β-葡聚糖水溶液的透光率≥50%,较佳地≥80%,较佳地≥85%,更佳地≥95%;
在另一优选例中,所述β-葡聚糖溶液具有良好的稳定性。
在另一优选例中,所述β-葡聚糖来源于高等植物或者各种细菌、真菌。
本发明的实施例具体以裂褶菌的发酵产物为例,但不限于此。
制剂或组合物
本发明提供一种用于预防和/或治疗炎症性肠病的制剂或组合物,所述制剂或组合物含有(a)β-葡聚糖;以及任选的(b)药学上、食品学上可接受的载体或赋形剂。
在另一优选例中,所述制剂或组合物含有(a)裂褶菌β-葡聚糖;以及任选的(b)药学上、食品学上、化妆品学上、或器械类可接受的载体或赋形剂。
在另一优选例中,所述制剂或组合物含有0.0001-99wt%,较佳地0.001-90wt%,更佳地0.01-50wt%,更佳地0.05-10wt%的β-葡聚糖(优选地裂褶菌β-葡聚糖),按制剂或组合物的总重量计。
在另一优选例中,所述β-葡聚糖在所述制剂或组合物中的质量浓度为≥1μg/ml,具体可以为1μg/ml-200mg/mll,或者1μg/ml-5mg/ml,或者1μg/ml-1mg/ml。
在另一优选例中,所述制剂含有裂褶菌β-葡聚糖水溶液,所述制剂中裂褶菌β-葡聚糖水溶液的含量≥80wt%,较佳地≥90wt%,更佳地≥95wt%,更佳地≥99wt%,更佳地≥99.5wt%,按制剂的总重量计。
在另一优选例中,所述制剂中,裂褶菌β-葡聚糖水溶液中的裂褶菌β-葡聚糖的质量浓度为0.0001-50wt%,较佳地0.02-10wt%,更佳地0.05-5wt%,按裂褶菌β-葡聚糖水溶液的总重量计。
本发明所述制剂或组合物中的“活性成分(第一活性成分)”是指本发明所述的β-葡聚糖(优选地裂褶菌β-葡聚糖)。
本发明所述的“活性成分(第一活性成分)”、制剂和/或组合物可用于预防和/或治疗炎症性肠病。
“第二活性成分”是指本发明中不同于所述β-葡聚糖的治疗炎症性肠病的活性成分。
在优选的实施方式中,第二活性成分选自下组:非特异性抗炎药物(包括氨基水杨酸及其类似物、类固醇激素和免疫抑制剂)、生物制品(包括炎症因子靶向抗体药物、抗白细胞黏附分子制剂、小分子抑制剂)、抗生素、益生菌、中药和/或中药活性成分、或其组合。
所述氨基水杨酸及其类似物,包括柳氮磺吡啶(sulfasalazine)、5-氨基水杨酸(5-aminosalicylicacid)、美沙拉秦(mesalazine)、巴柳氮(baisaiazide)、奥柳氮(olsalazine)、及其组合;
所述类固醇激素,包括氢化可的松、强的松、强的松龙、地塞米松、硫氢可的松、酸氯地米松、二丙酸倍氯米松、布地奈德、二丙布地奈德、及其组合;
所述免疫抑制剂,包括硫唑嘌呤(azathioprine)、6-巯基嘌呤(6-mercaptopurine)、甲氨蝶呤(methotrexate)、环磷酰胺(cyclophosphamide)、环孢素(cyclosporin)、来氟米特(leflunomide)、沙利度胺(thalidomide)、他克莫司(tacrolimus)、及其组合;
所述抗炎症因子靶向药物,包括抗tnf-α、il-1、il-12、il-23作用的抗体,具体包括英夫利昔单抗(infliximab)、依那西普(etanercrpt)、阿达木单抗(adalimumab)、戈利木单抗(golimumab)、优特克单抗(ustekinumab)、briakinumab、古赛库单抗(guselkumab)、蒂尔他昔单抗(tildrakizumab)、risankizumab(原名bi655066)、阿那白滞素(anakinra)、及其组合;
所述抗白细胞黏附分子制剂,包括维多珠单抗(vedolizumab)、那他珠单抗(natalizumab)、etrolizumab、carotegrast、及其组合;
所述小分子抑制剂,包括托法替尼(tofacitinib)、upadacitinib、filgotinib、蒙格森(mongersen)、己酮可可碱(pentoxifylline)、阿普斯特(apremilast)、及其组合;
所述生物制品还包括、ozanimod、fingolimod、奈米布单抗(namilumab)、赛妥珠单抗(certolizumab)、及其组合;
所述抗生素,包括甲硝唑、氯醇硝唑、环丙沙星、克拉霉素、利福昔明、及其组合;
所述益生菌,包括乳杆菌、双歧杆菌、芽孢杆菌、地衣芽孢杆菌、枯草杆菌、肠球菌、嗜热链球菌、酪酸梭菌、及其组合;
所述中药,包括健脾补肾类、益气固肠类、活血化瘀类、清热解毒类中药,具体包括黄芪、白术、茯苓、人参、莲子、山药、知母、槐耳、党参、木香、刺五加、五味子、乌梅、五倍子、陈皮、诃子、肉豆蔻、石榴皮、白扁豆、砂仁、蜂蜜、川芎、当归、三七、香附、干姜、丹参、苦参、黄芩、黄连、黄精、枸杞子、桑葚、白芍、车前子、白头翁、秦皮、败酱草、茯苓、薏苡仁、雷公藤、半夏、甘草、防风、桔梗、柚皮、冬凌草、马齿苋、细辛、肉桂、荔枝核、及其组合;
所述中药活性成分,是指提取或合成的中药活性成分,来源于包括健脾补肾类、益气固肠类、活血化瘀类、清热解毒类中药,具体包括黄芪、白术、茯苓、人参、莲子、山药、知母、槐耳、党参、木香、刺五加、五味子、乌梅、五倍子、陈皮、诃子、肉豆蔻、石榴皮、白扁豆、砂仁、蜂蜜、川芎、当归、三七、香附、干姜、丹参、苦参、黄芩、黄连、黄精、枸杞子、桑葚、白芍、车前子、白头翁、秦皮、败酱草、茯苓、薏苡仁、雷公藤、半夏、甘草、防风、桔梗、柚皮、冬凌草、马齿苋、细辛、肉桂、荔枝核、及其组合的提取物;
“安全有效量”指的是:活性成分的量足以明显改善病情或症状,而不至于产生严重的副作用。
通常,药物组合物含有1-2000mg活性成分/剂,更佳地,含有10-200mg活性成分/剂。较佳地,所述的“一剂”为一个药片或一支注射针剂。
“药学上可接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。
“相容性”在此指的是组合物中各组份能和本发明的活性成分以及它们之间相互掺和,而不明显降低活性成分的药效。
药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如
在另一优选例中,本发明β-葡聚糖可与大分子化合物或高分子通过非键合作用形成复合物。
在另一优选例中,本发明β-葡聚糖可通过化学键与大分子化合物或高分子相连接。所述大分子化合物可以是生物大分子如高聚糖、蛋白、核酸、多肽等。
本发明的活性成分或组合物的施用方式没有特别限制,代表性的施用方式包括但不限于:外敷、口服、瘤内、直肠、肠胃外(静脉内、肌肉内或皮下)等。
固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。
在这些固体剂型中,活性成分与至少一种常规惰性赋形剂或载体混合,如柠檬酸钠或磷酸二钙,或与下述成分一种或多种混合:
(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;
(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;
(c)保湿剂,例如,甘油;
(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;
(e)缓溶剂,例如石蜡;
(f)吸收加速剂,例如,季胺化合物;
(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;
(h)吸附剂,例如,高岭土;和/或
(i)润滑剂,例如,滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。
胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
所述的固体剂型还可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性成分的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。
液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性成分外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例如,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。
除了活性成分外,悬浮液可包含悬浮剂,例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物等。
组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水和非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
使用药物组合物时,是将安全有效量的本发明组合物施用于需要治疗的哺乳动物(如人),其中施用时剂量为药学上认为的有效给药剂量,对于60kg体重的人而言,日给药剂量通常为1~10000mg,较佳地10~2000mg,更佳地20~1000mg。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
本发明还提供了一种组合物产品,所述组合物产品包括:
(1)第一组合物,所述第一组合物含有(a)第一活性成分,所述第一活性成分为β-葡聚糖;和(b)药学上、食品学上、化妆品学上、或器械类可接受的载体或赋形剂;以及
(2)第二组合物,所述第二组合物为不同于第一组合物的炎症性肠病治疗药物。
本发明组合物可以单独给药,或者与其他治疗药物联合给药(如配制在同一组合物中)。
本发明组合物也可以与已知的治疗或改进相似病状的其它药物联用。联合给药时,原来药物的给药方式和剂量保持不变,而同时或随后使用本发明组合物。药物联用也包括在重叠的时间段使用本发明组合物与其它一种或几种已知药物。当本发明组合物与其它一种或几种药物进行药物联用时,本发明组合物或已知药物的剂量可能比它们单独用药时的剂量较低。
本发明的主要优点包括:
(a)本发明β-葡聚糖(如裂褶菌β-葡聚糖)能够非常有效地预防和/或治疗炎症性肠病,增加患病小鼠的体重和结肠长度、降低脾脏系数,抑制炎症因子的过表达。
(b)本发明β-葡聚糖可以改善肠道菌群多样性,可以提高肠道微生物otu数值、提高肠道微生物的数量、提高肠道微生物alpha多样性、提高肠道微生物beta多样性。
(c)本发明β-葡聚糖可以增强基础状态下巨噬细胞的免疫功能,同时抑制炎症状态下巨噬细胞的过度免疫反应,具有双向免疫调节的作用。
(d)本发明β-葡聚糖(优选地裂褶菌β-葡聚糖)为纯天然来源的生物多糖,具有完全可溶性或天然可溶性,并且未经过任何化学和/或物理的改性或修饰。
(e)本发明β-葡聚糖完整保留了三螺旋的三维构象,具有更好的预防和/或治疗炎症性肠病活性。
(f)本发明β-葡聚糖具有极佳的稳定性,能够与大多数物质共存而保持其活性,因而应用领域广泛,可与其他炎症性肠病治疗药物结合使用。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂、设备等,如无特殊说明,均可从商业途径得到。
制备实施例
β-葡聚糖的制备以及测定
本实施例仅以裂褶菌发酵获得的β-葡聚糖为例,但不限于此。
一、裂褶菌菌种发酵液的获得
下述实施例中的发酵液通过发酵裂褶菌菌种(裂褶菌schizophyllumcommunefr—1003,产品目录:
1、裂褶菌菌种活化:将马铃薯200g/l、葡萄糖30g/l、氯化钠10g/l、琼脂20g/l制成平板培养基,把裂褶菌菌种接种到该平板培养基上,于25℃恒温培养箱内培养7天得到平板菌丝体;
2、种子活化:将马铃薯淀粉100g/l、葡萄糖40g/l、酵母浸膏2g/l、酵母浸粉2g/l、水制成的液体培养基装入摇瓶,装液量为1/3,取步骤1所得的平板菌丝体接种该摇瓶,于25℃恒温摇床内160rpm震荡培养培养7天,作为种子液;
3、发酵培养:将葡萄糖50g/l、蔗糖50g/l、黄豆粉(山东招远市温计食品有限公司)5g/l、酵母浸粉2g/l、磷酸二氢钾0.5g/l、七水合硫酸镁0.5g/l、硫酸铵0.5g/l、硝酸钾6g/l和水制成的发酵培养基加入发酵罐中121℃灭菌15分钟,再将步骤2所得的种子液接种上述发酵罐中,25℃恒温300rpm搅拌4lpm通气发酵培养8天,得到裂褶菌发酵液。
二、β-葡聚糖的分离纯化及β-葡聚糖溶液的制备
(1)将上述第一部分得到的裂褶菌发酵液与4倍体积的蒸馏水混合,60℃下浸煮8h,得到浸煮液;
(2)将步骤(1)得到的浸煮液在4,000rpm离心5min,取上清液;将上清液用300目的滤布负压过滤,取滤出清液待用,即为浸煮清液;
(3)将步骤(2)过滤后的浸煮清液加热至50℃,向其中同时加入200目的木质活性炭及8~16目的椰壳活性炭,每种活性炭的添加体积为浸煮清液体积的1%。于50℃,350rpm条件下持续搅拌4h,冷却后待用,得到混合有活性炭的浸煮清液;再将混合有活性炭的浸煮清液依次使用300目滤布及scp-321#滤板(孔径大小约1.5μm)进行负压抽滤,取过滤后的清液待用;
(4)将solarbio脂肪酶(l8070,酶活力100~400u/mg)溶于生理磷酸盐缓冲液中,按10u/ml的酶用量,将脂肪酶溶液加入步骤(3)制备的滤液中,搅拌均匀后40℃酶解2h;再将solarbio中性蛋白酶(z8030,酶活力>60u/mg)溶于生理磷酸盐缓冲液中,按60u/ml的酶用量,将中性蛋白酶溶液加入上述酶解液中,搅拌均匀后,40℃酶解2h。酶解结束后90℃水浴加热30min,以灭酶活,再以scp-321#滤板(孔径大小约1.5μm)进行负压抽滤,取过滤后的清液待用;
(5)将步骤(4)过滤后的清液快速与95%浓度的食用乙醇混合(体积比为1:3),搅拌,直至得到析出物;再将析出物重新溶解至原体积,后快速与95%浓度的食用乙醇混合(体积比为1:3),搅拌,直至得到析出物;
(6)将步骤(5)得到的析出物置于带孔托盘中,使用电热烘箱40℃烘干,直至恒重,得干燥产物;
(7)将上述步骤(6)得到的β-葡聚糖干燥物粉碎,称取粉碎物5g,溶解于1,000ml超纯水中,维持600rpm搅拌2h,直至β-葡聚糖充分溶解,得到β-葡聚糖溶液;将上述β-葡聚糖溶液使用5μm滤膜进行负压抽滤,并添加适量化妆品用防腐剂后,即可得到浓度为0.5%的高粘度、高透光率的β-葡聚糖溶液。
该质量浓度为0.5%的β-葡聚糖溶液在600nm波长(以分光光度计检测)下的透光率可以达到90%,40℃时粘度可达600mpa·s以上。
三、β-葡聚糖的鉴定与检测
1、β-葡聚糖的红外光谱鉴定
对上述0.5%的β-葡聚糖溶液进行鉴定,具体按照《中华人民共和国药典》(2010版)二部附录iv中方法c使用红外光谱法,将105℃烘干后的样品,使用傅里叶变换红外光谱仪进行全波长扫描。结果上述第二部分步骤(7)得到的0.5%溶液为β-葡聚糖溶液。
与酵母β-葡聚糖行业标准qbt4572-2013中酵母β-葡聚糖的红外光谱图对比,官能团位置基本吻合。如图40所示,主要的官能团位置为:
1)3301cm-1附近有较强,较宽的吸收峰(糖类o-h键伸缩振动吸收峰)
2)2921cm-1附近有较弱的吸收峰(糖类c-h键伸缩振动吸收峰)
3)886cm-1附近有较弱的吸收峰(糖类β构型特征振动吸收峰)
4)1076cm-1附近有较强的吸收峰(糖类c-oh,c-o-c伸缩振动吸收峰)
傅里叶变换红外光谱测试结果表明,本实施例得到的产物为β-葡聚糖。
2、β-葡聚糖的含量检测
对上述第二部分步骤(6)得到的干燥产物进行β-葡聚糖定量检测,具体按照酵母β-葡聚糖行业标准qbt4572-2013中酵母β-葡聚糖含量测定方法,将得到的β-葡聚糖干燥物样品研磨至直径1.0mm左右后进行。结果产物中β-葡聚糖含量为99.23%。
3、β-葡聚糖溶液的激素检测
对上述0.5%的裂褶菌β-葡聚糖溶液进行48项激素测定,具体按照《化妆品安全技术规范》(2015年版)第四章2.4雌三醇等7种组分第一法高压液相色谱-二极管阵列检测器法和gb/t24800.2-2009化妆品中四十一种糖皮质激素的测定液相色谱/串联质谱法和薄层层析法进行。
结果发现,上述0.5%的裂褶菌β-葡聚糖溶液中,未检出上述激素。
4、β-葡聚糖溶液的粘度测定
按照第二部分步骤(7)的方法,配制0.3%、0.5%、0.8%、1.0%(质量体积比)的β-葡聚糖水溶液,于25℃时分别检测动力粘度。结果随着β-葡聚糖含量的提高,各样品的粘度也递增,分别为472、740、2150和3100mpa·s。
取市售分散性(不溶于水)酵母β-葡聚糖颗粒(购自wellmune公司),准确称取2g,加入去离子水混合,并定容至200ml,得到质量体积比为1.0%的酵母β-葡聚糖混悬液,于25℃时检测动力粘度。结果该1.0%的酵母β-葡聚糖混悬液的动力粘度为0mpa·s。
取市售可溶性酵母β-葡聚糖粉末(购自wellmune公司),准确称取2g,加入去离子水溶解,并定容至200ml,得到质量体积比为1.0%的酵母β-葡聚糖水溶液,于25℃时检测动力粘度。结果该1.0%的酵母β-葡聚糖水溶液的动力粘度为0mpa·s。
上述动力粘度的测定方法如下:
(1)取200ml上述溶液样品,置于250ml烧杯中;
(2)将盛有上述溶液/混合液样品的烧杯置于水浴锅中,25℃保温1h;
(3)使用旋转粘度计,检测25℃下各样品的动力粘度。
5、β-葡聚糖溶液的透光率测定
按照第二部分步骤(7)的方法,配制0.3%、0.5%、0.8%、1.0%(质量体积比)的β-葡聚糖水溶液,于600nm波长处测定溶液透光率,结果,各样品的透光率分别为96.5%、93.1%、87.5%和81.1%。
取市售1.0%的燕麦β-葡聚糖溶液(购自symrise公司),于600nm波长处测定溶液透光率,结果透光率为59.7%。
取市售分散性酵母β-葡聚糖颗粒,准确称取2g,加入去离子水混合,并定容至200ml,得到质量体积比为1.0%的酵母β-葡聚糖混悬液,于600nm波长处测定混悬液透光率,结果透光率仅为1.3%。
取市售可溶性酵母β-葡聚糖粉末,准确称取2g,加入去离子水溶解,并定容至200ml,得到质量体积比为1.0%的酵母β-葡聚糖水溶液,于600nm波长处测定溶液透光率,结果透光率为68.4%。
上述透光率的测定方法如下:
(1)取10ml上述溶液样品置于离心管中;
(2)1000rpm低速离心1min,以去除气泡(两种酵母β-葡聚糖溶液/悬液无气泡,未经离心处理);
(3)小心取3ml至1cm玻璃比色皿内,避免气泡;
(4)使用分光光度计,以去离子水作为空白参照(去离子水的透光率为100%计),于600nm波长处测定样品透光率。
6、β-葡聚糖溶液的稳定性测定
按照第二部分步骤(7)的方法,配制0.5%、0.8%、1.0%(质量体积比)的β-葡聚糖水溶液,加入防腐剂后,室温(未避光)放置24个月,观察溶液稳定性,并检测溶液动力粘度和透光率。结果,上述三种溶液状态均十分稳定,其粘度和透光率变化不大,其中透光率甚至有所提高。
取市售1.0%的燕麦β-葡聚糖溶液,室温(未避光)放置24个月,观察溶液稳定性,并检测溶液动力粘度和透光率。结果,该1.0%的燕麦β-葡聚糖溶液状态十分不稳定,室温放置3个月后就有固形物析出,导致其粘度和透光率无法检测。
实施例1实验动物分组及建模
雄性c57bl/6小鼠,6周龄,购自上海斯莱克实验动物有限公司。按照实验目的,将小鼠随机分为正常对照组、模型组、阳性药物组(柳氮磺吡啶150μg/g)、不同剂量的裂褶菌β-葡聚糖组(浓度分别为10、50和100μg/g),以及可溶性酵母β-葡聚糖组(50μg/g)等7组,每组10只。
以口服硫酸葡聚糖钠(dss,分子量36000-50000,购自美国mpbiomedicais)溶液的方法,建立小鼠急性肠炎模型。具体为:
1)将dss溶于无菌蒸馏水中,制备3%的dss溶液;
2)实验用c57bl/6小鼠,适应性喂养1周后,根据实验目的进行分组,并灌胃给药16天(按小鼠体重准确计算给药量),期间自由饮水;收集小鼠粪便备用;
3)将饮水换成新鲜配制的3%dss溶液,自由饮用5天,期间继续按原分组灌胃给药;
4)撤去dss溶液,改成正常饮用水,自由饮用2天,期间继续按原分组灌胃给药;
5)处死小鼠,收集脏器、血液及粪便等样品,备用。
如表1所示,向各组的建模小鼠给药。
表1小鼠急性肠炎模型的分组及给药
实施例2小鼠体重变化的检测
自小鼠自由饮用3%dss溶液的建模之日起,检测小鼠每日体重变化。以各组小鼠建模第0天的体重为标准(100%),统计建模期(第1-5天)以及建模结束后2日(6-7天)小鼠体重的变化率。每组小鼠10只(阳性药物组1只小鼠死亡,参与统计的为9只)。通过与所在组内第0天的小鼠平均体重相比,评价同一种药物在不同时间段内对小鼠体重的影响;与同一天模型组小鼠的平均体重相比,评价不同药物对小鼠体重下降的保护作用。
结果如图1和表2所示,不同药物处理的小鼠,体重表现出不同的变化趋势。具体结果如下:
1)正常组小鼠体重较为稳定,到第7天有极显著增加(p<0.01)。
2)模型组小鼠前4天较为稳定,第5天开始体重极显著下降(p<0.01),同时出现严重的拉稀和便血,且随着时间延长,体重持续下降。
3)阳性治疗药物150μg/g的柳氮磺吡啶作用下,实验性急性肠炎小鼠的体重没有得到显著改善(与模型组相比,p>0.05)。
4)裂褶菌β-葡聚糖对实验性急性肠炎小鼠的体重下降具有极显著的保护作用。在建模早期,与其他各组不同,各剂量的裂褶菌β-葡聚糖作用下,小鼠体重均有一定幅度的提升。到了建模结束时(第5天),三组小鼠平均体重的下降程度均低于同期模型组和阳性药物组。其中中剂量(50μg/g的裂褶菌β-葡聚糖)组小鼠的体重不仅未发生显著下降(第5-7天,与该组第0天相比,p>0.05),且在实验结束的第7天,该组小鼠的体重较模型组(p<0.01)和其余各治疗组(p<0.05),均显著提高。
5)可溶性酵母β-葡聚糖(50μg/g)对实验性急性肠炎小鼠的体重下降具有一定的保护作用,但效果不如同样剂量的裂褶菌β-葡聚糖。在建模结束后,体重虽然低于起始之时,但显著高于模型组(p>0.05)。
表2实验性急性肠炎模型小鼠的体重变化率(以所在组第0天的体重为100%)
注:以各组小鼠建模(自由饮用3%硫酸葡聚糖钠)第0天的体重为标准(100%),统计建模期(第1-5天)以及建模结束后2日(6-7天)小鼠的标准化体重。数据以各组内小鼠的标准化平均体重±标准误表示,n=10(阳性药物组n=9);与所在组内第0天的标准化平均体重相比,*p<0.05,**p<0.01;与同一天模型组小鼠的标准化平均体重相比,#p<0.05,##p<0.01。
实施例3小鼠结肠长度的检测
实验结束后处死小鼠,收集结肠,测量各组小鼠的结肠长度。
结果如图2和表3所示,小鼠结肠平均长度差异明显。正常对照组小鼠的结肠平均长度为7.14±0.11cm,而模型组小鼠则极显著地缩短为5.71±0.27cm(表3,p<0.01)。阳性药物对急性肠炎模型小鼠的结肠长度无显著影响,但两种β葡聚糖均表现出恢复结肠长度的作用。其中50μg/g的可溶性酵母β-葡聚糖作用下,小鼠平均结肠长度显著恢复至6.58±0.30cm(与模型组相比,p<0.05)。值得关注的是,50μg/g的裂褶菌β-葡聚糖作用下,小鼠平均结肠长度极显著地恢复至7.31±0.17cm(与模型组相比,p<0.01),达到与正常对照组接近的水平(与正常对照组相比,p>0.05)。
上述结果表明,裂褶菌β-葡聚糖能有效保护小鼠肠道,抑制硫酸葡聚糖钠诱导的小鼠急性肠炎。
表3实验性急性肠炎小鼠的主要脏器指标
注:c57bl/6小鼠适应性喂养一周后,将小鼠随机分为正常对照组、模型组、阳性药物组(柳氮磺吡啶150μg/g)、不同剂量的裂褶菌β-葡聚糖组(浓度分别为10、50和100μg/g),以及可溶性酵母β-葡聚糖组(50μg/g)等7组,每组10只,并灌胃给药16天,期间自由饮水;将饮水换成新鲜配制的3%dss溶液,自由饮用5天,期间继续按原分组灌胃给药;撤去dss溶液,改成正常饮用水,自由饮用2天,期间继续按原分组灌胃给药;处死小鼠,收集脏器进行测量。各种数据以组内小鼠的平均值±标准误表示,n=10(阳性药物组n=9);与正常对照组相比,*p<0.05,**p<0.01;与模型组相比,#p<0.05,##p<0.01。
实施例4小鼠脏器系数
准确称量实验性急性肠炎各组小鼠的肝脏、肾脏以及脾脏的重量,根据个小鼠自身的体重,计算三种脏器的脏器系数。
结果如表3所示,其中模型组肝脏系数和肾脏系数均无显著改变,而脾脏系数极显著增加(图3,与正常对照组相比,**p<0.01),约为正常对照组的2.5倍。阳性药物作用下,未能及时纠正脾脏的肿大,相反脾脏系数进一步上升至正常对照组的近3倍。
脾脏是脾脏是机体最大的免疫器官,占全身淋巴组织总量的25%,含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心。脾脏肿大对于多种疾病的诊断有参考价值。实验性急性肠炎小鼠的脾脏系数急剧增加,脾脏显著肿大,可能与小鼠免疫功能异常相关。
两种β葡聚糖作用下,实验性急性肠炎小鼠的脾脏系数得到有效控制。其中50μg/g的可溶性酵母β-葡聚糖作用下,小鼠平均脾脏系数显著降低至0.41±0.03(与模型组相比,p<0.05)。三种剂量的裂褶菌β-葡聚糖均能使小鼠脾脏系数降低。尤其是50μg/g的裂褶菌β-葡聚糖作用下,小鼠平均脾脏系数极显著地降低至0.38±0.02(与模型组相比,p<0.01)。
上述结果表明,裂褶菌β-葡聚糖能有效改善免疫相关的脾脏系数,保护小鼠,抑制硫酸葡聚糖钠诱导的小鼠急性肠炎。
实施例5肠道菌群16srrna分析(otu聚类分析)
将建模前第16日(下文简称建模前)和建模结束后第2日(下文简称建模后)小鼠粪便,分别收集并保藏于粪便收集管中的微生物测序样品保存液中。通过提取其中的核酸,将检测合格的微生物dna样本对其指定区域进行pcr扩增、文库制备、文库质检、定量,使用设定的tag序列进行样本区分。采用illuminahiseq2500高通量测序平台对检测合格的文库进行测序。
otu(operationaltaxonomicunits,操作分类单元)是在系统发生分析或群体遗传研究中的一个假定的分类单元,通过一定的距离度量方法计算两两不同序列之间的距离度量或相似性,继而设置特定的分类阈值,获得同一阈值下的距离矩阵,进行聚类操作,形成不同的分类单元。
根据97%的序列相似性水平,利用qiime软件包中的uclust方法进行otu聚类分析。然后基于silva(release128https://www.arb-silva.de/documentation/release-128/)参考数据库,利用rdpclassifier软件(confidencecutoff=0.8)对每个样品的otus进行物种分类学(taxonomy)注释。
5.1建模前正常小鼠的变化
使用建模前灌胃给药第16日所取的小鼠粪便进行16srrna分析。取小鼠粪便2-3粒,保存于stooldnastabilizer中送检。
otu聚类分析结果如图4所示。以模型组灌胃蒸馏水16天的样本为正常对照,雄性c57bl/6小鼠正常情况下灌胃裂褶菌β-葡聚糖16天后,其肠道微生物otu数值极显著增加(图4a、4b,p<0.01),但细菌总数无明显差异(图4c),表明微生物种类得到有效增加,微生物多样性增加。可溶性酵母β-葡聚糖作用下,小鼠肠道微生物otu值也有所增加,但未达到显著水平,无统计学意义。
5.2建模结束后第2日小鼠的变化
使用建模结束后第2日(实验结束时)所取的小鼠粪便进行16srrna分析。取小鼠粪便2-3粒,保存于stooldnastabilizer中送检。
结果如图5所示,而诱导急性肠炎后,模型组小鼠肠道微生物otu数值明显下降,但由于该组小鼠便血严重,有的小鼠粪便中提取不到有效的微生物核酸,且个别小鼠otu值异常降低,导致数据较少且不整齐,因此与正常对照组没有统计学差异。但将该异常值(465,图5a)去除后进行统计学分析,发现两种β-葡聚糖作用下,小鼠肠道微生物otu数值极显著提高(图5b,与模型组相比,p<0.01),同时,粪便中的细菌总数也出现了相应的改变(图5c,与模型组相比,p<0.05)。这两种β-葡聚糖,尤其是50μg/g的裂褶菌β-葡聚糖,具有有效丰富实验性急性肠炎小鼠肠道微生物种类和数量的作用,能够增加小鼠肠道微生物的丰度和多样性。
5.3建模前后小鼠肠道菌群otu和细菌总数的变化
使用建模前灌胃给药第16日(建模前)和建模结束后第2日(建模后)所取的小鼠粪便进行16srrna分析。取小鼠粪便2-3粒,保存于stooldnastabilizer中送检。本次比较旨在研究小鼠个体微生物丰度和多样性的变化。
同一只小鼠在建模前后的肠道微生物otu数以及细菌总数如图6所示。雄性c57bl/6小鼠正常情况下灌胃裂褶菌β-葡聚糖16天后,其otu增加,而细菌总数变化不大(图4,图6)。在造模后,由于急性肠炎造成的otu和细菌总数水平降低能够被β-葡聚糖扭转:其中otu值虽然提升(图5b),但均比造模的自身水平前低,而细菌总数水平恢复程度好,尤其是50μg/g的裂褶菌β-葡聚糖,其细菌总数水平最高,个别小鼠造模后的细菌总数甚至高于造模前。
上述结果表明,正常情况下,β-葡聚糖能够增强小鼠肠道菌群的多样性,而对于急性肠炎小鼠,β-葡聚糖在恢复菌群多样性的同时,能够迅速提高菌群丰度,促进肠道大环境的恢复。
实施例6肠道菌群的组成分析
统计实施例5中所有样本在门、纲、目、科、属各层次上的分类结果。将基于丰度的前15个类别,采用累积柱状图,比较样本间类别组成的差异。
结果如图7、图8所示。
肠道微生物是一个复杂的系统,在不同个体中多样性和丰度差异大,即便是饲养条件几乎一致的情况下也难以避免。如本实施例中的正常对照组小鼠,其个体间各层次前15个类别微生物的丰度和种类均存在巨大的差异。在β-葡聚糖作用下,这种差异趋于缩小,其中50μg/g的裂褶菌β-葡聚糖组,其前15个属微生物的丰度较其他三组更高(图7e),组内不同小鼠间的差异较其它几组更小。
急性肠炎发生后,小鼠肠道微生物在门、纲、目、科、属各层次上均发生了巨大变化(图8)。尤其在属水平上(图8e),可以看到正常对照组前15个种的丰度之和,占总丰度的50.46%,模型组则降低至40.23%。50μg/g和100μg/g的裂褶菌β-葡聚糖组,分别为59.85%和53.80%,而可溶性酵母β-葡聚糖组也达到了56.32%。可见三组经过β-葡聚糖干预组的小鼠,其微生物主要优势种的丰度更为突出,β-葡聚糖组对急性肠炎小鼠的微生物组成具有重要影响。
实施例7肠道菌群的数量变化分析
基于实施例5中的各个样本,根据otu聚类结果,分析建模前后β-葡聚糖对每个样本中排名前105的各属微生物的数量变化的综合影响。上述各属按丰度多少排列,分别属于拟杆菌门、厚壁菌门、疣微菌门、放线菌门、变形菌门、软壁菌门、蓝藻门、脱铁杆菌门、saccharibacteria等9个门,β-葡聚糖对其中的拟杆菌门、厚壁菌门、疣微菌门和saccharibacteria等的丰度具有显著影响。
7.1拟杆菌门
通过统计分析发现,建模前正常对照组小鼠肠道菌群以拟杆菌为主,拟杆菌门中拟杆菌目的微生物数量占了总数量的50.36%,其中丰度最大的是拟杆菌目s24-7组(26.61%),其次是普雷沃氏菌科(9.49%),接下来分别是拟杆菌科(5.87%)、理研菌科(4.91%)和卟啉单胞菌科(3.47%)。
裂褶菌β-葡聚糖处理对建模前拟杆菌门微生物的丰度无显著影响,而酵母β-葡聚糖作用下,建模前该丰度有显著降低,但降幅不大(从50.36%降至46.99%)。小鼠急性肠炎模型下拟杆菌门微生物丰度的下降至41.13%,而两种β-葡聚糖对这种下降均有保护作用。
1、拟杆菌目s24-7组:急性肠炎情况下,拟杆菌目s24-7组及其科内各属的丰度变化均不大(图9a)。但在两种β-葡聚糖处理下,其中丰度最大的未培养部分,百分比有极显著下降(图9b,p<0.01),致使该科总体丰度下降(图9a,p<0.01)。
而ambiguous_taxa和肠道宏基因组两个属,在建模前各组(包括正常对照组和给药组)和模型组中都几乎没有的情况下(图10a、c),给予两种β-葡聚糖均能使其丰度显著提高(图10b、d,p<0.05)。裂褶菌β-葡聚糖对其中ambiguous_taxa的丰度提升具有剂量依赖关系,在裂褶菌β-葡聚糖浓度为50μg/ml时,ambiguous_taxa的丰度为0.07%,当浓度提升至100μg/ml后,丰度上升为0.11%(图10b,p<0.05)。
即β-葡聚糖能够丰富拟杆菌目s24-7组内微生物的多样性。
2、普雷沃氏菌科:两种β-葡聚糖对建模前小鼠粪便中普雷沃氏菌科中各属微生物几乎没有影响(图11a)。急性肠炎模型小鼠,其普雷沃氏菌科微生物丰度极显著下降(图11b,p<0.01),两种β-葡聚糖能够使该科微生物丰度有效恢复至正常水平(与模型组相比,p<0.01;与正常对照组相比,p>0.05)。裂褶菌β-葡聚糖对建模后普雷沃氏菌丰度的提升具有剂量依赖关系,在裂褶菌β-葡聚糖浓度为50μg/ml时,该科的丰度由模型组的4.47%上升至8.67%,当浓度提升至100μg/ml后,丰度上升为11.85%(图11b)。
其中拟普雷沃氏菌属(图12a)、paraprevotella(图12b)和普雷沃氏菌科ga6a1组(图12c)三个属的变化趋势与普雷沃氏菌科的大变化趋势相似,即模型组丰度显著下降(p<0.05),尤其是paraprevotella(图12b)和普雷沃氏菌科ga6a1group(图12c),在硫酸葡聚糖钠的作用下,丰度几乎下降为零;而两种β-葡聚糖对这种降低具有显著的保护作用,其作用下微生物的丰度甚至高于正常对照组(与模型组相比,p<0.01;与正常对照组相比,p<0.01)。裂褶菌β-葡聚糖对建模后拟普雷沃氏菌属和paraprevotella丰度的提升,也存在剂量依赖关系(图12a、b)。而其他普雷沃氏菌科微生物总的变化趋势(图12d)也与拟普雷沃氏菌属等相似。
即β-葡聚糖能够有效防止甚至反转急性肠炎状态下普雷沃氏菌科微生物丰度的下降,对肠道菌群平衡的维持具有重要作用。
3、理研菌科:与对前两个科的作用方式不同,裂褶菌β-葡聚糖不仅对模型小鼠理研菌科微生物丰度的下降具有保护作用(图13b,p<0.01),对造模前理研菌科微生物的丰度同样具有显著提升作用(图13a,p<0.01)。
造模前各组中,50μg/ml的裂褶菌β-葡聚糖极显著提高alistipes(图14a)和理研菌科rc9gutgroup(图14c)的丰度(p<0.01)。
急性肠炎模型下,两种β-葡聚糖对于由于肠炎而造成的理研菌科各属微生物丰度的下降具有极显著得改善效果,其中alistipes恢复至正常水平(图14b),而理研菌科rc9肠道组的丰度不仅得到提升,甚至提升至正常对照组的3.2倍(p<0.01),且存在明显的剂量依赖关系(图14d)。
即β-葡聚糖具有有效提高理研菌科微生物丰度的作用。
7.2厚壁菌门
正常对照组小鼠肠道微生物中,厚壁菌门微生物丰度位列第二,为总丰度的28.27%。其中梭菌纲中的梭菌目占总丰度21.68%。急性肠炎模型下,梭菌目微生物丰度上升至40.75%,两种β-葡聚糖作用下,这种升高得到有效抑制,两个浓度裂褶菌β-葡聚糖分别为25.95%和26.05%左右,而酵母β-葡聚糖为24.88%。此外,厚壁菌门微生物是本实施例中种类最丰富的,在参与统计的前105个属中,就有65个属属于该门。
1、瘤胃菌科:在厚壁菌门的65个属中,瘤胃菌科微生物占据了22个。但该科内不同属微生物变化趋势差异较大。
两种β-葡聚糖对建模前小鼠肠道菌群中的颤杆菌克、ruminiclostridium9、anaerotruncus和瘤胃菌科ucg-003等属,具有显著的抑制作用(图15,p<0.05)。但模型组中,上述菌群丰度无显著改变,两种β-葡聚糖的抑制作用也没有受到模型的影响。
ruminiclostridium6和瘤胃菌科ucg-005则实现了从无到有的改变,正常对照组和模型组小鼠的肠道微生物中原本没有这两个属,但在两种β-葡聚糖作用下,这两种微生物数量明显上升(图16)。
而其中丰度最大的瘤胃菌科ucg-014(3.60%),建模前β-葡聚糖处理对其丰度无显著影响(图17a,p>0.05),但急性肠炎模型下,其丰度极显著下降为0.38%(图17b,p<0.01)。两种β-葡聚糖均能显著改善这种降低,尤其是50μg/ml的裂褶菌β-葡聚糖,在其作用下,瘤胃菌科ucg-014的丰度甚至显著高于正常对照组(10.80%,图17b,p<0.01)。
瘤胃菌科ucg-010也与瘤胃菌科ucg-014类似,建模前β-葡聚糖处理对其丰度无显著影响(图17c,p>0.05),但急性肠炎模型下,其丰度显著下降(p<0.05),在50μg/ml的裂褶菌β-葡聚糖作用下,其下降的丰度又得到显著的提高(图17d,p<0.01)。
2、毛螺旋菌科:前102个属中,有17个属属于毛螺旋菌科。
正常小鼠肠道菌群中,该科微生物占总丰度的7.24%,但在急性肠炎模型下,其丰度急剧提升至23.13%(p<0.01),两种β-葡聚糖均能显著改善这种病理性的剧增(图18,p<0.01)。
β-葡聚糖作用下,罗氏菌属和毛螺旋菌科fcs020组微生物丰度均有显著下降(图19a、c)。尤其是建模后,硫酸葡聚糖钠能够引起这两个属丰度的极显著增加(分别为6.74倍和5.07倍),裂褶菌β-葡聚糖和可溶性酵母β-葡聚糖均能有效控制这种病理性的剧增(图19b、d)。
marvinbryantia和tyzzerella两个属在建模后,丰度显著降低。两种β-葡聚糖,尤其是酵母β-葡聚糖对这种降低具有预防作用(图19e、f)。
正常对照组和模型组小鼠的肠道中,毛螺旋菌科断链真杆菌组和acetatifactor的丰度几乎为零,但β-葡聚糖能够使两者的丰度增加(图20),其中50μg/ml的裂褶菌β-葡聚糖使建模后小鼠肠道微生物中的断链真杆菌组的丰度大幅度升高至0.31%,可溶性酵母β-葡聚糖使其提升至0.50%(图20b,p<0.05)。
3、消化球菌科:
β-葡聚糖对消化菌科的微生物具有显著的抑制作用。但有意思的是,对建模后该科微生物丰度的降低,β-葡聚糖反而具有保护作用(图21a、b)。对其进一步分析发现,建模前β-葡聚糖对其中消化球菌属的丰度无显著影响,但是对于急性肠炎模型下该属丰度的降低具有极显著得保护作用(图21c、d)。
4、克里斯滕森菌科:
裂褶菌β-葡聚糖对克里斯滕森菌科微生物的丰度具有促进作用。无论是建模前,还是建模后,裂褶菌β-葡聚糖作用下,其丰度都有所提高(p<0.05),但是酵母β-葡聚糖无明显作用(图22)。
7.3疣微菌门
从单个分类单元的丰度来说,疣微菌门中的一种阿克曼菌是正常对照组中丰度最高的,急性肠炎下其丰度虽有降低,但未达到显著性水平,且建模前后两种β-葡聚糖也未能显著影响其水平。
7.4saccharibacteria
小鼠肠道菌群中saccharibacteria门的candidatussaccharimonas属微生物,其丰度在急性肠炎模型下极显著降低(图23b,p<0.01)。两种β-葡聚糖虽然对建模前小鼠的该属丰度无显著影响(图23a,p>0.05),但是对于硫酸葡聚糖钠引起的降低,具有极显著的保护作用(图23b,p<0.01)。相比之下,酵母β-葡聚糖没有这种作用。
实施例8otu分布韦恩图
venn图(韦恩图)也称文氏图,用于显示元素集合重叠区域的图示。通常,选用相似水平为97%的otu,展示多个样品中所共有的otu数目,反映环境样品的相似性及重叠情况。
实验性急性肠炎小鼠组间otu韦恩图如图24所示,不同组之间,绝大部分的otu都是重合的(917个),其中正常对照组有2个特有的otu,模型组有1个特有的otu。有96个otu在正常组和模型组中均存在,但是灌胃两种β-葡聚糖后,均被抑制了。有51个otu,在模型组中失去了,其中3个在灌胃裂褶菌β-葡聚糖后恢复了;有44种在灌胃两种β-葡聚糖后均得到了恢复。此外,灌胃两种β-葡聚糖后,新产生了34种otu,其中30种为共同的otu。通过韦恩图分析可知,β-葡聚糖对正常小鼠和实验性急性肠炎小鼠肠道微生物多样性的改变,具有积极的作用。
实施例9alpha多样性分析
alpha多样性是指一个特定区域或生态系统内的多样性。多样性指数是反映样本中微生物丰富度和均匀度的综合指标。
alpha多样性指数,包括物种丰富度指数(chao1)、综合体现物种丰度和均匀度的多样性指数(shannon、simpson)、以及反映样本out数量的observedspecies等。其中多样性指数衡量群落的异质性。
chao1:丰富度指数,和丰度、均匀度无关,但是它对稀有的物种很敏感,通过估算otu的数量来衡量,在生态学中常用来估计物种总数。
shannon指数:样品中微生物各种之间,个体分配越均匀,shannon指数就越大。如果每一个体都属于不同的种,多样性指数就最大;如果每一个体都属于同一种,则其多样性指数就最小。
simpson指数:其取值区间是0~1,当样品中只有一个物种时(即所有序列都代表同一个物种),值为0;当样品中各物种均匀分布时,值为1,此时样本中物种多样性最大。simpson指数值越大,越均匀,群落多样性越高。
小鼠肠道微生物种群的多样性分析结果见图25、图26。正常小鼠在接受β-葡聚糖灌胃后,其物种种类observedspecies(图25a)、丰富度chao1(图25b)等肠道菌群多样性指标得到明显提高,但物种分配的均匀度(图25c、d)影响不大,甚至有所降低。
实验性急性肠炎模型小鼠肠道菌群的4种多样性指标均明显下降,但在接受β-葡聚糖灌胃后,其物种种类observedspecies(图26a)、丰富度chao1(图26b)等肠道菌群多样性指标得到明显提高,但物种分配的均匀度(图26c、d)影响不大。在两种β-葡聚糖的作用下,硫酸葡聚糖钠引起的肠道菌群物种种类减少和丰富度降低得到有效改善。
由此可见,β-葡聚糖能够丰富正常小鼠以及炎症性肠病小鼠肠道微生物的种类(图25、图26)和数量,但并没有使微生物物种分配均一化,或者说并非简单的、统一的促进微生物生长,而是有选择性地增加具有某些特征的微生物的种类和/或数量。
实施例10beta多样性分析
beta多样性是对不同样本/不同组间样本的微生物群落构成进行比较分析。可以用otu的丰度信息进行样本间距离计算,也可以用otu之间的系统发生关系进行计算。unifrac是用于比较生物群落的一种距离度量,它在计算过程中包含了遗传距离(phylogeneticdistances)的信息,根据构建的进化树枝的长度计量两个不同环境样品之间的差异。unifrac分析分为weightedunifrac和unweightedunifrac两种度量方法,两者之间差异在于是否计入不同环境样品的序列相对丰度。weightedunifrac算法在计算树枝长度时将序列的丰度信息进行加权计算,因此unweightedunifrac可以检测样品间变化的存在,而weightedunifrac可以更进一步定量的检测样品间不同谱系上发生的变异。基于otu丰度信息表计算unifrac距离(unweightedunifrac)和weightedunifrac距离。距离矩阵可用于后续的beta多样性分析和可视化统计分析,从中发现不同样品(组)间的差异。
主坐标分析(principalcoordinateanalysis,pcoa)将多维数据进行降维,是一种研究数据相似性或差异性的可视化方法,基于距离矩阵来寻找主坐标,通过一系列的特征值和特征向量进行排序后,选择主要排在前几位的特征值,有效地找出数据中最“主要”的元素和结构,对样本之间的关系进行描述。首先随机取样计算各样本之间的unifrac距离,再根据距离矩阵绘制二维主坐标分析图,如果样本的距离越接近(即物种的丰度和构成越相似),则它们在主坐标分析图中的距离越近。
结果如图27所示,正常小鼠在接受β-葡聚糖灌胃后,其肠道微生物beta多样性所有不同,但不管组内各样本之间,或者各组之间,都距离较近(图27a)能够聚成一类,样本之间微生物丰度和构成较相似。急性肠炎模型中,小鼠肠道微生物数据之间的距离增大,其肠道微生物的丰度和构成出现异常。在两种β-葡聚糖的作用下,硫酸葡聚糖钠引起的肠道微生物丰度和物种结构的异常得到有效改善,各组内样品间的距离比模型组明显缩短,其微生物丰度和构成又趋于接近(图27b)。
综合实施例5-实施例10中的otu聚类、物种结构分析、alpha多样性分析和beta多样性分析,β-葡聚糖,尤其是裂褶菌β-葡聚糖,对于正常小鼠以及实验性急性肠炎小鼠的肠道微生物的物种种类和数量均有显著的提升作用。β-葡聚糖可能通过提高小鼠肠道菌群多样性等方式,减缓结肠炎症状。
实施例11小鼠结肠组织q-pcr
每组随机选取冻存的小鼠中间1/3段结肠组织进行匀浆(n=6),匀浆后4℃、12000r离心15min,取上清-80℃保存并及时用于rna提取和反转录,并在一周内进行q-pcr。
结果如图28所示,模型组小鼠的il-6的mrna水平极显著提高(与正常对照组相比,p<0.01),而阳性药物组未能及时纠正这种细胞因子的过渡表达,其il-6的mrna水平反而更高(与模型组相比,p<0.01)。两种β葡聚糖作用下,实验性急性肠炎小鼠急剧增高的il-6的mrna水平得到有效控制。尤其是,50μg/g的裂褶菌β-葡聚糖作用下,小鼠il-6mrna水平极显著地降低(与模型组相比,p<0.01)。结果表明裂褶菌β-葡聚糖能有效保护小鼠肠道,抑制硫酸葡聚糖钠诱导的小鼠急性肠炎中炎症因子的过表达。
实施例12、β-葡聚糖的免疫激活作用
本实施例中,raw264.7细胞(记载于“eun-heelee,hyung-minkim.activationofinduciblenitricoxidesynthasebyhumanchoriogonadotropininraw264.7cells.bba-molecularcellresearch,1997,1359(1):59-64”等论文中,公众也可以从美国atcc等机构购买获得)按照下述方法进行培养及β-葡聚糖处理:
(1)将装有raw264.7细胞的冻存管,37℃水浴至即将完全融化时,取出冻存管移至超净工作台内;
(2)在15ml离心管内加入4mlfbs培养液,将细胞的悬液吸至该离心管内,盖上管盖,1,000rpm离心4min后,小心吸弃上清液,并向离心管内加入fbs培养液1ml,吹打混匀;
(3)用血球计数板进行活细胞计数,稀释细胞悬液,移至培养皿,置于含5%co2培37℃养箱中;
(4)传代:每天传代1次;
(5)接板:将吹打下来的细胞制成细胞悬液,用血球计数板进行活细胞计数,以5×105个/ml的细胞密度接种到细胞板中;
(6)β-葡聚糖处理:接板12h后,换液或加入含有不同浓度β-葡聚糖的细胞培养液一定时间,收样。
12.1β-葡聚糖对raw264.7细胞存活率的影响
采用细胞毒性实验检测:
(1)100μlraw264.7细胞悬液(5×105/ml)接于96孔板中培养12h;
(2)每孔加入含有不同种类以及不同浓度β-葡聚糖的细胞培养液100μl继续培养20h;以100μl不含β-葡聚糖的细胞培养液为对照;
(3)加入mtt溶液(5mg/ml),每孔20μl,继续孵育4h;
(4)弃上清,加入100μldmso充分溶解结晶,在波长490nm下检测od值。
β-葡聚糖对raw264.7巨噬细胞存活率的影响(n=6)如图29所示,各个浓度的裂褶菌β-葡聚糖处理raw264.7巨噬细胞24h,均不会对细胞产生毒性作用,相反,200μg/ml的β-葡聚糖能够在一定程度上促进巨噬细胞的生长。结果表明,裂褶菌β-葡聚糖对巨噬细胞无细胞毒作用,反而有利于该细胞的存活率的提高。
12.2β-葡聚糖对raw264.7细胞一氧化氮(no)分泌和诱导型no合酶(inos)表达的影响
12.2.1、巨噬细胞inosmrna表达水平的测定
1)细胞rna抽提与反转录
以脂多糖为阳性对照,不同浓度β-葡聚糖(浓度分别为10、25、50和75μg/ml)单独作用于raw264.7巨噬细胞24h后,分别收集各组细胞,以检测inosmrna表达情况。
(1)加入500μltrizol吹打收取细胞样,放于-80℃冰箱过夜;
(2)rna抽提:取出细胞trizol样,溶化后加入1/5氯仿,震荡混匀,室温静置5min后,冷冻离心机4℃12,000rpm离心15min;
(3)离心结束后,吸取上清(约180μl)转移到新的ep管中,加入等体积异丙醇,轻轻混匀,室温静置10min,12,000rpm离心10min;
(4)弃去上清溶液,向剩下的沉淀加入1ml75%预冷的乙醇,轻轻颠倒混匀,12,000rpm离心5min;
(5)弃去上清,室温挥发至rna沉淀半透明,加入20-80μl65℃预热的depc水进行溶解;
(6)使用紫外分光光度计测定rna浓度,通过od260/od280数值及rna电泳检测rna是否降解;
(7)反转录:rna浓度测定后,500ngrna使用10μl体系进行反转录。根据试剂盒进行操作,其中5×primescriptbuffer2μl,oligodtprimer、random6mers和primescriptrtenzymemix分别为0.5μl,500ngrna根据浓度计算出的体积,然后用depc水补足到10μl,混匀瞬离,37℃水浴锅中反转录15min,之后迅速置于85℃10s使酶失活。加水补足至50μl,此时即为cdna,-20℃保存备用。本实验所用耗材等均为rnasefree。
2)荧光定量pcr实验
(1)25μl体系:2×ultrasybrmixture荧光染料12.5μl,depc水9.5μl,5μm的前后引物混合液2μl,cdna1μl;
(2)混匀瞬离,除去气泡;
(3)pcr仪设置反应程序:95℃10min预变性;95℃15s变性和60℃1min退火延伸,交替进行,共39个循环;60-95℃融解曲线分析,读板。
图30a为不同浓度的裂褶菌β-葡聚糖对raw264.7巨噬细胞inosmrna表达(n=3)的影响,结果发现,随着β-葡聚糖浓度的增加,raw264.7细胞inos的mrna表达水平呈剂量依赖的方式递增(与未处理组相比,*p<0.05)。表明β-葡聚糖可显著提高巨噬细胞inosmrna表达,裂褶菌β-葡聚糖具有显著的免疫激活作用。
12.2.2、细胞培养液中no分泌水平测试
以脂多糖为阳性对照,不同浓度裂褶菌β-葡聚糖(浓度分别为10、25、50、75和100μg/ml)单独作用于raw264.7巨噬细胞24h后,分别收集各组的培养上清液,以检测no分泌情况。
(1)收集上述诱导后的细胞培养上清液100μl;
(2)提前取出griess试剂盒,待其恢复至室温后开始进行实验;
(3)标准曲线的制作,用dmem+10%fbs稀释标准品,标准品的稀释浓度选定为0、1、5、10、25、50、100μm;
(4)按50μl/孔的体积,向96孔板中加入标准品/样品;
(5)按50μl/孔的体积,向各孔中加入室温的griessreagenti;
(6)按50μl/孔的体积,向各孔中加入室温的griessreagentii;
(7)室温反应10min,540nm处测od值。根据准曲线,计算出各组细胞培养上清液中no水平。
图30b为no检测标准曲线,根据该曲线,计算不同浓度的裂褶菌β-葡聚糖对raw264.7巨噬细胞no释放(图30c,n=4;以脂多糖为阳性对照)的影响,结果发现,raw264.7细胞培养液中的no水平,在裂褶菌β-葡聚糖浓度处于50μg/ml以下时,呈剂量依赖性地递增(与未处理组相比,**p<0.01);当裂褶菌β-葡聚糖以50-100μg/ml的浓度刺激该细胞株时,细胞no分泌水平进入平台期,能够维持在一个较稳定的高水平状态。结果表明β-葡聚糖可显著促进巨噬细胞no分泌,且这种促进作用可维持在一个特定的水平,裂褶菌β-葡聚糖具有显著的免疫激活作用。
12.3β-葡聚糖对raw264.7细胞因子mrna表达的影响
活化的巨噬细胞具有分泌多种炎性细胞因子和趋化因子的能力,主要包括tnf-α、il-1β、il-6、il-10、cxcl10和mcp-1等。上述因子在机体免疫反应和炎症反应中具有重要作用。
12.3.1、rna的抽提与反转录
以50ng/ml的脂多糖水溶液作为阳性对照,不同浓度裂褶菌β-葡聚糖(浓度分别为10、25、50和75μg/ml)或分散性酵母β-葡聚糖(浓度分别为1、10、25、50、75和100μg/ml)单独作用于raw264.7巨噬细胞24h后,分别收集各组细胞,以检测各种细胞因子mrna的表达情况。
(1)加入500μltrizol吹打收取细胞样,放于-80℃冰箱过夜;
(2)rna抽提:取出细胞trizol样,溶化后加入1/5氯仿,震荡混匀,室温静置5min后,冷冻离心机离心,4℃12000rpm离心15min;
(3)离心结束后,吸取上清(约180μl)转移到新的ep管中,加入等体积异丙醇,轻轻混匀,室温静置10min,12000rpm离心10min;
(4)弃去上清溶液,向剩下的沉淀加入1ml75%预冷的乙醇,轻轻颠倒混匀,12000rpm离心5min;
(5)弃去上清,室温挥发至rna沉淀半透明,加入20-80μl65℃预热的depc水进行溶解;
(6)使用紫外分光光度计测定rna浓度,通过od260/od280数值及rna电泳检测rna是否降解;
(7)反转录:rna浓度测定后,500ngrna使用10μl体系进行反转录。根据试剂盒进行操作,其中5×primescriptbuffer2μl,oligodtprimer、random6mers和primescriptrtenzymemix分别为0.5μl,500ngrna根据浓度计算出的体积,然后用depc水补足到10μl,混匀瞬离,37℃水浴锅中15min反转录,之后迅速置于85℃10s使酶失活。加水补足至50μl,此时即为cdna,-20℃保存备用。本实验所用耗材等均为rnasefree。
12.3.2、荧光定量pcr实验
(1)25μl体系:2×ultrasybrmixture荧光染料12.5μl,depc水9.5μl,5μm的前后引物混合液2μl,cdna1μl;
(2)混匀瞬离,除去气泡;
(3)pcr仪设置反应程序:95℃10min预变性;95℃15s变性和60℃1min退火延伸,交替进行,共39个循环;60-95℃融解曲线分析,读板。
图31为不同浓度的裂褶菌β-葡聚糖对raw264.7细胞因子和趋化因子mrna表达的影响(以脂多糖为阳性对照),结果显示,肿瘤坏死因子tnf-α(图31a)、白细胞介素il-1β(图31b)、il-6(图31c)、il-10(图31d)和趋化因子mcp-1(图31e)、cxcl10(图31f)的mrna表达量均呈增长的趋势,其中tnf-α、il-6、il-10、mcp-1和cxcl10在β-葡聚糖浓度低于75μg/ml,il-1β在β-葡聚糖浓度低于50μg/ml时,均具有明显的剂量依赖性(与未处理组相比,*p<0.05,**p<0.01,***p<0.001;n=3),结果表明β-葡聚糖可显著促进巨噬细胞免疫相关的各种细胞因子mrna的表达,裂褶菌β-葡聚糖具有显著的免疫活化作用。
图32为不同浓度的分散性酵母β-葡聚糖对raw264.7细胞因子tnf-α(图32a)和il-1β(图32a)mrna的表达的影响(以脂多糖为阳性对照)。结果表明,各浓度的分散性酵母β-葡聚糖均未能促进raw264.7细胞这两种免疫相关细胞因子mrna的表达。
12.4β-葡聚糖对raw264.7细胞mapk信号通路的影响
12.4.1、免疫印迹分析相关试剂及配制
(1)ripa裂解液(radioimmunoprecipitationassay,ripa)
nacl4.35g,sds0.5g,trisbase3.03g,tritonx-1005ml,10%脱氧胆酸钠25ml,调节ph至8.0即可。
(2)5×sds上样缓冲液
sds5g,溴酚蓝0.2g,1mtrishcl12.5ml,甘油30ml,混合均匀后-20℃保存。使用前分装出950μl,加入50μlβ-巯基乙醇,混匀。
(3)10×电泳缓冲液
称取trisbase33g,甘氨酸144g,sds10g,用超纯水定容至1l,后使用盐酸调ph至8.3。使用时用超纯水稀释至1×。
(4)10×转移电泳缓冲液
称取trisbase33g,甘氨酸144g,用超纯水定容至1l。使用时量取100ml,加入200ml甲醇,超纯水稀释至1l。
(5)10×tbs缓冲液
称取trisbase24.2g,nacl80g,用超纯水定容至1l,使用hcl调ph至7.5。
(6)1×tbst缓冲液
量取100ml10×tbs缓冲液,加入1mltween20超纯水定容至1l,超声使tween20溶解备用。
(7)脱脂牛奶封闭液
称取脱脂奶粉,使用1×tbst溶液配制成5%(w/v,质量体积比)脱脂牛奶。
(8)抗体稀释液
称取bsa,使用1×tbst溶液配制成1%(w/v),加入1/250的叠氮化钠,即为一抗稀释液。二抗同一抗,但是不加入叠氮化钠。
12.4.2、免疫印迹分析操作步骤
以50ng/ml的脂多糖溶液为阳性对照,不同浓度β-葡聚糖(浓度分别为10、25、50、75和100μg/ml)单独作用于raw264.7巨噬细胞24h后,分别收集各组细胞,以免疫印迹法检测mapk通路中相关蛋白的磷酸化水平。
(1)细胞裂解液的制备
β-葡聚糖处理结束后,以冰冷的pbs清洗细胞两遍,加入含有蛋白酶抑制剂的ripa裂解液,使用刮刀将细胞刮下,转移到ep管中。使用超声粉碎仪进行粉碎,20son,20soff,循环8次,之后放入-80℃冰箱中过夜裂解。
(2)蛋白定量及变性
-80℃冰箱中取出细胞裂解液,冰上融化,12000rpm4℃离心20min,取上清于新ep管中。使用bca试剂盒进行蛋白定量,每孔50000ng的标准,然后加入5×sds上样缓冲液,使用ripa补足,水浴煮沸10min,瞬离后置于-80℃冰箱备用。
(3)sds-page凝胶电泳
配制sds-page凝胶,组装好跑胶装置,电泳槽中加入1×电泳缓冲液。使用前将样品煮沸1min,以每孔20μl的量上样,marker上样量为1μl。70v电压电泳30min,之后100v电压电泳1h。
(4)转膜
电泳结束后,截取所需条带,制作三明治转膜模型,于冰盒中以120v电压,转膜90min。
(5)封闭、孵抗体及扫膜
转膜结束后,首先使用1×tbst洗膜两遍,每次10min;加入脱脂牛奶,摇床慢摇封闭1h;倒掉牛奶,洗膜三次,每次5min;加入一抗,4℃慢摇过夜;回收一抗,洗膜三次,每次5min;加入二抗,避光慢摇孵育1h;回收二抗,洗膜四次,每次8min;扫膜并分析结果。
图33为裂褶菌β-葡聚糖对raw264.7巨噬细胞mapk信号通路的影响,由图33可知,以脂多糖为阳性对照,不同浓度的β-葡聚糖处理raw264.7巨噬细胞24h,可显著增强mapk信号通路中的erk,p38以及jnk的磷酸化水平。表明β-葡聚糖可显著激活mapk信号通路,裂褶菌β-葡聚糖的免疫活化作用可能是通过mapk信号通路的激活实现的。
12.5β-葡聚糖对raw264.7细胞nf-κb信号通路的影响
检测方法同本实施例的四,使用目的蛋白对应的抗体,以检测其水平。
图34为裂褶菌β-葡聚糖对raw264.7巨噬细胞nf-κb信号通路的影响,由图34可知,以50ng/ml的脂多糖为阳性对照,不同浓度β-葡聚糖处理raw264.7巨噬细胞24h,可剂量依赖性地激活ikkβ和p65蛋白的磷酸化。表明β-葡聚糖可显著激活nf-κb信号通路,裂褶菌β-葡聚糖的免疫活化作用可能是通过nf-κb信号通路的激活实现的。
实施例13、β-葡聚糖对脂多糖引起的炎症的预防和治疗作用
13.1β-葡聚糖预处理对脂多糖刺激下raw264.7细胞no生成的影响
首先以不同浓度的裂褶菌β-葡聚糖(浓度分别为10、25、50和75μg/ml)预处理raw264.7单核巨噬细胞1h,之后再以1μg/ml的脂多糖联合上述不同浓度裂褶菌β-葡聚糖(浓度分别为10、25、50和75μg/ml),共同刺激细胞18h,收集细胞上清液,按照实施例2中二的方法,检测各组细胞no分泌水平。
结果β-葡聚糖可有效降低脂多糖刺激下raw264.7细胞no水平的急剧增加。由图35b可知,1μg/ml脂多糖刺激下,raw264.7细胞no水平较β-葡聚糖单独处理时(图30c),出现了大幅度的提升。但随着预处理β-葡聚糖浓度的增加,尤其是浓度增加至25μg/ml时,脂多糖刺激下过高的no分泌水平得到显著抑制(与脂多糖刺激组相比,p<0.01),且这种抑制作用呈现一定的剂量依赖关系。表明裂褶菌β-葡聚糖对脂多糖引起的炎症状态下no异常增加具有预防作用。
13.2β-葡聚糖预处理对脂多糖刺激下raw264.7细胞表达的细胞因子mrna水平的影响
以不同浓度的裂褶菌β-葡聚糖(浓度分别为1、10和25μg/ml)或可溶性酵母β-葡聚糖(浓度分别为10、15、20和25μg/ml)预处理raw264.7巨噬细胞24h,之后再以50ng/ml的脂多糖联合上述各不同浓度β-葡聚糖,共同刺激细胞1.5h后,检测各细胞因子mrna水平,检测方法同实施例2的三。将未经β-葡聚糖预处理的脂多糖模型组mrna的表达水平设为1,其余各组mrna的表达水平以脂多糖组的倍数表示。
结果如图36所示,各模型组中巨噬细胞tnf-α和il-1β的mrna表达水平极显著增加(p<0.01)。但随着预处理时使用浓度的增加,裂褶菌β-葡聚糖预处理的各组,其由脂多糖引起的tnf-α(图36a)和il-1β(图36c)mrna的高表达得到显著抑制(与模型组相比,p<0.05),且这种抑制作用具有剂量依赖性。而经可溶性酵母β-葡聚糖预处理后的各组raw264.7细胞,其由脂多糖引起的tnf-α和il-1βmrna的高表达没有得到显著抑制,其中各组的tnf-α的mrna水平与模型组无显著差异(图36b,p>0.05),而il-1β的mrna表达显著增加(图36d,p<0.05)。表明裂褶菌β-葡聚糖对脂多糖引起的炎症状态下巨噬细胞细胞因子表达的异常增加具有预防作用,而可溶性酵母β-葡聚糖没有预防作用。
13.3β-葡聚糖预处理对脂多糖诱导下raw264.7细胞mapk信号通路的影响
不同浓度的裂褶菌β-葡聚糖(浓度分别为10、25、50和75μg/ml)作用于raw264.7巨噬细胞24h,然后与50ng/ml的脂多糖共同处理细胞4h,检测mapk信号通路中erk、jnk和p38蛋白的水平,检测方法同实施例2的四。
由图37可知,模型组中,脂多糖单独处理可显著促进erk、p38、jnk的磷酸化。而裂褶菌β-葡聚糖预处理组与模型组相比,erk和p38的磷酸化水平显著下降,但对磷酸化jnk的表达没有影响。表明以裂褶菌β-葡聚糖进行预防后,脂多糖引起的炎症状态下巨噬细胞mapk通路的活化能够得到有效抑制。
13.4β-葡聚糖预处理对脂多糖诱导下raw264.7细胞nf-κb信号通路的影响
不同浓度的裂褶菌β-葡聚糖(浓度分别为10、25、50和75μg/ml)作用于raw264.7巨噬细胞24h,然后与50ng/ml的脂多糖共同处理细胞4h后,检测nf-κb通路相关蛋白的水平,检测方法同实施例2的四。
图38为不同浓度的裂褶菌β-葡聚糖对脂多糖诱导的raw264.7巨噬细胞内nf-κb信号通路蛋白表达的影响,由图38可知,模型组中,脂多糖单独处理后,该组细胞ikkβ和p65的磷酸化水平显著增强,表明nf-κb信号通路被脂多糖所激活。β-葡聚糖预处理24h后再与脂多糖共同作用4h的情况下,巨噬细胞磷酸化ikkβ和p65的水平降低。表明以裂褶菌β-葡聚糖进行预防后,脂多糖引起的炎症状态下巨噬细胞nf-κb通路的活化得到有效抑制。
13.5β-葡聚糖对脂多糖预刺激下raw264.7细胞表达的细胞因子mrna水平的影响
以50ng/ml的脂多糖预刺激raw264.7巨噬细胞1.5h之后,再以不同浓度的裂褶菌β-葡聚糖(浓度分别为1、10、25、50、75和100μg/ml)或分散性酵母β-葡聚糖(浓度分别为1、10、25、50、75和100μg/ml),联合50ng/ml的脂多糖,共同刺激细胞1.5h,检测各细胞因子mrna水平,检测方法同实施例2的三。将脂多糖组(模型组)mrna的表达水平设为1,其余各组mrna的表达水平以脂多糖的倍数表示。
结果如图39所示,脂多糖刺激可使巨噬细胞tnf-α、il-1β和il-6等的mrna表达水平显著增加(p<0.05)。随着裂褶菌β-葡聚糖使用浓度的增加,各治疗组细胞中,由脂多糖引起的tnf-α(图39a)、il-1β(图39c)和il-6(图39e)mrna的高表达得到进一步促进(与模型组相比,p<0.05)。而经分散性酵母β-葡聚糖处理后的各组raw264.7细胞,其由脂多糖引起的tnf-α、il-1β和il-6mrna的高表达情况各异,无特定规律可循,其中各组的tnf-α的mrna水平与模型组相比均无显著差异(图39b),而10μg/ml治疗中组,其il-1β(图39d)和il-6(图39f)的mrna表达显著提高(与模型组相比,p<0.05)。表明裂褶菌β-葡聚糖对脂多糖引起的炎症的治疗效果不明显或有所下降,而分散性酵母β-葡聚糖没有治疗作用。
综合实施例12-实施例13中结果,β-葡聚糖,尤其是裂褶菌β-葡聚糖,对于能够增强基础状态下巨噬细胞的免疫功能,同时抑制炎症状态下巨噬细胞的过度免疫反应,具有双向免疫调节的作用。
β-葡聚糖可能通过提高小鼠基础免疫功能,改善小鼠肠道菌群的多样性和丰度,增强正常小鼠肠道功能;通过抑制过度炎症、增加小鼠肠道菌群的多样性和丰度等方式,减缓结肠炎症状。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!