一种放射治疗计划精确目标函数的自动生成方法与流程
本发明涉及计算机科学及人工智能技术领域,具体涉及一种放射治疗计划精确目标函数的自动生成方法。
背景技术:
放射治疗是治疗恶性肿瘤的三种主要治疗手段之一,大约3/5~2/3的恶性肿瘤病人需要接受放射治疗。放射治疗的目的在于提高放射治疗的增益比,即最大限度地将照射剂量集中到肿瘤内,使周围正常组织减少或避免不必要的照射。放射治疗技术已从常规放射治疗技术发展到三维适形放疗技术,再到今天的调强放射治疗技术(intensity-modulatedradiationtherapy,imrt)。而imrt技术较三维适形放疗技术更适应于肿瘤放疗,这是因为imrt能够在肿瘤内形成较高的均匀剂量,同时在肿瘤边缘形成快速的剂量跌落,这样就能在控制肿瘤的同时又保护肿瘤周围的器官。
imrt计划设计是目前实施放射治疗一种广泛使用的技术,但是其逆向优化算法的复杂性会导致计划设计存在难度大,优化时间长等问题。并且,现如今imrt计划设计通常采用的是人工对目标函数试错的方式,执行imrt计划设计的放疗物理师需要在几十甚至近百次的试错中才能找到较为满意的目标函数,从而设计出较为令人满意的imrt计划。这样会产生一系列问题,它限制了医院的工作效率和提高了计划的设计成本,极大增加了医院和病人的负担。更重要的是,计划质量的关键在于目标函数,而找到合适的目标函数在很大程度上取决于放疗物理师的经验和所花费的时间。不同放疗中心之间,甚至同一放疗中心内不同物理师之间,所设计的imrt计划的质量和计划设计时间存在相当大的差别,并且存在着很大的不确定性。
现如今,机器学习已经是大数据时代的基石,人工智能领域中的重要分支。机器学习算法的根本在于以大量数据作为学习特征。随着肿瘤患者病例数据库的日益丰满,一方面,可以利用机器学习算法和计算机技术提取肿瘤患者的影像学或解剖学特征,或是借鉴既往患者imrt计划的特征,也许能够高效便利地设计出患者imrt计划;另一方面,在肿瘤患者的治疗中,仅基于首分次放疗前的计算机断层扫描图像进行imrt计划设计,并未在治疗过程中对imrt计划实时进行修改,因此不能很好地适应肿瘤的实时形状。如果要对imrt计划进行实时修正或重新设计,那么更需要一种快速的自动化方法以获得imrt计划的精确目标函数。但是由于实时计划对于计划设计的时间和计划的质量都有很高的要求,目前的方法还不能达到这样的要求。因此如何快速和自动化地获得imrt计划的精确目标函数是实施自适应放射治疗最大的难题。
技术实现要素:
本发明的目的在于提供一种放射治疗计划精确目标函数的自动生成方法,该方法有利于自动、快速、有针对性地生成放疗计划精确目标函数。
为实现上述目的,本发明采用的技术方案是:一种放射治疗计划精确目标函数的自动生成方法,包括以下步骤:
步骤s1:获取已接受放射治疗的肿瘤病例的影像与对应的放射治疗计划,并基于此建立一定病例数量的病例模版数据库;
步骤s2:从所述病例模版数据库的影像上获取每个肿瘤病例的器官与肿瘤特征;
步骤s3:从所述病例模版数据库的放射治疗计划上获取每个肿瘤病例的目标函数;
步骤s4:基于步骤s2和步骤s3的处理结果,建立单隐藏层神经网络模型;
步骤s5:获取待接受放射治疗的肿瘤病例的器官与肿瘤特征;
步骤s6:基于步骤s4和步骤s5的处理结果,生成所述待接受放射治疗的肿瘤病例对应的目标函数。
进一步地,所述步骤s1包括以下步骤:
步骤s11:获取已接受放射治疗的肿瘤病例的影像,包括历史ct图像以及历史磁共振图像;
步骤s12:将所述历史ct图像以及历史磁共振图像进行融合配准,并在融合配准后的图像上勾画出肿瘤及器官;
步骤s13:根据所述肿瘤病例的肿瘤分期、检查报告及治疗规范,获取肿瘤处方剂量以及器官剂量限值要求;
步骤s14:设定所述肿瘤病例的目标函数,进而建立放射治疗计划;
步骤s15:判断建立的放射治疗计划是否达到肿瘤处方剂量以及器官剂量限值要求,若未达到要求,则返回步骤s14,调整所述肿瘤病例的目标函数,进而建立新的放射治疗计划;若达到要求,则将当前目标函数作为与所述肿瘤病例匹配的目标函数,将当前放射治疗计划作为所述肿瘤病例对应的放射治疗计划,并存储于病例模版数据库中,进而建立一定病例数量的病例模版数据库。
进一步地,在所述步骤s2中,按以下方法获取所述器官与肿瘤特征:
器官特征的获取方法为:
记危及器官o与靶区t的重叠体积(overlapvolume,ov)函数如下:
其中,d(p,t)为点p到肿瘤边界的距离,|{p∈o|d(p,t)≤r}|表示各向同性扩缩r后的肿瘤t与器官o相交叠区域的体积,函数ov(r)为所述重叠体积与器官o体积的比值;
肿瘤特征为计划肿瘤区域本身在一定范围内的扩张或收缩的区域体积。
进一步地,在所述步骤s4中,按以下步骤建立所述神经网络模型:
步骤s41:初始化神经网络,初始设置模型输入层、隐藏层和输出层的节点数,学习率,迭代次数,输入层到隐藏层之间的链接权重矩阵wih,以及隐藏层到输出层之间的链接权重矩阵who;
步骤s42:以步骤s2获取的器官与肿瘤特征作为所述神经网络的输入层节点数值,以步骤s3获取的目标函数作为所述神经网络的输出层节点数值,训练所述神经网络,包括计算隐藏层节点值;
步骤s43:计算输出层计划目标函数值,计算输出层误差用于更新who权重,计算隐藏层误差用于更新wih权重,神经网络模型至此建立完成。
进一步地,对于链接权重矩阵中任一链接权重的获取方法如下:
记神经网络有输入层a,输入层a的节点矩阵a乘以链接权重矩阵w获得输出层b的节点矩阵b;输入层a与输出层b分别有m个隐藏层节点和n个输出层节点,wj,k为输入层a的第j个节点链接到输出层b的第k个节点的链接权重,每个输出层b的节点都有各自的固定目标值tk和计算出的实际值ok;
对所有n个输出层b节点的和,其误差函数对链接权重偏导数有:
但是对于输出层b的第k个节点,其实际值ok有且仅有取决于到这个节点的链接权重,所以有:
在这里,tk是一个为常数的固定目标值,而计算得到的实际值ok是随wj,k变化而变化的变量,因此有:
将ek代入等式右边第一项,有:
对于等式右边ok对链接权重wj,k的偏导数,ok是节点k的输出,是输入到节点k上输入信号的加权求和,再经过sigmoid函数处理得到的结果,因而有:
这里,已知sigmoid函数的偏微分公式为:
将式(1.5)代式(1.6),有:
在这里,通过神经网络模型的学习率α来不断调节链接权重,以计算得到最合适的链接权重值,公式如下:
当神经网络模型的迭代次数结束后,即可获得链接权重矩阵w中每一个链接权重值。
进一步地,在所述步骤s6中,获取目标函数的方法为:访问步骤s4已训练并建立的神经网络模型,以步骤s5获取的器官与肿瘤特征作为神经网络模型的输入层节点数值,依此乘以链接权重矩阵who和wih,计算得到输出层节点数值,即计划目标函数。
相较于现有技术,本发明具有以下有益效果:本发明提供了一种放射治疗计划精确目标函数的自动生成方法,充分利用了神经网络的自学习功能,通过挖掘病例影像上肿瘤和器官信息的潜在特征,快速生成准确的放疗计划目标函数。此外,针对几何形状空间位置复杂且周围器官繁多的肿瘤,快速和准确的高质量imrt自动计划能够大大减少计划设计师的工作量,提高计划设计的效率,减少因经验不足和人为误差导致的计划缺陷,减轻医院的负担,创造自适应放疗的条件。
附图说明
图1为本发明实施例的实现流程图。
图2为本发明实施例中病例模版数据库的建立流程图。
图3为本发明实施例中神经网络模型的训练流程图。
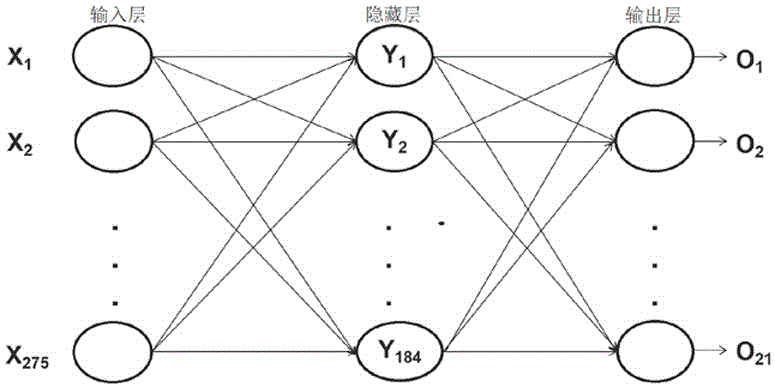
图4为本发明实施例中神经网络模型的结构图。
图5为本发明实施例中局部晚期鼻咽癌分立计划肿瘤区域的空间位置关系。
具体实施方式
下面结合附图及具体实施例对本发明作进一步说明。
本发明提供一种放射治疗计划精确目标函数的自动生成方法,如图1所示,包括以下步骤:
步骤s1:获取已接受放射治疗的肿瘤病例的影像与对应的高质量放射治疗计划,并基于此建立一定病例数量的病例模版数据库;
步骤s2:从所述病例模版数据库的影像上获取每个肿瘤病例的器官与肿瘤特征,并存储至所述病例模版数据库;
步骤s3:从所述病例模版数据库的放射治疗计划上获取每个肿瘤病例的目标函数;
步骤s4:基于步骤s2和步骤s3的处理结果,建立单隐藏层神经网络模型;
步骤s5:获取待接受放射治疗的肿瘤病例的器官与肿瘤特征;
步骤s6:基于步骤s4和步骤s5的处理结果,生成所述待接受放射治疗的肿瘤病例对应的目标函数。
在本实施例中,如图2所示,所述步骤s1包括以下步骤:
步骤s11:获取已接受放射治疗的肿瘤病例的影像,包括历史计算机断层扫描(computedtomography,ct)图像以及历史磁共振图像;
步骤s12:将所述历史ct图像以及历史磁共振图像进行融合配准,并在融合配准后的图像上勾画出肿瘤及器官;
步骤s13:根据所述肿瘤病例的肿瘤分期、检查报告及治疗规范,获取肿瘤处方剂量以及器官剂量限值要求;
步骤s14:设定所述肿瘤病例的目标函数,进而建立放射治疗计划;
步骤s15:判断建立的放射治疗计划是否达到肿瘤处方剂量以及器官剂量限值要求,若未达到要求,则返回步骤s14,调整所述肿瘤病例的目标函数,进而建立新的放射治疗计划;若达到要求,则将当前目标函数作为与所述肿瘤病例匹配的目标函数,将当前放射治疗计划作为所述肿瘤病例对应的放射治疗计划,并存储于病例模版数据库中,进而建立一定病例数量的病例模版数据库。
在所述步骤s2中,按以下方法获取所述器官与肿瘤特征:
器官特征的获取方法为:
记危及器官o与靶区t的重叠体积(overlapvolume,ov)函数如下:
其中,d(p,t)为点p到肿瘤边界的有符号距离(在肿瘤外为正,内为负),|{p∈o|d(p,t)≤r}|表示各向同性扩缩r后的肿瘤t与器官o相交叠区域的体积,函数ov(r)为所述重叠体积与器官o体积的比值;更简单地说,ov值表示各向同性均匀扩缩后的肿瘤与器官的重叠体积占器官体积的比值,所以其值位于0-1之间。
在生成危及器官ov的过程中,根据已有的分立计划肿瘤区域合成总体计划肿瘤区域,总体区域扩张或收缩距离从-1cm至1cm之间进行,步长0.2cm生成新的区域。所生成区域与器官的重叠部分占器官的体积百分比即为ov值,该值根据所述ov函数获取。通过ov值来表征器官特征。
肿瘤特征的获取方法:
肿瘤特征为计划肿瘤区域本身在一定范围内的扩张或收缩的区域体积。计划肿瘤区域起始距离、步长、终止距离分别始终为-1cm、0.2cm、1cm。
在所述步骤s4中,如图3所示,按以下步骤建立如图4所示的单隐藏层神经网络模型:
步骤s41:初始化神经网络,初始设置模型输入层、隐藏层和输出层的节点数,学习率,迭代次数,输入层到隐藏层之间的链接权重矩阵wih,以及隐藏层到输出层之间的链接权重矩阵who;
步骤s42:以步骤s2获取的器官与肿瘤特征作为所述神经网络的输入层节点数值,以步骤s3获取的目标函数作为所述神经网络的输出层节点数值,训练所述神经网络,包括计算隐藏层节点值;
步骤s43:计算输出层计划目标函数值,计算输出层误差用于更新who权重,计算隐藏层误差用于更新wih权重,神经网络模型至此建立完成。
其中,对于链接权重矩阵中任一链接权重的获取方法如下:
记神经网络有输入层a,输入层a的节点矩阵a乘以链接权重矩阵w获得输出层b的节点矩阵b;输入层a与输出层b分别有m个隐藏层节点和n个输出层节点,wj,k为输入层a的第j个节点链接到输出层b的第k个节点的链接权重,每个输出层b的节点都有各自的固定目标值tk和计算出的实际值ok;
对所有n个输出层b节点的和,其误差函数对链接权重偏导数有:
但是对于输出层b的第k个节点,其实际值ok有且仅有取决于到这个节点的链接权重,所以有:
在这里,tk是一个为常数的固定目标值,而计算得到的实际值ok是随wj,k变化而变化的变量,因此有:
将ek代入等式右边第一项,有:
对于等式右边ok对链接权重wj,k的偏导数,ok是节点k的输出,是输入到节点k上输入信号的加权求和,再经过sigmoid函数处理得到的结果,因而有:
这里,已知sigmoid函数的偏微分公式为:
将式(1.5)代式(1.6),有:
在这里,通过神经网络模型的学习率α来不断调节链接权重,以计算得到最合适的链接权重值,公式如下:
当神经网络模型的迭代次数结束后,即可获得链接权重矩阵w中每一个链接权重值。
在所述步骤s6中,获取目标函数的方法为:访问步骤s4已训练并建立的神经网络模型,以步骤s5获取的器官与肿瘤特征作为神经网络模型的输入层节点数值,依此乘以链接权重矩阵who和wih,计算得到输出层节点数值,即计划目标函数。
为了让本领域技术人员进一步了解本发明提出的技术方案,下面结合具体实施例进行说明。
1、首先,获取局部晚期鼻咽癌患者的ct图像和磁共振图像。患者在医生的安排下,进行相应的ct扫描,扫描层厚度为3mm。
ct图像的获取和基本要求如下:
体位:鼻咽癌患者取仰卧位,双手靠体,用头颈肩热塑膜与塑料头枕固定;
ct图像的获取:进行philips大孔径螺旋定位ct扫描,扫描范围:从颅顶至胸锁关节下2cm;
扫描条件:模拟ct扫描层厚3mm。
通过上述方式,获取已接受放射治疗的局部晚期鼻咽癌患者病例的影像,即历史ct图像以及该病例相应的历史磁共振图像。
2、对ct图像和磁共振图像进行融合配准,并依据icru83号文件的肿瘤与器官勾画指南,在融合配准后的ct图像上勾画出肿瘤与器官。
3、根据患者住院期间的病理报告、影像诊断、鼻咽镜检查等,确定患者的肿瘤分期、撰写检查报告、制定治疗规范,并给出相应的肿瘤处方剂量以及器官剂量限值要求。
通过如下方式获得肿瘤处方剂量:根据肿瘤的分期和相应的检查报告,然后结合治疗规范,给出肿瘤的处方剂量。
通过如下方式获得器官剂量限值要求:器官的剂量限值按照国际的参考建议和临床实际的经验结合给出。
4、通过如下方式进行放疗计划的设计:于pinnacle39.2计划系统上,根据以上给出的肿瘤处方剂量以及器官剂量限值要求进行放疗计划的设计。放疗计划的设计过程包括:治疗等中心点设定;切除床板;设置防护环;靶区及危及器官名称与颜色设定;射野添加;射野角度设置;设置剂量网格;编辑处方;设置等剂量线;imrt计划参数设置;21个目标函数参数设置;优化与评估。
若放疗计划的剂量分布和剂量体积直方图数据不能达到肿瘤处方剂量以及器官剂量限值要求,则需通过反复调整21个目标函数来进行优化,最终以达到肿瘤处方剂量以及器官剂量限值要求,完成高质量的放射治疗计划。
在本实施例中,依据融合配准后ct图像上已勾画的肿瘤与器官获得器官与肿瘤特征。
其中,器官特征的获取按如下方法实现:
记危及器官o与靶区t的重叠体积(overlapvolume,ov)函数如下:
其中,d(p,t)为点p到肿瘤边界的有符号距离(在肿瘤外为正,内为负),|{p∈o|d(p,t)≤r}|表示各向同性扩缩r后的肿瘤t与器官o相交叠区域的体积,函数ov(r)为所述重叠体积与器官o体积的比值;更简单地说,ov值表示各向同性均匀扩缩后的肿瘤与器官的重叠体积占器官体积的比值,所以其值位于0-1之间。
在生成鼻咽癌ov的过程中,根据已有的分立计划肿瘤区域合成总体计划肿瘤区域。在本实施例中,共有7个分立计划肿瘤区域:gtv_t_p、ctv1_p、ctv2_p、gtv_nl_p、gtv_nr_p、ctv_nl_p和ctv_nr_p,如图5所示。ctv2_p、ctv_nl_p和ctv_nr_p这三个分立计划肿瘤区域合成总体计划肿瘤区域ctv_all。
在本实施例中,总体区域扩张或收缩距离从-1cm至1cm之间进行,步长0.2cm不同的区域。与不同器官计算ov。器官包括左右腮腺,脊髓,脑干,晶体,左右视神经,垂体,视交叉。所生成区域与器官的重叠部分占器官的体积百分比即为ov值,该值根据所述ov函数获取。在本实施例中,选取20个总体区域或分立区域与不同器官的组合获取器官特征。每一个器官特征均含有11个参数。
肿瘤特征的获取按如下方法实现:
肿瘤特征为计划肿瘤区域本身在一定范围内的扩张或收缩的区域体积。计划肿瘤区域起始距离、步长、终止距离分别始终为-1cm、0.2cm、1cm。在本实施例中,选取5个分立计划肿瘤区域获取肿瘤特征。这5个分立计划肿瘤区域是gtv_t_p、ctv1_p、ctv2_p、gtv_nl_p、gtv_nr_p。每一个肿瘤特征均含有11个参数。
在本实施例中,收集至少100位局部晚期鼻咽癌患者的20项器官特征、5项肿瘤特征和对应高质量计划的21个目标函数,存储于病例模版数据库,至此病例模版数据库建立完毕。
在本发明中,单隐藏层神经网络模型的建立包括神经网络的初始化、神经网络训练的开始、神经网络内部权重更新。
在本实施例中,初始设置模型输入层、隐藏层和输出层的节点数分别设置为275、184、21,学习率设置为0.02,迭代次数设置为2500次,输入层到隐藏层之间的链接权重矩阵wih,以及隐藏层到输出层之间的链接权重矩阵who;
在本实施例中,20项ovh特征和5项靶区体积特征,每项特征含有11个参数,共275个特征参数作为神经网络的输入层节点数值,对应计划的21个目标函数作为输出层节点数值,开始训练神经网络;
在本实施例中,神经网络模型任一链接权重的获取方法如下:
记神经网络有输入层a,输入层a的节点矩阵a乘以链接权重矩阵w获得输出层b的节点矩阵b。层a与层b为分别有m个隐藏层节点和n个输出层节点。wj,k为输入层a的第j个节点链接到输出层b的第k个节点的链接权重,每个输出层b的节点都有各自的固定目标值tk和计算出的实际值ok。
对所有n个输出层b节点的和,其误差函数对链接权重偏导数有
对于输出层b的第k个节点,其实际值ok有且仅有取决于到这个节点的链接权重,所以有
在这里,tk是一个为常数的固定目标值,而计算得到的实际值ok是随wj,k变化而变化的变量。进一步的,有
将ek代入等式右边第一项,有
对于等式右边ok对链接权重wj,k的偏导数,ok是节点k的输出,是输入到节点k上输入信号的加权求和,再经过sigmoid函数处理得到的结果。因而有表达式:
这里,已知sigmoid函数的偏微分公式为:
将式(1.5)代式(1.6),有
通过神经网络模型的学习率α来不断调节链接权重,以计算得到最合适的链接权重值。公式如下:
在本实施例中,计算隐藏层节点值,计算输出层计划目标函数值,计算输出层误差用于更新who权重,计算隐藏层误差用于更新wih权重,经过2500次迭代后,神经网络模型至此建立完毕。
在本实施例中,按照如上所述获取病例模版数据库患者器官与肿瘤特征的同样方式,获取一待接受放射治疗的局部晚期鼻咽癌患者病例的器官与肿瘤特征,并作为神经网络的输入层节点数值,代入已建立的神经网络算法模型,即可自动计算得到输出层节点数值,即适应该待接受放射治疗患者的精确计划目标函数。
在本实施例中,将自动计算得到的计划目标函数带到pinnacle3计划系统进行计划设计,并标记为自动计划。通过上述过程,检查最终自动计划的剂量分布和剂量体积直方图数据,判断是否达到肿瘤处方剂量以及器官剂量限值要求。
经测试以及对比,根据上述方法自动建立的预案中绝大部分病例可以达到肿瘤处方剂量以及器官剂量限值要求。
以上是本发明的较佳实施例,凡依本发明技术方案所作的改变,所产生的功能作用未超出本发明技术方案的范围时,均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!