一种快速溶出的核黄素片及其制备方法与流程
本发明涉及药用的口服速释的维生素b2片,尤其涉及一种快速溶出的核黄素片及其制备方法,可满足人体生物等效性豁免。
背景技术:
近年来,难溶性药物的研究受到了广泛的关注,市场现有的药物有很多都是难溶性物质,在制药领域,约有一半的药物由于其难溶性而造成制剂开发难度大、产品稳定性差、生物利用度底等问题,因此,提高药物的溶出度,已经成为制剂开发领域的迫切需求。
核黄素,也称为维生素b2,由异咯嗪与核糖组成,结构式如下式(i)。
其微溶于水,不溶于丙酮、苯、氯仿和乙醚等绝大部分有机溶剂,可于加热条件下,溶于二甲亚砜中。维生素b2在预防口腔、皮肤出现炎症方面具有重要的作用,同时还能预防眼睛充血、头晕、口腔溃疡等症状的出现,其在机体的能量代谢、传递氢原子以及促进生物氧化等方面有着不可或缺的重要作用。然而,维生素b2在水中的溶出度却非常低,属于难溶性的药物之一。
中国药典“维生素b2片”质量标准项下明文规定该片剂的主药的溶出度应为≥75%,20分钟,600ml,100转/分钟,美国药典中该片剂的主药的溶出度≥75%,45分钟,900ml,50转/分钟。药典规定的片剂溶出度是该片剂中主药在规定的溶剂中溶出的速率与程度。在一定的时间内,主药溶出的多少,将直接影响到药物的疗效。
根据食品药品监督管理局药品审评中心颁布的《人体生物等效性试验豁免指导原则》溶出度检测项下说明:
口服固体常释制剂具有快速溶出的定义是:采用中国药典2015版附录通则(0931)方法1(篮法),转速为每分钟100转,或是方法2(桨法),转速为每分钟50或75转,溶出介质体积为500ml(或更少),在溶出介质:(1)0.1mol/lhcl或是不含酶的模拟胃液;(2)ph4.5缓冲介质;(3)ph6.8缓冲介质或是不含酶的模拟肠液中,30分钟内api的溶出均能达到标示量的85%以上。
口服固体常释制剂具有非常快速溶出的定义是:在上述条件下15分钟内api的溶出均能达到标示量的85%以上。
对于生物药剂学分类系统(biopharmaceuticsclassificationsystem,简称bcs)分类1类和3类的仿制制剂为快速溶出,且只要处方中的其他辅料成分不显著影响api的吸收,则不必证明该药物在体内生物利用度和生物等效的可能性,即生物等效性豁免。
维生素b2片为bcs1类口服固体常释制剂,为了达到快速溶出,申请生物等效性豁免,更加保证和提高产品质量。
技术实现要素:
基于上述的不足,本申请提供了一种快速溶出的核黄素片及其制备方法,以部分或全部地改善、甚至解决相关技术中的核黄素溶出度低的问题。
本申请是这样实现的:
在第一方面,本申请的示例提供了一种核黄素片。
该核黄素片包括两种规格,第一规格的片剂、第二规格的片剂,其中,第一规格是104毫克/片且含10毫克的维生素b2,第二规格是52毫克/片且含5毫克的维生素b2。每一片的核黄素片包括按照下述质量份的各组分:10份的维生素b2、78.5份的乳糖一水合物、8.3份的羧甲基淀粉钠、4.7份的玉米淀粉、0.5份的聚维酮k30、0.4份的硬脂酸镁、0.5份的滑石粉、1.1份的胶态二氧化硅。此外,其中,维生素b2是多晶结构体且未分解。
本申请示例提供了一种具有快速释放,具有高的利用率的核黄素片,能够为人体及时补充维生素b2元素。
结合第一方面,在本申请的第一方面的第一种可能的实施方式中,第一规格的片剂的硬度是1.5至3.5kg/cm2,崩解时限<2分钟,脆碎度<1%,厚度2.77±0.5mm。或者,第二规格的片剂的硬度是1.2至3.0kg/cm2,崩解时限<1分钟,脆碎度<1%,厚度2.1±0.5mm。
在第二方面,本申请的示例提供了一种制备核黄素片的方法。
制备方法包括:将构成核黄素片的各组分按比例混合,压片为10毫克/片或5毫克/片的规格。
结合第二方面,在本申请的第二方面的第一种可能的实施方式中,将构成核黄素片的各组分按比例混合是通过多个步骤进行的。
结合第二方面或第二方面的第一种可能的实施方式,在本申请的第二方面的第二种可能的实施方中,将构成核黄素片的各组分按比例混合包括依序进行制粒步骤和总混步骤。
其中,制粒步骤包括利用维生素b2、乳糖一水合物、部分量的羧甲基淀粉钠、聚维酮k30、玉米淀粉制作颗粒物。
其中,总混步骤包括将颗粒物、硬脂酸镁、滑石粉、胶态二氧化硅以及剩余量的羧甲基淀粉钠混匀。
结合第二方面的第二种可能的实施方式,在本申请的第二方面的第三种可能的实施方中,制粒步骤包括:
将维生素b2、乳糖一水合物、部分量的羧甲基淀粉钠进行干混制备干混物的干混步骤;
将聚维酮k30、玉米淀粉分别独立地用纯化水溶解的粘结剂制备步骤;
利用干混物和粘结剂制备湿颗粒的湿粒制备步骤;
干燥湿颗粒的干燥步骤。
结合第二方面的第三种可能的实施方式,在本申请的第二方面的第四种可能的实施方中,部分量的羧甲基淀粉钠与剩余量的羧甲基淀粉钠的质量之比为68/98。
结合第二方面的第三种可能的实施方式,在本申请的第二方面的第五种可能的实施方中,制粒步骤还包括以下的一种或两种限定。
第一限定:粘结剂制备步骤包括将聚维酮k30溶解于常温25~30℃的纯化水中至完全清澈得到第一分散液;将玉米淀粉中分散在纯化水搅匀得到第二分散液,再将两者利用80℃热水将第一分散液和第二分散液充分混匀。
第二限定:干燥步骤包括将湿颗粒转移至流化床中干燥,风量为80m3/h,进风温度为60℃,控制干燥终点的含水率在0.7%-2.5%。
结合第二方面的第三种可能的实施方式,在本申请的第二方面的第六种可能的实施方中,在总混步骤中,颗粒物、硬脂酸镁、滑石粉、胶态二氧化硅以及剩余量的羧甲基淀粉钠均为50目的筛网的筛下物。
结合第二方面,在本申请的第二方面的第七种可能的实施方式中,构成核黄素片的各组分均为颗粒物。
可选地,将构成核黄素片的各组分按比例混合之前,各组分还经历粒径筛选,其中,维生素b2、乳糖一水合物以及羧甲基淀粉钠是12至14目的筛网的筛下物,聚维酮k30、玉米淀粉、羧甲基淀粉钠、硬脂酸镁、胶态二氧化硅和滑石粉是50目的筛网的筛下物。
附图说明
为了更清楚地说明本申请实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
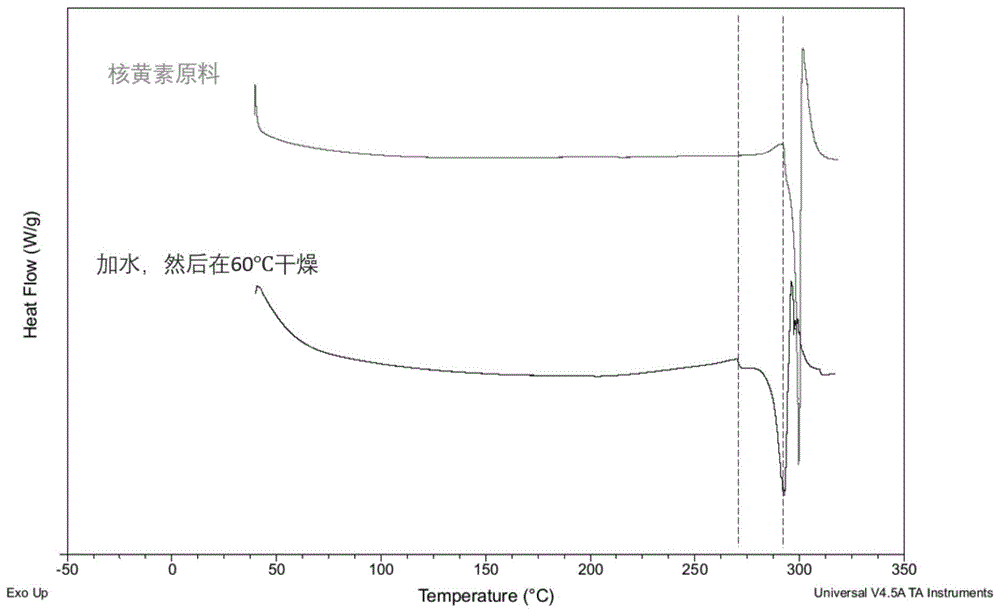
图1为本申请示例中纯维生素b2以及由水润湿的维生素b2的dsc图;
图2为本申请示例中纯维生素b2的tga图;
图3为本申请示例中所制备的核黄素片在不同ph值条件下的溶出曲线;
图4为本申请实施例1中的核黄素片的制备流程图。
具体实施方式
下面将结合实施例对本申请的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本申请,而不应视为限制本申请的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下针对本申请实施例的核黄素片及其制备方法进行具体说明:
就发明人所知,维生素b2在常见溶剂中的溶解度并不高,因此这显著地限制和影响其在药物方面的应用。目前,维生素b2通常以片剂的制剂形式作为药物。然而,目前的核黄素片形式中,主药(核黄素)的溶出的速率与程度并不理想,难以达到食品药品监督管理局药品审评中心颁布的《人体生物等效性试验豁免指导原则》快速溶出的规定。
有鉴于此,申请人经过研究实现了一种核黄素片(速释维生素b2片),其达到了生物等效性豁免的程度。该核黄素片不仅可达到快速溶出,而且制作工艺简单、工时短、成本低。由于其能够快速释放,是一种利用率高的速释制剂,因此可以为人体及时补充维生素b2元素。
在研究中,发明人发现,在核黄素片中,核黄素本身的稳定性以及片剂中的其他原料对其溶出和人体吸收起到相当程度的影响。
就核黄素的稳定性而言,由于其在自然界中是以多晶型方式存在,因此,申请人通过差示扫描量热法(differentialscanningcalorimetry,dsc)和热重分析(thermogravimetricanalysis,tga/tg)实验确定热稳定性。
根据dsc实验结果,其显示核黄素的熔点是290℃。
此外,将充分润湿的核黄素(模拟湿法制粒时的状态)在60℃下加热1小时。再进行dsc实验,结果显示核黄素的熔点下降至约为260℃,参阅图1。因此,这种熔点的改变是由于核黄素在水溶液中发生晶型转变。据此,申请人认为:在制作示例中的核黄素片时,涉及到将核黄素润湿操作,则后续的选择干燥温度为60℃时,以便保持原料药(核黄素)处于比较稳定的状态,使其没有分解和晶型的转变。
进一步地的tga实验结果显示,核黄素原料药在温度为279.88℃时立即分解,如图2所示。因此,对核黄素进行热处理时,选择干燥温度限定为60℃时,以便在整个干燥过程中原料药没有分解,处于比较稳定的状态。
综合上述实验(dsc和tga)分析:维生素b2片在制备过程当中选择干燥温度为60℃时,没有晶型的转变并且热稳定性较好。
在药物学中将化合物药物/原料药制作为各种适于人体使用的制剂通常需要使用各种添加剂/辅料。然而,正如前述,申请人在研究中发现不同的添加剂对核黄素片中的核黄素溶出度起到实质上的作用和影响。
因此,在本申请示例中,发明人提出了具有特定辅料和原料配比的核黄素片,其具有两种规格,第一规格的片剂、第二规格的片剂,其中,第一规格是104毫克/片且含10毫克的维生素b2,第二规格是52毫克/片且含5毫克的维生素b2。
每一片的所述核黄素片包括按照下述质量份的各组分:10份的维生素b2、78.5份的乳糖一水合物、8.3份的羧甲基淀粉钠、4.7份的玉米淀粉、0.5份的聚维酮k30、0.4份的硬脂酸镁、0.5份的滑石粉、1.1份的胶态二氧化硅。并且,核黄素片中的维生素b2多晶结构体且未分解。换言之,维生素b2保持其自然状态下的多晶结构,并且未受到热分解作用和光分解作用的影响。
维生素b2片的配方规格如下表1所示。
表1核黄素片
对应地,发明人还给出了速释的维生素b2片的制备方法,具体制备方法包括如下步骤:
步骤一:称量配料:分别称取维生素b2原料药、乳糖、羧甲基淀粉钠,过12~14目筛网。再称取粘合剂聚维酮k30、玉米淀粉。最后分别称羧甲基淀粉钠、硬脂酸镁、胶态二氧化硅、滑石粉作为外加辅料,过50目筛网。其中的胶态二氧化硅能够用作为助流剂,同时还具有崩解性,从而可以改善颗粒物的流动性能。
步骤二:干粉混合:将维生素b2原料药、乳糖、羧甲基淀粉钠,用湿法制粒机预先充分混匀。其中的乳糖为乳糖一水合物,其能够用作填充剂和稀释剂。此外,其作为优良的填充及粘合新型辅料,不仅能提高片剂硬度,增加耐磨性能,外观光洁细腻,而且还可提高内在“溶出”性能,特别对难溶性药物具有促进体内生物利用度的作用。
步骤三:粘合剂配制:将0.5mg的聚维酮k30相应的溶解于0.0044ml常温(25~30℃)纯化水中至完全清澈。4.7mg的玉米淀粉中加入相应的0.0106ml纯化水搅匀,再将两种粘合剂充分混匀并加入0.015ml80℃热水充分混匀,现配现用。
步骤四:制湿颗粒:将粘合剂加入已混匀的内加辅料中,与物料充分混匀制软材并过4*4圆孔筛网制备湿颗粒。
步骤五:干燥:湿颗粒至于流化床中干燥,风量为80m3/h,进风温度为60℃,共计干燥10min,测定水分,结果保持在0.8%至2.0%。
步骤六:干整粒:将干燥后软材过50目筛网整粒。
步骤七:总混:将已过筛外加辅料与干颗粒充分混匀。
步骤八:压片:将颗粒在压片机上,压片方式通过下述产品规格限定。
使用ф7.0mm浅凹圆形冲压片(10mg规格)。理论片重0.104±7.5%g,硬度1.5-3.5kg/cm2,崩解时限<2分钟,脆碎度<1%,厚度2.77±0.5mm。
使用ф5.5mm浅凹圆形冲压片(5mg规格),理论片重0.052±7.5%g,硬度:1.2-3.0kg/cm2,崩解时限<1分钟,脆碎度<1%,厚度2.1±0.5mm。
为了评价核黄素片的溶出效果,对其进行溶出度检测。检测方法根据食品药品监督管理局药品审评中心颁布的《人体生物等效性试验豁免指导原则》溶出度检测项下进行检测。
具体如下说明:桨法,转速为每分钟50转,溶出介质体积为500ml,在溶出介质:(1)0.1mol/l盐酸;(2)ph4.5缓冲介质;(3)ph6.8缓冲介质,取样检测时间点为:5、10、15、30、45、60分钟并绘制溶出曲线,参阅图3。
以下结合实施例对本申请的一种核黄素片及其制备方法作进一步的详细描述。
实施例1
所述的一种速释的维生素b2片,其是由以下组分制得(以10mg规格2000片计):
参阅图4,维生素b2片制备方法如下:
步骤一、称量配料:分别称取维生素b2原料药20.00g、乳糖157.00g、羧甲基淀粉钠6.80g等内加辅料,过12~14目筛网;再称取粘合剂聚维酮k301.00g、玉米淀粉9.40g;最后分别称羧甲基淀粉钠9.80g、硬脂酸镁0.80g、胶态二氧化硅2.20g、滑石粉1.00g作为外加辅料,过50目筛网。
步骤二、干粉混合:将内加辅料维生素b2原料药、乳糖、羧甲基淀粉钠等内加辅料用湿法制粒锅充分混合均匀,搅拌桨混合转速为300~400转/分,搅拌时间为1分钟;制粒刀转速为800~1000转/分,混合时间为1分钟;开盖,将锅盖以及壁上的粉末铲下,二次混合:搅拌桨混合转速为300~400转/分,搅拌时间为1分钟;制粒刀转速为800~1000转/分,混合时间为1分钟。
步骤三、粘合剂配制:将聚维酮k30溶解于10ml常温纯化水中至完全清澈,玉米淀粉中加入20ml常温纯化水搅匀,再将两种粘合剂充分混匀并加入30ml80℃热水充分混匀,现配现用。
步骤四、制湿颗粒:将粘合剂加入已混匀的内加辅料中,与物料充分混匀制软材并过4*4圆孔筛网制备湿颗粒。
步骤五、干燥:湿颗粒至于流化床中干燥,风量为80m3/h,进风温度为60℃,共计干燥10min,测定水分,结果保持在0.7%~2.5%。
步骤六、干整粒:将干燥后软材过50目筛网整粒。
步骤七、总混:将已过筛外加辅料与干颗粒充分混匀,转速20r/min,5min。
步骤八、压片:将颗粒在压片机上,使用ф7.0mm浅凹圆形冲压片。控制理论片重0.104±7.5%g/片,硬度1.5~3.5kg,崩解时限<2分钟,脆碎度<1%,厚度2.77±0.5mm,以及检测溶出度。
步骤九、溶出度检测:根据食品药品监督管理局药品审评中心颁布的《人体生物等效性试验豁免指导原则》溶出度检测项下进行检测。
具体如下说明:桨法,转速为每分钟50转,溶出介质体积为500ml,在溶出介质:(1)0.1mol/l盐酸;(2)ph4.5缓冲介质;(3)ph6.8缓冲介质,取样检测时间点为:5、10、15、30、45、60分钟并绘制溶出曲线。
溶出结果分析:在上述条件下,15分钟内维生素b2的溶出度均为90%以上(均能达到标示量的85%以上),表明:本发明涉及的药用核黄素(维生素b2)片是一种快速溶出的口服固体制剂,达到《人体生物等效性试验豁免指导原则》溶出度项目下标准,满足生物豁免。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!