ATCA在制备治疗肿瘤的药物中的用途的制作方法
本发明涉及生物医药技术领域,具体涉及一种atca(aurintricarboxylicacid,金精三羧酸,又称为ata)及其药学上可接受的盐在制备治疗肿瘤的药物中的用途。
背景技术:
近年来,癌症发病率逐年上升,危害广泛,造成病人巨大的痛苦和社会沉重的经济负担。通常抗癌的方法有手术、化疗、放疗、免疫治疗等,其中放疗和免疫治疗需要针对特定的癌症分型及病情,并不能广泛适用;手术对未转移的部分癌症有效,但对位置特殊和已转移的癌症无效。因此,化疗是唯一一种几乎可以适用于所有癌症的治疗方法。化疗又分普通化疗和靶向治疗两大类,其中普通化疗通常是以药物造成细胞毒性、干扰细胞的dna复制或rna合成、干扰细胞有丝分裂等作用机理为主。由于这些药物的选择性不强,杀伤癌细胞的同时也会杀伤正常细胞,从而导致严重的副作用;而癌细胞坏死之后会激发起严重的局部炎症,加剧肿瘤微环境的炎性,而肿瘤炎症微环境会促进肿瘤的发展,使那些还没有被杀伤的癌细胞发展更快,潜在增加复发的风险。而靶向治疗则是针对特定的基因变异来设计药物,其选择性强,作用高效而副作用低,但癌症突变多种多样,如果没有相应的突变则用药无效,有的癌症甚至并不由突变引起,因此靶向药适用范围极窄,且需要事先进行昂贵的基因检测。同时,由于癌症普遍存在的异质性,一团肿瘤细胞的基因组各不相同,靶向药能杀死其中含有特定基因突变的癌细胞,却一定会留下少量不含有此突变的癌细胞,因而靶向药使用一段时间之后一定会因肿瘤耐药而失效。
抑制蛋白质合成是一些抗生素常见的作用原理,常用于抗菌,但在抗肿瘤领域,长期的实践证明抑制蛋白质合成效果并不好。以往曾用于癌症治疗的蛋白质合成抑制剂有放线菌酮和嘌呤霉素,其中放线菌酮干预翻译的起始与延伸,嘌呤霉素使肽链合成过程中断,产生合成了一半的无功能肽链。由于正常细胞同样需要蛋白质合成,因此这些药物用量大了对正常细胞杀伤作用很大,造成实际使用中这两种药物的毒副作用非常大。而药物用量小了则不能阻止翻译的进行,而且会减慢翻译的速率,翻译速率减慢会导致蛋白质折叠质量更好(zhangg.,m.hubalewska,andz.ignatova,transientribosomalattenuationcoordinatesproteinsynthesisandco-translationalfolding.natstructmolbiol,2009.16(3):p.274-80.;zhangg.andz.ignatova,foldingatthebirthofthenascentchain:coordinatingtranslationwithco-translationalfolding.curropinstructbiol,2011.21(1):p.25-31.)。而近年来的研究已经证实,癌细胞恰恰是通过减慢癌基因翻译延伸速率以增强其恶性表型(lianetal.,genome-wideandexperimentalresolutionofrelativetranslationelongationspeedatindividualgenelevelinhumancells.plosgenetics(2016)12(2):e1005901),因此较小的药量难以有效抑制癌细胞恶性表型。这种两难的原理使得放线菌酮已经退出了一般癌症治疗的临床实践,而嘌呤霉素的使用也极为受限。
技术实现要素:
本发明的目的在于克服现有技术的缺点与不足,提供一种atca及其药学上可接受的盐在制备治疗肿瘤的药物中的用途。
在本发明的一个实施方式中,上述atca的药学上可接受的盐包括无机碱盐和有机碱盐,如钠盐、钾盐、铵盐等;在本发明的一个实施例中,上述atca的药学上可接受的盐为atca铵盐。
在本发明的一个实施方式中,上述肿瘤为恶性肿瘤,其中,恶性肿瘤的实例包括,但不限于,恶性上皮肿瘤、肉瘤、骨髓瘤、白血病、淋巴瘤、黑色素瘤、头颈部肿瘤、脑部肿瘤、腹膜癌、混合型肿瘤。
具体地,上述恶性上皮肿瘤选自:肺癌、乳腺癌、肝癌、胰腺癌、结直肠癌、胃癌、胃食管腺癌、食管癌、小肠癌、贲门癌、子宫内膜癌、卵巢癌、输卵管癌、外阴癌、睾丸癌、前列腺癌、阴茎癌、肾癌、膀胱癌、肛门癌、胆囊癌、胆管癌、畸胎瘤和心脏肿瘤。
在本发明的一个实施例中,上述肿瘤为肺癌,特别是非小细胞肺癌。
在本发明的另一个实施例中,上述肿瘤为卵巢癌,特别是卵巢上皮癌。
在本发明的另一个实施例中,上述肿瘤为肝癌。
在本发明的一个实施方式中,上述肿瘤选自中晚期肿瘤、复发难治性肿瘤、经化疗药物治疗失败和/或复发肿瘤、经放疗失败和/或复发肿瘤、经靶向药物治疗失败和/或复发肿瘤、经免疫治疗失败和/或复发肿瘤。
本发明还提供一种包含atca或其药学上可接受的盐的药物组合物在制备治疗肿瘤的药物中的用途,该药物组合物还包含一种或多种药学上可接受的辅料。
具体地,上述用途中,atca及其药学上可接受的盐、肿瘤具有本发明上述定义。
具体地,上述药物组合物中,atca或其药学上可接受的盐的含量为0.01-99.99%(质量百分比)(具体如,0.01%、0.1%、1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、99%、99.99%)。
在本发明的一个实施方式中,上述药物组合物中,atca或其药学上可接受的盐为唯一的活性成分。
在本发明的另一个实施方案中,上述药物组合物中,atca或其药学上可接受的盐与一种或多种其它用于治疗肿瘤的活性成分联用,其中,atca或其药学上可接受的盐与该活性成分可配制用于同时、单独或顺序给药(simultaneous,separateorsequentialadministration)。
上述其它用于治疗肿瘤的活性成分可为现有技术中任何已知抗肿瘤活性成分,如抗肿瘤烷化剂、抗肿瘤抗代谢药、抗肿瘤抗生素、抗肿瘤植物药、抗肿瘤铂络合物、抗肿瘤抗体、抗肿瘤激素等。
具体地,上述药物组合物的制剂形式可以是任何可药用的剂型,如,片剂(包括糖衣片剂、膜包衣片剂、舌下片剂、口腔崩解片、口腔片剂等等)、丸剂、粉剂、颗粒剂、胶囊剂(包括软胶囊、微胶囊)、锭剂、糖浆剂、液体、乳剂、混悬剂、控制释放制剂(例如,瞬时释放制剂、缓释制剂、缓释微囊)、气雾剂、膜剂(例如,口服崩解膜剂、口腔粘膜-粘附膜剂)、注射剂(例如,皮下注射、静脉注射、肌内注射、腹膜内注射)、静脉滴注剂、透皮吸收制剂、软膏剂、洗剂、粘附制剂、栓剂(例如,直肠栓剂、阴道栓剂)、小药丸、鼻制剂、肺制剂(吸入剂)、眼睛滴剂等等、口服或胃肠外制剂。在本发明的一个实施方式中,上述药物组合物为口服制剂。
具体地,上述药物组合物通过口服、喷雾吸入、直肠用药、鼻腔用药、颊部用药、局部用药、非肠道给药,例如,皮下、静脉、肌内、鞘内、心室内、胸骨内、颅内或腹膜内注射或输入的途径向体内施加药物组合物,或借助外植储器用药。在本发明的一个实施方式中,上述药物组合物通过口服给药。
具体地,上述药学上可接受的辅料选自:溶剂、乳化剂、增塑剂、崩解剂、填充剂、粘合剂、甜味剂和润滑剂等中的一种或两种以上的组合。
具体地,上述溶剂如水、甲醇、乙醇、异丙醇、羟丙基-β-环糊精、聚乙二醇-15-羟基硬脂酸酯、二氯甲烷丙酮或乙酸乙酯中的一种或两种以上的组合。
具体地,上述乳化剂如聚乙二醇油酸酯、聚乙烯醇、甘油硬脂酸酯或吐温-80中的一种或两种以上的组合。
具体地,上述增塑剂如聚乙二醇、蓖麻油、甘油或山梨醇中的一种或两种以上的组合。
具体地,上述崩解剂如交联聚维酮、羟甲纤维素钠、甲基纤维素钠淀粉或低取代羟丙纤维素中的一种或两种以上的组合。
具体地,上述填充剂如微晶纤维素、赤藓醇、山梨醇、甘露醇、预胶化淀粉、碳酸钙、蔗糖或乳糖中的一种或两种以上的组合。
具体地,上述粘合剂如聚乙烯吡咯烷酮、卡波姆、羟丙基纤维素、明胶、瓜尔胶、羟甲基纤维素钠、羟丙甲纤维素、硅酸镁铝、乙基纤维素、羟乙基纤维素、预胶凝淀粉、阿拉伯胶、聚乙烯醇、聚维酮、麦芽糊精或海藻酸钠中的一种或两种以上的组合。
具体地,上述甜味剂如阿司帕坦、木糖醇、薄荷脑、薄荷香精、安塞蜜、甜菊糖苷或三氯蔗糖中的一种或两种以上的组合。
具体地,上述润滑剂如滑石粉、氢化硬脂酸钙、十二烷基硫酸镁、硬脂酰醇富马酸钠、水合硅胶钠、氢化蓖麻油、硬脂酸锌或硬脂酸镁中的一种或两种以上的组合。
本发明还提供一种治疗肿瘤的方法,其包括向由此需要的受试者给与治疗有效量的atca或其药学上可接受的盐或本发明上述药物组合物的步骤。
具体地,上述给与治疗有效量的atca或其药学上可接受的盐或本发明上述药物组合物的步骤可单独进行,也可与其他治疗手段(如手术、放疗、化疗等)联合应用。
具体地,上述方法中,atca及其药学上可接受的盐、药物组合物、肿瘤具有本发明上述定义。
在本发明的一个实施方案中,上述受试者为哺乳动物,特别是人。
具体地,上述atca或其药学上可接受的盐的治疗有效量取决于诸多因素,包括患者的年龄、体重、性别、自然健康状况、营养状况、服用时间、代谢速率、病症的严重程度以及诊治医师的主观判断,等。
本发明提供一种atca及其药学上可接受的盐在制备治疗肿瘤的药物中的用途,本发明的发明人通过实验发现,atca通过特异性干预翻译起始过程,使癌细胞不能通过减慢癌基因翻译延伸速率以增强其恶性表型,可以抑制癌细胞的恶性表型,同时对正常细胞的杀伤效果最小化,在达到抗癌效果的同时可以使副作用得到有效控制。本发明对肿瘤治疗具有重要应用价值。
附图说明
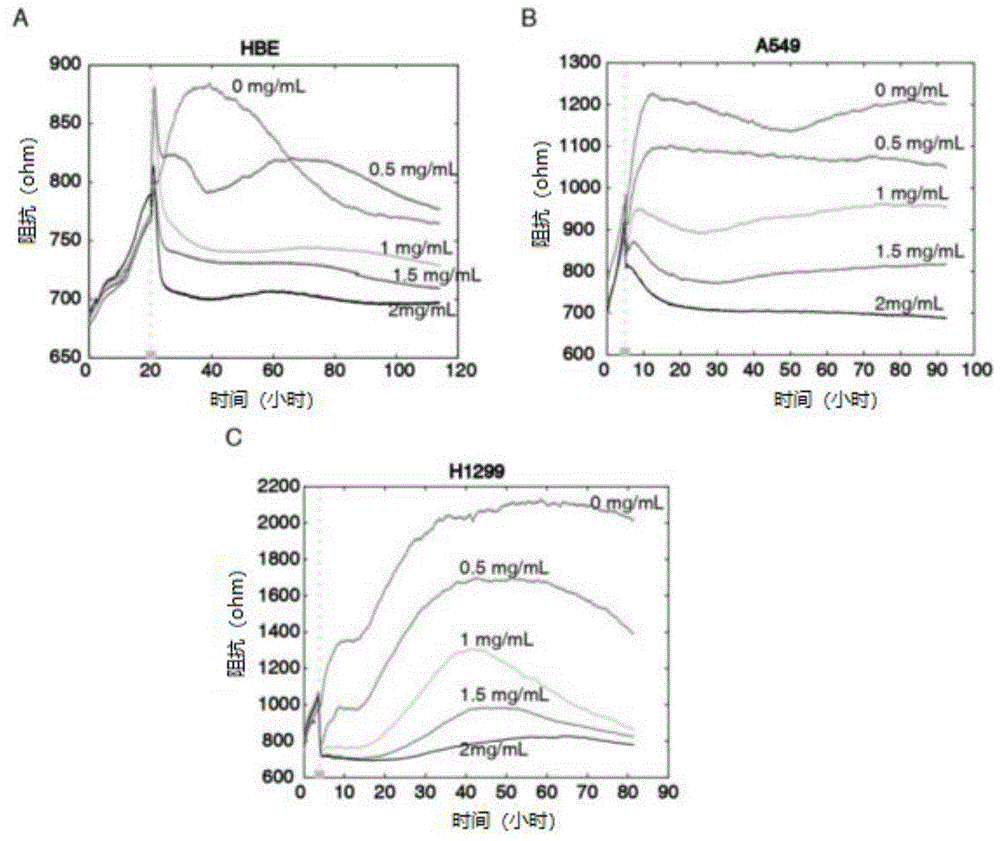
图1所示为实施例1中hbe、a549和h1299细胞用药前后细胞增殖检测结果。
图2所示为实施例1中hbe、a549和h1299细胞用药前后细胞迁移能力检测结果。
图3所示为实施例1中用药48、96小时后,对hbe、a549和h1299细胞毒性检测结果。
图4所示为实施例2中两组裸鼠的生存曲线和体重变化。
图5所示为实施例2中两组裸鼠的照片和移植瘤生长曲线。
图6所示为实施例2中小鼠移植瘤中凋亡标志物caspase3-clevage蛋白免疫组化检测结果。
图7所示为实施例3中人非小细胞肺腺癌细胞系a549及h1299和人肺正常上皮细胞hbe的细胞凋亡检测结果。
图8所示为实施例3中人卵巢透明细胞癌细胞系es-2的流式细胞检测结果。
图9所示为实施例3中人肝癌细胞系hcclm3、hcclm6和mhcc97h的细胞增殖检测结果。
具体实施方式
除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义。
本发明中,术语“肿瘤(tumor)”是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物(neogrowth),其分为良性肿瘤和恶性肿瘤两大类,其中,恶性肿瘤的实例包括,但不限于,恶性上皮肿瘤、肉瘤、骨髓瘤、白血病、淋巴瘤、黑色素瘤、头颈部肿瘤、脑部肿瘤、腹膜癌、混合型肿瘤等;恶性上皮肿瘤的实例包括,但不限于,肺癌、乳腺癌、肝癌、胰腺癌、结直肠癌、胃癌、胃食管腺癌、食管癌、小肠癌、贲门癌、子宫内膜癌、卵巢癌、输卵管癌、外阴癌、睾丸癌、前列腺癌、阴茎癌、肾癌、膀胱癌、肛门癌、胆囊癌、胆管癌、畸胎瘤、心脏肿瘤等;头颈部肿瘤的实例包括,但不限于,鼻咽癌、喉癌、甲状腺癌、舌癌、口腔癌等;肉瘤的实例包括,但不限于,askin瘤、软骨肉瘤、尤文氏肉瘤、恶性血管内皮瘤、恶性神经鞘瘤、骨肉瘤、软组织肉瘤等;骨髓瘤的实例包括,但不限于,孤立型骨髓瘤、多发型骨髓瘤、弥漫型骨髓瘤、白血病型骨髓瘤、髓外型骨髓瘤等;白血病的实例包括,但不限于,急性淋巴性白血病、慢性淋巴性白血病、急性骨髓性白血病、慢性骨髓性白血病、多毛细胞性白血病、t细胞淋巴细胞白血病、大颗粒淋巴细胞性白血病、成人t细胞白血病等;淋巴瘤的实例包括,但不限于,非霍奇金淋巴瘤、霍奇金淋巴瘤等;脑部肿瘤的实例包括,但不限于,神经上皮组织肿瘤、颅神经和脊髓神经肿瘤、脑膜组织肿瘤等。其中,肺癌包括,但不限于,非小细胞肺癌、小细胞肺癌。卵巢癌包括,但不限于,卵巢上皮癌、卵巢恶性生殖细胞肿瘤。肝癌包括,但不限于,原发性肝癌、继发性肝癌,所述原发性肝癌选自肝细胞癌、胆管细胞癌、混合性肝癌。
术语“有效量”是指可在受试者中实现治疗、预防、减轻和/或缓解本发明所述疾病或病症的剂量。
术语“受试者”可以指患者或者其它接受本发明组合物以治疗、预防、减轻和/或缓解本发明所述疾病或病症的动物,特别是哺乳动物,例如人、狗、猴、牛、马等。
术语“治疗”包括在疾病和/或病症发作之后,根除、移除、逆转、缓解、改变或控制该疾病和/或病症。
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
为检验本发明方法对癌细胞的恶性表型是否有抑制作用、对正常细胞是否有杀伤,进行细胞增殖、细胞迁移、细胞毒性的实验。实验步骤如下:
(1)用细胞培养液于37℃、0.5%co2环境中培养人肺癌细胞系a549、h1299和肺正常上皮细胞hbe;
(2)加入atca溶液,使终浓度分别达到0.5mg/ml、1.0mg/ml、1.5mg/ml、2.0mg/ml,摇匀,继续在原环境中培养细胞。
检测步骤(1)和(2)细胞增殖、细胞迁移、细胞毒性情况。
hbe、a549和h1299细胞用药前后细胞增殖结果如图1所示。由图1可知,随着药物浓度的增加,癌细胞增殖速率明显降低,说明步骤(2)方法对癌细胞的高速增殖表型有明显抑制。
通过transwell实验,hbe、a549和h1299细胞用药前后穿过小孔的迁移能力检测结果如图2所示。由图2可知,用药后,癌细胞的迁移能力被完全抑制(p<0.05,n=3),与正常细胞基本等同,说明步骤(2)方法对癌细胞的迁移表型有明显抑制。
通过ldh法,用药48、96小时后,对hbe、a549和h1299细胞毒性检测结果如图3所示。由图3可知,在该浓度下,药物并未导致癌细胞和正常细胞明显的细胞毒性,正常细胞hbe的各种生理活动正常,说明步骤(2)方法对正常细胞无明显杀伤。
实施例2
为检验本发明方法对癌细胞是否有抑制作用、对正常细胞是否有杀伤,进行以下实验,在裸鼠移植瘤模型上抑制癌细胞的恶性表型:
(1)取裸鼠,皮下注射肺癌细胞a549;
(2)等待裸鼠成瘤,弃去未成瘤裸鼠;
(3)治疗组小鼠使用0.2ml的atca溶液(浓度25mg/ml)灌胃,使每只小鼠atca的药物剂量达到5mg,每天灌胃一次;对照组小鼠使用等体积的生理盐水(nacl)灌胃;
(4)同时取未注射癌细胞的裸鼠为健康组,灌胃与实验组相同量的atca和nacl溶液。
记录各组裸鼠的生存曲线、肿瘤生长曲线及凋亡标志物免疫组化检测。
两组裸鼠的生存曲线和体重变化如图4所示。图4a为对8只灌胃5mgatca和8只灌胃nacl的小鼠的生存曲线,可明显看到,未注射癌细胞的健康组裸鼠在实验期间内未死亡,图4b为给药期间小鼠的体重变化,其显示小鼠体重未在给药期间出现明显差异(p=0.083;nc:n=7;atca-5mg:n=8),说明本发明方法对正常生理过程无影响。
两组裸鼠的照片和移植瘤生长曲线如图5所示。图5a为将非小细胞肺癌a549细胞株经皮下注射入小鼠体内,每日灌胃5mgatca及等体积nacl,待肿瘤生长一定体积后处死拍照;图b为给药周期内小鼠肿瘤体积的测量结果,结果显示atca可明显抑制肿瘤生长(p=0.0289;nc:n=7;atca-5mg:n=8)。
对小鼠移植瘤中凋亡标志物caspase3-clevage蛋白进行免疫组化检测(ihc),结果如图6所示。图6a显示给药组小鼠的移植瘤中caspase3-clevage蛋白含量明显高于对照组,图6b为两组小鼠中caspase3-clevage阳性细胞占比的统计图,结果与图6a一致(p=0.0207;nc:n=7;atca-5mg:n=8)。本结果表明atca可通过引发肿瘤凋亡抑制肿瘤生长。
实施例3
为检验本发明方法对肺癌及其他种类癌细胞的恶性表型是否有抑制作用、对正常细胞是否有杀伤,进行细胞凋亡、细胞增殖检测实验。实验步骤如下:
(1)用细胞培养液于37℃、0.5%co2环境中培养人肺癌细胞系a549、h1299和肺正常上皮细胞hbe,卵巢癌细胞系es-2,肝癌细胞系hcclm3、hcclm6和mhcc97h;
(2)加入atca溶液,设置加药浓度梯度,使终浓度分别达到0.125mg/ml、0.25mg/ml、0.5mg/ml、0.75mg/ml、1.0mg/ml,摇匀,继续在原环境中培养细胞。
使用annexinv、碘化丙啶对人肺癌细胞a549、h1299和正常肺上皮细胞hbe染色,进而用流式细胞仪检测,结果如图7所示。由图7可知,在0.5mg/mlatca作用下肺腺癌细胞a549及h1299出现明显凋亡(p<0.05,n=4),而正常肺细胞hbe未出现凋亡,说明atca可在不杀伤正常细胞下引发癌细胞凋亡。
使用annexinv、碘化丙啶对人卵巢癌细胞系es-2染色,进而用流式细胞仪检测,结果如图8所示。由图8可知,在0.25mg/ml、0.5mg/ml、0.75mg/ml、1.0mg/mlatca作用下卵巢癌细胞es-2发生凋亡,说明atca可引发卵巢癌细胞凋亡。
使用wst-1试剂检测人肝癌细胞系hcclm3、hcclm6和mhcc97h在不同浓度atca作用下细胞增殖情况,结果如图9所示。由图9可知,药物浓度达到0.5mg/ml时半数肝癌细胞生长均被抑制,说明atca可抑制肝癌细胞增殖。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!