HIF2α激动剂、ACER2激动剂用于制备治疗动脉粥样硬化的药物的用途的制作方法
本发明属于药物领域,具体涉及hif2α激动剂、acer2激动剂用于制备治疗动脉粥样硬化的药物的用途。
背景技术:
动脉粥样硬化疾病(as)是一种慢性的代谢性心血管疾病,是全球人口死亡的重要原因。慢性炎症和血脂代谢紊乱是as发生、发展的主要病理特点。as病变从内皮细胞激活开始,脂质进行性的沉积于血管壁内,诱导单核细胞发生黏附和浸润,在细胞因子的作用下增殖并分化为巨噬细胞。泡沫细胞的形成和平滑肌细胞的增殖是as的主要特点。巨噬细胞表达大量清道夫受体,经清道夫受体摄取修饰的低密度脂蛋白(lowdensitylipoprotein,ldl),形成泡沫细胞,参与构成脂质核心。斑块内的炎性微环境诱导平滑肌细胞增殖并分泌胶原,将脂质核心包裹,形成纤维粥样斑块。而随着斑块进展到后期,斑块内凋亡和坏死细胞增加,局部的炎症反应激活,从而释放大量的基质金属蛋白酶,降解纤维组织而使纤维帽变薄。当血流切应力发生急性改变,斑块纤维帽破裂,易诱发血栓形成而使血管管腔堵塞,最终造成急性心肌梗死。
在药物干预方面,降脂药-他汀类药物目前应用最为广泛。除此之外,还可采用依折麦布、pcsk9抑制剂、pcsk9抗体疫苗或者几者之间的联用。
但高强度他汀类药物在获益递增的同时其潜在危害性也会随之增加,严重情况下甚至可能导致癌症、肝酶升高、肌炎和肌病、糖尿病和认知功能障碍(如阿尔茨海默病和痴呆),并且患者对于药物的依赖性较高,一旦停药,部分症状仍将持续。pcsk9抑制剂、pcsk9抗体疫苗不仅成本极高,其临床安全性以及有无其他副作用仍需要进一步验证。
因此,寻找一个更为有效的药物靶点以及针对该靶点的药物治疗as成为本领域亟需解决的技术难题。
技术实现要素:
发明人构建了脂肪细胞hif2α(缺氧诱导因子2α)特异性敲除的小鼠,并构建了高脂模型,发现脂肪细胞hif2α的敲除会加重西式饮食诱导的动脉粥样硬化。进一步研究发现,脂肪细胞hif2α促进脂肪组织产热,增加肝脏胆固醇的外排,抑制血浆胆固醇增加,抑制或减轻动脉粥样硬化的发生和发展。还发现了脂肪细胞hif2α上调神经酰胺酶2(acer2)的表达,acer2促进致动脉粥样硬化的脂质介质神经酰胺的分解,减少神经酰胺释放入血,从而抑制动脉粥样硬化的风险因素,抑制或减轻动脉粥样硬化的发生和发展。此外,还研究发现,acer2的过表达病毒可反转脂肪细胞hif2α敲除引起的动脉粥样硬化的加重。发明人基于大量的实验研究完成了本发明。
在一个方面,本发明提供hif2α激动剂用于制备治疗和/或预防动脉粥样硬化的药物的用途。
在一个实施方案中,所述hif2α激动剂是脂肪细胞hif2α激动剂。
在本发明中,所述hif2α激动剂可以是稳定hif2α或者增强hif2α的表达的物质,例如可以是hif2α稳定剂、hif脯氨酸羟化酶(hif-pdh)抑制剂,如phd1抑制剂、phd2抑制剂和phd3抑制剂等。
在一个实施方案中,所述hif2α激动剂包括但不限于以下化合物:
二甲基草酰甘氨酸(dmog(dimethyloxallylglycine),参见baadere.etal.,biochemj.,300(pt2):525-30,jun1,1994;mikiewiczm.etal.,jphysiol.560(pt1):21-6,oct1,2004);
在另一个方面,本发明提供acer2激动剂用于制备治疗和/或预防动脉粥样硬化的药物的用途。
在一个实施方案中,所述acer2激动剂是内脏脂肪acer2酶激活剂。
在本发明中,所述acer2激动剂可以是稳定acer2或者增强acer2的表达的物质。
在又一个方面,本发明提供罗沙司他用于制备治疗和/或预防动脉粥样硬化的药物的用途。
在再一个方面,本发明提供一种治疗和/或预防动脉粥样硬化的方法,包括给予有需要的受试者治疗有效量的hif2α激动剂、acer2激动剂或罗沙司他。其中所述hif2α激动剂和acer2激动剂如上面所定义的。
附图说明
图1示出了脂肪细胞hif2α特异性敲除小鼠的构建流程和对小鼠相关指标的检测结果。
图2示出了脂肪细胞hif2α的敲除加重西式饮食诱导的动脉粥样硬化。
图3示出了脂肪细胞hif2α的敲除加重斑块局部的炎症浸润。
图4示出了脂肪细胞hif2α的敲除加重西式高脂饮食诱导的血脂紊乱。
图5示出了脂肪细胞hif2α的敲除后抑制肝脏胆固醇外排。
图6示出了脂肪细胞hif2α特异性过表达的效率。
图7示出了脂肪细胞hif2α的过表达富集鞘磷脂类代谢通路而不影响多种脂肪因子的表达。
图8示出了脂肪细胞hif2α的敲除影响apoe敲除小鼠内脏脂肪神经酰胺代谢。
图9示出了脂肪细胞hif2α的敲除上调apoe敲除小鼠内脏脂肪神经酰胺和二氢神经酰胺的含量上调。
图10示出了脂肪细胞hif2α的敲除上调apoe敲除小鼠皮下脂肪神经酰胺和二氢神经酰胺的含量。
图11示出了脂肪细胞hif2α的敲除上调apoe敲除鼠棕色脂肪神经酰胺和二氢神经酰胺的含量。
图12示出了脂肪细胞hif2α的敲除增加apoe敲除鼠血中二氢神经酰胺和神经酰胺的含量。
图13示出了在体给予神经酰胺引起小鼠血浆脂蛋白紊乱。
图14示出了在体给予神经酰胺调控肝脏胆固醇代谢。
图15示出了在体给予神经酰胺激活血管组织炎症反应。
图16示出了脂肪细胞hif2α的过表达上调神经酰胺酶acer2的表达。
图17示出了脂肪细胞hif2α基因的过表达上调内脏脂肪acer2酶的表达。
图18示出了脂肪细胞hif2α的敲除下调内脏脂肪acer2的表达。
图19示出了acer2是hif2α的靶基因。
图20示出了脂肪细胞hif1α的特异性过表达不影响acer2的表达。
图21示出了acer2过表达病毒的在体感染效率。
图22示出了acer2过表达病毒反转脂肪细胞hif2α敲除引起的内脏和血浆神经酰胺的升高。
图23示出了acer2过表达病毒反转脂肪细胞hif2α敲除引起的动脉粥样硬化的加重。
图24示出了acer2过表达病毒反转脂肪细胞hif2α敲除引起的血脂紊乱和血浆脂蛋白紊乱。
图25示出了acer2过表达病毒反转脂肪细胞hif2α敲除引起的肝脏胆固醇清除基因的激活和肝脏胆固醇水平的升高。
图26示出了fg4592(罗沙司他,roxadustat)激活脂肪细胞hif2。
图27示出了fg4592改善脂肪细胞hif2α敲除引起的动脉粥样硬化的加剧。
图28示出了fg4592改善脂肪细胞hif2α敲除引起的血脂紊乱和血浆脂蛋白紊乱。
图29示出了fg4592改善脂肪细胞hif2α敲除引起的内脏和血浆神经酰胺的升高。
图30示出了fg4592改善脂肪细胞hif2α敲除引起的肝脏胆固醇清除基因的激活以及粪便中的胆固醇和胆汁酸水平。
具体实施方式
下文将结合具体实验对本发明的用途做更详细的说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
除非另有说明,以下实施例中所使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
实施例
(一)实验方法
1.动物实验
1.1实验动物与疾病模型建立
(1)实验动物:hif2afl/fl,hif2alsl来源于美国nihgonzalezfj实验室。为了构建脂肪细胞hif2α特异性敲除或过表达小鼠,我们将hif2afl/fl,hif2alsl与adiponectin启动子控制的cre重组酶(adipoq-cre)转基因小鼠杂交来获得脂肪细胞hif2α特异性敲除小鼠(hif2aδadipo)和过表达小鼠(hif2alsl)。为了研究脂肪细胞hif2α对动脉粥样硬化的影响,我们将hif2aδadipo小鼠与apoe-/-小鼠杂交得到hif2aδadipoapoe-/-小鼠。所有小鼠均在无特定病原体(spf)环境下饲养。
(2)西式饮食模型:为了诱导动脉粥样硬化的发生,我们给予6周龄hif2afl/flapoe-/-和hif2aδadipoapoe-/-雄性小鼠高脂高胆固醇饲料(简称西式饮食)(42%高脂,0.2%总胆固醇,td.88137)饲喂8周。
(3)所有动物实验均遵守北京大学医学部生物医学伦理委员会实验动物伦理分会指南进行。
1.2神经酰胺的腹腔注射
6周龄的雄性c57bl/6j小鼠连续7天腹腔注射神经酰胺(c16∶0,10mg/kg),最后一次给药12h后麻醉处死取血、腹股沟脂肪、附睾脂肪、棕色脂肪和肝脏于-80℃冻存备用。
1.3小鼠取材
小鼠取材前禁食4h,麻醉后内眦取血,edta抗凝,4℃下3000rpm离心10min,取上层血浆-80℃冻存备用。脱颈处死后取腹股沟脂肪、附睾脂肪、棕色脂肪和肝脏组织-80℃冻存备用。
2.组织染色实验
2.1小鼠心脏流出道切片油红o染色
(1)1×组化pbs水化3min×3次;
(2)60%异丙醇5min分化;
(3)油红o工作液染色30min;
(4)60%异丙醇脱色;
(5)1×组化pbs洗3min×3次;
(6)苏木素染色液复染30s;
(7)1×组化pbs洗3min×3次;
(8)封片:90%甘油+10%水;
(9)阴暗处干燥2h;
(10)在显微镜下观察斑块染色并拍摄照片,使用imagej软件进行斑块面积统计。
2.2小鼠心脏流出道切片免疫荧光染色
(1)1×组化pbs水化3min×3次;
(2)10%bsa(1×组化pbs配)37℃封闭1h(在湿盒中进行,避免干片);
(3)吸掉封闭液,滴加一抗(5%bsa稀释,moma2抗体1∶100,α-sma抗体1∶200)4℃孵育过夜;
(4)1×组化pbs洗3次,每次10min;
(5)吸掉残液,滴加相应免疫荧光二抗(5%bsa稀释,1∶400),37℃孵育1h;
(6)1×组化pbs洗3次,每次10min;
(7))hoechest33258(1×组化pbs稀释,1∶1000)染核,室温10min;
(8)1×组化pbs洗3次,每次5min;
(9)防淬灭封片剂封片,激光共聚焦显微镜检测。
3.细胞实验
3.1luciferase实验
(1)构建荧光素酶报告质粒:合成小鼠acer2启动子序列并将其扩增克隆到pgl3-basic载体质粒kpni和xhoi位点之间;
(2)用转染试剂lipofectamine2000将构建的acer2荧光素酶质粒与内参质粒phrl-tkrenillaluciferase转入hek293t细胞中,然后分别转染hif2α过表达质粒(hif2α-tm)和空载质粒(pcdna3.1),24h后收样;
(3)利用双荧光素酶试剂盒分别检测荧光素强度,计算荧光素酶相对活性(萤火虫/海参荧光素酶比),统计两组差异。
3.2chromatinimmunoprecipitation实验
(1)200μm终浓度的cocl2刺激3t3-l1脂肪细胞;
(2)12h后,1%甲醛固定10min,随后室温甘氨酸终止5min;
(3)裂解缓冲液收集每样大约2×107个细胞;
(4)使用m220(covaris)仪器将核质交联复合物碎裂10min至片段大约500bp;离心收集染色体片段;
(5)染色体孵育:bsa(1μg/μl),hif2α抗体(2μg)以及裂解缓冲液400μl于4℃孵育3h;
(6)准备proteinaagarose,用pbs洗两遍珠子,然后用pbs配制成50%浓度;
(7)加入40μlproteina琼脂糖珠来捕捉抗原抗体复合物,4℃缓慢转动抗原抗体混合物过夜;
(8)1ml洗涤缓冲液洗涤,3-4次×5min转动,染色质随同洗脱液洗脱;
(9)通过trizol和氯仿提取dna,20μg糖原,40μl3mnaac(ph=4.5)沉淀dna,1ml冰无水乙醇过夜;
(10)离心,4℃下13000rpm,25min;
(11)70%无水乙醇洗涤沉淀,离心,4℃下10000g,5min;
(12)弃上清,约40μl超纯水重悬dna。
通过qpcr和pcr产物进行凝胶电泳以确定chip结果,引物序列见下面的表1。
3.3流式细胞术
cba试剂盒检测小鼠血浆炎症因子:将六种炎症因子捕获珠子等比例混合,每管血浆样品(10μl)加入10μl混合珠子,再加入10μl的pe检测试剂,室温避光放置2小时。洗液清洗后离心,加入100μl洗液重悬后即可上机。
4.分子生物学实验
4.1血浆/肝脏生化指标的测定
4.1.1血浆总胆固醇和总甘油三酯的测定
(1)标准品配置:取甘油三酯(192mg/dl)或胆固醇校准品(200mg/dl),用生理盐水2倍比稀释,共设置8个浓度;
(2)工作液的配置:取10ml溶液溶解试剂盒干粉;
(3)加样:5μl样品或标准品加入200μl工作液,37℃孵育(甘油三酯10min,胆固醇6min);
测定od值:读取波长为490nm时的od值。
计算样品总胆固醇和总甘油三酯浓度:以od值为纵坐标,以对应标准品浓度为横坐标,绘制标准曲线,得到浓度公式。所得样品od值代入该公式求得相应样品的总胆固醇和总甘油三酯浓度。
4.1.2肝脏胆固醇和甘油三酯的测定
(1)精确称取肝脏约20mg,加入20倍体积甘油三酯裂解液(普利莱e1003);
(2)bulletblender组织破碎仪匀浆3min;
(3)室温静置10min;
(4)70℃震荡混匀10min;
(5)离心,2000rpm,室温,10min;
(6)取上层水相测定胆固醇和甘油三酯浓度,方法同上。
4.1.3血浆脂蛋白各组分含量的测定
(1)配液准备:缓冲液、三蒸水和20%乙醇
(2)平衡柱子
三蒸水,室温,清洗2个柱体积,流速0.5ml/min;
缓冲液平衡柱子,2个柱体积,流速0.5ml/min;
(3)进样品:100μl血浆,流速0.5ml/min;洗脱体积1个柱体积;收集体积500μl。每个样品准备50个ep管,每管可收集500μl,前五个可不收集。收集各管液体测定甘油三酯和胆固醇。
4.2总蛋白的提取及定量
(1)组织总蛋白提取:收集脂肪组织至1.5mlep管中,加入ripa组织裂解液(每40mg组织对应加入200μl),加入氧化锆珠子震荡破碎,冰上放置30min待组织细胞充分裂解。4℃下离心,10000rpm,10min,转移上清至新的1.5mlep管,即得到组织总蛋白裂解液;
(2)蛋白定量:利用pierce公司的bca蛋白定量试剂盒,配置白蛋白标准溶液(0、50、100、200、300、400、500、1000mg/ml),分别加入96孔酶标板中(每孔25μl),待测蛋白样品用水稀释至25μl(2.5μl样品+22.5μl水)后加入酶标板,最后每孔加入200μl的bca工作液(试剂a和试剂b以50∶1的浓度混合),37℃孵育30min,以570nm为测定波长,630nm为校准波长,利用酶标仪测定并记录od值。利用prism7软件根据标准蛋白的od值作出标准曲线,再根据样品的od值计算出样品的蛋白浓度。
4.3蛋白印迹实验(westernblotting)
(1)蛋白电泳:配置不连续sds聚丙烯酰胺凝胶(上层为5%浓缩胶,下层为10%分离胶),利用bio-radmini-proteantetracell系统加入蛋白样品(蛋白与5×上样缓冲液以4:1比例混合)以及蛋白分子量标志物后进行电泳,55v恒压电泳至溴酚兰到达分离胶界面,蛋白标志物初步分离后,改变电压至110v,恒压电泳至溴酚兰到达分离胶下边界后停止电泳;
(2)蛋白转膜:切割去掉上层浓缩胶,利用bio-radminitrans-blotelectrophoretictransfercell系统将下层7×5cm大小的分离凝胶恒流(250ma)电转2小时,转移到硝酸纤维膜上;
(3)免疫杂交:转膜后,取出印迹膜在室温下用5%牛奶封闭1小时,随后加入相应一抗(1∶1000浓度稀释),4℃摇床孵育过夜。第二天取出印迹膜,用tbst洗膜(3次×10min),接着在印迹膜中加入irdye700或800连接的荧光二抗(1∶10000~20000稀释),室温避光孵育1小时,用tbst洗膜(3次×10min);
(4)蛋白显影:利用odyssey红外成像系统,选取相应的荧光通道检测印迹膜的荧光条带;
(5)图像分析:利用odyssey软件,去除背景后,根据条带的灰度值进行蛋白表达的定量,并导出相应图像。
4.4总rna的提取和定量
(1)总rna液相分离:收集脂肪组织至1.5mlep管中(约40mg),加入200μlrnatrizol,加入氧化锆珠子震荡破碎(3min×2次),再补充800μlrnatrizol,随后冰上放置10min待组织细胞充分裂解;向ep管内加入200μl三氯甲烷,用手剧烈混匀15s,冰上放置分层后,离心(4℃,13000rpm,15min);转移上层液相(约500μl)至新的1.5mlep管中;
(2)rna沉淀:加入等体积的异丙醇至上层液相中,颠倒混匀后冰上放置15min,离心(4℃,13000rpm,15min);
(3)rna洗涤:离心后弃去上清,加入1ml的75%乙醇(利用depc水稀释),颠倒混匀后离心(4℃,13000rpm,10min),弃去上清后室温静置干燥rna;
(4)rna溶解重悬:加入depc水溶解rna;
(5)rna定量:吸取depc水测定,作为空白对照,随后每个样品吸取1μl进行浓度测定,记录rna浓度与吸光度比值(od260nm/280nm)。
4.5rna-seq
取1.0μg内脏脂肪组织总rna,利用truseqrnasampleprepkitv2进行dna文库构建。使用nextseqsequencer测序仪对构建的文库进行单末端测序。
4.6实时定量pcr分析
(1)rna逆转录:(20μl体系)
5×all-in-onertmastermix4μl
2μg总rna
ddh2o补充至总体积20μl
逆转录程序:25℃10min,42℃5min,85℃10min,4℃结束,样品加100μlddh2o稀释后放入-40℃保存。
(2)pcr引物设计:pcr引物根据ncbi网站上primer设计,利用oligo软件进行引物筛选,最后利用ncbi网站上blast进行引物特异性对比分析,得到特异的引物。具体引物序列如下表所示:
表1pcr引物序列
4.7定量pcr及数据分析
逆转录得到cdna按照qpcr体系进行实验,体系如下
预变性94℃5min;(变性94℃30s,退火58℃30s,延伸72℃30s)×40个循环;延伸72℃5min。收集数据,利用stratagenemxpro软件进行统计分析。
4.8液相质谱分析
a.样品处理方法
(1)取20mg内脏脂肪组织置于200μldddh2o中匀浆,加入1200μl甲醇氯仿的提取液(甲醇/氯仿2∶1),并加入2.5μmlm6002作为内标。
(2)室温混匀20min,离心(13000rpm,4℃,20min)。
(3)将下层液相转移至新的eppendorf管中,将提取物冻干或在不加热的条件下进行真空离心浓缩挥发1~2小时,冻干后样品放至-80℃保存至到实验测定。
(4)样品测定前用200μl异丙醇和乙腈混合液(异丙醇/乙腈1∶1)复溶,离心(13000rpm,4℃,10min)除去杂质,取100μl上清上机检测。
b.lc-qexacfive的检测条件
利用lc-qexactive系统进行实验。
液相分离条件:色谱柱为watersacquityhsst3column(2.1×100mm);柱温设置为45℃。
流动相:水相(a)为含2mm甲酸铵和0.1%甲酸的三蒸水,有机相(b)为甲醇。实验采用梯度洗脱方式进行色谱分离,梯度程序设置为:0-6min75%b,6-20min100%b,20-22.5min75%b。
c.数据处理和分析
利用xcalibur2.2sp1.48软件进行峰提取和积分,最终得到每个色谱峰对应峰面积,每个色谱峰的面积都代表了该峰/化合物在此样品中相对含量。每个样品的峰面积均采用内标和组织重量进行权重。随后利用metaboanalyst软件对权重后的数据进行分析。导入数据后运用主成分分析(pca)进行数据降维,得出几个主成分来描述样本之间最大的差异,并排除差异较大的样本。利用该软件产生基于层次类聚的热图,展现不同样品之间代谢物的变化趋势。此外,利用代谢物富集分析以及通路富集分析能寻找出样品之间差异显著的代谢物以及代谢通路。
4.9统计学分析
4.9.1实验结果的表示
所有实验数据均利用graphpadprism7软件统计,并以平均值±标准误(mean±sem)表示,统计结果差异显著性以p值表示(*p<0.05,**p<0.01)。
4.9.2两组结果比较
实验前,首先确认样本处理是否服从正态分布,对两组数据进行比较时,采用学生t检验方法:非配对t检验用于斑块面积,肝脏和血浆胆固醇和甘油三酯含量,基因和蛋白相对含量,脂质组学各代谢物相对含量等;配对t检验用于对棕色脂肪线粒体呼吸代谢结果。
4.9.3多组结果比较
对多组结果进行比较时采用单因素方差分析,首先利用f-test检验方差齐性,并利用tukey法进行多重比较。
(二)实验结果
1.脂肪细胞hif2α特异性敲除小鼠的构建
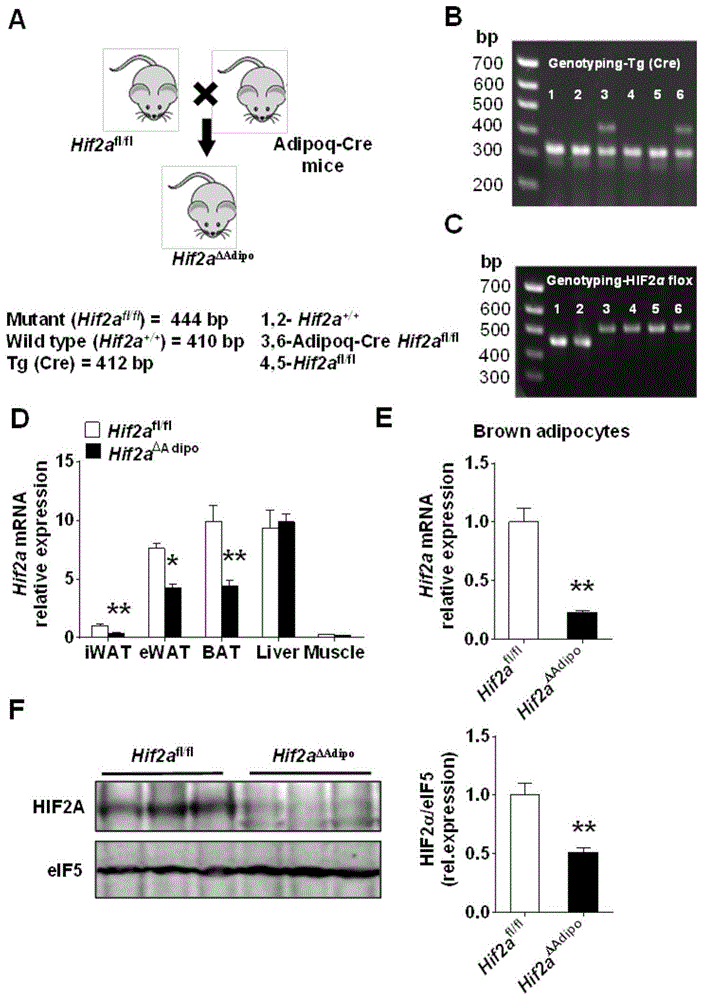
如图1所示,将hif2afl/fl小鼠和adipoqcre转基因小鼠杂交,则得到脂肪细胞hif2α特异性敲除小鼠(hif2aδadipo,图1a-c)。rt-pcr检测发现hif2aδadipo小鼠皮下、内脏和棕色脂肪组织中hif2α的表达明显降低,而肝和肌肉组织中hif2α的表达无明显差异(图1d)。同时,我们分离了小鼠原代棕色脂肪细胞,发现hif2aδadipo小鼠原代棕色脂肪细胞中hif2α的mrna水平明显降低(图1e)。westernblotting检测也证实hif2aδadipo小鼠棕色脂肪中hif2α的蛋白表达显著下调(图1f)。以上结果说明,脂肪细胞hif2α特异性敲除小鼠构建成功。
2.脂肪细胞hif2α的敲除加重西式饮食诱导的动脉粥样硬化
为了探究脂肪细胞hif2α对动脉粥样硬化的调节作用,我们利用hif2αδadipo与apoe-/-小鼠杂交构建了脂肪细胞hif2α和apoe双敲小鼠(hif2aδadipoapoe-/-)和apoe单敲小鼠(hif2afl/flapoe-/-)。给予高脂高胆固醇饮食(西式饮食)8周,分别检测两组小鼠主动脉根部和整个主动脉中动脉粥样硬化斑块的形成情况。油红o结果显示,hif2aδadipoapoe-/-较对照组小鼠主动脉根部斑块面积明显增加(图2a),并且其整个主动脉中的斑块面积也明显增加,以上结果显示脂肪细胞hif2α敲除加重西式饮食诱导的动脉粥样硬化。同时,我们利用免疫荧光实验检测斑块局部的炎症水平,发现hif2aδadipoapoe-/-小鼠斑块中巨噬细胞标志分子moma2的荧光面积明显增加,而平滑肌细胞的标志分子α-sma的荧光面积并没有明显变化(图3a),提示脂肪细胞hif2α敲除促进了斑块局部巨噬细胞的浸润,增加血管局部的炎症反应。进而,我们分离主动脉并对其炎症因子的mrna表达进行检测,发现hif2aδadipoapoe-/-小鼠主动脉tnfa的表达上调,但其他炎症因子的表达并无明显差异(图3b)。
低密度脂蛋白运载的胆固醇作为“坏胆固醇”,被公认为是动脉粥样硬化主要的致病因子。因此,我们检测了两组小鼠血浆中胆固醇和甘油三酯水平,发现hif2aδadipoapoe-/-小鼠血浆中总的胆固醇和甘油三酯水平明显增加(图4a,c)。接着,利用fplc分离了不同血浆脂蛋白组分后,发现hif2aδadipoapoe-/-小鼠胆固醇的增加主要由极低密度脂蛋白和低密度脂蛋白运载的胆固醇增加所致(图4b),但是两组不同血浆脂蛋白运载的甘油三酯水平并没有显著的差异(图4d)。
同时,我们进一步检测了肝脏胆固醇的代谢,发现hif2aδadipoapoe-/-小鼠肝中胆固醇和甘油三酯的水平明显增加(图5a,b),ldlr的mrna表达明显降低,胆固醇外排的基因如cyp7a1,cyp7b1,abcg5和abcg8的表达明显下调,而胆固醇合成相关的基因变化不明显(图5c-e),以上结果提示脂肪组织hif2α敲除抑制棕色脂肪产热,抑制肝脏胆固醇的外排,从而增加血浆胆固醇的水平,促进动脉粥样硬化发生。
3.脂肪细胞hif2α特异性过表达小鼠的构建
内脏脂肪分泌功能紊乱在动脉粥样硬化的发生和发展中发挥至关重要的作用。为了研究脂肪细胞hif2α是否参与调节脂肪因子的合成和分泌,我们构建了脂肪细胞hif2α特异性过表达小鼠(hif2alsl),检测发现其内脏脂肪hif2α特异的靶基因如epo、trf和dmt1均显著上调(图6a),而hif1α特异的靶基因如glut1和vegfa没有明显变化(图6b)。同时我们发现hif2alsl小鼠内脏脂肪hif2α的蛋白水平也明显上调(图6c)。以上结果证明脂肪细胞hif2α特异性过表达小鼠构建成功。
4.脂肪细胞hif2α的敲除上调内脏脂肪二氢神经酰胺和神经酰胺的含量
基于上述脂肪细胞hif2α特异性过表达的小鼠,我们利用rna-seq得到其内脏脂肪的基因表达谱数据,寻找可能受hif2α调节的脂肪因子。我们从中筛选了变化倍数大于2或小于0.5而调整的p值小于0.05的基因,共有375个,如图7a中右上方框以及左上方框中的点所示。可是,在这些基因中我们并未发现常见的脂肪因子基因,并且利用rt-pcr验证发现hif2alsl小鼠内脏脂肪中脂肪因子如resistin,lcn2,fabp4,pai1,visfatin,vaspin,apelin和cfd的表达没有明显变化(图7b)。进一步,我们利用david软件对其中上调的基因进行kegg通路富集,发现鞘磷脂类代谢通路被显著富集(图7c)。
基于鞘磷脂类代谢通路基因的显著富集,我们利用高效液相色谱-串联质谱法(hplc-ms/ms)对hif2afl/flapoe-/-和hif2αδadipoapoe-/-小鼠内脏脂肪的脂质组进行检测,随后使用metaboanalyst软件分析结果。偏最小二乘判别分析(pls-da)结果显示,两组内脏脂肪的脂质成分差异明显(图8a)。vipscore权重分析显示,二氢神经酰胺和神经酰胺是介导两组明显分群的主要脂质成分(图8b)。
神经酰胺作为鞘磷脂代谢的核心中间产物,在代谢性疾病和心血管疾病中发挥重要作用。神经酰胺主要由三条通路合成(图9a),一是神经酰胺的从头合成途径即由丝氨酸和棕榈酰辅酶a经多步关键反应生成二氢神经酰胺,最后由二氢神经酰胺脱氢酶氧化生成神经酰胺。二是神经鞘磷脂水解途径即由细胞膜上的神经鞘磷脂经鞘磷脂酶水解生成。神经酰胺也能由神经节苷脂经一系列复杂的分解代谢生成糖基化神经酰胺,最后由葡糖脑苷脂酶水解生成神经酰胺,称之为旁路途径。而生成的神经酰胺可分别由鞘磷脂合成酶、神经酰胺酶和葡萄糖神经酰胺合成酶重新转化为神经鞘磷脂、神经鞘氨醇和糖基化神经酰胺。我们进而定量检测了神经酰胺代谢通路上的多种代谢物,发现hif2aδadipoapoe-/-小鼠的内脏脂肪总的二氢神经酰胺和占最大比重的二氢神经酰胺c24:1显著增加(图9b),不同碳链的神经酰胺和神经酰胺总量均有明显增加(图9d),但是神经鞘磷脂的变化不明显(图9c)。此外,hif2aδadipoapoe-/-小鼠的内脏脂肪糖基化神经酰胺c16:0也明显增加,但是神经鞘氨醇变化不明显(图9e)。以上结果提示脂肪细胞hif2α敲除上调了内脏脂肪二氢神经酰胺和神经酰胺的含量。
接着,我们进一步定量检测了皮下脂肪和棕色脂肪神经酰胺及其相关代谢物的变化,发现hif2aδadipoapoe-/-小鼠皮下脂肪中神经酰胺c16:0,c18:0,c20:0,c22:0,c24:0和c24:1增加,神经酰胺总量也明显上调(图10a),不同碳链的二氢神经酰胺略有增加而鞘磷脂sm不变(图10b-c)。棕色脂肪组织神经酰胺c16:0,c22:0,c24:0和c24:1增加,神经酰胺总量明显上调(图11a),不同碳链的二氢神经酰胺和二氢神经酰胺总量均有增加(图11b)。与内脏脂肪变化类似,hif2aδadipoapoe-/-小鼠棕色脂肪糖基化神经酰胺c16:0的含量增加而神经鞘氨醇无明显变化(图11c,d)。
我们随后对血浆中神经酰胺及相关代谢物进行了定量检测,发现hif2aδadipoapoe-/-小鼠血中二氢神经酰胺变化不明显,仅有二氢神经酰胺c14:0和c16:0增加(图12a)。而hif2aδadipoapoe-/-小鼠血中神经酰胺c20:0,c22:0和c24:1明显增加,总的神经酰胺含量也明显上升(图12b)。然而血中神经鞘磷脂和糖基化神经酰胺变化却并不明显(图12c-d)。这些结果说明,hif2α缺失上调脂肪组织神经酰胺含量,进而增加血浆中神经酰胺的水平。
神经酰胺作为诱导肥胖和胰岛素抵抗的关键脂质分子,也被越来越多的研究证实是预测动脉粥样硬化疾病发生和发展的标志物。为进一步探究其在动脉粥样硬化中的作用,我们给予小鼠神经酰胺c16:0刺激1周,发现神经酰胺刺激增加了小鼠血中总的胆固醇水平,但对总甘油三酯水平没有明显影响(图13a,c)。分离不同血浆脂蛋白组分,发现神经酰胺上调低密度脂蛋白胆固醇水平而下调高密度脂蛋白胆固醇水平(图13b)。与胆固醇水平的变化相似,神经酰胺也能降低高密度脂蛋白甘油三酯水平而增加极低密度和低密度脂蛋白甘油三酯水平(图13d)。
进而我们检测了肝脏胆固醇代谢情况,发现两组肝中胆固醇和甘油三酯水平无明显变化(图14a-b)。但是神经酰胺刺激明显上调高密度脂蛋白摄取基因scarb1而抑制高密度脂蛋白排出基因abca1和abcg1的表达(图14d),这些结果与血中脂蛋白变化的结果相吻合。同时神经酰胺刺激明显上调srebplc的表达和胆固醇外排基因如cyp7b1,abcg5和abcg8的表达(图14c-e)。
神经酰胺能够促进炎症反应,诱导胰岛素抵抗的发生。因此,我们检测了主动脉组织炎症基因的表达,发现神经酰胺刺激上调血管中促炎性巨噬细胞m1标志分子如il6,tnfa和mcp1的表达,下调血管中抑炎性巨噬细胞m2标志分子如mrc1的表达(图15)。以上结果说明神经酰胺作为脂肪因子介导了脂肪细胞hif2α对动脉粥样硬化的保护作用。
5.脂肪细胞hif2α特异性上调acer2的表达
为了研究hif2α如何调节神经酰胺的生成,我们从内脏脂肪表达谱数据中寻找神经酰胺代谢通路中的关键酶(图16b),发现神经酰胺合成相关的代谢酶下调而分解相关的代谢酶上调,其中神经酰胺酶acer2上调最为明显,如图16a所示。接着我们进一步利用脂肪细胞hif2α特异性过表达的小鼠内脏脂肪进行验证,发现hif2alsl较野生型小鼠内脏脂肪acer2的mrna表达明显增加(图17a),但是acer1和acer3的表达水平无明显差异,提示脂肪细胞hif2α特异的上调acer2。westemblotting结果也证实脂肪细胞hif2α显著上调acer2的表达(图17b)。
我们进一步使用hif2aδadipoapoe-/-小鼠验证脂肪细胞hif2α敲除是否抑制acer2的表达,结果发现hif2aδadipoapoe-/-小鼠内脏脂肪acer2的mrna和蛋白表达均明显下调(图18a,b)。与此同时,我们还发现hif2aδadipoapoe-/-小鼠内脏脂肪神经酰胺合成相关的基因如sptlc2和degs2的mrna表达明显上调(图18a)。这些结果证实脂肪细胞hif2α参与调节神经酰胺酶acer2的表达进而促进神经酰胺的生成。
为进一步证实脂肪细胞hif2α是否直接调控acer2的表达,我们利用免疫共沉淀和双荧光素酶报告基因实验进行后续的探究。首先,我们从小鼠acer2的启动子区检索hif2α的经典结合位点(hre),发现两个可能的位点(图19a)。为此,我们针对这两个位点分别设计了相应的pcr引物,对分别用igg和hif2α免疫共沉淀富集的dna片段进行扩增,发现只有含hre1位点片段被hif2α明显富集,提示hif2α能直接与acer2的启动子区的hre1位点结合(图19b)。因此,我们设计了acer2启动子区的荧光素酶报告质粒,分别与hif2α和空载体质粒转染入293t细胞中,发现hif2α上调荧光素酶活性,突变hre2位点后荧光素酶活性没有明显降低,而当突变hre1或者双突变hre1和hre2后荧光素酶活性显著下调,提示hif2α通过与acer2启动子区的hre1位点结合,增强acer2的转录活性(图19c)。以上结果证实脂肪细胞hif2α通过对acer2的直接转录调节而促进神经酰胺的分解。
hif1α作为hifα亚基的另一亚型,在脂肪组织功能调节中也发挥着关键作用,并且对一些基因的转录调节作用与hif2α相似。所以,为确认脂肪细胞hif1α是否调节acer2的表达,我们构建了脂肪细胞hif1α特异性过表达小鼠。如图20a和b所示,hif1alsl小鼠内脏脂肪hif1α的靶基因pgk1和glut1明显上调,hif1α的蛋白水平也明显增加,提示脂肪细胞hif1α特异性过表达小鼠构建成功。但是hiflalsl小鼠内脏脂肪acer2的mrna表达变化不明显(图20c),而hif1α轻微上调acer2启动子区的荧光素酶活性(图20d)。以上结果证实脂肪细胞hif2α而非hif1α特异性调节acer2的表达。
6.脂肪acer2的过表达反转脂肪细胞hif-2α敲除后肝胆固醇水平的升高和肝脏胆固醇清除基因水平的下调
为了确定脂肪细胞hif-2α介导的动脉粥样硬化的改善是否依赖于acer2的增加,我们将携带小鼠acer2cdna序列的慢病毒原位注射到hif2aδadipoapoe-/-小鼠的ewat中进行了反转实验。我们向hif2afl/flapoe-/-和hif2aδadipoapoe-/-小鼠分别注射了带有绿色荧光蛋白(gfp)的慢病毒作为对照。我们同时验证了病毒的感染效率,发现脂肪细胞而非血管基质成分svf的gfp表达相较于空白对照组有明显的上调(图21a),并且相较于肝脏和小肠组织中,只在脂肪细胞中有明显的升高(图21b)。并且与hif2afl/flapoe-/-+gfp小鼠相比,hif2aδadipoapoe-/-+acer2小鼠逆转了hif2aδadipoapoe-/-gfp小鼠的ewat中较低的acer2水平(图21c)。与此同时,在hif2aδadipoapoe-/-+acer2小鼠中逆转了由脂肪hif-2α敲除介导的ewat和血浆中神经酰胺水平的上调(图22a-b)。与hif2afl/flapoe-/-+gfp小鼠相比,ewat中acer2的过表达逆转了wd喂养的hif2aδadipoapoe-/-+gfp小鼠的动脉粥样硬化加重(图23a)。与hif2afl/flapoe-/-+gfp小鼠相比,hif2aδadipoapoe-/-+gfp小鼠血浆中较高的胆固醇水平也被hif2aδadipoapoe-/-+acer2小鼠废除(图24a-b)。此外,脂肪acer2的过表达反转了脂肪细胞hif-2α敲除后肝胆固醇水平的升高和肝脏胆固醇清除基因cyp7a1,abcg5和abcg8mrna水平的下调(图25a-b)。
为了进一步验证hif-2α的选择性激活是否可能是wd诱发的动脉粥样硬化的治疗靶标,我们用fg-4592(罗沙司他,一种选择性稳定hif-2α的hif脯氨酰羟化酶抑制剂)分别治疗了wd喂养的hif2afl/flapoe-/-和hif2aδadipoapoe-/-小鼠。腹腔注射fg-4592(20mg/kg,隔日注射)后,hif2afl/flapoe-/-小鼠的内脏脂肪,皮下脂肪和棕色脂肪组织中的hif-2α蛋白水平都显著高于对照组,而在hif2aδadipoapoe-/-+fg-4592小鼠中则相反(图26a)。使用fg-4592导致hif2afl/flapoe-/-小鼠的动脉粥样硬化程度降低,而在脂肪细胞特异性hif-2α缺失小鼠中则消除了fg-4592介导的动脉粥样硬化抑制作用(图27a)。我们进一步发现,与对照组相比,hif2afl/flapoe-/-小鼠在fg-4592治疗后血浆胆固醇和脂蛋白水平显著降低,然而,在脂肪细胞hif-2α特异性缺失小鼠中,由fg-4592介导的血浆胆固醇水平的抑制作用消失(图28a-b)。此外,fg-4592处理降低了hif2afl/flapoe-/-小鼠的内脏脂肪和血浆中的神经酰胺水平,但在hif2aδadipoapoe-/-+fg-4592小鼠中却失去了这种抑制作用(图29a-b)。与此相一致的是,fg-4592处理后,脂肪细胞特异性hif-2α敲除消除了肝脏胆固醇清除基因cyp7a1,abcg5和abcg8的降低作用,肝脏胆固醇水平的下调,粪便游离胆固醇和胆汁酸水平的升高(图30a-d)。
综上,本发明的上述实验表明,脂肪细胞hif2α的激活通过促进肝脏胆固醇外排而降低血浆胆固醇水平,同时上调脂肪组织acer2的表达,抑制致动脉粥样硬化的脂质介质神经酰胺的生成和分泌,最终抑制或减轻动脉粥样硬化的发生和发展。因此,采用hif2α激动剂如脂肪细胞hif2α激动剂来激活脂肪细胞hif2α,或者采用acer2激动剂来激活acer2可抑制或减轻动脉粥样硬化的发生和发展。还表明,fg-4592(罗沙司他)能够通过激活脂肪细胞hif2α而抑制或减轻动脉粥样硬化的发生和发展。
以上对本发明的实施方式进行了说明,但是本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!