一种临床研究时间日程生成方法、设备及系统与流程
:
1.本发明涉及药物临床研究实施领域,具体的,涉及一种临床研究时间日程生成方法、设备及系统。
背景技术:
:
2.随着近年来新药研发行业的快速发展,我国药企对药物的临床研究需求量大幅增加。而临床研究具有研究周期长、招募受试者成本高等特点,需要参与临床研究的工作人员具有很强的专业性及责任感,以保证临床研究的顺利进行。
3.在临床研究中,基础工作主要由临床协调员(crc)完成。因此,crc需要完成繁多的临床任务,并且需要在整个临床研究周期中对受试者进行跟踪或访视,因此各个任务的时间表或排期是保证临床研究顺利完成的必要条件,同时也消耗了crc的大量工作精力,这一问题在组内有大量受试者时更为突出。此外,由于药物临床研究的特点,在临床项目开始时,无法确定准确的临床任务及排期,如不同受试者的治疗周期数目可能不同,临床研究中可能出现的退组情况,以及治疗周期结束后的长期随访,这些临床事件均无法在制订计划时准确确定起止时间,从而对临床研究时间表的制订带来了进一步挑战。
技术实现要素:
:
4.为解决背景技术中的至少一个技术问题,提出本发明。
5.具体地,本发明的第一方面,提供了一种临床研究日程生成方法,包括如下步骤:
6.接收临床研究的临床阶段信息;
7.接收各临床阶段的信息采集时间式;
8.根据各临床阶段的信息采集时间式,生成临床研究日程。
9.优选地,所述信息采集时间式包括所述临床阶段的起算点时间标记、时间宽度标记。
10.优选地,所述信息采集时间式还包括采集点间隔标记,用于标记多个采集点的时间间隔。
11.优选地,所述信息采集时间式还包括采集点窗口时间标记,用于标记某一采集点的时间窗口。
12.优选地,所述起算点时间标记可以由临床阶段编号、计算方式、距离时间表示。
13.优选地,所述时间宽度标记为临床阶段的持续时间。
14.优选地,所述时间宽度标记包括采集点间隔标记,及采集点间隔实现次数。
15.优选地,所述起算点时间标记可以为某一临床阶段的结束时间,所述结束时间为由起算点时间起算的时间宽度终点。
16.优选地,所述起算点时间标记包括第一事件起算点时间标记,或第二事件起算点时间标记。其中,第一事件为临床研究日程生成时可确定的临床阶段,第二事件为临床研究日程生成时不可确定的临床阶段。
17.优选地,所述临床阶段包括至少一个治疗期。
18.优选地,所述临床阶段包括筛选期。
19.优选地,所述临床阶段包括治疗后随访。
20.优选地,所述起算点时间标记可以包括临床任务起算点时间标记。所述临床任务为临床研究日程中需要完成的临床任务。
21.更优选地,所述临床任务起算点时间标记包括临床任务第一次完成的时间标记、或临床任务最后一次完成的时间标记、或临床任务每次完成的时间标记。
22.本发明的另一方面,提供了一种临床研究时间计划生成方法,包括如下步骤:
23.接收待完成的临床任务信息;
24.根据如上所述的方法生成临床研究日程;
25.接收临床任务与临床阶段的匹配指令。
26.优选地,所述临床研究时间计划生成方法,还包括步骤:
27.接收临床任务的操作频次信息。
28.优选地,所述操作频次信息可以为在单位时间内完成一次、或在单位时间内完成不限次。本方案中,单位时间内完成不限次为在单位时间内的完成次数大于一次,且无上限。
29.优选地,所述起算点时间标记包括临床任务起算点时间标记。更优选地,所述临床任务起算点时间标记包括临床任务第一次完成的时间标记、或临床任务最后一次完成的时间标记、或临床任务每次完成的时间标记。
30.优选地,所述临床研究时间计划生成方法,还包括步骤:
31.接收临床任务的备注信息。
32.优选地,所述临床研究时间计划生成方法,还包括步骤:
33.接收临床任务的原始名称;
34.根据临床任务原始名称生成临床任务标准名称。
35.本发明的另一方面,提供了一种临床研究项目的进度记录方法,包括如下步骤:
36.按照如上所述的方法生成临床研究时间计划;
37.将临床研究时间计划与工作人员进行匹配;
38.接收患者录入指令;
39.接收患者选择指令;
40.接收治疗期开始时间数据;
41.接收临床任务的完成指令;
42.接收治疗期结束时间数据。
43.优选地,所述临床研究项目的进度记录方法还包括步骤:接收筛选期开始时间数据。
44.优选地,所述临床研究项目的进度记录方法还包括步骤:接收第二事件的发生时间。
45.优选地,所述接收临床任务的完成指令次数与操作频次信息相匹配。
46.优选地,所述临床研究项目的进度记录方法,还包括步骤:
47.接收临床研究项目结束指令。
48.本发明的另一方面,提供了一种设备,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述程序时实现上述临床研究日程生成方法。
49.本发明的另一方面,提供了一种设备,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述程序时实现上述临床研究时间计划生成方法。
50.本发明的另一方面,提供了一种设备,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述程序时实现上述临床研究项目的进度记录方法。
51.本发明的另一方面,提供了一种计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现上述临床研究日程生成方法。
52.本发明的另一方面,提供了一种计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现上述临床研究时间计划生成方法。
53.本发明的另一方面,提供了一种计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现上述临床研究项目的进度记录方法。
54.本发明的另一方面,提供了一种临床研究日程生成系统,包括:
55.临床阶段信息接收模块,用于接收临床研究的临床阶段信息;
56.信息采集时间接收模块,用于接收各临床阶段的信息采集时间式;
57.临床研究日程生成模块,用于根据各临床阶段的信息采集时间式,生成临床研究日程。
58.优选地,所述信息采集时间式包括所述临床阶段的起算点时间标记、时间宽度标记。
59.优选地,所述信息采集时间式还包括采集点间隔标记,用于标记多个采集点的时间间隔,所述采集点间隔标记用于标记多个采集点的时间间隔。
60.优选地,所述起算点时间标记可以由临床阶段编号、计算方式、距离时间表示。
61.优选地,所述信息采集时间式还包括采集点窗口时间标记,用于标记某一采集点的时间窗口。
62.优选地,所述时间宽度标记为临床阶段的持续时间。
63.优选地,所述时间宽度标记包括采集点间隔标记,及采集点间隔实现次数。
64.优选地,所述起算点时间标记可以为某一临床阶段的结束时间,所述结束时间为由起算点时间起算的时间宽度终点。
65.优选地,所述起算点时间标记包括第一事件起算点时间标记,或第二事件起算点时间标记。其中,第一事件为临床研究日程生成时可确定的临床阶段,第二事件为临床研究日程生成时不可确定的临床阶段。
66.优选地,所述临床阶段包括至少一个治疗期。
67.优选地,所述临床阶段包括筛选期。
68.优选地,所述临床阶段包括治疗后随访。
69.优选地,所述起算点时间标记可以包括临床任务起算点时间标记。所述临床任务为临床研究日程中需要完成的临床任务。
70.更优选地,所述临床任务起算点时间标记包括临床任务第一次完成的时间标记、或临床任务最后一次完成的时间标记、或临床任务每次完成的时间标记。
71.本发明的另一方面,提供了一种临床研究时间计划生成系统,包括:
72.临床任务接收模块,用于接收待完成的临床任务信息;
73.如上所述的临床研究日程生成系统;
74.任务匹配模块,用于接收临床任务与临床阶段的匹配指令。
75.优选地,所述临床研究时间计划生成系统,还包括:
76.操作频次接收模块,用于接收临床任务的操作频次信息。
77.优选地,所述操作频次信息可以为在单位时间内完成一次、或在单位时间内完成不限次。本方案中,单位时间内完成不限次为在单位时间内的完成次数大于一次,且无上限。
78.优选地,所述起算点时间标记包括临床任务起算点时间标记。更优选地,所述临床任务起算点时间标记包括临床任务第一次完成的时间标记、或临床任务最后一次完成的时间标记、或临床任务每次完成的时间标记。
79.优选地,所述临床研究时间计划生成系统,还包括:
80.备注信息接收模块,用于接收临床任务的备注信息。
81.优选地,所述临床研究时间计划生成系统,还包括:
82.临床任务标准名称生成系统,用于接收临床任务的原始名称,并根据临床任务原始名称生成临床任务标准名称。
83.本发明的另一方面,提供了一种临床研究项目的进度记录系统,包括:
84.临床研究时间计划生成系统,用于按照如上所述的方法生成临床研究时间计划;
85.人员匹配模块,用于将临床研究时间计划与工作人员进行匹配;
86.患者录入模块,用于接收患者录入指令;
87.患者选择模块,用于接收患者选择指令;
88.治疗期开始时间接收模块,用于接收治疗期开始时间数据;
89.临床任务完成模块,用于接收临床任务的完成指令;
90.治疗期结束时间接收模块,用于接收治疗期结束时间数据。
91.优选地,所述临床研究项目的进度记录系统,还包括:
92.筛选期开始时间接收模块,用于接收筛选期开始时间数据。
93.优选地,所述临床研究项目的进度记录系统,还包括:
94.第二事件开始时间接收模块,用于接收第二事件的发生时间。
95.优选地,所述接收临床任务的完成指令次数与操作频次信息相匹配。
96.优选地,所述临床研究项目的进度记录系统,还包括:
97.项目结束模块,用于接收临床研究项目结束指令。
98.综上所述,本发明具有以下有益效果:
99.1.本发明提出的临床研究任务日程生成方法及系统,可以对临床研究任务日程进行自动生成,可显著提高crc的工作效率。
100.2.本发明提出的临床研究任务日程生成方法及系统,可以对具有不确定起止时间的临床研究任务日程进行有序安排,如含有不确定治疗期的临床研究任务,增加了该日程
的普适性,避免了对不同临床研究、甚至对不同患者都需要重新进行日程创建的情况,进一步提高crc的工作效率。
101.3.本发明提出的临床研究时间计划生成方法及系统,将临床任务与临床阶段相匹配,提高了临床研究时间计划的生成效率,进一步的,所述方法还可以包括临床任务的完成频次信息,避免了对临床研究时间计划的临时更改,增加了该计划的应用效率。
102.4.本发明提出的临床研究项目的进度记录方法及系统,针对不同患者创建独立的进度记录,方便crc的工作记录,同时也可以提醒crc的工作日程,可显著提升crc的工作效率。
附图说明
103.图1为本发明临床试验资源统计系统的系统架构图;
104.图2为本发明临床试验资源统计方法的流程图;
105.图3为本发明统计临床项目中cra工作量的方法流程图。
106.图4为本发明临床研究日程生成系统的示意图;
107.图5为本发明临床研究时间计划生成系统的示意图;
108.图6为本发明临床研究项目的进度记录系统的示意图。
具体实施方式:
109.这里将详细地对示例性实施例进行说明,以下示例性实施例中所描述的实施方式并不代表与本发明相一致的所有实施方式。相反,它们仅是与如所附权利要求书中所详述的、本发明的一些方面相一致的装置和方法的例子。
110.在本发明使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本发明。在本发明和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他。还应当理解,本文中使用的术语“和/或”是指并包含一个或多个相关联的列出项目的任何或所有可能组合。
111.以下将通过实施例对本发明进行详细描述。
112.本申请实施例通过提供一种临床研究日程生成方法及系统、一种临床研究时间计划生成方法及系统、一种临床研究项目的进度记录方法及系统,解决了现有技术中所述的至少一项技术问题,达到更高效生成临床研究日程的技术效果。
113.本申请实施例的技术方案为解决上述技术问题,总体思路如下:
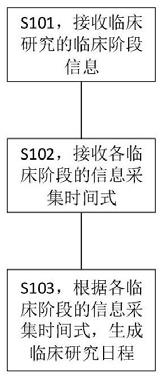
114.一种临床研究日程生成方法,包括如下步骤:
115.接收临床研究的临床阶段信息;
116.接收各临床阶段的信息采集时间式;
117.根据各临床阶段的信息采集时间式,生成临床研究日程。
118.上述临床研究任务日程生成方法,对临床研究任务日程进行自动生成,可显著提高crc的工作效率。
119.为了更好的理解上述技术方案,下面将结合说明书附图以及具体的实施方式对上述技术方案进行详细的说明。
120.实施例1
121.具体的,如图1所示,本发明提供了一种临床研究日程生成方法,包括如下步骤:
122.s101,接收临床研究的临床阶段信息;
123.在具体实施过程中,所述临床阶段信息包括该临床研究项目的各个阶段,包括但不限于:筛选期、治疗期、计划外访视、治疗结束后访视(eot访视)、安全性随访、长期随访等。在上述临床阶段中,临床协调员(crc)需要对患者进行信息采集,以实现对患者临床情况的记录。所述信息采集的内容包括但不限于,知情同意、病史采集、体格检查、物理学检查、血尿便检查等。
124.作为一种可选的实施方式,在接收临床研究的临床阶段信息后,对各临床阶段进行唯一性标注,所述标注可以为一由数字和/或字母组成的id号。
125.s102,接收各临床阶段的信息采集时间式;
126.在具体实施过程中,所述信息采集时间式可以为在各临床阶段中,需要对患者进行信息采集的时间、和/或次数,所述信息采集时间可以为某一时间点、或某一时间段,所述次数可以为一次、多次、或者不限次。
127.s103,根据各临床阶段的信息采集时间式,生成临床研究日程。
128.在具体实施过程中,通过对临床阶段,以及各临床阶段中需要进行采集的时间进行匹配,生成该临床研究的日程。
129.作为一种可选的实施方式,所述信息采集时间式包括所述临床阶段的起算点时间标记、时间宽度标记。
130.在具体实施过程中,所述起算点时间标记可以由:(临床阶段编号+计算方式+距离时间)表示,所述起算点时间标记可以为某一固定的时间点,也可以为与某一临床阶段结束时间相关的时间点,即某一临床阶段的起算点时间标记包含与其相关联的另一临床阶段的结束时间。标记某一固定的时间点的方式可以为:与某一临床阶段的起始时间相关的时间点,如以治疗期的起始时间为基准时间进行起算点时间标记,具体的,如采用字母a表示临床阶段起始时间,设治疗期第一周期id为01,则治疗期第一周期的开始时间为01a1(其中,01为临床阶段编号,a为计算方式,1为距离时间,当距离时间为1时,可以省略),筛选期应在治疗期前28天开始,则筛选期的起算点时间标记为01a-28,治疗期第二周期在治疗期第一周期后第29天开始,则治疗期第二周期的起算点时间标记为01a29,其他临床阶段可以按同样的逻辑进行起算点时间标记,当a前不加id值时代表整个临床研究的起始时间;当多个临床阶段共享同一起始时间时,如计划外访视同样在治疗期第一周期开始,设计划外访视id为05,则此时计划外访视的标记可以为01a1,也可以用01a来表示(某阶段的起始时间,其1),需要注意的是,某一临床阶段只可引用其他临床阶段的id作为起算点时间标记的组成。起算点时间标记为与某一临床阶段结束时间相关的时间点的方式可以为:以某一临床阶段的结束时间为基准时间进行起算点时间标记,具体的,如采用字母b表示临床阶段的结束时间(b即为计算方式),则将治疗期的结束时间标记为治疗期id+b,如治疗期id为01,则治疗期的结束时间为01b,以治疗期结束时间为起始时间的临床阶段,如治疗结束时访视的起算点时间标记为01b1(该阶段起始时间为治疗结束时第1天),治疗结束后安全访视的起算点时间标记为01b28(该阶段起始时间为治疗结束时第28天),当b前不加id值时代表整个临床研究的结束时间。在具体实施过程中,所述时间宽度标记用于标记某一临床阶段的时间宽度,该宽度可以为某一临床阶段的持续时间。如以治疗期起始时间为基准时间,持续100天
的治疗期,用起算点时间标记、时间宽度标记表示为:a1100。进一步地,上述基准时间为crc在启动临床项目时需要采集的时间,如患者的入组时间、筛选期开始时间、治疗期开始时间等,也即,所述信息采集时间式包括第一基准时间采集标记(即上述起算点时间标记中的a),所述第一基准时间采集标记为启动临床项目时需要采集的时间。采用此种方式,可以对此种信息采集式对临床阶段的时间段进行简单、精确的描述,为生成完整的临床日程提供了基础。
131.作为一种可选的实施方式,所述信息采集时间式还包括采集点间隔标记,用于标记多个采集点的时间间隔。
132.在具体实施过程中,某一临床阶段,需要crc进行一次或多次数据采集,如在筛选期内,crc只需对患者进行一次信息采集,此时不需对该临床阶段进行采集点间隔标记;但是在某些临床阶段如第一年的长期访视中,需要每隔3个月对患者进行一次信息采集,这3个月即为采集点时间间隔,可以用3m对此时间间隔进行标记,即为采集点间隔标记。如对第一年长期访视的临床阶段进行标记,其起始时间为治疗期接收后4个月,每3个月采集数据1次,时间宽度为1年,假设治疗期的id为01,则第一年长期访视的信息采集时间式为,01b4m(起算点时间标记)3m(采集点间隔标记)<=1y(时间宽度标记)。本领域技术人员应当了解,采集点间隔标记还可以采用天或周或年的形式,对时间间隔进行标记,如采用30d(即30天)、4w(即4周)、1y(即1年)对某一时间间隔进行标记。采用采集点间隔标记,可以将需要多次重复的临床阶段表示在一个信息采集时间式中,提高了临床日程的生成效率。
133.作为一种可选的实施方式,所述信息采集时间式还包括采集点窗口时间标记,用于标记某一采集点的时间窗口。
134.在具体实施过程中,不同的临床阶段,对于crc采集患者信息的时间点有着不同的要求,如在治疗结束时访视需要在治疗结束的当天完成,不存在窗口期;而在治疗期中,对患者的信息采集可以在预计采集点的前后3天内进行,也就是存在7天的窗口期,对于这一采集点窗口时间标记,可以采用+-3d或
±
3d来表示。对采集点的窗口时间进行标记,增加了临床日程生成的灵活性,也更符合临床工作的实际操作情况。
135.作为一种可选的实施方式,所述时间宽度标记包括采集点间隔标记,及采集点间隔实现次数。
136.在具体实施过程中,会存在无法确定固定周期的临床阶段,如长期访视,该阶段的时间终点不能确定,如从治疗期截止后4个月开始的长期访视,每6个月对患者进行一次信息采集,直到患者死亡或药物临床试验终止,以t表示采集点间隔实现次数,则该长期访视的时间宽度为6m>=1t,此时该临床阶段的信息采集时间式为b4m 6m>=1t。无法确定固定周期的临床阶段,在临床工作中经常出现,也一直是临床日程制作人员难以处理的情况,此方案通过采集点间隔标记、采集点间隔实现次数来表示时间宽度标记,对此种情况进行了妥善处理,使生成的临床日程更为实用、便捷。在crc的具体工作中,需要对此临床阶段的结束时间进行采集录入,以结束该临床阶段。
137.作为一种可选的实施方式,所述起算点时间标记可以为某一临床阶段的结束时间,所述结束时间为由起算点时间起算的时间宽度终点。
138.在具体实施过程中,以某一临床阶段的结束时间为起算点时间标记,具体的,如以治疗期起始时间为基准时间,设置治疗结束后调查问卷的起始时间标记,设治疗期id为01,
持续100天,用起算点时间标记、时间宽度标记表示治疗期:id01=a1100,采用字母b表示临床阶段的结束时间,则将治疗期的结束时间标记为治疗期id+b,则治疗期的结束时间为01b,如果以治疗期的结束时间作为治疗结束后调查问卷的起始时间,则该阶段的起始时间标记为01b,此时01b即为由治疗期起算点时间(即a1)起算的时间宽度(即100)终点(即a1100)。因此,在一些优选的实施例中,所述信息采集时间式还包括第二基准时间采集标记(即上述标记中的01b),所述第二基准时间采集标记为治疗期的结束时间。此方案中,将不同临床阶段通过结束时间进行关联,可以提高临床日程生成的效率,进一步,在具有无法确定固定周期的临床阶段的情况下,采用此方案,可以将后续方案与此无法确定固定周期的临床阶段通过结束时间点相联系起来,使临床日程更具整体性,也更为实用。
139.作为一种可选的实施方式,所述起算点时间标记包括第一事件起算点时间标记,或第二事件起算点时间标记。
140.在具体实施过程中,所述第一事件为临床研究日程生成时可确定的临床阶段,如筛选期、治疗期、治疗后随访等;而第二事件为临床研究日程生成时不可确定的,但是在临床试验方案中涉及到的临床阶段,如临床试验方案中特别指出,当患者体温超过39℃时,应当在1周内服用相应的药物,或如果患者出现骨折,应当在2日内进行包扎处理等。其中,第二事件起算点时间标记可以h表示(h即为计算方式),假设骨折这一事件的id为02,则在骨折后2日内进行包扎处理的临床阶段应为:02h12;同理,假设高温这一事件的id为01,则在高温后1周内进行服药的临床阶段应为:01h11w。采用第二事件起算点时间标记,可以引入临床研究日程生成时不可确定时间的临床阶段,增加了临床日程的灵活性、实用性。
141.作为一种可选的实施方式,所述临床阶段包括至少一个治疗期。
142.在具体实施过程中,对于不同患者的临床研究治疗期,其周期数不能在项目开始时确定,其治疗期可能持续一个周期、两个周期、或更多。crc需要在最初治疗期启动时采集时间数据,确定该患者的治疗期起始时间,在治疗期结束时采集时间数据,确定该患者的治疗期结束时间。因此,对于不能确定时间的治疗期,可以用采集点间隔标记,及采集点间隔实现次数来表示时间宽度标记。
143.作为一种可选的实施方式,所述临床阶段包括筛选期。
144.在具体实施过程中,所述筛选期设置在治疗期之前,进行对患者的筛选,筛选期的启动时间也可以由crc进行采集。
145.作为一种可选的实施方式,所述临床阶段包括治疗后随访。
146.在具体实施过程中,对于结束治疗的患者,还要进行治疗后随访,其随访的时间不能在项目开始时确定,随访的时间可能为1年、2年、或数年,直至项目结束或患者死亡。因此,对于不能确定时间的随访期,可以用采集点间隔标记,及采集点间隔实现次数来表示时间宽度标记。
147.作为一种可选的实施方式,所述起算点时间标记可以包括临床任务起算点时间标记。
148.在具体实施过程中,所述临床任务为临床研究日程中需要完成的临床任务,如签署知情同意、血常规检查、尿常规检查、心电图、血压监测等。进一步地,所述临床任务起算点时间标记包括临床任务第一次完成的时间标记、或临床任务最后一次完成的时间标记、或临床任务每次完成的时间标记。其中,当所述临床任务起算点时间标记包括临床任务第
一次完成的时间标记时,可以f表示(f即为计算方式),假设血常规检查的id为03,则要在第一次完成血常规检查后的10天内进行心电图检查,则该临床阶段应为:03f110;当所述临床任务起算点时间标记包括临床任务最后一次完成的时间标记时,可以g表示(g即为计算方式),假设血常规检查的id为03,则要在最后一次完成血常规检查后的10天内进行尿常规检查,则该临床阶段应为:03g110;当所述临床任务起算点时间标记包括临床任务每次完成的时间标记时,可以e表示(e即为计算方式),假设血常规检查的id为03,则要在每次完成血常规检查后的1周内进行血压监测,则该临床阶段应为:03e11w。将起算点时间与临床任务相关联,增加了临床日程与临床任务的匹配性,可以实现临床阶段与临床任务的时间关联,增加了临床日程的灵活性、实用性。
149.实施例2
150.如图2所示,本发明还提供了一种临床研究时间计划生成方法,包括如下步骤:
151.s201,接收待完成的临床任务信息;
152.在具体实施过程中,临床研究时间计划的创建者录入待完成的临床任务信息,在一些实施例中,所述待完成的临床任务包括,知情同意、资格标准确认、病史调查、吸烟状态调查、体格检查、问卷表填写、体重检查、身高检查、心电图检测、血液学检测、生化检测、尿液分析等,上述待完成任务为临床研究中需要在不同阶段完成一次或多次的临床任务。
153.s204,根据如上所述的方法生成临床研究日程;
154.在具体实施过程中,采用如实施例1中所述的任一种方法生成临床研究日程。
155.s205,接收临床任务与临床阶段的匹配指令。
156.在具体实施过程中,临床研究时间计划的创建者将临床任务与临床研究日程相匹配,临床日程有多个临床阶段组成,也即通过匹配,得到在某一临床阶段内,需要完成哪些临床任务的数据,该数据可以以表格的形式体现在终端设备,同时,该数据也可以工作日历的形式体现在crc的移动终端,便于crc查看日程。在一些实施例中,crc可以通过在移动终端对待完成任务进行处理,实现已完成任务的记录,显著节约crc在登记工作时的时间,以提高其工作效率。
157.作为一种可选的实施方式,所述临床研究时间计划生成方法,还包括步骤:
158.s206,接收临床任务的操作频次信息。
159.在具体实施过程中,在临床任务与临床阶段进行匹配后,录入临床任务的操作频次信息,所述操作频次信息可以为在单位时间内完成一次,如在筛选期的知情同意书只需要完成一次;或在单位时间内完成数次,如在一个月内完成三次某项任务;或在单位时间内的完成次数大于一次,且无上限,如在治疗期内可以完成不限次数的体重测量任务。采用此方案,可以减少相同任务的录入次数,增加临床研究时间计划的生成效率,也可以进一步提高该计划的适用性。
160.作为一种可选的实施方式,所述起算点时间标记可以包括临床任务起算点时间标记。
161.在具体实施过程中,所述临床任务为临床研究日程中需要完成的临床任务,如签署知情同意、血常规检查、尿常规检查、心电图、血压监测等。进一步地,所述临床任务起算点时间标记包括临床任务第一次完成的时间标记、或临床任务最后一次完成的时间标记、或临床任务每次完成的时间标记。其中,当所述临床任务起算点时间标记包括临床任务第
一次完成的时间标记时,可以f表示,假设血常规检查的id为03,则要在第一次完成血常规检查后的10天内进行心电图检查,则该临床阶段应为:03f110;当所述临床任务起算点时间标记包括临床任务最后一次完成的时间标记时,可以g表示,假设血常规检查的id为03,则要在最后一次完成血常规检查后的10天内进行尿常规检查,则该临床阶段应为:03g110;当所述临床任务起算点时间标记包括临床任务每次完成的时间标记时,可以e表示,假设血常规检查的id为03,则要在每次完成血常规检查后的1周内进行血压监测,则该临床阶段应为:03e11w。将起算点时间与临床任务相关联,增加了临床日程与临床任务的匹配性,可以实现临床阶段与临床任务的时间关联,增加了临床日程的灵活性、实用性。
162.作为一种可选的实施方式,所述临床研究时间计划生成方法,还包括步骤:
163.s203,接收临床任务的备注信息。
164.在具体实施过程中,所述备注信息可以为该临床任务的注意事项,操作要求等,与该临床任务相关联,crc可以在移动终端操作时看到所述备注信息,为crc的操作提供便利,也可以减少临床任务发生错误的概率。
165.作为一种可选的实施方式,所述临床研究时间计划生成方法,还包括步骤:
166.s202,接收临床任务的原始名称;
167.根据临床任务原始名称生成临床任务标准名称。
168.在具体实施过程中,可能会出现不同的临床计划创建者对相同的临床任务有不同命名的情况,不便于后期的项目管理。因此在本实施例中,将临床任务的通用名称提前录入并上传至数据库,创建者需要在录入临床任务的原始名称后,将该初始名称转化为通用名称,该转化方式可以为在通用名称库中进行选择。
169.实施例3
170.如图3所示,本发明还提供了一种临床研究项目的进度记录方法,包括如下步骤:
171.s301,按照如上所述的方法生成临床研究时间计划;
172.在具体实施过程中,采用如实施例2中所述的任一种方法生成临床研究时间计划。
173.s302,将临床研究时间计划与工作人员进行匹配;
174.在具体实施过程中,将s301中生成的临床研究时间计划在系统中与相应的人员进行匹配,该工作人员即可通过账号登录等方式,通过终端设备如手机获取相应的临床研究时间计划,所述获取方式可以通过移动终端的小程序或app实现。上述工作人员可以为crc。
175.s303,接收患者录入指令;
176.在具体实施过程中,在与相应的临床研究时间计划匹配后,工作人员可以正式开始临床研究计划,此时需要对入组患者进行信息录入,如入组时间、姓名等。工作人员需要对录入信息的入组患者按临床研究时间计划进行临床任务的信息采集。
177.s304,接收患者选择指令;
178.在具体实施过程中,不同的入组患者均有独立的临床任务数据,工作人员在采集某患者的临床任务信息前,需要对患者进行选择。
179.s306,接收治疗期开始时间数据;
180.在具体实施过程中,工作人员选择相应的入组患者后,录入患者的入组时间,也即信息采集时间式中的基准时间采集标记,此时,临床研究时间计划中与此基准时间相关的临床阶段时间即可确定。在一些实施例中,录入患者入组时间后,上述临床研究时间计划会
更新在工作人员移动终端的工作日历中,便于工作人员进行查看,并安排工作时间。
181.s307,接收临床任务的完成指令;
182.在具体实施过程中,选择某一入组患者后,工作人员在相应的工作阶段内对该患者进行相应的临床任务信息采集,任务完成后,对相应的任务进行完成标记。在一些实施例中,工作人员可以通过移动终端进行完成操作,该完成操作可以通过点击小程序或app中的相应任务实现。
183.s308,接收治疗期结束时间数据。
184.在具体实施过程中,由于治疗期的不确定性,工作人员需要在患者治疗期结束时录入治疗期的结束时间,以确定治疗期后续临床阶段的任务时间。
185.作为一种可选的实施方式,所述临床研究项目的进度记录方法还包括步骤:
186.s305,接收筛选期开始时间数据。
187.在具体实施过程中,工作人员可以从患者的筛选期开始时即录入筛选期开始时间数据,进一步对整个方案的时间进行准确标注。
188.作为一种可选的实施方式,所述接收临床任务的完成指令次数与操作频次信息相匹配。
189.在某些实施例中,不同临床任务的操作频次不同,包括可确定次数如1次、2次等,也包括不确定次数如无限次。当临床任务的操作频次为可确定,工作人员需完成相应的操作频次,并在终端设备上进行操作,而在完成了相应的操作次数后,该项目即不能再被操作,处于完成状态;当临床任务的操作频次为不可确定,工作人员需完成至少一次该项任务,而该项目可以一直被操作,且系统会记录该项目的操作次数。采用此方案,可以将相同的操作内容显示为同一条目,方便工作人员的操作。
190.作为一种可选的实施方式,所述临床研究项目的进度记录方法还包括步骤:
191.s315,接收第二事件的发生时间。
192.在具体实施过程中,第二事件为临床研究日程生成时不可确定的,但是在临床试验方案中涉及到的临床阶段,需要临床协调员或其他工作人员在临床研究中对此类事件进行采集,从而触发并生成相应的临床阶段,进而与相应的临床任务相对应。
193.作为一种可选的实施方式,所述临床研究项目的进度记录方法,还包括步骤:
194.s309,接收临床研究项目结束指令。
195.在具体实施过程中,由于治疗期后存在长期访视,该时间将伴随患者很长时间甚至一生,因此该患者的临床研究的结束时间需要工作人员进行采集,以准确确定该结束时间。
196.实施例4
197.本发明提供了一种设备,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述程序时实现如权利要求1所述的临床研究日程生成方法。
198.实施例5
199.本发明提供了一种设备,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述程序时实现如权利要求2所述临床研究时间计划生成方法。
200.实施例6
201.本发明提供了一种设备,提供了一种设备,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述程序时实现如权利要求3所述临床研究项目的进度记录方法。
202.实施例7
203.本发明提供了一种计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现如权利要求1所述的临床研究日程生成方法。
204.实施例8
205.本发明提供了一种计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现如权利要求2所述的临床研究时间计划生成方法。
206.实施例9
207.本发明提供了一种计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现如权利要求3所述的临床研究项目的进度记录方法。
208.实施例10
209.如图4所示,本发明提供了一种临床研究日程生成系统,包括:
210.临床阶段信息接收模块,用于接收临床研究的临床阶段信息;
211.在具体实施过程中,所述临床阶段信息包括该临床研究项目的各个阶段,包括但不限于:筛选期、治疗期、计划外访视、治疗结束后访视(eot访视)、安全性随访、长期随访等。在上述临床阶段中,临床协调员(crc)需要对患者进行信息采集,以实现对患者临床情况的记录。所述信息采集的内容包括但不限于,知情同意、病史采集、体格检查、物理学检查、血尿便检查等。
212.作为一种可选的实施方式,在接收临床研究的临床阶段信息后,对各临床阶段进行唯一性标注,所述标注可以为一由数字和/或字母组成的id号。
213.信息采集时间接收模块,用于接收各临床阶段的信息采集时间式;
214.在具体实施过程中,所述信息采集时间式可以为在各临床阶段中,需要对患者进行信息采集的时间、和/或次数,所述信息采集时间可以为某一时间点、或某一时间段,所述次数可以为一次、多次、或者不限次。
215.临床研究日程生成模块,用于根据各临床阶段的信息采集时间式,生成临床研究日程。
216.在具体实施过程中,该模块通过对临床阶段,以及各临床阶段中需要进行采集的时间进行匹配,生成该临床研究的日程。
217.作为一种可选的实施方式,所述信息采集时间式包括所述临床阶段的起算点时间标记、时间宽度标记。
218.在具体实施过程中,所述起算点时间标记可以为某一固定的时间点,也可以为与某一临床阶段结束时间相关的时间点。标记某一固定的时间点的方式可以为:与某一临床阶段的起始时间相关的时间点,如以治疗期的起始时间为基准时间进行起算点时间标记,具体的,如采用字母a表示临床阶段起始时间,设治疗期第一周期id为01,则治疗期第一周期的开始时间为01a1,筛选期应在治疗期前28天开始,则筛选期的起算点时间标记为01a-28,治疗期第二周期在治疗期第一周期后第29天开始,则治疗期第二周期的起算点时间标
记为01a29,其他临床阶段可以按同样的逻辑进行起算点时间标记;当多个临床阶段共享同一起始时间时,如计划外访视同样在治疗期第一周期开始,设计划外访视id为05,则此时计划外访视的标记可以为01a1,也可以用01a来表示,需要注意的是,某一临床阶段只可引用其他临床阶段的id作为起算点时间标记的组成。起算点时间标记为与某一临床阶段结束时间相关的时间点的方式可以为:以某一临床阶段的结束时间为基准时间进行起算点时间标记,具体的,如采用字母b表示临床阶段的结束时间,则将治疗期的结束时间标记为治疗期id+b,如治疗期id为01,则治疗期的结束时间为01b,以治疗期结束时间为起始时间的临床阶段,如治疗结束时访视的起算点时间标记为01b1(该阶段起始时间为治疗结束时第1天),治疗结束后安全访视的起算点时间标记为01b28(该阶段起始时间为治疗结束时第28天)。在具体实施过程中,所述时间宽度标记用于标记某一临床阶段的时间宽度,该宽度可以为某一临床阶段的持续时间。如以治疗期起始时间为基准时间,持续100天的治疗期,用起算点时间标记、时间宽度标记表示为:a1100。进一步地,上述基准时间为crc在启动临床项目时需要采集的时间,如患者的入组时间、筛选期开始时间、治疗期开始时间等,也即,所述信息采集时间式包括第一基准时间采集标记(即上述起算点时间标记中的a),所述第一基准时间采集标记为启动临床项目时需要采集的时间。采用此种方式,可以对此种信息采集式对临床阶段的时间段进行简单、精确的描述,为生成完整的临床日程提供了基础。
219.作为一种可选的实施方式,所述信息采集时间式还包括采集点间隔标记,用于标记多个采集点的时间间隔。
220.在具体实施过程中,某一临床阶段,需要crc进行一次或多次数据采集,如在筛选期内,crc只需对患者进行一次信息采集,此时不需对该临床阶段进行采集点间隔标记;但是在某些临床阶段如第一年的长期访视中,需要每隔3个月对患者进行一次信息采集,这3个月即为采集点时间间隔,可以用3m对此时间间隔进行标记,即为采集点间隔标记。如对第一年长期访视的临床阶段进行标记,其起始时间为治疗期接收后4个月,每3个月采集数据1次,时间宽度为1年,假设治疗期的id为01,则第一年长期访视的信息采集时间式为,01b4m(起算点时间标记)3m(采集点间隔标记)<=1y(时间宽度标记)。采用采集点间隔标记,可以将需要多次重复的临床阶段表示在一个信息采集时间式中,提高了临床日程的生成效率。
221.作为一种可选的实施方式,所述信息采集时间式还包括采集点窗口时间标记,用于标记某一采集点的时间窗口。
222.在具体实施过程中,不同的临床阶段,对于crc采集患者信息的时间点有着不同的要求,如在治疗结束时访视需要在治疗结束的当天完成,不存在窗口期;而在治疗期中,对患者的信息采集可以在预计采集点的前后3天内进行,也就是存在7天的窗口期,对于这一采集点窗口时间标记,可以采用+-3d或
±
3d来表示。对采集点的窗口时间进行标记,增加了临床日程生成的灵活性,也更符合临床工作的实际操作情况。
223.作为一种可选的实施方式,所述时间宽度标记包括采集点间隔标记,及采集点间隔实现次数。
224.在具体实施过程中,会存在无法确定固定周期的临床阶段,如长期访视,该阶段的时间终点不能确定,如从治疗期截止后4个月开始的长期访视,每6个月对患者进行一次信息采集,直到患者死亡或药物临床试验终止,以t表示采集点间隔实现次数,则该长期访视
的时间宽度为6m>=1t,此时该临床阶段的信息采集时间式为b4m 6m>=1t。无法确定固定周期的临床阶段,在临床工作中经常出现,也一直是临床日程制作人员难以处理的情况,此方案通过采集点间隔标记、采集点间隔实现次数来表示时间宽度标记,对此种情况进行了妥善处理,使生成的临床日程更为实用、便捷。在crc的具体工作中,需要对此临床阶段的结束时间进行采集录入,以结束该临床阶段。
225.作为一种可选的实施方式,所述起算点时间标记可以为某一临床阶段的结束时间,所述结束时间为由起算点时间起算的时间宽度终点。
226.在具体实施过程中,以某一临床阶段的结束时间为起算点时间标记,具体的,如以治疗期起始时间为基准时间,设置治疗结束后调查问卷的起始时间标记,设治疗期id为01,持续100天,用起算点时间标记、时间宽度标记表示治疗期:id01=a1100,采用字母b表示临床阶段的结束时间,则将治疗期的结束时间标记为治疗期id+b,则治疗期的结束时间为01b,如果以治疗期的结束时间作为治疗结束后调查问卷的起始时间,则该阶段的起始时间标记为01b,此时01b即为由治疗期起算点时间(即a1)起算的时间宽度(即100)终点(即a1100)。因此,在一些优选的实施例中,所述信息采集时间式还包括第二基准时间采集标记(即上述标记中的01b),所述第二基准时间采集标记为治疗期的结束时间。此方案中,将不同临床阶段通过结束时间进行关联,可以提高临床日程生成的效率,进一步,在具有无法确定固定周期的临床阶段的情况下,采用此方案,可以将后续方案与此无法确定固定周期的临床阶段通过结束时间点相联系起来,使临床日程更具整体性,也更为实用。
227.作为一种可选的实施方式,所述起算点时间标记包括第一事件起算点时间标记,或第二事件起算点时间标记。
228.在具体实施过程中,所述第一事件为临床研究日程生成时可确定的临床阶段,如筛选期、治疗期、治疗后随访等;而第二事件为临床研究日程生成时不可确定的,但是在临床试验方案中涉及到的临床阶段,如临床试验方案中特别指出,当患者体温超过39℃时,应当在1周内服用相应的药物,或如果患者出现骨折,应当在2日内进行包扎处理等。第一事件与第二事件其中,第二事件起算点时间标记可以h表示,假设骨折这一事件的id为02,则在骨折后2日内进行包扎处理的临床阶段应为:02h12;同理,假设高温这一事件的id为01,则在高温后1周内进行服药的临床阶段应为:01h11w。
229.作为一种可选的实施方式,所述临床阶段包括至少一个治疗期。
230.在具体实施过程中,对于不同患者的临床研究治疗期,其周期数不能在项目开始时确定,其治疗期可能持续一个周期、两个周期、或更多。crc需要在最初治疗期启动时采集时间数据,确定该患者的治疗期起始时间,在治疗期结束时采集时间数据,确定该患者的治疗期结束时间。因此,对于不能确定时间的治疗期,可以用采集点间隔标记,及采集点间隔实现次数来表示时间宽度标记。
231.作为一种可选的实施方式,所述临床阶段包括筛选期。
232.在具体实施过程中,所述筛选期设置在治疗期之前,进行对患者的筛选,筛选期的启动时间也可以由crc进行采集。
233.作为一种可选的实施方式,所述临床阶段包括治疗后随访。
234.在具体实施过程中,对于结束治疗的患者,还要进行治疗后随访,其随访的时间不能在项目开始时确定,随访的时间可能为1年、2年、或数年,直至项目结束或患者死亡。因
此,对于不能确定时间的随访期,可以用采集点间隔标记,及采集点间隔实现次数来表示时间宽度标记。
235.作为一种可选的实施方式,所述起算点时间标记可以包括临床任务起算点时间标记。
236.在具体实施过程中,所述临床任务为临床研究日程中需要完成的临床任务,如签署知情同意、血常规检查、尿常规检查、心电图、血压监测等。进一步地,所述临床任务起算点时间标记包括临床任务第一次完成的时间标记、或临床任务最后一次完成的时间标记、或临床任务每次完成的时间标记。其中,当所述临床任务起算点时间标记包括临床任务第一次完成的时间标记时,可以f表示,假设血常规检查的id为03,则要在第一次完成血常规检查后的10天内进行心电图检查,则该临床阶段应为:03f110;当所述临床任务起算点时间标记包括临床任务最后一次完成的时间标记时,可以g表示,假设血常规检查的id为03,则要在最后一次完成血常规检查后的10天内进行尿常规检查,则该临床阶段应为:03g110;当所述临床任务起算点时间标记包括临床任务每次完成的时间标记时,可以e表示,假设血常规检查的id为03,则要在每次完成血常规检查后的1周内进行血压监测,则该临床阶段应为:03e11w。将起算点时间与临床任务相关联,增加了临床日程与临床任务的匹配性,可以实现临床阶段与临床任务的时间关联,增加了临床日程的灵活性、实用性。
237.实施例11
238.如图5所示,本发明提供了一种临床研究时间计划生成系统,包括:
239.临床任务接收模块,用于接收待完成的临床任务信息;
240.在具体实施过程中,临床研究时间计划的创建者通过临床任务接收模块录入待完成的临床任务信息,在一些实施例中,所述待完成的临床任务包括,知情同意、资格标准确认、病史调查、吸烟状态调查、体格检查、问卷表填写、体重检查、身高检查、心电图检测、血液学检测、生化检测、尿液分析等,上述待完成任务为临床研究中需要在不同阶段完成一次或多次的临床任务。
241.如实施例10所述的临床研究日程生成系统;
242.任务匹配模块,用于接收临床任务与临床阶段的匹配指令;
243.在具体实施过程中,临床研究时间计划的创建者通过任务匹配模块将临床任务与临床研究日程相匹配,临床日程有多个临床阶段组成,也即通过匹配,得到在某一临床阶段内,需要完成哪些临床任务的数据,该数据可以以表格的形式体现在终端设备,同时,该数据也可以工作日历的形式体现在crc的移动终端,便于crc查看日程。在一些实施例中,crc可以通过在移动终端对待完成任务进行处理,实现已完成任务的记录,显著节约crc在登记工作时的时间,以提高其工作效率。
244.作为一种可选的实施方式,所述临床研究时间计划生成系统,还包括:
245.操作频次接收模块,用于接收临床任务的操作频次信息。
246.在具体实施过程中,在临床任务与临床阶段进行匹配后,通过操作频次接收模块录入临床任务的操作频次信息,所述操作频次信息可以为在单位时间内完成一次,如在筛选期的知情同意书只需要完成一次;或在单位时间内完成数次,如在一个月内完成三次某项任务;或在单位时间内的完成次数大于一次,且无上限,如在治疗期内可以完成不限次数的体重测量任务。采用此方案,可以减少相同任务的录入次数,增加临床研究时间计划的生
成效率,也可以进一步提高该计划的适用性。
247.作为一种可选的实施方式,所述起算点时间标记可以包括临床任务起算点时间标记。
248.在具体实施过程中,所述临床任务为临床研究日程中需要完成的临床任务,如签署知情同意、血常规检查、尿常规检查、心电图、血压监测等。进一步地,所述临床任务起算点时间标记包括临床任务第一次完成的时间标记、或临床任务最后一次完成的时间标记、或临床任务每次完成的时间标记。其中,当所述临床任务起算点时间标记包括临床任务第一次完成的时间标记时,可以f表示,假设血常规检查的id为03,则要在第一次完成血常规检查后的10天内进行心电图检查,则该临床阶段应为:03f110;当所述临床任务起算点时间标记包括临床任务最后一次完成的时间标记时,可以g表示,假设血常规检查的id为03,则要在最后一次完成血常规检查后的10天内进行尿常规检查,则该临床阶段应为:03g110;当所述临床任务起算点时间标记包括临床任务每次完成的时间标记时,可以e表示,假设血常规检查的id为03,则要在每次完成血常规检查后的1周内进行血压监测,则该临床阶段应为:03e11w。将起算点时间与临床任务相关联,增加了临床日程与临床任务的匹配性,可以实现临床阶段与临床任务的时间关联,增加了临床日程的灵活性、实用性。
249.作为一种可选的实施方式,所述临床研究时间计划生成系统,还包括:
250.备注信息接收模块,用于接收临床任务的备注信息。
251.在具体实施过程中,所述备注信息可以为该临床任务的注意事项,操作要求等,与该临床任务相关联,crc可以在移动终端操作时看到所述备注信息,为crc的操作提供便利,也可以减少临床任务发生错误的概率。
252.作为一种可选的实施方式,所述临床研究时间计划生成系统,还包括:
253.临床任务标准名称生成系统,用于接收临床任务的原始名称,并根据临床任务原始名称生成临床任务标准名称。
254.在具体实施过程中,可能会出现不同的临床计划创建者对相同的临床任务有不同命名的情况,不便于后期的项目管理。因此在本实施例中,将临床任务的通用名称提前录入并上传至数据库,创建者需要在录入临床任务的原始名称后,将该初始名称转化为通用名称,该转化方式可以为在通用名称库中进行选择。
255.实施例12
256.如图6所示,本发明提供了一种临床研究项目的进度记录系统,包括:
257.如实施例11中所述的临床研究时间计划生成系统;
258.人员匹配模块,用于将临床研究时间计划与工作人员进行匹配;
259.在具体实施过程中,将临床研究时间计划生成系统生成的临床研究时间计划在系统中与相应的人员进行匹配,该工作人员即可通过账号登录等方式,通过终端设备如手机获取相应的临床研究时间计划,所述获取方式可以通过移动终端的小程序或app实现。上述工作人员可以为crc。
260.患者录入模块,用于接收患者录入指令;
261.在具体实施过程中,在与相应的临床研究时间计划匹配后,工作人员可以正式开始临床研究计划,此时需要通过患者录入模块对入组患者进行信息录入,如入组时间、姓名等。工作人员需要对录入信息的入组患者按临床研究时间计划进行临床任务的信息采集。
262.患者选择模块,用于接收患者选择指令;
263.在具体实施过程中,不同的入组患者均有独立的临床任务数据,工作人员在采集某患者的临床任务信息前,需要利用患者选择模块对患者进行选择。
264.治疗期开始时间接收模块,用于接收治疗期开始时间数据;
265.在具体实施过程中,工作人员选择相应的入组患者后,通过治疗期开始时间接收模块录入患者的入组时间,也即信息采集时间式中的基准时间采集标记,此时,临床研究时间计划中与此基准时间相关的临床阶段时间即可确定。在一些实施例中,录入患者入组时间后,上述临床研究时间计划会更新在工作人员移动终端的工作日历中,便于工作人员进行查看,并安排工作时间。
266.临床任务完成模块,用于接收临床任务的完成指令;
267.在具体实施过程中,选择某一入组患者后,工作人员在相应的工作阶段内对该患者进行相应的临床任务信息采集,任务完成后,通过临床任务完成模块对相应的任务进行完成标记。在一些实施例中,工作人员可以通过移动终端进行完成操作,该完成操作可以通过点击小程序或app中的相应任务实现。
268.治疗期结束时间接收模块,用于接收治疗期结束时间数据。
269.在具体实施过程中,由于治疗期的不确定性,工作人员需要在患者治疗期结束时,通过治疗期结束时间接收模块录入治疗期的结束时间,以确定治疗期后续临床阶段的任务时间。
270.作为一种可选的实施方式,所述临床研究项目的进度记录系统,还包括:
271.筛选期开始时间接收模块,用于接收筛选期开始时间数据。
272.在具体实施过程中,工作人员可以从患者的筛选期开始时即录入筛选期开始时间数据,进一步对整个方案的时间进行准确标注。
273.作为一种可选的实施方式,所述临床研究项目的进度记录系统,还包括:
274.第二事件开始时间接收模块,用于接收第二事件的发生时间。
275.在具体实施过程中,第二事件为临床研究日程生成时不可确定的,但是在临床试验方案中涉及到的临床阶段,需要临床协调员或其他工作人员在临床研究中对此类事件进行采集,从而触发并生成相应的临床阶段,进而与相应的临床任务相对应。
276.作为一种可选的实施方式,所述接收临床任务的完成指令次数与操作频次信息相匹配。
277.在某些实施例中,不同临床任务的操作频次不同,包括可确定次数如1次、2次等,也包括不确定次数如无限次。当临床任务的操作频次为可确定,工作人员需完成相应的操作频次,并在终端设备上进行操作,而在完成了相应的操作次数后,该项目即不能再被操作,处于完成状态;当临床任务的操作频次为不可确定,工作人员需完成至少一次该项任务,而该项目可以一直被操作,且系统会记录该项目的操作次数。采用此方案,可以将相同的操作内容显示为同一条目,方便工作人员的操作。
278.作为一种可选的实施方式,所述临床研究项目的进度记录系统,还包括:
279.项目结束模块,用于接收临床研究项目结束指令。
280.在具体实施过程中,由于治疗期后存在长期访视,该时间将伴随患者很长时间甚至一生,因此该患者的临床研究的结束时间需要工作人员通过项目结束模块进行采集,以
准确确定该结束时间。
281.本领域普通技术人员可以意识到,结合本文中所公开的实施例描述的各示例的单元及算法步骤,能够以电子硬件、或者计算机软件和电子硬件的结合来实现。这些功能究竟以硬件还是软件方式来执行,取决于技术方案的特定应用和设计约束条件。专业技术人员可以对每个特定的应用来使用不同方法来实现所描述的功能,但是这种实现不应认为超出本发明的范围。
282.在本申请所提供的几个实施例中,应该理解到,所揭露的系统、装置和方法,可以通过其它的方式实现。另一点,所显示或讨论的相互之间的耦合或直接耦合或通信连接可以是通过一些接口,装置或单元的间接耦合或通信连接,可以是电性,机械或其它的形式。
283.所述作为分离部件说明的单元可以是或者也可以不是物理上分开的,作为单元显示的部件可以是或者也可以不是物理单元,即可以位于一个地方,或者也可以分布到多个网络单元上。可以根据实际的需要选择其中的部分或者全部单元来实现本实施例方案的目的。
284.另外,在本发明各个实施例中的各功能单元可以集成在一个处理单元中,也可以是各个单元单独物理存在,也可以两个或两个以上单元集成在一个单元中。
285.应当理解,本申请实施例中,从权、各个实施例、特征可以互相组合结合,都能实现解决前述技术问题。
286.所述功能如果以软件功能单元的形式实现并作为独立的产品销售或使用时,可以存储在一个计算机可读取存储介质中。基于这样的理解,本发明的技术方案本质上或者说对现有技术做出贡献的部分或者该技术方案的部分可以以软件产品的形式体现出来,该计算机软件产品存储在一个存储介质中,包括若干指令用以使得一台计算机设备(可以是个人计算机,服务器,或者网络设备等)执行本发明各个实施例所述方法的全部或部分步骤。而前述的存储介质包括:u盘、移动硬盘、只读存储器(rom,read-only memory)、随机存取存储器(ram,random access memory)、磁碟或者光盘等各种可以存储程序代码的介质。
287.对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1