病毒免疫治疗药物复合物在制备治疗HBV感染药物中的应用的制作方法
本发明为申请号201310322617.0,申请日2013年07月26日,发明名称“一种病毒免疫治疗药物复合物及其用途”的分案申请。
本发明属生物医药领域,涉及一种新的病毒免疫治疗药物复合物,尤其涉及一种病毒免疫治疗药物复合物在制备治疗hbv感染药物中的应用。
背景技术:
现有技术公开了乙型病毒性肝炎是由乙肝病毒(hbv)引起的、通过血液与体液传播的、以肝脏损害为主的传染病,是一个严重的公共卫生问题,该疾患对人类健康的威胁很大。研究显示,感染乙型肝炎后,部分患者将发展成为慢性持续性感染状态,其中有可能演变为肝硬变或原发性肝细胞癌。我国是乙型肝炎病毒感染高流行区,每年约有35万人死于与乙肝相关的疾病(如:肝硬化、肝癌等),其中,人群感染率为60%,乙型肝炎表面抗原(hbsag)人群携带率为10%。目前,据估计,全世界共有3亿hbsag携带者,而我国占其中的三分之一,乙型肝炎传播已成为影响我国人口素质的重要问题。
实践显示,乙肝疫苗的接种是控制或预防乙型肝炎最有效的措施。进入80年代,乙型肝炎基因重组疫苗的发展非常迅速,自1981年起,默克公司成功研制出乙型肝炎基因s蛋白在酵母中表达后与铝佐剂配伍的基因重组疫苗并商品化后,对全球乙型肝炎的预防和控制起到了重要作用。现有上市的乙肝疫苗主要是基于乙肝病毒s抗原与铝佐剂配伍的形式。
对于慢性乙型肝炎患者,hbv在肝脏细胞内长期持续复制,会导致机体内病毒特异性效应t细胞的耗竭以及病毒的免疫逃逸,使患者处于一种免疫耐受的状态,病毒特异性的ctl反应变得非常弱。有研究提示,机体针对hbv的特异性t细胞应答低下可能是hbv持续性感染的重要原因之一,其具体分子机制尚未完全明了,分析认为可能与病毒抗原的量、天然免疫的诱导效率、抗原提呈细胞的类型、辅助性t细胞与调节性t细胞的数量与功能及共刺激分子的调控等有关。
根据中华医学会肝病学分会和感染病学分会组织国内有关专家制定的《慢性乙型肝炎防治指南》,对于属于抗病毒的适应症范围内的hbv患者,应给予抗病毒治疗。目前的治疗乙肝的抗病毒药物包括α-ifn、核苷(酸)类似物,如拉米夫定、阿德福韦酯、恩替卡韦、替比夫定、替诺福韦酯等;这些药物能抑制适应症范围内患者的hbvdna拷贝数,但长期服用,易产生耐药性;此外,核苷(酸)类似物停用后可出现复发,甚至病情恶化;而干扰素有骨髓抑制作用,长期服用有较大的副作用;甘草酸制剂、水飞蓟素制剂、多不饱和卵磷脂制剂以及双环醇等,均有不同程度的抗炎、抗氧化、保护肝细胞膜及细胞器等作用,临床应用结果显示可改善肝脏生化学指标,但并不能取代抗病毒治疗。
研究者认为,目前,乙肝有效的免疫治疗手段应是基于激发病毒携带者体内的免疫系统。已知粒细胞-巨噬细胞集落刺激因子(gm-csf)是一种具有多项潜能的造血细胞重要生长因子,对各种原因引起的白细胞减少症有明显的疗效。gm-csf主要由活化的t细胞、b细胞、单核巨噬细胞、肥大细胞、内皮细胞和成纤维细胞产生,它不仅能够促进造血前体细胞的增殖、分化和成熟,而且对其他细胞,如抗原递呈细胞(apc)、成纤维细胞、角质细胞、皮肤黏膜细胞等均有不同程度的刺激作用。1993年,dranoff等首次将gm-csf作为免疫佐剂,增强了抗肿瘤疫苗的免疫反应。gm-csf的免疫增强作用可能与其增强apc细胞的抗原递呈能力有关。gm-csf作用于树突状细胞(dc),增强其递呈抗原的能力[1];增加il-2的产生,活化cd4+t细胞,使其分泌抗体的能力增强,同时亦可增强cd8+t细胞的功能[2]。近年来的研究发现,gm-csf可激活t细胞、内皮细胞,增强apc的功能,增加细胞mhc,协同刺激分子,参与机体免疫调节,增强抗病毒药物的疗效。但hasan等通过在给正常人注射重组乙肝疫苗之前立即肌肉注射gm-csf,发现此种情况下gm-csf不能提供显著的佐剂活性,即不能有效地提高初级免疫反应[3]。v.bronte等人发现全身性高水的gm-csf能诱导暂时性抑制t细胞反应[4]。s.j.simmons等人在一个前列腺癌疫苗的ⅱ期临床试验中,利用gm-csf作为全身性佐剂,结果却无法检测到dc-多肽注射后的临床反应增强,或检测到显著提高的免疫反应。此外,部分患者还发生了一些剂量不良反应,例如局部反应、疲劳、骨痛、肌痛和发热[5]。这些结果与其他许多gm-csf作为佐剂一同免疫能显著改善抗原特异性免疫反应的报道不同,这说明可能是由于gm-csf的剂量、给药的持续时间以及免疫剂量与临床免疫结果息息相关,然而对于gm-csf免疫疗法的剂量、持续时间的研究还并不透彻,亟待通过系统的研究优化出较优的gm-csf作为免疫疗法药物的用途。
有研究报道,单独使用干扰素治疗hbv,大约只有25%-40%具有治疗效果。拉米夫定因其相对安全和价格低廉,至今仍是很多地区治疗hbv感染的首要选择,但其快速形成的耐药性是其中存在的主要缺陷[6]。随着阿德福伟使用量增加,针对这种药物的耐药性也成为了主要问题,这说明部分病人对这种单一治疗是无反应的,或易产生耐药性。鉴于在针对hiv感染方面的联合治疗法取得成功,以及单一药物治疗hbv仍存在各种问题,很多研究者对联合治疗法治疗hbv进行研究[7]。guptan等通过联合干扰素和gm-csf,观察到60%干扰素单一治疗无反应的hbv患者在最初治疗结束后hbeag和hbv-dna降低,但随后患者中出现了病毒复发情况[8]。而heintges等则使用α-ifn和乙肝疫苗联合治疗六个月后,发现50%(8/19)的干扰素单一治疗无反应者已无法检测出hbv-dna,但治疗后的持续反应率在该临床实验中没有报道。也有研究报道了病毒携带者直接接种hbsag疫苗进行治疗,28.6%的患者病毒复制减少,21.4%的患者hbv-dna呈阴性。但dikici等人却发现慢性hbv感染的免疫耐受儿童乙肝疫苗接种治疗组和未接种组无明显区别。
中国公开号“cn1990043a”,“重组人粒细胞巨噬细胞集落刺激因子在制备治疗或预防乙型肝炎药物中的用途”公开了同时给予重组人gm-csf和基因工程乙型肝炎疫苗可以促进机体的体液免疫;提前给予重组人gm-csf,再给予基因工程乙型肝炎疫苗,可以刺激动物产生细胞免疫,加快t细胞转化,可刺激th1细胞分泌ifn-γ等细胞因子,促进igg2a型抗体的产生,增加细胞毒t细胞(ctl)的功能,从而达到治疗治疗hbv的效果。近几年,不同的细胞因子、趋化因子已经被用于动物模型和人类疫苗研究的免疫佐剂,促进抗原识别和t细胞的扩增。有研究报道,gm-csf是目前在增加抗肿瘤疫苗免疫原性方面使用最多的细胞因子佐剂。gm-csf即可以通过基因转导至肿瘤细胞或周边正常的细胞释放该细胞因子,也可以以重组蛋白形式全身性或局部地用于动物或病人的不同疫苗接种。但gm-csf用于人类抗病毒疫苗的免疫佐剂仍存在争议。hasan等通过在给正常人注射重组乙肝疫苗之前立即肌肉注射gm-csf,发现此种情况下gm-csf不能提供显著的佐剂活性,即不能有效地提高初级免疫反应[3]。同样以gm-csf为免疫佐剂,却得到不同的结果,可能与gm-csf实际应用时的剂量、免疫部位和免疫方式有关。
基于上述研究,本申请的发明人拟提供一种新的病毒免疫治疗药物复合物,尤其涉及一种用于乙肝持续性病毒感染的病毒免疫治疗药物复合物。
与本发明相关的现有技术有:
1.vandelaarl,cofferp,woltmana:regulationofdendriticcelldevelopmentbygm-csf:molecularcontrolandimplicationsforimmunehomeostasisandtherapy.blood2012,119(15):3383-3393.
2.wanjallac,goldsteine,wirblichc,schnellm:aroleforgranulocyte-macrophagecolony-stimulatingfactorintheregulationofcd8(+)tcellresponsestorabiesvirus.virology2012,426(2):120-133.
3.crucianim,mengolic,serpellonig,mazzir,boscoo,malenam:granulocytemacrophagecolony-stimulatingfactorasanadjuvantforhepatitisbvaccination:ameta-analysis.vaccine2007,25(4):709-718.
4.cytokinesasnaturaladjuvantsforvaccines.pdf.
5.gm-csfasasystemicadjuvantinaphaseiiprostatecancervaccinetrial.pdf.
6.morreyj,baileyk,korbab,sidwellr:utilizationoftransgenicmicereplicatinghighlevelsofhepatitisbvirusforantiviralevaluationoflamivudine.antiviralresearch1999,42(2):97-108.
7.pauln,hans-h:combinationtherapyforchronichepatitisb:currentindications.currenthepatitisreports2011,10(2):98-105.
8.rajkumarcg,varshat,seyednk,shivks:efficacyofgranulocyte-macrophagecolony-stimulatingfactororlamivudinecombinationwithrecombinantinterferoninnon-responderstointerferoninhepatitisbvirus-relatedchronicliverdiseasepatients.journalofgastroenterologyandhepatology2002,17.
技术实现要素:
本发明的目的是提供一种新的病毒免疫治疗药物复合物,尤其涉及一种用于乙肝持续性病毒感染的病毒免疫治疗药物复合物。本发明的药物复合物可为治疗乙肝提供新的免疫治疗药物。
本发明的药物复合物由抗病毒药物,免疫调节药物和重组乙肝疫苗组成。
本发明的药物复合物用于治疗乙肝,尤其适合治疗慢性乙型肝炎,所述的药物复合物中,利用α-ifn、核苷类等抗病毒药物降低机体内的病毒载量;再为机体给以gm-csf为佐剂的乙肝疫苗,使机体建立有效的免疫记忆保护反应,产生强力的抗体保护和细胞免疫,防止病毒复发,甚至达到清除病毒的目的,以及预防hbv再次感染。
本发明中,所述的抗病毒药物选自干扰素或核酸类药物,例如:普通ifn-α3~5mu,聚乙二醇ifn-α2a,聚乙二醇ifn-α2b,拉米夫定(lamivudine,lam),阿德福韦酯(adefovirdipivoxil,adv),恩替卡韦(entecavir,etv),替比夫定(telbivudine,ldt),替诺福韦酯((tenofovirdisoproxilfumarate,tdf);
所述的免疫调节药物选自重组人粒细胞巨噬细胞集落刺激因子,如gm-csf;
所述的重组乙肝疫苗为基因工程乙肝疫苗,如亚单位蛋白质疫苗;
本发明采用下述技术实施方,通过基因工程技术将干扰素基因在大肠杆菌或酵母系统中进行表达出蛋白质,提取纯化后与辅料配伍制成抗病毒药物ifn-a(一型干扰素),通过基因工程技术将人粒细胞巨噬细胞集落刺激因子基因酵母系统中进行表达出蛋白质,提取纯化后与辅料配伍制成免疫调节药物为rhgm-csf(重组人粒细胞巨噬细胞集落刺激因子),通过基因工程技术将人乙肝抗原基因在酵母系统中进行表达出蛋白质,提取纯化后与佐剂配伍制成重组乙肝表面抗原疫苗。
本发明的药物复合物中的α-ifn、核苷类等抗病毒药物均为已上市的常用抗病毒药。
本发明的药物复合物中,抗病毒药物的用量采用临床常规用药剂量(可参照《慢性乙型肝炎防治指南》);基因工程乙型肝炎疫苗与重组人粒细胞巨噬细胞集落刺激因子的质量配比为1:1~30。
本发明中,抗病毒药物用量和用法参照了《慢性乙型肝炎防治指南》,例如,
1.普通ifn-α3~5mu(可根据患者的耐受情况适当调整剂量),每周3次或隔日1次,皮下注射,一般疗程为6个月。
2.聚乙二醇ifn-α2a180μg,每周1次,皮下注射,疗程1年。
3.聚乙二醇ifn-α2b1.0~1.5μg/kg,每周1次,皮下注射,疗程1年。
4.拉米夫定(lamivudine,lam),每日1次口服100mg拉米夫定。
5.阿德福韦酯(adefovirdipivoxil,adv),阿德福韦酯10mg,每日1次口服。
6.恩替卡韦(entecavir,etv):恩替卡韦0.5mg,每日1次口服。
7.替比夫定(telbivudine,ldt):替比夫定600mg,每日1次口服。
8.替诺福韦酯((tenofovirdisoproxilfumarate,tdf):tdf与阿德福韦酯结构相似,但肾毒性较小,治疗剂量为每日300mg(本药在我国尚未被批准上市)。
本发明的药物复合物中的抗病毒药物,免疫调节药物和重组乙肝疫苗采用混合物形式给药,或分别给予的方式给药,其给药方式采用皮下或肌肉注射的方式;或分别口服加注射的形式给药,或给予不同时间的先后次序形式给药,如,采用抗病毒药物给药在基因工程乙肝疫苗给药前;或采用重组人粒细胞巨噬细胞集落刺激因子给药在基因工程乙肝疫苗给药前。
具体地,另一方面,本发明公开了:
抗病毒药物(干扰素、核酸类药物等)和免疫调节药物(重组人粒细胞巨噬细胞集落刺激因子)、重组乙肝疫苗在制备治疗乙型肝炎药物中的用途;尤其在制备治疗慢性乙型肝炎药物中的用途;
所述的用途中,抗病毒药物在基因工程乙肝疫苗给药前给药;
所述的用途中,重组人粒细胞巨噬细胞集落刺激因子在基因工程乙肝疫苗给药前给药;
抗病毒用药剂量参照《慢性乙型肝炎防治指南》;基因工程乙型肝炎疫苗与重组人粒细胞巨噬细胞集落刺激因子的质量配比为1:1~30。
本发明的药物复合物进行了抗病毒免疫实验,结果表明,用于治疗乙肝持续性病毒感染,其中的α-ifn、核苷(酸)类药物降低机体内的病毒载量;gm-csf等具有免疫增强作用的细胞因子为佐剂的乙肝疫苗,使机体建立有效的免疫记忆保护反应,能产生强力的抗体保护和细胞免疫,清除病毒以及防止感染。在本发明的一个实施例中,采用重组人粒细胞巨噬细胞集落刺激因子和基因工程乙型肝炎疫苗不同的联合免疫方式进行了大量实验,结果显示,注射乙肝疫苗前3天原位注射重组人粒细胞巨噬细胞集落刺激因子(2~30ug/只/天)后,再进行基因工程乙肝疫苗免疫(1ug/只)能有效促进动物树突细胞成熟,显著增强动物的细胞免疫水平,提高抗体水平,促进th1型细胞因子,存进igg2a类抗体产生,增强t细胞增殖能力和细胞毒t细胞(ctl)功能。
在本发明的另一个实施例中,在慢性乙肝转移基因小鼠动物模型中,注射乙肝疫苗前3天原位注射重组人粒细胞巨噬细胞集落刺激因子(2~30ug/只/天)后,再进行基因工程乙肝疫苗免疫(1ug/只)能有效打破小鼠的免疫耐受,产生较高的抗乙肝病毒抗体水平,增强了细胞免疫能力,有效的清除了小鼠表达乙肝抗原的肝脏细胞。而同时注射重组人粒细胞巨噬细胞集落刺激因子(2~30ug/只)与基因工程乙肝疫苗(1ug/只),不能较好的打破小鼠对乙肝抗原的免疫耐受。
在本发明的另一个实施例中,将抗病毒药物(重组人一型干扰素)与重组人粒细胞巨噬细胞集落刺激因子、重组乙肝疫苗配伍联合使用,在乙肝疫苗注射前(4~0天)注射抗病毒药物,乙肝疫苗前3天原位注射重组人粒细胞巨噬细胞集落刺激因子(2~30ug/只/天)后,再进行基因工程乙肝疫苗免疫(1ug/只)同样可以诱导较高的细胞免疫反应,促进t细胞的增殖能力。
本发明还提供一种用于治疗已经被乙肝和艾滋病病毒感染的病人的乙肝和艾滋病的疫苗复合物,该疫苗复合物包含有抗病毒药物、免疫调节剂和乙肝疫苗。
本发明的优点有:
1.相比于现有技术,本发明的药物复合物用抗病毒药物暂时抑制病毒复制,再利用免疫调节剂加疫苗的方式进行免疫,可有效地增强乙肝疫苗的免疫反应,避免使用单一抗病毒药物耐药性产生无反应性和,为慢性hbv感染的治疗研究提供了新的研究方向;
2.由实施例1-3可知,本发明的抗病毒药物免疫联合,相比于现有的抗病毒疗法,能更有效地激活机体的体液和细胞免疫水平,显著增强了免疫效果;
3.本发明的药物复合物,使用方便,成本低,副作用小,易于推广;
4.本发明的药物复合物,不仅能打破免疫耐受激起抗体反应,更高的激活机体的cd4以及cd8t细胞反应,包括th1、th2、th17、tc1和tc17的激活,有效通过免疫反应清除病毒,还能预防愈后再次感染。
附图说明
图1.显示实施例1中,通过定量elisa法,a,检测重组人粒细胞巨噬细集落刺激因子联合乙肝疫苗免疫的总igg,及检测重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫的igg亚型比例,b,显示实施例1中重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫增强免疫反应的t淋巴细胞扩增的检测结果,c,显示实施例1中流式细胞仪检测重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫增强免疫反应后的体内ctl反应。
图2.显示实施例1中流式细胞仪检测重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫增强乙肝疫苗免疫反应的ifn-γ、il-4在cd4t细胞中,和ifn-γ在cd8t细胞中表达结果。
图3.显示实施例2中检测重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫打破乙肝表面抗原转基因小鼠免疫耐受后乙肝表面抗原抗体的变化情况以及转基因小鼠体内乙肝表面抗原下降情况。
图4.显示实施例2中流式细胞仪检测重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫打破乙肝表面抗原转基因小鼠免疫耐受后il-10、ifn-γ在cd4和cd8t细胞中的表达情况;以及,显示实施例2中在乙肝表面抗原转基因小鼠总进行重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫后增强乙肝疫苗免疫反应dth的检测结果。
图5.显示实施例2中流式细胞仪检测重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫打破乙肝表面抗原转基因小鼠免疫耐受后,清除乙肝抗原转基因小鼠肝脏表面的乙肝表面抗原的组化染色情况,以及经过治疗后转基因小鼠肝脏内表达乙肝抗原的肝细胞的平均光密度值。
图6.a,显示elisa方法检测实施例3中抗病毒药物ifn-a2a了、重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫增强乙肝疫苗免疫反应检测重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫的总igg;b,显示实施例3中抗病毒药物ifn-a2a了、重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫增强免疫反应的t淋巴细胞扩增的检测结果;显示实施例3中流式细胞仪检测抗病毒药物ifn-a2a了、重组人粒细胞巨噬细胞集落刺激因子联合乙肝疫苗免疫增强乙肝疫苗免疫反应的ifn-γ、il-17在cd4t细胞中表达结果。
图7.是实施例5的hbsag水平下降情况,其中纵坐标为hbsag水平,iu/ml;横坐标为各时间点,2012年5月—2013年3月。
图8.实验免疫组别设计。
具体实施方式
下述实施例对本发明做更详细的说明,它们并不构成对本发明的限制。下述实施例中的实验方法,如无特别说明,均为常规方法。下述实施例中的百分含量,如无特别说明,均为质量百分含量。
除非特别说明,本发明实施例中的实验数据均为各组中每只小鼠得到的数值的平均值。
实施例1:gm-csf联合重组乙肝疫苗免疫策略增强c57bl/6对重组乙肝亚单位疫苗的免疫反应
材料与仪器:
实验材料:基因工程(cho)乙型肝炎疫苗[recombinanthepatitisbvaccine(cho)],10ug/1.0ml,注射用重组人粒细胞巨噬细胞集落刺激因子[recombinanthumangranulocyte/macrophageclolony-stimulatingfactorforinjection],300ug/支,cho表达的基因工程乙肝疫苗原液(hbsag原液)均由华北制药集团金坦生物技术有限公司提供。
主要试剂盒仪器:rpmi1640培养液(wisent公司);胎牛血清(天津市灏洋生物制品有限公司);小鼠抗兔igg抗体:购于sigma,hrp标记抗鼠igg、igg1、igg2a,购于southernbiotechnologyassosiates,brimingham,al,usa。红细胞裂解液:8.29gnh4cl,1gkhco3,37.2mgna2edta,加去离子水到800ml,调节ph值到7.2-7.4,加去离子水到1000ml,过滤除菌,室温保存。玻璃棉柱:将玻璃棉装入一次性的1ml注射器中制成分离t淋巴细胞用的玻璃棉柱。mtt:将购买的mtt粉末溶于pbs后(浓度为5mg/ml即0.5%mtt)过滤除菌,-20℃避光保存。cona:将cona粉末溶解于无血清的rpmi1640培养基中,浓度为60μg/ml。荧光标记单克隆抗体:常用的有fitc、pe、apc标记的单克隆抗体,购自bd、ebioscience、biolegend公司;封闭抗体:抗fc受体抗体免疫细胞表面一般表达有fc受体,能和抗体的fc段结合。封闭抗体的作用就是阻断荧光标记的单克隆抗体的fc段与免疫细胞表面fc受体结合所产生的非特异性的结果;固定剂:4%的多聚甲醛pbs溶液;破膜剂:1%皂素;乙肝表面抗原cd8体外ctl刺激多肽由上海吉尔生化公司合成。乙肝表面抗体诊断试剂盒及乙肝表面抗体标准品购自北京金豪制药股份有限公司。离心机:eppendorf产品;流式细胞仪:facscalibur,美国bdbioscience制造。
实验动物及免疫:实验动物及免疫:c57bl/6小鼠,spf级,6-8周龄雌性,体重16-18g,购于中国医学科学院实验动物研究所。分4组,每组6只小鼠,实验分组见下表。每组疫苗或gm-csf溶解在生理盐水中,每只小鼠注射100微升,每只小鼠颈部皮下注射进行免疫,第一次免疫后14天加强免疫一次。
实验免疫组别设计
小鼠血清收集:灭菌的毛细玻璃针,收集小鼠眼底动脉血样约200-300μl至无菌微量离心管中,室温静置30min,置4℃2h,5000rpm,离心10min,收集上清,-20℃保存备用。
elisa检测血清中总igg滴度:
(1)抗原包被:以1ug/ml抗原包被96孔酶标板,100μl/孔,4℃过夜;
(2)封闭:pbst(0.05%tween20溶于pbs)洗涤3次,每次5min,5%脱脂奶粉,100μl/孔,37℃封闭1h;
(3)加血清:pbst洗涤3次,每次5min,将小鼠血清做2倍梯度稀释,以未免疫的小鼠血清作对照,100μl/孔,37℃孵育1h;
(4)加二抗:pbst洗涤3次,每次5min,加入hrp标记的山羊抗小鼠igg(1:1000),100μl/孔,37℃孵育1h;
(5)显色:pbst洗涤3次,每次5min,加底物tmb显色,100μl/孔,37℃避光显色15min;
(6)终止:加入0.2m硫酸终止显色,50μl/孔;
(7)读数:od450nm/620nm处测光密度值。实验孔的od值为对照孔的两倍时认为是阳性。
elisa检测血清中igg1和igg2a浓度
(1)抗原包被:以2μg/ml兔的igg和1ug/mlvp1抗原包被96孔酶标板,100μl/孔,4℃过夜;
(2)封闭:pbst(0.05%tween20溶于pbs)洗涤3次,每次5min,3%bsa,100μl/孔,37℃封闭1h。
(3)加血清:pbst洗涤3次,每次5min,将小鼠抗兔igg从20ng/ml按2倍稀释10个梯度,将小鼠血清按1:100倍稀释,每个设3个重复孔,100μl/孔,37℃孵育1h。
(4)加二抗:pbst洗涤3次,每次5min,加入hrp标记的山羊抗小鼠igg1和igg2a(1:1000),100μl/孔,37℃孵育1h。
(5)显色:pbst洗涤3次,每次5min,加底物tmb显色,100μl/孔,37℃避光显色15min;
(6)终止:加入0.2m硫酸终止显色,100μl/孔。
(7)读数:od450nm/620nm处测光密度值。实验孔的od值为对照孔的两倍时认为是阳性。
(8)做出标准曲线,计算出抗体含量。
t细胞增殖实验:
用mtt法检测小鼠t细胞体外增殖活性
(1)实验中用到的所有物品均需提前灭菌。
(2)脱臼处死小鼠,用70%乙醇浸泡15分钟。
(3)在提前紫外灯灭菌20分钟的超净工作台中,无菌条件下取出小鼠脾脏于提前加有2mlrpmi1640培养液的细胞培养皿中。
(4)将铜网灼烧后降温放入平皿中,利用无菌注射器将脾脏磨碎,制成细胞悬浮液,并过滤到13ml细胞离心管内。
(5)将离心管口用封口膜封好,离心2000转,10分钟。
(6)弃上层培养液,加2~3ml红细胞裂解液,悬浮细胞,裂解2分钟后,加等体积rpmi1640培养基(或胎牛血清)中止反应,将离心管口用封口膜封好,离心2000转,10分钟。
(7)弃上层培养液,加3~4mlrpmi1640(含2%胎牛血清)培养基悬浮细胞。
(8)用玻璃棉37℃慢慢滤过细胞,保证细胞充分和玻璃棉结合以除去b细胞。
(9)用血球计数板细胞计数。
(10)用rpmi1640(含2%胎牛血清)培养基调整细胞浓度至3~4x106个/ml。
(11)将调整好浓度的细胞加入96孔板,每孔100ul。
(12)将抗原过滤除菌,稀释一定倍数后每孔加刺激物20ul(刺激物终浓度为:cona10ug/ml,5ug/ml,bsa/ova2ug/ml,抗原刺激物可以按不同浓度稀释加样。),并设有只有细胞不加刺激物的对照孔,和只有培养基的本底孔。
(13)将细胞放入细胞培养箱,37℃,5%co2培养48~72小时后,用mtt法进行显色,(每孔加20ulmtt显色液,3~4小时后读数)实验组od-培养本底od
(14)然后吸掉上清,每孔加入150ul二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。用酶标仪(magellan,tecanaustriagmbh)测定490nm的od值。
(15)结果计算:刺激指数si=(各刺激孔的od值-培养基od值)/(未刺激孔的od值-培养基od值)。
表面及胞内染色实验方法:
(1)从小鼠分离得到纯的t细胞,在10%的培养基中并稀释成1×107/ml个细胞。
(2)往96细胞板里加100ul,同时加入终浓度为10ug/ml的短肽,同时可以加入共刺激信号终浓度10ug/mlcd28的单抗,混匀后,37℃,5%二氧化碳培养。
(3)刺激4-6小时后加2ul/孔的monensin蛋白转运抑制剂。
(4)monensin拟制2小时后,用2ml的pbs2000rpm离心5分钟,将细胞重悬于100-200ul的pbs中,按照1ug/106细胞的用量加入纯化的fcii/iii受体的抗体(cd16/32,消除非特异性的结合染色,冰浴上孵育15-20分钟,用2ml的pbs2000rpm离心5分钟。
(5)将细胞重悬200ul的加4%的多聚甲醛pbs溶液,室温孵育10-15分钟,用2ml的pbs2000rpm离心5分钟。;
(6)将细胞重悬200ul的加0.1%的皂素,4℃孵育10分钟,用2ml的pbs2000rpm离心5分钟。
(7)进行表面分子和细胞内细胞因子的染色
根据说明书同时加入适量的两种荧光抗体,冰浴上孵育20-30分钟,用2ml的pbs2000rpm离心5分钟,将细胞重悬于300ul的pbs中,将细胞悬液用铜网过滤入facs专用管中,准备进行仪器检测和分析。
体内ctl实验方法:
取
(1)将脾细胞等分成二份于两个培养皿中,一份孵育50gt细胞表位的肽段,一份不孵育肽,每皿的体积为1-2ml,37℃,5%co2培养4小时(此步可以根据实验组的多少适当增加靶细胞数目)。
(2)4小时后将细胞转入15ml的细胞管中,3000rmp离心5分钟。
(3)将没有孵育小肽的靶细胞用低浓度的cfse(0.5um)染色,孵育小肽靶细胞用高浓度的cfse(5um)染色,37℃避光轻摇染色15分钟。
(4)染色后用等体积的胎牛血清终止反应,3000rmp离心5分钟,弃上清,用10ml的pbs洗3次。
(5)将低浓度和高浓度染色的靶细胞等体积的混合,按每只小鼠2×107个细胞由尾静脉注射回实验组小鼠体内,进行体内细胞毒反应。
(6)注射4小时后,处死实验小鼠,避光分离得到脾细胞。
(7)铜网过滤后转入facs专用管中,准备进行仪器检测和分析。
实验结果用t-检验进统计学分析,p<0.05差异显著,p<0.01差异极显著。
实验结果:
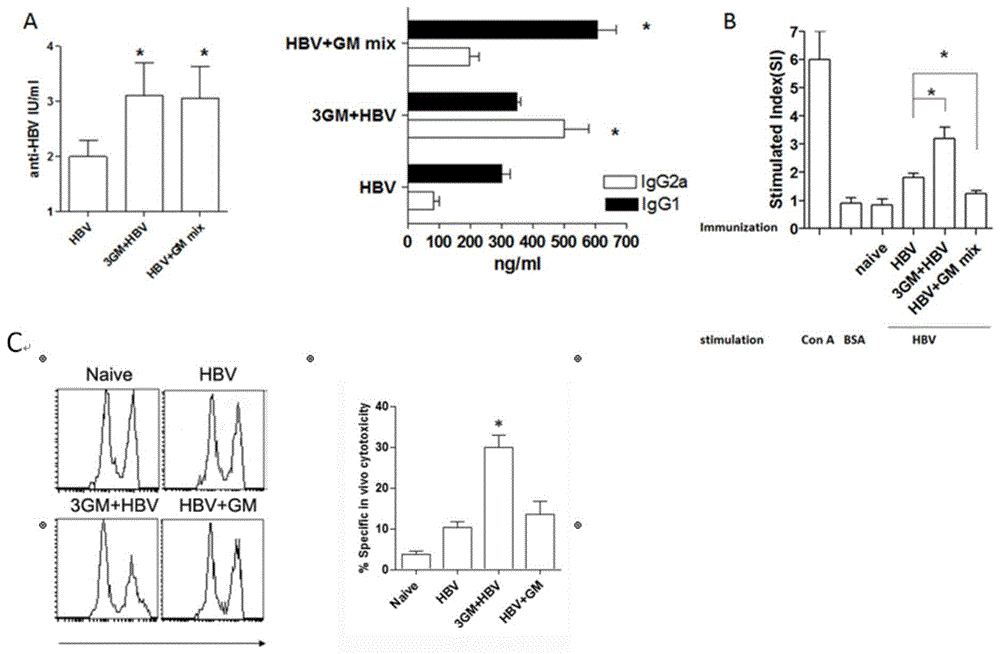
1.为了检测是否gm-csf能够影响hbv疫苗的体液反应,gm-csf进行提前或同时与hbv疫苗注射,加强免疫后第七天,检测了血清中抗hbsag总igg抗体,与只注射了hbv的小组相比,注射了gm-csf的小组总igg水平显著增强(图1-a);在免疫前3天注射gm-csf的小组,igg2a水平显著提高(p<0.05);相反,若gm-csf与hbv同时注射时,igg1水平显著提高(图2);数据表明gm-csf的预处理可以增强th1反应,而gm-csf与疫苗同时注射能够增强th2反应。
2.不同时间注射gm-csf对乙型肝炎疫苗t细胞水平的影响
进一步观察是否gm-csf会影响t细胞反应,在加强免疫后一周,无菌取小鼠的脾脏细胞,rhbsag抗原来刺激t细胞增殖,用bsa作为非特异性抗原对照,用cona作为阳性对照,用培养基作为阴性对照,结果表明在预注射gm-csf组中增殖反应显著提高,而在
gm-csf,hbv同时注射的小组中增殖反应水平低下(图1-b),表明了gm-csf预处理能够促进抗原特异性t细胞反应。
3.不同时间注射gm-csf对乙型肝炎疫苗体内ctl水平的影响
了解不同时间注射gm-csf对ctl反应的影响,在第二次免后7天,通过流式细胞仪检测ctl反应,如图1-c所示,gm-csf预处理组对靶细胞特异性的杀伤率为30.01%,明显高于单独免疫核酸疫苗组的杀伤率为10.26%,而hbv与gm-csf同时注射的组的杀伤率为13.6%,结果证明gm-csf预处理组能够增强体内ctl反应水平,而hbv与gm-csf同时注射组没有明显的变化。
4.不同时间注射gm-csf对乙型肝炎疫苗细胞因子水平的影响
细胞因子可以调节细胞分化、增殖和诱导细胞发挥相应功能,在调节免疫反应中起重要的作用,本实验通过胞内细胞因子染色的方法检测cd4+t细胞中抗原特异il-4,ifn-γ和cd8+t细胞中抗原特异ifn-γ的表达水平,如图2所示,gm-csf预处理组比只用hbv注射组的il-4,ifn-γ(cd4细胞中)水平和ifn-γ(cd8细胞中)水平都显著提高,然而,hbv与gm-csf同时注射的组中ifn-γ表达水平没有增强,只有il-4水平比对照组有所提高,这表明gm-csf预处理组能够同时提高th-1和th-2细胞因子的表达水平,而gm-csf与hbv疫苗同时注射只能够诱导th-2型细胞因子的表达。
实施例2:gm-csf联合重组乙肝疫苗免疫策略打破hbsag转基因小鼠免疫耐受诱导转基因小鼠抗乙肝表面抗原体液免疫应答
材料与仪器:
hbsag转基因小鼠(c57bl/6j-tg(alblhbv)44bri/jf4j)购自复旦大学附属上海市公共卫生临床中心。“乙型肝炎表面抗原酶联免疫法诊断试剂盒”及乙肝表面抗原标准品购自北京金豪制药股份有限公司。其他实验材料、主要试剂和仪器同实施例1。
试验方法:
动物分组及免疫方法:
hbsag转基因小鼠(c57bl/6j-tg(alblhbv)44bri/jf4j)35只(初始血清hbsag浓度为5000-10000pg/ml),随机分为5组,每组7只,实验分组按下表免疫实验组别设计;每组疫苗或gm-csf溶解在生理盐水中,每只小鼠注射100微升,每只小鼠颈部皮下注射进行免疫,各组小鼠免疫4次,前三次每次间隔14天,第四次免疫与第三次免疫间隔8周,每两周对小鼠进行眼眶采血,并用elisa方法检测转基因小鼠血清中的乙肝表面抗原及抗乙肝表面抗原抗体浓度。
免疫实验组别设计
乙肝表面抗原诊断试剂盒检测hbvs抗原转基因小鼠血清hbvs抗原:
1.抗原标准品(2mg/ml)稀释:从10^6开始做2倍梯度稀释。
取2ulag用pbs稀释到20ul(10x),取10ul用pbs稀释到1ml(100x2ug),取500u用pbsl稀释至1ml(2x1ug),继续2倍稀释14次。取最后7次稀释和pbs组做8点的标准曲线。
2.血清稀释:10x,50x,100x每个样品做3个副孔。
3.根据实验要求,选择一定量的反应条,每孔加入稀释好的样本75ul,留阴性对照,阳性对照,空白各一孔。
4.用封片纸封好,37℃孵育60min。
5.取出反应板,死去封片,各孔加入50ul酶底物复合物。震荡10s,封片纸封好37c孵育30min
6.取出反应板死去封片纸,洗涤5次。拍干。
7.将显色液a、b1:1配好,每孔加入100混匀的显色液,震荡10s,37℃孵育30min。
8.每孔加入50ul终止液,震荡混匀,用酶标仪度数,波长450nm,参考波长630nm。
乙肝表面抗体诊断试剂盒检测hbvs抗原转基因小鼠血清hbvs抗体
1.抗体标准品(40miu)稀释:从原液开始做2倍梯度稀释。稀释7次,加pbs组做8点的标准曲线;
2.血清稀释:10x,50x,100x每个样品做3个副孔;
3.根据实验要求,选择一定量的反应条,每孔加入稀释好的样本50ul,留阴性对照,阳性对照,空白各一孔。各孔加入50ul酶底物复合物。震荡10s,封片纸封好37c孵育30min;
4.取出反应板死去封片纸,洗涤5次。拍干;
5.将显色液a、b1:1配好,每孔加入100混匀的显色液,震荡10s,37c孵育30min;
6.每孔加入50ul终止液,震荡混匀,用酶标仪度数,波长450nm,参考波长630nm。
实验结果用t-检验进统计学分析,p<0.05差异显著,p<0.01差异极显著。
实验结果:
1.检测是否gm-csf联合重组乙肝疫苗免疫策略能打破hbsag转基因小鼠免疫耐并受诱导转基因小鼠抗乙肝表面抗原体液免疫应答,gm-csf进行提前或同时与hbv疫苗注射,每隔两周,检测小鼠血清中hbsag浓度及抗hbsag总igg抗体,和只注射了hbv的小组相比,3gm-csf+hbv的小组总igg水平显著增强(如图3所示),在第四次免疫后六周,前3天注射gm-csf的小组(3gm-csf+hbv),乙肝病毒表面抗原水平显著下降(p<0.05),结果说明3gm-csf+hbv组即前3天注射gm-csf的小组可以打破转基因小鼠免疫耐受并受诱导转基因小鼠抗乙肝表面抗原体液免疫应答,进而使乙肝病毒表面抗原水平保持较低状态,。而单纯注射hbv疫苗组以及gm-csf与hbv疫苗同时注射组都没有促进抗乙肝表面抗原抗体显著升高。
实施例3:gm-csf联合重组乙肝疫苗免疫策略打破hbsag转基因小鼠免疫耐受诱导转基因小鼠抗乙肝病毒表面抗原细胞免疫应答并清除肝脏中乙肝病毒表面抗原
材料与仪器:
hbsag转基因小鼠(c57bl/6j-tg(alblhbv)44bri/jf4j)购自复旦大学附属上海市公共卫生临床中心。乙肝表面s抗原免疫组化一抗、二抗购自上海长岛生物技术有限公司。其他实验材料、主要试剂和仪器同实施例1。
动物分组及免疫方法:
hbsag转基因小鼠(c57bl/6j-tg(alblhbv)44bri/jf4j)35只(初始血清hbsag浓度为5000-10000pg/ml),随机分为5组,每组5只,实验分组见下表。每组疫苗或gm-csf溶解在生理盐水中,每只小鼠注射100微升,每只小鼠颈部皮下注射进行免疫,各组小鼠免疫3次,每次间隔14天,第三次免疫后12天,进行迟发型超敏反应检测,第三次免疫后15天处死小鼠,分离脾细胞检测并取肝脏进行免疫组化实验。
免疫实验组别设计
迟发型超敏反应检测:
在第三次免疫后12天,所有的实验组和对照组均被右脚垫注射rhbsag抗原(2μg),左脚垫注射生理盐水。24小时,48小时,72小时分别采用游标卡尺检测脚垫厚度,按如下公式计算:肿胀厚度(mm)=右脚厚度(mm)-左脚厚度(mm),肿胀厚度的高低代表迟发型超敏反应水平(dth)的高低。
流式细胞仪检测细胞因子表达水平:同实施例1。
组织学检测:
在最后一次免疫后14天将hbsag转基因小鼠麻醉处理,制作肝脏组织固定、包埋和切片,分别进行h&e染色和免疫组织化学实验,免疫组织化学实验中采用的抗体为有抗hbsag的抗体。
制备组织切片:
(1)取样:麻醉处死转基因小鼠后,取出小鼠的肝脏组织;
(2)固定:将肝脏组织块迅速放入配制好的bouin固定液中;
(3)脱水、透明:用由低到高浓度的酒精,脱去组织中的水分;
(4)浸蜡:
蜡i56℃-58℃用时约1hrs;蜡ii56℃-58℃用时约1hrs;蜡iii56℃-58℃用时约1-2hrs;
(5)包埋:将组织块放入预先叠好的小纸盒中,加入蜡;
(6)修理蜡块:将蜡块修理成梯形,有利于蜡带的形成;
(7)切片:切片厚度约8-10μm;
(8)展片:将蜡带放入水浴展片机,调整温度为38度,待蜡带已经展开的时候,用载玻片将蜡带捞上来,在显微镜下观察,已确定选取组织形态;
(9)烤片:展片后尽快放入大于41℃不高于50℃温箱烘烤至少4个小时,使组织块与玻片牢固粘合。
组织切片的免疫组化:
(1)将组织形态比较好的组织切片进行梯度酒精复水,用pbs(0.01m;ph7.4)浸泡三次,每次5分钟;
(2)抗原修复:切片放入盛有柠檬酸缓冲液的容器中,置微波炉内高火加热5min×3,如液体损失,需补入热蒸馏水;
(3)用封闭用血清或bsa在37℃的烘箱内封闭至少1小时;
(4)倾去血清,勿洗,切片上覆盖适当比例稀释的一抗;27℃封闭1小时或4℃过夜;
(5)pbs冲洗3次,每次5min;
(6)滴加适当比例稀释的生物素标记二抗(1%bsa-pbs稀释),27℃孵育30~40min;
(7)pbs冲洗3次,每次5min;
(8)滴加适当比例稀释的三抗,27℃孵育30min;
(9)碱性磷酸酶显色;显色需要在避光条件下进行;ap显色结果阳性应为特异性的红色;
(10)自来水冲洗;
(11)复染:染色流程为苏木精染色1~3min,弱酸液(可在蒸馏水中滴加1~2滴1m的盐酸即可)进行返蓝处理1min,自来水冲洗3min即可。伊红染色直接进行,染色1min即可完成;
(12)脱水封片,通风橱中干燥后观察组织形态;
将切片存放到切片盒中,观察与照相注意合适的比例尺,色泽的调整以及适当阳性结果的选择。
实验结果用t-检验进统计学分析,p<0.05差异显著,p<0.01差异极显著。
实验结果:
1.gm-csf联合重组乙肝疫苗免疫增强了乙肝表面抗原转基因小鼠迟发型超敏反应水平:迟发型超敏反应是主要由t细胞介导的一种免疫反应,为了进一步确gm-csf联合重组乙肝疫苗免疫策略在体内诱导了强烈的细胞免疫水平,利用迟发型超敏反应水平来作为体内指标,根据实验分组进行免疫,三次免疫hbsag转基因小鼠(c57bl/6j-tg(alblhbv)44bri/jf4j)后12天,所有的实验组和对照组均被右脚垫注射rhbsag抗原,左脚垫注射生理盐水,24小时,48小时,72小时分别检测脚垫厚度,图4中可以看出只免疫乙肝疫苗组的dth水平比对照组较高,而gm-csf联合重组乙肝疫苗免疫策略组(3*gm-csf+hbv和30uggm-csf+hbv组)的dth水平比单独注射hbv疫苗要显著增强,说明gm-csf联合重组乙肝疫苗免疫策略组(3*gm-csf+hbv和30uggm-csf+hbv组)在体内诱导了强烈的细胞免疫水平。
2.gm-csf联合重组乙肝疫苗免疫策略增强了cd8+t细胞介导的dth,可能会提高杀伤性cd8+t细胞的活性,分泌ifn-γ的cd8+t细胞(tc1)和分泌il-17的cd8+t细胞(tc17)是两群关键的杀伤性cd8+t细胞,本实验进一步检测了免疫后小鼠cd8+t细胞的ifn-γ和il-17表达情况,三次免疫后15天,无菌取出脾脏,制备单细胞悬液,进行体外的乙肝表面抗原cd8+t细胞表位多肽的孵育,培养6小时后,进行胞内细胞因子染色,流式细胞仪分析细胞亚群的变化,图4可以看出gm-csf联合重组乙肝疫苗免疫策略能够促进cd4+t细胞、cd8+t细胞分泌ifn-γ和il-17的水平,而3*gm-csf+hbv免疫策略更多的是诱导th1、tc1的免疫反应,30uggm-csf混合hbv免疫策略更多是诱导th17、tc17的免疫反应。
3.在最后一次免疫后14天麻醉处理hbsag转基因小鼠,进行肝脏组织固定、包埋和切片,分别进行h&e染色和免疫组织化学实验,图5为乙肝病毒表面抗原转基因小鼠肝脏的乙肝病毒表面原免疫组化照片及图片光密度统计图,可以看出3*gm-csf+hbv免疫策略下的转基因小鼠的肝脏中的乙肝表面抗原得到了非常显著的清除,而30uggm-csf混合hbv免疫策略组虽然肝脏中乙肝病毒表面抗原有所下降,但没有3*gm-csf+hbv免疫策略清除显著,结果显示,由于gm-csf+hbv免疫打破了乙肝病毒表面抗原转基因小鼠的免疫耐受,诱导乙肝病毒表面抗原转基因小鼠产生了强烈的体液免疫及细胞免疫反应,有效的清除了血清中及肝脏中乙肝病毒表面抗原。
实施例4:不同时间注射一型干扰素对gm-csf联合重组乙肝疫苗免疫策略的影响
材料与仪器:重组人干扰素α1b注射液购自北京三元基因工程有限公司,50ug/1ml/支。其他实验材料、主要试剂和仪器同实施例1、2、3。
实验动物及免疫:实验动物及免疫:c57bl/6小鼠,spf级,6-8周龄雌性,体重16-18g,购于中国医学科学院实验动物研究所,分8组,每组6只小鼠,实验分组如表1所示;每组疫苗或gm-csf溶解在生理盐水中,每只小鼠注射100微升,每只小鼠颈部皮下注射进行免疫,第一次免疫后14天加强免疫一次,按照实验分组干扰素每只颈部皮下注射5*104u;
乙肝表面抗原elisa抗体检测、t细胞增殖实验、t细胞细胞因子流式细胞仪检测方法均参照实施例1。
cfse法测t细胞增殖:
1.常规处理小鼠,在75%乙醇中浸泡5-10min;
2.取小鼠脾脏,加600ulpbs或1640培养基,磨碎,铜网过滤大块组织,1500rpm离心3min,弃上清;
3.rbc裂解红细胞:每管加入700ulrbc裂解细胞2min(严格控制裂解时间),加入700ulfbs终止裂解,1500rpm离心3min弃上清,用1ml1640或pbs重悬细胞;
4.细胞计数,调整细胞浓度为1x107/ml;
5.取500ul重悬的细胞,取500ulpbs加入1ul1mm的cfse,将cfse溶液加入细胞中,充分混匀,颠倒十次;摇床37c避光染色10min,加入500ulfbs终止染色,2000rpm离心3min,加入15%bfs血清的1640或pbs洗3次;
6.细胞计数,用完全培养基调整细胞浓度为1x107/ml,充分混匀细胞;
7.将细胞分在96孔板中,每孔50ul细胞(5x105细胞/孔)每组3个平行;
8.加入刺激物:用完全培养基将刺激物配成浓度为终浓度2倍的培养基溶液,(50ul里含有0.1ulpma=0.2ug/ml,0.1ul离子霉素=2ug/ml)(anticd3终浓度为2ug/mlanticd28终浓度为0.1ug/ml),抗原刺激物为10ug/ml;
9.37c培养72小时,流式检测,可以在检测前染cd8抗体。
实验结果用t-检验进统计学分析,p<0.05差异显著,p<0.01差异极显著;
实验结果显示:
1.第二次免疫后14天通过乙肝表面抗体elisa检测发现(见图6-a),在hbv疫苗注射前一天注射ifn-a1b与对照组相比可显著降低抗乙肝病毒表面抗原抗体水平,特别是ifn-a1b与乙肝疫苗混合注射组体液免疫水平得到了显著抑制,说明在乙肝疫苗注射前一天或混合乙肝疫苗注射一型干扰素,会影响乙肝疫苗的体液免疫水平。
2.通过cfse法体细胞增殖实验(图6-b)以及cd4+t细胞ifn-γ、il-17胞内染色流式细胞仪检测(图6-c),发现干扰素对gm-csf联合重组乙肝疫苗免疫诱导的cd8细胞的免疫反应影响不显著。
实施例5:抗病毒药物、干扰素、gm-csf联合乙肝疫苗免疫策略对慢性乙肝病人的临床治疗效果评估
患者,男,56岁,2004年5月确诊为hbeag阳性慢性乙型肝炎,其母亲hbsag阳性;从2009年5月开始使用恩替卡韦治疗,2年后发生hbeag血清转换,2012年5月给予本发明药物复合物干预,包括聚乙二醇干扰素α-2a皮下注射,180ug/周,同时联合粒细胞巨噬细胞集落刺激因子(gm-csf)和乙肝疫苗免疫干预,gm-csf每天1次肌肉注射75ug,连续注射3天,第4天在同一部位注射1次乙肝疫苗20ug,此免疫干预程序分别在干扰素治疗的第1、2、3、6、9、12个月使用1次,gm-csf在干扰素注射后2-3天使用,在使用干扰素治疗3个月后,停用恩替卡韦,结果显示:经过上述干预后7个月后,患者hbsag转阴,抗hbs水平有升高趋势。
- 还没有人留言评论。精彩留言会获得点赞!