一种低强度聚焦涡旋声场辅助的超声精细高效溶栓系统的制作方法
本发明属于超声物理、控制与治疗领域,具体涉及一种低强度聚焦涡旋声场辅助的超声精细高效溶栓系统。
背景技术:
2010年世界卫生组织报告显示,心血管疾病死亡占全球死亡原因的首位,其中众多心、脑及外周血管疾病的发生都与血栓的形成有关,因而安全、高效溶栓意义重大。目前,血栓的临床治疗主要包括药物溶栓、血管内导管介入取栓或二者结合等方式,然而,药物溶栓具有治疗效率低、适用患者有限以及易引起大出血等问题,而血管内导管的引入则存在有创、易感染、仅适用于大尺寸血管(直径大于2mm)等弊端。
研究表明,药物溶栓治疗时低强度聚焦超声的引入可以有效促进溶栓药物向血栓内部的渗透、提高溶栓效率,但仍存在药物引发出血并发症的可能。超声与造影微泡的结合也被证明是一种高效、非药物的溶栓方式,但却因超声作用下微泡的不可控破裂存在损伤血管壁的风险。此外,大量的离体和活体实验结果表明,高强度聚焦超声提供了一种靶向、高效、非药物的溶栓方式,可以实现血栓的快速溶解,并且可以方便地利用超声设备对治疗过程进行实时监控,因而具有极大的临床应用潜力。然而,目前临床医生对高强度聚集超声溶栓技术的安全性仍存在担忧,因为其溶栓过程中会产生大量(百万级)直径在10μm以上的血栓碎片,而人体微血管直径小于10μm,因而存在大尺寸血栓碎片堵塞下游血管、造成二次栓塞的风险。此外,如何进一步提升高强度聚焦超声溶栓的效率也是临床需要解决的问题。
有学者研究发现,相对于常规的超声行波溶栓模式,利用高强度聚焦超声驻波场进行溶栓时可以明显降低溶栓过程中产生的大尺寸血栓碎片的比例,血栓碎片的平均尺寸也明显下降,并进一步指出这是因为驻波场中存在的声势阱可以将血栓碎片局限在声场焦域,从而促进血栓的充分破碎。然而,超声驻波场的产生需要两个超声换能器或一个超声换能器和一个声反射板相对放置,并且要求靶向区域位于二者之间,从而极大地限制了超声驻波场在活体条件下的应用空间。此外,驻波场中多个波节、波腹的存在也使得高强度聚焦超声驻波溶栓时存在损伤靶向区域外健康组织和器官的风险。
涡旋声场提供了另一种产生声势阱的方式,其可以由位于靶向区域一侧的单个超声换能器或换能器阵列产生,因此相对于传统的超声驻波场具有更加灵活的空间可操作性,更适用于活体条件下的应用。目前,基于涡旋声势阱的微粒声操控技术已经吸引了众多研究学者的注意,中国专利cn109261472a公开了一种空间聚焦涡旋声场的产生装置及方法,其将聚焦涡旋声场应用在了对造影微泡进行空间聚集中,但目前尚缺乏涡旋声场在生物医学相关领域具体应用的研究。
综上所述,现有高强度聚焦超声溶栓技术存在血栓碎片尺寸过大的弊端,而基于驻波场的超声精细溶栓技术也具有一定的局限性和隐患,此外,超声溶栓技术还存在提高溶栓效率的必要性。
技术实现要素:
本发明的目的在于提供一种低强度聚焦涡旋声场辅助的超声精细高效溶栓系统,从而实现对活体条件下血栓的超声精细、快速溶解。
为了达到上述目的,本发明采用了以下技术方案:
一种低强度聚焦涡旋声场辅助的超声精细高效溶栓装置,该装置包括一个用于利用所产生的高强度聚焦超声声场进行溶解血栓(溶栓)的高强度聚焦超声换能器和一个与该超声换能器的声场焦域互相重叠的用于利用所形成的低强度(避免产生空化)聚焦超声涡旋声场对溶栓过程中产生的血栓碎片和空化微泡进行捕捉和聚集的低强度聚焦超声涡旋换能器,通过将血栓碎片和空化微泡局限于高强度聚焦超声声场焦域(涡旋声场不存在多个波节波腹带来安全隐患的问题,所以不需要调控),从而促进血栓的精细、高效溶解。
优选的,所述低强度聚焦超声涡旋换能器为球形聚焦超声换能器,从而可以方便地形成聚焦涡旋声场。
优选的,所述高强度聚焦超声换能器的频率为1~3mhz,可以产生较好的超声聚焦效果,形成能量集中的超声声场,同时避免频率过高时组织对超声的过度衰减,保证焦域内声压的强度。
优选的,所述高强度聚焦超声声场的负压极值为3~10mpa,可以在血管内产生所需的空化微泡,并且激励微泡发生稳态和惯性空化,从而破碎血栓,同时减小对焦域外组织和器官的附加损伤。
优选的,所述低强度聚焦超声涡旋换能器的频率为0.5~1mhz,可以产生较大的涡旋声势阱范围,同时保证涡旋声场中能量集中,从而对血栓碎片和空化微泡产生较强的声辐射力,实现对二者的高效捕捉。
优选的,所述低强度聚焦超声涡旋换能器的阵元数为8~20个,可以产生声压分布连续、均匀的涡旋声场,同时避免因阵元数目过多导致驱动系统过于复杂的问题。
优选的,所述低强度聚焦超声涡旋声场的拓扑荷数为1~2,对应涡旋声场的阶数为1~2阶,便于产生所需强度下的声压连续均匀分布的涡旋声场,从而实现对血栓碎片和空化微泡的高效捕捉与聚集,同时避免高拓扑荷时因涡旋声场焦域过大而导致对治疗区域外粒子的随机捕获。
优选的,所述低强度聚焦超声涡旋声场的负压极值为0.3~0.8mpa,使涡旋声场可以对血栓碎片和空化微泡产生有效的捕捉,同时避免因涡旋声场声压过高而对组织和器官产生附加的损伤。
优选的,所述低强度聚焦超声涡旋换能器与高强度聚焦超声换能器组成复合超声换能器探头,便于活体条件下将以上两个换能器的声场焦域重叠区域精准定位于血栓。
优选的,对于活体血栓模型条件,静脉注射一定浓度的临床超声微泡造影剂,利用上述涡旋声场对血管内的微泡进行聚集,同时利用超声成像设备(例如b超设备)对涡旋声场焦域所处区域进行成像观察。涡旋声场作用下,焦域内微泡聚集形成团状聚集体(微泡聚集体),在超声(b超)图像上呈现为焦域区域内像素值的明显增强,通过对涡旋声场施加前后靶向区域(血栓位置)内像素值变化的观察可以准确地对微泡聚集体的位置进行确定,进而确定涡旋声场焦域的准确位置,由于上述复合超声换能器探头中高强度聚焦超声换能器和低强度聚焦超声涡旋换能器的声场焦域互相重叠,因此,通过确定涡旋声场焦域的准确位置即可将焦域重叠区域精确定位于透血栓内部。
一种低强度聚焦涡旋声场辅助的超声精细高效溶栓调控(包括共焦操作)装置,该调控装置包括上述高强度聚焦超声换能器和上述低强度聚焦超声涡旋换能器,还包括透明血管仿体、用于放置该仿体的水箱、用于实时观察透明血管仿体(例如观察仿体内由于涡旋声场引起的微泡聚集)的高速显微成像系统,以及用于检测所述高强度聚焦超声换能器在其声场焦域作用于透明血管仿体时的超声回波信号幅值的主动空化检测系统。
一种低强度聚焦涡旋声场辅助的超声精细高效溶栓调控(包括共焦操作)方法,该调控方法包括以下步骤:
1)调节上述低强度聚焦超声涡旋换能器的驱动参数,使其相邻超声阵元间的驱动信号保持固定的相位差,而不同阵元驱动信号的功率保持一致,同时控制功率的幅值,从而产生所需的低强度(避免产生空化,例如,声压负压极值为0.3~0.8mpa)聚焦超声涡旋声场;
2)调节上述高强度聚焦超声换能器的空间位置,使得该超声换能器产生的高强度(产生空化)聚焦超声声场的焦域与所述低强度聚焦超声涡旋声场的焦域重叠(使高强度聚焦超声声场的焦域落入涡旋声场的焦域内);
3)调节血栓的空间位置,使得所述低强度聚焦超声涡旋声场和高强度聚焦超声声场的焦域重叠区域精确定位于透明血管仿体内的血栓内部。然后可以调节以上提及的换能器参数,并观测相应的溶栓效果。
优选的,所述调控方法还包括以下步骤:对于离体血栓模型条件,利用高速显微成像系统对低强度聚焦超声涡旋声场内微泡的运动过程进行观察,确定该涡旋声场焦域的准确位置。
优选的,对于离体血栓模型条件,利用主动空化检测技术确定高强度聚焦超声声场焦域的准确位置,并利用三维装置对其进行调节,保证上述高强度聚焦超声换能器和上述低强度聚焦超声涡旋换能器的焦域的准确重叠。
优选的,对于离体血栓模型条件,利用高速显微成像系统对血栓的位置进行观察、确定,进而在光学图像监控下利用三维装置将血栓移动到上述两个换能器的声场焦域的重叠区域(利用三维装置对仿体位置进行调节,使得上述两个声场焦域准确重叠于血栓内部),利用超声成像设备对超声溶栓过程进行实时观察;对于活体血栓模型条件,利用超声成像设备对血栓的位置进行确定,并对超声溶栓过程进行实时观察。
本发明的有益效果体现在:
相对现有的高强度聚焦超声溶栓技术,本发明通过低强度聚焦涡旋声场辅助,将溶栓过程中空化微泡和血栓碎片捕捉、聚集于声场焦域来增强空化微泡与血栓及其碎片间的相互作用,不仅降低血栓碎片尺寸,而且可以提高溶栓效率,从而提供了一种更加安全高效的超声溶栓方式。本发明由可位于治疗区域一侧的低强度聚焦超声涡旋换能器产生所需的声势阱,声操控区域仅局限于涡旋声场焦域,相对于高强度聚焦超声驻波溶栓技术,本发明具有更好的灵活性和安全性,更适用于活体条件下的超声溶栓治疗。
附图说明
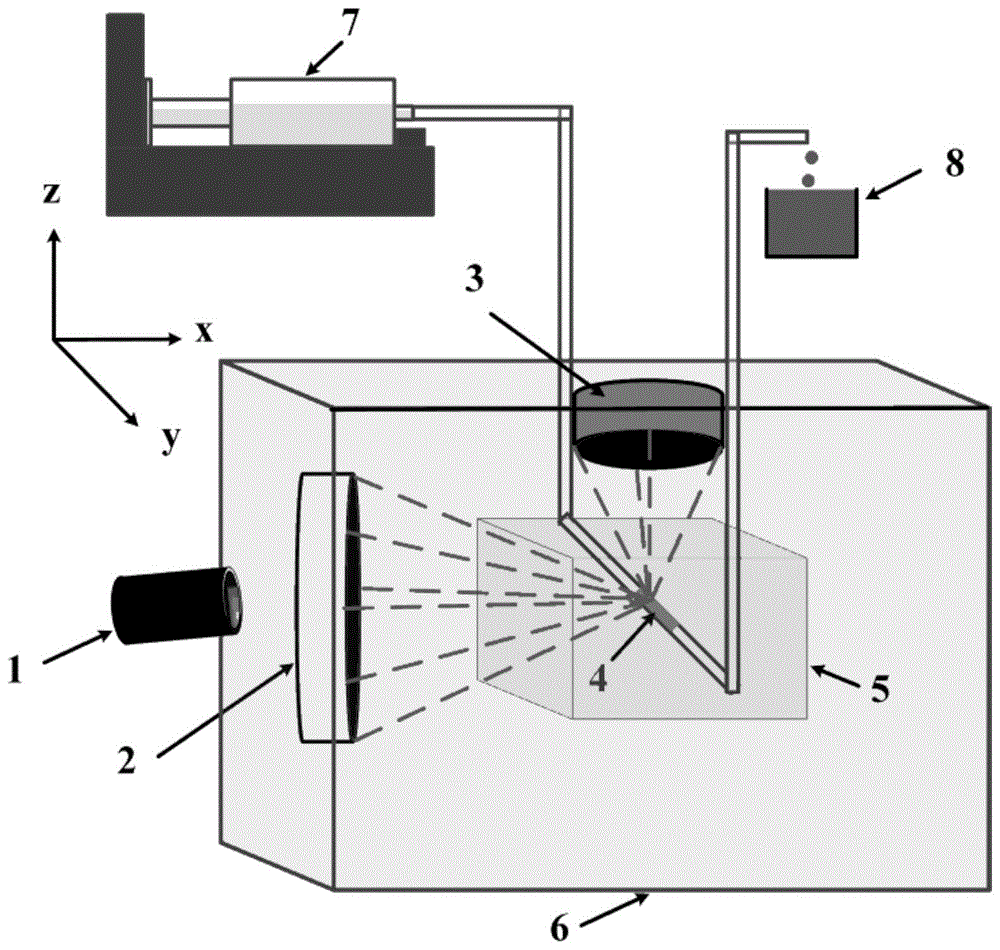
图1是低强度聚焦涡旋声场辅助的超声精细高效溶栓实验系统的示意图;其中:1.高速显微摄像机,2.低强度聚焦超声涡旋换能器,3.高强度聚焦超声换能器,4.血栓,5.血管仿体,6.水箱,7.脉动泵,8.烧杯。
图2是有无涡旋声场条件下高强度聚焦超声溶栓过程中产生的血栓碎片的尺寸分布,其中(a)、(b)分别为不同直径血栓碎片的数目百分比、体积百分比分布。
图3是有无涡旋声场条件下高强度聚焦超声溶栓过程中产生的不同尺寸区间内血栓碎片的体积百分比分布,其中(a)、(b)、(c)分别对应为直径在2-10μm、10-30μm、30-60μm内的血栓碎片(***p<0.001)。
图4是有无涡旋声场条件下高强度聚焦超声溶栓过程中产生的血栓碎片的平均尺寸对比(***p<0.001)。
图5是有无涡旋声场条件下高强度聚焦超声溶栓效率的对比(*p<0.05)。
具体实施方式
下面结合附图和实施例对本发明做进一步的详细说明。
参见图1,本发明提出的低强度聚焦涡旋声场辅助的超声精细高效溶栓方法,利用高强度聚焦超声声场对血栓进行溶解,同时利用低强度聚焦超声涡旋声场对血栓碎片和空化微泡进行聚集,最终在血管仿体内实现了血栓的超声精细、高效溶解,具体包括以下步骤:
步骤一、安置多阵元低强度聚焦超声涡旋换能器、单阵元高强度聚焦超声换能器、透明血管仿体和高速显微摄像机,精确调节四者之间的相对空间位置。具体空间位置是按照以下方式排布的:
利用丙烯酰胺凝胶制成的透明血管仿体5模拟离体的含血管组织,将其沿图1中y轴方向放置在水箱6内;低强度聚焦超声涡旋换能器2固定在水箱6的一侧,其轴向沿x轴方向;高强度聚焦超声换能器3利用三维装置放置在水箱6上方,其轴向沿z轴方向;血栓4位于透明血管仿体5内部,利用三维装置调节血管仿体5位置,使得上述两个超声换能器(低强度聚焦超声涡旋换能器和高强度聚焦超声换能器)焦域重叠区域位于血栓4内部;高速显微摄像机1沿x轴方向放置,摄像镜头光路经由低强度聚焦超声涡旋换能器2的中央孔洞到达血管仿体5,用于对溶栓过程进行实时监控。
其中上述两个超声换能器焦域位置的准确重叠通过以下步骤实现:1)首先利用三维装置调节透明血管仿体5沿z轴方向的位置,使得透明血管仿体5与低强度聚焦超声涡旋换能器2等高,之后沿x轴方向调节透明血管仿体5的位置,使得其距离低强度聚焦超声涡旋换能器2表面的距离等于该换能器的焦距;2)利用脉动泵7向透明血管仿体5内泵入含有一定浓度造影微泡的生理盐水溶液,待该溶液静止后驱动低强度聚焦超声涡旋换能器2,在血管仿体内产生低强度聚焦涡旋声场进而对微泡进行聚集,此时微泡将聚集于涡旋声场焦域,利用高速显微摄像机1对微泡的聚集区域进行确定,调节透明血管仿体5的位置使得微泡聚集体位于血管仿体中央,并在光学图像中对微泡聚集体位置进行标记;3)将高强度聚焦超声换能器3放置于透明血管仿体5上方,利用脉动泵7向透明血管仿体5内泵入空气,关闭低强度聚焦超声涡旋换能器2,驱动高强度聚焦超声换能器3,向透明血管仿体5内发射脉冲声波并同时利用示波器检测回波幅值,调节高强度聚焦超声换能器3沿x轴的位置,当回波幅值最大时表明此时高强度聚焦超声换能器3位于透明血管仿体5正上方,固定其在x轴的位置;4)调节高强度聚焦超声换能器3沿z轴的位置,并同步检测回波幅值,当回波幅值最大时表明此时超声换能器3的焦域位于血管仿体正中央,固定其在z轴的位置;5)利用脉动泵7向透明血管仿体5内泵入一段空气气柱,接着向透明血管仿体5内泵入生理盐水溶液,控制透明血管仿体5内溶液体积使得光学图像中微泡聚集体位置处出现一个气液交界面(气液界面是由脉动泵泵入空气和溶液形成,利用脉动泵来控制泵入溶液的体积,进而调节透明血管仿体5内气液交界面的位置),沿y轴方向调节高强度聚焦超声换能器3的位置,并实时观察回波幅值的变化,当回波幅值变为步骤4)中回波幅值最大值的一半时表明此时高强度聚焦超声换能器3的焦域位于气液交界面处(即低强度聚焦超声涡旋换能器的焦域所处位置),固定高强度聚焦超声换能器3在y轴的位置,完成两个超声换能器间的共焦操作。
步骤二、利用电子天平称量血栓4的重量,然后利用脉动泵7将其引入透明血管仿体5内,利用三维装置调节透明血管仿体5位置,将血栓4调节到已经标记于光学图像中的两个超声换能器的焦域重叠区域,使得低强度聚焦超声涡旋换能器2和高强度聚焦超声换能器3的焦域重叠区域位于血栓4的内部。
步骤三、利用脉动泵7向透明血管仿体5内泵入纯净的生理盐水溶液,待溶液静止后驱动低强度聚焦超声涡旋换能器2(阵元数为16,拓扑荷为1),在血管仿体内形成低强度聚焦超声涡旋声场(负压极值:500kpa,频率:660khz),然后驱动高强度聚焦超声换能器3,在血管仿体内产生高强度聚焦超声场(负压极值:4.34mpa,频率:1.6mhz),进而溶解血栓。其中低强度聚焦超声涡旋换能器2以连续模式进行工作,高强度聚焦超声换能器3以脉冲模式进行工作,脉冲长度为200μs,占空比为10%,每次溶栓时间为60s。
步骤四、超声溶栓后,利用脉动泵7将含血栓碎片的生理盐水溶液泵出血管仿体,利用干净的烧杯8收集血栓碎片溶液,并小心地从血管仿体内移出剩余的血栓。
步骤五、利用粒度仪对血栓碎片溶液中碎片的尺寸分布进行测量,利用电子天平称量剩余血栓的质量,进而对碎片的尺寸分布和超声溶栓的效率(即血栓质量下降比)进行量化分析。
其中,粒度仪测量碎片尺寸时使用的是孔径为100μm的小孔管,对应碎片直径测量范围为2-60μm,这与已发表文献中所用小孔管尺寸相一致。从粒度仪测量结果中可得直径在di-1与di间血栓碎片的数目百分比pni和体积百分比pvi,进而可以分别利用两种计算方法量化碎片的平均尺寸,即利用碎片尺寸分布的数目百分比计算得到血栓碎片的平均直径dnum,和利用血栓碎片尺寸分布的体积百分比计算得到的碎片平均直径dvol,具体表达式如下:
当高强度聚焦超声换能器工作参数保持不变时,利用粒度仪测量得到有无低强度聚焦涡旋声场条件下超声溶栓过程中产生的血栓碎片的尺寸分布,由图2可知,当其他条件保持不变时,低强度聚焦涡旋声场的施加可以有效降低大尺寸血栓碎片的数目和体积百分比。
在其他条件保持不变时,有无涡旋声场条件下高强度聚焦超声溶栓过程中产生的不同尺寸区间(2-10μm,10-30μm,30-60μm)内血栓碎片的体积百分比分布如图3所示。相对于常规的单独利用高强度聚焦超声进行的溶栓,低强度聚焦涡旋声场辅助的超声溶栓技术中产生的直径在2-10μm间的血栓碎片的体积百分比明显增大,对应的直径在10μm以上的血栓碎片的体积百分比明显减小,从而降低了大尺寸血栓碎片堵塞下游微小血管的风险。
参见图4,通过将在其他条件保持不变时,有无涡旋声场条件下高强度聚焦超声溶栓过程中产生的血栓碎片的平均尺寸进行对比,可知相对于常规的单独利用高强度聚焦超声进行的溶栓,低强度聚焦涡旋声场辅助的超声溶栓技术产生的血栓碎片的平均尺寸明显下降,从而提供了一种更加精细的超声溶栓方式,提高了超声溶栓的安全性。
参见图5,通过将在其他条件保持不变时,有无涡旋声场条件下高强度聚焦超声溶栓的效率进行对比,可知在相同超声溶栓参数条件下,相对于常规的单独利用高强度聚焦超声进行的溶栓,低强度聚焦涡旋声场辅助的超声溶栓技术的效率明显提高,从而提供了一种更加高效的溶栓方式,有利于实现血栓的快速充分溶解。
- 还没有人留言评论。精彩留言会获得点赞!