一种改性医用镁合金材料及其制备方法与流程
本发明涉及生物医学与材料工程的交叉领域,具体涉及一种改性医用镁合金材料及其制备方法。
背景技术:
目前在治疗骨折、矫形及移植手术中,一般采用的内固定拉力螺钉为钛合金及不锈钢材质。这些高密度金属材料在ct/mri造影检查过程中会产生不可避免的伪影,最终影响医生对影像图片信息的读取和治疗方案的制定。此外,由于上述金属材料在体内不可降解,因此在骨折愈合后需要二次手术取出,增加了病人的经济和生理负担。
现有骨科可降解材料如:聚乳酸(polylacticacid,pla)、聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolicacid),plga)、羟基磷灰石(ha)、磷酸三钙(tcp)等体内可降解材料,但存在以下问题:①体内完全降解时间较长,通常需要3年以上;②由于上述可降解材料及材料复合物密度低于骨组织或非常接近骨组织,x线、ct和mri检测时很难区分材料与骨组织的界限,导致医生读取影像信息困难;③上述材料及材料复合物力学强度远低于金属材料,在手术过程中极易碎裂,导致固定骨折效果不佳。
为了解决现有骨科可降解材料的不足,镁基金属材料成为这些材料的最具有潜力的替代品,其具有较快的降解速率,较高的力学强度、接近自然骨的密度以及全降解产物无毒性等特征。但镁基金属材料直接用于骨科植入仍需要解决如下问题:(1)镁合金可控降解速率,在骨折固定后三个月内保持较低的降解速率,尤其在植入第一个月内需要保持1/10以下的降解速度,其目的在于保证镁合金螺钉在3-6个月内具有足够的力学强度和骨折固定的稳定性。同时,缓慢降解产生的氢气和oh-在局部可以完全代谢,以及低浓度镁离子具有更好的生物活性。(2)表面涂层改性成为实现上述目的重要技术,但结合临床转化的要求,新型涂层需要满足以下要求:①良好的生物安全性和生物相容性;②涂层与镁合金表面足够强度的黏合力,能够抵抗在手术过程中的磨损和掉落;③涂层本身在体内的可降解性,在3-6个月内涂层自身逐渐降解,暴露出镁合金基体,以利于镁合金材料的降解。
技术实现要素:
发明目的:本发明的目的是克服现有临床内固定材料的不足,以及克服现有医用镁基金属材料的过快腐蚀性,本发明所要解决的技术问题是提供了一种改性医用镁合金材料的制备方法,该方法修饰的医用镁基金属材料具有可控的降解速率,较高的涂层粘附力以及安全的降解产物。
本发明还要解决的技术问题是提供了一种改性医用镁合金材料及其应用。
为了解决上述技术问题,本发明采取了如下的技术方案:一种改性医用镁合金材料,所述医用镁合金材料从内到外依次包括镁基金属材料、具有微纳结构的陶瓷涂层、脂溶性调控涂层和可降解的高分子涂层。
其中,所述镁基金属材料包括镁铝合金或镁稀土合金中的一种或两种。
本发明内容还包括所述的改性医用镁合金材料的制备方法,包括以下步骤:
1)通过在镁基金属材料表面进行预处理得到具有微纳结构的陶瓷涂层;
2)在具有微纳结构的表面加入长链烷基分子制备脂溶性调控涂层;
3)在脂溶性调控涂层表面加入可降解高分子制备可降解的高分子涂层;
4)利用真空热处理去除残余溶剂即得改性医用镁合金材料。
其中,步骤1)中所述的预处理方法包括碱活化处理和高温高压水热处理。
其中,步骤2)中所述的长链烷基分子为油酸、硬脂酸或十八烷基硅烷中的一种或几种。
其中,步骤2)中所述制备脂溶性调控涂层的方法为浸涂处理。
其中,步骤3)中所述的可降解高分子为聚乳酸、聚乳酸-羟基乙酸共聚物或聚三亚甲基碳酸酯中的一种或几种。
其中,步骤3)中所述的制备可降解的高分子涂层方法为浸涂或超声喷涂中的一种或几种。
其中,所述高温高压水热法预处理具体步骤为:将清洗过的镁基金属材料浸泡于超纯水中,在高压反应釜内,调节温度到120~200℃,处理1~9小时,最后用双蒸水和乙醇清洗并120℃高温处理2小时,备用。
其中,所述浸涂处理具体步骤为:将高温高压水热预处理的镁基金属材料浸泡于硬脂酸乙醇溶液中,50℃保持6~12小时,之后用50℃乙醇清洗3遍并置于80℃干燥箱处理6~12小时即可。
其中,所述碱活化处理具体步骤为:将清洗过的镁基金属材料浸泡于50~80℃的3摩尔每升的氢氧化钠溶液中,处理6~12小时,取出后超纯水超声清洗干燥,备用。
其中,在步骤3)中本发明用于溶解可降解高分子的溶剂为二氯甲烷(ch2cl2)三氯甲烷(chcl3)和乙酸异戊酯中的一种。
本发明根据对镁基金属材料的预处理,调控其表面的微纳结构,同时利用不同长链烷基分子调控其表面的脂溶性,最终提高其表面可降解高分子涂层的粘附力和质量,使这种具有组合涂层的医用镁基金属材料成为理想的骨折植入材料。
有益效果:与现有技术相比,本发明具有以下优点:
1、优异的机械性能和影像学可视性:经过表面多重组合涂层处理的医用镁基金属材料保持了其优异的机械性能,使其在服役期间能够保持良好的力学功能。镁合金材料密度介于骨组织和钛合金之间,在x-ray、ct和mri检测中既能与骨组织区分,又不会形成伪影,有利于骨科医生直观观察骨折固定情况、骨折愈合情况和材料降解情况。
2、镁合金材料降解速率降低且可控:镁合金表面多重防护层的存在,阻止电解液到达镁合金表面,极大地降低了镁合金的降解速率,延长了植入器件的使用寿命,解决了镁合金材料或器件在使用初期力学衰减快、降解速率高的问题,避免了因镁合金材料降解而导致的提前失效的问题,同时又保持了镁合金器件或材料所具备的降解性能。
3、使用安全,满足临床需要:镁合金在体内生理环境下可逐步被腐蚀降解并被肌体吸收或代谢,其降解产物主要是人体所需的镁离子,氢气以及氢氧根离子,镁合金材料所含其他合金元素成分及含量均在生物安全性范围之内,因此选择该镁合金材料制备可降解医用植入器件生物安全性可得到保障。同时,生物可降解高分子涂层材料在生物体内通过水解反应降解最终产物如:乳酸、co2和h2o等高安全性小分子,可被安全地吸收和代谢。
4、通过对无机转化膜和有机涂层的化学和物理性质的调控,譬如无机转化膜的种类、有机涂层的厚度,实现速率可控的镁合金基体力学衰减和降解,满足不同治疗期的骨科创伤固定和不同基础疾病患者的不同的具体需求。
5、经涂层防护后,镁合金片材或棒状材料在骨折线周围降解产生低浓度的镁离子显著促进骨折的愈合,尤其促进骨质疏松骨折等难愈合骨折的愈合。
6、制备工艺简单、原料等成本低,便于工业化生产。
附图说明
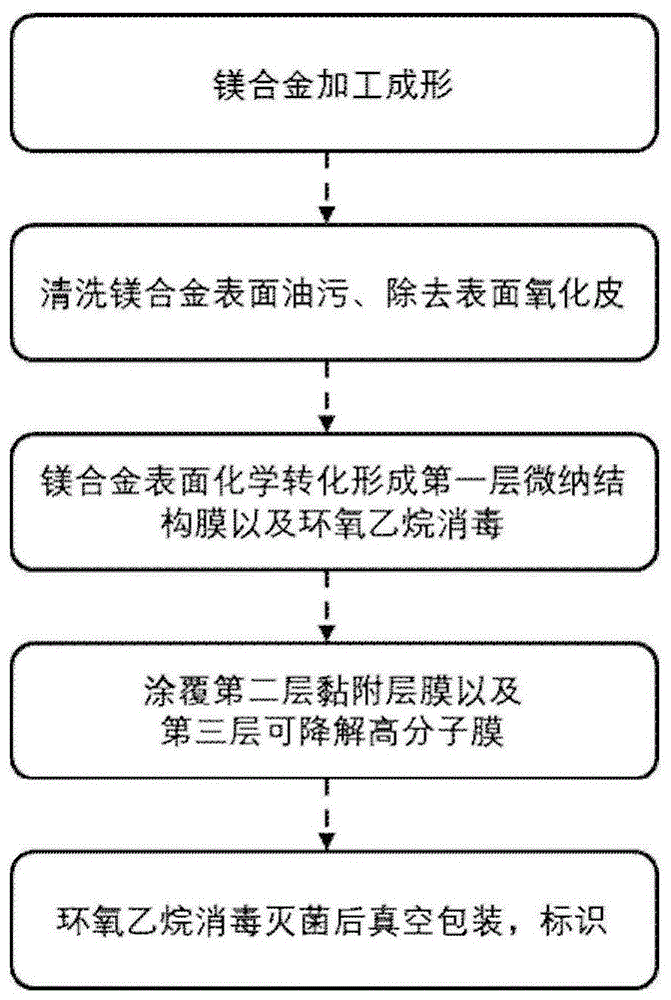
图1为本发明制备技术路线图。
图2本发明的镁基材料表面组合涂层的截面示意图。图中1表示可降解高分子涂层,2表示脂溶性调控涂层,3表示微纳结构的陶瓷涂层,4表示镁合金基底。
图3本发明的碱活化预处理az31的高倍扫描电镜照片。
图4本发明的高温高压预处理az31的高倍扫描电镜照片。
图5本发明的az31高温高压预处理的硬脂酸修饰水接触角照片。
图6本发明az31高温高压预处理和硬脂酸修饰后的ptmc涂层粘附力数码照片。
图7本发明az31高温高压预处理和硬脂酸修饰后的ptmc涂层的耐腐蚀性能测试(电化学极化测试)。
图8az31高温高压预处理和硬脂酸修饰后的ptmc涂层的体外模拟降解实验(37±0.5℃pbs溶液浸泡30天的析出氢气量检测)。
图9az31高温高压预处理和硬脂酸修饰后的ptmc涂层的体外模拟降解实验(37±0.5℃pbs溶液浸泡30天的micro-ct图片)。
图10为az31高温高压预处理和硬脂酸修饰后的ptmc涂层的体内3个月植入的降解和新骨生成检测图(micro-ct图片,三角形为腐蚀区域,圆形为新生成骨)。
图11本发明的we43表面碱活化处理后油酸修饰水接触角照片。
图12本发明为az31表面经高温高压预处理后,再利用硬脂酸修饰后的plga涂层涂覆扫描电镜照片。
图13本发明为az31表面碱活化预处理后油酸修饰水接触角照片。
具体实施方式
下面结合附图和实施例对本发明作进一步的说明。
实施例1一种az31表面组合涂层材料的制备
1、选取镁铝合金(az31),其化学成分(均为质量百分数)为:al:3.1%;zn:0.8%;mn:0.15%,si:0.06%,余量为mg,其他杂质元素<0.05%;
2、将az31原材料利用压铸和激光切割的方法制备成直径为3-10mm的圆柱形镁合金材料az31合金螺钉,螺钉直径公差为±0.1mm,长度1-3m,公差±3mm;
3、表面清洗:将加工好的az31合金螺钉在浓度为10~30wt.%的三氧化铬水溶液,室温下浸泡5~10分钟,随后依次在丙酮和乙醇中超声清洗10分钟,保护气体下干燥,备用;
4、高温高压水热法预处理:将清洗过的az31合金螺钉基体浸泡于超纯水中,在高压反应釜内,调节温度到160℃,处理3小时,最后用双蒸水和乙醇清洗并120℃高温处理2小时,备用;
5、脂溶性调控处理:将高温高压水热预处理的az31合金螺钉浸泡于硬脂酸乙醇溶液中(2.5mg/ml),50℃保持12小时,之后用50℃乙醇清洗3遍并置于80℃干燥箱处理6小时,备用;
6、可降解高分子膜的涂覆处理:
①用二氯甲烷有机溶剂溶解聚三亚甲基碳酸酯(poly(trimethylenecarbonate),ptmc),根据高分子分子量配置为浓度为1%(质量百分比)的高分子溶液,用磁力搅拌完全溶解,备用。
②采用浸涂表面的涂覆工艺,将上述制备的ptmc溶液涂覆至胶粘剂涂覆后的az31合金螺钉表面。涂层厚度由溶液浓度和浸涂次数决定,厚度可为10~300μm,备用。
③成膜后将样品置入真空干燥箱中,真空60℃处理12小时,真空值为1~100pa。
7、组合涂层az31合金螺钉消毒备用:最后完成的组合涂层az31镁合金螺钉采用环氧乙烷消毒灭菌,医用级高分子塑料真空包装,封装袋标识,干燥冷藏保存。
实施例2一种we43合金片材表面组合涂层材料的制备
1、选取镁铝合金(we43),其化学成分(均为质量百分数)为:y:3.7-4.3%;nd+gd:2.3-3.5%;zr:0.05-0.5%,余量为mg,其他杂质元素<0.5%。最佳成分:y:4.0%,nd:2.25%,zr:0.5%,mg:93.7%。
2、将we43原材料利用压铸和激光切割的方法制备成片状镁合金,其规格为宽10mm,长10mm,高1mm,公差为±0.1mm。
3、表面清洗:将加工好的we43合金片材在浓度为10~30wt.%三氧化铬水溶液,室温下浸泡5~10分钟,随后依次在丙酮和乙醇中超声清洗10分钟,保护气体下干燥,备用。
4、碱活化法预处理:将清洗过的we43合金片材基体浸泡于80℃的3摩尔每升的氢氧化钠溶液中,处理12小时,取出后超纯水超声清洗干燥,备用。
5、脂溶性调控处理:将碱活化预处理的we43合金片材基体浸泡于油酸乙醇溶液中(2.5mg/ml),50℃保持12小时,之后用50℃乙醇清洗3遍并置于80℃干燥箱处理6小时,备用。
6、可降解高分子膜的涂覆处理:
①用三氯甲烷有机溶剂溶解聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolicacid),plga),根据高分子分子量配置为浓度为4%(质量百分比)的高分子溶液,用磁力搅拌完全溶解,备用。
②采用超声喷涂工艺,将上述制备的plga溶液涂覆至胶粘剂涂覆后的we43合金片材表面。涂层厚度由溶液浓度和喷涂次数决定,厚度可为10~300μm,备用。
③成膜后将样品置入真空干燥箱中,真空60℃处理12小时,真空值为1~100pa。
7、组合涂层we43镁合金片材消毒备用:最后完成的组合涂层we43镁合金片材采用环氧乙烷消毒灭菌,医用级高分子塑料真空包装,封装袋标识,干燥冷藏保存。
实施例3
所用操作与工艺与实施例1相同,本实施例中不同点在于:高温高压预处理温度为120℃,所用长链烷基分子为油酸(2.5mg/ml),所用ptmc的浓度为4%(质量百分比)。
实施例4
所用操作与工艺与实施例1相同,本实施例中不同点在于:高温高压预处理温度为180℃,所用长链烷基分子为十八烷基硅烷(2.5mg/ml),所用ptmc的浓度为8%(质量百分比)。
实施例5
所用操作与工艺与实施例2相同,本实施例中不同点在于:碱活化预处理温度为50℃,所用长链烷基分子为油酸(5mg/ml),所用plga的浓度为4%(质量百分比)。
实施例6
所用操作与工艺与实施例2相同,本实施例中不同点在于:碱活化预处理温度为50℃,所用长链烷基分子为油酸(5mg/ml),所用pla的浓度为4%(质量百分比)。
实施例7
所用操作与工艺与实施例1相同,本实施例中不同点在于:ptmc的成膜工艺为超声喷雾。
实验例
经过相关实验测试,上述实施例1~7中所用的组合涂层的制备技术所得的改性医用镁基金属材料在控制镁合金降解,提高高分子粘附力以及促进新骨生成方面具有显著效果。
通过对粘附力测试,如图6所示,本发明实施例1制备的经过组合涂层修饰后的az31高分子粘附力的增强,表面脱附面积为1.05%,未经修饰的az31的表面脱附率高达14.03%(所用统计软件为imagej),结果表明本发明对高分子的粘附力具有显著增强的作用。
通过调控镁合金表面微纳结构(如图4)和界面亲脂溶性的调控(如图5),浸泡实验中未经修饰的az31的h2的释放量为3.48ml/cm2,实施例1制备的经过组合涂层修饰后的az31下降到0.12ml/cm2。
实施例1制备的经过组合涂层修饰后的az31和未经修饰的az31通过电化学极化测试表明,如图7所示,未经修饰的az31的自腐蚀电流为1.33×10-4(a/cm2),而经过组合涂层修饰后的az31自腐蚀电流下降到5.05×10-10(a/cm2)。
实施例1制备的经过组合涂层修饰后的az31和未经修饰的az31通过体外浸泡30天和体内植入3个月的micro-ct结果如图9所示,未经修饰的az31的体外浸泡体积减小量为2.53%,经过组合涂层修饰后的az31的体外浸泡体积减小量下降到0.52%,同时3个月体内植入结果如图10所示:未经修饰的az31的体积减小量为13.12%,经过组合涂层修饰后的az31体积减小量下降到2.25%。
最后利用micro-ct检测新骨生成效果,如图10所示,通过本发明实施例1处理制备的经过组合涂层修饰后的az31材料表面新骨生成量是未经修饰的az31材料的1.7倍左右。
实验例2,碱活化处理的we43片材经油酸修饰后其表面呈现出超疏水效果(图11),其与实施例1中高温高压预处理的az31经硬脂酸修饰后的结果类似。
实验例3和4,通过体外30天pbs(37±0.5℃)浸泡实验结果表明二者与实验例1结果类似。
实验例5,如图13所示,碱活化镁合金经油酸修饰后的表面呈现出高疏水性,通过体外30天pbs(37±0.5℃)浸泡实验结果表明与实验例1结果类似。
实验例6和7,通过体外30天pbs(37±0.5℃)浸泡实验结果表明二者与实验例1结果类似。
综上,利用本发明组合涂层制备技术所得的改性医用镁基金属材料在控制降解,提高高分子粘附力以及促进新骨生成等方面具有显著效果。
- 还没有人留言评论。精彩留言会获得点赞!