递送siRNA药物的阳离子脂质体及其制备方法与流程
本发明涉及医药技术领域,具体而言,涉及一种递送sirna药物的阳离子脂质体。
背景技术:
小干扰rna(smallinterferingrna,sirna)是双链的小分子核酸,在转录后发挥基因沉默作用,可特异性抑制疾病相关靶基因的mrna的表达从而发挥治疗效果。随着sirna生物学机制的阐明和sirna合成方法的快速发展,绝大多数的基因可通过sirna技术进行沉默,以弥补小分子药物的不足。目前,已有多个sirna药物进入不同阶段的临床实验。但是,sirna体内应用存在着如下的难题:sirna注射给药后血液中的稳定性差,体内滞留时间短,细胞摄取效率低,缺少细胞内溶酶体的逃逸能力等。
脂质体是由一层或者多层的磷脂双分子层组成的封闭的囊泡状结构。当磷脂膜分散在过量的水中即可形成此结构。脂质体具有很高的生物相容性和生物可降解性,因此它可以被用来递送多种活性成分,包括化疗药物、反义寡核苷酸、dna、sirna、抗原和蛋白质。脂质体的内部与外部均为亲水相,磷脂双分子层中为亲油相,药物可根据其极性包裹于磷脂双分子中或内外水相中。目前已经有七种以脂质体作为载体的药物经fda批准进入临床中应用。
技术实现要素:
本发明的目的在于提供一种阳离子脂质体,其与sirna混合后可包载sirna,并以较高的转染率向体内的细胞中递送sirna,并可避免sirna在转染前在体内被降解。
本发明提供的技术方案如下:
一种递送sirna药物的阳离子脂质体,其包含如下组分:dotap、hspc、dope、chol和dspe-peg2000,各组分的重量比例为dotap:hspc:dope:chol:dspe-peg2000=60:68:64:89-x:x,其中,x=35~45。
本领域技术人员熟知,dotap是指(2,3-二油酰基-丙基)-三甲胺、hspc是指氢化大豆卵磷脂、chol是指胆固醇、dope是指二油酰磷脂酰乙醇胺、dspe-peg2000是指二硬脂酰磷脂酰乙醇胺-聚乙二醇。
进一步地,本发明所述的递送sirna药物的阳离子脂质体,其中,所述阳离子脂质体粒径为100~150nm。
进一步优选地,本发明所述的递送sirna药物的阳离子脂质体,其中,所述阳离子脂质体粒径为110~130nm。
进一步地,本发明所述的递送sirna药物的阳离子脂质体,其中,所述阳离子脂质体zeta电位为50~70mv。
优选地,本发明所述的递送sirna药物的阳离子脂质体,其中,所包含的各组分的比例为:各组分的重量比例为dotap:hspc:dope:chol:dspe-peg2000=60:68:64:50:39。
进一步地,本发明所述的递送sirna药物的阳离子脂质体,其由以下方法制备而成:
称取所述dotap、hspc、chol、dspe-peg2000和dope,溶于混合有机溶剂中,40~45℃减压旋转蒸发2~4h除去有机溶剂,加入纯水60℃水浴下水化40~55min,冰浴条件下超声处理脂质体10min,通过挤出器挤出200nm膜5~15次得到的阳离子脂质体。
进一步地,本发明所述的递送sirna药物的阳离子脂质体,其中,所述制备方法中所述混合有机溶剂为氯仿和甲醇按体积比4:1混合制成。
优选地,本发明所述的递送sirna药物的阳离子脂质体,其中,所述制备方法中减压旋转蒸发的温度为42℃,旋转蒸发时间为2h。
优选地,本发明所述的递送sirna药物的阳离子脂质体,其中,所述制备方法中水浴下水化时间为45min。
优选地,本发明所述的递送sirna药物的阳离子脂质体,其中,所述制备方法中所述超声条件为100w,工作1s和间隔1s重复进行。
优选地,本发明所述的递送sirna药物的阳离子脂质体,其中,所述制备方法中通过挤出器挤出200nm膜15次得到的阳离子脂质体。
本发明能实现的技术效果为:
阳离子脂质dotap可与带负电荷的无义sirna通过静电作用形成脂质体/sirna复合物,具有高效的体外转染效率。同时复合物也易于与带负电荷的细胞表面结合,有利于将sirna通过细胞膜融合或者受体介导的胞吞作用递送入细胞内。
dope可以帮助转染,其与dotap产生协同作用,加入dope可进一步提高转染效率。
加入hspc和胆固醇可增加脂质体的磷脂膜的刚性,提高脂质体的稳定性,同时使得sirna与脂质体结合的更加牢固,从而提高转染效率。
dspe-peg2000可以为脂质体提供保护,减少脂质体与血清中的物质结合,防止sirna/载体被血液中的血浆蛋白所吸附,提高载体在体内的循环时间。但是dspe-peg2000的加入对脂质体粒径、pdi和zeta电位产生较大影响,从而影响转染效率,因此发明人对配方进行了优化,得到了即能保持高效转染,又能在血浆中保持稳定的sirna脂质体载体。
经发明人试验发现,本发明制备的递送sirna药物的阳离子脂质体,转染效果好,能使sirna高比率快速到达靶部位发挥作用,脂质体与sirna结合牢固,在血液中不易降解,且作为药物在放置过程稳定性好,毒副作用低。本发明脂质体为100~150nm,优选为110~130nm,根据epr效应,脂质体的粒径在200nm以下,才能保证脂质体能更好的进入肿瘤部位,使sirna发挥治疗作用,本发明脂质体zeta电位为50~70mv,电位过小,不利于脂质体通过静电吸附作用吸附基因(rna或者质粒),电位过大,会引起较大的细胞毒性,产生较大的副作用。
附图说明
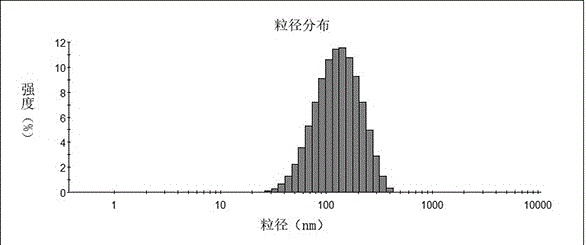
图1实施例1阳离子脂质体的粒度分布图;
图2实施例1阳离子脂质体透射电镜图;
图3实施例1阳离子脂质体4℃储存2周粒径和zeta电位图。
具体实施方式
下面实施例用于进一步详细说明本发明,但不以任何形式限制本发明。
实施例1:阳离子脂质体的制备
精密称取6.0mgdotap,6.8mghspc,5.0mgchol,3.9mgdspe-peg2000和6.4mgdope溶于混合有机溶剂(8ml氯仿,2ml甲醇),水浴超声2min,使其充分溶解,42℃水浴下减压旋转蒸发2h除去氯仿和甲醇,在瓶壁形成一层薄膜,加入2.0ml超纯水60℃水浴下水化45min。将脂质体转移至试管中,冰浴条件下使用超声波细胞破碎仪探头超声处理脂质体10min(100w,工作1s,间隔1s),通过挤出器挤出200nm膜15次得到最终的阳离子脂质体。
实施例2:阳离子脂质体的制备
精密称取6.0mgdotap,6.8mghspc,5.4mgchol,3.5mgdspe-peg2000和6.4mgdope溶于混合有机溶剂(8ml氯仿,2ml甲醇),水浴超声2min,使其充分溶解,42℃水浴下减压旋转蒸发2h除去氯仿和甲醇,在瓶壁形成一层薄膜,加入2.0ml超纯水60℃水浴下水化45min。将脂质体转移至试管中,冰浴条件下使用超声波细胞破碎仪探头超声处理脂质体10min(100w,工作1s,间隔1s),通过挤出器挤出200nm膜15次得到最终的阳离子脂质体。
实施例3:阳离子脂质体的制备
精密称取6.0mgdotap,6.8mghspc,4.4mgchol,4.5mgdspe-peg2000和6.4mgdope溶于混合有机溶剂(8ml氯仿,2ml甲醇),水浴超声2min,使其充分溶解,42℃水浴下减压旋转蒸发2h除去氯仿和甲醇,在瓶壁形成一层薄膜,加入2.0ml超纯水60℃水浴下水化45min。将脂质体转移至试管中,冰浴条件下使用超声波细胞破碎仪探头超声处理脂质体10min(100w,工作1s,间隔1s),通过挤出器挤出200nm膜15次得到最终的阳离子脂质体。
对比例1:
称取8.9mgchol,0mgdspe-peg2000,其他操作同实施例1。
对比例2:
称取6.4mgchol,2.5mgdspe-peg2000,其他操作同实施例1。
对比例3:
称取3.4mgchol,5.5mgdspe-peg2000,其他操作同实施例1。
实施例4:阳离子脂质体的制备
精密称取6.0mgdotap,6.8mghspc,5.0mgchol,3.9mgdspe-peg2000和6.4mgdope溶于混合有机溶剂(8ml氯仿,2ml甲醇),水浴超声2min,使其充分溶解,42℃水浴下减压旋转蒸发2h除去氯仿和甲醇,在瓶壁形成一层薄膜,加入2.0ml超纯水60℃水浴下水化45min。将脂质体转移至试管中,冰浴条件下使用超声波细胞破碎仪探头超声处理脂质体10min(100w,工作1s,间隔1s),通过挤出器挤出200nm膜5次得到最终的阳离子脂质体。
实施例5:阳离子脂质体的粒径及表面电位(zetapotential)的测定
将实施例1~3、对比例1~3阳离子脂质体用超纯水稀释10倍后,采用马尔文粒度仪nanozs90测定其粒径分布(实施例1脂质体粒径分布见附图1)及其表面电位,结果见表1:
表1不同chol和dspe-peg2000质量比对脂质体粒径、电位及pdi影响
从表1中可以发现,当阳离子脂质体修饰peg之后,粒径会变小,这是因为dspe-peg2000的增加了整个脂质体的压缩性。随着dspe-peg2000的含量增加,pdi减小,同时,peg屏蔽了表面的正电荷,导致zeta电位减小。pdi小于0.2的脂质体具有更好的分散性,zeta电位大于50mv更有利于吸附负电荷的sirna药物。因此,我们选取chol:dspe-peg2000=89-x:x,其中,x=35~45。
注:pdi(polydispersityindex)为多分散系数,是由累积距法得到的一个无纲量的值,代表的是粒子尺寸的分布宽度。由dsl测得的值大小在0-1之间,pdi值越小,表明样品的粒子尺寸分布越狭窄。
实施例6:阳离子脂质体透射电镜(tem)检测
利用透射电镜负染技术,对制备好的脂质体进行透射电镜检测,目的是观察实施例1所制备脂质体的形态。
结果如附图2所示,观察到所制备的脂质体外观呈圆球形,通过对脂质体颗粒半高宽的测量,结果得到脂质体粒径大约为110~130nm。
实施例7:阳离子脂质体的体外稳定性考察
将实施例1制备的阳离子脂质体保存在4℃冰箱中保存,在两周内每隔一定时间取出,用超纯水稀释10倍后测定其粒径和zeta电位,结果如表2所示,说明实施例1阳离子脂质体在2周内粒径和电位没有发生明显的变化,表明其在4℃下的保存稳定性较好,如附图3所示。
表2实施例1脂质体稳定性考察
实施例8:细胞摄取实验
实验组为脂质体组,将ags细胞(小鼠胃癌细胞)按照300000个细胞每孔的密度接种于12孔板,每孔添加2ml含10%胎牛血清和1%双抗(耐氨苄青霉素和卡那霉素)的rpmi1640培养基,37℃、5%co2条件培养箱培养24h后,弃去培养基,用pbs清洗两次,每孔加入10µlfam-sirna(浓度:0.008od/µl,序列(5’-3’)为:uucuccgaacgugucacgutt)和30µl实施例1制备的阳离子脂质体,补充1%双抗的rpmi1640培养基至2ml,继续在培养箱中培养1h、4h、6h后吸去培养液,用预冷的pbs洗两次,采用2ml4%的多聚甲醛固定20min,加入2mlhoechst33258细胞核染料(2μg/ml),室温孵育10min,冰pbs润洗五次,在荧光显微镜下观察并拍照。另一组为空白对照组,以无脂质体载体的sirna在其他条件相同情况下进行转染。
fam-sirna在激发的条件下,fam基团能够发出绿色荧光,用hoechst33258细胞核染料,使得细胞核在激发的条件下,细胞核显示为蓝色。我们选取转染后1h、4h、6h为观察时间点,观察绿色荧光和蓝色荧光的表达情况。在每个时间点,采用相同的条件在显微镜下拍照,利用imagej定量每个时间点的绿色荧光和蓝色荧光的荧光强度,绿色荧光强度用fam-sirna表示,蓝色荧光用hochest表示。检测结果如表3:
表3细胞摄取试验检测结果(光密度值)
hochest的荧光强度在上述3个时间点变化不大,代表选取的拍照区域细胞数目基本无变化。fam-sirna的荧光强度,随着时间的推移显著上升,4h和6h相对于1h的荧光信号分别上升到3.6倍和5.7倍,说明绿色荧光代表的fam-sirna随脂质体穿过细胞膜进入细胞内部,随时间推移,进入细胞内部的比例增加。以上说明说明包载fam-sirna的阳离子脂质体能被细胞所摄取,并且具有较高的转染效率。
实施例9:转染效果试验
为验证本发明的脂质体转染效果,我们选取了keratin17(krt17)作为靶基因,利用本发明的实施例1制备的脂质体,向胃癌细胞系ags细胞中转染一条针对krt17的sirna,5’-3’方向的序列为:cgucaggugcguaccauug,对照sirna的序列为:uucuccgaacgugucacgutt。
在sirna转染ags细胞24h后,利用实时定量pcr的方法,检测了ags细胞中krt17mrna的相对表达量。具体方法如下:
1、细胞rna的提取及cdna的逆转录
吸去ags细胞培养液,并用pbs缓冲液清洗后,用trizol(invitrogen,carlsbad,ca,usa)裂解细胞。按1mltrizol加入0.2ml氯仿的量加入适量氯仿,震荡混匀,冰上静置15min后12,000rpm,4℃离心15min。取上层水相(约0.5ml)于新的rnaase-free的1.5mlep管中,加等体积异丙醇混匀,于-20℃静置30min以沉淀rna,12,000rpm,4℃离心15min。弃上清,沉淀的rna用1ml预冷75%乙醇洗一遍,于室温晾干后加入适量depc水溶解。用分光光度计检测充分溶解的rna在260nm处光吸收值,以确定rna的含量及纯度。取适量提取的总rna,利用rna快速逆转录试剂盒(takara,japan)逆转录成cdna。逆转录的cdna通过rt-pcr仪(roche,switzerland)检测相关基因mrna的相对表达量。
2、qpcr检测
1)反应体系为20μl,10μlybrmix(takara,japan),1μlcdna,1μl引物,8μl超纯水。
2)反应在rochelightcycler480或rotorgene2000仪器上进行。
3)反应条件为:95℃,2min,94℃,30s,60℃,1min,共40个循环,pcr结束后自动进入熔解曲线分析,以确定pcr产物的特异性。
4)数据分析:采用δδct法分析krt17mrna在ags细胞中的表达情况。
与对照sirna相比,krt17sirna能够显著降低,结果见表4:
表4转染效果试验数据
实施例10:空白阳离子脂质体毒性考察
将对数生长期的ags细胞以1×104cells/孔的密度接种到96孔细胞培养板中,培养24h后,加入系列不同浓度的空白阳离子脂质体溶液(以不含血清的培养基进行稀释,并过0.45μm水膜除菌),平行操作三份。常规培养条件下避光孵育48h后,每孔加入10μl的cck-8溶液,继续孵育1h,并用酶标仪检测其吸光度值(a)。
结果见表5:
表5阳离子脂质体毒性考察数据
从结果可见,空白阳离子脂质体对ags细胞显示出一定的细胞毒性,这是由于脂质体表面的正电荷增加了细胞膜的通透性,使培养液中的双抗被细胞摄取,产生细胞毒性,是使用阳离子脂质体不可避免的问题。在最高浓度1000μg/ml条件下孵育48h后,细胞生存率大约在80%左右。而在50μg/ml和10μg/ml的浓度条件下孵育48h后,细胞生存率分别为95%和100%。根据上述数据,我们认为在浓度50μg/ml以下,载体对细胞的影响可控,有比较高的安全性。
- 还没有人留言评论。精彩留言会获得点赞!