放射性核素标记纳米粒子及其制备方法和应用与流程
本发明属于化学和生物医学成像领域,具体涉及一种放射性核素标记纳米粒子及其制备方法和应用。
背景技术:
疾病诊断的方法主要包括生物发光/荧光成像(fi),计算机断层扫描成像(ct)、核磁共振成像(mri)、光声成像(pa)技术等。成像技术各有优点和局限,生物发光具有较高的探测灵敏度,但受到组织深度的限制,mri具有对软组织较高的分辨率,但对于对比度较高的组织分辨率较低,ct具有较好的深层组织穿透能力及能够提供优良的解剖信息,但探测灵敏度受到限制。
放射性同位素的标记、示踪和成像研究应用作为核分析技术的重要组成部分,利用核技术探索生命现象的本质和物质变化规律,已广泛应用于医学基础理论研究,其内容主要包括核衰变测量、标记、示踪、体外放射分析、活化分析和放射自显影等。正电子发射断层扫描成像(pet)成像分析,具有更高的灵敏度和穿透力,能够观察和分析金属标记纳米粒子参与活体、组织、细胞及胞内微区的代谢、分布及动态变化,对做出科学的处理和分析,能够对观察对象进行定量分析和动态跟踪,从而揭示生命过程中的生理和病理变化,具有无可替代的优越性,已经成为体内脏器显像和功能测定的重要方法。目前,pet成像检查中应用的pet药物95%以上为氟[18f]标记的2-氟代脱氧葡糖(18f-fdg),这大大限制了pet的潜在功能和作用,亟需发展新的同位素标记。
技术实现要素:
为了解决上述问题,本发明提供一种放射性核素标记纳米粒子及其制备方法和应用。
本发明提供一种放射性核素标记纳米粒子,包括放射性核素和纳米颗粒载体,所述放射性核素通过络合剂偶联至所述纳米颗粒载体。
根据本发明的一实施方式,所述放射性核素选自55fe、64cu、153gd、68ga中的一种或多种。
根据本发明的另一实施方式,所述纳米颗粒载体为富勒烯,所述富勒烯选自c60和gd@c82富勒烯中的一种或两种。
根据本发明的另一实施方式,所述纳米粒子中所述放射性核素与富勒烯的摩尔比为1:1-10。
根据本发明的另一实施方式,所述纳米粒子中所述放射性核素与富勒烯的摩尔比为1:1-6。
根据本发明的另一实施方式,所述络合剂为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸、二乙基三胺五乙酸、乙二胺四乙酸中的一种或多种。
本发明的上述放射性核素标记纳米粒子作为正电子发射断层扫描成像造影剂的用途。
本发明还提供一种放射性核素标记纳米粒子的制备方法,通过络合剂将放射性核素偶联至所述纳米颗粒载体。
根据本发明的一实施方式,所述的制备方法,包括:在所述纳米颗粒载体表面修饰羧基;用naoh溶液活化在表面修饰有羧基的纳米颗粒载体;将具有氨基末端的络合剂通过酰胺键偶联至经过活化后的纳米颗粒载体;以及使放射性核素与偶联到所述富勒烯表面的络合剂反应形成络合物。
本发明的放射性核素标记纳米粒子通过络合剂偶联至纳米颗粒载体,结构稳定性好,适合作为正电子发射断层扫描成像造影剂。
附图说明
通过参照附图详细描述其示例实施方式,本发明的上述和其它特征及优点将变得更加明显。
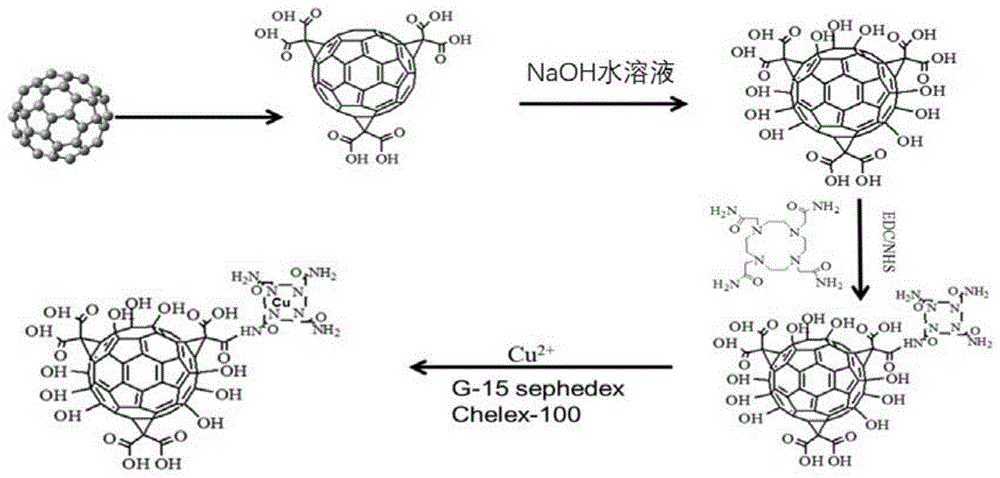
图1是c60和gd@c82富勒烯表面偶联64cu的流程示意图。
图2a和图2b分别是c60富勒烯表面羧基化修饰及偶联dota前后的红外光谱及电喷雾电离质谱(esi-ms)。
图3a、图3b和图3c分别是64cu、64cu标记c60和gd@c82富勒烯在丙酮和生理盐水中的快速薄层层析tlc。
图4是64cu标记c60和gd@c82富勒烯的血清稳定性检测。
图5是小鼠通过尾静脉注射标记了64cu标记c60后不同时间点的micropet成像。
图6a和图6b分别是尾静脉注射64cu-c60和64cu-gd@c82后,24h和48h在小鼠组织中的分布(图中的id%表示排泄的药物占注射药物的百分比)。
图7a和图7b分别是尾静脉注射64cu-c60和64cu-gd@c82后不同时间点的排泄量(图中的id%表示排泄的药物占注射药物的百分比)。
图8是gd@c82(oh)22的血药浓度-时间曲线和半对数图。
具体实施方式
下面结合具体实施方式对本发明作详细说明。
本发明提供一种放射性核素标记纳米粒子,包括放射性核素和纳米颗粒载体,放射性核素通过络合剂偶联至纳米颗粒载体。放射性核素可以是任何适用于放射性治疗或诊断的放射性核素,例如55fe、64cu、153gd、68ga等。纳米颗粒载体可以任何适用于放射性核素标记的纳米粒子。优选,纳米颗粒载体为富勒烯。更优选为c60和gd@c82。偶联至富勒烯表面的放射性核素与富勒烯的摩尔比为1:1-10,更优选为1:1-6。络合剂优选具有环状结构,例如dota(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraaceticacid,中文1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)、dtpa(二乙基三胺五乙酸)、edta(乙二胺四乙酸)等。
可以通过任何适当的方式将放射性核素偶联至纳米颗粒载体上。可以是,但不限于,首先在纳米颗粒载体表面修饰羧基,之后用naoh溶液活化经过表面修饰的纳米颗粒载体,之后将具有氨基末端的络合剂通过酰胺键偶联纳米颗粒载体表面,最后将放射性核素与偶联至纳米颗粒载体上的络合剂形成络合物,即完成放射性核素偶联至纳米颗粒载体表面过程。最后还可以包括提纯步骤,制得纯净的放射性核素标记纳米粒子。
实施例1
如图1所示,经过溴代丙二酸酯加成和酯水解反应将c60(购于河南富勒烯纳米新材料科技有限公司)羧基化。首先,将nah加入已经配制好的c60甲苯溶液中,溶液由原来的紫色变为深红色,然后加入溴代丙二酸二乙酯。将上述溶液体系在ar气保护下搅动10h,将反应后的溶液过滤。过滤后的上清液通过旋转蒸发仪真空浓缩去除溶剂,剩余物经硅胶柱(400目)进行层析分离,层析分离的流动相分别为甲苯、甲苯/氯仿(1:1)和氯仿。通过层析分离分别可以得到色带ⅰ~ⅺ,均为不同加成数目的c60丙二酸酯衍生物。将其中经过甲苯洗脱的深棕色带再经旋转蒸发后,投入甲苯溶液中,并加入20倍过量的nah。溶液在ar气保护下继续加热搅动10h,反应温度为80℃。移去加热源后,立即在溶液中加入ch3oh中止反应,并加入hcl。通过离心法收集容器中的红色粉末状沉淀。收集的沉淀物分别经ch3oh,2mol/lhcl,h2o洗两次。将沉淀物用水溶解,并用0.22μm的滤膜滤去不溶物。最后通过真空干燥去除溶剂,所获得的棕色干燥粉末状产物,即为c60羧基化衍生物。
以0.01m的naoh对制得的c60羧基化衍生物进行5min活化。调节溶液ph至5.0,按照质量比为dotam:edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐):nhs(n-羧基琥珀酰亚胺)=12:6:3,加入含有氨基的dota(dotam)、edc和nhs,反应60min。用去离子水离心清洗5遍,以去除没有反应的dotam,冷冻干燥后备用。
将555mbq64cucl2溶解在0.1ml中0.05毫升盐酸溶液和10μl1mg/ml的dotam-c60于200μl0.1醋酸铵溶液(ph5.5-6.5)。总反应混合物为放置在一个震荡金属浴,80℃,1h。接下来,10μl5%edta水溶液。用g-15和chelex-100阳离子交换色谱柱除去游离64cucl2。对过柱纯化水溶液45℃旋转蒸发浓缩,再溶于0.1m醋酸铵缓冲液中,达到370mbq/ml。
标记后的产物经过sephedexg-15葡聚糖凝胶柱和chelex-100阳离子交换柱分离纯化。
图2示出实施例1的c60富勒烯表面羧基化修饰及偶联dota前后的红外光谱及电喷雾电离质谱(esi-ms)。图2a的红外光谱显示,1700cm-1的c=o的特征吸收峰,表明富勒烯表面羧基化修饰成功;1670cm-1的酰胺键i带的特征吸收和1570cm-1的酰胺键ii带的特征吸收,说明dotam通过键偶联到富勒烯表面。图2b的电喷雾电离质谱(esi-ms)所示,2097.4m/z的峰表明dota已经偶联到c60富勒烯上,每个富勒烯分子偶联四个羧基,其中两个分子与dotam分子发生酰胺化反应连接到碳笼表面,形成c60(c(cooh)2)2(oh)24-(dota)2。通过图2b可以证明该实施例制备的核素标记纳米粒子中64cu与c60的摩尔比是1:2。
实施例2
通过与实施例1相同的方式将64cu偶联至gd@c82表面。经过检测本实施例制的纳米粒子中64cu与gd@c82的摩尔比是1:1。
产物结构稳定的鉴定
图3a、图3b和图3c分别是64cu、64cu标记c60和gd@c82富勒烯在丙酮和生理盐水中的快速薄层层析tlc。纯化后的产物经过硅胶滤纸进行快速薄层层析tlc鉴定。如图3a所示,64cu在丙酮相中的比移值(rf)为0.01,在生理盐水相中的rf为0.81。图3b示出纯化后的64cu-c60在丙酮相中的比移值rf=0.01,水相中rf=0.4。图3c示出[64cu-gd@c82]在丙酮中的比移值rf=0.01,水相中rf=0.3。从层析的结果可以看出纯化后的64cu标记c60和gd@c82富勒烯能够在水相迁移,产物单一并有效结合64cu2+。
透析测定24h内64cu标记c60和gd@c82富勒烯在牛血清溶液中的稳定性,结果如图4所示。从图中可以看出,64cu标记c60和gd@c82富勒烯表现在血清溶液中具有良好的稳定性,经过与标准64cu的归一比较,在24h,结合在c60和gd@c82富勒烯碳笼的64cu仍然保留75%以上。
64cu标记c60和gd@c82富勒烯在体micropet成像
正电子发射断层扫描成像(pet)是被中国(sfda)和美国(fda)都认可的一种在体、动态及定量研究药物体内代谢动力学的方法。利用micropet图研究它们经尾静脉注射到体内后,在体的分布及代谢。图5显示了小鼠尾静脉注射64cu-c60和64cu-gd@c82后,不同时间点的micropet图。如图所示,与游离64cucl2相比,64cu-c60在体内的滞留时间长,主要分布在肝、肾等器官。注射15min后,64cu-c60主要通过肾排。2h后通过肠道排泄。推测可能是通过循环系统进入并在肝中蓄积的64cu-c60通过肝肠循环在此时间点通过肠道排泄。说明64cu标记的富勒烯纳米颗粒可以进行pet检测,并且有很好的效果,可以进行定量分析。
64cu-c60和64cu-gd@c82的体内分布
图6a和图6b分别示出64cu-c60和64cu-gd@c82尾静脉注射24小时和48小时后,主要的脏器分布。64cu-c60和64cu-gd@c8在肝脏中都有较高的蓄积。48h之后,64cu-c60在各个脏器中还是有较高的残留。而64cu-gd@c82得大部分已经被排出,各个脏器中的含量都很低。
64cu-c60和64cu-gd@c82的排泄
图7a和图7b分别是尾静脉注射64cu-c60和64cu-gd@c82后不同时间点的排泄量级累加。通过伽马计数,对64cu-c60和64cu-gd@c82排泄清除进行了检测。其中id%=尿(粪便)的剂量/注射剂量,图7a和图7b中的曲线显示了尿(粪便)在不同时间点的排泄及其排泄总量在不同时间点的累加。由图所示,64cu-c60和64cu-gd@c82主要以粪便的形式排泄,64cu-gd@c82在48h后从体内的清除率达到96.38%,而64cu-c6048h后的清除率为67.03%。结合图5的数据分析,与64cu-gd@c82比较,64cu-c60在各个脏器都有较高分布,清除较慢,48h后清除率比64cu-gd@c82低29.35%,其代谢符合二室模型。
结合分布和消除这两个相互竞争的过程,以血液、肝、肾等富勒烯能够迅速达到分布平衡的器官组成中央室,完成富勒烯的摄入。图7显示,静脉注射64cu-c60大部分通过吸收系统进入其他脏器,最后通过粪便排出体外。而64cu-gd@c82的一部分被肾脏快速吸收排泄,其余部分通过吸收系统进入其他脏器并通过粪便排出体外。同时小鼠显示了对64cu-c60比64cu-gd@c82较高的吸收能力和较低的清除能力。
从以上实验结果可以看出,两种性质极为相近的碳笼分子,通过64cu标记后核成像的方法,清晰的显示了它们在体代谢的差别,表现了这种方法的优越性及准确性。
gd@c82的静脉推注给药代动力学
静脉给药确保所有药物进入体循环。快速注射给药可迅速达到较高的血药浓度。本实验通过对昆明小鼠(spf级)单次静脉注射给药,研究单剂量给药后的血药浓度随时间变化的趋势。其中小鼠雌雄各半,60只,6-7周龄,16.0-20.0g/只。雌雄随机分组,共13组,每组5只。尾静脉注射给药gd@c82(oh)22,剂量为2.5umol/kg,给药后0.08,0.17,0.5,1,1.5,2,3,4,6,8,12,16,24小时摘眼球采血。采用icp-ms测量不同时间点采集的血样中gd的含量,确定血样中药物浓度,绘制血药浓度-时间曲线(见图8),通过计算获得半衰期(t1/2)、稳态分布容积(vss)、血液浓度-时间曲线下面积(auc)和清除率(cl)见表1。图8gd@c82(oh)22的血药浓度-时间曲线和半对数图。数据如表1所示。
表1gd@c82(oh)22的给药动力学参数
图8及表1示出gd@c82(oh)22静脉注射后血液随时间变化的趋势。在30min内血液浓度剧烈降低,注射16h后,gd@c82(oh)22的血药浓度仅仅剩余3.18ng/ml。给药后,如果药物在体内各脏器瞬时达到平衡,即血液浓度和全身各组织器官部位的药物浓度迅速平衡,这种代谢可被认为是一室模型。多数情况下,药物首先在某些脏器部位和血液中的浓度迅速达到平衡,而在另一些脏器中的转运有一定的延后、但彼此具有近似的吸收及代谢速率,迅速和血液浓度达到平衡的脏器被归并为中央室,随后达到平衡的部位则归并为周边室,称开放性二室模型。为了和文献报道相比较,通过拟合的一室模型获得的gd@c82(oh)22的血浆半衰期t1/2是123.84min。消除半衰期(t1/2)是123.84min,表明了gd@c82(oh)22从血液循环中的彻底清除是中等速率的。稳态分布容积(vss)是189.04ml,比身体的水含量大(身体水含量是17.5ml),说明gd@c82(oh)22能够广泛分布于血液和细胞外液。血液浓度-时间曲线下面积(auc),面积越大表示被机体吸收利用的程度越大;清除率(cl)是1.06ml/min,低于肝的血流灌注速率(1.2ml/min),表明gd@c82(oh)22在血液循环中的时间更长。
以上实验可以表明,采用富勒烯外接dota金属离子螯合剂螯合64cu2+形成的纳米粒子可作为pet成像的显影剂。其中,cu位于元素周期表的第4周期,第ib族,相对分子量约为63.546,其放射性同位素包括60cu、61cu、62cu和64cu,其中占70%比例的64cu[t(1/2)12.7h;β+,0.653mev(17.8%);β-,0.579mev(38.4%)]适合pet成像诊断。64cu的生产比较容易,可以通过68zn的核反应产生,获得的产率和纯度很高,然后再用64cu标记dota而得到64cu-dota,而且放射性核素纯度>90%,64cu-dota的标记率>80%,放射化学纯度>99%。仅仅1ng64cu就达到1mci的剂量,按照临床剂量0.14mci/kg,进入人体的cu2+远远低于cu离子的安全剂量1.5-2mg/kg,因此无需考虑cu2+的毒性。环状金属螯合剂dota螯合物通常比一般配合物要稳定,dota与铜离子的结合常数k为19.3,所以,64cu-dota适合做生物医学成像的造影剂。
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
- 还没有人留言评论。精彩留言会获得点赞!