一种抑郁症快速治疗的复合物及其制备方法和应用与流程
本发明涉及医药领域,具体涉及一种抑郁症快速治疗的复合物及其制备方法和应用。
背景技术:
抑郁症是导致残疾和自杀的主要原因,也是导致全球总体疾病负担的主要因素,抑郁症影响了全球3亿多人。然而,现有的抑郁症治疗通常需要数周至数月才能达到其抗抑郁作用。因此,迫切需要能够缩短发作时间以实现其抗抑郁作用且毒性更低的改进的治疗剂。
随着多学科纳米医学和纳米生物技术的快速发展,已开发出多种用于疾病诊断和治疗的纳米载体。其中,无磷层状半导体黑磷(bp)纳米片由于其出色的生物相容性,良好的生物降解性,近红外(nir)诱导的光热效应和载药性而受到了广泛的关注。
技术实现要素:
本发明的目的是为解决治疗抑郁症的时间过长的问题,提供一种快速治疗抑郁症的复合物。
为实现上述目的,本发明采用的技术方案是:
本发明提供一种抑郁症快速治疗的复合物,所述复合物由黑磷纳米片与抗抑郁药物的复合而成。常用的抗抑郁药物有氟西汀、帕罗西汀、舍曲林、氟伏沙明、西酞普兰,优先为氟西汀。
本发明还提供一种抑郁症快速治疗的复合物的制备方法,步骤为:将黑磷纳米片与抗抑郁药物分散在生理盐水中,在常温和黑暗下搅拌复合,再经离心、洗涤后,得到复合物。
进一步地,所述黑磷纳米片与抗抑郁药物的质量比为1∶2-1∶20,优先为1∶5。
进一步地,所述搅拌复合时间为20-30h。
与现有技术相比,本发明的有益效果是:
(1)bp纳米片可以改善如氟西汀等抗抑郁药物的生物相容性,抗抑郁药物通过与bp纳米片复合,增强其通过血脑屏障的能力;
(2)bp-fluoxetine复合物可以缓解高浓度fluoxetine对细胞的毒性;
(3)本发明提供的复合物在近红外光照射下可以增加海马bdnf表达,降低杏仁核pns兴奋性和mepsc频率;
(4)本发明提供的复合物在近红外光照射下,极大地缩短了抑郁症的治疗时间,且无明显的副作用。
附图说明
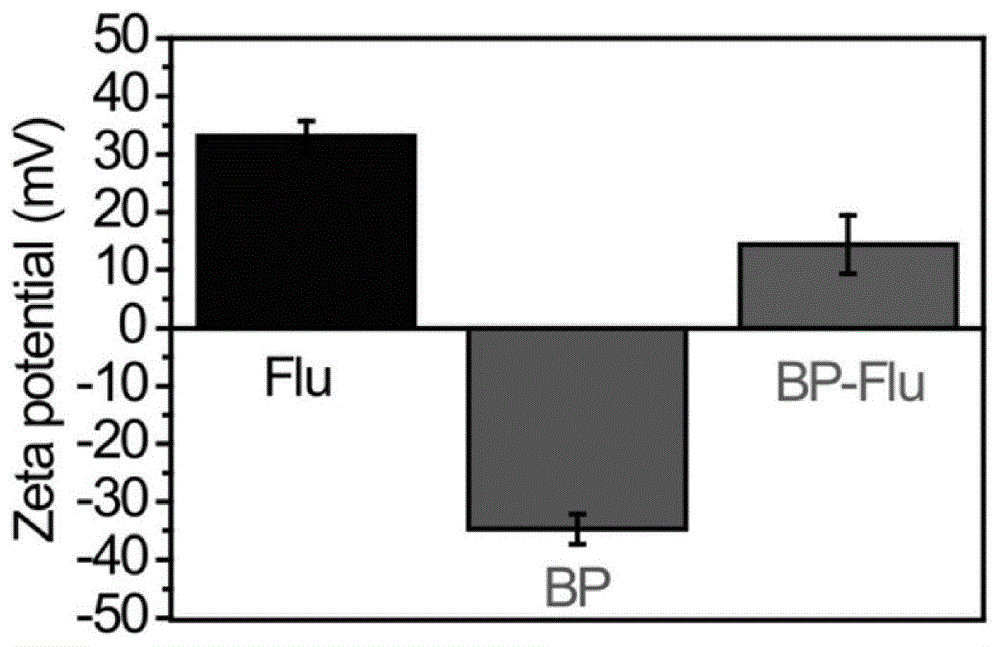
图1为黑磷纳米片、氟西汀和bp-fluoxetine的zeta电位;
图2为黑磷纳米片和bp-fluoxetine的sem或tem图像,其中a为黑磷纳米片的sem图,b为黑磷纳米片的tem图,c和d为bp-fluoxetine的sem图;
图3为近红外的照射下,氟西汀从bp-fluoxetine中释放;
图4为不同浓度的黑磷纳米片对u251,huvec,4t1,llc四种细胞的细胞毒性;
图5为低浓度的氟西汀对huvec的细胞毒性;
图6为不同浓度的黑磷纳米片,氟西汀,bp-fluoxetine,bp-flu-nir对huvec的细胞毒性;
图7为小鼠外套评分试验测试实物图;
图8为小鼠体重变化图;
图9为小鼠的行为测试图,其中a为蔗糖偏爱测试(spt),b为强迫游泳测试(fst),c为尾部悬挂测试(tst)和d为外套评分试验;
图10为小鼠海马bdnf的表达情况图,其中a、b、c分别为两周治疗后小鼠bdnfmrna表达水平、具有代表性的bdnf和β-actin蛋白印迹图像以及各组小鼠bdnf蛋白的相对水平;d、e、f分别为四周治疗后的。
图11为显示基底外侧杏仁核(bla)神经元全细胞记录的示意图;显示bla-pns记录的亮场图像;(从左至右)
图12为bla-pns对电流注入(250pa,1000ms)反应的点火模式的代表性痕迹;
图13为四周治疗bla-pns的尖峰数随注入电流强度的函数曲线;
图14为j-m,从左到右,从每组小鼠中提取的mepsc的代表性痕迹;n-q,绘制了mepsc振幅(n)和mepsc频率(p)的累积分布图;定量分析(o和q)显示,应激小鼠的mepsc频率升高,随后被bp-flu-nir消除,而对于游离的氟西汀,mepsc波幅无明显变化;
图15为用flu或bp-flu-nir治疗四周会降低bla投射神经元的内在兴奋性,其中a.显示基底外侧杏仁核(bla)神经元全细胞记录的示意图;b.pns对电流注入(250帕,1000毫秒)反应的点火模式的代表性痕迹;c.bla-pns的尖峰数随注入电流强度的函数的汇总图;
图16为用氟西汀或bp-flu-nir治疗四周会减少bla投射神经元的兴奋性突触传递;a-d.从左至右,从非应激+生理盐水、应激+生理盐水、应激+氟西汀和bp-flu-nir组中提取的mepsc的代表性痕迹。绘制了mepsc振幅(e)和mepsc频率(g)的累积分布图;(f和h)定量分析显示,应激小鼠的mepsc频率升高,随后bp-flu-nir和free-flu均被消除,mepsc波幅无明显变化。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
以下选择氟西汀(fluoxetine)作为代表性抗抑郁药物,与bp纳米片复合。
实施例一bp-fluoxetine复合物的制备
1.bp纳米片的制备
将1g氢氧化钠固体分散在40ml的n-甲基-2-吡咯烷酮(nmp)中并超声处理5分钟,以获得酒红色nmp的饱和氢氧化钠溶液。之后,将20mgbp粉末分散在上述溶液中,并在冰浴中超声处理8至10h。将得到的棕色悬浮液以1000rpm离心10分钟以除去残留的未剥皮的颗粒,收集上清液并以10000rpm离心5分钟以除去nmp。将收集的沉淀物用超纯水洗涤两次,然后冻干并保存在4℃的冰箱中以备进一步使用。
2.bp-fluoxetine的复合
将10mgbp纳米片和50mg氟西汀分散在10ml生理盐水中,在常温和黑暗下搅拌24小时。以10000rpm离心后,收集的沉淀物用超纯水洗涤两次。之后,将bp-fluoxetine复合物重新分散在水中以进一步使用。
试验例一bp-fluoxetine复合物的结构
通过zeta电位、扫描电镜和eds光谱分析bp-fluoxetine复合物的结构等特性。
如图1所示,吸附后纳米片的zeta电位从-35下降到+15mv,表明氟西汀(flu)通过静电作用成功地吸附在bp纳米片的表面上。扫描电子显微镜sem图像和eds光谱结果(图2)表明,flu加载后bp纳米片的粒径仍在200nm左右。
试验例二bp-fluoxetine复合物对细胞毒性
用cck-8法测定bp-fluoxetine的细胞毒性。以每毫升2×103个细胞的密度将细胞接种于96孔板中培养24小时,然后用100μl含不同浓度bp-fluoxetine(25、50、100和200μgml-1)的新鲜培养基代替。培养72h后,用10%cck-8培养基代替培养基,每孔加入100μl,再培养2h,在多功能酶标仪上测量450nm处的吸光度。细胞毒性计算公式如下:细胞活力=(od450nm/样品/od450nm/对照)×100%
如图4所示,0-100μg/ml的bp-fluoxetine对u251、huvec、4t1和llc细胞没有显著毒性。如图5所示,小于6.25μg/ml的fluoxetine对huvec细胞无明显的细胞毒作用。然而,当fluoxetine的浓度大于6.25μg/ml,可以观察到fluoxetine对huvec细胞有显著的细胞毒性,而通过bp-flu和bp-flu-nir可缓解fluoxetine的细胞毒性(如图6所示)。
试验例三氟西汀从bp-fluoxetine中释放情况
制备3ml2mgml-1bp-fluoxetine,并用808nm(2wcm-2)的激光辐照。每2分钟将100μl上清液放入96孔板中,然后将100μl超纯水添加到溶液中。使用酶标仪测量上清液中氟西汀的吸光度,并根据标准曲线计算氟西汀的浓度。
如图3所示,30分钟内,90%以上的fluoxetine在nir下可从bp-fluoxetine中释放。
试验例四bp-fluoxetine复合物对小鼠抑郁症治疗效果评价
一、小鼠抑郁模型的构建——慢性不可预测的轻度应激(cums)
对4周大的雄性c57bl/6j雄性小鼠进行慢性不可预测的轻度应激(cums),以获得抑郁症的动物模型。使用了以下压力源:约束在塑料管中,笼子倾斜,光照期间熄灭,夜间照明,冷隔离,强迫游泳。为了防止习惯并为压力源提供不可预测的功能,上述2个压力源每天在不同的时间随机使用。cums程序持续4周。
二、小鼠分组治疗
抑郁症的动物模型完成之后,将小鼠分成8组(n=10-15只):(a)无应激+生理盐水;(b)应激+生理盐水;(c)应激+bp;(d)应激+808nmnir激光照射;(e)应激+具有808nm激光照射的bp;(f)应激+fluoxetine;(g)应激+bp-fluoxetine;(h)应激+具有808nm激光照射的bp-fluoxetine。其中氟西汀的浓度为2.5mgml-1,bp-fluoxetine的浓度为2.86mgml-1,每天给小鼠注射100μl药物的剂量。对于具有808nm激光照射的组,每天老鼠控制在40-45℃的温度范围之内,照射5分钟。治疗持续四周,每天对抑郁小鼠进行相应地治疗。
三、小鼠行为测试
包括蔗糖偏爱测试(spt),强迫游泳测试(fst),尾部悬挂测试(tst)和外套评分试验,以测量抑郁症样行为。治疗过程中每周对进行小鼠行为测试,并称重。
实验结果如图7、图8和图9所示,与对照组相比,cums能显著降低小鼠体重,蔗糖偏好试验(spt)和皮毛的物理状态,同时增加了尾部悬吊试验(tst)和强迫游泳试验(fst)中的静止时间,表明小鼠有抑郁样行为。
经过两周的治疗,游离的flu和无nir的bp-flu没有缓解小鼠的抑郁行为,而bp-flu-nir明显缓解了抑郁行为。经过四周的治疗,游离的flu和bp-flu-nir均显示出预期的抗抑郁作用。结果表明,808nm激光照射的bp-flu较传统氟西汀治疗缩短了治疗时间。试验例五从细胞生化和生理变化评价bp-fluoxetine复合物对小鼠抑郁症治疗效果
对四组小鼠进行进一步的分析(n=4-5只):(a)无应激+生理盐水;(b)应激+生理盐水;(c)应激+fluoxetine;(d)应激+具有808nm激光照射的bp-fluoxetine。其中氟西汀的浓度为2.5mgml-1,bp-fluoxetine的浓度为2.86mgml-1,每天给小鼠注射100μl药物的剂量。对于具有808nm激光照射的组,每天老鼠控制在40-45℃的温度范围之内,照射5分钟。治疗分别持续两周和四周,每天对抑郁小鼠进行相应地治疗。
一、小鼠脑源性神经营养因子(bdnf)测量
利用定量实时聚合酶链反应技术测定小鼠海马bdnf的表达。
如图10所示,与非应激对照组相比,cums显著减少bdnf的mrna表达,而经过bp-flu-nir治疗两周后,可明显逆转bdnf的表达。同样,海马中bdnf的蛋白水平与其mrna表达水平相同。
治疗四周后,bp-flu-nir和游离flu治疗均阻断了cums诱导的bdnf的mrna表达和蛋白质水平的减少。
二、小鼠杏仁核pns兴奋性和mepsc频率测定
对小鼠急性脑切片的杏仁核进行全细胞膜片钳记录,以确认bp-flu-nir的快速抗抑郁作用(图11)。
如图12所示,与非应激对照组相比,cums显著增加了小鼠的放电频率。两周的bp-flu-nir治疗可以有效的改善由cums引起小鼠放电频率的增加,而游离的flu无法在两周的治疗周期内起到相应的作用(图12、图13)。
另一方面,cums引起的微小兴奋性突触后电流(mepsc)频率升高也可被bp-flu-nir阻断,而游离的flu治疗未起作用(图14)。mepsc波幅没有明显变化,表明cums增强了bp-flu-nir治疗后突触前小泡的释放,而不是增强了突触后反应。而在经过四周bp-flu-nir或游离flu的治疗后,bp-flu-nir和游离flu可阻断cums诱导的bla-pns的内在兴奋性(图15)和mepsc频率(图16)的改变。这两组小鼠之间的变化具有可比性。
综上所述,用bp-flu-nir治疗两周后,可诱发抗抑郁样细胞变化,包括增加海马bdnf表达,降低杏仁核pns兴奋性和mepsc频率,而两周的游离的flu治疗是无效的,这表明bp-flu-nir是一种快速有效的抗抑郁策略。
- 还没有人留言评论。精彩留言会获得点赞!