复合体、组织修复材料及其制备方法和应用与流程
本发明属于生物制品技术领域,尤其涉及一种复合体、组织修复材料及其制备方法和应用。
背景技术:
组织、器官的损伤或功能障碍是人类健康所面临的主要危害之一,也是人类疾病和死亡的最主要原因。目前临床常见的组织器官缺损修复技术主要有三种:异体组织移植,但存在组织相容性及供体来源严重不足的问题;自体组织移植,这种移植以牺牲正常组织为代价,且组织异位常导致功能紊乱;应用人工合成材料代用品,易导致异物反应、继发感染及周围组织萎缩等。
间充质干细胞是干细胞家族的重要成员,来源于发育早期的中胚层,具有多向分化潜能、造血支持和促进干细胞植入和免疫调控等特点,可以调控组织再生和伤口愈合。细胞外囊泡是间充质干细胞介导细胞间通讯以增强组织修复的关键分泌产物之一,外泌体就属于细胞外囊泡的一种,它是一种直径在40~100nm的圆形单层膜结构,由机体多种细胞内膜以出芽方式形成,并广泛分布于不同体液当中,携带多种蛋白质、mrna和microrna等,可通过生物合成与内吞作用参与到精确而复杂调控的细胞通讯、细胞迁移、细胞增殖与分化、调节免疫等过程。但未做任何改变的外泌体会在肝、肾、脾等器官集聚,并迅速被胆管系统、泌尿系统排泄,或被网状内皮系统吞噬,不能有效地到达目标组织器官。
外泌体的靶向修饰主要是通过先转染后分离的方式,即先通过转染的方式使细胞表达靶向蛋白,然后从细胞中分离出表达靶向蛋白的外泌体,其修饰效率低,操作较繁琐,所以寻找修饰效率高、操作简便的外泌体靶向修饰方法迫在眉睫。适配子是人工合成的单链寡核苷酸,可通过指数富集配基的系统进化技术(selex)进行体外筛选、扩增和富集,常形成发卡、茎环等二级结构及三维立体空间结构,可通过分子构象匹配与靶标结合,具有亲和力高、特异性强、免疫原性低的特点。已有研究将核酸适配体通过化学键连接到人工合成的脂质体上,以制备适配体靶向脂质体载药系统,以增强药物的稳定性、靶向性和传递效率。然而人工合成的脂质体虽然便于修饰功能基团,但成本大幅增加,且合成过程也更加繁琐,而且脂质体来源于外来物质,人体耐受性有限,容易在体内产生免疫反应。
技术实现要素:
针对现有技术存在的问题,本发明提供一种复合体,所述复合体的药效稳定、靶向性高、传递效率高,在体内有良好的耐受性,并可以通过内源物发挥多种生物学功能,同时避免了体内的免疫反应。
本发明的进一步目的是提供一种组织修复材料,所述组织修复材料在皮肤疾病治疗方面具有稳定的治疗效果和靶向性,特别在久治不愈的糖尿病并发症治疗方面具有显著的效果。
本发明的目的是通过以下技术方案来实现的:
本发明第一方面提供一种复合体,所述复合体由靶向基团和药用囊泡结合而成,所述靶向基团选自适配子,所述药用囊泡选自外泌体。
本发明利用适配子对特定细胞的靶向作用,使外泌体迁移并作用于目标细胞,提高了外泌体的生物利用率,达到促进组织修复的目的。经过适配子修饰的外泌体可以加快来自慢性不愈合伤口的成纤维细胞的生长和迁移,并能有效激活生长因子信号通路,提高血管生成相关基因和基质蛋白的表达,诱导新生血管的生成,因此,本发明提供的复合体可作为安全有效的产品促进慢性难愈合伤口或骨缺损伤口的愈合。
优选地,每个复合体包含所述适配子和外泌体的数量比为:n:1,n≧1,n为整数。
优选地,所述适配子选自血管内皮细胞靶向适配子。所述血管内皮细胞靶向适配子对血管内皮细胞具有靶向作用,可使外泌体迁移并作用于血管内皮细胞,提高了外泌体的生物利用率,达到促进血管内皮细胞增殖,组织血管修复的目的。
优选地,所述适配子选自成骨细胞靶向适配子。所述成骨细胞靶向适配子对成骨细胞具有靶向作用,可使外泌体迁移并作用于成骨细胞,提高了外泌体的生物利用率,达到促进成骨细胞增殖,促进骨密度增加、修复骨缺损的目的。
优选地,所述适配子的序列为:
5′-cccacgtctgcgcttagctcctgggcctggatgggc-3′。
优选地,所述适配子的3′或5′端进行了氨基修饰。普通的适配子难以和外泌体结合,利用酰胺缩合反应,进行氨基修饰后的适配子能与外泌体进行有效结合,修饰后的适配子为:适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺,化学结构式为:
使用二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基对适配子进行修饰,得到具有脂质分子结构的适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺,能与外泌体进行有效结合。
优选地,所述适配子的修饰方法包括以下步骤:
1)将二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺溶于适量ddh2o中,调节反应体系的ph值为5~6,室温搅拌40~60min,获得第一溶液;
2)将所述第一溶液用焦碳酸二乙酯处理水透析后,得到二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺;
3)取未经修饰的适配子,溶于焦碳酸二乙酯处理水,置于85℃水浴10min,然后迅速冰浴10min,获得活化适配子的焦炭酸二乙酯处理水溶液;
4)将所述二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺、活化适配子的焦炭酸二乙酯处理水溶液和三乙胺混合,室温搅拌8-12h,获得第二溶液;
5)将所述第二溶液利用焦碳酸二乙酯处理水超滤后,得到适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺。
本发明利用酰胺缩合反应对适配子进行基团修饰,使适配子获得脂质分子结构,以便能够与外泌体进行融合,并且操作过程简单,获得的适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺纯度高。
优选地,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:(10~30):(100~300)。
优选地,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:(15~20):(150~200)。
优选地,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:10:100。
优选地,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:30:300。
优选地,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:18:160。
优选地,步骤2)中所述透析过程具体为:
1)反应结束后,将所述第一溶液装入透析袋,将透析袋浸入焦碳酸二乙酯处理水中,缓慢搅拌,直至透析袋内外物质浓度达到平衡;
2)透析袋内外物质浓度达到平衡后,更换新的焦碳酸二乙酯处理水,重复步骤1)3次,每次透析2-4h。
优选地,步骤5)中,所述超滤过程具体为:
1)将所述第二溶液装入超滤管内管,10000rpm离心30-40min;
2)当超滤管内管液体达到最小体积后,加焦碳酸二乙酯处理水稀释样品,重复步骤1)3次。
优选地,所述外泌体为间充质干细胞外泌体。
更优选地,所述间充质干细胞外泌体选自骨髓间充质干细胞外泌体、脐带血间充质干细胞外泌体、脐带组织间充质干细胞外泌体、胎盘组织间充质干细胞外泌体或脂肪组织间充质干细胞外泌体。
本发明第二方面,提供一种组合物,所述组合物的活性成分为上述的复合体。本发明的组合物可以加快来自慢性不愈合伤口的成纤维细胞的生长和迁移,并能有效激活生长因子信号通路,提高血管生成相关基因和基质蛋白的表达,诱导新生血管的生成或成骨细胞的生成,因此,本发明提供的组合物可作为安全有效的产品促进慢性难愈合伤口或骨缺损伤口的愈合。
本发明第三方面,提供上述复合体或上述组合物在促进血管新生方面的用途。所述血管包括动脉血管、静脉血管和毛细血管。所述毛细血管包括存在于皮肤真皮层、骨组织、心肌细胞中的毛细血管。
本发明第四方面,提供上述的复合体或上述的组合物在制备皮肤疾病治疗药物中的用途。
优选地,所述皮肤疾病包括皮肤损伤、皮肤感染、褥疮或糖尿病溃疡。
本发明第五方面,提供一种组织修复材料,所述组织修复材料的组分包括复合体和凝胶材料,所述复合体由适配子和外泌体结合而成。
现有技术中,利用水凝胶包埋活性药物、蛋白质和细胞等,可以通过扩散作用和凝胶的降解作用使活性物质达到长效缓释的效果,但在治疗中由于缺少成血管和成骨等组织修复的关键环节,治疗效果大打折扣。本发明利用酰胺缩合反应、相似相溶原理和混悬的方法构建的组织修复材料,通过实验证实,本发明提供的组织修复材料不但可以通过扩散作用和凝胶的降解作用使活性物质达到长效缓释的效果,而且本发明的组织修复材料具有明显的促进血管生成的能力和组织修复能力,可以加速难愈合伤口愈合,促进胶原在组织损伤部位的沉积,促肉芽组织成熟和表皮再生。
优选地,每个复合体包含所述适配子和外泌体的数量比为:n:1,n≧1,n为整数。
优选地,所述适配子选自血管内皮细胞靶向适配子。
优选地,所述适配子的序列为:
5′-cccacgtctgcgcttagctcctgggcctggatgggc-3′。
优选地,所述适配子的3′或5′端进行了-nh2修饰,修饰后的适配子为:适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺,化学结构式为:
优选地,所述适配子的修饰方法包括以下步骤:
1)将二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺溶于适量ddh2o中,调节反应体系的ph值为5~6,室温搅拌40~60min,获得第一溶液;
2)将所述第一溶液用焦碳酸二乙酯处理水透析后,得到二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺;
3)取未经修饰的适配子,溶于焦碳酸二乙酯处理水,置于85℃水浴10min,然后迅速冰浴10min,获得活化适配子的焦炭酸二乙酯处理水溶液;
4)将所述二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺、活化适配子的焦炭酸二乙酯处理水溶液和三乙胺混合,室温搅拌8-12h,获得第二溶液;
5)将所述第二溶液利用焦碳酸二乙酯处理水超滤后,得到适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺。
优选地,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:(10~30):(100~300)。
优选地,步骤2)中所述透析过程具体为:
1)反应结束后,将所述第一溶液装入透析袋,将透析袋浸入焦碳酸二乙酯处理水中,缓慢搅拌,直至透析袋内外物质浓度达到平衡;
2)透析袋内外物质浓度达到平衡后,更换新的焦碳酸二乙酯处理水,重复步骤1)3次,每次透析2-4h。
优选地,步骤5)中,所述超滤过程具体为:
1)将所述第二溶液装入超滤管内管,10000rpm离心30-40min;
2)当超滤管内管液体达到最小体积后,加焦碳酸二乙酯处理水稀释样品,重复步骤1)3次。
优选地,所述外泌体为间充质干细胞外泌体。
更优选地,所述间充质干细胞外泌体选自骨髓间充质干细胞外泌体、脐带血间充质干细胞外泌体、脐带组织间充质干细胞外泌体、胎盘组织间充质干细胞外泌体或脂肪组织间充质干细胞外泌体。
优选地,所述凝胶材料选自胶原蛋白、海藻酸盐和透明质酸钠中的至少一种。
本发明第六方面,提供一种组织修复材料的制备方法,包括以下步骤:
1)常规培养间充质干细胞,利用超速离心法提取间充质干细胞来源的外泌体;
2)用焦碳酸二乙酯处理pbs缓冲液作为溶剂,将适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺与所述外泌体37℃搅拌4~6h;
3)利用焦碳酸二乙酯处理pbs缓冲液超滤后,得到适配子修饰的间充质干细胞外泌体悬液;
4)向上述适配子修饰的间充质干细胞外泌体悬液中加入适量凝胶材料,充分混匀,即得到所述组织修复材料。
使用本发明组织修复材料的制备方法获得的组织修复材料构造了一种具有强靶向能力和低免疫原性的治疗体系,并且该制备方法操作简单,解决了现有技术中组织修复材料合成繁琐和制备效率低下的问题。
优选地,所述凝胶材料选自胶原蛋白、海藻酸盐和透明质酸钠中的至少一种。
优选地,所述适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺由以下方法制备而成:
1)将二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺溶于适量ddh2o中,调节反应体系的ph值为5~6,室温搅拌40~60min,获得第一溶液;
2)将所述第一溶液用焦碳酸二乙酯处理水透析后,得到二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺;
3)取未经修饰的适配子,溶于焦碳酸二乙酯处理水,置于85℃水浴10min,然后迅速冰浴10min,获得活化适配子的焦炭酸二乙酯处理水溶液;
4)将所述二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺、活化适配子的焦炭酸二乙酯处理水溶液和三乙胺混合,室温搅拌8-12h,获得第二溶液;
5)将所述第二溶液利用焦碳酸二乙酯处理水超滤后,得到适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺。
优选地,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:(10~30):(100~300)。
优选地,步骤2)中所述透析过程具体为:
1)反应结束后,将所述第一溶液装入透析袋,将透析袋浸入焦碳酸二乙酯处理水中,缓慢搅拌,直至透析袋内外物质浓度达到平衡;
2)透析袋内外物质浓度达到平衡后,更换新的焦碳酸二乙酯处理水,重复步骤1)3次,每次透析2-4h。
优选地,步骤5)中,所述超滤过程具体为:
1)将所述第二溶液装入超滤管内管,10000rpm离心30-40min;
2)当超滤管内管液体达到最小体积后,加焦碳酸二乙酯处理水稀释样品,重复步骤1)3次。
本发明第七方面,提供上述组织修复材料在制备皮肤疾病治疗产品中的用途。
优选地,所述皮肤疾病包括皮肤损伤、皮肤感染、褥疮或糖尿病溃疡。
本发明第八方面,提供一种皮肤损伤修复凝胶,所述皮肤损伤修复凝胶的组分包含上述的组织修复材料。
本发明利用酰胺缩合反应、相似相溶原理和混悬的方法构建的组织修复材料,通过实验证实,本发明提供的组织修复材料不但可以通过扩散作用和凝胶的降解作用使活性物质达到长效缓释的效果,而且本发明的组织修复材料具有明显的促进血管生成的能力和组织修复能力,可以加速难愈合伤口愈合,促进胶原在组织损伤部位的沉积,促肉芽组织成熟和表皮再生。
本发明第九方面,提供一种糖尿病溃疡修复敷料,所述糖尿病溃疡修复敷料包含上述的组织修复材料。本发明提供的糖尿病溃疡修复敷料,具有明显的促进血管生成的能力和组织修复能力,可以加速糖尿病导致的慢性难愈合溃疡的伤口愈合,促进胶原在溃疡部位的沉积,促进肉芽组织成熟和溃疡部位表皮再生。
本发明第十方面,提供一种足贴,所述足贴包含上述述的组织修复材料和胶贴,所述组织修复材料黏贴在所述胶贴上。本发明提供的足贴的形状针对足部设计,能有效固定于足部溃疡部位,不影响日常行走,并能有效促进足部伤口特别是足部慢性难愈合糖尿病足溃疡的愈合。优选地,本发明所述胶贴选自无纺布、纺粘布、聚乙烯薄膜或医用pu膜。
术语解释:
本发明所述的ddh2o指将经过一次蒸馏后,再次蒸馏所得到的水,也称双蒸水或重蒸水。
本发明所述的焦碳酸二乙酯处理水是指经焦碳酸二乙酯处理过并经高温高压灭菌的高纯水,不含杂质rna、dna和蛋白质。本发明所述的焦碳酸二乙酯处理水采购自生工生物工程(上海)股份有限公司,编号:b501005-0500。
本发明所述的焦碳酸二乙酯处理pbs缓存液是指经过焦碳酸二乙酯处理的pbs缓存液,不含杂质rna、dna和蛋白质。本发明所述的焦碳酸二乙酯处理pbs缓存液采购自生工生物工程(上海)股份有限公司,编号:b501005-0500。
本发明所述的pbs缓冲液是指磷酸缓冲盐溶液。
tae缓冲液是指由三羟甲基氨基甲烷(trisbase)、乙酸(aceticacid)和乙二胺四乙酸(edta)组成的缓冲液。
附图说明
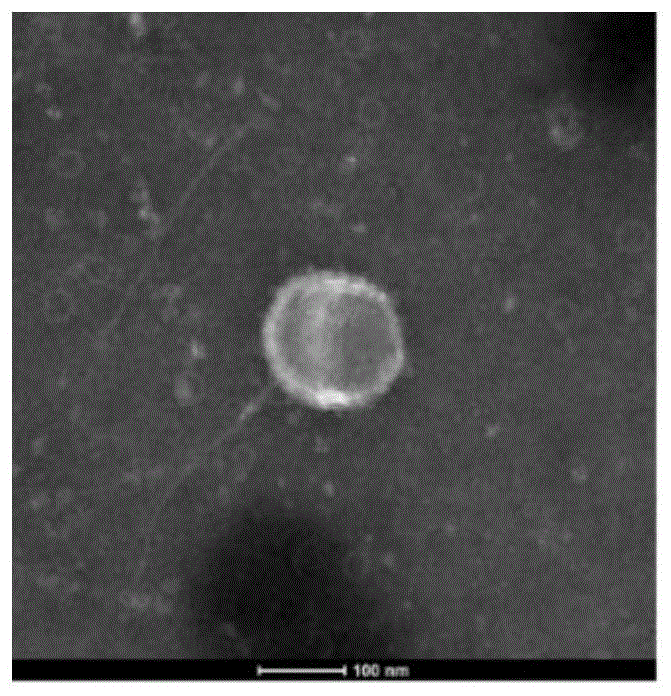
图1a为本发明实施例中所述外泌体的透射电镜结果图;
图1b为本发明实施例中所述复合体的透射电镜结果图;
图2a为本发明实施例中所述外泌体的粒径分布;
图2b为本发明实施例中所述复合体的粒径分布;
图3为本发明实施例所述的复合体的琼脂糖凝胶电泳鉴定结果图;
图4a为本发明实施例中所用适配子对血管内皮细胞组的靶向荧光图;
图4b为本发明实施例中所用适配子对间充质干细胞组的靶向荧光图;
图5a为本发明实施例中适配子-羧基荧光素-透明质酸组给药2天后皮肤创面组织的hochest染色图;
图5b为本发明实施例中适配子-羧基荧光素-透明质酸组给药2天后皮肤创面组织的fam荧光图;
图5c为本发明实施例中适配子-羧基荧光素-透明质酸组给药2天后皮肤创面的经cd31染色后的荧光图;
图5d为本发明实施例中适配子-羧基荧光素-透明质酸组给药2天后皮肤创面的的merge荧光图;
图6a为本发明实施例中透明质酸组给药2天后皮肤创面组织的hochest染色图;
图6b为本发明实施例中透明质酸组给药2天后皮肤创面组织的fam荧光图;
图6c为本发明实施例中透明质酸组给药2天后皮肤创面组织经cd31染色后的荧光图;
图6d为本发明实施例中透明质酸组给药2天后的merge荧光图;
图7a为本发明实施例中pbs组滴注2天后皮肤创面组织的hochest染色图;
图7b为本发明实施例中pbs组滴注2天后皮肤创面组织的fam荧光图;
图7c为本发明实施例中pbs组滴注2天后皮肤创面组织经cd31染色后的荧光图;
图7d为本发明实施例中pbs组滴注2天后皮肤创面组织的merge荧光图;
图8a为本发明实施例中组织修复材料组给药4天后皮肤创面组织的hochest染色荧光图;
图8b为本发明实施例中组织修复材料组给药4天后皮肤创面组织的经cd31染色后的免疫荧光图;
图8c为本发明实施例中组织修复材料组给药4天后皮肤创面组织的经emcn染色后的免疫荧光图;
图8d为本发明实施例中组织修复材料组给药4天后皮肤创面组织的merge荧光图;
图8e为本发明实施例中组织修复材料组给药4天后皮肤创面组织的血管图;
图9a为本发明实施例中外泌体凝胶组给药4天后皮肤创面组织的hochest染色荧光图;
图9b为本发明实施例中外泌体凝胶组给药4天后皮肤创面组织经cd31染色后的免疫荧光图;
图9c为本发明实施例中外泌体凝胶组给药4天后皮肤创面组织经emcn染色后的免疫荧光图;
图9d为本发明实施例中外泌体凝胶组给药4天后皮肤创面组织的merge荧光图;
图9e为本发明实施例中外泌体凝胶组给药4天后皮肤创面组织的血管图;
图10a为本发明实施例中透明质酸组给药4天后皮肤创面组织的hochest染色荧光图;
图10b为本发明实施例中透明质酸组给药4天后皮肤创面组织经cd31染色后的免疫荧光图;
图10c为本发明实施例中透明质酸组给药4天后皮肤创面组织经emcn染色后的免疫荧光图;
图10d为本发明实施例中透明质酸组给药4天后皮肤创面组织的merge荧光图;
图10e为本发明实施例中透明质酸组给药4天后皮肤创面组织的血管图;
图11a为本发明实施例中pbs组滴注4天后皮肤创面组织的hochest染色荧光图;
图11b为本发明实施例中pbs组滴注4天后皮肤创面组织经cd31染色后的免疫荧光图;
图11c为本发明实施例中pbs组滴注4天后皮肤创面组织经emcn染色后的免疫荧光图;
图11d为本发明实施例中pbs组滴注4天后皮肤创面组织的merge荧光图;
图11e为本发明实施例中pbs组滴注4天后皮肤创面组织的血管图;
图12a为涂抹本发明实施例的组织修复材料前的皮肤损伤图;
图12b为涂抹外泌体凝胶前的皮肤损伤图;
图12c为涂抹透明质酸前的皮肤损伤图;
图13a为涂抹本发明实施例的组织修复材料4天后的皮肤损伤图;
图13b为涂抹外泌体凝胶4天后后的皮肤损伤图;
图13c为涂抹透明质酸4天后后的皮肤损伤图;
图14a为涂抹本发明实施例的组织修复材料8天后的皮肤损伤图;
图14b为涂抹外泌体凝胶8天后后的皮肤损伤图;
图14c为涂抹透明质酸8后后的皮肤损伤图;
图15a为涂抹本发明实施例的组织修复材料12天后的皮肤损伤图;
图15b为涂抹外泌体凝胶12天后的皮肤损伤图;
图15c为涂抹透明质酸12天后的皮肤损伤图;
图16a显示了本发明实施例的组织修复材料修复损伤皮肤后的苏木精—伊红染色图;
图16b显示了外泌体凝胶修复损伤皮肤后的苏木精-伊红染色图;
图16c显示了透明质酸修复损伤皮肤后的苏木精-伊红染色图;
图17a为本发明实施例所述组织修复材料治疗损伤皮肤后的masson染色图;
图17b为外泌体凝胶治疗损伤皮肤后的masson染色图;
图17c为透明质酸治疗损伤皮肤后的masson染色图。
具体实施例
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
一、试剂耗材
二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基:采购自avantipolarlipids公司,编号880135p;
n-羟基琥珀酰亚胺:采购自阿拉丁试剂(上海)有限公司,编号h109330;
1-(3-二甲氨基丙基)-3-乙基碳二亚胺:采购自上海麦克林生化科技有限公司,编号n807578;血管靶向适配子:采购自生工生物工程(上海)股份有限公司,cccacgtctgcgcttagctcctgggcctggatgggc;
三乙胺:采购自阿拉丁试剂(上海)有限公司,编号t103289;
焦碳酸二乙酯处理水:采购自生工生物工程(上海)股份有限公司,编号b501005-0500;
焦碳酸二乙酯处理pbs:采购自生工生物工程(上海)股份有限公司,编号b540627-0500;
透明质酸:采购自上海麦克林生化科技有限公司,编号h823435;
cd31荧光一抗:采购自r&d公司,编号fab3628g;
cd31一抗:采购自abcam公司,编号ab28364;
emcn一抗:采购自santacruzbiotechnology公司,编号sc-6549;
二抗:采购自上海翊圣生物科技有限公司,编号33308es60;
透析袋:采购自上海源叶生物科技有限公司,编号sp131084;
5kd超滤离心管:采购自sartorius公司,编号vs0112;
30kd超滤离心管:采购自millipore公司,编号ufc203024。
实施例1:
本发明实施例提供一种复合体,所述复合体由靶向基团和药用囊泡结合而成,所述靶向基团选自适配子,所述药用囊泡选自外泌体。
本发明实施例利用适配子对特定细胞的靶向作用,使外泌体迁移并作用于目标细胞,提高了外泌体的生物利用率,达到促进组织修复的目的。经过适配子修饰的外泌体可以加快来自慢性不愈合伤口的成纤维细胞的生长和迁移,并能有效激活生长因子信号通路,提高血管生成相关基因和基质蛋白的表达,诱导新生血管的生成,因此,本发明提供的复合体可作为安全有效的产品促进慢性难愈合伤口或骨缺损伤口的愈合。
在一些实施例中,每个复合体包含所述适配子和外泌体的数量比为:n:1,n≧1,n为整数。
在一些实施例中,所述适配子选自血管内皮细胞靶向适配子。所述血管内皮细胞靶向适配子对血管内皮细胞具有靶向作用,可使外泌体迁移并作用于血管内皮细胞,提高了外泌体的生物利用率,达到促进血管内皮细胞增殖,组织血管修复的目的。
在一些实施例中,所述适配子选自成骨细胞靶向适配子。所述成骨细胞靶向适配子对成骨细胞具有靶向作用,可使外泌体迁移并作用于成骨细胞,提高了外泌体的生物利用率,达到促进成骨细胞增殖,促进骨密度增加、修复骨缺损的目的。
在一些实施例中,所述适配子的序列为:
5′-cccacgtctgcgcttagctcctgggcctggatgggc-3′。
在一些实施例中,所述适配子的3′或5′端进行了氨基修饰。普通的适配子难以和外泌体结合,利用酰胺缩合反应,进行氨基修饰后的适配子能与外泌体进行有效结合。
在一些实施例中,修饰后的适配子为:适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺,化学结构式为:
使用二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基对适配子进行修饰,得到具有脂质分子结构的适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺,能与外泌体进行有效结合。
在一些实施例中,所述适配子的修饰方法包括以下步骤:
1)将二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺溶于适量ddh2o中,调节反应体系的ph值为5~6,室温搅拌40~60min,获得第一溶液;
2)将所述第一溶液用焦碳酸二乙酯处理水透析后,得到二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺;
3)取未经修饰的适配子,溶于焦碳酸二乙酯处理水,置于85℃水浴10min,然后迅速冰浴10min,获得活化适配子的焦炭酸二乙酯处理水溶液;
4)将所述二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺、活化适配子的焦炭酸二乙酯处理水溶液和三乙胺混合,室温搅拌8-12h,获得第二溶液;
5)将所述第二溶液利用焦碳酸二乙酯处理水超滤后,得到适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺。
本发明利用酰胺缩合反应对适配子进行基团修饰,使适配子获得脂质分子结构,以便能够与外泌体进行融合,并且操作过程简单,获得的适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺纯度高。
本实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:(10~30):(100~300)。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:10:100。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:10:150。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:10:200。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:10:300。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:20:100。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:20:150。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:20:200。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:20:300。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:30:100。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:30:150。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:30:200。
在一些实施例中,步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:30:300。
步骤2)中所述透析过程具体为:
1)反应结束后,将所述第一溶液装入透析袋,将透析袋浸入焦碳酸二乙酯处理水中,缓慢搅拌,直至透析袋内外物质浓度达到平衡;
2)透析袋内外物质浓度达到平衡后,更换新的焦碳酸二乙酯处理水,重复步骤1)3次,每次透析2-4h。
步骤5)中所述超滤过程具体为:
1)将所述第二溶液装入超滤管内管,10000rpm离心30-40min;
2)当超滤管内管液体达到最小体积后,加焦碳酸二乙酯处理水稀释样品,重复步骤1)3次。
在一些实施例中,所述外泌体为间充质干细胞外泌体,例如:骨髓间充质干细胞外泌体、脐带血间充质干细胞外泌体、脐带组织间充质干细胞外泌体、胎盘组织间充质干细胞外泌体或脂肪组织间充质干细胞外泌体。
实施例2
本实施例提供一种组合物,所述组合物的活性成分为实施例1中所述的复合体。本发明的组合物可以加快来自慢性不愈合伤口的成纤维细胞的生长和迁移,并能有效激活生长因子信号通路,提高血管生成相关基因和基质蛋白的表达,诱导新生血管的生成或成骨细胞的生成,因此,本发明提供的组合物可作为安全有效的产品促进慢性难愈合伤口或骨缺损伤口的愈合。
实施例3
本实施例提供实施例1中的复合体或实施例2中的组合物在促进血管新生方面的用途。所述血管包括动脉血管、静脉血管和毛细血管。所述毛细血管包括存在于皮肤真皮层、骨组织、心肌细胞中的毛细血管。
实施例4
本实施例提供实施例1中的复合体或实施例2中的组合物在制备皮肤疾病治疗药物中的用途。
在一些实施例中,所述皮肤疾病包括皮肤损伤、皮肤感染、褥疮或糖尿病溃疡。
实施例5
本实施例提供一种组织修复材料,所述组织修复材料的组分包括复合体和凝胶材料,所述复合体由适配子和外泌体结合而成。
现有技术中,利用水凝胶包埋活性药物、蛋白质和细胞等,可以通过扩散作用和凝胶的降解作用使活性物质达到长效缓释的效果,但在治疗中由于缺少成血管和成骨等组织修复的关键环节,治疗效果大打折扣。本发明利用酰胺缩合反应、相似相溶原理和混悬的方法构建的组织修复材料,通过实验证实,本发明提供的组织修复材料不但可以通过扩散作用和凝胶的降解作用使活性物质达到长效缓释的效果,而且本发明的组织修复材料具有明显的促进血管生成的能力和组织修复能力,可以加速难愈合伤口愈合,促进胶原在组织损伤部位的沉积,促肉芽组织成熟和表皮再生。
在一些实施例中,每个复合体包含所述适配子和外泌体的数量比为:n:1,n≧1,n为整数。
在一些实施例中,所述适配子选自血管内皮细胞靶向适配子。
在一些实施例中,所述适配子的序列为:
5′-cccacgtctgcgcttagctcctgggcctggatgggc-3′。
在一些实施例中,所述适配子的3′或5′端进行了-nh2修饰,修饰后的适配子为:适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺,化学结构式为:
在一些实施例中,所述适配子的修饰方法包括以下步骤:
1)将二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺溶于适量ddh2o中,调节反应体系的ph值为5~6,室温搅拌40~60min,获得第一溶液;
2)将所述第一溶液用焦碳酸二乙酯处理水透析后,得到二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺;
3)取未经修饰的适配子,溶于焦碳酸二乙酯处理水,置于85℃水浴10min,然后迅速冰浴10min,获得活化适配子的焦炭酸二乙酯处理水溶液;
4)将所述二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺、活化适配子的焦炭酸二乙酯处理水溶液和三乙胺混合,室温搅拌8-12h,获得第二溶液;
5)将所述第二溶液利用焦碳酸二乙酯处理水超滤后,得到适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺。
步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:(10~30):(100~300)。
步骤2)中所述透析过程具体为:
1)反应结束后,将所述第一溶液装入透析袋,将透析袋浸入焦碳酸二乙酯处理水中,缓慢搅拌,直至透析袋内外物质浓度达到平衡;
2)透析袋内外物质浓度达到平衡后,更换新的焦碳酸二乙酯处理水,重复步骤1)3次,每次透析2-4h。
步骤5)中,所述超滤过程具体为:
1)将所述第二溶液装入超滤管内管,10000rpm离心30-40min;
2)当超滤管内管液体达到最小体积后,加焦碳酸二乙酯处理水稀释样品,重复步骤1)3次。
在一些实施例中,所述外泌体为间充质干细胞外泌体,例如:骨髓间充质干细胞外泌体、脐带血间充质干细胞外泌体、脐带组织间充质干细胞外泌体、胎盘组织间充质干细胞外泌体或脂肪组织间充质干细胞外泌体。
在一些实施例中,所述凝胶材料选自胶原蛋白、海藻酸盐和透明质酸钠中的至少一种。
实施例6
本实施例提供一种组织修复材料的制备方法,包括以下步骤:
1)常规培养间充质干细胞,利用超速离心法提取间充质干细胞来源的外泌体;
2)用焦碳酸二乙酯处理pbs缓冲液作为溶剂,将适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺与所述外泌体37℃搅拌4~6h;
3)利用焦碳酸二乙酯处理pbs缓冲液超滤后,得到适配子修饰的间充质干细胞外泌体悬液;
4)向上述适配子修饰的间充质干细胞外泌体悬液中加入适量凝胶材料,充分混匀,即得到所述组织修复材料。
使用本发明组织修复材料的制备方法获得的组织修复材料构造了一种具有强靶向能力和低免疫原性的治疗体系,并且该制备方法操作简单,解决了现有技术中组织修复材料合成繁琐和制备效率低下的问题。
在一些实施例中,所述适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺由以下方法制备而成:
1)将二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺溶于适量ddh2o中,调节反应体系的ph值为5~6,室温搅拌40~60min,获得第一溶液;
2)将所述第一溶液用焦碳酸二乙酯处理水透析后,得到二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺;
3)取未经修饰的适配子,溶于焦碳酸二乙酯处理水,置于85℃水浴10min,然后迅速冰浴10min,获得活化适配子的焦炭酸二乙酯处理水溶液;
4)将所述二硬脂酰磷脂酰乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺、活化适配子的焦炭酸二乙酯处理水溶液和三乙胺混合,室温搅拌8-12h,获得第二溶液;
5)将所述第二溶液利用焦碳酸二乙酯处理水超滤后,得到适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺。
步骤1)中所述的二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺的物质的量之比为1:(10~30):(100~300)。
步骤2)中所述透析过程具体为:
1)反应结束后,将所述第一溶液装入透析袋,将透析袋浸入焦碳酸二乙酯处理水中,缓慢搅拌,直至透析袋内外物质浓度达到平衡;
2)透析袋内外物质浓度达到平衡后,更换新的焦碳酸二乙酯处理水,重复步骤1)3次,每次透析2-4h。
步骤5)中,所述超滤过程具体为:
1)将所述第二溶液装入超滤管内管,10000rpm离心30-40min;
2)当超滤管内管液体达到最小体积后,加焦碳酸二乙酯处理水稀释样品,重复步骤1)3次。
实施例7
本实施例提供上述组织修复材料在制备皮肤疾病治疗产品中的用途。
在一些实施例中,所述皮肤疾病包括皮肤损伤、皮肤感染、褥疮或糖尿病溃疡。
实施例8
本实施例提供一种皮肤损伤修复凝胶,所述皮肤损伤修复凝胶的组分包含实施例5中的组织修复材料。
本发明利用酰胺缩合反应、相似相溶原理和混悬的方法构建的组织修复材料,通过实验证实,本发明提供的组织修复材料不但可以通过扩散作用和凝胶的降解作用使活性物质达到长效缓释的效果,而且本发明的组织修复材料具有明显的促进血管生成的能力和组织修复能力,可以加速难愈合伤口愈合,促进胶原在组织损伤部位的沉积,促肉芽组织成熟和表皮再生。
实施例9
本实施例提供一种糖尿病溃疡修复敷料,所述糖尿病溃疡修复敷料包含实施例5中的组织修复材料。本发明提供的糖尿病溃疡修复敷料,具有明显的促进血管生成的能力和组织修复能力,可以加速糖尿病导致的慢性难愈合溃疡的伤口愈合,促进胶原在溃疡部位的沉积,促进肉芽组织成熟和溃疡部位表皮再生。
实施例10
本实施例提供一种足贴,所述足贴包含所述的组织修复材料和胶贴,所述组织修复材料黏贴在所述胶贴上。本发明提供的足贴的形状为贴合足部结构的形状,可以是方形、圆形,并可任意裁剪成需要的形状,本发明提供的足贴可固定于足部溃疡部位,不影响日常行走,并能有效促进足部伤口特别是足部慢性难愈合糖尿病足溃疡的愈合。
在一些实施例中,所述胶贴的材料选自无纺布、纺粘布、聚乙烯薄膜或医用pu膜。
效果验证:
一、实施例1所述的复合体的透射电子显微镜(tem)及粒径分析
将30μg的外泌体和复合体分别用pbs稀释至适当浓度,滴在200/300目f/c的tem铜网上,自然吸附样品至3分钟后将过量样品吸出,随后将吸附的样品用10μl3%的磷钨酸染色30秒,再将多余的染剂用滤纸吸出,自然风干后检测。同时,取30μg的外泌体和复合体,分别用pbs稀释至适当浓度,使用纳米激光粒度分析仪测量粒径分布。
参考图1a-图2b,图1a为外泌体的电镜图,图1a可以看到直径约为100nm的具有清晰膜结构的杯状膜泡;图1b为复合体的电镜图,从图1b可以看到,适配子成功连接到外泌体膜表面,呈微球状;图2a显示了外泌体的粒径分布;图2b显示了复合体的粒径分布;可以看出,外泌体的粒径尺寸大多分布在90nm左右,复合体的粒径尺寸大多分布在300nm左右。
二、复合体的琼脂糖凝胶电泳鉴定
将有机玻璃的电泳凝胶床洗净,晾干,放在水平的工作台上,插上样品梳;称取0.6g琼脂糖置于锥形瓶中,加入30mltae缓冲溶液,微波炉加热至全部融化,加入3μl核酸染料后摇匀,待琼脂糖溶液冷却到50~60℃,缓慢倒入安装好的电泳槽水平板上;待琼脂糖溶液凝固后,在电泳槽内加入电泳缓冲液,然后拔出梳子,将适配子、适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺及复合体与电泳缓冲液按10:1混匀后,用微量移液器将混合液加到样品槽中,每槽加10μl;安装好电极导线,点样孔一端接负极,另一端接正极,打开电源,调电压至30-40v/cm,当溴酚蓝移到距凝胶前沿1-2cm时,停止电泳,采用凝胶成像系统拍照保存。
电泳结果如图3所示,条带1为适配子琼脂糖凝胶电泳鉴定结果,条带2为适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺的琼脂糖凝胶电泳鉴定结果,条带3为复合体的琼脂糖凝胶电泳鉴定结果,由于适配子、适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺及复合体的分子量依次增大,条带的电泳速度也依次减慢,证明中间产物适配子-聚乙二醇-二硬脂酰磷脂酰乙醇胺及最终产物复合体成功合成。
三、适配子特异性靶向血管内皮细胞能力检测
细胞爬片放于24孔板中,将血管内皮细胞和间充质干细胞分别以适宜浓度接种于24孔板,待细胞长至对数生长期,将5od适配子-羧基荧光素(apt-fam)溶于100μl焦碳酸二乙酯处理水配制贮存液,置于85℃水浴10min,然后迅速冰浴10min,用dmem培养基将apt-fam贮存液稀释至10μm,处理细胞2h后,pbs清洗数次,用5μm的hochest染核5min,固定,封片,用荧光显微镜进行观察成像。
图4a显示了血管内皮细胞组的靶向荧光图;图4b显示了间充质干细胞组的靶向荧光图;从图4a和图4b可以看出,血管内皮细胞组的荧光强度高于间充质干细胞组,说明所用的适配子对血管内皮细胞具有较好的靶向能力。
四、适配子在体内特异性靶向血管能力检测
将小鼠麻醉后剃去背中部毛,用特制打孔器切割一个直径为1.0cm的圆形创面,深至皮下,形成机械损伤动物模型。造模后第2天将小鼠随机分为3组,分别设置pbs组、透明质酸组和适配子-羧基荧光素-透明质酸组给药,于给药后第2天取材,立即放入4%多聚甲醛中固定4~6h,后转至30%蔗糖溶液至组织沉底,包埋冰冻组织块,冰冻切片机切片30μm,室温放置30min以上防脱片,1×pbs洗3次,每次5min,免疫组化笔画圈,2%bsa室温封闭1h,1×pbs清洗,cd31一抗4℃孵育过夜,1×pbs清洗,二抗室温避光孵育1h,1×pbs清洗,hochest室温染核20min,1×pbs清洗,滴加防淬灭剂,封片,荧光显微镜观察结果如图5a-图7d所示,其中,图5a显示了适配子-羧基荧光素-透明质酸组给药2天后皮肤创面组织的hochest染色图;图5b显示了适配子-羧基荧光素-透明质酸组给药2天后皮肤创面组织的fam荧光图;图5c显示了适配子-羧基荧光素-透明质酸组给药2天后皮肤创面组织经cd31染色后的荧光图;图5d显示了适配子-羧基荧光素-透明质酸组给药2天后皮肤创面组织的merge荧光图;图6a显示了透明质酸组给药2天后皮肤创面组织的hochest染色图;图6b显示了透明质酸组给药2天后的皮肤创面组织fam荧光图;图6c显示了透明质酸组给药2天后皮肤创面组织经cd31染色后的荧光图;图6d显示了透明质酸组给药2天后皮肤创面组织的merge荧光图;图7a显示了pbs组滴注2天后皮肤创面组织的hochest染色图;图7b显示了pbs组滴注2天后皮肤创面组织的fam荧光图;图7c显示了pbs组滴注2天后皮肤创面组织经cd31染色后的荧光图;图7d显示了pbs组滴注2天后皮肤创面组织的merge荧光图。
cd31又称为血小板-内皮细胞粘附分子,通常位于血管内皮细胞、血小板、巨噬细胞等,可以用于评估血管生成,结合图5a-图7d可以看出,适配子-羧基荧光素-透明质酸组中带有fam荧光基团的适配子与皮肤创面组织中的cd31共染后有部分重叠,而透明质酸组和pbs组无fam显色,表明该实施例中的适配子在体内也具有良好的血管靶向能力。
五、本实施例5所述的组织修复材料促进血管生成能力检测
将小鼠麻醉后剃去背中部毛,用特制打孔器切割一个直径为1.0cm的圆形创面,深至皮下,形成机械损伤动物模型。造模后将小鼠随机分为4组,分别设置组织修复材料组、外泌体凝胶组、透明质酸组和pbs组给药,于给药后第4天取材,立即放入4%多聚甲醛中固定4~6h,后转至30%蔗糖溶液至组织沉底,包埋冰冻组织块,冰冻切片机切片30μm,室温放置30min以上防脱片,1×pbs洗3次,每次5min,免疫组化笔画圈,2%bsa室温封闭1h,1×pbs清洗,cd31荧光一抗和emcn一抗4℃孵育过夜,1×pbs清洗,二抗室温避光孵育1h,1×pbs清洗,hochest室温染核20min,1×pbs清洗,滴加防淬灭剂,封片。
图8a-图11e显示了组织修复材料组、外泌体凝胶组、透明质酸组和pbs组给药后的免疫荧光成像图和血管图,其中,图8a显示了组织修复材料组给药4天后皮肤创面组织的hochest染色免疫荧光图;图8b显示了组织修复材料组给药4天后皮肤创面组织经cd31染色后的免疫荧光图;图8c显示了组织修复材料组给药4天后皮肤创面组织经emcn染色后的免疫荧光图;图8d显示了组织修复材料组给药4天后皮肤创面组织的merge荧光图;图8e显示了组织修复材料组给药4天后皮肤创面组织的血管图;图9a显示了外泌体凝胶组给药4天后皮肤创面组织的hochest染色免疫荧光图;图9b显示了外泌体凝胶组给药4天后皮肤创面组织经cd31染色后的免疫荧光图;图9c显示了外泌体凝胶组给药4天后皮肤创面组织经emcn染色后的免疫荧光图;图9d显示了外泌体凝胶组给药4天后皮肤创面组织的merge荧光图;图9e显示了外泌体凝胶组给药4天后皮肤创面组织的血管图;图10a显示了透明质酸组给药4天后皮肤创面组织的hochest染色免疫荧光图;图10b显示了透明质酸组给药4天后皮肤创面组织经cd31染色后的免疫荧光图;图10c显示了透明质酸组给药4天后皮肤创面组织经emcn染色后的免疫荧光图;图10d显示了透明质酸组给药4天后皮肤创面组织的merge荧光图;图10e显示了透明质酸组给药4天后皮肤创面组织的血管图;图11a显示了pbs组滴注4天后皮肤创面组织的hochest染色免疫荧光图;图11b显示了pbs组滴注4天后皮肤创面组织cd31染色后的免疫荧光图;图11c显示了pbs组滴注4天后皮肤创面组织经emcn染色后的免疫荧光图;图11d显示了pbs组滴注4天后皮肤创面组织的merge荧光图;图11e显示了pbs组滴注4天后皮肤创面组织的血管图。
从图8a-图11e可以看出,实施例5中的组织修复材料与外泌体凝胶组、透明质酸组和pbs组相比荧光显著增强,血管数目也明显增多,说明组织修复材料具有明显的促进血管生成的能力。
六、本实施例5所述的组织修复材料治疗皮肤损伤效果检测
将小鼠麻醉后剃去背中部毛,用特制打孔器切割一个直径为1.0cm的圆形创面,深至皮下,形成机械损伤动物模型。造模后随机分为3组,分别涂抹本发明实施例的组织修复材料、外泌体凝胶以及透明质酸,于给药后第0、4、8、12天对创伤进行拍照,计算创面愈合率。
愈合率=(原创伤面积-现创伤面积)/原创伤面积×100%
利用实施例5的组织修复材料治疗小鼠皮肤缺损,治疗效果参考图12a-15c,在第12天,组织修复材料组伤口愈合率为99.04%,而对照组外泌体凝胶和透明质酸的愈合率分别为88.92%和87.20%,显示组织修复材料具有良好的修复能力,可以加速伤口愈合。其中,图12a为涂抹本发明实施例的组织修复材料前的皮肤损伤图;图12b为涂抹外泌体凝胶前的皮肤损伤图;图12c为涂抹透明质酸前的皮肤损伤图;图13a为涂抹本发明实施例的组织修复材料4天后的皮肤损伤图;图13b为涂抹外泌体凝胶4天后后的皮肤损伤图;图13c为涂抹透明质酸4天后后的皮肤损伤图;图14a为涂抹本发明实施例的组织修复材料8天后的皮肤损伤图;图14b为涂抹外泌体凝胶8天后后的皮肤损伤图;图14c为涂抹透明质酸8后后的皮肤损伤图;图15a为涂抹本发明实施例的组织修复材料12天后的皮肤损伤图;图15b为涂抹外泌体凝胶12天后的皮肤损伤图;图15c为涂抹透明质酸12天后的皮肤损伤图。
七、本实施例5所述的组织修复材料治疗皮肤损伤后的苏木精-伊红染色检测用无菌手术器械取上述组织修复材料组、外泌体凝胶组以及透明质酸组的创面新生皮肤及创周部分正常皮肤,深达肌层;立即放入4%多聚甲醛中固定过夜;将固定的组织依次置于下列溶剂中脱水:于50%酒精中脱水0.5h→70%酒精脱水0.5h→80%酒精脱水0.5h→95%酒精脱水0.5h→100%酒精脱水0.5h,然后进行透明处理:1/2二甲苯+1/2酒精处理2h→二甲苯ⅰ处理1.5h→二甲苯ⅱ处理1.5h;将组织置于溶化的石蜡中,待石蜡完全浸入组织块后进行包埋,冷却凝固成块;将包埋好的蜡块固定于切片机上,切成3~5μm的薄片,贴到载玻片上,自然风干;将切片依次放入下列溶剂中脱蜡:放入二甲苯ⅰ中10min→二甲苯ⅱ中5min→1/2二甲苯+1/2酒精中5min→100%乙醇中2min→95%的乙醇中1min→80%乙醇中1min→75%乙醇中1min→蒸馏水中1min;将脱蜡的切片放入苏木精溶液中染色约10min,然后用自来水冲洗;放入1%盐酸酒精溶液中分化数秒,用自来水漂洗;将切片依次置于下列溶剂中脱水:
在70%酒精中脱水2h→80%酒精中脱水2h→95%酒精中脱水2h,然后置于伊红液中复染2min;对切片进行二次脱水:在80%酒精中脱水10min→95%酒精中脱水5min→100%酒精中脱水5min,然后进行透明处理:3/4二甲苯+1/4石碳酸中脱水1min→二甲苯ⅰ中脱水3min→二甲苯ⅱ中脱水5min;给已透明的组织切片滴加少量中性树脂,盖上盖玻片封固。
参考图16a-16c,苏木精-伊红染色检测结果显示,组织修复材料组具有更小的肉芽组织间隙宽度,表明其具有优良的促肉芽组织成熟能力和表皮再生能力。其中,图16a显示了本发明实施例的组织修复材料修复损伤皮肤后的苏木精—伊红染色图;图16b显示了外泌体凝胶修复损伤皮肤后的苏木精-伊红染色图;图16c显示了透明质酸修复损伤皮肤后的苏木精—伊红染色图。
八.本实施例5所述的组织修复材料治疗皮肤损伤的masson染色取组织修复材料、外泌体凝胶以及透明质酸治疗后的组织,进行切片,脱水,包埋,脱蜡;weigert铁苏木素(a、b液等比例混合)染色10min,水洗;1%盐酸酒精溶液中分化数秒,水洗;丽春红酸性品红溶液染7~8min,快速水洗;磷钼酸处理切片1min,倾去多余液体;苯胺蓝染液复染5min,快速水洗;脱水后用中性树胶封固。
胶原的合成和沉积也是伤口愈合的关键过程,masson染色是胶原纤维染色经典的技术方法,参考图17a-17c,相比于外泌体凝胶组以及透明质酸组,组织修复材料组显著促进了胶原沉积,其中,图17a为组织修复材料治疗损伤皮肤后的masson染色图;17b为外泌体凝胶治疗损伤皮肤后的masson染色图;17c为透明质酸治疗损伤皮肤后的masson染色图。
尽管以上结合附图对本发明的实施方案进行了描述,但是本发明并不局限于上述的具体实施方案和应用领域,上述的具体实施方案仅仅是示意性的、指导性的,而不是限制性的。本领域的普通技术人员在说明书的启示下,在不脱离本发明权利要求所保护的范围的情况下,还可以做出多种形式的变化,这些均属于本发明保护之列。
- 还没有人留言评论。精彩留言会获得点赞!