本发明属于生物技术领域,具体地说,涉及一种src酪氨酸激酶抑制剂在抑制炎症因子分泌中的应用。
背景技术:
炎症(inflammation):是机体对于外界刺激的一种防御反应。分为感染性炎症和非感染性炎症。通常情况下,炎症是有益的,是人体的防御反应,但是一些情况下,炎症也是有害的,与多种疾病的发生有关,例如:心脏疾病,神经病,糖尿病等。
脂肪型脂肪酸结合蛋白(a-fabp)又称为脂肪酸结合蛋白4(fabp4),是脂肪酸结合蛋白(fabps)家族中的一员,能结合多种疏水性化合物,在脂肪和卵巢组织中分布广泛,参与脂肪酸的合成代谢,它可逆地结合细胞内的疏水配体,并将其运输到细胞的各个部分,从而在细胞脂质代谢和信号传导中发挥作用。它是一种胞质蛋白,在脂肪细胞和巨噬细胞中表达较多,并且在脂质代谢和炎症中发挥重要作用。在脂肪细胞中,fabp4通过介导脂肪分解和脂质再酯化,进而影响葡萄糖代谢;在巨噬细胞中,fabp4参与脂质代谢和炎症反应,有研究显示:敲除fabp4可抑制炎症反应,降低内质网应激,降低活化b细胞活化巨噬细胞的核因子kappa轻链增强因子。可见fabp4在局部巨噬细胞反应中起重要作用,但其分子机制尚不清楚。
酪氨酸src通过酪氨酸位点的磷酸化而被激活,激活后可引起一些紧密和粘附蛋白的酪氨酸磷酸化。还被证明可以抑制紧密连接蛋白聚集。大量证据表明激酶活化参与多个器官急性损伤,包括脑缺血损伤、心肌梗塞、肝细胞损伤、急性肾损伤等。c-src蛋白(是酪氨酸激酶tyrosineproteinkinase,tpk的一种)在肿瘤发生的早期在质膜下被激活,并传递致癌信号。一方面,研究显示:c-src通过肉豆蔻酰化作用与细胞膜结合,从而将信号从细胞外传递到细胞内。另一方面,也有报道称c-src不仅在质膜中定位和发挥作用,而且在内膜中也起作用。越来越多的研究把src激酶被作为恶性肿瘤中抗肿瘤药物的一个作用靶点,将src激酶抑制剂用于预防和治疗恶性肿瘤。但巨噬细胞中fabp4、c-src与炎症信号通路之间的关系尚不清楚。src激酶抑制剂pp2是一种吡唑并嘧啶复合物,可有效抑制src激酶。但到目前为止,还没有发现现有技术中对src酪氨酸激酶抑制剂在抑制炎症因子分泌中的有效应用方法。
技术实现要素:
本发明的目的在于提供一种减轻fabp4介导的免疫炎症反应的抑制剂,即src酪氨酸激酶抑制剂在抑制炎症因子分泌中的应用方法。
本发明的具体技术方案为:
src酪氨酸激酶抑制剂在抑制炎症因子分泌中的应用。
所述的炎症反应由fabp4所介导的;所述的src抑制剂为pp2。
其应用流程包括以下步骤:
(1)培养正常的人单核细胞源巨噬细胞,将人单核细胞源巨噬细胞fabp4过表达后采用western-blot(蛋白质免疫印迹)检测jak2/stat2两种蛋白的磷酸化水平;
(2)将fabp4过表达后采用elisa法(酶联免疫吸附测定法)检测人单核细胞源巨噬细胞免疫炎症因子分泌水平;
(3)将人单核细胞源巨噬细胞fabp4过表达后采用western-blot检测src及src磷酸化水平;
(4)将人单核细胞源巨噬细胞fabp4过表达后采用酶法检测src酶活性的水平;
(5)将人单核细胞源巨噬细胞fabp4过表达后加入pp2抑制剂采用western-blot检测通路jak2/stat2磷酸化水平;
(6)将人单核细胞源巨噬细胞fabp4过表达后加入pp2抑制剂采用elisa法检测人单核细胞源巨噬细胞免疫炎症因子分泌水平;
进一步,fabp4过表达后采用elisa法检测人单核细胞源jak2/stat2磷酸化水平增加,巨噬细胞免疫炎症因子分泌水平也增加。
进一步,将人单核细胞源巨噬细胞fabp4过表达后src磷酸化水平和酶活性在增加。
进一步,将人单核细胞源巨噬细胞ad-fabp4过表达后加入pp2抑制剂,与ad-fabp4过表达组相比jak2/stat2磷酸化水平降低,炎症因子分泌水平也降低。
本发明所述src酪氨酸激酶抑制剂在抑制炎症因子分泌中的应用,与现有技术相比,有如下有益效果:
本发明通过实验研究发现了巨噬细胞中fabp4、c-src与炎症信号通路之间的关系,并在此基础上,找到了src酪氨酸激酶抑制剂在抑制炎症因子分泌中的有效应用方法,在巨噬细胞炎症性疾病的缓解中具有应用价值。
附图说明
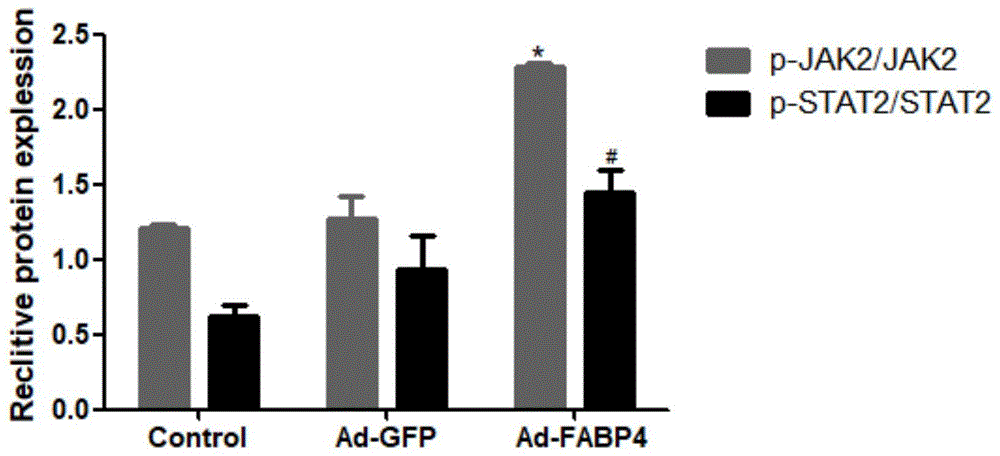
图1为:control正常对照组,ad-gfp腺病毒对照组和ad-fabp4过表达脂肪酸结合蛋白4组,炎症信号通路jak2/stat2磷酸化水平对照示意图。
图2为:control正常对照组,ad-gfp腺病毒对照组和ad-fabp4过表达脂肪酸结合蛋白4组,炎症因子il-1β,il-6,tnf-α含量对照示意图。
图3为:control正常对照组,ad-gfp腺病毒对照组和ad-fabp4过表达脂肪酸结合蛋白4组,src磷酸化水平对照示意图。
图4为:control正常对照组,ad-gfp腺病毒对照组和ad-fabp4过表达脂肪酸结合蛋白4组,src激酶活性对照示意图。
图5为:人单核细胞源巨噬细胞ad-fabp4过表达后加入pp2抑制剂,与ad-fabp4组相比,jak2/stat2磷酸化水平对照示意图。
图6为,人单核细胞源巨噬细胞ad-fabp4过表达后加入pp2抑制剂,与ad-fabp4组相比,炎症因子分泌水平对照示意图。
如图1所示,纵坐标:蛋白表达水平,横坐标:分组分别为control代表对照组,ad-gfp代表空载体组,ad-fabp4代表过表达脂肪酸结合蛋白4组,灰色代表p-jak2/jak2磷酸化的非受体型酪氨酸激酶2与酪氨酸激酶2的比值,黑色代表p-stat2/stat2是磷酸化的转录活化因子2与转录活化因子2的比值。*和#分别代表与ad-gfp组比较,ad-fabp4组p-jak2/jak2与p-stat2/stat2的表达含量增加,p小于0.05差异有统计学意义。
如图2所示,纵坐标:细胞因子的含量,横坐标:分组分别为control代表对照组,ad-gfp代表空载体组,ad-fabp4代表过表达脂肪酸结合蛋白4组,il-1β是白细胞介素1β;il-6是白细胞介素6,tnf-α是肿瘤坏死因子α。*代表与ad-gfp组比较,ad-fabp4组il-1β,il-6,tnf-α的表达含量增加,p小于0.05差异有统计学意义。
如图3所示,纵坐标:磷酸化的酪氨酸激酶与酪氨酸激酶的比值。横坐标:分组分别为control代表对照组,ad-gfp代表空载体组,ad-fabp4代表过表达脂肪酸结合蛋白4组。**代表与ad-gfp组比较,ad-fabp4组磷酸化酪氨酸激酶表达增加,p小于0.01差异有统计学意义。
如图4所示,纵坐标:酪氨酸激酶活性;横坐标:分组分别为control代表对照组,ad-gfp代表空载体组,ad-fabp4代表过表达脂肪酸结合蛋白4组。**代表与ad-gfp组比较,ad-fabp4组酪氨酸激酶活性增加,p小于0.01差异有统计学意义。
如图5所示,纵坐标:蛋白表达。横坐标:分组分别为control代表对照组,ad-gfp代表空载体组,ad-fabp4代表过表达脂肪酸结合蛋白4组,pp2代表酪氨酸激酶抑制剂组,ad-fabp4+pp2代表过表达脂肪酸结合蛋白4并加入酪氨酸激酶抑制剂组。灰色代表p-jak2/jak2磷酸化的非受体型酪氨酸激酶2与酪氨酸激酶2的比值,黑色代表p-stat2/stat2是磷酸化的转录活化因子2与转录活化因子2的比值。*代表与ad-gfp组比较,ad-fabp4组p-jak2/jak2与p-stat2/stat2的表达含量增加,p小于0.05差异有统计学意义,#代表与ad-fabp4组相比,p-jak2/jak2与p-stat2/stat2的表达含量降低,p小于0.05差异有统计学意义。
如图6所示,纵坐标:细胞因子的含量。横坐标:分组分别为control代表对照组,ad-gfp代表空载体组,ad-fabp4代表过表达脂肪酸结合蛋白4组,pp2代表酪氨酸激酶抑制剂组,ad-fabp4+pp2代表过表达脂肪酸结合蛋白4并加入酪氨酸激酶抑制剂组。浅灰色柱il-1β是白细胞介素1β;深灰色il-6是白细胞介素6,黑色tnf-α是肿瘤坏死因子α。*代表与ad-gfp组比较,ad-fabp4组il-1β、il-6和tnf-α的表达含量增加,p小于0.05差异有统计学意义,#代表与ad-fabp4组相比,il-1β、il-6和tnf-α的表达含量降低,p小于0.05差异有统计学意义。
具体实施方式
下面结合附图和具体实施方案对本发明的技术方案作进一步详细地说明。
1材料
1.1主要试剂
炎症因子检测试剂盒购自中国酶免公司、全蛋白提取试剂盒购自中国贝博公司、western-blot凝胶试剂盒购自美国bio-rad公司、ecl显影剂购自中国凯基公司、激酶活性检测试剂盒购自美国abcam公司。
1.2主要仪器
酶标仪购自美国bio-tek公司、凝胶成像仪购自美国bio-rad公司,低温冰箱购自日本三洋公司,精密电子天平购自德国sartorius仪器有限公司,低温高速离心机购自德国heraeus公司;台式离心机购自德国eppendorf公司,恒温水浴箱购自中国太仓华利达公司;纯水仪-zyuph-i-10购自美国tmillipore公司;制冰机购自中国bilon公司;显微镜购自日本olympus有限公司。
2方法
2.1巨噬细胞细胞培养及分组
将冻存的细胞从液氮灌中取出后迅速放入37ºc温水的烧杯或者水浴锅中融化,室温离心机1000r/min离心5min,在超净工作台内打开冻存管,将细胞管内冻存液完全倒掉,将剩余液体吸尽,向管内加入含血清的10%1640培养基,用移液器轻轻将细胞从培养瓶底部吹起后,缓慢将细胞重悬,然后将悬浮的细胞分装至25cm2培养瓶内,再向培养瓶内加入适量10%含血清的培养基,置于37℃、5%co2的恒温培养箱内培养。单核细胞呈悬浮生长,待到细胞生长至80%-90%时,1000rpm离心5min,传代培养。
control组(正常对照组):给予单核细胞pma刺激形成的巨噬细胞。
ad-gfp组(空载体组):给予pma(刺激单核细胞)形成的巨噬细胞后,以ad-gfp腺病毒对照组刺激6h后,换10%1640培养基培养48h。
ad-fabp4组(过表达脂肪酸结合蛋白4组):给予单核细胞pma刺激形成的巨噬细胞后,以ad-fabp4腺病毒刺激6h后,换10%1640培养基培养48h。
pp2组:给予单核细胞pma刺激形成的巨噬细胞后,以pp2刺激2h。
ad-fabp4+pp2组:给予单核细胞pma刺激形成的巨噬细胞后,以ad-fabp4腺病毒刺激6h后,换10%1640培养基培养48h后用pp2刺激2h。
2.2elisa检测细胞培养液中炎症因子的水平
将细胞培养液收集到离心管中,12000r离心5min,设置标准品孔和样本孔,标准品孔各加不同浓度标准品50μl;样品孔中加待测样品10μl,再加稀释液40μl;除空白孔外,标准品孔和样品孔中,加入辣根过氧化物酶(hrp)标记的检测抗体100μl,封板膜封闭,37℃水浴锅或恒温箱温育60min;弃去液体,吸水纸上拍干,每孔加满洗涤液静置1min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次;每孔加底物a、b各50μl,37℃避光孵育5min;
每孔加入终止液50μl,15min内,450nm波长处测定各孔的od值;结果计算:将得到的浓度乘以稀释倍数是实际的炎症因子浓度。
2.3酶活性测定
以罗丹明110肽为底物,激酶测定采用的方法见试剂盒(profluor®src-familykinaseassay,promega,v1270)。简单地,30ng纯化的c-src被复苏激酶溶液,与罗丹明110肽在25℃,10mmol/升atp(简称三磷酸腺苷)孵育一小时。然后加入蛋白酶溶液,在25℃孵育一小时后,用酶标仪检测激发波长485nm,发射波长530nm。
2.4western-blot检测jak2,p-jak2,stat2,p-stat2,src,p-src几种蛋白水平表达。
配胶:根据分子量大小选择合适大小浓度的分离胶和浓缩胶。按照配比进行配制。配制后向玻璃板中先灌分离胶至玻璃板指示位置,向胶面加入适量蒸馏水,将胶面压平,并赶走气泡;待分离胶凝固后,倒干净蒸馏水并用滤纸吸干。然后加入浓缩胶,立即将梳子迅速插入浓缩胶内。
上样及电泳:将配好的胶与电泳槽组装好,检查上下玻璃板是否对齐平整,完成后将其放到电泳槽中,向电泳槽中加入刚没过电泳槽上缘的电泳液后向孔内按照顺序分别加marker及相应组别的样品(注意垂直加样,悬空,避免将样品孔戳破,不要有气泡或者使样品流入其他孔内);电泳:以80v电压待样品跑过浓缩胶后,将电压加大至120v跑完分离胶全程。电泳至marker跑至玻璃板夹底部绿线时,即可将电泳终止,准备转膜。
转膜:a.准备转膜物品:选择适合分子大小的pvdf膜、厚滤纸、无水乙醇、牛奶封闭液等。
b.将提前已准备好的滤纸用电转液完全浸湿,剪好合适大小的pvdf膜,使用无水乙醇将pvdf膜提前激活5min。
c.采用半干转进行转膜:将玻璃板轻轻撬开,按marker提示,切取出目的条带,用胶板裁取下来放入呈有电转液的玻璃皿中,用镊子按照滤纸-pvdf(聚偏二氟乙烯膜)-胶-滤纸的顺序依次将物品置于电转仪之上,注意将各层中间的气泡赶走,插好电极,开始进行电转。
封闭:将转膜完成的pvdf膜放入到5%的脱脂奶粉中进行封闭,于室温摇床上摇4h(根据室温不同孵育时间有差异)。
孵育一抗:用pbst稀释一抗至适当浓度,将封闭后的膜用pbst洗三遍,每次10min。将稀释好的一抗加入孵育盒内,将洗干净的pvdf膜放入孵育盒内,4ºc摇床上孵育过夜或者室温孵育2h左右。
孵育二抗:室温下在摇床上用pbst清洗5min重复3次,将膜放于干净的孵育盒内,加入稀释好的适当比例的相应的鼠源或兔源的二抗(稀释比通常为1:5000),室温孵育2h。
曝光及凝胶图像分析:室温下在摇床上用pbst清洗10min重复3次。避光条件下,将显影液按照a:b=1:1混合并用移液器将其混匀,将膜的蛋白面朝向上平整的放置于显影板上,均匀逐滴地加入已配制好的显影液避光,立即曝光。用凝胶图象处理系统分析条带的光密度值,以目的与相对应内参的比值来反应蛋白的相对表达的情况。
3.统计学处理
数据以均数±标准差()表示。两样本均数间比较采用两样本独立t检验,多样本均数间比较采用one-wayanova检验,组间的两两比较采用student-newman-keuls检验,以p≤0.05为差异有显著性。
4结果
4.1western-blot检测的jak2,p-jak2,stat2,p-stat2蛋白水平
采用western-blot检测jak2,p-jak2,stat2,p-stat2蛋白水平变化,与control组相比,ad-gfp组p-jak2/jak2,p-stat2/stat2水平变化无差异,与ad-gfp组相比,ad-fabp4组p-jak2/jak2,p-stat2/stat2水平升高,差异具有显著性(*p<0.05,#p<0.05)(见图1)。
4.2elisa检测炎症因子水平变化
采用elisa检测炎症因子il-1β、il-6、tnf-α水平变化,与control组相比,ad-gfp组炎症因子il-1β、il-6、tnf-α水平无差异,与ad-gfp组相比,ad-fabp4炎症因子il-1β、il-6、tnf-α水平升高,差异具有显著性(*p<0.05)(见图2)。
4.3western-blot检测的src,p-src蛋白水平
采用western-blot(蛋白质印迹)检测src,p-src蛋白表达水平,与control组相比,ad-gfp组p-src/src水平无差异,与ad-gfp组相比,ad-fabp4组p-src/src水平升高,差异具有显著性(**p<0.01)(见图3)。
4.4酶活性检测src酶活性
采用酶活性检测src酶活性的变化,与control组相比,ad-gfp组src酶活性无差异,与ad-gfp组相比,ad-fabp4组src酶活性增加,差异具有显著性(**p<0.01)(见图4)
4.5western-blot检测pp2干预后p-jak2/jak2,p-stat2/stat2蛋白水平
采用western-blot检测jak2,p-jak2,stat2,p-stat2表达。与control组相比,ad-gfp组p-jak2/jak2,p-stat2/stat2水平变化无差异,与ad-gfp组相比,ad-fabp4组p-jak2/jak2,p-stat2/stat2水平升高,差异具有显著性(*p<0.05,),与ad-fabp4组相比,ad-fabp4+pp2组p-jak2/jak2,p-stat2/stat2水平降低,差异有统计学意义(#p<0.05)(见图5)。
4.6elisa检测炎症因子水平变化
为了探讨src是否参与fabp4诱导的巨噬细胞炎症反应,加入src抑制剂后,采用elisa检测炎症因子的变化。结果显示,与control组相比,ad-gfp组无差异;与ad-gfp组(过表达fabp4组),ad-fabp4组炎症因子水平升高,差异有统计学意义(p<0.01);与ad-fabp4组相比,ad-fabp4+pp2组炎症因子il-1β、il-6、tnf-α水平降低,差异具有显著性(p<0.05)(见图6)。
5结论
src酪氨酸激酶抑制剂pp2可以减少fabp4介导的巨噬细胞炎症因子分泌。
以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围不限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可显而易见地得到的技术方案的简单变化或等效替换均落入本发明的保护范围内。