特定凝集素组合构建基于唾液糖蛋白糖链鉴别肺部疾病测试工具的应用的制作方法
本发明涉及一种特定凝集素组合构建基于唾液糖蛋白糖链鉴别肺部疾病测试工具的应用。
背景技术:
根据国际癌症研究中心(iarc)的《2018全球癌症统计数据》,全世界有五分之一的男性和六分之一的女性在其一生中会罹患癌症,且八分之一的男性和十一分之一的女性死于这种疾病。这份报告对全球185个国家36种癌症的发病率和死亡率进行了估算。报告显示,今年新发病例将达到1810万,死亡人数将达到960万。四年前新增病例与死亡人数分别为1410万和820万。肺癌是造成男性和女性死亡的主要原因之一,其中北美、北欧和西欧等地区以及中国、澳大利亚和新西兰等国家女性肺癌发病率最高。
原发性支气管肺癌,简称肺癌,是起源于支气管粘膜或腺体的恶性肿瘤。目前在全世界范围内因恶性肿瘤引起的死亡中,肺癌最为常见。而且,它的发生率正在以约5%的速度逐年增加,预计到2020年,因肺癌而死亡的人数将达到恶性肿瘤引起的总死亡人数的50%。肺癌已经成为全世界各个国家亟待解决的重大健康问题和社会问题,在发展中国家尤甚。在2010年进行的全国性抽样调查显示,肺癌的死亡率已升高为30.83/10万,其中,男性为41.34/10万,女性为19.84/10万,肺癌死亡人数占肿瘤相关的总死亡人数已达到22.70%,居第1位,值得指出的是,在我国城市人口中,肺癌的死亡率为40.98/10万,居首位,且明显高于农村地区(26.93/10万)。
根据肺癌的分化程度、形态特征和生物学特点,目前将大多数肺癌分成两大类:非小细胞肺癌(non-small-celllungcancer,nsclc)和小细胞肺癌(small-celllungcancer,sclc)。前者主要包括腺癌(adc)和鳞状细胞癌(简称鳞癌,scc)。其中,adc发病率最高,约占肺癌的50%;scc为曾经最为常见的肺癌类型,现约占肺癌的1/3,而小细胞肺癌仅占肺癌的15%。
虽然,近年来肺癌的治疗方面已取得了长足的进步,但从总体上来说,肺癌的预后情况仍旧很不理想,非小细胞肺癌和小细胞肺癌的5年生存率仅分别为14%和4%。引起这一情况的主要原因是由于肺癌起病隐匿,早期通常无明显症状,大多数肺癌患者在确诊时已处于进展期,失去了手术治愈的机会。因此,肺癌的早期筛查和诊断对于提高肺癌患者的生存率、延长患者的生存期,都是至关重要的。由于肺癌早期通常都是从肺部良性病变开始发生恶化形成的,对于大多数人群(包括亚健康人群)来说,通常首先是关心是否患有肺部疾病,所以,很有必要给出一种快速鉴别被试者是否患有肺部疾病的方案。糖基化是最普遍的蛋白质翻译后修饰之一,研究发现约一半以上的哺乳动物蛋白质都发生了糖基化。糖基化作为一种重要的翻译后修饰,可以影响蛋白质的溶解度、折叠、定位及构象的维持,调节蛋白质的功能和降解;还可以介导分子与分子之间、分子与细胞之间、细胞与细胞之间的相互作用。大量研究表明,蛋白质糖基化,作为重要的翻译后修饰,在肿瘤发生、浸润、转移的过程中会发生改变并有相应的功能性作用。糖基化修饰的改变主要包括两个方面:1)多肽链上糖基化结合位点的改变;2)寡糖链结构的改变。因此,差异性表达的蛋白质糖基化亚型可以成为新型肿瘤标记物,用于肿瘤的早期诊断,还可以成为肿瘤生物靶向治疗的新靶点。
随着现今科学技术的发展,检测技术的多样性和灵敏度不断提高,近些年来,唾液作为临床样本已被广泛应用于多种疾病诸如艾滋病、自身免疫性疾病、酒精性肝硬变、囊性纤维病、糖尿病、心血管病、龋病等疾病的药物水平监测、病情监控和疗效评价当中。文献和申请人以往的研究工作表明唾液中含有丰富的n-连接糖蛋白和o-连接糖蛋白,而唾液蛋白糖基化的改变与疾病的发生发展具有较高的关联性。从变化的唾液糖蛋白糖链中可以找到与疾病相关的生物标志物以用于检测,而基于唾液检测的新技术和新方法也会逐渐成为今后非侵袭性临床诊断发展的一个方向。
有必要指出的是,虽然已有研究基于血清样本糖蛋白糖链鉴别肺癌及其分型和分期的方案,血液中的一些因子能够随体液循环到达唾液腺,或随唾液分泌进入口腔或导致唾液中的基因转录谱发生改变,引起某些蛋白质的丰度或种类改变,从而反映出血液中部分蛋白质水平的变化。但目前研究发现,人唾液中有1939种蛋白质,人血浆中有3020种蛋白质,仅有27%的唾液蛋白质组与血浆蛋白质组重合。血浆蛋白质组学发现的177个与心血管疾病相关的潜在生物标志物的蛋白质中,也仅有40%的蛋白质出现在唾液蛋白质组中;在已列出的1058个潜在癌症相关生物标志物的蛋白质中,仅有34%的蛋白质出现在唾液蛋白质组中。这表明许多血液循环中的生物标志物并非能够在唾液中得到鉴定。另外,即使是同一种蛋白,较之于血清,其在唾液中的含量通常明显较低。所以在实践中,两者没有必然的联系,往往需要研究人员经过大量的实验和分析,才能判断是否有蛋白质组重合的可能性。
凝集素芯片是通过固定于芯片上的凝集素探针与样品中糖蛋白糖链特异性结合,可以高通量地检测出样品中糖蛋白糖链结构和连接方式的变化,是研究糖蛋白糖链结构变化最有效的分析工具之一,其有助于发展新的诊断和监测疾病方法。
二元logistic逐步回归分析及roc曲线分析(receiveroperatingcharacteristiccurve)早先多见于农业统计分析和财务管理等方面,目前也有见于疾病诊断方向。
技术实现要素:
本发明的目的在于提供一种无损伤取样的快速、准确鉴别肺部疾病的方案。
本申请通过大量的实验和分析,最终确立了针对唾液样本的特定凝集素组合能够用来确定受试者是否患有肺部疾病(或为健康人);并且,构建了肺部疾病(pud)的诊断模型,通过roc曲线分析评估其诊断能力。
总结应用方案如下:
第一方面,特定凝集素组合构建基于唾液糖蛋白糖链鉴别肺部疾病测试工具的应用。所述特定凝集素组合选自pha-e+l、pwm、cona、rca120、sja、ptl-i和jacalin这七种凝集素;肺部疾病样本与健康样本相比,该特定凝集素组合呈显著差异性表达。具体可以参考表2-表4。
上述测试工具可以是凝集素芯片、试剂盒或凝集素检测智能终端。
第二方面,一种用于基于唾液糖蛋白糖链鉴别肺部疾病的智能终端。其包括处理器和程序存储器,所述程序存储器存储的程序被处理器加载时执行以下步骤:
获取唾液样本的凝集素测试结果,所述凝集素测试结果体现凝集素pha-e+l、pwm、cona、rca120、sja、ptl-i和jacalin对应的糖蛋白糖链的表达水平;
根据所述凝集素测试结果,计算以下模型pud(modelpud)的检测值;
将计算得到的检测值输出显示,并提示鉴别结论;若检测值≥0.913,则表明唾液样本所属主体为肺部疾病患者,反之检测值<0.913,则为健康人。这里所说的“提示鉴别结论”,可以是直接输出是否患肺部疾病的结论,也可以仅给出检测值、参考值和鉴别依据,或者二者兼有。
上述智能终端的具体形式可以是专门的自助终端设备,也可以是普通用户常用的手机、平板电脑等。
第三方面,一种人机交互设备,包括显示屏,所述人机交互设备运行时显示屏依次显示以下界面:
唾液样本的凝集素测试结果的输入界面;所述凝集素测试结果体现凝集素pha-e+l、pwm、cona、rca120、sja、ptl-i和jacalin对应的糖蛋白糖链的表达水平;
肺部疾病鉴别信息的输出界面;所述肺部疾病鉴别信息包括模型pud(modelpud)的参考值0.913以及检测值和/或鉴别结论;所述模型pud(modelpud)为:
若检测值≥0.913,则表明唾液样本所属主体为肺部疾病患者,反之检测值<0.913,则为健康人。
该人机交互设备的具体形式可以是专门的自助终端设备,也可以是普通用户常用的手机、平板电脑等。其输入界面还可以包含预先的提示、确认信息(例如请用户确认身份信息、检测目的等)。所述唾液样本的凝集素测试结果的输入界面,可以是直接呈现这几种凝集素的输入项,也可以依次呈现涉及的每一种凝集素的输入项;具体人机交互方式还可以有多种改型,根据实际需要不难设置。
对于该人机交互设备,显示屏的画面显示内容,可以由人机交互设备内部的处理器、存储器运行既定程序进行数据处理得到,也可以连接远程服务器(在服务器运行既定程序进行数据处理)通过数据传送得到。
第四方面,一种用于基于唾液糖蛋白糖链鉴别肺部疾病的系统,包括:
a、用于获取唾液样本特定糖蛋白糖链结构的表达水平的设备,所述特定糖蛋白糖链结构对应于上述的特定凝集素组合;
b、上述的一种用于基于唾液糖蛋白糖链鉴别肺部疾病的智能终端。
该系统中,用于获取唾液样本特定糖蛋白糖链结构的表达水平的设备和用于基于唾液糖蛋白糖链鉴别肺部疾病的智能终端可以是集成一体的医疗诊断综合设备,也可以是分立的设备,甚至没有任何信号连接(例如可以由医护人员、患者等自行取送唾液样本的凝集素测试结果)。
上述用于获取唾液样本特定糖蛋白糖链结构的表达水平的设备包括凝集素芯片、孵育盒和生物芯片扫描系统,其中凝集素芯片上设置有所述的特定凝集素组合。
采用本发明的方案,能够根据唾液样本,快速、准确地鉴别受试者是否患有肺部疾病(或为健康人)。
附图说明
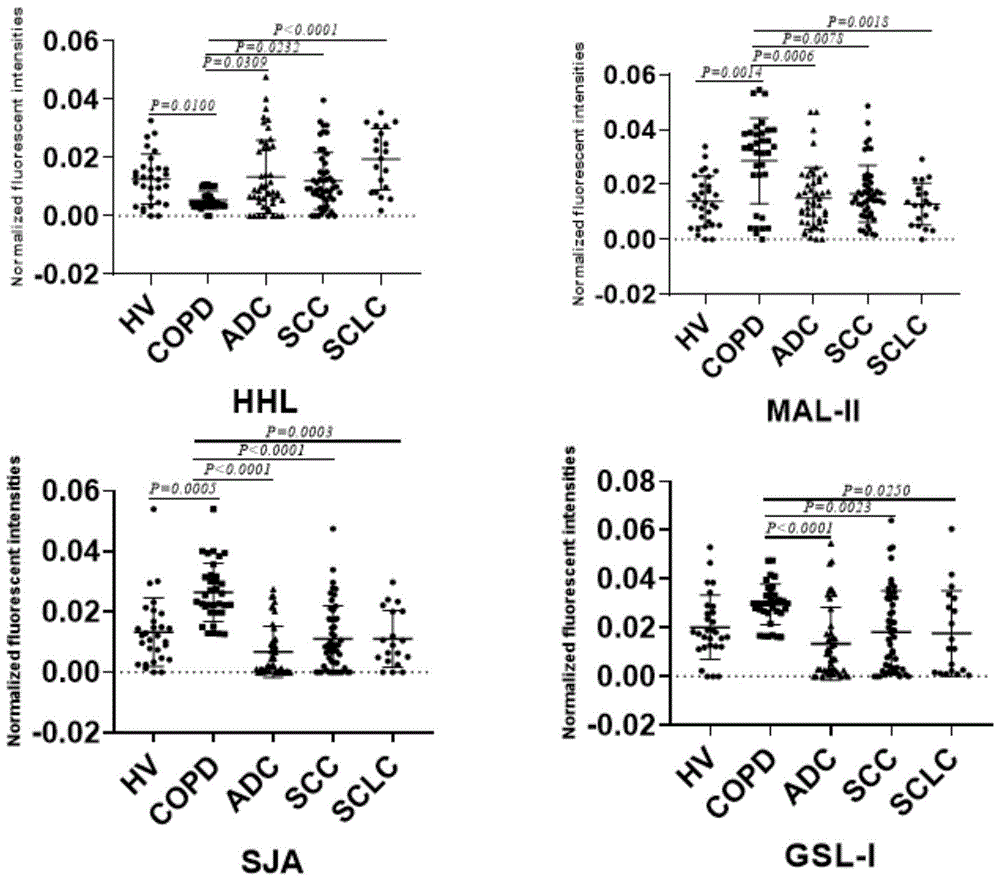
图1、图2和图3为凝集素芯片对190例唾液样本(hv,n=30;copd,n=34;adc,n=49;scc,n=55;sclc,n=22)进行逐例检测,其中差异性表达凝集素结果的散点图分析。图中,纵坐标表示凝集素芯片上该凝集素所对应的归一化荧光强度nfi,横线代表两端所示两组间的比较,p为根据单因素方差分析所获得的p-value,通常p*<0.05表示差异显著,p**<0.01表示差异非常显著,p***<0.001表示差异极显著。hv:健康志愿者唾液,copd:肺部良性疾病患者唾液,adc:肺腺癌患者唾液,scc:肺鳞癌患者唾液,sclc:肺小细胞癌患者唾液。
图4、图5、图6、图7和图8分别为基于37种凝集素构建pud、lc、adc、scc、sclc的诊断模型,通过roc曲线分析评估其诊断能力的示意图。pud:肺部疾病,lc:肺癌,adc:肺腺癌,scc:肺鳞癌,sclc:肺小细胞癌。
具体实施方式
以下详细介绍本申请重点的相关验证实验及分析,发明人具体的研发过程不限于此。
一、hv、copd、adc、scc、sclc患者唾液蛋白质差异糖链结构的筛选
研究方法:
1.1、唾液样本的收集及预处理
本实验所采用的健康志愿者及肺部良性疾病、肺腺癌及肺鳞癌以及小细胞癌患者的唾液样本均严格经过西北大学以及西安交通大学第一附属医院的伦理审批(humanresearchethicscommittees(hrecs))。所有捐赠唾液样本的志愿者连同协助采样指导的临床医师均对本研究工作知情、同意且高度配合,在均一的采样要求之下完成唾液样本的采集。其具体要求为:样本捐献者需无糖尿病,除肺部外其他的器官应无炎症以及肿瘤等慢性疾病,在采样时捐献者需确定在采集唾液前3小时内未进食并且24小时内未服用药物,然后用洁净无菌的生理盐水(0.9%nacl)漱口三次,确保捐献者口腔卫生和无食物残渣的前提下,捐献者舌尖抵住上颚并于舌下收集自然分泌的唾液样本收集至2ml离心管,立即加入10μl蛋白酶抑制剂(proteaseinhibitorcocktail,sigma-aldrich,u.s.a)于冰浴暂存。在临床医师指导下共收集唾液样本190例:其中健康志愿者30例(hv,n=30),肺部良性病患者34例(copd,n=34),肺腺癌患者49例(adc,n=49),肺鳞癌患者55例(scc,n=45)。肺小细胞癌患者22例(scc,n=22)具体的样本信息如表1所示。
唾液采集12小时内,将唾液按1ml分装至离心管中,若有量少不足1ml者可加入1×pbs补足至1ml,10,000g×15min离心,小心吸取上清液,经微量核酸蛋白测定仪(nano-drop)测定浓度后按1mg唾液蛋白:10μl蛋白酶抑制剂的量加入蛋白酶抑制剂,混匀后分装于-80℃贮藏。
表1用于肺部疾病诊断凝集素芯片及诊断模型构建唾液样本信息
1.2、个例唾液蛋白的荧光标记与定量
取经nano-drop定量的唾液样本100μg,等体积地加入0.1mol/lna2co3/nahco3ph9.3缓冲液,按照1mg:120μl利用dmso溶解cy3荧光干粉并向样本中加入5μl荧光溶液于室温孵育3小时,期间样本严格避光且保持震荡。反应结束后,向样本中加入10μl4m羟胺溶液,于冰上反应5分钟,待充分封闭过量的游离荧光后,利用sephadexg-25分子筛凝胶柱对蛋白样本进行分离。用新1.5ml离心管收集荧光样本并进行定量,荧光标记后的样本避光防止荧光基团猝灭,于-20℃贮藏。
1.3、凝集素芯片逐例检测唾液蛋白质糖链表达差异
本研究采用的是西北大学功能糖组学实验室设计的一款由37种凝集素构成的凝集素芯片,其可识别并结合常见的n-糖链与o-糖链结构。芯片的具体制备过程详见yannanqin等的报道。每张片基点制四个阵列,通过配套盖片上的胶条使芯片上的四个阵列彼此独立,形成彼此封闭的小室,使每张芯片可同时检测4个不同的蛋白样本。
在进行凝集素芯片检测样本之前,从4℃取出芯片,于37℃真空干燥器内负压回温30min,随后利用1×pbst于水平震荡摇床70rpm清洗5min×2次,再用1×pbs清洗5min×2次,以充分清洗未偶联至玻片上的游离凝集素。清洗完成后用小型载玻片离心机甩干残留的pbs。在上样前,向孵育盒的各阵列区域内先加入120μl凝集素芯片封闭液对玻片空白表面的环氧化基团进行封闭以降低荧光扫描时玻片背底的信号值。待孵育盒密封后于恒温孵育箱内37℃反应1h,封闭完成后,1×pbst清洗5min×2次,1×pbs清洗5min×2次,甩干后向孵育盒的各阵列区域内加入蛋白样本孵育体系(80μl凝集素芯片孵育液,8μl4m羟胺,2μl0.1%tween-20,4μgcy3标记的唾液蛋白样本,超纯水补足终体积至120μl),于37℃恒温孵育3h,待反应结束后1×pbst清洗5min×2次,1×pbs清洗5min×2次,甩干并扫描。凝集素芯片最终的数据读取采用axon公司所产的genepix4000b芯片扫描仪实现,扫描参数设定为:激发波长532nm,pmt功率70%,激发强度为100%。
1.4、凝集素芯片数据分析
凝集素芯片荧光信号的数值化过程通过genepixpro(4000b)软件完成,通过对每个阵列的数据提取,获得的数据包括:探针信号减去背景信号所获得的净差值fi(fluorescentintensity)、背景的标准方差sd(standarddeviation)等数据。在分析过程中,首先根据各个点的fi/sd判断该点数据的有效性,取fi/sd≥1.5的点作为有效数据,计算各个探针标准归一化荧光信号值nfi(normalizedfluorescentintensity),即用各个探针的medianfi值除以14个检测探针fi值之和,用算式表示为:nfix=medianfix/(medianfi1+medianfi2+medianfi3+…+medianfi14),据此可获得每个阵列上37种凝集素探针所对应的nfi并用作统计学分析。
这里的统计学分析主要是利用graphpadprism6.0对hv、copd、adc、scc、sclc四组数据进行组间单因素方差分析(one-wayanovaanalysis),具体方法为将数据按组录入“column”分析程式,根据作图需求选择散点图“scatter&sd”等。随后进入“analyze”分析程式通过组间两两对比并报告差异显著性p-value。
研究结果:
2.1凝集素芯片分析肺部良性病及肺癌患者唾液糖蛋白糖链表达差异
利用凝集素芯片阵列对190例唾液样本进行逐例检测,通过芯片数据处理获得各nfi值,通过各组数据课计算出的平均nfi,各平均nfi结果可以直观地显示各组唾液样本与各个探针的结合情况,并且根据其标准差sd可以评估各凝集素对个例样本检测的离散程度。
表2ration值(第一部分)
表3ration值(第二部分)
表4ration值(第三部分)
2.2肺良性病及肺癌患者唾液差异糖蛋白糖链的筛选
根据各个平均nfi值进行组间两两对比求得各相较组之间的ratio值,并且定义ratio>1.500代表该凝集素所识别的糖链在组间对比中体现高表达,ratio<0.667代表该凝集素所识别的糖链在组间对比中体现低表达。通过组间比较后,筛选出差异性表达凝集素,利用统计学分析凝集素探针所对应的个例数据,通过单因素方差分析判断凝集素识别的糖链结构在健康志愿者、肺良性病患者及肺癌患者中的差异显著性,其结果如图1-图3所示,一系列统计学数据可在图上直观地反应出各组间比较的差异显著性及离散程度。根据各组间单因素方差分析的结果来看:相比唾液中其他糖蛋白糖链结构,可特异性识别部分糖蛋白糖链结构的凝集素差异性表达,例如可特异性识别manα1-6(manα1-3)man、terminalgalnac的cona,与hv组和copd组相比较,adc、scc、sclc组显著差异性表达(p*≤0.0001);可特异性识别α-gal、α-galnac的gsl-i,adc、scc、sclc组与copd组间相比明显降低;其他差异性凝集素可见图1-图3。
二、利用37种凝集素构建pud、lc、adc、scc、sclc诊断模型
研究方法:
利用160例肺良性病及不同类型肺癌患者唾液样本(copd,n=34;adc,n=49;scc,n=55;sclc,n=22)和30例健康志愿者唾液样本。本研究期望通过凝集素的芯片数据实现肺腺癌adc、肺鳞癌scc、小细胞肺癌sclc同健康志愿者hv、肺良性病copd患者的准确鉴别。因此首先对37种凝集素进行roc曲线分析,以估测其对样本的诊断鉴别能力。通常情况下,roc曲线线下面积达到0.70时才认为该区分模型有一定的鉴别能力,但无论是用以hv/(adc、scc、sclc)、copd/(adc、scc、sclc)的判别还是用于三个肺癌患病组彼此之间的鉴别,单一候选凝集素除hhl在sclc/(copd、adc、scc)区分中roc-auc分别达到0.7以上,其余凝集素的auc值均低于0.70的标准,说明仅单一凝集素不足以用于肺部疾病、肺癌或不同肺癌类型唾液样本的鉴别。因此本研究利用二元逐步logistic回归方法构建诊断模型,以提高凝集素的样本鉴别能力。
由于之前实验数据显示hv组数据同其他四组数据之间具有明显差异,因此模型pud(modelpud)被首先构建,用以初步判定患者是否患有肺部疾病。
modelpud的构成凝集素有7种,分别为pha-e+l、pwm、cona、rca120、sja、ptl-i、jacalin,其中除modelpud外,其他凝集素auc值皆小于0.7,故无诊断意义。而modelpud的auc值为0.725,cut-off值为0.913(检测值≥0.913为pud患者,反之检测值<0.913,则为健康人)灵敏度为0.608,特异性为0.667;能够准确鉴别出42例肺部疾病患者中的28例,9例hv中的6例,其roc曲线如图4所示。
为区分肺部良性疾病患者与肺癌患者,接下来构建模型lc(modellc)
modellc的构成凝集素有5种,分别为sna、aca、cona、lca、jacalin其中除modellc外,其他凝集素auc值皆小于0.7,故无诊断意义。而modellc的auc值为0.990,cut-off值为0.097(检测值≥0.097为lc患者,反之检测值<0.097,则为肺部良性病患者)灵敏度为0.975,特异性为0.900;能够准确鉴别出40例肺部疾病患者中的39例,11例copd患者中的10例,其roc曲线如图5所示。
为区分三种不同类型肺癌(adc、scc、sclc),依次构建模型adc(modeladc)、scc(modelscc)、sclc(modelsclc),用以快速区分不同类型肺癌患者。
其中modeladc的构成凝集素有4种,分别为pha-e+l、stl、wfa、jacalin,modeladc的auc值为0.798,cut-off值为0.697(检测值≥0.697为adc患者,反之检测值<0.697,则为其他受试者),灵敏度为0.750,特异性为0.733;能够准确鉴别出15例肺腺癌患者中的11例,36例其他受试患者中的26例,其roc曲线如图6所示。
modelscc的构成凝集素有6种,分别为pha-e+l、pwm、wga、aal、bs-i,modelscc的auc值为0.782,cut-off值为0.797(检测值≤0.797为scc患者,反之检测值>0.797,则为其他受试者),灵敏度为0.706,特异性为0.733;能够准确鉴别出17例肺鳞癌17患者中的12例,34例其他受试患者中的24例,其roc曲线如图7所示。
modelsclc的构成凝集素有2种,分别为wga、hhl,modelsclc的auc值为0.738,cut-off值为0.784(检测值≤0.784为sclc患者,反之检测值>0.784,则为其他受试者)灵敏度为0.767,特异性为0.625;能够准确鉴别出8例小细胞癌患者中的6例,43例其他受试患者中的26例,其roc曲线如图8所示。
- 还没有人留言评论。精彩留言会获得点赞!