CXCR2抑制剂在制备治疗鼻咽癌的药物中的用途
cxcr2抑制剂在制备治疗鼻咽癌的药物中的用途
技术领域
1.本发明涉及cxcr2抑制剂在制备治疗鼻咽癌的药物中的用途,属于医药领域。
背景技术:
2.鼻咽癌是一种起源于鼻咽上皮细胞的恶性肿瘤,与ebv病毒的感染密切相关。鼻咽癌是我国南方高发的恶性肿瘤之一,在南方的年发病率可达20-30/100000。目前鼻咽癌的治疗方案是以放射治疗为主,铂类化疗为辅的综合治疗方案。早期患者仅通过放射治疗即可达到完全缓解,局部进展的患者则需要接受同步放化疗(chemoradiation therapy,crt)的强化治疗。随着放射治疗水平的不断提高,适形调强放疗(intensity-modulated radiation therapy,imrt)已逐步取代2d和3d放疗技术成为临床首选的放疗方法。已有报告数据显示,单纯imrt和同步放化疗治疗早期和局部进展期鼻咽癌的3年局部控制率和生存率均可达80-90%,但晚期鼻咽癌患者的治疗效果仍然不好,其3年生存率约25-58%。同时,尽管放射治疗的技术不断提升,但由于鼻咽癌解剖位置接近辐射敏感器官,如唾液腺、视神经交叉、耳蜗、脑干和颞叶,放射治疗所引起的黏膜炎症、呕吐等急性反应以及2-4级的口干(39.3%)、听力丧失(37.0%)、视神经损伤(20%)以及颞叶坏死(5%)等晚期副作用仍然无法避免。此外,与基于铂类的同步放化疗(crt)相关的血液系统和非血液系统的毒副作用也严重降低了患者的生存质量。部分患者更是由于无法耐受副作用而影响联合治疗的正常开展。由于以上原因的限制,目前的鼻咽癌放射治疗剂量已达到上限,如何能够增加放射治疗的效果而又不增加毒副作用逐渐成为科学家们研究的重点。
技术实现要素:
3.本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明的目的在于提供cxcr2抑制剂在制备治疗鼻咽癌或预防鼻咽癌复发的药物中的用途。本发明的另一目的在于提供cxcr2抑制剂在制备鼻咽癌的放疗增敏剂中的用途。本发明的第三个目的在于提供cxcr2抑制剂在制备鼻咽癌的放疗保护剂中的用途。
4.本发明提供了cxcr2抑制剂在制备治疗鼻咽癌或预防鼻咽癌复发的药物中的用途。
5.进一步地,所述的药物抑制鼻咽癌肿瘤细胞增殖。
6.进一步地,所述的药物抑制鼻咽癌肿瘤中新生血管生成。
7.进一步地,所述的药物抑制鼻咽癌肿瘤对中性粒细胞的募集。
8.本发明提供了cxcr2抑制剂在制备鼻咽癌的放疗增敏剂中的用途。
9.进一步地,所述的放疗增敏剂诱导鼻咽癌肿瘤细胞阻滞在g2/m期。
10.进一步地,所述的放疗增敏剂抑制鼻咽癌肿瘤细胞的dna损伤后修复。
11.进一步地,所述的放疗增敏剂抑制鼻咽癌肿瘤细胞增殖和/或促进鼻咽癌肿瘤细胞凋亡。
12.进一步地,所述的放疗增敏剂抑制放疗诱导的肿瘤新生血管生成。
13.进一步地,所述的放疗增敏剂抑制放疗诱导的中性粒细胞浸润和/或募集。
14.本发明提供了cxcr2抑制剂在制备鼻咽癌的放疗保护剂中的用途。
15.进一步地,所述的药物、放疗增敏剂、放疗保护剂是以cxcr2抑制剂作为活性成分,加入药学上可接受的辅料或者辅助性成分制备而成的制剂。
16.进一步地,所述的制剂为口服制剂、鼻腔给药制剂或注射制剂。
17.进一步地,所述的cxcr2抑制剂为sb225002或其盐。
18.其中,放疗增敏剂可以提高肿瘤细胞对于放疗的敏感性。放疗保护剂能够在放疗杀伤肿瘤细胞的情况下,降低放疗对正常细胞的毒性,从而保护正常组织免受放疗损伤。
19.其中,趋化因子受体cxcr2是一种跨膜g蛋白偶联受体,是趋化因子受体家族中重要的一员,其与elr阳性的趋化因子cxcl1、cxcl2、cxcl3、cxcl5、cxcl 6、cxcl 7和cxcl 8有较高亲和力。
20.sb225002是趋化因子受体cxcr2的选择性小分子抑制剂,其化学式为1-(2-溴苯基)-3-(2-羟基-4-硝基苯基)脲,结构如下所示:
[0021][0022]
sb225002可以竞争性地与cxcr2结合从而阻断cxcl1或cxcl8与cxcr2的结合并抑制cxcr2的激活。
[0023]
通过建立体内外模型,本发明证实了cxcr2抑制剂能够对鼻咽癌发挥显著的治疗作用,cxcr2可以作为鼻咽癌新的治疗靶点。此外,本发明还首次将cxcr2抑制剂与放射治疗联合应用于鼻咽癌肿瘤的治疗中,结果cxcr2抑制剂大幅增加了鼻咽癌对放疗的敏感性,减轻其毒副作用。本发明的应用将有助于降低临床上放射治疗鼻咽癌所带来的毒副作用,提高鼻咽癌患者的生存质量和晚期鼻咽癌患者的疗效,为临床上鼻咽癌的综合治疗提供了一种新的思路和策略。
附图说明
[0024]
图1为实施例1鼻咽癌患者肿瘤组织中cxcr2表达量与预后关系图;
[0025]
图2为实施例1鼻咽癌患者肿瘤组织中cxcl8表达量与预后关系图;
[0026]
图3为实施例1人鼻咽癌细胞系中cxcr2的表达量检测结果图;
[0027]
图4为实施例2sb225002处理人鼻咽癌细胞系后的细胞形态学改变图;
[0028]
图5为实施例2sb225002对人鼻咽癌细胞系增殖活性的抑制作用图;
[0029]
图6为实施例2sb225002诱导人鼻咽癌细胞g2/m期阻滞图;
[0030]
图7为实施例2sb225002抑制人鼻咽癌细胞的克隆形成图;
[0031]
图8为实施例2sb225002抑制人鼻咽癌细胞mapk信号通路激活图;
[0032]
图9为实施例3sb225002抑制人鼻咽癌细胞肿瘤上清液对huvecs的趋化图;
[0033]
图10为实施例3sb225002抑制人鼻咽癌细胞肿瘤上清液促进huvecs小管形成图;
[0034]
图11为实施例4用肿瘤细胞肿瘤上清液ts刺激原代中性粒细胞对其cxcr2表达的影响结果图;
[0035]
图12为实施例4sb225002抑制人鼻咽癌细胞肿瘤上清液对原代中性粒细胞的趋化图;
[0036]
图13为实施例5sb225002对c666-1细胞裸鼠皮下瘤的治疗效果图;
[0037]
图14为实施例6sb225002增加人鼻咽癌肿瘤细胞的放疗敏感性图;
[0038]
图15为实施例6sb225002通过诱导g2/m期阻滞增加人鼻咽癌细胞的放疗敏感性图;
[0039]
图16为实施例6sb225002抑制人鼻咽癌细胞c666-1在放射治疗后的dna损伤后修复图;
[0040]
图17为实施例6sb225002抑制人鼻咽癌细胞hone-1在放射治疗后的dna损伤后修复图;
[0041]
图18为实施例7sb225002对c666-1细胞裸鼠皮下瘤的治疗效果图;
[0042]
图19为实施例7sb225002对hone-1细胞裸鼠皮下瘤的治疗效果图;
[0043]
图20为实施例7sb225002联合放疗治疗裸鼠鼻咽癌肿瘤后肿瘤组织切片的ki67免疫组化染色图;
[0044]
图21为实施例7sb225002联合放疗治疗裸鼠鼻咽癌肿瘤后肿瘤组织切片的tunel免疫荧光染色图;
[0045]
图22为实施例7sb225002联合放疗治疗裸鼠鼻咽癌肿瘤后肿瘤组织切片的cd31和vegf免疫组化染色图;
[0046]
图23为实施例7sb22500抑制放疗介导的鼻咽癌肿瘤中的肿瘤相关中性粒细胞的浸润图;
[0047]
图24为实施例7sb225002联合放疗治疗裸鼠鼻咽癌肿瘤后肿瘤组织切片的ly6g免疫组化染色图;
[0048]
图25为实施例7放疗诱导人鼻咽癌肿瘤细胞发生细胞死亡图;
[0049]
图26为实施例7sb225002抑制裸鼠皮丘模型中辐照后的鼻咽癌细胞的上清液对中性粒细胞的募集图;
[0050]
图27为实施例7流式细胞术检测中性粒细胞分泌的细胞因子il-10结果图;
[0051]
图28为实施例7流式细胞术检测中性粒细胞分泌的细胞因子tgf-β结果图;
[0052]
图29为实施例7流式细胞术检测中性粒细胞分泌的细胞因子vegf结果图;
[0053]
图30为实施例7sb225002联合放疗治疗裸鼠的体重变化曲线图;
[0054]
图31为实施例7sb225002联合放射治疗鼻咽癌肿瘤模型中血生化检测结果图;
[0055]
图32为实施例7sb22500联合放射治疗在鼻咽癌皮下瘤模型中各脏器的he染色病理切片结果图。
具体实施方式
[0056]
本发明确认了cxcr2及其配体cxcl8在鼻咽癌中的高表达与患者的不良预后相关的临床现象,并以此为依据,首次将cxcr2作为鼻咽癌的治疗靶点。
[0057]
除此之外,本发明的创新点还在于首次将cxcr2抑制剂与放射治疗联合应用于鼻咽癌肿瘤的治疗中,发现cxcr2抑制剂不仅可以增加鼻咽癌肿瘤细胞对放射治疗的敏感性,还可以通过调节肿瘤微环境和抑制肿瘤新生血管来协同增加放射治疗对鼻咽癌的抗肿瘤
作用。具体而言,通过本发明的研究,cxcr2抑制剂增加鼻咽癌对放射治疗敏感性的机制有如下几点:(1)cxcr2抑制剂可以通过调节鼻咽癌细胞的细胞周期,使其阻滞放疗最敏感的g2/m期,而从增加鼻咽癌细胞的放疗敏感性,同时cxcr2抑制剂还能抑制放射治疗杀伤肿瘤细胞后的dna双链损伤修复。(2)cxcr2抑制剂可以通过抑制放射治疗诱导的肿瘤新生血管的形成,从而提高放射治疗的疗效。(3)cxcr2抑制剂可以通过抑制放射治疗诱导鼻咽癌肿瘤细胞死亡引起的中性粒细胞的募集,减少肿瘤微环境中的肿瘤相关中性粒细胞,改善肿瘤微环境中的免疫抑制因素,从而增加鼻咽癌肿瘤对放射治疗的敏感性。
[0058]
同时,在cxcr2抑制剂联合放射治疗的动物模型中,体重、排泄物监测、血生化检测和重要脏器的病理切片he染色检测均没有发现明显的毒副作用,表明cxcr2抑制剂联合放射治疗具有生物安全性,具有临床应用潜力。
[0059]
综上所述,cxcr2作为鼻咽癌的抗肿瘤治疗新靶点,在联合放射治疗提高疗效并减少放疗毒副作用方面具有良好的应用前景。
[0060]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0061]
1、实验主要试剂
[0062]
(1)细胞培养相关试剂:dmem培养基(美国gibico-invitrogen公司)、rpmi1640培养基(美国gibico-invitrogen公司)、胎牛血清(fbs,(美国gibico-invitrogen公司)、胰蛋白酶(美国gibico-invitrogen公司)、青霉素-链霉素(美国gibico-invitrogen公司)。
[0063]
(2)药物溶解相关试剂:cxcr2小分子抑制剂sb225002(美国selleck公司);聚乙二醇400(peg 400,美国sigmaaldrich公司)、tween 80(成都科龙化工有限公司)、二甲基亚砜(dmso,美国sigmaaldrich公司)。
[0064]
(3)实验室常用化学试剂:氯仿、无水乙醇、氯化钠、氯化铵、碳酸氢钠、磷酸氢二钠、磷酸二氢钠、水合氯醛、多聚甲醛等(成都科龙化工试剂厂);生理盐水(四川科伦药业股份有限公司);十二烷基磺酸钠(sds)、三羟甲基氨基甲烷(tris-base)、甘氨酸、吐温-20(tween-20)等(美国sigmaaldrich公司)。
[0065]
(4)免疫印迹法相关试剂:ripa裂解液(广州赛国科技有限公司公司);抗磷酸化酶抑制剂(美国epizyme公司);cocktail蛋白酶抑制剂(美国epizyme公司);蛋白上样缓冲液(碧云天公司);bca蛋白定量试剂盒(美国thermo scientific公司);page凝胶制备试剂盒(成都佰和科技有限公司)一抗稀释液(碧云天公司);蛋白预染maker(碧云天公司);牛血清白蛋白(bsa,美国sigmaaldrich公司);脱脂奶粉(美国bd公司);0.2μm pvdf膜(德国merck millipore公司);显影液(美国millipore公司);western blot一抗、二抗剥离液(碧云天公司)。
[0066]
(5)中细胞分离试剂:histopaque 1119(美国sigmaaldrich公司);histopaque 1077(美国sigmaaldrich公司)。
[0067]
(6)细胞实验相关试剂:碘化丙啶(pi,美国sigmaaldrich公司);结晶紫(北京索莱宝科技有限公司);枸橼酸钠(美国sigmaaldrich公司)、人重组蛋白cxcl8(近岸蛋白科技有限公司);rna酶(rnasea,碧云天公司);matrigel基质胶(美国bd biocoat公司356234)。
[0068]
(7)免疫荧光及免疫组化相关抗体及试剂:兔抗γh2ax多克隆抗体(美国abcam公司ab11174);山羊抗兔的igg荧光二抗(美国abcam公司ab6717);兔抗ki67单克隆抗体(美国abcam公司ab16667);兔抗小鼠的vegf多克隆抗体(美国abcam公司ab46154);兔抗cd31多克隆抗体(美国abcam公司ab28364);兔抗小鼠的ly6g多克隆抗体(武汉servicebio公司gb11229);兔抗人的cxcr2多克隆抗体(美国abcam公司ab143935);小鼠抗人的cxcl8单克隆抗体(美国abcam公司ab18672);hrp标记山羊抗兔二抗(武汉servicebio公司gb1211);tunel免疫荧光染色试剂盒(美国promega公司);组化试剂盒dab显色剂(武汉servicebio公司gb1211);dapi(碧云天公司);抗荧光淬灭封片剂(碧云天公司);打孔液triton x-100(美国sigmaaldrich公司)。
[0069]
(8)动物实验相关试剂:ι型和v型胶原酶(美国sigmaaldrich公司);苏木素(碧云天公司)、伊红染液(碧云天公司);免疫组化试剂盒(美国boster bio公司)。
[0070]
(9)流式抗体:抗小鼠的cd45-percp-cy5.5抗体(美国biolegend公司)、抗小鼠的cd11b-fitc抗体(美国biolegend公司)、抗小鼠的ly6g-bv421抗体(美国bd biolegend公司)、抗小鼠的ly6g-bv510抗体(美国bdbiolegend公司)、抗小鼠的ly6c-pe抗体(美国bd biolegend公司);大鼠抗小鼠的cxcr2一抗(美国r&d公司);兔抗大鼠的fitc荧光二抗(美国bd pharmingen公司);小鼠抗人的cxcr2-apc抗体(美国bd pharmingen公司551127);annexinv-fitc/pi双染试剂盒(美国bd pharminge公司);抗小鼠tgf-β-bv421抗体(美国bd biolegend公司);抗小鼠il-10一抗(美国bd biolegend公司);抗小鼠vegf一抗(美国abcam公司)。
[0071]
(10)免疫印迹法抗体:β-actin rabbitmab(美国cst公司#8457);β-actin mouse mab(美国cst公司#3700);erk1/2(美国cst公司#4695);phospho-erk1/2(美国cst公司#4370);p38(美国cst公司#8690);phospho-p38(美国cst公司#4511);jnk(美国cst公司#9252);phospho-jnk(美国cst公司#4668;山羊抗兔多克隆hrp二抗(美国abcam公司ab136817);山羊抗小鼠多克隆hrp二抗(美国abcam公司ab136815)。
[0072]
2、临床患者病例资料
[0073]
纳入的99例鼻咽癌患者的鼻咽癌组织病理组织芯片及临床资料由上海芯超生物科技有限公司提供,该样本签署了患者知情同意书,取得了医学伦理委员会的同意,符合医学伦理委员会的规定。
[0074]
3、细胞系
[0075]
人鼻咽癌细胞系c666-1、hone-1、hne-1、cne-1、cne-2购自美国典型培养物储藏中心(american type culture collection,atcc),由四川大学国家重点实验室保存并提供。
[0076]
人脐静脉上皮细胞系(huvecs)由四川大学国家生物重点实验室保存并提供。
[0077]
小鼠原代中性粒细胞,从6-8周雌性c57bl/6小鼠骨髓中提取的细胞,通过中性粒细胞分离液,经梯度离心分离,提取小鼠原代中性粒细胞。
[0078]
人原代中性粒细胞,将正常健康成年人外周血裂解红细胞后,通过中性粒细胞分离液,经梯度离心分离,提取人原代中性粒细胞。该样本签署了患者知情同意书,符合医学伦理委员会的规定。
[0079]
4、实验动物
[0080]
雌性spf级balb/c裸鼠(4~5周龄、16~18g)购自北京华阜康生物科技股份有限公
司,饲养于spf级动物房。
[0081]
雌性spf级c57bl/6小鼠(6~7周龄、18~20g)购自北京维通利华实验动物技术有限公司,饲养于spf级动物房。
[0082]
实施例1鼻咽癌肿瘤中cxcr2及其配体cxcl8的表达情况
[0083]
1.1鼻咽癌患者肿瘤组织中肿瘤细胞和间质细胞cxcr2高表达与不良预后相关
[0084]
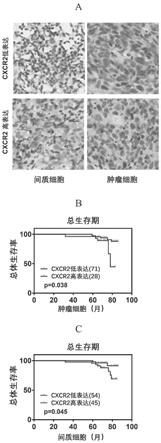
通过对上海芯超生物科技有限公司提供的99例鼻咽癌患者的肿瘤病理组织芯片进行免疫组化染色,发现患者鼻咽癌组织中肿瘤细胞及间质细胞均表达趋化因子cxcr2,如图1a所示,其中棕色代表阳性表达,图的放大倍数为20倍。
[0085]
根据cxcr2的表达强度和阳性率,由2名研究者对cxcr2的表达量进行了独立免疫组化分析(ihc)评分,并根据其表达的部位不同,将其分为肿瘤细胞cxcr2高表达组和cxcr2低表达组以及肿瘤中的间质细胞cxcr2高表达组和cxcr2低表达组。结合患者的临床资料进行kaplan
–
meier生存分析,结果发现,肿瘤组织中肿瘤细胞cxcr2高表达组的患者的总生存期比cxcr2低表达组患者更短,且两组患者的基线情况没有统计学差异,如图1b所示。同理,肿瘤组织中的间质细胞cxcr2高表达组的患者的总生存期也比cxcr2低表达组患者更短,且两组患者的基线情况没有统计学差异,如图1c所示。
[0086]
以上结果提示,鼻咽癌肿瘤组织中肿瘤细胞和间质细胞cxcr2高表达与不良预后相关。
[0087]
1.2鼻咽癌患者肿瘤组织中的肿瘤细胞cxcl8高表达与不良预后相关
[0088]
对上述组织芯片进行了cxcr2相关配体cxcl8的免疫组化染色,结果发现鼻咽癌患者肿瘤组织中的肿瘤细胞表达趋化因子cxcl8,如图2a所示,图的放大倍数为20倍。
[0089]
运用pearson's相关系数与线性回归对肿瘤细胞cxcl8的表达与肿瘤细胞和间质细胞cxcr2的表达进行了相关性分析,结果发现:患者肿瘤组织中肿瘤细胞cxcl8的表达与肿瘤间质细胞cxcr2的表达呈正相关,相关系数r=0.43,p<0.001;而肿瘤细胞cxcl8的表达与肿瘤细胞cxcr2的表达没有表现出相关性,r=0.14,p>0.05,如图2b所示,**p<0.01,***p<0.001。
[0090]
结合患者的临床资料,进行kaplan
–
meier生存分析,发现肿瘤组织中肿瘤细胞cxcl8高表达组的患者的总生存期比cxcl8低表达组患者更短,且两组患者的基线情况没有统计学差异,如图2c所示。
[0091]
结果提示,鼻咽癌患者肿瘤组织中肿瘤细胞cxcl8高表达与不良预后相关。
[0092]
1.3人鼻咽癌细胞系中cxcr2的表达
[0093]
为了进一步验证鼻咽癌中cxcr2的表达情况,对5种已建立的人鼻咽癌细胞系的cxcr2的表达情况进行检测。流式细胞术结果显示,人源鼻咽癌细胞系均表达cxcr2,其中cxcr2表达阳性率由高到低依次为c666-1(94.78%
±
1.325%)、hone-1(79.62%
±
0.495%)、hne-1(52.9
±
0.8373%)、cne-1(74.13%
±
1.181%)及cne-2(40.66%
±
1.9%),如图3a和图3b所示。对人鼻咽癌细胞系cxcr2蛋白的表达量进行western blot半定量分析也得到了一致的结果,如图3c所示。
[0094]
实施例2cxcr2抑制剂sb225002抑制人鼻咽癌细胞增殖的体外实验2.1sb225002抑制人鼻咽癌细胞的活性
[0095]
在体外,将不同浓度的sb225002(0μm,0.25μm,0.5μm,1μm)作用于上述人鼻咽癌细
胞系(c666-1、hone-1、hne-1、cne-1、cne-2),24小时后观察肿瘤细胞的形态及生长状态,结果发现,随着浓度增加,c666-1和hone-1细胞逐渐变圆、变亮,漂浮增加,1μm浓度处理后大部分细胞漂浮在培养基中;1μm浓度处理后的hne-1细胞有部分细胞变亮变圆,漂浮于培养基中;而cne-1和cne-2细胞形态变化均不明显,如图4所示,比例尺为500μm。
[0096]
在体外,将不同浓度的sb225002(0-10μm)作用于5种人鼻咽癌细胞系24-72小时,以溶剂组(0.1%dmso)作为对照,采用cck8的方法测定细胞活性并计算sb225002作用于每种细胞系各时间点的半抑制浓度(ic50)。结果发现,sb225002对人鼻咽癌细胞c666-1、hone-1、hne-1、cne-1、cne-2细胞活性的半抑制浓度(24h/48h/72h)依次递增,分别为0.872μm/0.3451μm/0.2795μm、1.287μm/0.4573μm/0.3377μm、3.784μm/0.6848μm/0.4598μm、3.722μm/1.153μm/0.992μm和9.568μm/2.484μm/1.747μm。半抑制浓度值越低,表示sb225002对该细胞系细胞活性的抑制作用越强。以上结果表明,在相同时间点,sb225002对5种人鼻咽癌细胞活性的抑制率均随着sb225002浓度的增加而增加;在相同浓度时,sb225002对5种人鼻咽癌细胞的增殖活性抑制率也均随着时间的延长而增加。这说明sb225002对人鼻咽癌细胞系活性的抑制作用具有浓度依耐性和时间依赖性。结合cxcr2在各细胞系中的表达量,发现sb225002对鼻咽癌细胞的抑制作用基本与cxcr2的表达量正相关,即sb225002对cxcr2表达量越高的鼻咽癌细胞系的抑制效果越明显,如图5所示,*p<0.05,**p<0.01,***p<0.001。
[0097]
2.2sb225002诱导人鼻咽癌细胞周期阻滞
[0098]
结合cxcr2的表达量及体外sb225002作用于5种人鼻咽癌细胞系后的cck8结果,选择鼻咽癌细胞系中cxcr2表达量最高且sb225002抑制效果最好的两种人鼻咽癌细胞系c666-1和hone-1进行后续研究。使用低渗的pi染色对不同浓度的sb225002处理后的人鼻咽癌肿瘤细胞c666-1和hone-1的细胞周期进行了流式细胞术测定,以0.1%dmso作为对照。结果发现,随着sb225002浓度(0,0.25,0.5,1μm)的增加,处于g1合成期的细胞逐渐减少,处于g2/m期的细胞逐渐增加。其中c666-1细胞g2/m期细胞比例由对照组的16.67%
±
2.06%,依次上升至33.7%
±
1.01%,45.72%
±
2.25%以及55.69%
±
1.13%。而hone-1细胞g2/m期细胞比例由对照组的27.5%
±
0.71%,依次上升至33.61%
±
0.47%,45.71%
±
0.63%以及65.18%
±
0.78%,如图6所示,*p<0.05,**p<0.01,***p<0.001。实验结果说明sb225002可诱导人鼻咽癌细胞g2/m期阻滞。
[0099]
2.3sb225002抑制人鼻咽癌细胞的克隆形成
[0100]
采用克隆形成实验检测sb225002处理c666-1和hone-1细胞后对其克隆形成能力影响,在6孔板中用不同浓度的sb225002(0,0.25,0.5,1μm)处理c666-1和hone-1细胞24小时后(0.1%dmso作为对照),继续培养10-14天,待有肉眼可见的克隆团后,弃去培养基,使用4%多聚甲醛固定细胞后,用0.5%结晶紫染色并计数大于50个细胞的克隆数。结果如图7所示,其中图7a为细胞克隆团的代表性照片,图7b为图7a的统计图,结果以均数
±
标准差表示,**p<0.01,***p<0.001。
[0101]
可以看出,随着sb225002浓度的递增,鼻咽癌肿瘤细胞c666-1和hone-1形成的克隆数逐渐减少,其中c666-1细胞形成的克隆数由对照组的120.7
±
11.7个,依次减少至90.7
±
6.6,48.7
±
8.3以及11.3
±
2.1个。而hone-1细胞形成的克隆数由对照组的93.0
±
4.0个,依次减少至63.3
±
3.7,45,24.7
±
2.9以及4.5
±
1.5个。
[0102]
以上结果表明,sb225002能抑制人鼻咽癌细胞的克隆形成。
[0103]
2.4sb225002抑制人鼻咽癌细胞内mapk信号通路的激活
[0104]
为了研究sb225005在体外抑制鼻咽癌肿瘤细胞增殖的分子机制,采用western blot检测不同浓度sb225002(0,0.25,0.5,1μm)处理人鼻咽癌细胞c666-1和hone-1后,其细胞内mapk信号通路的激活情况,以0.1%dmso作为对照。结果发现,sb225002处理2小时后,鼻咽癌肿瘤细胞c666-1和hone-1中mapk信号通路中磷酸化的p38和erk1/2的表达显著下降,而磷酸化的jnk1/2的表达显著升高,且该变化具有浓度依赖趋势,如图8所示。
[0105]
以上体外结果提示,cxcr2在鼻咽癌肿瘤细胞中,通过激活mapk信号通路来促进肿瘤细胞的增殖和生长,而cxcr2选择性小分子抑制剂sb225002可以阻断cxcr2与其配体的结合,抑制mapk信号通路的激活,从而抑制鼻咽癌肿瘤细胞增殖的作用。
[0106]
实施例3cxcr2抑制剂sb225002抑制血管形成的体外实验
[0107]
3.1sb225002抑制人鼻咽癌细胞肿瘤上清液对huvecs的趋化
[0108]
为了探索cxcr2抑制剂sb225002在鼻咽癌肿瘤中对新生血管生成的作用,在体外分别采用人鼻咽癌细胞肿瘤上清液(tumor culture medium supernatant,ts)和人重组蛋白cxcl8去刺激人脐静脉上皮细胞(huvecs),测量sb225002对huvecs在transwell中的迁移能力的抑制作用。在transwell的上室接种1
×
105个/200ul的huvecs,下室分别加入含或不含sb225002(0.5μm)的人鼻咽癌细胞的肿瘤上清液、50ng/ml人重组蛋白cxcl8和无血清无抗生素dmem培养基,培养24小时后,用4%多聚甲醛固定细胞,0.5%的结晶紫溶液染色5分钟,显微镜下计数穿过滤膜附着在膜下层的细胞数。结果发现,鼻咽癌细胞肿瘤上清液组和cxcl8组中穿过小室膜的huvecs数量(1185
±
15.9和1086
±
16.7)较无血清对照组(741
±
21)明显增加,p<0.001;而sb225002处理后,穿过小室膜的huvecs细胞数量较相对应的未处理组明显减少,p<0.001,如图9所示,*代表不含sb225002的肿瘤上清液组和cxcl8组与无血清培养基组之间统计结果的p值,
#
代表含sb225002组与相应未含sb225002的组之间的统计结果的p值,***p<0.001;
###
p<0.001。
[0109]
以上结果表明,鼻咽癌细胞肿瘤上清液和cxcl8均对huvecs有趋化作用,可增加其迁移,而sb225002可显著抑制肿瘤上清液及cxcl8对huvecs的趋化,提示sb225002可以通过阻断cxcl8-cxcr2轴从而抑制人鼻咽癌细胞肿瘤上清液介导的huvecs的迁移。
[0110]
3.2sb225002抑制鼻咽癌细胞肿瘤上清液对huvecs小管形成的促进
[0111]
由于人脐静脉上皮细胞huvecs保留了在在基质丰富的基底膜中形成三维小管的能力,可在体外反映血管上皮细胞生成新生血管的能力。因此将huvecs细胞8
×
104个/孔接种于基质胶铺底的24孔板中,用含或不含sb225002(0.5μm)的人鼻咽癌细胞的肿瘤上清液、50ng/ml蛋白cxcl8去刺激huvecs(无血清无抗生素dmem培养基作对照),3-4小时后观察其血管形成情况。结果发现,人鼻咽癌细胞肿瘤上清液组和cxcl8组中huvecs的形成小管总数(28.7
±
1.2和32.5
±
0.5)较对照组(21.3
±
1.5)明显增加,p<0.05,其形成的交点数和小管总长度(61.3
±
1.85和67.7
±
1.2;11948
±
220.2μm和12632
±
127.8μm)也较对照组(50.3
±
2.6;10811
±
307.8μm)明显增加,而sb225002可以显著抑制肿瘤上清液及cxcl8对huvecs小管形成的促进作用,如图10所示,*代表不含sb225002的肿瘤上清液组和cxcl8组与无血清培养基组之间统计结果的p值,
#
代表含sb225002组与相应未含sb225002的组之间的统计结果的p值,*p<0.05,**p<0.01;
###
p<0.001。
[0112]
以上结果表明,人鼻咽癌细胞肿瘤上清液和cxcl8能促进huvecs的小管形成,sb225002可以通过阻断cxcl8-cxcr2轴从而抑制鼻咽癌细胞肿瘤上清液对huvecs小管形成的促进。
[0113]
上述实验结果提示,sb225002在体外可以抑制鼻咽癌肿瘤对血管内皮细胞的趋化和对小管形成的促进作用,具有抑制鼻咽癌肿瘤中新生血管生成的潜力。
[0114]
实施例4cxcr2抑制剂sb225002抑制中性粒细胞迁移的体外实验
[0115]
4.1人鼻咽癌细胞肿瘤上清液刺激原代中性粒细胞会上调其cxcr2的表达
[0116]
为了探索cxcr2抑制剂sb225002对鼻咽癌肿瘤的微环境的调节作用,首先在体外验证sb225002是否能抑制肿瘤对中性粒细胞的趋化。采用梯度分离的方法提纯了小鼠的骨髓中的原代中性粒细胞和人外周血中的原代中性粒细胞,以流式细胞术检测中性粒细胞纯度,其中cd45
+
cd11b
+
ly6g
+
的中性粒细胞可达90%以上,结果如图11a所示。将提纯出的小鼠骨髓原代中性粒细胞和人外周血原代中性粒细胞分别与人鼻咽癌细胞肿瘤上清液(ts)共培养6小时(以含10%fbs的正常完全培养基作对照),再检测两种原代中性粒细胞cxcr2的表达量。结果发现,相对于正常培养基的对照组,肿瘤上清液共培养组的小鼠骨髓原代中性粒细胞和人外周血原代中性粒细胞中cxcr2阳性细胞比例均有显著的增加,如图11b所示。这说明肿瘤上清液可以提高中性粒细胞cxcr2的表达量。
[0117]
4.2sb225002抑制人鼻咽癌细胞肿瘤上清液对原代中性粒细胞的趋化
[0118]
为了模拟体内肿瘤对中性粒细胞的趋化和募集,将小鼠骨髓原代中性粒细胞和人外周血原代中性粒细胞5
×
105个分别接种于transwell的上室,下室分别加入含或者不含sb225002(0.5μm)的人鼻咽癌细胞的肿瘤上清液、50ng/ml人重组蛋白cxcl8和无血清无抗生素dmem培养基培养4小时后,流式细胞仪计数穿过滤膜进入下室液体中的中性粒细胞的数量,以衡量其迁移能力。结果发现,肿瘤上清液和人重组蛋白cxcl8刺激的小鼠骨髓原代中性粒细胞穿过小室滤膜的数量比对照组明显增加,由2529
±
60.5个分别增加至82919
±
9002个和11636
±
448个;肿瘤上清液和人重组蛋白cxcl8刺激的人外周血原代中性粒细胞穿过小室滤膜的数量由对照组的9159
±
947.2个分别增加至127807
±
13323个和85395
±
3427个;而sb225002可以显著抑制肿瘤上清液及cxcl8对中性粒细胞的趋化作用。如图12所示,其中图12a为小鼠骨髓来源的原代中性粒细胞transwell迁移实验结果统计图,图12b为人外周血来源的原代中性粒细胞transwell迁移实验结果统计图;*代表不含sb225002的肿瘤上清液组和cxcl8组与无血清培养基组之间统计结果的p值,
#
代表含sb225002组与相应未含sb225002的组之间的统计结果的p值,*p<0.05,**p<0.01;
#
p<0.05。无论是小鼠骨髓来源的原代中性粒细胞还是人外周血来源的原代中性粒细胞,人鼻咽癌细胞肿瘤上清液和人重组蛋白cxcl8均对其有趋化作用,可增加其迁移能力,而sb225002可以显著抑制人鼻咽癌肿瘤上清液和cxcl8对中性粒细胞的趋化作用。其中肿瘤上清液对中性粒细胞的趋化作用比人重组蛋白cxcl8更强,这可能与肿瘤上清液同时增加了原代中性粒细胞cxcr2的表达量相关;人鼻咽癌肿瘤细胞上清液和人重组蛋白cxcl8对小鼠骨髓来源的原代中性粒细胞的趋化作用弱于对人外周血来源的中性粒细胞的趋化作用,这可能与种属同源性差异相关。
[0119]
以上结果表明,人鼻咽癌细胞肿瘤上清液可以上调中性粒细胞的cxcr2表达量,并通过以cxcl8为主的趋化因子趋化募集人源或鼠源的中性粒细胞,而sb225002可以通过阻断cxcl8-cxcr2轴抑制人鼻咽癌细胞肿瘤上清液介导的中性粒细胞的迁移,提示sb225002
具有抑制鼻咽癌肿瘤对中性粒细胞的募集的潜力。
[0120]
实施例5cxcr2抑制剂sb225002对裸鼠人鼻咽癌肿瘤模型的抗肿瘤作用
[0121]
上述实验已经在体外证实了cxcr2小分子抑制剂sb225002能抑制人鼻咽癌肿瘤细胞的增殖和克隆形成,同时能抑制肿瘤上清对中性粒细胞和内皮细胞的趋化,并对内皮细胞形成血管有抑制作用,显示出良好的抗鼻咽癌肿瘤的潜力。因此,本实施例进一步将sb225002应用于鼻咽癌裸鼠模型,验证在体内sb225002能否有效的抑制鼻咽癌肿瘤的生长。构建balb/c裸鼠人鼻咽癌c666-1细胞的皮下瘤异体移植模型:在5周龄的雌性balb/c裸鼠右侧大腿皮下接种c666-1细胞5
×
106个/只,接种后随机分为3个组,分别给予以下方案处理:(1)肿瘤自然生长组,不予任何处理,作为空白对照;(2)溶剂对照组,每日腹腔注射溶剂(25%peg 400+5%tween 80+70%ddh2o)100μl作为对照;(3)sb225002组,接瘤第5天开始给药,每日腹腔注射10mg/kg sb225002溶液100μl,连续给药至实验终止;每3天测量一次肿瘤大小和小鼠体重,给药第18天时,处死小鼠,观察疗效。结果显示,单纯sb225002治疗组在c666-1鼻咽癌肿瘤细胞的裸鼠皮下瘤模型中对的肿瘤抑制率为35%,如图13所示,**p<0.01,***p<0.001。
[0122]
以上结果表明,sb225002具有显著的抗鼻咽癌的效果。
[0123]
实施例6cxcr2抑制剂sb225002增加鼻咽癌放疗敏感性的体外实验
[0124]
为证明cxcr2抑制剂能够增强鼻咽癌放疗敏感性,本实施例在体外检测了sb225002与电离辐射联合作用于肿瘤细胞后对其细胞克隆形成能力、细胞周期以及dna损伤情况的影响。
[0125]
6.1sb225002在体外可以通过诱导周期阻滞增加人鼻咽癌细胞的放疗敏感性
[0126]
首先在体外验证sb225002是否可以增强人鼻咽癌肿瘤细胞对放射治疗的敏感性。将经sb225002(0.25μm和0.5μm,以0.1%dmso作为对照组)处理3-4小时后人鼻咽癌肿瘤细胞c666-1和hone-1分别进行不同的辐照剂量(0gy、2gy、4gy、6gy、8gy)的x射线辐照,待sb225002处理24小时后更换新鲜培养基继续培养10-14天,直到出现肉眼可见细胞克隆团时终止培养,0.5%结晶紫染色,观察并计数大于50个细胞的克隆团数,计算克隆形成率。结果发现,0gy剂量对照组的肿瘤细胞生长状态良好,可见多个肉眼可见的c666-1或hone-1细胞形成的克隆团,随着照射剂量的增加,细胞逐渐出现细胞膜破裂、细胞崩解等,漂浮于培养基中。各放射剂量组中sb225002实验组的克隆形成率都较其对照组有所下降,且具有浓度依赖性,如图14所示,*p<0.05,**p<0.01。
[0127]
以上结果表明,sb225002在体外能增加人鼻咽癌肿瘤细胞c666-1和hone-1的放疗敏感性,且具有浓度依赖性,其中0.5μm浓度的sb225002对人鼻咽癌肿瘤细胞有较显著的放疗增敏作用,后续体外实验均0.5μm浓度sb225002与放射治疗联合使用。
[0128]
为了进一步探究sb225002增加人鼻咽癌肿瘤细胞对放疗敏感性的机制,用低渗的pi染色,对单独sb225002(0.5μm)处理、单独x射线辐照(8gy)处理以及sb225002联合x射线辐照处理后的人鼻咽癌c666-1和hone-1细胞的细胞周期进行了流式细胞术检测,以0.1%dmso作为对照。结果发现,单独接受x射线辐照治疗的肿瘤细胞,细胞周期变化不明显,单独sb225002治疗的肿瘤细胞g2/m期阻滞。而sb225002处理3-4小时后接受x射线辐照的肿瘤细胞,g2/m期阻滞的细胞比例显著下降,如图15所示,*代表对照组与sb225002组或单独x射线辐照处理组之间统计结果的p值,
#
代表单独sb225002组与sb225002联合x射线辐照处理组
之间的统计结果的p值,
$
代表单独x射线辐照处理组与sb225002联合x射线辐照处理组之间的统计结果的p值;***p<0.001;
###
p<0.001;
$$$
p<0.001。
[0129]
以上结果表明,sb225002可以通过诱导人鼻咽癌细胞阻滞在对放射治疗敏感的g2/m期,从而提高其对放疗的敏感性。
[0130]
6.2sb225002在体外可以通过抑制dna损伤后修复增加人鼻咽癌细胞的放疗敏感性
[0131]
放射治疗可以直接和间接地损伤细胞的dna,引起dna的断裂、交联从而杀伤肿瘤细胞,其中dna双联断裂(dbs)是放射治疗最常见的dna损伤形式。由于射线造成的损伤多为亚致死性损伤,部分肿瘤细胞dna在损伤后仍可以修复,这也是肿瘤对放射治疗抵抗的机制之一。因此为了探究sb225002对鼻咽癌细胞x射线辐照引起的dna损伤后修复的作用,本实施例对sb225002(0.5μm,处理3-4小时)联合x射线辐照处理(8gy)后的人鼻咽癌细胞c666-1和hone-1内dna双链损伤标志物γh2ax进行过免疫荧光染色,观察显微镜下各组细胞中γh2ax焦点的数量,以细胞核内γh2ax焦点数大于10个的细胞为γh2ax阳性细胞。结果发现,对照组的c666-1和hone-1细胞中几乎没有γh2ax阳性的细胞(6.8%
±
1.4%和17.0%
±
10.4%),而相比单独接受x射线辐照处理组(34.0%
±
4.8%和47.4%
±
4.4%),接受sb225002联合x射线辐照处理组的细胞内中γh2ax阳性的细胞显著增多(76.0%
±
5.8%和84.5%
±
3.5%),如图16和图17所示,其中绿色荧光颗粒代表γ-h2ax焦点,蓝色荧光代表dapi,**p<0.01,***p<0.001。
[0132]
以上结果表明,sb225002可以抑制人鼻咽癌肿瘤细胞在放射治疗后的dna损伤后修复,减少其对放疗的抵抗,增加放疗敏感性。
[0133]
实施例7cxcr2抑制剂sb225002联合放疗对裸鼠人鼻咽癌肿瘤模型的抗肿瘤作用
[0134]
7.1sb225002联合放射治疗对裸鼠人鼻咽癌皮下瘤模型的治疗效果
[0135]
为了进一步验证在体内,cxcr2抑制剂能否有效抑制鼻咽癌肿瘤的生长并探究其是否能提高放射治疗的效果,本实施例构建了balb/c裸鼠人鼻咽癌c666-1和hone-1细胞的皮下瘤异体移植模型,接种肿瘤细胞后随机分为5个组,分别给予以下方案处理:(1)肿瘤自然生长组,不予任何处理,作为空白对照;(2)溶剂对照组,每日腹腔注射溶剂(25%peg 400+5%tween80+70%ddh2o)100μl作为对照;(3)sb225002组,接瘤第5天开始给药,每日腹腔注射10mg/kg sb225002溶液100μl;(4)单独放射治疗组,给药后的第3天给予单次8gy剂量x射线辐照肿瘤局部;(5)联合治疗组,sb225002联合单次8gy剂量x射线辐照肿瘤局部。每3天测量一次肿瘤大小和小鼠体重,观察肿瘤生长情况。结果显示,单纯sb225002治疗组在c666-1和hone-1两种鼻咽癌肿瘤细胞的裸鼠皮下瘤模型中对的肿瘤抑制率分别为38%和29%;单纯放疗治疗组在两种肿瘤模型中的肿瘤抑制率分别为69%和54%;而联合治疗组的抑瘤效果最佳高达79%和86%,其肿瘤体积均较单纯放疗组缩小了55%,如图18和图19所示,*p<0.05,**p<0.01,***p<0.001。
[0136]
以上结果表明,sb225002具有一定的肿瘤抑制效果,并能显著的增强放射治疗的抗肿瘤作用。
[0137]
7.2sb225002联合放射治疗抑制鼻咽癌肿瘤细胞增殖、促进细胞凋亡
[0138]
为了进一步验证sb225002联合放射治疗在体内对鼻咽癌肿瘤细胞增殖活性的抑制作用,对鼻咽癌c666-1皮下瘤模型的肿瘤组织进行细胞增殖标志ki67的免疫组化染色。
结果发现,sb225002组和放射治疗组小鼠肿瘤组织内的ki67表达量低于对照组,而sb225002联合放射治疗组小鼠肿瘤组织内的ki67表达量,明显低于sb225002组和单独放射治疗组,如图20所,其中棕色代表ki67阳性,比例尺为50μm。
[0139]
以上结果表明,在体内sb225002可抑制肿瘤细胞的增殖,并能增强放疗对肿瘤细胞增殖的抑制作用。
[0140]
同时,为了探索sb225002联合放射治疗后肿瘤组织中细胞凋亡的情况,对该模型的肿瘤组织进行了tunel免疫荧光染色。结果发现,sb225002组和放射治疗组小鼠肿瘤组织内的tunel表达量高于对照组,而sb225002联合放射治疗组小鼠肿瘤组织内的tunel表达量,明显高于sb225002组和单独放射治疗组,如图21所示,其中绿色荧光代表tunel,蓝色荧光代表dapi,图的放大倍数为20倍。
[0141]
以上结果表明,在体内sb225002可促进肿瘤细胞的凋亡,并能增强放疗对肿瘤细胞的杀伤作用。
[0142]
7.3sb225002可以抑制放疗诱导的肿瘤新生血管的生成
[0143]
有研究报道,放射治疗会诱导肿瘤新生血管的生成,新生的血管在肿瘤抵抗放疗损伤和肿瘤的复发中具有重要作用。为了进一步验证sb225002是否可以减少放射治疗后鼻咽癌肿瘤组织中的微血管密度及新生血管的生成,采用免疫组化的方法,检测了sb225002联合放疗抗治疗裸鼠鼻咽癌皮下瘤模型中肿瘤组织的cd31和vegf的表达情况。结果发现,sb225002组小鼠肿瘤组织中cd31和vegf的表达明显低于对照组;相较于对照组,单独放射治疗组小鼠肿瘤组织中的cd31和vegf表达增加,而sb225002联合放射治疗组小鼠肿瘤组织中的cd31和vegf的表达明显低于单独放疗组,如图22所示,其中棕色代表cd31或vegf阳性,比例尺为100μm。
[0144]
以上结果表明,sb225002在体内可以通过抑制放射治疗诱导的肿瘤新生血管的生成,减少鼻咽癌肿瘤对放疗的抵抗,从而增加放疗对鼻咽癌的抗肿瘤作用。
[0145]
7.4sb225002可以抑制放疗介导的肿瘤相关中性粒细胞的浸润
[0146]
有研究表明,募集至肿瘤灶的中性粒细胞在肿瘤微环境的作用下会转化成为具有免疫抑制功能的肿瘤相关中性粒细胞(tumor-associated neutrophils,tan)促进肿瘤的生长。为了验证sb225002在体内联合放射治疗对肿瘤微环境的调节作用,对sb225002联合放疗治疗鼻咽癌c666-1皮下瘤模型中各实验组小鼠的肿瘤组织进行了流式细胞术检测,观察肿瘤组织中cd45
+
cd11b
+
ly6c
mid
ly6g
high
的中性粒细胞的比例和数量。结果发现,sb225002组小鼠肿瘤组织内的中性粒细胞比例(57.17%
±
5.667%)显著低于溶剂对照组的(76.74%
±
4.887%),p<0.05;放射治疗组小鼠肿瘤组织内的中性粒细胞比例(82.82%
±
1.465%)比溶剂对照组(76.74%
±
4.887%)有所升高,差异尚无统计学意义;而sb225002联合放射治疗组小鼠肿瘤组织内的中性粒细胞比例(48.57%
±
3.058%)显著低于单独放射治疗组(82.82%
±
1.465%),p<0.01。对各组每1
×
105个细胞中中性粒细胞的绝对数进行统计发现,sb225002组小鼠肿瘤组织内的中性粒细胞数(398.8
±
60.52)显著低于溶剂对照组(705.9
±
97.77),p<0.05;放射治疗组小鼠肿瘤组织内的中性粒细胞数(809.5
±
136.9)较溶剂对照组(710.8
±
84.22)略有升高,差异尚无统计学意义;而sb225002联合放射治疗组小鼠肿瘤组织内的中性粒细胞数(356.5
±
39.55)显著低于单独放射治疗组(809.5
±
136.9),p<0.05,如图23所示,*p<0.05,**p<0.01。
[0147]
此外,对sb225002联合放疗治疗裸鼠鼻咽癌皮下瘤模型中的肿瘤组织进行ly6g免疫组化染色,发现放射治疗组小鼠肿瘤组织内的ly6g阳性的细胞显著增加,sb225002联合放射治疗组小鼠肿瘤组织内的ly6g阳性的细胞显著少于放射治疗组,也证实了sb225002可以有效的抑制放疗诱导的肿瘤组织内ly6g阳性的中性粒细胞浸润的增加,如图24所示,**p<0.01,***p<0.001。
[0148]
7.5sb225002抑制放疗诱导肿瘤细胞死亡引起的中性粒细胞的募集
[0149]
有研究报道,放疗诱导鼻咽癌肿瘤细胞死亡后释放出的损伤相关分子模式(damage-associated molecularpatterns,damps)会刺激中性粒细胞的募集至肿瘤灶。基于此,有可能放疗诱导的肿瘤细胞死亡增加了肿瘤微环境中的免疫抑制性的中性粒细胞从而限制了放疗的抗肿瘤作用。为了进一步验证sb225002是否可以抑制放疗诱导肿瘤细胞死亡而引起的中性粒细胞的募集增加,增加鼻咽癌对放疗的敏感性,本实施例首先采用annexinv和pi染色流式细胞术检测在体外辐照对人鼻咽癌细胞的杀伤作用,结果发现,辐照可诱导鼻咽癌细胞发生凋亡(annexinv
+
)和坏死(annexinv
-
pi
+
),且这种死亡为迟发性的,约在辐照72小时开始,在辐照96小时后较显著,如图25所示,**p<0.01,***p<0.001。
[0150]
于是本实施例构建了裸鼠皮丘模型,如图26a所示。在辐照后第4天,收集接受或未接受辐照处理的鼻咽癌c666-1和hone-1肿瘤细胞培养上清液和含有sb225002的辐照处理的鼻咽癌细胞肿瘤上清液,注射至裸鼠皮下形成皮丘(以无血清无抗生素dmem培养基为对照),6小时后用流式细胞术检测皮丘组织内中性粒细胞数量。结果发现,空白对照组中小鼠皮丘内的中性粒细胞数为56.6
±
23.8个/105个细胞;注射经8gy辐照处理的c666-1以及hone-1肿瘤细胞上清液组的小鼠皮丘内的中性粒细胞数最多,分别为354.7
±
34.9和1152
±
188.3个/105个细胞;注射未辐照处理的肿瘤细胞上清液组的小鼠皮丘内的中性粒细胞数次之,分别为133.4
±
45.4和490.8
±
67.6个/105个细胞;注射含有sb225002(0.5μm)的8gy辐照处理的c666-1以及hone-1肿瘤细胞上清液组的小鼠皮丘内的中性粒细胞数(157.8
±
4.7和409.2
±
35.4个/105个细胞)较8gy辐照处理组显著减少,如图26b所示,ns代表差异无统计学意义,*p<0.05,**p<0.01。
[0151]
以上结果说明,放射治疗诱导鼻咽癌肿瘤细胞死亡后释放出的某些物质会刺激增加肿瘤对中性粒细胞的趋化和募集,而sb225002可以抑制放疗诱导肿瘤细胞死亡引起的中性粒细胞的募集。辐照处理后的hone-1细胞肿瘤上清液对中性粒细胞的趋化作用强于c666-1,这可能是由于在辐照处理后的第4天时,hone-1细胞的死亡多于c666-1细胞。
[0152]
综合以上结果,表明sb225002可抑制放疗诱导肿瘤细胞死亡引起的鼻咽癌肿瘤灶对中性粒细胞的募集,从而减少了鼻咽癌肿瘤微环境中肿瘤相关中性粒细胞的浸润。
[0153]
为了明确这群被抑制的肿瘤相关中性粒细胞在鼻咽癌肿瘤中的功能,本实施例采用流式细胞术对正常小鼠外周血中性粒细胞(non-tumor-bearing mice peripheral bloodneutrophil,npbn)、人鼻咽癌c666-1荷瘤小鼠外周血中性粒细胞(tumor-bearing mice peripheral bloodneutrophil,tpbn)以及其肿瘤组织中的肿瘤相关中性粒细胞(tan)分泌的相关免疫抑制因子(il-10、tgf-β和vegf)进行了检测。结果发现,人鼻咽癌荷瘤小鼠肿瘤组织中的肿瘤相关中性粒细胞(tan)分泌的il-10(36.87%
±
9.83%)高于正常小鼠外周血中性粒细胞(npbn)分泌的il-10(12.53%
±
1.429%),也高于人鼻咽癌荷瘤小鼠外周血中性粒细胞(tpbn)分泌的il-10(7.02%
±
4.529%),p<0.05,如图27所示。tan分
泌的tgf-β(38.97%
±
6.335%)高于npbn(0.6567%
±
0.1184%)和tpbn(0.7967%
±
0.3569%)分泌的tgf-β,p<0.01,如图28所示。tan分泌的vegf(67.29%
±
5.36%)高于npbn(11.79%
±
4.257%)和tpbn(7.313%
±
2.504%)分泌的vegf,p<0.01,如图29所示。而npbn和tpbn分泌的免疫抑制因子il-10、tgf-β和vegf间没有明显差异。
[0154]
以上结果表明,与外周血中的中性粒细胞相比,鼻咽癌肿瘤组织中的肿瘤相关中性粒细胞具有分泌免疫抑制因子,促进肿瘤生长的作用。
[0155]
上述实验结果说明,放射治疗诱导的鼻咽癌肿瘤细胞死亡会增加肿瘤灶对中性粒细胞的募集,从而增加肿瘤中tan的浸润。而tan能分泌免疫抑制因子促进鼻咽癌肿瘤生长,抵抗放疗的抗肿瘤作用。而sb225002恰好可以抑制放疗诱导的中性粒细胞的浸润,起到增加鼻咽癌肿瘤对放射治疗的敏感性。
[0156]
综合以上实验,证明cxcr2抑制剂sb225002不仅可以增加鼻咽癌细胞对放射治疗的敏感性,还要可以通过调节肿瘤微环境和抑制肿瘤新生血管来协同增加放射治疗对鼻咽癌的抗肿瘤作用。
[0157]
7.6sb225002联合放射治疗在鼻咽癌皮下瘤动物模型中的毒性研究
[0158]
为了评估sb225002联合放射治疗在鼻咽癌抗肿瘤治疗过程中的毒副作用,本实施例在给药期间,每3天观察记录一次小鼠的体重。结果显示,各实验组小鼠体重变化曲线无明显差异,如图30所示,其中图30a为鼻咽癌c666-1细胞皮下瘤模型中各组裸鼠的体重变化曲线,图30b为鼻咽癌hone-1细胞皮下瘤模型中各组裸鼠的体重变化曲线。
[0159]
在处死小鼠前眼球取血,对小鼠的血清进行血生化检测评估sb225002联合放射治疗对小鼠的肝功能和肾功能的影响。结果显示,sb225002组小鼠的肝功能指标alt、ast和肾功能指标crea和bun均比溶剂对照组小鼠偏高,但差异尚无统计学意义;联合治疗组小鼠的肝功能指标alt、ast和肾功能指标crea和bun较单纯放射治组也都偏高,差异尚不具有统计学意义,如图31所示。
[0160]
同时,本实施例在处死小鼠时取各实验组小鼠的心肝脾肺肾等重要脏器进行he染色,从形态上对各重要脏器进行毒副作用的评估。结果显示,联合治疗组仅肾脏中有少量出血点,如图32所示。
[0161]
以上结果表明10mg/kg剂量的sb225002联合放疗在裸鼠鼻咽癌抗肿瘤治疗过程中没有严重的毒副作用。
[0162]
需要说明的是,本说明书中描述的具体特征、结构、材料或者特点可以在任一个或多个实施例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例以及不同实施例的特征进行结合和组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1