AMHR2重组蛋白或融合蛋白在制备AMH信号轴异常活化相关疾病治疗药物中的用途的制作方法
本发明涉及生物医药工程
技术领域:
,具体涉及重组amhr2及amhr2融合蛋白、以其作为活性组分的药物组合物和其医药用途,尤其是用于amh信号轴异常活化相关疾病的用途。
背景技术:
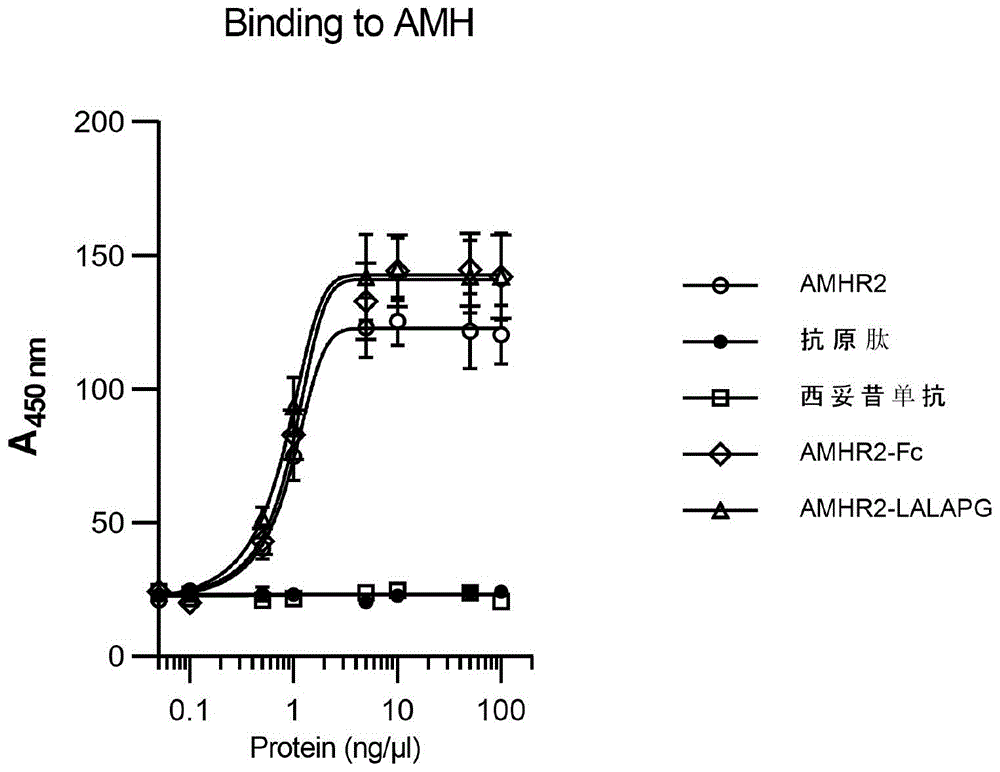
:抗苗勒管激素(anti-müllerianhormone,amh),亦称为苗勒管-抑制物质(müllerianinhibitingsubstance,mis),是一种tgf-β家族糖蛋白。amh受体包括i型受体和ii型受体的受体复合物,其中ii型受体即amhr2,多个i型受体参与信号的传导。amh在人雄性胚胎中诱导苗勒管退化,但在生殖年龄的女性中表达,不随周期或妊娠而波动,随卵母细胞数量和质量二者降低而逐渐降低,表明amh可用作卵巢生理学的标记物。参见文献例如[zecetal,(2011)biochemiamedica21(3):219-30]。在睾丸中,amh通过抑制细胞色素p45017α-羟化酶/c17-20裂解酶和芳香化酶的转录来调节leydig细胞雄激素的生成,染色体19p13位置的amh突变或染色体12q13位置的amhr2突变均可以引起男性常染色体隐性遗传疾病:持续性苗勒氏管综合征(persistentmüllerianductsyndrom,pmds)。对于女性而言,出生后amh是由颗粒细胞产生并逐渐升高,在生育期达到高峰,与生育力的峰值吻合,然后在功能性绝经时逐渐下降。在卵巢中,amh抑制原始卵泡募集、第二次减数分裂、颗粒细胞分裂和孕激素产生。正由于血液amh水平与生育力的吻合性,其作为生物标志物已广泛应用于生育力的诊断。近年来的一些报道显示,amh参与多种生理过程,如怀孕,排卵,更年期和生育力保留等。它还可能参与一些特殊疾病的病理生理过程,如多囊卵巢综合征(polycysticovariansyndrome,pcos)和癌症等,但由于这些疾病的复杂性,amh信号轴在其中的地位未明。目前,尚未有amh信号轴的拮抗剂功能的新型药物问世,阻碍了进一步的研究。因此,本发明人创新性的认为,利用通用的蛋白质工程方法,重组amhr2的胞外结构域获得的重组蛋白,以及再进一步制备amhr2获得的融合蛋白,也许可以发挥amh拮抗剂的效应。专利文献wo2015114142a1公开了一种类似的amhr融合蛋白、其制备方法及其在检测血浆amh水平中的用途。但并未公开或提示其拮抗/中和amh作用,事实上,amh和amhr2介导的信号传导是由多个受体(如多个alk受体)、多个接头蛋白参与的,重组amhr2及amhr2融合蛋白能否发挥拮抗效果是未知的,即重组蛋白和融合蛋白能否阻断amh信号轴、能否拮抗/中和由amh介导的生物学效应是未知的。进一步的,重组蛋白和融合蛋白能否用于机理尚未明确的疾病治疗也是完全未知的,需要技术人员进行大量创造性的工作才能得知。技术实现要素:本发明的目的在于,依托上述研究背景,研究amhr2重组蛋白或amhr2融合蛋白能否用于amh的拮抗或中和、amh异常相关疾病的治疗,并对发挥所述用途的amhr2重组蛋白或amhr2融合蛋白的具体结构、制备方法和用途进行了限定性描述,即提供了amhr2重组蛋白或amhr2融合蛋白、其制备方法和用途。本发明的第一方面,对amhr2重组蛋白或amhr2融合蛋白的多肽链结构进行描述。amhr2重组蛋白的多肽链结构通式为z1,amhr2融合蛋白的多肽链结构通式为z1-z2,其中z1为amhr2胞外结构域或其功能变体或片段,z2为二聚化结构域或其功能变体或片段。所述amhr2在国际数据库编码为:entrezgene:269;uniprotkb:q16671。z2二聚化结构域包括免疫球蛋白重链恒定区。在具体的变化中,二聚化结构域z2是igg的fc片段,诸如人免疫球蛋白γ1fc片段。此外,二聚化结构域z2还可以包含有肽接头,该肽接头由15-32个氨基酸残基组成,其中这些残基中的1-8个(例如,2个)是半胱氨酸残基。在具体变化中,z2包含免疫球蛋白铰链区或其变体。例如,在一个具体实施方案中,z2包含免疫球蛋白铰链变体(例如,人免疫球蛋白γ1铰链变体),其中fc片段的220相对应的半胱氨酸残基被丝氨酸替代。根据上述二聚化结构域z2使用的特别合适的肽接头包括这样的肽接头:所述接头包含多个甘氨酸残基,且任选地包含至少一个丝氨酸残基。在本发明的某些实施方案中,二聚化结构域z2可以是人免疫球蛋白fc片段的活性变体,如采用igg2、igg3或igg4的fc结构域。在某些实施方案中,可以进一步采用fc的突变体以降低免疫球蛋白诸如adcc、补体结合等生物活性,如lala-pg突变体、l235e;e318a;k320a;k322a突变体等。在某些实施方案中,还包括可以减少新生儿fc受体结合的igg突变体,如h433k/n434f突变体、i253a/h310a/h435a突变体、m428l/n434s突变体、m252y/s254t/t256e突变体等,参见grevys,aetal.thejournalofimmunology194.11(2015):5497-5508.在本发明的一些优选实施例中,z1的氨基酸序列与seqidno.1所示的氨基酸序列具有至少60%、优选至少65%、优选至少70%、更优选至少75%、更优选至少80%、更优选至少85%、甚至更优选至少90%、甚至更优选至少95%和最优选至少99%同一性。在本发明的一些优选实施例中,z1-z2的氨基酸序列与seqidno.2所示的氨基酸序列具有至少60%、优选至少65%、优选至少70%、更优选至少75%、更优选至少80%、更优选至少85%、甚至更优选至少90%、甚至更优选至少95%和最优选至少99%同一性。在本发明的一些优选实施例中,z1-z2的氨基酸序列与seqidno.3所示的氨基酸序列具有至少60%、优选至少65%、优选至少70%、更优选至少75%、更优选至少80%、更优选至少85%、甚至更优选至少90%、甚至更优选至少95%和最优选至少99%同一性。本发明的第二方面,提供了编码上述多肽链的多核苷酸、运载该核苷酸的载体以及包含这种载体的细胞。本发明提供的表达载体包含下述可操作地连接的元件:转录启动子、编码上述多肽的dna区和转录终止子。通过培养包含载体的细胞,用于生产如上公开的多肽,包括:(i)培养包含如上公开的表达载体的细胞,其中细胞表达由所述dna区段编码的多肽,并生产编码的多肽;(ii)回收可溶性多肽。本发明的第三方面,提供了一种amh中和剂或拮抗剂,包括活性成分以及药学上可接受的药物载体,所述活性成分包括上述的amhr2重组蛋白或融合蛋白、编码该amhr2重组蛋白或融合蛋白的核苷酸或运载有amhr2重组蛋白或融合蛋白或核苷酸的载体。该药物组合物以上述多肽为主要或唯一活性成分,辅料可以保证本发明公开的多肽氨基酸核心序列的构像完整性,同时还要保护蛋白质的多官能团,防止其降解(包括但不限于凝聚、脱氨或氧化),从而更稳定地发挥疗效。在药物形式上,可为制药领域常用的混悬、水针、冻干等制剂,优选水针或冻干制剂。液体制剂可以在2℃-8℃条件下保存至少稳定一年,冻干制剂在30℃至少六个月保持稳定。对于本发明公开的上述amhr2重组蛋白和/或amhr2融合蛋白的水针或冻干制剂,药学上可以接受的辅料包括表面活性剂、溶液稳定剂、等渗调节剂和缓冲液之一或其组合。其中,表面活性剂包括非离子型表面活性剂如聚氧乙烯山梨醇脂肪酸酯(吐温20或80);poloxamer(如poloxamer188);triton;十二烷基硫酸钠(sds);月桂硫酸钠;十四烷基、亚油基或十八烷基肌氨酸;pluronics;monaquattm等,其加入量应使双功能双特异性抗体蛋白的颗粒化趋势最小;溶液稳定剂可以为糖类,包括还原性糖和非还原性糖,氨基酸类包括谷氨酸单钠或组氨酸,醇类包括三元醇、高级糖醇、丙二醇、聚乙二醇之一或其组合,溶液稳定剂的加入量应该使最后形成的制剂在本领域的技术人员认为达到稳定的时间内保持稳定状态;等渗调节剂可以为氯化钠、甘露醇之一;缓冲液可以为tris、组氨酸缓冲液、磷酸盐缓冲液之一。本发明的第四方面,提供了本发明的amhr2重组蛋白或amhr2融合蛋白、amh中和剂或拮抗剂、多核苷酸、载体或宿主细胞在发挥拮抗或中和amh作用的用途,从而用于治疗amh信号轴异常活化相关疾病。上述发挥拮抗或中和amh作用,具体表现在:(1)拮抗amh介导的细胞生长调控作用:包括对特定细胞amh介导的细胞生长抑制作用或细胞生长促进作用等,如实施例4所述。(2)拮抗amh信号轴作用:包括抑制amh-amhr2下游信号、抑制amhr2受体异源二聚体形成等,如实施例4所述。(3)拮抗/中和amh作用:包括降低体内外amh水平等,如实施例5、6所述。(4)逆转pcos表型作用:包括改善生殖激素紊乱、改善生殖周期紊乱、减轻卵巢组织破坏、解除生育能力抑制等,如实施例5、6所述。(5)抑制amh依赖的肿瘤增殖活性,发挥抗瘤作用,如实施例7所述。因此,本发明的amhr2重组蛋白和/或amhr2融合蛋白、药物组合物、多核苷酸、载体或宿主细胞可以应用于amh信号轴异常活化相关疾病,如pcos,恶性肿瘤等。本发明的有益保障及效果:通过稳定性实验,本发明中的amhr2融合蛋白半衰期长,体内稳定性优异,且与amh结合力强,具备一定的成药性。通过细胞实验以及动物模型实验,本发明提供的amhr2重组蛋白或amhr2融合蛋白在体内外均能有效拮抗或中和amh,并能进一步阻断amh信号轴,有效预防和治疗amh异常增高引起的病症。附图说明图1为重组蛋白及融合蛋白对amh的结合能力检测具体实施方式以下实施例、实验例对本发明进行进一步的说明,不应理解为对本发明的限制。实施例不包括对传统方法的详细描述,如那些用于构建载体和质拉的方法,将编码蛋白的基因插入到这样的载体和质拉的方法或将质粒引入宿主细胞的方法.这样的方法对于本领域中具有普通技术的人员是众所周知的,并且在许多出版物中都有所描述,包括sambrook,j.,fritsch,e.f.andmaniais,t.(1989)molecularcloning:alaboratorymanual,2ndedition,coldspringharborlaboratorypress。实施例1.amhr2重组蛋白和amhr2融合蛋白的构建及表达amhr2重组蛋白和amhr2融合蛋白的构建和表达简单描述如下:(1)全基因合成的amhr2(多肽链的氨基酸序列和核苷酸序列如seqidno.1和seqidno.4所示)、amhr2-fc(多肽链的氨基酸序列和核苷酸序列如seqidno.2和seqidno.5所示)、amhr2-fc-lalapg(多肽链的氨基酸序列和核苷酸序列如seqidno.3和seqidno.6所示),分别得到amhr2重组蛋白以及两种形式的amhr2融合蛋白。(2)重组蛋白和融合蛋白的表达纯化按照文献(hus,etal.sciencetranslationalmedicine,2017,9(380):eaag0339;finckbk.science,265.;miharametal..journalofclinicalinvestigation.2000;106:91-101;yux,etal.natureimmunology.2009;10:48-57.lius,etal.clinimmunol.2019jun;203:72-80.)方法利用pcdna3.4载体和293f瞬时转染系统进行重组蛋白和融合蛋白的表达纯化。重组蛋白利用amhr2多抗琼脂糖层析柱进行纯化,融合蛋白用proteina进行纯化,最后用sds-page检测获得的蛋白,符合目的分子量大小,委托肽指纹鉴定(清华大学生物医学中心)氨基酸序列一致。实施例2.amhr2重组蛋白和amhr2融合蛋白的体内稳定性试验利用文献(hus,etal.sciencetranslationalmedicine,2017,9(380):eaag0339.)方法在nsg小鼠中评估amhr2重组蛋白和amhr2融合蛋白的半衰期。结果显示,amhr2、amhr2-fc、amhr2-fc-lalapg的体内半衰期分别为2.1天、9.6天、和9.1天;阳性对照西妥昔单抗为9.7天;阴性对照amhr2抗原肽(氨基酸序列ppnrrtcv)的半衰期太短未能测出。结果可见,amhr2具有一定的成药性,可以用于体内研究,融合蛋白amhr2-fc、amhr2-fc-lalapg具有更好地体内稳定性。实施例3.amhr2重组蛋白和/或amhr2融合蛋白结合试验利用文献(hus,etal.sciencetranslationalmedicine,2017,9(380):eaag0339.)中所述的elisa结合试验方案进行本实施例。其中amh蛋白(购自r&dsystems)铺板浓度为10μg/ml,预标记了生物素的amhr2、amhr2-fc、amhr2-fc-lalapg蛋白浓度范围为0.01-100ng/μl。孵育amh随后进行检测显色,结果如图1所示。三种蛋白具有较强的结合能力,对照抗原肽、西妥昔单抗均无结合力。实施例4.amhr2重组蛋白和amhr2融合蛋白对amh体外拮抗/中和活性1)对amh介导caski细胞生长抑制作用的影响caski细胞具有在amh介导下凋亡的性质(kimjh,etal.obstetgynecolsci.2014;57(5):343–357.)因此可以用此模型研究重组蛋白和融合蛋白是否有拮抗/中和amh的作用。将caski细胞以5000个细胞/孔的比率置于96孔板的中固定,向培养基中添加终浓度为1μg/ml的amh蛋白,各处理组同时添加终浓度为1μg/ml的amhr2、amhr2-fc、amhr2-fc-lalapg蛋白。然后继续在在37℃、5%co2下生长48小时。使用改良的mtt细胞活力测定法测量生长抑制。结果如表1,显示amhr2重组蛋白和amhr2融合蛋白均可以显著逆转由amh介导的caski细胞生长抑制作用。表1caski细胞生长%组别细胞生长%sdp值(vs.amh处理组)空白对照组(仅培养基)1008.75amh处理组16.612.35amh+amhr278.559.51p<0.05amh+amhr2-fc85.3810.51p<0.05amh+amhr2-fc-lalapg80.559.57p<0.052)对amh介导磷酸化smad作用的影响按照文献方法(beck,timn.,etal.cellreports16,no.3(2016):657-671.)分别在a549和smat1细胞中检测amhr2重组蛋白和amhr2融合蛋白(1μg/ml)在有amh蛋白(1μg/ml)处理情况下的下游信号的情况。结果如表2和表3所示,amhr2重组蛋白和amhr2融合蛋白可以显著抑制amh介导的smad信号通路激活作用表2a549细胞smad磷酸化抑制水平组别标准化smad磷酸化水平%sdp值(vs.amh处理组)空白对照组(仅培养基)1009.15amh处理组655.4878.64amh+amhr297.335.51p<0.05amh+amhr2-fc78.668.15p<0.05amh+amhr2-fc-lalapg91.058.15p<0.05表3smat1细胞smad磷酸化抑制水平组别标准化smad磷酸化水平%sdp值(vs.amh处理组)空白对照组(仅培养基)1007.16amh处理组961.25101.51amh+amhr2121.6610.55p<0.05amh+amhr2-fc98.459.11p<0.05amh+amhr2-fc-lalapg101.5710.29p<0.053)对amh介导amhr2-alk6异源二聚体影响amhr2-alk6二聚体免疫共沉淀实验参考文献(diclemente,n.,etal.molecularandcellularendocrinology211.1-2(2003):9-14.)。在转染alk6的cho细胞检测amhr2重组蛋白和amhr2融合蛋白(1μg/ml)在有无amh蛋白(1μg/ml)处理情况下amhr2-alk6二聚体的情况,结果如表4所示。结果显示,amhr2重组蛋白和amhr2融合蛋白均可以显著抑制amh介导的amhr2-alk6二聚化。表4amhr2-alk6异源二聚体水平4)对amh介导细胞生长作用的影响某些恶性肿瘤细胞自身高表达amh,amh对这类细胞具有刺激增殖作用。如文献(beck,timn.,etal.cellreports16,no.3(2016):657-671.)所述的肺癌a549和h1299细胞。将a549和h1299细胞以5000个细胞/孔的比率置于96孔板的中固定,向培养基中添加终浓度为1.0μg/ml的amh蛋白,各处理组同时添加终浓度为1.0μg/ml的amhr2、amhr2-fc、amhr2-fc-lalapg蛋白。然后继续在在37℃、5%co2下生长48小时。使用改良的mtt细胞活力测定法测量生长抑制。结果如表5和表6所示,显示amhr2重组蛋白和/或amhr2融合蛋白可以显著抑制由amh介导的细胞生长促进作用。表5a549细胞生长百分率组别细胞生长%sdp值(vs.amh处理组)空白对照组(仅培养基)1005.14amh处理组571.2565.33amh+amhr2154.3412.25p<0.05amh+amhr2-fc110.369.56p<0.05amh+amhr2-fc-lalapg133.5410.71p<0.05表6h1299细胞生长百分率组别细胞生长%sdp值(vs.amh处理组)空白对照组(仅培养基)100amh处理组457.9160.22amh+amhr296.2211.32p<0.05amh+amhr2-fc78.368.65p<0.05amh+amhr2-fc-lalapg83.5510.12p<0.05实施例5amhr2重组蛋白和amhr2融合蛋白对amh体内拮抗或中和活性和逆转amh介导的pcos表型按照文献报道[tatab,etal..naturemedicine,2018,24(6):834.]利用c57小鼠建立孕鼠amh诱导pcos模型,将孕鼠分组,每组(n=10)在孕16.5-18.5天每天均给予腹腔注射200μl溶液。对照组给予pbs溶液,amh处理组给予0.15mg/kgamh(r&dsystems,rhmis1737-ms-10),amhr2重组蛋白或amhr2融合蛋白组在amh的基础上再给予本发明所述的蛋白0.15mg/kg。在处理结束时采血检测孕鼠血液(孕19.5天),利用elisa方法检测血液中的amh、黄体生成素lh、睾酮(testosterone)、雌二醇(estradiol)、黄体酮(progesterone)水平。结果如表7-11。结果显示amhr2重组蛋白和/或amhr2融合蛋白可以显著抑制血清amh的上升,还可以逆转由amh升高诱导的激素紊乱。表7amh水平(pg/ml)表8lh水平(pg/ml)组别lh水平sdp值(vs.amh诱导组)空白对照组(pbs)151.8610.33amh诱导组499.2855.91amh+amhr2122.3521.66p<0.05amh+amhr2-fc115.6713.66p<0.05amh+amhr2-fc-lalapg118.189.85p<0.05表9睾酮水平(ng/ml)组别睾酮水平sdp值(vs.amh诱导组)空白对照组(pbs)1.350.16amh诱导组4.180.33amh+amhr21.460.21p<0.05amh+amhr2-fc1.330.11p<0.05amh+amhr2-fc-lalapg1.510.18p<0.05表10雌二醇水平(pg/ml)组别雌二醇水平sdp值(vs.amh诱导组)空白对照组(pbs)48.545.51amh诱导组10.591.33amh+amhr239.564.20p<0.05amh+amhr2-fc49.515.59p<0.05amh+amhr2-fc-lalapg42.335.15p<0.05表11黄体酮水平(pg/ml)组别黄体酮水平sdp值(vs.amh诱导组)空白对照组(pbs)113.5712.51amh诱导组35.633.88amh+amhr297.3510.11p<0.05amh+amhr2-fc110.369.55p<0.05amh+amhr2-fc-lalapg99.358.57p<0.05进一步在孕19.5天处死各组孕鼠,按照文献方法[tatab,etal..naturemedicine,2018,24(6):834.]分离获取各组孕鼠胎盘并利用实时定量pcr法检测各组胎盘组织内的cyp191a(cytochromep450family19,subfamilya,polypeptide1),hsd3b1(hydroxy-delta-5-steroiddehydrogenase,3beta-andsteroiddelta-isomerase1)基因的表达水平。cyp191a是细胞p450芳香化酶的编码基因,hsd3b1编码类固醇生成酶。结果如表12-13。这些结果显示amhr2重组蛋白和/或amhr2融合蛋白可以显著逆转由amh过度表达介导的胎盘组织类固醇生成紊乱。表12cyp191a相对表达水平表13hsd3b1相对表达水平按照上述方法重新利用c57小鼠建立孕鼠amh诱导模型,将孕鼠分组,每组(n=10)在孕16.5-18.5天每天均给予腹腔注射200μl溶液。对照组给予pbs溶液,amh处理组给予0.15mg/kgamh(r&dsystems,rhmis1737-ms-10),amhr2重组蛋白和amhr2融合蛋白组在amh的基础上再给予本发明所述的蛋白0.15mg/kg。等待各组小鼠正常分娩,待幼鼠成长后进行检测(p60-p90)。按照文献方法[tatab,etal..naturemedicine,2018,24(6):834.]对子代小鼠进行动情周期检测和卵巢组织学分析(n=10)和各组小鼠(n=11)组内配对90天的生育能力测试。结果显示,各组动情前期(proestrus,p)、动情期(estrus,e)、动情后期(metestrus,m)均无统计学差异,动情间期(diestrus,d)具有明显差异,见表14。卵巢组织分析包括各组子代小鼠卵巢黄体(corporalutea)数目、晚期窦卵泡(lateantralfollicles)数目、和闭锁性卵泡数目(atreticfollicles),结果如表15-17。生育能力包括第一次生育时间、每月生育次数(生育指数)、和每次生育胎数,结果如表18-20。这些结果显示amhr2重组蛋白和/或amhr2融合蛋白可以显著逆转由amh过度表达介导的动情周期紊乱、卵巢组织破坏和生育能力抑制。表14动情间期组别平均动情间期(天)sdp值(vs.amh诱导组)空白对照组(pbs)1.300.48amh诱导组5.800.63amh+amhr21.400.52p<0.05amh+amhr2-fc1.300.48p<0.05amh+amhr2-fc-lalapg1.500.53p<0.05表15黄体数目组别黄体数目sdp值(vs.amh诱导组)空白对照组(pbs)10.12.13amh诱导组5.50.97amh+amhr210.22.04p<0.05amh+amhr2-fc9.71.63p<0.05amh+amhr2-fc-lalapg10.41.71p<0.05表16晚期窦卵泡数目组别晚期窦卵泡数目sdp值(vs.amh诱导组)空白对照组(pbs)61.41amh诱导组20.94amh+amhr25.81.54p<0.05amh+amhr2-fc6.31.63p<0.05amh+amhr2-fc-lalapg5.61.57p<0.05表17闭锁性卵泡数目组别闭锁性卵泡数目sdp值(vs.amh诱导组)空白对照组(pbs)14.41.57amh诱导组13.91.37amh+amhr213.71.76p<0.05amh+amhr2-fc14.61.42p<0.05amh+amhr2-fc-lalapg13.81.75p<0.05表18配对后第一次生育时间(天)表19生育指数组别平均每月生育次数sdp值(vs.amh诱导组)空白对照组(pbs)1.330.30amh诱导组0.700.23amh+amhr21.300.28p<0.05amh+amhr2-fc1.330.34p<0.05amh+amhr2-fc-lalapg1.360.32p<0.05表20每次生育胎数组别每次生育胎数sdp值(vs.amh诱导组)空白对照组(pbs)11.000.89amh诱导组3.731.85amh+amhr211.091.04p<0.05amh+amhr2-fc11.451.21p<0.05amh+amhr2-fc-lalapg10.821.25p<0.05实施例6.amhr2重组蛋白和amhr2融合蛋白对逆转双氢睾酮诱导的pcos样表型按照文献方法[胡巧云,etal.现代生物医学进展12(2018):3.]建立小鼠模型和监测指标,简述如下:在孕第15.5-18.5天给予孕鼠皮下注射双氢睾酮(dihydrotestosterone,dht)诱导子代雌鼠pcos模型。待子鼠8周龄后,对pcos小鼠进行分组(n=10),对照组给予pbs溶液,amhr2重组蛋白和/或amhr2融合蛋白组给予本发明所述的蛋白0.15mg/kg。给药方式为腹腔注射,隔天一次连续处理4周。给药期间检测动情周期,结果显示,各组动情前期(proestrus,p)、动情期(estrus,e)、动情后期(metestrus,m)均无统计学差异,动情间期(diestrus,d)明显差异,见表21。待小鼠16周龄左右,通过眼球取血后处死,取出下丘脑、卵巢,采用he染色观察卵巢组织的病理改变,结果见表22-24。用elisa试剂盒检测血清中amh、雌二醇(estradiol)、睾酮(testosterone)、孕酮(progesterone,p4)、促黄体生成素(luteinizinghormone,lh),结果见表25-29;利用实时荧光定量pcr法检测下丘脑的前腹侧视旁核(anteroventralperiventricular,avpv)、弓状核(arcuate,arc)的kisspeptin以及视前区(preopticarea,poa)里gnrh的表达水平,结果如30-32。这些结果显示,这些结果显示amhr2重组蛋白和/或amhr2融合蛋白可以降低模型鼠体内amh的水平,具有拮抗/中和活性,且对pcos具有调节动情周期紊乱、减少卵巢组织破坏、改善神经元kisspeptin、gnrh的表达紊乱。表21动情间期统计表22黄体数目统计组别黄体数目sdp值(vs.阴性对照)模型对照(正常小鼠)7.600.84阴性对照组(pbs)4.300.95amhr26.800.63p<0.05amhr2-fc6.400.84p<0.05amhr2-fc-lalapg6.600.84p<0.05表23晚期窦卵泡数目统计表24闭锁性卵泡数目统计表25amh水平(pg/ml)检测组别amh水平sdp值(vs.阴性对照)模型对照(正常小鼠)155.6814.33阴性对照组(pbs)556.3643.51amhr2143.3628.64p<0.05amhr2-fc168.3615.33p<0.05amhr2-fc-lalapg151.9711.23p<0.05表26雌二醇水平(pg/ml)检测组别雌二醇水平sdp值(vs.阴性对照)模型对照(正常小鼠)51.666.31阴性对照组(pbs)15.312.15amhr240.333.25p<0.05amhr2-fc42.564.81p<0.05amhr2-fc-lalapg52.737.68p<0.05表27睾酮水平(ng/ml)检测组别睾酮水平sdp值(vs.阴性对照)模型对照(正常小鼠)2.120.21阴性对照组(pbs)8.640.93amhr23.110.28p<0.05amhr2-fc2.240.22p<0.05amhr2-fc-lalapg2.510.30p<0.05表28lh水平(ng/ml)检测组别lh水平sdp值(vs.阴性对照)模型对照(正常小鼠)1.260.11阴性对照组(pbs)4.360.26amhr21.560.21p<0.05amhr2-fc1.180.17p<0.05amhr2-fc-lalapg1.490.16p<0.05表29黄体酮水平(pg/ml)组别黄体酮水平sdp值(vs.阴性对照)模型对照(正常小鼠)16.351.89阴性对照组(pbs)8.360.8amhr215.282.51p<0.05amhr2-fc16.111.98p<0.05amhr2-fc-lalapg16.811.68p<0.05表30avpv内kisspeptin蛋白相对表达水平表31arc内kisspeptin蛋白相对表达水平表32poa内gnrh蛋白相对表达水平实施例7.amhr2重组蛋白和/或amhr2融合蛋白对amh信号依赖恶性肿瘤的抗瘤作用a549、h1299肿瘤细胞系为amh依赖型肿瘤细胞系(beck,timn.,etal.cellreports16,no.3(2016):657-671.),按照文献方法(beck,timn.,etal.cellreports16,no.3(2016):657-671.)建立荷瘤小鼠模型,在肿瘤平均体积约为100mm3时进行分组,对照组给予pbs溶液,amhr2重组蛋白和/或amhr2融合蛋白组给予本发明所述的蛋白10mg/kg。给药方式为尾静脉注射,隔天一次连续处理3周后检测各组肿瘤组织体积,结果如表33-34。处死小鼠,分离小鼠肿瘤组织体积,利用文献报道的方法利用实时定量pcr检测肿瘤组织内增殖活性标记物ki67的表达水平,结果如表35-36。这些结果显示amhr2重组蛋白或amhr2融合蛋白可以明显抑制荷瘤小鼠模型中的肿瘤生长,降低肿瘤组织增殖活性。表33a549肿瘤组织体积组别肿瘤组织体积sdp值(vs.阴性对照)阴性对照组(pbs)1050.98135.66amhr2431.6548.41p<0.05amhr2-fc258.2833.22p<0.05amhr2-fc-lalapg289.3929.62p<0.05表34h1299肿瘤组织体积表35a549肿瘤组织ki67相对表达水平组别ki67表达水平%sdp值(vs.阴性对照)阴性对照组(pbs)10014.19amhr234.694.08p<0.05amhr2-fc23.041.74p<0.05amhr2-fc-lalapg35.704.09p<0.05表36h1299肿瘤组织ki67相对表达水平组别ki67表达水平%sdp值(vs.阴性对照)阴性对照组(pbs)10010.21amhr224.841.79p<0.05amhr2-fc17.481.82p<0.05amhr2-fc-lalapg22.752.50p<0.05综上,本发明所描述的重组蛋白和融合蛋白具有显著的amh拮抗/中和作用,有利于后续的临床试验的开展。序列表<110>沣潮医药科技(上海)有限公司<120>amhr2重组蛋白或融合蛋白在制备amh信号轴异常活化相关疾病治疗药物中的用途<130>权利要求书说明书<160>6<170>siposequencelisting1.0<210>1<211>128<212>prt<213>人工序列(artificialsequence)<400>1proproasnargargthrcysvalphepheglualaproglyvalarg151015glyserthrlysthrleuglygluleuleuaspthrglythrgluleu202530proargalaileargcysleutyrserargcyscyspheglyiletrp354045asnleuthrglnaspargalaglnvalglumetglnglycysargasp505560seraspgluproglycysgluserleuhiscysaspproserproarg65707580alahisproserproglyserthrleuphethrcyssercysglythr859095aspphecysasnalaasntyrserhisleuproproproglyserpro100105110glythrproglyserglnglyproglnalaalaproglygluserile115120125<210>2<211>360<212>prt<213>人工序列(artificialsequence)<400>2proproasnargargthrcysvalphepheglualaproglyvalarg151015glyserthrlysthrleuglygluleuleuaspthrglythrgluleu202530proargalaileargcysleutyrserargcyscyspheglyiletrp354045asnleuthrglnaspargalaglnvalglumetglnglycysargasp505560seraspgluproglycysgluserleuhiscysaspproserproarg65707580alahisproserproglyserthrleuphethrcyssercysglythr859095aspphecysasnalaasntyrserhisleuproproproglyserpro100105110glythrproglyserglnglyproglnalaalaproglygluserile115120125gluprolyssercysasplysthrhisthrcysproprocysproala130135140progluleuleuglyglyproservalpheleupheproprolyspro145150155160lysaspthrleumetileserargthrprogluvalthrcysvalval165170175valaspvalserhisgluaspprogluvallyspheasntrptyrval180185190aspglyvalgluvalhisasnalalysthrlysproarggluglugln195200205tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln210215220asptrpleuasnglylysglutyrlyscyslysvalserasnlysala225230235240leuproalaproileglulysthrileserlysalalysglyglnpro245250255arggluproglnvaltyrthrleuproproserargaspgluleuthr260265270lysasnglnvalserleuthrcysleuvallysglyphetyrproser275280285aspilealavalglutrpgluserasnglyglnprogluasnasntyr290295300lysthrthrproprovalleuaspseraspglyserphepheleutyr305310315320serlysleuthrvalasplysserargtrpglnglnglyasnvalphe325330335sercysservalmethisglualaleuhisasnhistyrthrglnlys340345350serleuserleuserproglylys355360<210>3<211>360<212>prt<213>人工序列(artificialsequence)<400>3proproasnargargthrcysvalphepheglualaproglyvalarg151015glyserthrlysthrleuglygluleuleuaspthrglythrgluleu202530proargalaileargcysleutyrserargcyscyspheglyiletrp354045asnleuthrglnaspargalaglnvalglumetglnglycysargasp505560seraspgluproglycysgluserleuhiscysaspproserproarg65707580alahisproserproglyserthrleuphethrcyssercysglythr859095aspphecysasnalaasntyrserhisleuproproproglyserpro100105110glythrproglyserglnglyproglnalaalaproglygluserile115120125gluprolyssercysasplysthrhisthrcysproprocysproala130135140proglualaalaglyglyproservalpheleupheproprolyspro145150155160lysaspthrleumetileserargthrprogluvalthrcysvalval165170175valaspvalserhisgluaspprogluvallyspheasntrptyrval180185190aspglyvalgluvalhisasnalalysthrlysproarggluglugln195200205tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln210215220asptrpleuasnglylysglutyrlyscyslysvalserasnlysala225230235240leuglyalaproileglulysthrileserlysalalysglyglnpro245250255arggluproglnvaltyrthrleuproproserargaspgluleuthr260265270lysasnglnvalserleuthrcysleuvallysglyphetyrproser275280285aspilealavalglutrpgluserasnglyglnprogluasnasntyr290295300lysthrthrproprovalleuaspseraspglyserphepheleutyr305310315320serlysleuthrvalasplysserargtrpglnglnglyasnvalphe325330335sercysservalmethisglualaleuhisasnhistyrthrglnlys340345350serleuserleuserproglylys355360<210>4<211>384<212>dna<213>人工序列(artificialsequence)<400>4ccccccaacagaagaacctgcgtgttcttcgaggcccccggcgtgagaggcagcaccaag60accctgggcgagctgctggacaccggcaccgagctgcccagagccatcagatgcctgtac120agcagatgctgcttcggcatctggaacctgacccaggacagagcccaggtggagatgcag180ggctgcagagacagcgacgagcccggctgcgagagcctgcactgcgaccccagccccaga240gcccaccccagccccggcagcaccctgttcacctgcagctgcggcaccgacttctgcaac300gccaactacagccacctgcccccccccggcagccccggcacccccggcagccagggcccc360caggccgcccccggcgagagcatc384<210>5<211>1080<212>dna<213>人工序列(artificialsequence)<400>5ccccccaacagaagaacctgcgtgttcttcgaggcccccggcgtgagaggcagcaccaag60accctgggcgagctgctggacaccggcaccgagctgcccagagccatcagatgcctgtac120agcagatgctgcttcggcatctggaacctgacccaggacagagcccaggtggagatgcag180ggctgcagagacagcgacgagcccggctgcgagagcctgcactgcgaccccagccccaga240gcccaccccagccccggcagcaccctgttcacctgcagctgcggcaccgacttctgcaac300gccaactacagccacctgcccccccccggcagccccggcacccccggcagccagggcccc360caggccgcccccggcgagagcatcgagcccaagagctgcgacaagacccacacctgcccc420ccctgccccgcccccgagctgctgggcggccccagcgtgttcctgttcccccccaagccc480aaggacaccctgatgatcagcagaacccccgaggtgacctgcgtggtggtggacgtgagc540cacgaggaccccgaggtgaagttcaactggtacgtggacggcgtggaggtgcacaacgcc600aagaccaagcccagagaggagcagtacaacagcacctacagagtggtgagcgtgctgacc660gtgctgcaccaggactggctgaacggcaaggagtacaagtgcaaggtgagcaacaaggcc720ctgcccgcccccatcgagaagaccatcagcaaggccaagggccagcccagagagccccag780gtgtacaccctgccccccagcagagacgagctgaccaagaaccaggtgagcctgacctgc840ctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcaacggccagccc900gagaacaactacaagaccaccccccccgtgctggacagcgacggcagcttcttcctgtac960agcaagctgaccgtggacaagagcagatggcagcagggcaacgtgttcagctgcagcgtg1020atgcacgaggccctgcacaaccactacacccagaagagcctgagcctgagccccggcaag1080<210>6<211>1080<212>dna<213>人工序列(artificialsequence)<400>6ccccccaacagaagaacctgcgtgttcttcgaggcccccggcgtgagaggcagcaccaag60accctgggcgagctgctggacaccggcaccgagctgcccagagccatcagatgcctgtac120agcagatgctgcttcggcatctggaacctgacccaggacagagcccaggtggagatgcag180ggctgcagagacagcgacgagcccggctgcgagagcctgcactgcgaccccagccccaga240gcccaccccagccccggcagcaccctgttcacctgcagctgcggcaccgacttctgcaac300gccaactacagccacctgcccccccccggcagccccggcacccccggcagccagggcccc360caggccgcccccggcgagagcatcgagcccaagagctgcgacaagacccacacctgcccc420ccctgccccgcccccgaggccgccggcggccccagcgtgttcctgttcccccccaagccc480aaggacaccctgatgatcagcagaacccccgaggtgacctgcgtggtggtggacgtgagc540cacgaggaccccgaggtgaagttcaactggtacgtggacggcgtggaggtgcacaacgcc600aagaccaagcccagagaggagcagtacaacagcacctacagagtggtgagcgtgctgacc660gtgctgcaccaggactggctgaacggcaaggagtacaagtgcaaggtgagcaacaaggcc720ctgggcgcccccatcgagaagaccatcagcaaggccaagggccagcccagagagccccag780gtgtacaccctgccccccagcagagacgagctgaccaagaaccaggtgagcctgacctgc840ctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcaacggccagccc900gagaacaactacaagaccaccccccccgtgctggacagcgacggcagcttcttcctgtac960agcaagctgaccgtggacaagagcagatggcagcagggcaacgtgttcagctgcagcgtg1020atgcacgaggccctgcacaaccactacacccagaagagcctgagcctgagccccggcaag1080当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1