一种具有生物活性的人工血管支架、其制备方法及其用途与流程
1.本发明涉及一种具有生物活性的人工血管支架、其制备方法及其用途,属于医用植入材料领域。
背景技术:
2.脑血管病已成为人类致残致死率第一位的疾病,颅内外血管搭桥手术是治疗烟雾病、颅内复杂动脉瘤及缺血性脑血管病等疾病的重要外科治疗手段之一。目前常用于颅内外血管搭桥手术的血管主要为自体血管、异体血管及传统的人工血管。但是,无论是自体血管,或者是异体血管,还是传统的人工血管,均存在一定的缺陷。
3.一方面,自体血管为截取患者自体临近病变区域或远隔部位的血管获得的,为目前临床手术最常用的来源,其手术时间长、创伤大,可导致桥血管供血区的副损伤,且自体血管的来源有限,无法多次取材,若移植血管在截取过程中如果受到损害则可导致移植血管无法使用,甚至手术失败;另外,疾病状态下可能因一些全身性的因素而导致截取的自体血管质量不高,使其使用范围大大受限。另一方面,异体血管移植则存在免疫排斥问题。与此同时,传统的人工血管主要为涤纶或不可降解的高分子材料所制作,这类人工血管缺乏生物活性,且需要患者长期服用抗凝药物以防止血栓形成,同时一般人工血管的顺应性较差,且可能出现异体组织移植的免疫排斥反应,尤其是小口径的人工血管在移植时容易发生急性血栓或吻合口处内膜增生,导致管腔狭窄甚至闭塞,这大大限制了其在脑血管疾病中的临床应用。
4.发明人通过查阅文献及预实验探索发现,专利申请文件cn105999415a提供了一种跨尺度血管及其3d打印方法。该跨尺度血管自内至外依次包括:内衬层,以中空纤维形式螺旋卷绕而成的内管壁,以中空纤维形式螺旋卷绕而成的外管壁。但是,该跨尺度血管的构建过程复杂,且机械强度较低,内衬细胞分布不均。
5.与此同时,有研究者利用四通道同轴技术制作实心的多层次结构(图1),但其实心结构不能用于血液运输及血管移植(he j,shao j,li x,et al.bioprinting of coaxial multicellular structures for a 3d co-culture model[j].bioprinting,2018,11);进一步的,也有研究者利用三通道同轴技术制作空心的多层次血管结构,最内层为中空,外两层分别注以两种打印细胞混合支撑材料的生物墨汁(图2),但此方法不能实现将打印细胞与非细胞支撑材料分隔的效果,容易引起生物活性血管内细胞生长繁殖不良的后果(qingmeng p,sushila m,xiang y,et al.digitally tunable microfluidic bioprinting of multilayered cannular tissues[j].advanced materials,2018:1706913)。
技术实现要素:
[0006]
发明要解决的问题
[0007]
基于现有技术中存在的缺陷,本发明提供一种可供移植的生物活性血管、前述血
管的制备方法和前述血管的用途。
[0008]
用于解决问题的方案
[0009]
本发明提供了如下技术方案。
[0010]
(1)一种具有生物活性的人工血管支架,其包括内层、外层、第一中间层和第二中间层,其中,所述内层为形成于所述第一中间层的内侧的具有中空结构的柱形体;所述外层为第一支撑材料层,其形成所述人工血管支架的外表面;所述第一中间层为第二支撑材料层;所述第二中间层为混合细胞层,并且所述混合细胞层形成于所述第一中间层和所述外层之间;并且所述第一支撑材料层和所述第二支撑材料层均不含有细胞。
[0011]
(2)根据(1)所述的具有生物活性的人工血管支架,其中,所述第一支撑材料层和/或第二支撑材料层的材料源自于可降解的天然高分子聚合物或者合成高分子聚合物;可选的,所述材料包括选自聚丙烯腈、聚乙二醇、聚己内酯、聚乳酸、聚酰亚胺、聚乙烯醇、明胶、海藻酸钠、透明质酸、壳聚糖、丝素蛋白、纤维蛋白、胶原蛋白、普朗尼克酸中的一种或两种以上的组合。
[0012]
(3)根据(1)-(2)任一项所述的具有生物活性的人工血管支架,其中,所述内层的直径为0.30-0.55mm;所述外层的厚度为200-725μm;所述第一中间层的厚度为155-480μm;和/或所述第二中间层的厚度为45-470μm。
[0013]
(4)根据(1)-(3)任一项所述的具有生物活性的人工血管支架,其中,所述混合细胞层中含有内皮细胞,平滑肌细胞和成纤维细胞;可选的,以数量计,所述内皮细胞,平滑肌细胞和成纤维细胞的含量的比值为(3.9-4.1):1:(4.9-5.1)。
[0014]
(5)一种根据(1)-(4)任一项所述的具有生物活性的人工血管支架的制备方法,其包括将内层、外层、第一中间层和第二中间层复合成型的步骤。
[0015]
(6)根据(5)所述的具有生物活性的人工血管支架的制备方法,其包括以下步骤:
[0016]
成型步骤:配制能够和可降解的天然高分子聚合物或者合成高分子聚合物交联的交联溶液,可降解的天然高分子聚合物溶液,混合细胞溶液,利用生物打印技术,使得所述交联溶液通过内层通道,所述混合细胞溶液通过第二中间层通道,所述可降解的天然高分子聚合物溶液通过外层通道和第一中间层通道,进而获得成型体。
[0017]
(7)根据(5)-(6)任一项所述的具有生物活性的人工血管支架的制备方法,其中,所述混合细胞溶液中包含有内皮细胞,平滑肌细胞和成纤维细胞,其中,所述内皮细胞的含量为(1.9-2.1)x107个/ml;所述平滑肌细胞的含量为(0.4-0.6)x107个/ml;和/或所述成纤维细胞的含量为(2.4-2.6)x107个/ml。
[0018]
(8)根据(5)-(7)任一项所述的具有生物活性的人工血管支架的制备方法,其中,所述生物打印技术为3d同轴打印技术,使得所述人工血管支架中的所述内层、所述外层、所述第一中间层和所述第二中间层同时形成。
[0019]
(9)根据(5)-(8)任一项所述的具有生物活性的人工血管支架的制备方法,其中,所述交联溶液为含钙离子的溶液;优选的,所述交联溶液为氯化钙溶液。
[0020]
(10)根据(6)-(9)任一项所述的具有生物活性的人工血管支架的制备方法,其中,所述制备方法还包括:将通过生物打印技术得到的所述成型体置于含所述交联溶液中进行交联的步骤;其中,所述交联溶液为含钙离子的溶液。
[0021]
(11)根据(6)-(10)任一项所述的具有生物活性的人工血管支架的制备方法,其
中,所述制备方法还包括:将所述成型体进一步进行体外培养的步骤。
[0022]
(12)一种根据(1)-(4)任一项所述的具有生物活性的人工血管支架或者(5)-(11)任一项所述的具有生物活性的人工血管支架的制备方法制备得到的人工血管支架在制备血管修复制品或制备血管修复动物模型中的应用。
[0023]
发明的效果
[0024]
在一个实施方式中,本发明的人工血管中的多种细胞分布均匀,并且多种细胞之间均保留了良好的细胞间连接性能,且具有良好的机械性能。
[0025]
在另一个实施方式中,本发明的人工血管支架与真实血管相比,具有相仿的解剖学结构。另外,本发明的人工血管支架的生物相容性好,具有优良的生物活性,并且机械强度优异。
[0026]
在另一个实施方式中,本发明的人工血管支架的制备方法,其原料易于获取,且制备方法简单易行,且能够大批量生产。
[0027]
本发明为移植桥血管的获取和制备提供了新的方法和思路,为临床生物活性血管获取及手术移植提供实验基础与理论依据,具有十分重要的临床应用基础研究价值和社会经济效益。
附图说明
[0028]
图1示出了现有技术中利用四通道同轴3d打印技术制作的实心多层次结构;
[0029]
图2示出了利用三通道同轴3d打印技术制作的中空多层次结构;
[0030]
图3示出了本发明的多通道(四层)同轴技术模式图;
[0031]
图4示出了本发明四层同轴打印针头的外观(a,b)和横截面观(c)图;
[0032]
图5示出了本发明多通道同轴3d生物打印的实验装置;
[0033]
图6示出了本发明通过多通道同轴3d生物打印的生物墨汁打印细胞,大鼠脑血管ec(a),smc(b)和fb细胞(c)图;
[0034]
图7示出了本发明的四层同轴打印模式图;
[0035]
图8示出了本发明细胞打印后第1天的多通道同轴3d打印生物活性血管纵om切面图;
[0036]
图9示出了本发明打印后第1天的多通道同轴3d打印生物活性血管纵切面模式图;
[0037]
图10示出了本发明打印后第1天的多通道同轴3d打印生物活性血管横截面模式图;
[0038]
图11示出了本发明采用的灌注培养系统图;
[0039]
图12示出了本发明打印后第1天的多通道同轴3d打印生物活性血管大体外观图;
[0040]
图13示出了本发明打印后即刻的多通道同轴3d打印生物活性血管大体外观(a,b)及横截面观(c)图;
[0041]
图14示出了本发明多通道同轴3d打印生物活性血管om纵切面观测图;
[0042]
图15示出了本发明打印第6天的mcss及其之间的细胞间连接om观测图;
[0043]
图16示出了本发明打印后第1天的多通道同轴3d打印生物活性血管sem观测图;
[0044]
图17示出了本发明打印后第1天的多通道同轴3d打印生物活性血管he染色横截面观图;
[0045]
图18示出了本发明打印后第7天的mcss he染色结果;
[0046]
图19示出了本发明打印后第7天的mcss sirius red染色结果;
[0047]
图20示出了本发明打印后第1天的多通道同轴3d打印生物活性血管if染色结果;
[0048]
图21示出了本发明打印后第3天的mcss和其之间的细胞间连接if染色结果;
[0049]
图22示出了本发明打印后第7天的mcss ihc染色结果;
[0050]
图23示出了本发明打印后第1d的多通道同轴3d打印生物活性血管calcein-am/pi活细胞/死细胞双染实验结果;
[0051]
图24示出了本发明多通道同轴3d打印生物活性血管壁内细胞存活率;
[0052]
图25示出了本发明多通道同轴3d打印生物活性血管拉伸的应力-应变图;
[0053]
图26示出了本发明通道同轴3d打印生物活性血管的力学性能指标;
[0054]
图27示出了本发明多通道同轴3d打印生物活性血管的大鼠腹主动脉移植模型模式图。
具体实施方式
[0055]
以下将详细说明本发明的各种示例性实施例、特征和方面。在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
[0056]
另外,为了更好地说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在另外一些实例中,对于本领域技术人员熟知的方法、手段、器材和步骤未作详细描述,以便于凸显本发明的主旨。
[0057]
如无特殊声明,本发明所使用的单位均为国际标准单位,并且本发明中出现的数值,数值范围,均应当理解为包含了工业生产中所不可避免的系统性误差。
[0058]
本发明所述“数值a~数值b”表示的数值范围是指包含端点数值a、b的范围。
[0059]
本发明所述如没有特别说明,则“%”均表示质量百分含量。
[0060]
本发明所述“可以”或“可”表示的含义包括了进行某种处理以及不进行某种处理两方面的含义。
[0061]
本发明所述“可选的”或“可选地”是指接下来描述的事件或情况可发生或可不发生,并且该描述包括该事件发生的情况和该事件不发生的情况。
[0062]
本发明所述“质量体积比”,又称“质量浓度”,其含义是溶质的质量与所形成的溶液的体积之比。
[0063]
本发明中所述的“交联”与“交联改性”具有相同或相似的含义,在“交联”的过程中,可以附带有“改性”的一些特点,本发明中为了简便,可以使用“交联”代替“交联改性”。
[0064]
第一实施方式
[0065]
本发明的第一实施方式提供了一种具有生物活性的人工血管支架,其包括内层、外层、第一中间层和第二中间层,其中,
[0066]
所述内层为形成于所述第一中间层的内侧的具有中空结构的柱形体;
[0067]
所述外层为第一支撑材料层,其形成所述人工血管支架的外表面;
[0068]
所述第一中间层为第二支撑材料层;并且
[0069]
所述第二中间层为混合细胞层,并且所述混合细胞层形成于所述第一中间层和所述外层之间;
[0070]
其中,所述第一支撑材料层和所述第二支撑材料层中均不含有细胞。
[0071]
<支撑材料层>
[0072]
本发明的支撑材料层的材料可以选自高分子聚合物或其衍生物中的一种或两种以上的组合,可以包括合成高分子聚合物和/或天然高分子聚合物。由于本申请的支撑材料层将作为血管支架的组成部分,因此,前述合成高分子聚合物和/或天然高分子聚合物均为体内可降解的材料。
[0073]
在一个具体的实施方式中,本发明的所述第一支撑材料层和第二支撑材料层的材料相同或者不同。
[0074]
在一个具体的实施方式中,合成高分子聚合物可以是聚丙烯腈、聚乙二醇、聚己内酯、聚乳酸、聚酰亚胺、聚乙烯醇等。天然高分子聚合物包括:明胶、海藻酸钠、透明质酸、壳聚糖、丝素蛋白等。
[0075]
在另一个具体的实施方式中,本发明支撑材料层的材料选自海藻酸钠。
[0076]
在一个实施方式中,本发明的支撑材料层包括第一支撑材料层和第二支撑材料层,前述第一支撑材料层和第二支撑材料层的材料可以相同或者不同。
[0077]
在一个具体的实施方式中,前述第一支撑材料层和第二支撑材料层的材料相同。
[0078]
在一个实施方式中,本发明的第一支撑材料层和/或第二支撑材料层经过交联处理。
[0079]
在一个具体的实施方式中,利用含钙离子的溶液进行所述交联处理。
[0080]
由于海藻酸钠是从褐藻类的海带或马尾藻中提取碘和甘露醇之后的副产物,其分子由β-d-甘露糖醛酸(β-d-mannuronic,m)和α-l-古洛糖醛酸(α-l-guluronic,g)按(1
→
4)键连接而成。海藻酸钠的水溶液具有较高的黏度,且无毒。海藻酸钠可以在极其温和的条件下快速形成凝胶。海藻酸钠与多价阳离子结合能力的顺序依次为pb
2+
>cu
2+
>cd
2+
>ba
2+
>sr
2+
>ca
2+
>co
2+
>ni
2+
>zn
2+
>mn
2+
,当有ca
2+
、sr
2+
等阳离子存在时,g单元上的na
+
与二价阳离子发生离子交换反应,g单元堆积形成交联网络结构,从而形成水凝胶。海藻酸钠形成水凝胶的条件温和,这可以避免敏感性药物、蛋白质、细胞和酶等活性物质的失活。
[0081]
在本发明中,当高分子材料为海藻酸钠溶液时,所述溶液可以为任何能够使海藻酸钠形成凝胶的溶液,例如上述pb
2+
、cu
2+
、cd
2+
、ba
2+
、sr
2+
、ca
2+
等多价阳离子溶液,但考虑到离子的生物毒性和螯合能力,当选用海藻酸钠作为高分子材料时,优选所述溶液为ca
2+
溶液。
[0082]
在一个实施方式中,所述混合细胞层中含有内皮细胞,平滑肌细胞和成纤维细胞。
[0083]
在一个具体的实施方式中,以数量计,所述内皮细胞,平滑肌细胞和成纤维细胞的含量的比值为(3.9-4.1):1:(4.9-5.1)。
[0084]
在一个实施方式中,所述混合细胞层中进一步含有能够培养所述混合细胞层中的细胞的培养液。
[0085]
第二实施方式
[0086]
本发明的第二实施方式提供了一种第一实施方式的人工血管支架的制备方法,其包括将内层、外层、第一中间层和第二中间层复合成型的步骤。
[0087]
在一个具体的实施方式中,所述方法包括成型步骤。具体的,通过配制能够和可降解的天然高分子聚合物或者合成高分子聚合物交联的交联溶液,可降解的天然高分子聚合物溶液,混合细胞溶液,利用生物打印技术,使得所述交联溶液通过内层通道,所述混合细胞溶液通过第二中间层通道,所述可降解的天然高分子聚合物溶液通过外层通道和第一中间层通道,进而获得成型体。
[0088]
在一个实施方式中,以多通道的同轴针头作为打印工具,进行3d打印。
[0089]
示例性的,所述打印工具的通道数为四通道。
[0090]
在一个具体的实施方式中,多通道的最内层可从针头主体上分离。四个装有对应的打印初始材料的容器,分别由一条连接管连接同轴打印针头的四个通道,并精确控制四个通道的打印速度。
[0091]
在一个具体的实施方式中,四层同轴针头由内至外的管壁的厚度依次减小。
[0092]
示例性的,在四通道的同轴打印工具中,四层同轴针头由内至外的管壁规格分别为24g-18g-15g-12g,即内外径分别如下:管壁1:0.30mm,0.55mm;管壁2:0.86mm,1.26mm;管壁3:1.35mm,1.80mm;管壁4:2.20mm,2.80mm。通道由内至外分别对应由上到下,且通道1可从针头主体上分离。
[0093]
在一个具体的实施方式中,四层同轴针头由内至外的打印速度依次增加。
[0094]
示例性的,四层同轴针头由内至外的打印速度分别为2-8-15-20ml/h,由内至外开始启动注射泵开始打印。
[0095]
在一个实施方式中,所述方法中使用的交联溶液为可以和可降解的天然高分子聚合物或者合成高分子聚合物发生交联的交联溶液。
[0096]
在一个实施方式中,所述方法还包括将通过生物打印技术得到的所述成型体置于可以和可降解的天然高分子聚合物或者合成高分子聚合物发生交联的交联溶液中进行交联的步骤。
[0097]
示例性的,所述交联溶液为含钙离子的溶液。示例性的,所述含钙离子的溶液优选为氯化钙溶液。
[0098]
在一个实施方式中,所述制备方法还还包括:将所述成型体进一步进行体外培养的步骤。示例性的,通过灌注培养系统对所述成型体进行进一步的培养。
[0099]
第三实施方式
[0100]
本发明的第三实施方式提供了一种根据本发明第一实施方式的人工血管支架和根据本发明第二实施方式的人工血管支架的制备方法得到的人工血管支架在制备血管修复制品或制备血管修复动物模型中的应用。
[0101]
实施例
[0102]
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0103]
实施例1:多通道同轴3d打印生物活性血管制作及培养方法
[0104]
(1)打印器械:
[0105]
①
打印针头:
alg水凝胶;第3层(第二中间层):混合细胞;第4层(外层):ca-alg水凝胶。
[0121]
(3)打印方法:
[0122]
①
按图5和图7所示安装好打印装置——将交联材料置于1000ml烧杯中;
[0123]
②
将四层同轴针头固定于铁架台的十字架上,打印针头针面放置在交联溶液液面下2mm处;
[0124]
③
由内至外即从上到下四个通道分别装有交联溶液,3%na-alg溶液,4:1:5比例的大鼠脑血管ec、smc、fb及其培养液混合体,3%na-alg溶液;
[0125]
④
分别以连接管连接四个通道至10ml注射器,各注射器由注射泵精确控制泵速;
[0126]
⑤
选择四条通道由内至外打印速度分别为2-8-15-20ml/h(图7),由内至外开始启动注射泵开始打印;
[0127]
⑥
选择实验操作环境温度28℃,同时空气湿度为60%,打印时间约30min,可获得长度1m左右的多通道同轴3d打印生物活性血管置于烧杯中的交联液中;
[0128]
⑦
保证其无菌性移至4℃环境中交联10分钟,使na-alg与ca
2+
交联成坚韧的ca-alg水凝胶。如说明书图8-10所示,最终形成“中空(第1层,内层)-ca-alg水凝胶(第2层,第一中间层)-混合细胞(第3层,第二中间层)-ca-alg水凝胶(第4层,外层)”结构多通道同轴3d打印生物活性血管。
[0129]
(4)通过灌流培养系统培养生物活性血管的方法:
[0130]
我们将打印、交联后得到的多通道同轴3d打印生物活性血管截成每段20mm左右长度,将其置于广州迈普再生医学科技股份有限公司研制的动态灌注培养系统bf-x1(如说明书图11所示)的灌流培养瓶中,灌流速度设置为2ml/min,灌流方向与血管纵轴平行,再将整个灌流培养系统置于37℃、5%co2培养箱中,连续培养7天。此培养方法可模拟体内血流动力环境,可将多通道同轴3d打印生物活性血管可进行体外培养。
[0131]
经过体外培养一段时间后,测试经过不同培养时间的血管性能,进而挑选最佳时间点的血管进行生物体移植。
[0132]
实施例2:多通道同轴3d打印生物活性血管性能检测
[0133]
如无相反说明,实施例2中提及的多通道同轴3d打印生物活性血管,均为通过实施例1所记载的方式得到的多通道同轴3d打印生物活性血管。
[0134]
①
大体观察
[0135]
对打印后即刻及打印后第1天的多通道同轴3d打印生物活性血管进行大体观察(参见说明书图12,图13),其横截面可以区分“中空(第1层)-alg水凝胶(第2层)-混合细胞(第3层)-alg水凝胶(第4层)”结构(参见说明书图13的c部分)。
[0136]
②
光学显微镜(om)观察
[0137]
1>多通道同轴3d打印生物活性血管om观察
[0138]
对打印后7天内的多通道同轴3d打印生物活性血管进行om(日本nikon公司,eclipse ti2-u)观察,纵切面观可以区分“中空(第1层)-alg水凝胶(第2层)-混合细胞(第3层)-alg水凝胶(第4层)”结构(参见说明书图9,图10,图11),且此种结构可在灌流系统培养7天内保持基本稳定(参见说明书图14)。
[0139]
与此同时,从打印后第2天开始,大鼠脑血管ec、smc和fb三种细胞在血管壁内自动聚集形成圆形的mcss(multicellular spheroids细胞微球,参见说明书图14和图15的a部
分),并在其之间形成细胞间连接(参见说明书图14和图15的b部分)。
[0140]
2>mcss om观察
[0141]
对mcss和细胞间连接进行om观察,mcss和细胞间连接的数量和大小可随着时间的增长而增加(参见说明书图14);且随着时间的增长,mcss有倾向两侧的第2层与第4层alg水凝胶的趋势(参见说明书图15的c部分)。
[0142]
③
扫描电子显微镜(sem)观察
[0143]
对打印后第1d的多通道同轴3d打印生物活性血管进行sem(美国fei公司,nova nanosem430)观察,横截面、外侧面整体形态结构可辨(参见说明书图16的a部分和b部分),并且可以观察到嵌插入水凝胶中的细胞(参见说明书图16的c部分和d部分)。
[0144]
④
he染色
[0145]
1>多通道同轴3d打印生物活性血管进行苏木精-伊红染色(he染色)
[0146]
对打印后第1天的多通道同轴3d打印生物活性血管进行he染色观察(he染料:武汉谷歌生物科技公司,g1005),横截面可以区分“中空(第1层)alg水凝胶(第2层)-混合细胞(第3层)-alg水凝胶(第4层)”结构(参见说明书图17)。
[0147]
2>mcss he染色
[0148]
对打印后第7天的多通道同轴3d打印生物活性血管壁中获取的mcss进行he染色(参见说明书图18),显示细胞聚集成球形。
[0149]
⑤
天狼星红(sirius red)染色
[0150]
对打印后第7天的多通道同轴3d打印生物活性血管壁中获取的mcss进行sirius red染色(参见说明书图19)(servicebio公司,g1018)。显示mcss分泌的其内广泛分布的大量可促进mcss内细胞生长的ecm胶原蛋白被染成红色。
[0151]
⑥
免疫荧光(if)染色
[0152]
1>多通道同轴3d打印生物活性血管if染色
[0153]
对打印后第1天的多通道同轴3d打印生物活性血管进行细胞分类实验的if染色观察。第1组以绿色荧光(celltracker green cmfda,invitrogen公司,c7025)标记ec,以红色荧光(celltracker red cmtpx,invitrogen公司,c34552)标记smc(参见说明书图20的a部分-c部分);第2组以绿色荧光标记fb,以红色荧光标记smc(参见说明书图20的d部分-f部分)。
[0154]
结果显示,两组实验中绿色荧光与红色荧光在血管壁内均为均匀分布,提示打印后第1天的多通道同轴3d打印生物活性血管壁内第三层(即第二中间层)中,三种细胞均匀分布。
[0155]
2>mcss if染色
[0156]
对打印后第3天的多通道同轴3d打印生物活性血管壁中的mcss和细胞间连接进行细胞分类实验的if染色观察(参见说明书图21)。第1组以绿色荧光标记ec,红色荧光标记smc(参见说明书图21的a部分-b部分);第2组以绿色荧光标记ec,红色荧光标记fb(参见说明书图21的c部分)。
[0157]
结果显示,两组实验中绿色荧光与红色荧光在mcss内均为均匀分布,且说明书图21的a部分中细胞间连接显示绿色荧光(ec),说明书图21的b部分中细胞间连接显示红色荧光(smc),说明书图21的c部分中细胞间连接显示红色荧光(fb)。提示打印后第3天的多通道
同轴3d打印生物活性血管壁中的mcss中三种细胞均匀分布,且三种细胞均可形成细胞间连接。
[0158]
⑦
免疫组织化学(ihc)染色
[0159]
对打印后第7天的多通道同轴3d打印生物活性血管壁中获取的mcss进行细胞分类实验的ihc染色观察(参见说明书图22)。
[0160]
结果显示,cd31(servicebio公司,gb12063)阳性血管ec(参见说明书图22的a部分)和desmin(servicebio公司,gb11081)阳性的smc(参见说明书图22的b部分)在mcss内均匀分布,提示打印后第7天的多通道同轴3d打印生物活性血管壁中的mcss中三种细胞均匀分布。
[0161]
结合细胞分类实验的if与ihc染色的结果,提示在生物打印后7天内,三种细胞在血管壁内及mcss中均匀分布,且三种细胞均可形成细胞间连接。
[0162]
⑧
calcein-am/pi活细胞/死细胞双染实验
[0163]
对打印后7天内的多通道同轴3d打印生物活性血管进行calcein-am/pi(江苏凯基公司,kgaf001)活细胞/死细胞双染实验(参见说明书图23),活细胞显示绿色荧光(参见说明书图23的b部分),死细胞显示红色荧光(参见说明书图23的c部分)。
[0164]
进一步的,由于“image j”软件可分别计算不同颜色荧光的面积,因此,以绿色荧光面积除以绿色荧光加红色荧光面积总和计算大致的细胞存活率,并进行统计分析。
[0165]
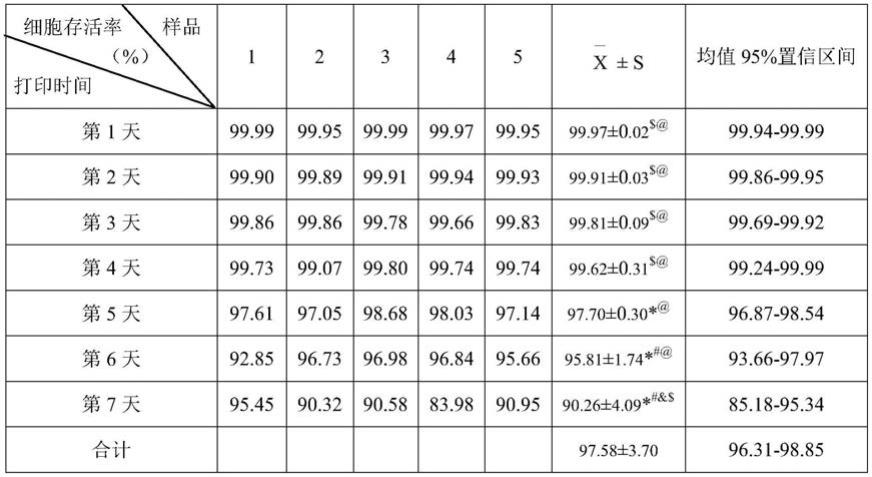
统计分析结果如表1及说明书图24所示,其中表1中不同字符的含义如下:
[0166]
*所示的是,与打印后第1天时相比,p<0.05;
[0167]
#所示的是,与生物打印后第2、3、4天时相比,p<0.05;
[0168]
&所示的是,与打印后第5天时相比,p<0.05;
[0169]
$所示的是,与打印后第6天时相比,p<0.05;
[0170]
@所示的是,与打印后第7天时相比,p<0.05。
[0171]
表1.多通道同轴3d打印生物活性血管壁内细胞存活率
[0172][0173]
从上述结果来看,打印后7天内每天分别检测的5个随机样本共35个样品的细胞存活率为83.98%-99.99%,表明经过此种采用多通道(四层)同轴3d打印技术制作出的中空
结构大鼠生物活性血管的细胞活力在生物打印后7天内保持较高水平。打印后7天内细胞存活率均值为97.58%,标准差为3.70%,均值的95%置信区间为96.31-98.85%。随着时间的推移,细胞存活率的均值有所降低、标准差有所增加,即细胞存活率差异性变大。
[0174]
与此同时,在折线图(说明书图24)中,从第4天开始,细胞存活率均值有明显下降的转折点,下降趋势越来越大。打印后第5天的细胞存活率即开始与第1天相比有明显下降(p<0.05)。
[0175]
⑨
力学性能检测
[0176]
对打印后7天内的多通道同轴3d打印生物活性血管进行拉伸的力学性能测试。以万能力学测试机测量了其拉伸的应力-应变数据,并通过“origin”软件绘制了应力-应变图像(参见说明书图25)。
[0177]
其中,弹性模量,抗拉强度和断裂伸长率的力学性能计算如表2、3、4及说明书图26所示。
[0178]
在表2-4中,不同字符所表示的含义如下:
[0179]
*所示的是,与打印后第1天时相比p<0.05;
[0180]
#所示的是,与打印后第2天时相比p<0.05;
[0181]
&所示的是,与打印后第3天时相比p<0.05;
[0182]
$所示的是,与打印后第4天时相比p<0.05;
[0183]
@所示的是,与打印后第5天时相比p<0.05;
[0184]
※
所示的是,与打印后第6天时相比p<0.05;
[0185]
☆
所示的是,与打印后第7天时相比p<0.05。
[0186]
表2.多通道同轴3d打印生物活性血管弹性模量测定
[0187][0188]
表3.多通道同轴3d打印生物活性血管抗拉强度测定
[0189][0190]
表4.多通道同轴3d打印生物活性血管断裂伸长率测定
[0191][0192]
从上述结果来看,打印后7天内生物活性血管的弹性模量为0.57-0.30mpa,抗拉强度为0.60-0.32mpa,断裂伸长率为1.30-1.01。弹性模量均值为0.38mpa,标准差为0.058mpa,均值的95%置信区间为0.35-0.41mpa;抗拉强度均值为0.44mpa,标准差为0.069mpa,均值的95%置信区间为0.41-0.48mpa;断裂伸长率均值为1.15,标准差为0.085,均值的95%置信区间为1.11-1.19。
[0193]
另外,随着时间的增长,打印后第7天的弹性模量(p=0.024)和抗拉强度(p=0.004)与打印后第1天相比明显减小;而打印后第7天的断裂伸长率与打印后第1天相比,不能认为随着时间的推移增长而减小(p=0.250)。
[0194]
实施例3:多通道同轴3d打印生物活性血管动物模型建立方法
[0195]
(1)选取购买自广东省医学实验动物中心的7周龄健康纯系雄性spf级别sd大鼠,体重200g左右,在南方医科大学实验动物中心给予自由进食进水,人工照明,保持12h开/关。湿度维持50%,室温维持25-28℃,饲养一周后进行动物移植实验。所有相关动物实验符合中华人民共和国科学技术部的《关于善待实验动物的指导性意见》标准。本研究中的动物实验过程获得广东省人民医院伦理委员会的批准。整个研究过程符合伦理要求。
[0196]
(2)步骤:
[0197]
①
取准备的实验大鼠,采用2%浓度、4l/min流量的异氟烷吸入麻醉剂诱导麻醉,诱导时间约1min。
[0198]
②
麻醉成功后换1%浓度、2l/min流量的异氟烷维持麻醉。
[0199]
③
术区备皮,仰卧位固定,行腹正中切口,沿腹正中线切开皮肤、筋膜,轻轻挤出内脏,以生理盐水浸润湿纱布包裹置于一侧。
[0200]
④
解剖显露腹主动脉,以低分子肝素250u/kg体重经动脉注射使之全身肝素化。
[0201]
⑤
用动脉瘤夹将近端和远端结扎并截取肾动脉以下1cm左右长度的腹主动脉。
[0202]
⑥
取一段1cm左右长度的,通过实施例1所记载的方法得到的多通道同轴3d打印生物活性血管,通过医用可吸收胶粘连的方式将前述多通道同轴3d打印生物活性血管进行端端粘连吻合,使前述多通道同轴3d打印生物活性血管中空管腔与大鼠自身血管内腔形成连接,完成多通道同轴3d打印生物活性血管的大鼠腹主动脉移植。
[0203]
⑦
将大鼠内脏按顺序放回,以防术后消化道梗阻。逐层关闭筋膜、皮肤各层,并敷料包扎。
[0204]
⑧
多通道同轴3d打印生物活性血管移植后的大鼠予半流质喂养,注意保温及术后妥善饲养,注意观察大鼠术后下肢及尾部血运情况。
[0205]
(3)结果:
[0206]
以医用可吸收胶粘连的方式制作3d打印生物活性血管移植模型2只,移植成功率100%,术后即刻血管通畅率100%(参见说明书图27),连接处渗血率0%,术后第2天下肢及尾部无明显青紫、活动障碍等缺血情况。
[0207]
本发明的上述实施例仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1