一种血管重建装置的制作方法
本发明涉及医疗器械,尤其涉及动脉重建装置。
背景技术:
主动脉瘤和主动脉夹层是十分凶险的人类血管疾病。主动脉瘤源自血管弥漫状的异常扩张,以瘤状破裂为其主要危险。主动脉夹层则以血管内膜撕裂、破口扩展,形成真假血管腔,除破裂风险外,还严重影响分支血管或脏器的供血。
主动脉瘤,主要发生于腹主动脉及胸主动脉,主动脉弓部也可涉及。目前使用覆膜支架的腔内介入治疗方式以其微创伤的特点,逐渐取代外科开放式手术,成为胸主动脉瘤、腹主动脉瘤治疗首选。但仍然存在以下问题:当主动脉瘤体累及分叉血管或附近时,为了不封闭或干涉分支动脉的正常血液灌注,提供给覆膜支架锚固区域的正常主动脉段往往有限;而目前的腔内治疗共识认为需要确保距离真性瘤颈不小于15mm的健康主动脉,以保证覆膜支架的锚定。在无法提供覆膜支架足够长的健康主动脉段的情况下,患者往往不得不选择大创伤的外科手术进行干预。目前有在覆膜支架近端或远端设计稀疏的支架裸区,让裸区匹配分叉血管从而一定程度增加锚定区域;其问题在于,为了让支架裸区不闭塞分支血管,支架裸区往往会设置得非常稀疏,虽然可以覆盖分支血管增加了锚定区域,但是支架裸区无法提供充足的径向支撑力确保锚定,存在覆膜支架移位的风险。同样原因,对于主动脉弓部位置的主动脉瘤,因为毗邻无名动脉、左颈总动脉和左锁骨下动脉,目前仍旧没有有效、方便的腔内治疗的介入器械供使用,外科治疗依旧是主流选择,患者不得不面对较大的手术创伤及手术风险。
主动脉夹层常发于50-70岁男性群体,是人类主动脉有关最常见的死亡原因。机理主要源于主动脉内膜的退行性变,血流撕破内膜进入到动脉中膜,使中膜分离,并形成夹层瘤状。其危害十分严重,未经治疗的一年内死亡率高达90%,国内近年来主动脉夹层呈现上升趋势,成为关注的热点。主动脉夹层按照是否累计升主动脉可分类为stanforda型和b型,其中累及升主动脉为a型,近端破口可发于升主动脉、主动脉弓部或降主动脉近端。不累及升主段的为b型主动脉夹层,近端破口主要位于降主动脉。目前的治疗现状:对于a型夹层,往往累及弓部分支动脉,目前主要是通过外科开放手术,进行升主、以及弓部人工血管置换(如象鼻手术、孙氏手术),达到消除近端破口以及近端病变血管的置换;而对潜在的远端破口因其往往邻近分叉动脉,则选择旷置或者分期处理。对于b型夹层,目前采用覆膜支架的腔内治疗方式封闭近端破口已经成为首选,但当近端破口或远端破口累及分叉动脉时,仍旧没有较好的解决方法。
综上所述,目前对于邻近分叉血管的主动脉瘤或主动脉夹层,难以在确保覆膜支架锚定的前提下,兼顾分叉动脉的正常血液灌注;诸如弓部主动脉疾病,腹主动脉疾病。目前也有一些诸如开窗技术,分支支架的处理方法,但仍旧存在适应范围窄、操作难度大等弊端而难以推广。开窗的方式,可以分为术前开窗和术中开窗两种,在覆膜支架上开好与分支动脉位置匹配的‘窗口’,兼顾分支血管的灌注。术前开窗的难点在于术中操作时如何将窗口准确对位分支血管,术中开窗的限制在于过程中存在对分支动脉的一定的封闭时间,往往会造成缺血损伤,特别是主动脉弓部会涉及到颅内的供血。分支支架的制约在于分叉血管解剖位置的多样性,一个特定位置关系及大小的分支覆膜支架难以适应不同的分支血管解剖情况。目前也有一些将开窗技术与再植入分支支架结合的尝试,但大都没能扩大适用范围或难以解决对位、术中分支动脉缺血的问题。
技术实现要素:
本发明提供一种主动脉重建装置,可以在全程不影响毗邻分叉动脉的血管灌注情况下,可方便、顺利、有效地完成治疗主动脉瘤或夹层治疗,重建毗邻分支动脉血管。器械装置的主要作用机制如下:针对毗邻分叉动脉的主动脉瘤或者主动脉夹层,先行植入一个带有临时导流通道的覆膜支架,在实现自身锚定的同时,临时导流通道可将主动脉的血液与分支动脉导通;并且在对分支动脉开口部位的覆膜支架实施术中开窗时,因覆膜支架上临时导流通道的导流作用,可确保术中开窗过程中仍然维持分支动脉的血液灌注;而在开窗完成或进一步地在分支动脉植入分支覆膜支架后,该临时导流通道可以通过再行植入裸支架、或者球囊扩张等扩张机制,膨胀恢复为覆膜支架主体的管状,从而达到完整重建主动脉及毗邻分叉血管,且全过程中不影响分支血管的血液灌注。
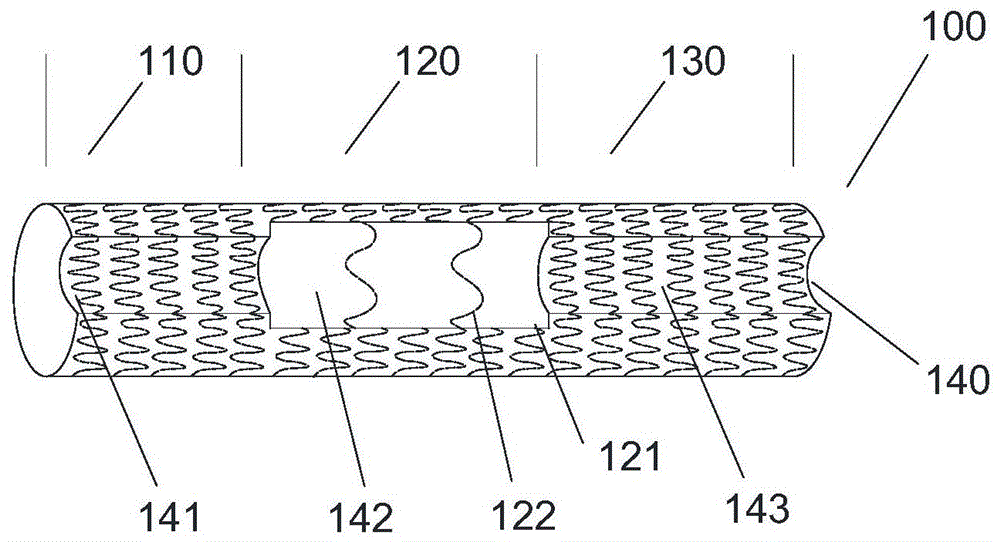
在一个实施例,本发明提供一种主动脉重建装置包含:一个带有临时导流通道的覆膜支架(100),和一个裸支架(200);如图1a所示,一个覆膜支架(100),其主体由支架框架和覆盖于其上的覆膜构成,可由第一覆膜支架段(110)(覆膜支架靠近心脏的一端,后文称为近端),第二覆膜支架段(120),第三覆膜支架段(130)(覆膜支架远离心脏一端,后文称为远端)组成;其中第二覆膜支架段设置有开窗区(121)。在覆膜支架(100)的表面,包含至少一条临时导流通道(140),并进一步可由近端通道(141),开窗区通道(142),远端通道(143)构成.其中近端通道(141)位于第一覆膜支架段(110),开窗区通道(142)包含于开窗区(121),远端通道(143)位于第三覆膜支架段(130).开窗区(121)对应毗邻的一个或多个分支动脉口,临时导流通道(140)的作用在于,当覆膜支架(100)被植入到血管内时,血液可以通过临时导流通道(140)导流至毗邻的分叉动脉,且行术中开窗时不会因覆膜支架封闭分支动脉口影响血液灌注。而当开窗区(121)完成术中开窗,或进一步地在分支动脉血管内植入分支覆膜支架后,临时导流通道(140)可以被撑开改变内凹状态,与覆膜支架(100)形成完整的管状。
在一个实施例,本发明的主动脉重建装置用于修复弓部一个或多个近端夹层破口。
附图说明
图1a是一个是本发明的覆膜支架(100),其主体由支架框架和覆盖于其上的覆膜构成,可由第一覆膜支架段(110)(覆膜支架靠近心脏的一端),第二覆膜支架段(120),第三覆膜支架段(130)(覆膜支架远离心脏一端)组成;其中第二覆膜支架段设置有开窗区(121)。在覆膜支架(100)的表面,包含至少一条临时导流通道(140),并进一步可由近端通道(141),开窗区通道(142),远端通道(143)构成.其中近端通道(141)位于第一覆膜支架段(110),开窗区通道(142)包含于开窗区(121),远端通道(143)位于第三覆膜支架段(130).开窗区(121)对应毗邻的一个或多个分支动脉口。相邻开窗区(121)被内凹骨架(122)间隔开。
图1b显示临时导流通道(140)的横截面,可以是圆弧状,槽状,v字形、直线状等任意形状。
图1c显示临时导流通道(140)可被撑开后与覆膜支架主体形成圆柱状,即在其不改变周长的情况下扩开后成为一个整圆。
图1d显示临时导流通道(140)可以沿覆膜支架表面以螺旋-直线状或其他任意曲线轨迹贯通分布。
图2a显示临时导流通道(140)可以由第一覆膜支架段(110)即近端发起,延伸贯通第二覆膜支架段(120)后结束。
图2b显示临时导流通道(140)可以由第三覆膜支架段(130)即远端发起,延伸至第二覆膜支架段(120)后结束。
图3a显示内凹骨架(122)在开窗区(121)的覆膜通过一个或多个缝合点通过缝线相连接。
图3b显示内凹骨架(122)在开窗区(121)内以带状结构实现,与覆膜编织在一起。
图3c显示内凹骨架(122)实施为能进行塑型的非金属线材,其连续或非连续地与覆膜线材在开窗区122编织为一体,即整个带有内凹骨架(122)的开窗区(121)可实现内凹塑性并可被扩开,区别于其他区域的覆膜特征。
图4a显示覆膜支架(100),其第一覆膜支架段(110)的框架结构由近端主体支架(111)和近端通道支架(112)构成;其第三覆膜支架段(130)的框架结构由远端主体支架(131)和远端通道支架(132)构成。
图4b显示覆膜支架(100)局部向外膨出,缩小了在瘤体上分支动脉口与开窗区(121)的距离。
图5a显示一种覆膜支架(100),其第一覆膜支架段(110)包括设置在覆膜外、并且与覆膜部分接合的主体支架(111),以及设置在覆膜内、并且与覆膜完全接合的内部支架(113);第二覆膜支架段(120)包含一个开窗区(121),且开窗区(121)不含骨架。
图5b显示上述覆膜支架(100),其临时导流通道(140)为开放状态,并且在控制下弯曲成预设构型。
图5c显示上述覆膜支架(100),在覆膜近端临时导流通道(140)的同侧和对侧至少各设有1个缝线环(144),并至少设有1根用于开闭覆膜临时导流通道(140)的控制线(145),首先控制线(145)从手柄处依次由远端向近端穿过1个或多个临时导流通道(140)对侧的缝线环(144),然后控制线(145)由近端向远端穿过1个或多个临时导流通道(140)同侧的缝线环(144),最后控制线(145)再由近端向远端依次穿过1个或多个临时导流通道(140)对侧的缝线环(144)。
图6显示裸支架(200),由第一裸支架段(210),第二裸支架段220,第三裸支架段(230)组成;分别对应第一覆膜支架段(110),第二覆膜支架段(120),第三覆膜支架段(130)。
图7显示通过设置裸支架(200)的网格特征,使得覆膜支架(100)的支架框架部分陷入其中。
图8a显示在弓部存在一个或多个近端夹层破口,经由近端破口开始形成了真腔及假腔。
图8b显示带有临时导流通道的覆膜支架(100)通过经导管方式被植入,夹层破口被覆膜支架(100)封闭,但是弓部各个分支血管仍然可以通过临时导流通道(140),获得正常的血液灌注。
图8c显示经血管路径对开窗区进行覆膜开窗,覆膜支架(100)的开窗区(121)无金属框架,或者内凹框架为非金属材料。
图8d显示进一步植入分支覆膜支架(100),覆膜支架(100)的开窗区(121)无金属框架。
图8e显示经导管方式植入裸支架(200)后,近端通道(141),远端通道(143)支架框架被撑开;开窗区通道(142)也被撑开,覆膜被裸支架(200)贴合到血管壁。
图8f显示当有在植入分支覆膜支架的情况,裸支架(200)撑开近端通道(141)及远端通道(143)。
图8g显示当有植入分支覆膜支架的情形如图8f,裸支架(200)将分支覆膜支架近端的喇叭口与开窗区(121)覆膜贴紧。
图9a显示一个带有临时导流通道的覆膜支架(100),其带有内凹特征的开窗区位于所属覆膜支架(100)的端部,即仅包含第一覆膜支架段(110)和带有开窗区的第二覆膜支架段(120);相应地,临时导流通道(140)包含了非开窗通道(141)和开窗区通道(142)。
图9b显示临时导流通道(140)仅包含开窗区通道(142)。
图9c显示临时导流通道(140)从开窗区(121)发出,延伸至第一覆膜支架段(110)但不贯通。
图10a显示降主动脉的夹层累及左锁骨下动脉。
图10b显示带有临时导流通道的覆膜支架(100),通过经导管方式被植入。夹层破口被覆膜支架封闭,带有内凹特征的开窗区位于覆膜支架的端部。
图10c显示覆膜支架(100)被植入后,再经血管路径对开窗区进行覆膜开窗。
图10d显示覆膜支架(100)被植入并经血管路径对开窗区进行覆膜开窗后,再进一步对左锁骨下动脉植入分支覆膜支架。
图10e显示裸支架(200)被经导管方式植入,临时导流通道(140)被裸支架撑开,覆膜被裸支架(200)贴合到血管壁。
图10f显示当左锁骨下动脉有植入分支覆膜支架。
图11a显示腹主动脉瘤临近了肾动脉。
图11b显示带有两条临时导流通道的覆膜支架(100),通过经导管方式被植入。
图11c显示植入覆膜支架(100)后,再经血管路径对开窗区进行覆膜开窗。
图11d显示植入覆膜支架(100)并经血管路径对开窗区进行覆膜开窗后,再进一步对左肾动脉、右肾动脉植入分支覆膜支架。
图11e显示裸支架(200)被经导管方式植入,临时导流通道(140)被裸支架撑开,覆膜被裸支架(200)贴合到血管壁。
图11f显示左肾动脉、右肾动脉有植入分支覆膜支架。
具体实施方式
本发明提供一个血管重建装置,包括一个覆膜支架。在一个实施例,所述覆膜支架包括由框架和覆膜组成的主体,其特征在于:所述主体包括一个开窗区,所述开窗区内只有覆膜;及所述覆膜支架表面包括至少一条临时导流通道,所述临时导流通道连通所述开窗区。
在一个实施例,所述临时导流通道是可以被撑开使所述覆膜支架横截面固定成圆形。
在一个实施例,进一步包括多于一个开窗区,每个开窗区以内凹骨架隔开。
在一个实施例,所述内凹骨架与所述主体的框架相连接或不相连接。
在一个实施例,所述临时导流通道连通所述开窗区内的部分横截面较其他部分宽。
在一个实施例,所述开窗区位于所述主体的端部并带有内凹特征。
在一个实施例,所述主体由第一覆膜支架段、第二覆膜支架段和第三覆膜支架段组成,所述开窗区位于第二覆膜支架段。在一个实施例,所述临时导流通道经第一覆膜支架段或第三覆膜支架段连接第二覆膜支架段的开窗区。在一个实施例,所述第二覆膜支架段较第一覆膜支架段或第三覆膜支架段更为柔性。
在一个实施例,所述覆膜支架的形态包括局部向外膨出或向内凹陷、直筒状、锥形状或弯曲状。
在一个实施例,所述临时导流通道在覆膜支架表面的分布是沿覆膜支架的长度方向直线状分布、沿覆膜支架表面以螺旋-直线状分布或任意曲线轨迹分布。
在一个实施例,所述临时导流通道至少连通所述覆膜支架的一端。
在一个实施例,所述覆膜支架包括一个用于控制所述至少一条临时导流通道的打开和关闭的控制机制。在另一个实施例,所述控制机制位于所述覆膜支架具有至少一条临时导流通道的部分,组成所述至少一条临时导流通道的框架和覆膜不接合,所述至少一条临时导流通道的同侧和对侧至少各设有一个缝线环,并设有至少一根用于开闭所述至少一条覆膜临时导流通道的控制线。
在一个实施例,所述覆膜支架内部设有缝线环和控制线,临时导流通道由可控制形态的覆膜构成。在一个实施例,所述覆膜支架和覆膜所构成临时通道的形态都可以控制。在另一个实施例,所述覆膜支架的横截面为圆形。
本发明进一步提供一个血管重建装置。在一个实施例,所述血管重建装置包括:
一个本发明所述的覆膜支架;及一个膨胀件,所述膨胀件能置于所述覆膜支架内膨胀至不小于所述覆膜支架内径。
在一个实施例,所述膨胀件是裸支架。在一个实施例,所述裸支架包括一个与所述开窗区对应的区域,所述区域具有稀疏的网格。
在一个实施例,所述膨胀件是一个球囊。
本发明进一步提供一个使用本发明的血管重建装置的方法。在一个实施例,所述方法包括以下步骤:a)经导管置入所述覆膜支架至一个有需要的血管内,所述血管包括至少一个分支血管;b)将所述开窗区的临时导流通道置于所述分支血管外,为分支血管提供血液;c)向所述开窗区对应分支血管的位置进行覆膜开窗;及d)经导管置入所述膨胀件至所述覆膜支架内,撑开所述覆膜支架至横截面固定成圆形并且与所述血管的内壁贴合。
在一个实施例,所述步骤c)进一步在所述位置向对应分支血管植入一个分支覆膜支架。在一个实施例,所述分支覆膜的近端包括一个喇叭口,步骤(d)中膨胀件将所述喇叭口与开窗区覆膜贴紧。
在一个实施例,所述膨胀件是裸支架。在一个实施例,所述裸支架包括一个与所述开窗区对应的区域,所述区域具有稀疏的网格。
在一个实施例,所述膨胀件是一个球囊。
在一个实施例,所述膨胀件完成步骤(d)后撤出血管。
在一个实施例,所述步骤(b)进一步包括使用一个控制机构来打开所述临时导流通道。在另一个实施例,所述控制机构包括控制线、缝线环和不接合的框架和覆膜,牵拉所述控制线将打开所述临时导流通道。
实施例1
在一个实施例,本发明提供一种主动脉重建装置包含:一个带有临时导流通道的覆膜支架(100),和一个裸支架(200);如图1a所示,一个覆膜支架(100),其主体由支架框架和覆盖于其上的覆膜构成,可由第一覆膜支架段(110)(覆膜支架靠近心脏的一端,后文称为近端),第二覆膜支架段(120),第三覆膜支架段(130)(覆膜支架远离心脏一端,后文称为远端)组成;其中第二覆膜支架段设置有开窗区(121)。在覆膜支架(100)的表面,包含至少一条临时导流通道(140),并进一步可由近端通道(141),开窗区通道(142),远端通道(143)构成.其中近端通道(141)位于第一覆膜支架段(110),开窗区通道(142)包含于开窗区(121),远端通道(143)位于第三覆膜支架段(130).开窗区(121)对应毗邻的一个或多个分支动脉口,临时导流通道(140)的作用在于,当覆膜支架(100)被植入到血管内时,血液可以通过临时导流通道(140)导流至毗邻的分叉动脉,且行术中开窗时不会因覆膜支架封闭分支动脉口影响血液灌注。而当开窗区(121)完成术中开窗,或进一步地在分支动脉血管内植入分支覆膜支架后,临时导流通道(140)可以被撑开改变内凹状态,与覆膜支架(100)形成完整的管状。
如图1b所示,临时导流通道(140)(包含近端通道(141),开窗区通道(142),远端通道(143))的横截面可以是圆弧状、槽状、v字形、直线状等任意形状,即只要局部未形成完整圆柱即可;临时导流通道(140)可被撑开后与覆膜支架主体形成圆柱状。优选为圆弧内凹状,由圆截面的部分圆弧内凹形成,即在其不改变周长的情况下扩开后成为一个整圆,如图1c所示。
在一个实施例,临时导流通道(140)可以沿覆膜支架的长度方向贯通分布(直线状),也可沿覆膜支架表面以螺旋-直线状或其他任意曲线轨迹贯通分布,以避开血管内可能的夹层内膜,避免堵塞临时导流通道;如图1d所示。
实施例2
在一个实施例,可选的,临时导流通道(140),可以不沿其长度方向完全贯通,即临时导流通道(140)可以由第一覆膜支架段(110)即近端发起,延伸贯通第二覆膜支架段(120)后结束,如图2a所示,或继续延伸至第三覆膜支架段(130)但不贯通;或临时导流通道(140)可以由第三覆膜支架段(130)即远端发起,延伸至第二覆膜支架段(120)后结束,如图2b所示,或继续延伸至第一覆膜支架段(110)但不贯通。
在一个实施例,临时导流通道(140)的三部分,近端通道(141)、开窗区通道(142)、远端通道(143)可以配置为相同的或不同的截面形状,相同的或者不同的通道横截面积;优选地,开窗区通道(142)的横截面宽度大于近端通道(141)及远端通道(143)的横截面宽度。同样,每段通道(近端通道(141)、开窗区通道(142)、远端通道(143))自身可以配置为均匀或者渐变的横截面。
在一个实施例,第二覆膜支架段(120)包含了一个或多个开窗区(121)。
在一个实施例,开窗区(121)无金属框架区,仅包含覆膜材料,相邻开窗区(121)被内凹骨架(122)间隔开。
在一个实施例,第二覆膜支架段仅包含一个开窗区时,此时可以无内凹骨架。内凹骨架(122)的作用在于,使得开窗区(121)的覆膜形成并维持内凹通道形态。内凹骨架(122)的形态可以是内凹的圆弧结构,可以是内凹的波浪状结构,可以是内凹的多个v字型结构等。内凹骨架(122)可以与第二覆膜支架段(120)的支架主体相连接或不相连接。
在一个实施例,内凹骨架(122)的材料可以为不锈钢金属丝、镍钛合金丝等金属材料,以及可以塑型的其他非金属材料,诸如尼龙、聚四氟乙烯等;优选为可以通过激光或其他开窗方式破坏的非金属材料。
实施例3
在一个实施例,内凹骨架(122)可以与开窗区(121)的覆膜通过一个或多个缝合点通过缝线相连接,如图3a所示。可选地,内凹骨架(122)还可以在开窗区(121)内以带状结构实现,与覆膜编织在一起,如图3b所示。可选地,内凹骨架(122)还可实施为能进行塑型的非金属线材,其连续或非连续地与覆膜线材在开窗区(121)编织为一体,即整个带有内凹骨架(122)的开窗区(121)可实现内凹塑性并可被扩开,区别于其他区域的覆膜特征,如图3c所示。开窗区设置无金属框架仅具有覆膜,以及设置稀疏的内凹骨架(122),或者非金属材料的内凹骨架(122),其目的在于尽可能少地避免术中开窗时的金属框架干扰,提高开窗以及后续分支覆膜支架植入的成功率。优选地,开窗区(121)的周向宽度大于分支动脉的直径尺寸,以确保开窗区与分支动脉对位有充足的容许空间,便于使得分支动脉总是对准开窗区覆膜;例如在主动脉弓部应用领域时,开窗区(121)的周向宽度范围可为0.5厘米至5厘米。
第一覆膜支架段(110)和第三覆膜支架段(130),将主要承担覆膜支架术中锚定作用。因适应特定病变解剖的需要(如扭曲成角的动脉瘤,弓部病变等),需要支架具备一定的可弯曲性。如上所述覆膜支架各个段落可以设置具有相同或者不同的径向支撑力,优选地,第一覆膜支架段(110)和第三覆膜支架段(130)的支撑力大于第二覆膜支架段(120),第二覆膜支架段(120)的相比其余两段更为柔性。实现方式如下:当支架主体为波浪状金属丝单元时,可通过变化金属丝径,波浪状结构单元不同的设计尺寸,不同的波浪状结构单元密度等方式来实现;如当支架主体为切割定型类支架时,可以通过设置差异化的节杆长度、宽度及角度来实现;如当支架主体为编织类支架时,可以通过差异化的编织密度来达到如上差异化支撑力的设置。作为可选地,三个覆膜支架段可以各自实施为不同的加工工艺,如波浪状框架结构、编制类、切割类、3d打印等,以达到差异化的各段性能效果。
实施例4
如上所述覆膜支架(100),其第一覆膜支架段(110)的框架结构由近端主体支架(111)和近端通道支架(112)构成;其第三覆膜支架段(130)的框架结构由远端主体支架(131)和远端通道支架(132)构成,如图4a。近端主体支架(111)和近端通道支架(112)可设置具有相同或者不同的刚度,同样的,远端主体支架(131)和远端通道支架(132)可设置具有相同或不同的刚度。为了使得近端通道支架(112)和远端通道支架(132),能够容易地被后续植入的裸支架或球囊等扩张机制撑开,优选地,近端通道支架(112)的刚度低于同段的主体支架(111),远端通道支架(132)的刚度低于同段的主体支架(131)。其中,近端通道支架(112)可与近端主体支架(111)相连接或不相连接,两者可选择相同或不同的结构单元,可选择相同或不同的材料以及制造工艺;其中,远端通道支架(132)可与主体支架(131)相连或不相连接,两者可选择相同或不同的结构单元,可选择相同或不同的材料以及制造工艺。
如上所述覆膜支架(100),其主体支架框架的材料可为不锈钢,或镍钛合金,或钴铬合金,可选为丝材或管材。
如上所述覆膜支架(100),其主体可以为等直径的直筒状,也可为直径渐变的锥型状,也可为与应用领域解剖结构相适应的弯曲状造型。
在一个实施例,如上所述覆膜支架(100),其局部可以向外膨出,以利于动脉瘤包含分叉动脉时的应用,即缩小了在瘤体上分支动脉口与开窗区(121)的距离,以便利开窗及后续潜在的分支覆膜支架植入,如图4b。同样可选地,其局部可以向内凹陷。
如上所述覆膜支架(100),优选地,其近端和远端直径不小于对应植入部位的血管直径。
如上所述覆膜支架(100),其覆膜可以位于支架框结构的外表面,或内表面,或支架框架结构内外表面都设置有覆膜。可选地,覆膜的材料可以为聚对苯二甲酸乙二酯(pet)、聚四氟乙烯(ptfe)、硅胶等。
当覆膜支架(100)在其远端未设置临时导流通道时,可选地,其远端覆膜可以超出支架主体,形成无支架的裙边部,以便利未来可能的再次的外科手术。
实施例5
在一个实施例,覆膜支架(100)的横截面为圆形,临时导流通道(140)由可控制形态的覆膜构成。如图5a、图5b所示,第一覆膜支架段(110)包括设置在覆膜外、并且与覆膜部分接合的主体支架(111),以及设置在覆膜内、并且与覆膜完全接合的内部支架(113);第二覆膜支架段(120)包含一个开窗区(121),且开窗区(121)不含骨架,如此使得第一覆膜支架段(110)和第二覆膜支架段(120)的覆膜可以活动,在下凹时能够成为临时导流通道(140)。
在一个实施例,进一步地,如图5c所示,在覆膜近端临时导流通道(140)的同侧和对侧至少各设有1个缝线环(144),并至少设有1根用于开闭覆膜临时导流通道(140)的控制线(145),首先控制线(145)从手柄处依次由远端向近端穿过1个或多个临时导流通道(140)对侧的缝线环(144),然后控制线(145)由近端向远端穿过1个或多个临时导流通道(140)同侧的缝线环(144),最后控制线(145)再由近端向远端依次穿过1个或多个临时导流通道(140)对侧的缝线环(144)。在图5b、5c中,缝线环(144)分别设置在临时导流通道(140)的中线及其对侧,在牵拉控制线(145)时,临时导流通道(140)被打开,而且覆膜支架(100)绕x轴弯曲。可以理解的是,若在覆膜支架(100)的周向设置多根控制线(145)及对应的缝线环(144),则可以加强对于临时导流通道(140)形态的控制,并能够使覆膜支架(100)分别绕图示坐标下的x、y、z轴旋转,加强其在屈曲血管处的贴壁能力,改善“鸟嘴”和内漏问题。
在一个实施例,上述覆膜支架(100)被放置在目标血管,开窗区(121)对应分支血管,此时若操作者在手柄远端同时牵拉控制线(145)的两头,则临时导流通道(140)被完全打开,同时,随着牵拉量的增加,覆膜支架(100)会弯曲成预设构型,直到与血管壁紧密贴合;反之,若松开控制线(145),由于近端内部支架(113)的回弹力,临时导流通道(140)会自动关闭。当完成开窗并植入分支支架后,操作者在手柄远端持续牵拉控制线(145)的其中一头,可将控制线(145)由体内从手柄处完全撤出。
当上所述覆膜支架(100)被植入到主动脉内后,在开窗区进行与分支动脉对应的开窗操作,或进一步地经开窗在分支动脉植入分支覆膜支架后,可以通过再行植入裸支架,将临时导流通道扩张恢复为覆膜支架主体的管状。
如上所述裸支架(200),由第一裸支架段(210),第二裸支架段(220),第三裸支架段(230)组成;分别对应第一覆膜支架段(110),第二覆膜支架段(120),第三覆膜支架段(130)。如图6。
如上所述裸支架(200),其直径尺寸大于覆膜支架(100)内径,以保证将位于覆膜支架(100)上的临时导流通道(140)撑开,并确保自身相对于覆膜支架(100)的稳固锚定;同时可确保开窗区(121)的分支覆膜支架紧贴覆膜,以降低内漏风险。
在一个实施例,如上所述裸支架(200),其主体可以为切割扩张定型内支架,也可以为编制类支架,或者切割与编制类混合工艺实现。裸支架的材料可为不锈钢,镍钛记忆合金、钴铬合金等,可选为丝材或管材。
在一个实施例,可选地,如上所述裸支架(200),其第一裸支架段(210)及第三裸支架段(230),其径向支撑力大于第二裸支架段(220);可选地,第二裸支架段(220)相比第一裸支架段(210)、第三裸支架段(230)具有更好的柔韧性。所述特点均可以通过设置不同的网格密度、节杆宽度、丝径等参数实现。
在一个实施例,可选地,如上所述裸支架(200),在与覆膜支架(100)的开窗区(121)对应区域,相比其他区域具有更为稀疏的网格,以确保后续开窗后分支动脉的血液灌注不受裸支架影响。
在一个实施例,与上述覆膜支架(100)相适应地,裸支架(200)其主体可以为等直径的直筒状,也可为直径渐变的锥型状,也可为局部外凸或内凹的轮廓构型。
在一个实施例,可选地,裸支架(200)在能够撑开上述覆膜支架(100)的同时,还设置由一个或多个相对于覆膜支架的锚固机制,其可以由两个支架的框架结构间相互卡接限位实现,如一个卡接限位的剖面,如图7。这可以通过设置裸支架(200)的网格特征,使得覆膜支架(100)的支架框架部分陷入其中得到实现,如当覆膜支架(100)的框架结构为波浪状单元时,裸支架(200)在局部位置可设置相近的波浪状单元,两者可以匹配形成卡锚固机制。
视解剖及治疗策略的需要,可选地,裸支架(200)的长度可以大于、等于、小于上所述覆膜支架(100)的长度。
可选地,裸支架(200)与覆膜支架开窗区(121)对应区域外,可局部设置覆膜,如在第一裸支架段(210),第三裸支架段(310)设置覆膜.
可选地,裸支架(200)的远端可设置覆膜,并且超出裸支架框架,以便利未来可能的再次的外科手术。
可选的,上述覆膜的材料可以为聚对苯二甲酸乙二酯(pet)、聚四氟乙烯(ptfe)、硅胶等。
实施例6
以上所述覆膜支架(100),以弓部的主动脉夹层为例,其植入过程实施如下:
在一个实施例,如图8a,在弓部存在一个或多个近端夹层破口,经由近端破口开始形成了真腔及假腔。
如图8b,带有临时导流通道的覆膜支架(100)通过经导管方式被植入,夹层破口被覆膜支架(100)封闭,但是弓部各个分支血管仍然可以通过临时导流通道(140),获得正常的血液灌注。
如图8c,再经血管路径对开窗区进行覆膜开窗,覆膜支架(100)的开窗区(121)无金属框架,或者内凹框架为非金属材料,可以避免金属框架对开窗的干扰。或进一步植入分支覆膜支架(100)如图8d,覆膜支架(100)的开窗区(121)无金属框架,同样也确保了分支覆膜支架的顺利植入展开。
如图8e,裸支架(200)被经导管方式植入,近端通道(141),远端通道(143)支架框架被撑开;开窗区通道(142)也被撑开,覆膜被裸支架(200)贴合到血管壁。当有植入分支覆膜支架(100)的情形下如图8f,裸支架(200)在撑开近端通道(141),及远端通道(143),同时裸支架(200)将分支覆膜支架近端的喇叭口与开窗区(121)覆膜贴紧,确保无内漏,如图8g.
如上所述覆膜支架(100),若其主体支架框架(包含临时导流通道支架框架),采用不锈钢管材或钴铬合金管材切割定型方式制得时,其可选的另一种植入过程实施方式为:当开窗区(121)覆膜开窗完成后,经导管于分支动脉植入分支覆膜支架,可后续行球囊扩张;球囊扩张可以使得临时导流通道被扩张成圆柱状,并永久成型。此时未使用裸支架(200),仅覆膜支架(100)和分支覆膜支架被永久植入。
实施例7
如上所述一个带有临时导流通道的覆膜支架(100),其带有内凹特征的开窗区可以位于支架端部,可以应用于必要的治疗环境,诸如降主动脉病变累及左锁骨下动脉的治疗情形,又如腹主动脉病变累及肾动脉的治疗情形,或者其他可适用的应用环境。如图9a所示,开窗区(121)位于所属覆膜支架(100)的端部,即仅包含第一覆膜支架段(110)和带有开窗区的第二覆膜支架段(120);相应地,临时导流通道(140)包含了非开窗通道(141)和开窗区通道(142)。作为可选地,如图9b所示,临时导流通道(140)可以仅包含开窗区通道(142)。或从开窗区(121)发出,延伸至第一覆膜支架段(110)但不贯通,如图9c所示。
以累及左锁骨下动脉的降主动脉夹层为例,其植入过程如下:
如图10a,降主动脉的夹层累及左锁骨下动脉;
如图10b,带有临时导流通道的覆膜支架(100),通过经导管方式被植入。夹层破口被覆膜支架封闭,带有内凹特征的开窗区位于覆膜支架的端部,左锁骨下动脉可以通过临时导流通道(140),获得正常的血液灌注。
如图10c,再经血管路径对开窗区进行覆膜开窗,覆膜支架(100)的开窗区(121)无金属框架,或者内凹框架为非金属材料,可以避免金属框架对开窗的干扰。或进一步对左锁骨下动脉植入分支覆膜支架如图10d。覆膜支架(100)的端部开窗区(121)无金属框架,同样也确保了分支覆膜支架的顺利植入和支架展开。
如图10e,裸支架(200)被经导管方式植入,临时导流通道(140)被裸支架撑开,覆膜被裸支架(200)贴合到血管壁。当左锁骨下动脉有植入分支覆膜支架的情形下如图10f。依据需要,裸支架可以设置在近端超出覆膜支架的长度。同样的,裸支架(200)在撑开临时导流通道的同时,还将分支覆膜支架近端的喇叭口与开窗区覆膜贴紧,确保无内漏。
实施例8
以累及肾动脉的腹主动脉瘤为例,其植入过程如下:
如图11a,腹主动脉瘤临近了肾动脉;
如图11b,带有两条临时导流通道的覆膜支架(100),通过经导管方式被植入。带有内凹特征的开窗区位于覆膜支架的端部,左肾动脉和右肾动脉可以通过临时导流通道(140),获得正常的血液灌注。
如图11c,再经血管路径对开窗区进行覆膜开窗,覆膜支架(100)的开窗区(121)无金属框架,或者内凹框架为非金属材料,可以避免金属框架对开窗的干扰。或进一步对左肾动脉、右肾动脉植入分支覆膜支架如图11d。覆膜支架(100)的端部开窗区(121)无金属框架,同样也确保了分支覆膜支架的顺利植入和支架展开。
如图11e,裸支架(200)被经导管方式植入,临时导流通道(140)被裸支架撑开,覆膜被裸支架(200)贴合到血管壁。当左肾动脉、右肾动脉有植入分支覆膜支架的情形下如图11f。同样的,裸支架(200)在撑开临时导流通道的同时,还将分支覆膜支架近端的喇叭口与开窗区覆膜贴紧,确保无内漏。
以上实施过程以弓部为例,同样适用于主动脉的其他位置,以及血管领域的类似应用场景;以上实施过程以主动脉夹层为例,同样适用于主动脉瘤,以及血管领域类似应用场景。
- 还没有人留言评论。精彩留言会获得点赞!