含有拉科酰胺的药剂学缓释性组合物的制作方法
本发明涉及含有拉科酰胺的药剂学缓释性组合物。具体而言,涉及一种能1日1次服用的拉科酰胺缓释性制剂。
背景技术:
据推测癫痫是全世界约2%人口患病的疾病。就韩国而言,如果换算成统计数值,每1000人中有2.4人出现癫痫,主要在60岁以上的老年层中发生。癫痫因脑细胞无秩序的电现象而发病。尽管没有特殊的发作原因,但如果慢性发作,则诊断为癫痫并开始治疗。癫痫治疗的核心是有效抑制发作。
作为癫痫治疗剂,有托吡酯、唑尼沙胺等药物。他们的机制虽然并未明确,但被认为作用于电压开闭性钾通道或钙通道、作为兴奋性及抑制性神经传递物质的谷氨酸及γ-氨基丁酸等。拉科酰胺是us5,773,475公开的下一代药物,据报告称具有促进钠通道的缓慢失活而使过度兴奋性神经元膜稳定的机制。
拉科酰胺获得了迄今癫痫治疗剂中耐药性最优秀的评价,与原有药物的相互作用小,适合并行给药。现在,拉科酰胺在癫痫患者中正被用作治疗伴随2次性全身发作或不伴随2次性全身发作的部分发作的附加疗法性抗癫痫剂药物。拉科酰胺被分类为具有与原有1代或2代抗癫痫剂不同作用机制的3代抗癫痫剂,以1294名癫痫患者为对象进行的2010年临床试验结果表明,有效抑制不用原有药物调节的癫痫患者的发作,从数值上来看,发作减少50%以上的患者服用400mg时,达到38-49%。
拉科酰胺原创公司的制品名为维派特(vimpat)。维派特于2008年获得美国fda许可,在韩国,口服型片剂和注射剂等在2010年获得食品医药品安全处批准。韩国从韩国ucb制药进口,片剂有拉科酰胺50mg、100mg、150mg、200mg用量的速释性制品。
上述维派特片作为速释性片剂,需1日2次服用。具体而言,首次推荐量为1日2次,1次50mg,1周后增加为2次,1次100mg,这是制品说明书的用法用量事项。该药品根据临床反应及耐药性,维持量可为每周1日2次,按1次50mg增量,如非有特殊疾病,最大推荐给药量为1日400mg(1日2次,1次200mg)。
但是,癫痫是即使没有电解质不均衡、尿毒症等特殊原因也诱发慢性发作的疾病,因而拉科酰胺一般要求长期服用。因此,减少每日服用次数,在整体的服药便利性方面会带来相当的改善,在韩国尚未有将拉科酰胺开发成缓释片而能够1日1次服用的先例。因此,本发明人试图开发能1日1次服用的拉科酰胺缓释片。
作为参考,存在从构想层面提出拉科酰胺缓释片的专利文献。
例如,韩国公开专利公报第10-2015-0034579号指出,虽然表现出与速释性制剂相同的曲线下面积,但减少峰值浓度并延迟达到峰值浓度的tmax而体现为1日1次缓释性片剂时,发现提供相同的临床效能,但与速释性制剂相比,副作用发生率减小,提出了相对于制剂的总拉科酰胺含量,约8.5-41wt%的拉科酰胺在1小时以内释放,相对于制剂的总拉科酰胺含量,约15-64wt%的拉科酰胺在2小时以内释放,相对于制剂的总拉科酰胺含量,约28-88wt%的拉科酰胺在4小时以内释放的溶出曲线。
上述文献以副作用与峰值浓度有关而效能主要与曲线下面积有关的结果为前提,参考本人的一期临床试验结果,通过模拟来对能够降低峰值浓度、延迟tmax的释放曲线进行特定。但是,模拟终究是预测程序,无法断言借助于模拟而导出的溶出曲线范围的上限线与下限线均满足作为医药品所希望的峰值浓度和曲线下面积,或试图从根本上减小副作用并表现出生物学等效性。另外,峰值浓度低时,存在初始药效表达不令人满足的忧虑。
韩国授权专利公报第10-1732731号指出了如果拉科酰胺的含量不同,则各缓释性片剂的溶出曲线会相异的问题后,阐明如果调节乙基纤维素高分子粒子的平均粒径,则可以克服上述问题。
但是,利用粒径互不相同的乙基纤维素原料,片剂溶出延迟效果受到粒径影响较大,因而存在的缺点是在商业化时,不仅需确保各赋形剂的平均粒径,而且需要精细调节、管理适度粒径分布图。为了使含有4种拉科酰胺用量的片剂分别商业化,存在需要持续确保具有稳定不变的粒子分布图的4种乙基纤维素原料并进行品质管理的限制条件。
技术实现要素:
技术问题
本发明人旨在开发能1日1次服用的拉科酰胺缓释性制剂。进而,旨在开发出一种制剂,不同于韩国公开专利公报第10-2015-0034579号,设计得使峰值浓度不低于速释性制剂,从而在服用药物后的初始药效表达方面也没有不足,不同于韩国授权专利公报第10-1732731号,即使不调节赋形剂的粒度,使用适合的高分子组合也能够将多种含量的拉科酰胺缓释片溶出率曲线表现为彼此等效的模式。
技术方案
本发明通过如下手段解决前述课题。
1.一种药剂学组合物,所述药剂学组合物以拉科酰胺或其盐为主成分,其特征在于,包含速释层和缓释层,缓释层按1:0.1至1:10的重量比包含纤维素衍生物和蜡或蜡类似脂质,1日1次经口给药。
2.根据所述1的药剂学组合物,其特征在于,纤维素衍生物为选自由羟丙基纤维素、羟丙基甲基纤维素、乙基纤维素、甲基纤维素及羟乙基纤维素构成的组的一种以上。
3.根据所述1或2的药剂学组合物,其特征在于,蜡或蜡类似脂质为选自由山嵛酸甘油酯、棕榈硬脂酸甘油酯及硬脂酸甘油酯构成的组的一种以上。
4.根据所述1至3中任一项的药剂学组合物,其特征在于,速释层与缓释层按1:1至1:7的重量比包含主成分。
5.根据所述1至4中任一项的药剂学组合物,其特征在于,纤维素衍生物与蜡或蜡类似脂质相对于缓释层重量为5至50重量%。
有益效果
本发明即使1日1次经口给药,显示出与市销的速释性制剂1日2次经口给药时在生物学上同等的药效。另外,本发明具有的优点是,在速释性与缓释性方面分别包含有效成分,在初始药效表达方面,也并不亚于单纯缓释性片剂。进而,最终制剂的表面积根据有效成分的含量而异,因而一般而言溶出率会相异,但本发明的溶出率曲线表现得彼此同等。
附图说明
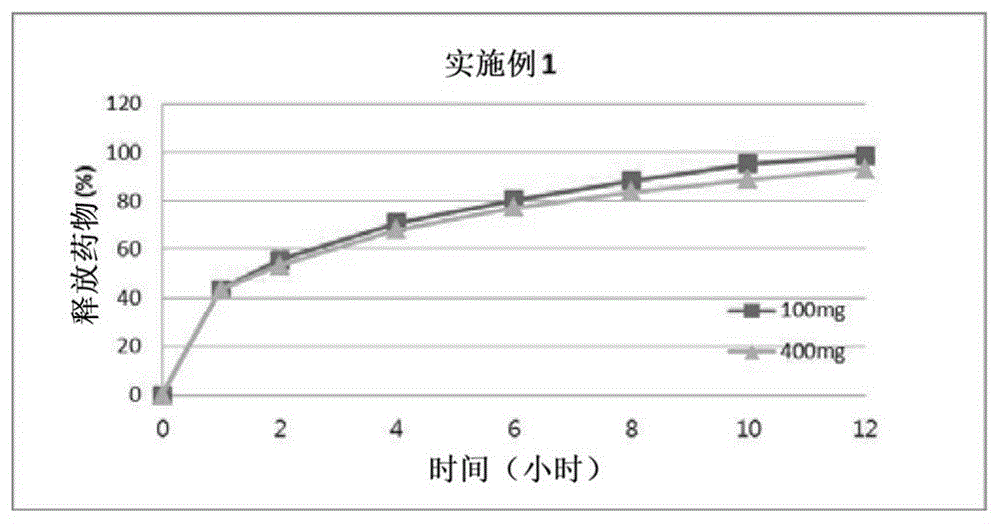
图1显示了实施例1的拉科酰胺100mg和400mg制剂溶出曲线。
图2显示了实施例2的拉科酰胺100mg和400mg制剂溶出曲线。
图3显示了实施例3的拉科酰胺100mg和400mg制剂溶出曲线。
图4显示了实施例4的拉科酰胺100mg和400mg制剂溶出曲线。
图5显示了实施例5的拉科酰胺100mg和400mg制剂溶出曲线。
图6显示了实施例6的拉科酰胺100mg和400mg制剂溶出曲线。
图7显示了实施例7的拉科酰胺100mg和400mg制剂溶出曲线。
图8显示了实施例8的拉科酰胺100mg和400mg制剂溶出曲线。
图9显示了实施例9的拉科酰胺100mg和400mg制剂溶出曲线。
图10显示了实施例10的拉科酰胺100mg和400mg制剂溶出曲线。
图11显示了实施例11的拉科酰胺100mg和400mg制剂溶出曲线。
图12显示了比较例1的拉科酰胺100mg和400mg制剂溶出曲线。
图13显示了比较例2的拉科酰胺100mg和400mg制剂溶出曲线。
图14显示了比较例3的拉科酰胺100mg和400mg制剂溶出曲线。
图15显示比较例4的拉科酰胺100mg和400mg制剂溶出曲线。
图16显示了比较例5的拉科酰胺100mg和400mg制剂溶出曲线。
图17显示了比较例6的拉科酰胺100mg和400mg制剂溶出曲线。
图18显示了对比格犬经口给药拉科酰胺200mg制剂(实施例3)1次与维派特片100mg(对照制剂)2次时随着时间的拉科酰胺血中浓度。
具体实施方式
最佳模式
公开一种拉科酰胺速释性片剂。维派特片就是这种,该药1日2次服用。速释性片剂与水性媒质接触后,15分钟内释放药物的98%,tmax在普通给药后1.4-1.5小时内以到达,具有约13–14小时的排泄半衰期,适合1日2次给药。现在拉科酰胺只作为速释性片剂市销,没有作为缓释性片剂市销的医药品。但是,拉科酰胺由于适应症特性上的原因,是要求长期服用的药物,因而要求开发一种制剂,仅1日1次服用,便可表现出与1日2次服用的医药品同等的效果。
本发明涉及满足上述要求的拉科酰胺缓释性片剂。
在本说明书中,所谓拉科酰胺全部囊括了活性成分为拉科酰胺的成分。例如,可以为拉科酰胺或其盐。下面也将拉科酰胺或其盐表现为主成分。
存在单纯使拉科酰胺缓释化的构想。但是,单纯以缓释性系统构成拉科酰胺时,在初始药效表达方面,无法与服用速释性片剂时相比。因此,本发明的特征在于同时包含速释性和缓释性。
以往没有同时包含速释性和缓释性,从而没有将速释性片剂1日2次给药的情形和达成生物学等效性的前例。但是,本发明人惊讶地将拉科酰胺在速释层和缓释层中按1:1至1:7的重量比配合主成分,在缓释层中将纤维素衍生物与蜡或蜡类似脂质按1:0.1至1:10的重量比配合时,确认了是能够在生物学上证实等效性的制剂。
另外,一般而言,制剂的表面积因主成分的含量而异,通常溶出率曲线会不同,而在缓释层按1:0.1至1:10的重量比配合纤维素衍生物与蜡或蜡类似脂质时,确认了溶出率曲线表现得彼此同等。
本发明的速释层可以包含主成分、崩解剂及填充剂。其他添加剂可以根据需要,配合速释性片剂中普通采用的成分。
例如,作为崩解剂,可以选择选自由交联维酮、交联羧甲基纤维素钠及羟乙酸淀粉钠构成的组的一种以上。
作为填充剂,可以选择选自由微晶纤维素、淀粉、低取代羟丙基纤维素、磷酸钙和乳糖构成的组的一种以上。
崩解剂与填充剂的配合比可以由普通技术人员根据主成分含量适宜配合,例如,可以相对于速释层重量分别添加10-80重量%,优选地,可以添加10-50重量%。
本发明的速释层除此之外还可以根据需要追加配合流化剂、结合剂、润滑剂等。例如,流化剂可以选择选自由硅酸钙、胶态二氧化硅、偏硅酸铝镁及滑石粉构成的组的一种以上,结合剂可以选择选自由聚维酮、羟丙基纤维素及共聚维酮构成的组的一种以上,润滑剂可以选择选自由硬脂富马酸钠、硬脂酸及硬脂酸镁构成的组的一种以上。各个的配合比也可以由普通技术人员适宜地调节,例如,可以相对于速释层重量分别包含1-30重量%,优选地,可以包含1-10重量%。
本发明的速释层可以在混合拉科酰胺、流化剂、填充剂后,施加结合剂而实现颗粒化,定粒后混合崩解剂和润滑剂而制备。
本发明的缓释层包含主成分及控制释放型基剂。控制释放型基剂的特征在于,将纤维素衍生物与蜡或蜡类似脂质按1:0.1至1:10的重量比配合。所述控制释放型基剂包含5至50重量%,优选地,包含5至40重量%。所述控制释放型基剂含量如果超过50重量%,则药物的释放过慢,不仅无法控制释放,而且片剂的大小过大,服药依从性下降,如果不足5重量%,则药物释放快,无法实现持续的控制释放。
本发明的缓释层可以根据需要,适当地追加配合上面提到的流化剂、填充剂、结合剂、润滑剂。例如,填充剂可以选择选自由微晶纤维素、淀粉、低取代羟丙基纤维素、磷酸钙和乳糖构成的组的一种以上。流化剂可以选择选自由硅酸钙、胶态二氧化硅、偏硅酸铝镁及滑石粉构成的组的一种以上。结合剂可以选择选自由聚维酮、羟丙基纤维素及共聚维酮构成的组的一种以上。润滑剂可以选择选自由硬脂富马酸钠、硬脂酸及硬脂酸镁构成的组的一种以上。各个的配合比也可以由普通技术人员适宜地调节,例如,可以相对于缓释层重量分别包含1-50重量%,优选地,可以包含1-30重量%。
本发明的缓释层可以将拉科酰胺、流化剂、填充剂、控制释放型基剂混合后,施加结合剂实现颗粒化,定粒后混合润滑剂而制备。
最终制剂可以以速释层和缓释层作为双层片而制片,根据需要在外廓进行涂膜而收得。涂膜基剂可以选择选自由羟丙基甲基纤维素及聚乙烯醇构成的组的一种以上,配合比相对于片剂重量可以包含1-10重量%。
本发明按拉科酰胺基准,可以成为100mg、200mg、300mg、400mg含量的制剂。
发明模式
下面通过实施例,补充说明本发明。不过需要注意的,实施例只不过是本发明的一个体现例,本发明的范围并不由此限定。
1.实施例
1-1.缓释化基剂成分(主成分200mg处方表)
[表1]
*单位为mg,下表同。
缓释层制备是在混合拉科酰胺与胶态二氧化硅、微晶纤维素、缓释性高分子(控制释放型基剂)及蜡或蜡类似脂质后,加入溶解羟丙基纤维素的结合剂进行联合及颗粒化,在干燥器中,以60℃温度干燥1~2小时。定粒后混合润滑剂。
速释层制备是混合拉科酰胺与胶态二氧化硅、微晶纤维素、低取代羟丙基纤维素后,添加溶解羟丙基纤维素的结合剂进行联合及颗粒化,在干燥器中,以60℃温度干燥1~2小时。定粒后混合崩解剂和润滑剂。
利用上述制备的缓释层颗粒与速释层颗粒,制片成双层片,使用羟丙基甲基纤维素或聚乙烯醇类的半干型涂膜基剂,根据通常的方法,制备了薄膜1片中含有拉科酰胺200mg的缓释片。
拉科酰胺缓释片的含量分别按100、200、300、400mg进行倍数处方。
1-2.缓释化基剂成分组合的含量比
[表2]
根据与实施例1-1相同的制备方法,变化羟乙基纤维素(hec)/山嵛酸甘油酯(gb)比率(1:0.1~1:10)而制备拉科酰胺缓释片。1-3.主成分含量比
[表3]
根据与实施例1.1相同的制备方法,变化主成分含量制备拉科酰胺缓释片。
2.比较例
2-1.缓释化基剂成分
[表4]
根据与实施例1-1相同的制备方法,变化缓释性高分子种类制备了拉科酰胺缓释片。
2-2.缓释化基剂成分组合的含量比
[表5]
根据与实施例1-1相同的制备方法,变化羟乙基纤维素/山嵛酸甘油酯制备了拉科酰胺缓释片。
3.实验例
3-1.溶出率评价(实施例1~3)
将实施例1~3制剂,根据大韩药典溶出试验法第2法(桨式法),在提纯水900ml50rpm条件下,评价了随时间的溶出率。溶出试验液在经pvdf0.45um过滤后,利用hplc测量。分析条件如下。
<分析条件>
-柱:在直径约4.6mm、长度约50mm的不锈钢管中填充了3μm的液体色谱仪用十八烷基硅烷基硅胶的柱(ultracarbods,4.6x50mm,3μm)或与之同等的柱
-移动相:水·乙腈·三氟乙酸(v/v/v)=700·300·1
-检测波长:uv,215nm
-注入量:2ul
*-流速:1.0ml/min
确认了根据实施例1~3制备的100mg、400mg制剂的溶出曲线,将其结果显示于表6。
[表6]
3-2.溶出率评价(实施例4~9)根据与3-1溶出率评价相同的方法,确认了根据实施例4~9制备的100mg、400mg制剂的溶出曲线。将其结果显示于下表7~8。
[表7]
[表8]
3-3.溶出率评价(实施例10~11、比较例1)根据与3-1溶出率评价相同的方法,确认了根据实施例10~11制备的400mg制剂的溶出曲线。将其结果显示于下表9。
[表9]
3-4.溶出率评价(比较例2~6)根据与3-1溶出率评价相同的方法,确认了根据比较例2~6制备的100mg、400mg制剂的溶出曲线。将其结果显示于下表10~11。
[表10]
[表11]
将各制剂的溶出曲线图示于图1至图17。如图所示,作为本发明体现例的图1至图11,拉科酰胺为100mg时与为400mg时,溶出曲线等效。作为参考,溶出曲线为10%左右时,评价为等效。但作为比较例的图12至图17,溶出曲线随着拉科酰胺含量而并不彼此等效。
3-5.比格犬pk评价
为了通过比较所述制剂的溶出形态与药理学动态来预测对人体内药物效果表达的影响,利用实施例的组成制剂,在比格犬中确认了药理活性。将根据实施例1-1的实施例3制备的片剂与市销的维派特片100mg(vimpat
[表12]
结果,如所述表12中确认的,实施例3的制剂相比对照制剂,血浆浓度曲线下的面积(auc)显示为94.7%,最高血浆中药物浓度(cmax)显示为118.8%。因此,确认了实施例3与对照制剂是在生物学上等效的制剂。
- 还没有人留言评论。精彩留言会获得点赞!