治疗干性A.M.D(年龄相关性黄斑变性)的组合物及方法与流程
本发明涉及一种治疗干性年龄相关性黄斑变性(a.m.d或amd)的组合物和方法。更具体地,本发明涉及含有一种或多种抗炎药物的用于治疗干性amd的组合物和方法。
背景技术:
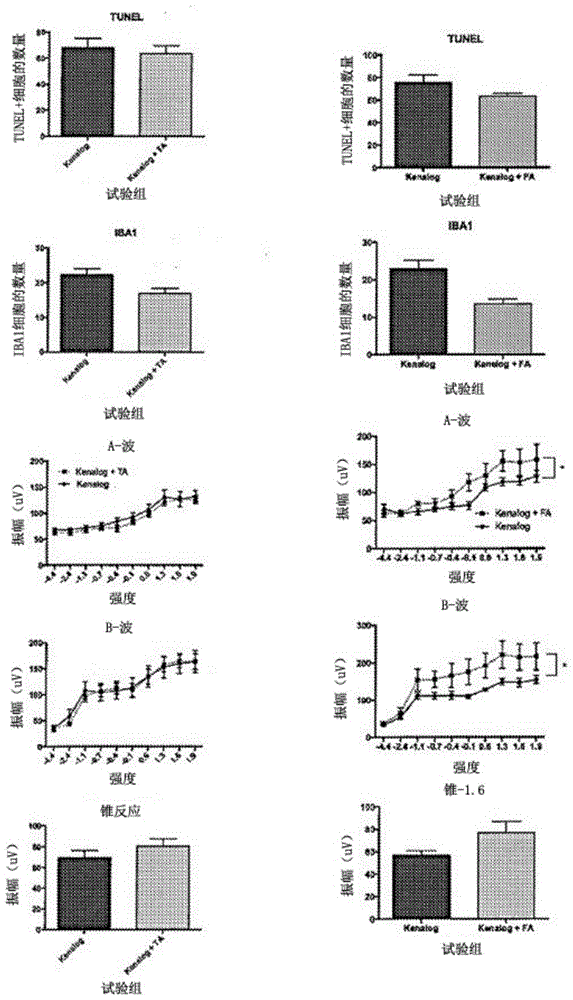
:人们普遍认为干性amd没有内科或外科的治疗方法。arunagorusupudi、kellynelson和paulsbernstein指出,多种营养素,如矿物质、维生素、v-3(n-3)脂肪酸,和各种类胡萝卜素,一直与降低amd的风险有关。这些作者指出,年龄相关性眼病研究(age-relatedeyediseasestudy)(areds)的结果表明,补充抗氧化剂(b-胡萝卜素和维生素c和维生素e)和锌,与降低amd进展风险有关,areds2的后续研究旨在改进早期配方,测试叶黄素、玉米黄素和v-3脂肪酸的添加。然而,singh指出,areds未能证明补充维生素可以减缓其发展为地图状萎缩(ga)。ga是amd的一种晚期形态,可导致视网膜(光感受器、视网膜色素上皮(rpe)和脉络膜毛细血管)的进行性和不可逆性萎缩。ga的发病机制是多因素的,被认为是由再生不良的rpe的内在与外在应激源所触发的。萎缩的区域会看起来像一张地图,这解释了术语“地图状”。术语ga可与术语“干性amd”互换使用。即使在areds2中,当β-胡萝卜素被叶黄素/玉米黄素取代以降低肺癌风险时,新配方也没有显示出减缓向ga恶化。singh提到了克利夫兰诊所科尔眼科研究所(coleeyeinstitute,clevelandclinic)正在进行的临床研究,以进一步阐明和理解干性amd的机制,并评估旨在减缓干性amd进展的新疗法。有两个治疗ga的大型3期试验正在进行中。filly研究评估了对ga患者玻璃体腔(ivt)内多次注射apl-2(apellis制药)的安全性、耐受性和活性证据。第二个则是一项多中心、随机化的、双掩蔽的、假对照的研究,以调查在ga患者中的兰帕单抗(lampalizumab)的ivt注射。singh还提到了另一个研究领域,该领域来自于对玻璃膜疣中补体副产物的发现,从而得到了补体调节异常与amd之间的联系。一些研究人员目前正在评估补体级联作为非新生血管性amd的临床治疗靶点。因子d被认为是涉及补体因子h替代途径的早期成分。正在开发的抗炎药物包括兰帕单抗、氟轻松(fluocinolone)、醋酸格拉替雷(glatirameracetate)、西罗莫斯(sirolimus)、依库珠单抗(eculizumab)和arc-1905。研究表明,暴露在明亮连续光(bcl)中24小时可以诱导一系列补体系统基因的差异性表达,其包括经典成分和凝集素成分、调节因子和受体。c1qr1、mcp、dafl、和clqtnf6都与光感受器死亡和ap-1的表达一致的调节,其在暴露24小时时达到峰值。c1s和c4a在暴露后3天达到峰值,然而c3、c3arl和c5rl在暴露后7天表达量最高。在ed1-阳性小胶质细胞和iba1-阳性小胶质细胞/巨噬细胞、视网膜血管和视神经头,以及视网膜下腔中,均可检测到c3mrna,尤其是在新发病变边缘。本研究表明bcl诱导一系列补体基因的长时间表达。通过基因关联研究揭露了补体在老年性黄斑变性(amd)中的致病作用。这些结果证实了调节基因补体因子h(cfh)中的y402h序列变异与amd发病率14-17,以及补体通路基因中的其他易感变异,如c2、18,19、cfb、18、19和中心成分c320,24之间存在的显著相关性。这些发现确定了补体激活和炎症是影响amd发病和进展的因素(rutaretal)。il-1β是由视网膜小胶质细胞和巨噬细胞产生,并在视网膜变性中通过müller细胞和rpe促进趋化因子的表达。靶向il-1β被建议广泛用于抑制在视网膜营养不良中的趋化因子介导的炎症,如amd(natolietal)。c3,由视网膜小胶质细胞/巨噬细胞局部产生,已被认为是导致视网膜变性的原因之一。因此,有人提出c3靶向基因治疗可能在减缓amd的进展方面被证明是有价值的(natolietal)。singh还指出,视觉周期抑制剂正处于后期开发阶段,其包括芬维a胺(fenretinide)、acu-4429和alk-001。这些化合物下调视觉周期以减少视网膜代谢中的有毒废物。已经在玻璃疣中发现了β淀粉样蛋白,rn6g和gsk933776正在开发中,以调节β淀粉样蛋白的积累。singh所指出的另一类疗法是正在开发中的神经保护药物,包括uf-021、睫状神经营养因子和酒石酸溴莫尼定玻璃体腔内种植体。诸如mc-1101局部给药以期其能通过增加脉络膜灌注来减缓amd。包括hucns-sc和ma09-hrpe在内的干细胞疗法也在研究中,作为ga的潜在治疗方法。john和karenrepine的ep0819003描述了一种用于治疗或预防黄斑变性的发病或进展的方法,其包括周期性地单独用谷胱甘肽进行给药,或联合至少一种抗氧化剂或抗炎疗法,以及可能除了一个或多个上述症状治疗方法之外的方法。isarna治疗公司(isarnatherapeuticsgmbh)的pct/ep2014/056222描述了一种寡核苷酸,其由转化生长因子-β1(tgf-betal)、转化生长因子-β2(tgf-beta2)或转化生长因子-β3(tgf-beta3)核酸序列的选定区域的10至20个核苷酸组成,该寡核苷酸包括修饰的核苷酸,如lna、ena、聚氧化烯基(polyalkyleneoxide-)、2’-氟、2’-o-甲氧基和/或2’-o-甲基修饰的核苷酸。该组合物或寡核苷酸用于预防和/或治疗青光眼、后发性白内障、干眼、马凡氏(marfan)综合征或洛伊-迪茨(loeys-dietz)综合征、核糖母细胞瘤(riboblastoma)、脉络膜癌(choroidcarcinoma)、黄斑变性,例如年龄相关性黄斑变性、糖尿病黄斑水肿或白内障。vitrisa治疗公司(vitrisatherapeutics,inc.)的pct/us2017/014458公开了涉及将适体用于抑制补体因子d,以及用于治疗干性年龄相关性性黄斑变性、地图状萎缩、湿性年龄相关性黄斑变性或stargardt病的方法和组合物。基因泰克公司(genentechinc.)的jp2015083609描述了将补体抑制剂,包括那些抑制替代补体途径,如d因子、备解素、b因子、ba因子和bb因子,以及典型补体途径,如c3a、c5、c5a、c5b、c6、c7、c8、c9和c5b-9,用于治疗眼部相关病症或疾病,如年龄相关性性黄斑变性(amd)、糖尿病视网膜病变(diabeticretinopathy)、眼部血管生成(如影响脉络膜、角膜或视网膜组织的眼部新血管生成),和其他涉及补体激活的眼部病症。佛罗里达大学研究基金会公司(universityoffloridaresearchfoundation,inc)的pct/us2015/020001描述了方法和组合物,用于预防、治疗和/或改善一种或多种炎症症状,该炎症症状包括amd、关节炎、白塞氏病、best黄斑营养不良、角膜炎症、糖尿病视网膜病变、玻璃膜疣生成、干性amd、干眼、地图状萎缩、青光眼眼部新血管生成、红斑狼疮、黄斑变性、mallatialeventinese和doyne蜂窝状视网膜营养不良、肾炎、高眼压、眼部炎症、复发性葡萄膜炎、sorsby眼底营养不良、血管炎、玻璃体视网膜病变、湿性amd或相关紊乱。该药用组合物包括重组病毒载体,该重组病毒载体输送可分泌性和细胞穿透性的m013蛋白或肽。dvashizeev和pollakeayala的pct/il2015/051174描述了用于治疗阿尔茨海默(alzheimer)病、和/或眼部和视网膜退行性疾病(如年龄相关性黄斑变性疾病)的组合物。所述组合物包括有效量的氢-亮氨酰-亮氨酸-甲酯盐酸盐(h-leu-leu-omehydrochloride),或其功能性衍生物。本说明书中对任何现有技术的引用不是,也不应被视为承认或任何形式的暗示现有技术形成公知常识的一部分。技术实现要素:通常,本发明的实施例涉及一种治疗干性年龄相关性黄斑变性(amd)的组合物和方法。广义上来说,本发明涉及一种或多种抗炎药物在干性amd治疗中的应用。在一个具体实施例中,一种或多种抗炎药物包括一种或多种糖皮质激素和/或盐皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。在第一方面,虽然其不一定是唯一的或实际上最广泛的形式,但本发明提供了一种在受试者中治疗干性amd的方法,该方法包括给受试者施加治疗有效量的抗炎药物,来治疗干性amd。治疗有效量的抗炎药物可以被包含在所述药用组合物中。在第二方面,本发明提供了一种药用组合物,当用于治疗干性年龄相关性黄斑变性时,该药用组合物包括治疗有效量的一种或多种抗炎药物和药学上可接受的载体、稀释剂或赋形剂。在第三方面,本发明提供含有一种或多种抗炎药物的药用组合物用于制备治疗干性amd药物的应用。在上述任一方面的一个实施例中,一种或多种抗炎药物包括一种或多种cox抑制剂、一种或多种盐皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物、一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物、抗白三烯药物(antileukotrine)和/或白三烯受体拮抗剂。该cox抑制剂可抑制cox-1和cox-2中的一个或两个都抑制。该cox抑制剂可以包括非甾体类抗炎药物(nsaid)。所述nsaid可以包括布洛芬、布洛芬铜(copperibuprofenate)、吲哚美辛(indomethacin)、吲哚美辛铜(copperindomethacin)、萘普生(naproxen)、氟比洛芬(flurbiprofen)和/或塞来昔布(celecoxib)。根据上述任一方面,一种或多种抗炎药物,例如可以包括以下一种或多种:醋氯芬酸(aceclofenac)、阿西美辛(acemetacin)、乙酰水杨酸(acetylsalicylicacid)、5-氨基乙酰水杨酸(5-aminoacetylsalicylicacid)、阿氯芬酸(alclofenac)、阿明洛芬(alminoprofen)、氨芬酸(amfenac)、苄达酸(bendazac)、柏莫洛芬(bermoprofen)、α-红没药醇(alpha-bisabolol)、溴芬酸钠(bromfenac)、溴水杨醇(bromosaligenin)、布氯酸(bucloxicacid)、异丁苯丁酸(butibufen)、卡洛芬(carprofen)、桂美辛(cinmetacin)、环氯茚酸(clidanac)、氯苯吡乙酸(clopirac)、双氯芬酸钠(diclofenacsodium)、二氟尼柳(diflunisal)、地他唑(ditazol)、因法来酸(enfenamicacid)、依托度酸(etodolac)、依托芬那酯(etofenamate)、联苯乙酸(felbinac)、联苯丁酮酸(fenbufen)、氯苯噻唑乙酸(fenclozicacid)、芬度柳(fendosal)、非诺洛芬(fenoprofen)、芬替酸(fentiazac)、非普地醇(fepradinol)、氟灭酸(flufenamicacid)、氟尼辛(flunixin)、氟诺洛芬(flunoxaprofen)、氟比洛芬(flurbiprofen)、葡美辛(glucametacin)、水杨酸乙二醇酯(glycolsalicylate)、布洛芬(ibuprofen)、异丁普生(ibuproxam)、吲哚美辛(indomethacin)、吲哚洛芬(indoprofen)、三苯唑酸(isofezolac)、伊索克酸(isoxepac)、伊索昔康(isoxicam)、酮洛芬(ketoprofen)、酮咯酸(ketorolac)、氯诺昔康(lomoxicam)、洛索洛芬(loxoprofen)、甲氯芬那酸(meclofenamicacid)、甲芬那酸(mefenamicacid)、美洛昔康(meloxicam)、美沙拉嗪(mesalamine)、甲嗪酸(metiazinicacid)、莫苯唑酸(mofezolac)、萘普生(naproxen)、尼氟灭酸(niflumicacid)、奥沙西罗(oxaceprol)、奥沙普秦(oxaprozin)、羟保松(oxyphenbutazone)、帕沙米特(parsalmide)、哌立索唑(perisoxal)、苯基乙酰水杨酸(phenylacetylsalicylate)、奥沙拉嗪(olsalazine)、pyrazolac、吡罗昔康(piroxicam)、吡洛芬(pirprofen)、普拉洛芬(pranoprofen)、丙替嗪酸(protizinicacid)、醋水杨胺(salacetamide)、醋水杨胺o-乙酸(salicilamideo-aceticacid)、salicylsulphuricacid、双水杨酸酯(salsalate)、舒林酸(sulindac)、舒洛芬(suprofen)、琥布宗(suxibuzone)、替诺昔康(tenoxicam)、噻洛芬酸(tiaprofenicacid)、噻拉米特(tiaramide)、替诺立定(tinoridine)、托芬那酸(tolfenamicacid)、托美汀(tolmetin)、tropesin、联苯丁酸(xenbucin)、希莫洛芬(ximoprofen)、扎托洛芬(zaltoprofen)、佐美酸(zomepirac)、tomoxiprol;和舒林酸(sulindac)。在上述任一方面一个具体实施例中,一种或多种抗炎药物可以包括一种或多种盐皮质激素,和/或一种或多种糖皮质激素,或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。一种或多种盐皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,可以包含以下一种或多种:11-脱氧可的松(11-desoxycortisone,11-dc);氟氢可的松;醋酸氟氢可的松(fa);安奈德氟氢可的松(fludrocortisoneacetonide);醋酸脱氧皮质酮(da);脱氧皮质酮(ds);或醛固酮;或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。一种或多种糖皮质激素或或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,可以包含以下一种或多种:皮质醇、可的松、泼尼松、泼尼松龙(prednisolone)、甲基泼尼松龙(methylprednisolone)、地塞米松、倍他米松、曲安西龙(triamcinolone)、曲安奈德、倍氯米松或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。一种或多种盐皮质激素和/或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物可以包括一种或多种双重作用化合物,其中每种双重作用化合物能够调节盐皮质激素受体和糖皮质激素受体两者的活性。双重作用化合物可以包括以下一种或多种:曲安西龙;曲安奈德;皮质醇;可的松;泼尼松;泼尼松龙;甲基泼尼松龙;氟氢可的松;醋酸氟氢可的松;氟氢化可的松;或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。在一个具体实施例中,一种或多种盐皮质激素,或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,包括氟氢可的松或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。治疗活性类似物、衍生物、同系物、药学上可接受的盐,或共轭物,其可以包括一种或多种醋酸氟氢可的松和安奈德氟氢可的松。氟氢可的松或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。在上述任一方面的一具体实施例中,一种或多种盐皮质激素和/或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其包括曲安奈德或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。当一种或多种盐皮质激素和/或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物包括曲安奈德时,其浓度可以包括3.0至5.0mg/ml。在一个具体实施例中,该浓度可以包括4.0mg/ml。在上述任一方面的另一具体实施例中,一种或多种盐皮质激素和或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其包括二者其一:曲安西龙和氟氢可的松或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。该治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其可包括一种或多种醋酸氟氢可的松和安奈德氟氢可的松和曲安奈德。在任一方面另一实施例中,一种或多种盐皮质激素和/或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其包括一种或多种盐皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其与一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物的混合物。该混合物可以包括:两种或多种盐皮质激素或一种或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物;两种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物的混合物和/或一种或多种盐皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物和一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。在第一方面的一个实施例中,该方法还包括将至少一种抗炎药物注射到眼睛中。该注射可以包括脉络膜上腔注射。在第二方面的一个实施例中,药用组合物被注射进眼睛中。该注射可以包括脉络膜上腔注射。在上述任一方面的另一实施例中,至少一种抗炎药物是由单剂量配方提供。该单剂量配方可以是由预先装填的注射器提供。该预先装填的注射器可以包括两个筒。第一个筒可以包括第二或第三方面的药用组合物。第二个筒可以包括一种或多种添加剂。在上述任一方面的另一个实施例中,一种或多种药学上可接受的载体、稀释剂或赋形剂可以包括一种或多种表面活性剂或润湿剂。在上述任一方面的又一实施例中,表面活性剂可以包括聚山梨酸酯。该聚山梨酸酯可以包括一个或多个聚山梨酸酯20和聚山梨酸酯80。在一具体实施例中,表面活性剂包括聚山梨酸酯80。在上述任一方面的另一个实施例中,药学上可接受的载体、稀释剂或赋形剂可以包括羧甲基纤维素(cmc)。在上述任一方面的另一个实施例中,药用组合物还包括一种或多种ph调节组合物和注射用水。该ph调节组合物可以包括盐酸和/或氢氧化钠。在上述任一方面的另一个实施例中,该药用组合物包括6至8的ph。该ph可包括6至7.5。在任一上述方面的一个实施例中,该药用组合物包括平衡盐溶液。该平衡盐溶液可以包括盐水和缓冲液。平衡盐溶液可以包括一种或多种氯化钠;氯化钾;氯化钙(无水);氯化镁(六水);乙酸钠(三水);柠檬酸钠(无水);盐酸;氢氧化钠和注射用水。在任一上述方面的另一具体实施例中,该药用组合物是不含防腐剂的。根据上述任何一个方面,本发明的药用合物可以包括缓释组合物。在上述任一个方面的具体实施例中,该药用组合物或其一个或多个成分可以被灭菌。在上述任一个方面的一个实施例中,干性amd包括早期amd和地图状萎缩(ga),其与渗出性amd不同类。与渗出性amd不同类指渗出性amd不被包括在干性amd中。在上述任一个方面的另一实施例中,治疗包括预防性治疗。预防性治疗可以包括预防干性amd的治疗、干性amd易感性的治疗或干性amd敏感性的治疗。易感性或敏感性可包括具有眼部疾病或病症家族史的个体,例如干性amd。如果完全或部分预防或减缓干性amd的发展,预防或防治可能是成功的。在上述任一方面的一个实施例中,该方法还包括向受试者以至少一种添加剂进行给药。至少一种该添加剂可以包括抗vegf(抗血管内皮生长因子)抗体。该抗vegf抗体可以包括雷珠单抗(ranibizumab)(商标名)、阿帕西普(aflibercept)(商标名)、贝伐单抗(bevacizumab)(商标名)和opt-302中的一种或多种。本发明的其它方面和/或特征将通过如下的详细描述而变得显而易见。附图说明为了便于理解本发明并将其付诸实施,现在将参照附图来作为本发明实施例的参考,其中相同的附图序号指的是相同的组成部分。提供的附图仅作为示例,其中:图1:体内实验发现:光氧化损伤后,使用皮质激素治疗(ta左、fa右)或不使用皮质激素治疗(仅限kenalog媒介物)的细胞死亡(末端脱氧核苷酸转移酶dutp缺口末端标记;tunel)、巨噬细胞募集(iba1),和功能(erg)的测定。图2:根据本发明的一个实施例,示出了在建议注射氟氢可的松的初始筛查时收集的受试者数据。图2a和2b示出了受试者(fca-001)的左眼和右眼的照片。图2b和2c示出了同一双眼的视网膜照片。图2e至2j示出了同一眼睛的激光追踪断层扫描(trackinglasertomography):os(左侧的眼睛,左眼),fa0:40.3230°[hr](图2e);os,fa0:54.3830°art[hr](图2f);od(右侧的眼睛,右眼),fa1:08.6930°art[hr](图2g);os,fa3:15.3530°art[hr](图2h);od,fa5:02.4430°art[hr](图2i);os,fa10:09.4930°[hs](图2j)。图2k和2l显示进一步的激光追踪断层扫描图像:os,baf30°art[hr](图2k);od,baf30°art[hr](图2l)。图2m至2r显示了同一双眼的厚度绘图(thicknessmapping):odir30°art[hr](图2m和2n);odoct20°(5.9mm)art(14)a:27[hr](图2o);osir30°art[hr](图2p和2q);osoct20°(5.5mm)art(16)q:26[hr](图2r)。图3:示出了在第0天(即治疗前)收集的同一受试者的数据。图3a至3f示出了激光追踪断层扫描:odir30°art[hr](图3a和3b);odoct20°(5.9mm)art(16)q:25[hr](图3c);osir30°art[hr](图3d和3e);osoct20.0°(5.5mm)art(16)q:29[hr](图3f)。图3g和3h示出了同一双眼睛的追踪断层扫描:os,baf30°art[hr](图3g)和od,baf30°art[hr](图3h)。图4:示出了根据本发明的一个实施例,同一受试者第1天(即注射氟氢可的松后)的数据。图4a和4b示出了视力测试(snellan图表)。图4c和4d示出了激光追踪断层扫描图像:osir30°art[hr](图4c)和osbaf30°art[hr](图4d)。图4e至4g示出了激光追踪断层扫描:osir30°art[hr](图4e和4f);以及oct20°(5.5mm)art(16)q:32[hr](图4g)。图5:示出了在第14天从同一受试者收集的数据。图5a和5b示出了激光追踪断层扫描:os,baf30°art[hr](图5a);od,baf30°art[hr](图5b)。图5c至5h进一步地显示了的激光断层扫描图像:odir30art[hr](图5c和5d);odoct20°(5.9mm)art(16)q:30[hr](图5e);osir30°art[hr](图5f和5g);osoct20°(5.5mm)art(16)q:31[hr](图5h)。图5h和5i示出了视力测试(snellan图表)。图6:示出了在第28天从同一受试者收集的数据。图6a至6h示出了激光追踪断层扫描结果:odir30°art[hr](图6a和6b);odoct20°(5.9mm)art(16)q:28[hr](图6c);osir30°art[hr](图6d和6e);oct20°(5.5mm)art(16)q:29[hr](图6f);od,baf30°art[hr](图6g);os,baf30°art[hr](图6h)。图6h和6i显示了视力测试(snellan图表)。本领域技术人员将理解,列举附图中的组成部分是为了简化和明晰,其并没有必要是按比例绘制的。例如,附图中的一些组成部分的相对尺寸可能会被扭曲,以帮助增进对本发明实施例的理解。具体实施方式本发明的实施例涉及治疗干性年龄相关性黄斑变性(amd)的组合物和方法。更具体地,本发明涉及包括一种或多种抗炎药物的治疗干性年龄性黄斑变性的组合物和方法。干性amd是一种可能导致视野中心视力模糊或没有视力的医学病症。在这种疾病的早期阶段,其发展会看到视力的逐渐恶化,其可能会影响到一只或两只眼睛。虽然它的确不会导致完全失明,但由此导致的中心视力丧失会使面孔识别、驾驶、阅读和进行其他日常活动变得困难,并可能降低生活质量。如本文中所用的干性amd包括地图状萎缩(ga)。ga也可以称为萎缩性年龄性黄斑变性(amd)或晚期干性amd,其是年龄性黄斑变性的一种晚期形式,其可导致视网膜(光感受器、rpe和脉络膜毛细血管)进行性和不可逆性的丧失。本文中“干性amd”是用来指干性amd、ga和萎缩性amd。在本文中使用的一个实施例中,干性amd包括早期amd和地图状萎缩(ga),与渗出性amd不同。目前,amd的干性形式比湿性形式会丧失更多的视力。人们长期渴望对于干性amd的治疗。发明人认识到,在没有新生血管的情况下,干性amd的干性病变被认为是黄斑变性的终末期。这意味着在相当多的情况下,眼睛是干的,而不是湿的。本文中给出的数据通过干性amd的啮齿动物模型(实际上是小鼠和大鼠模型)生成的,该模型已被公开并得到认可。人们识别该模型,且已经在该模型中完成了许多治疗干预,示出了该模型是相关的且可以映射到人体模型和/或与人体病症相似。虽然不想受任何一种理论的约束,但发明人假设,在干性amd中,巨噬细胞进入rpe的基底膜和brook膜之间的裂解面,该brook膜包括脉络膜的基底膜,由此产生的炎症会剥离rpe。在很多情况下,慢性炎症细胞会在rpe的基底膜和脉络膜之间形成。因为低程度的慢性炎症过程会加剧和扩大ga病变(干性amd在没有新生血管的情况下的终末期),发明人意识到氟氢可的松可与ta或其他抗炎药物一起适用于终末期干性amd。为此,发明人提出可以用抗炎药物有效治疗干性amd,如氟氢可的松或曲安西龙。根据本发明,临床医生可以给急性晚期干性amd的患者注射氟氢可的松。本发明提供了在受试者中治疗干性amd的方法,该方法包括给受试者用治疗有效量的抗炎药物进行给药,来治疗干性amd。本发明还提供了一种药用组合物,当用于治疗干性amd时,该药用组合物包括治疗有效量的一种或多种抗炎药物和药学上可接受的载体、稀释剂或赋形剂。此外,本发明还提供了一种含有一种或多种抗炎药物,用于制备治疗干性amd药剂的应用。一种或多种抗炎药物可以包括cox抑制剂、一种或多种盐皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物、一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物、抗白三烯药物和/或白三烯受体拮抗剂。该cox抑制剂可抑制cox-1和cox-2中的一个或两个。该cox抑制剂可以包括非甾体类抗炎药物(nsaid)。所述nsaid可以包括布洛芬、布洛芬铜、吲哚美辛、吲哚美辛铜、萘普生、氟比洛芬和/或塞来昔布。一种或多种抗炎药物例如可以包括以下一种或多种:醋氯芬酸、阿西美辛、乙酰水杨酸、5-氨基乙酰水杨酸、阿氯芬酸、阿明洛芬、氨芬酸、苄达酸、柏莫洛芬、α-红没药醇、溴芬酸钠、溴水杨醇、布氯酸、异丁苯丁酸、卡洛芬、桂美辛、环氯茚酸、氯苯吡乙酸、双氯芬酸钠、二氟尼柳、地他唑、因法来酸、依托度酸、依托芬那酯、联苯乙酸、联苯丁酮酸、氯苯噻唑乙酸、芬度柳、非诺洛芬、芬替酸、非普地醇、氟灭酸、氟尼辛、氟诺洛芬、氟比洛芬、葡美辛、水杨酸乙二醇酯、布洛芬、异丁普生、吲哚美辛、吲哚洛芬、三苯唑酸、伊索克酸、伊索昔康、酮洛芬、酮咯酸、氯诺昔康、洛索洛芬、甲氯芬那酸、甲芬那酸、美洛昔康、美沙拉嗪、甲嗪酸、莫苯唑酸、萘普生、尼氟灭酸、奥沙西罗、奥沙普秦、羟保松、帕沙米特、哌立索唑、苯基乙酰水杨酸、奥沙拉嗪、pyrazolac、吡罗昔康、吡洛芬、普拉洛芬、丙替嗪酸、醋水杨胺、醋水杨胺o-乙酸、水杨酰硫酸、双水杨酸酯、舒林酸、舒洛芬、琥布宗、替诺昔康、噻洛芬酸、噻拉米特、替诺立定(tinoridine)、托芬那酸、托美汀、tropesin、联苯丁酸、希莫洛芬、扎托洛芬、佐美酸、tomoxiprol;和舒林酸。一种或多种抗炎药物,可以包括一种或多种盐皮质激素和/或一种或多种糖皮质激素,或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。一种或多种盐皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,可以包含以下一种或多种:11-脱氧可的松(11-dc);氟氢可的松;醋酸氟氢可的松(fa);安奈德氟氢可的松;醋酸去氧皮质酮(da);去氧皮质酮(ds);或醛固酮;或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。一种或多种糖皮质激素或或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,可以包含以下一种或多种:皮质醇、可的松、泼尼松、泼尼松龙、甲基泼尼松龙、地塞米松、倍他米松、曲安西龙、曲安奈德、倍氯米松或其治疗活性类似物、衍生物、同系物药学上可接受的盐或共轭物。一种或多种盐皮质激素和/或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物可以包括一种或多种双重作用化合物,其中每种双重作用化合物能够调节盐皮质激素受体和糖皮质激素受体两者的活性。双重作用化合物可以包括以下一种或多种:曲安西龙;曲安奈德;皮质醇;可的松;泼尼松;泼尼松龙;甲基泼尼松龙;氟氢可的松;醋酸氟氢可的松;安奈德氟氢可的松或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。一种或多种盐皮质激素或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其包括氟氢可的松或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物可以包括一种或多种醋酸氟氢可的松和安奈德氟氢可的松。一种或多种盐皮质激素和/或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其可以包括曲安奈德或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。当一种或多种盐皮质激素和/或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物包括曲安奈德时,其浓度可以包括3.0至5.0mg/ml。在一个具体实施例中,该浓度可以包括浓度可包括4.0mg/ml。从本文的教导中,技术人员能够容易地为一种或多种抗炎药物选择合适的剂量。一种或多种盐皮质激素和或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其可以包括二者其一:曲安西龙和氟氢可的松或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。该治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其可包括一种或多种醋酸氟氢可的松和安奈德氟氢可的松和曲安奈德。一种或多种盐皮质激素和/或一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物,其包括一种或多种盐皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物与一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物的混合物。该混合物可以包括:两种或多种盐皮质激素或一种或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物;两种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物的混合物和/或一种或多种盐皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物和一种或多种糖皮质激素或其治疗活性类似物、衍生物、同系物、药学上可接受的盐或共轭物。至少一种抗炎药物可以被注射到眼睛中。该注射可以包括脉络膜上腔注射。至少一种抗炎药物是可以由单剂量配方提供。该单剂量配方可以是由预先装填的注射器提供。该预先装填的注射器可以包括两个筒。第一个筒可以包括第二或第三方面的药用组合物。第二个筒可以包括一种或多种添加剂。如本文中所用的,术语“单剂量”用于指药用组合物所要使用的形式。单剂量可以包括本发明的药用组合物以特定的剂量、体积、颗粒大小、ph、粘度、和/或絮凝度。单剂量可以包括不可重复使用的包装,如注射器或双筒注射器。一种或多种药学上可接受的载体、稀释剂或赋形剂可以包括一种或多种表面活性剂或润湿剂。表面活性剂可以包括聚山梨酸酯。该聚山梨酸酯可以包括一个或多个聚山梨酸酯20和聚山梨酸酯80。在一具体实施例中,表面活性剂包括聚山梨酸酯80。药学上可接受的载体、稀释剂或赋形剂可以包括羧甲基纤维素(cmc)。药用组合物还包括一种或多种ph调节组合物和注射用水。该ph调节组合物可以包括盐酸和/或氢氧化钠。药用组合物包括6至8的ph。该ph可包括6至7.5。药用组合物可以包括平衡盐溶液。该平衡盐溶液可以包括盐水和缓冲液。平衡盐溶液可以包括一种或多种氯化钠;氯化钾;氯化钙(无水);氯化镁(六水);乙酸钠(三水);柠檬酸钠(无水);盐酸;氢氧化钠和注射用水。药用组合物可以是不含防腐剂的。本发明的药用合物可以包括缓释组合物。方法还包括向受试者施用至少一种添加剂。至少一种该添加剂可以包括抗vegf(抗血管内皮生长因子)抗体。该抗vegf抗体可以包括兰尼单抗(商标名)、阿柏西普(商标名)、贝伐单抗(商标名)和opt-302中的一种或多种。药用组合物可以包括羧甲基纤维素(cmc)。药用组合物可以包括表面活性剂。如本文所用的,术语“表面活性剂”是指优先吸附到两个不相容相之间界面的任何试剂,例如水与有机聚合物溶液之间的界面、水/空气界面或有机溶剂/空气界面。表面活性剂通常具有亲水部分和亲脂部分;因此,当吸附到微粒上时,表面活性剂倾向于向外部环境呈现不吸引类似涂层微粒的部分,从而减少微粒集聚。表面活性剂还可以促进治疗剂或诊断剂的吸收,并提高该制剂的生物利用度。表面活性剂可以包括聚山梨酸酯,例如一个或多个聚山梨酸酯20和聚山梨酸酯80。在一优选实施例中,表面活性剂包括聚山梨酸酯80。如本文所用的“预防”或“防治”,指的是防治或预防措施。需要预防或防治的人包括要预防干性amd的人,并且在一些实施例中,可能是对眼部疾病或病症易感或敏感的人,例如,有眼部疾病或病症家族病史的个体。如果完全或部分预防或减缓干性amd的发展,本文中的预防或防治就是成功的。本文中受试者的“治疗”指给药治疗。需要治疗的人包括那些已经患有干性amd的人,以及那些要阻止干性amd进展的人。因此,受试者可能已经被诊断为患有干性amd或可能患有干性amd或在没有治疗的情况下可能进展的损害。另外,受试者可能无症状,但有干性amd发展的风险因素,例如阳性家族史。如果干性amd或者干性amd的进展,得到缓解或治愈,包括其体征和症状和/或结构损伤,在与给药前的病症相比,被停止或减缓,则本文中的治疗是成功的。成功的治疗还包括完全或部分预防干性amd的发展。对于本文中的目的,减缓或降低干性amd或干性amd的发展与干性amd的中止、减少、或逆转相同。术语“有效量”是指以单剂或系列一部分的试剂或药剂的量,其对治疗或预防干性amd有效或倾向于此。这包括有效量,其与给药前的基线相比,可以有效地实现一个或多个症状减少,所述有效量由例如通过视力或其他测试而确定。有效量将根据接受治疗的个体的健康和身体状态、接受治疗的个体的分类组别、配方的成分、医疗情况的评估、及其他相关因素而变化。预计该量将落在一个可以通过常规试验确定的相对广的范围内。术语“受试者”、“患者”或“个体”在本文中可以互换使用,指任何需要治疗或预防的受试者,特别地,是脊椎动物受试者,甚至更特别地,是哺乳动物受试者。合适的脊椎动物落入本发明的所包括得范围,但不限于,任何脊索动物(chordata)亚门的成员,包括人类、以及非人类的灵长类、啮齿类(例如,老鼠、天竺鼠)、兔形类(例如,家兔、野兔)、牛科(例如,牛)、羊科(例如,绵羊)、山羊科(例如,山羊)、猪科(例如,猪)、马科(例如,马)、犬科(例如,狗)、猫科(例如,猫)、鸟类(例如,鸡、火鸡、鸭、鹅,同伴鸟类诸如金丝雀、虎皮鹦鹉等)、海洋哺乳动物(例如海豚、鲸鱼)、爬行类(蛇、青蛙、蜥蜴等)、和鱼。在特定的实施例中,“受试者”、“患者”或“个体”是需要治疗或预防眼睛疾病或病症的人类,包括患有糖尿病眼病或病症或眼肿瘤的受试者。在特定实施例中,术语“受试者”、“患者”或“个体”指任一单个人类受试者,包括有资格接受治疗的患者,该患者正在或已经经历干性amd或其易感性的一种或多种体征、症状、或其他指标。例如,无论原因如何,是新诊断的或以前诊断的,以及现在经历重现或复发的,或处于干性amd的风险中的。拟作为“受试者”、“患者”或“个体”的对象是指参与临床研究试验但未显示疾病的任何疾病临床迹象的受试者、或参与流行病学研究的受试者、或曾用作对照的受试者。“受试者”、“患者”或“个体”可能以前接受过干性amd药物治疗,或没有接受过这样的治疗。如本文所用的糖皮质激素和盐皮质激素,包括其治疗活性类似物、衍生物、同系物、药学上可接受的盐、前药、代谢物或共轭物。如本文所用的衍生物,包括化合物的治疗活性或药学活性片段,该化合物可调节盐皮质激素受体或糖皮质激素受体的活性。类似物可以是结构类似物或功能类似物。同系物可以包括相同化学类型的分子,但不同之处在于,原子的固定增量或恒定的原子组。一个例子是甲醇和乙醇,它们是同源的。下面的表1显示了一些示例化合物及其所测定的盐皮质激素和糖皮质激素的效力。在一个实施例中,本发明的组合物包括缓释组合物。基于本文的教导,技术人员能够容易地选择和/或制定一个合适的缓释组合物。在另一个实施例中,组合物或其组分可以被灭菌处理。从本文的教导,技术人员能够容易地选择一个合适的消毒方法,如热处理。在另一个实施例中,本发明的组合物不含防腐剂。在具体实施例中,本发明的组合物可以包括在注射器中。在一个实施例中,该注射器允许直接注射进眼睛中。“药学上可接受的载体、稀释剂或赋形剂”指一种固体或液体填料、稀释剂或封装物质,其可以安全用于全身给药。根据具体的给药途径,可以使用多种现有技术已知的载体。这些载体可以选自包括以下物质的组:糖、淀粉、纤维素及其衍生物、麦芽、明胶、滑石粉、硫酸钙、植物油、合成油、多元醇、海藻酸、磷酸缓冲溶液、乳化剂、生理盐水和盐,例如无机酸盐,该无机酸盐包括盐酸盐、溴化物和硫酸盐,有机酸例如醋酸盐、丙酸酯、丙二酸酯和无热原水。一种或多种药学上可接受的载体、稀释剂或赋形剂可以包括一种或多种润湿剂和粘度调节剂。描述药学上可接受的载体、稀释剂和赋形剂的有用参考文献是remington’spharmticssciences(mackpublishingco,新泽西州,美国,1991),其通过引用并入本文中。上述组合物可以以与剂量配方兼容的方式给药,并以药学上有效量进行给药。在本发明的上下文中,对患者给药的剂量应该足以在适当的时间段内对患者产生有益的反应。给药的数量可能取决于治疗的受试者,包括年龄、性别、体重及其一般健康状况,这些因素将取决于医师的判断。以下的非限制性实施例解释了本发明。这些实施例不应被解释为限制:包括这些实施例仅用于说明目的。该实施例将被理解为表示本发明的范例。实施例方法动物和曝光:所有实施的实验都依照arvo声明—动物在眼科和视力研究中的使用。将出生后130~160天的斯泼累格·多雷(sprague-dawley)(sd)大鼠暴露在1000lux的明亮连续光(bcl)中。该大鼠出生和饲养在昏暗周期性光照条件下(12小时光照:12小时黑暗),环境光照水平约为5lux。产后日龄(p)在90-150天之间的动物被暴露在bcl中。在bcl暴露之前,大鼠被暗适应了至少15小时,然后被转移到单独的笼子里,所述笼子被设计为允许光线畅通无阻地进入。笼子里没有阴影区域;不实施扩瞳。bcl暴露始终开始于上午9:00,并通过使用位于笼子上方的冷白荧光光源(18w,冷白;tfc)来实现,笼底的强度约为1000lux。bcl暴露持续24小时以上,此后动物立即回到暴露后的昏暗周期性条件。动物被保持在bcl暴露后的昏暗光线条件下的最长时间为56天。动物暴露于bcl中1、3、6、12、17或24小时后,取视网膜组织进行分析。一些动物在bcl24小时后立即被送回昏暗(5lux)的条件下3或7天,以评估暴露后的影响。年龄匹配、昏暗饲养的动物作为对照样本。组织收集和处理通过腹腔注射过量巴比妥酸盐(60毫克/千克体重;valabarb;virbac动物健康中心,摄政公园(regentspark),新南威尔士州,澳大利亚)对动物进行安乐死。在每只动物的左眼表面上作定位标记,然后摘出眼球并进行冰冻切片,右眼视网膜通过角膜切口摘除并准备提取rna。用于冰冻切片的眼睛在室温下立即浸泡在0.1mpbs(ph7.3)的4%多聚甲醛中固定3小时,然后在放在15%蔗糖溶液中过夜冰冻保护前用0.1mpbs冲洗。眼睛被定向并包埋在o.c.t.化合物(tissue-tek,sakura,日本)中,然后马上冰冻于液氮中并冰冻切片至16μm。用于rna提取的视网膜立即存放在rna稳定剂中(rnalater;ambion,奥斯汀,德克萨斯州),在冰上预冷冻,并按照厂商的说明书储存。然后从每个样品中提取rna,该样品在4℃下孵育过夜,以使防腐剂能够充分渗透,然后在80℃下储存直到需要。为了确保可比性,涵盖了整个时间过程的样本被分批处理。提取时,视网膜样本在冰上解冻,并去除rna稳定剂。如另一出版物中所述,使用分别用于提取和纯化rna的提取剂(trizol;商品目录号.15596-026;invitgen,卡尔斯巴德,加利福尼亚州)与纯化试剂盒(rnaquous-smallscale,商品目录号.1912;ambion)的组合进行rna提取。用分光光度计(nd-1000;nanodroptechnologies,威明顿,特拉华州)分析分离的总rna的数量和纯度,260/280比率大于1.90的样品被认为是足够的。对每个样本中的rna质量进行评估(2100生物分析仪;agilenttechnologies,圣克拉拉,加利福尼亚州),仅使用完整性数量(rin)≥8的样本。微阵列实验与分析微阵列分析使用来自先前研究(natolir、zhuy、valterk、bistis、eelisj、stonej,geneandnoncodingrnaregulationunderlyingphotoreceptorprotection:microarraystudyofdietaryantioxidantsaffronandphotobiomodulationinratretina.molvis,2010;16:1801-1822)的原始微阵列数据,使用大鼠基因芯片(大鼠基因1.0st;affymetrix,圣克拉拉,加利福尼亚州)。完整的微阵列数据已经存放在ncbi基因表达综合库中,登录号为gse22818(国家生物技术信息中心,国家卫生研究院,贝塞斯达,马里兰州)。该分析比较了昏暗饲养和24小时bcl实验组(n!3每组)。分析微阵列数据(partekgenologysuite6.4软件;partek有限公司,圣路易斯,密苏里州),将cel文件(affymetrix)导入软件并进行背景校正、归一化和汇总,使用稳健性多阵列平均(robustmultiarrayaverage)(rma)算法对针对探针序列和gc含量调整(gc-rma)。处理值显示为表示外显子编码序列的单个探针集,其用碱基2(base2)进行对数转化。使用方差统计(anova)分析进行差异表达分析,显著性水平为p”0.05。使用欧氏距离度量法(euclideandistancemetric)和主成分分析(pca;两者均由genologysuite提供;partek),通过聚聚式层次聚类法(agglomerativehierarchicalclustering)评估所得到的差异表达数据的异质性(heterogeneity)。根据geneontologyconsortium所描述的生物学过程,将差异表达数据进行聚类,利用由软件(partekgsgenologysuite)提供的基因本体(go)富集进行功能分析。此后,使用#50%的差异表达截止值,并辅助从基因本体协会总结的通路信息和来自hugo基因命名委员会的基因分组,筛选那些与补体级联相关的差异表达基因列表。实时定量聚合酶链式反应根据厂商的说明书进行第一链cdna合成(superscriptiiireversetranscriptasekit,cat,no.18080-044;invitrogen)。20μl反应混合物与1μgrna、500ng低聚(dt)18引物,和200u的逆转录酶结合使用。使用商用水解探针(taqman;applicationbiossystems,有限公司,[abi],福斯特市,加利福尼亚州)或有定制设计引物的sybrgreen,(其详细信息分别参见表2和表3中)测量基因扩增。根据先前建立的qpcr方案应用水解探针。sybrgreenqpcr(表3)的引物是使用primer3基于网络的设计程序在横跨内含子的编码域序列内设计的(参见rosen等)。使用商用qpcr系统(steponeplus;abi)进行qpcr。对每个生物样本的扩增都是实验性的三倍,然后用平均cq(定量周期)值来确定在表达中的变化率。对于两个qpcr(taqman和sybrgreen;abi),使用cq方法确定与昏暗饲养样品相比的百分比变化。目标基因的表达被归一化为参考基因甘油醛-3-磷酸脱氢酶(gapdh)的表达,其在本研究或以前的光诱导视网膜损伤调查中没有显示出差异表达。使用凝胶电泳法检测扩增特异性。使用单因素方差分析(one-wayanova)进行统计分析,以评估表达趋势的显著性。p"0.05的差异被认为具有统计学显著性。原位杂交为了研究bcl后c3mrna转录在视网膜中的定位,生成一种针对c3的用于在视网膜冰冻切片中原位杂交的核糖核苷酸探针。利用从大鼠视网膜(如上所述)制备的cdna、pgem-tdna载体系统(promega,麦迪逊,威斯康星州)、和top10感受态细胞(oneshot;invitgen),从pcr产物(483bp扩增子)中克隆了c3。使用digrna标记试剂盒(sp6/t7;roche,巴塞尔,瑞士)转录线性化的质粒并产生dig标记的反义和正义核糖核苷酸探针。原位杂交以上述方法进行;该c3核糖核苷酸探针57℃杂交过夜,然后在60℃柠檬酸钠盐溶液(ph7.4)中洗涤。杂交后,某些切片进一步地进行免疫组化染色(详见后文)。细胞死亡分析以先前公开的方案,在bcl期间和之后,用tunel标记来定量冰冻切片中的光感受器凋亡。在外核层(onl)的tunel阳性细胞的计数是沿着在矢状上平面(上矢状面)切的视网膜切片的全长(包括视盘)进行,在相邻区域测量1000%1000!m。每只动物的最终计数是在两个不连续的切片中可比较位置的平均值。用单因素anova进行统计分析。p"0.05的差异被认为具有统计学显著性。免疫组化各时间点的冰冻切片用于免疫组化分析,使用补体c3(1:50;abeam,坎布里奇,马萨诸塞州)、c3d(1:100;r&d系统,明尼阿波利斯,明尼苏达州)、ed1(1:200;millipore,比勒里卡,马萨诸塞州)和iba1(1:1000;wako,大阪,日本)的一抗。免疫组化采用前述的方法进行。用激光扫描显微镜(carlzeissmeditec有限公司)观察免疫荧光,并使用pascal软件(4.0版本;carlzeissmeditec有限公司)获取。图像被增强以供公开(photoshop;adobe,圣何塞,加利福尼亚州),这是图像之间的标准化。结果图1显示了体内实验结果:用皮质类固醇治疗(ta左,fa右)或不治疗(仅限kenalog载体),对光氧化损伤后的细胞死亡(tunel)、巨噬细胞募集(iba1)和功能(erg)进行测定。图1中的数据比较了ta和fa在我们的光损伤(光氧化损伤)模型中减少细胞死亡和保护功能的效果。该结果表明,fa在预防巨噬细胞募集和光感受器死亡(tunel),以及保护视网膜功能上,比ta更有效。数据与体外实验结果一致。治疗后也对视网膜和一些视网膜的组织学图像,进行了qpcr分析。ib期,地图状萎缩(ga)的病人玻璃体腔内注射醋酸氟氢可的松(fa)和曲安西龙(ta)的安全性和耐受性研究试验用产品、剂量及给药途径:醋酸氟氢可的松(fa)1mg/0.1ml&2mg/0.1ml,玻璃体腔内(ivt)注射。ta将遵循相同的方案。剂量原理:根据先前的临床前期模型选择浓度在1mg/0.1ml和2mg/0.1ml的0.1ml单剂量。在裂隙灯检查、间接眼底镜、或通过光镜在所有注射400μg/0.1ml、1mg/0.1ml和2mg/0.1ml的眼睛中没有视网膜毒性迹象。但是,报道了1例在4mg/0.1ml中玻璃体腔内出血。全身注射醋酸氟氢可的松有严重的盐皮质激素和糖皮质激素副作用,如高血压、钾素流失、库氏综合征样变化(cushingoidchanges)等。玻璃体腔内注射可以避免全身副作用。目的:为了确定在有年龄相关性黄斑变性(amd)继发地图状萎缩受试者中1mg/0.1ml和2mg/0.1mlfa单剂量ivt注射的安全性和耐受性。研究人群:研究人群将包括无先前治疗的双眼amd继发ga的患者。该研究计划招募多达9名参与者。研究设计:本研究将招募9名参与者,基于3+3算法评估剂量递增。在研究期间的任何时候,如果>2名患者出现剂量限制毒性,招募将停止。剂量限制毒性被定义为眼内炎症、高iop(眼压)、视力下降(丢失>15个字母)、或注射后28天内出血。第1部分涉及单个参与者评估1mg/0.1mlfa的安全性和耐受性。该参与者接受长达28天的追踪调查,并在招募另外2名参与者之前接受安全审查委员会审查,在第一组中,总计3名参与者接受了1mg/0.1mlfa治疗。第2部分涉及单个参与者评估2mg/0.1mlfa的安全性和耐受性。该参与者接受长达28天的追踪调查,并在招募另外5名参与者之前接受安全审查委员会审查,在第二组中,总计6名参与者接受了2mg/0.1mlfa治疗。为这项研究选择的样本量(n=9)是没有正式统计评价的情况下选择的,但选择的数量被认为足以评估研究目的。样本量是基于初步研究的实际和逻辑考量确定的,而不是基于假设检验的统计能力或参数估计的精确性。研究干预的说明:醋酸氟氢可的松(9-α-氟-11β.17α,21-三羟基-4-孕烯-3,20-二酮醋酸酯)是一种合成激素,其具有强效的盐皮质激素效果和高糖皮质激素活性。醋酸氟氢可的松的生理作用与氢化可的松相似,但要强得多。fa有比皮质醇高10倍的糖皮质激素活性和比皮质醇高250倍的盐皮质醇效果。皮质醇的c-9中氟的加入给了氟氢可的松一个在糖皮质激素、盐皮质激素和抗炎的效力上显著的提高。该药物将通过玻璃体腔内注射给药。研究期:6个月招募期和6个月追踪期。参与者时期:参与者将接受为期6个月的研究。筛查:最多14天。治疗:1天。追踪:6个月。纳入标准:除非有特定说明,眼部特定的纳入标准仅适用于研究眼。1.愿意并有能力在进行任何特定程序之前给予同意。2.男性或女性。3.年龄>50岁。4.最佳矫正视力(bcva)为24个字母,或最好使用早期治疗糖尿病视网膜病变研究(etdrs)表(相当于20/320snellen)。5.双眼amd继发黄斑的ga的诊断,在给药前14天内由pi(首席调查员)使用眼底自发荧光(faf)图像确认,并符合以下标准:a.总ga面积必须≥1.9并≤17mm2(分别为1和7个视盘面积(da)),由faf的筛选图像确定。b.如果ga是多灶的,至少一个病灶必须是≥1.25mm2(0.5da)。c.ga能完全显示在黄斑中心的图像上。d.ga必须能够整体拍摄。e.ga必须能够从乳头周围萎缩的任何区域分别测量。f.在ga交界区存在任何形式的高自体发光(hyperautofluorescence)。无高自体发光(即模式=无)是排除性的。6.女性受试者必须是:a.非生育潜力的妇女(woncbp),或b.妊娠测试阴性,并必须同意在研究期间使用方案规定的避孕方法的生育潜力妇女(wocbp)。7.有生育潜力的女性伴侣的男性必须同意使用方案规定的避孕方法,并同意在研究期间避免捐献精子。8.愿意并有能力给予知情同意。注意:如果两只眼睛都符合纳入标准,在筛查就诊期间视力最好的眼睛指定为研究眼。如果两只眼睛的视力相同,右眼将被用作研究眼。排除标准:除非有特定说明,眼部特异性排除标准仅适用于研究眼。1.不是amd引起的ga,如stargardt病、视锥视杆细胞营养不良(coneroddystrophy)或中毒性黄斑病变,诸如必赖克瘻黄斑病变(plaquenilmaculopathy)。2.显示近视屈光度>6或眼轴长度>26mm的折射误差的球面等效。3.根据pi在12个月内对两眼之一的荧光素血管造影评估的渗出性(湿性)amd的证据,包括视网膜色素上皮撕裂的证据或在视网膜中任何地方新生血管的证据。4.视网膜疾病可能混淆视觉性能或受眼内激素影响。5任何降低介质清晰度而且被调查者认为干扰眼科检查(例如,晚期白内障或角膜病变)的眼科病症。6.任何由pi判断的阻碍视网膜充分成像的眼科病症。7.给药前3个月内的眼内手术(包括晶状体置换手术)。8.无晶状体或缺少后囊。以前的后囊破裂也被排除,除非它是因为钇铝石榴石(yag)激光后囊膜切开术联合先前的后房型人工晶状体植入发生的,且至少在第0天前60天发生的。9.在研究期间可能需要手术的任何眼科病症。10.青光眼或青光眼家族史。11.任何ivt注射的禁忌症,包括当下的眼部或眼周感染。12.葡萄膜炎或眼内炎历史。13.双眼之一的脉络膜新生血管(cnv)历史。14.12个月内的ivt注射历史。15.在研究治疗开始前的6个星期或5个活性半衰期内(按较长时间),参与另一项干预性临床研究,或使用amd试验性治疗或任何其他试验性新药。注意:仅涉及观察、非处方维生素、补充剂,或饮食的临床试验不排除。16.适用于氟氢可的松使用的全身病症,如高血压、和真菌感染。17.以调查员观点,不太可能在研究期间进行持续追踪的,或一般来说因为其他全身疾病或活跃的不受控制的感染而医疗风险低的医疗或精神状况。18.调查员认为,任何具有临床意义且不适合参与研究的筛选试验室值(血液学、血清化学或尿液分析)。19.对荧光素有超敏反应。终点:本研究的主要终点是基于生命体征、临床安全实验室、和不良事件的评估,在年龄相关性黄斑变性(amd)继发地图状萎缩(ga)的受试者中醋酸氟氯可的松玻璃体腔内(ivt)注射剂量的安全性和耐受性。主要安全终点:局部和全身治疗新生事件(teae)的数量和严重程度。次要终点:如faf测量的从基线到第6个月的地图状萎缩(ga)病变大小变化;最佳矫正视力(bcva)变化;低亮度最佳矫正视力(ll-bcva)的变化;ga病变大小变化与bcva变化的关系;iop的增加。药代动力学(pk)参数:单剂量醋酸氟氢化可的松ivt注射后暴露;血清最大观察浓度;到最大测量浓度的时间;末端消除半衰期。计划中期分析:本研究没有计划正式的中期分析。然而,本研究将计划一个用于安全数据审查的数据安全监测委员会(dsmb)。分析人群-计划以下分析人群:安全人群:ivt醋酸氟氯可的松的所有登记的参与者将被包括在安全人群内;意向治疗(itt)人群:接受了ivt醋酸氟氯可的松和给药后有至少一次效力测量的所有登记的参与者将被包括在itt人群内。统计分析-安全分析:安全分析的统计方法实质上将主要是描述性的。所有安全数据的列表和汇总将使用安全人口来展示。描述性统计(平均值、sd、中位数、最小值和最大值)将被用来计算连续安全数据汇总,而频率计数和百分比(当合适时)将用来计算离散/分类安全数据汇总。安全数据,包括生命体征、临床安全实验室和不良事件,将被汇总。从基线开始的变化将被包括在用于生命体征和实验室参数的汇总表中。所有实验室数据将被包括在数据清单中,且所有超出正常范围的测试值将被标记。每位参与者的身体检查将被列入列表。不良事件(ae)将通过管理活动医学词典(medicaldictionaryforregulatoryactivities(meddra))进行编码,且数据将通过系统器官分类和优选术语汇总。疗效分析:对最佳矫正视力(bcva)进行探索性分析,并参照早期治疗糖尿病视网膜病变评分(etdrsletters)进行评分。地图状萎缩病变大小将通过眼底荧光成像以mm2测定。描述性统计(平均值、sd、中位数、最小值和最大值)将被汇总以用于etdrs字母和ga面积,以mm2的观测值,以及每次注射后就诊时从基线开始的变化。通过采用混合模型,评估etdrs字母和ga随时间的病变大小的探索性分析。将在每次就诊时,预估etdrs的最小二乘平均值,和从基线开始的ga病变大小以及它的95%置信区间。将对眼压实施类似的分析。分类疗效终点,诸如裂隙灯生物显微镜检测结果、扩张眼底镜检测结果、彩色眼底摄影和oct结果,将通过合适的频率计数和百分比(比例)进行描述性汇总。活动时间表:其被汇总在表4中。配方:该配方采用无菌工艺制造。其被包装在带包覆橡胶的瓶塞和塑料翻转盘的玻璃瓶中,且仅被用于单剂量给药。部分a:将10mg氟氢化可的松将放置在一个小瓶中,并送去进行伽玛灭菌。部分b:将是一个装有无菌稀释剂的小瓶。这些过程将由经过培训的药剂师和消毒设施技术员在a级防护服,b级房间中实施。试验用产品将被由gmp认证的复方药房生产。储存和处理:氟氢可的松按10mg粉末调制成溶液配方,用于玻璃体腔内给药。每瓶含有10mg氟氢化可的松粉末。稀释剂由等渗无菌生理盐水(0.9%的氯化钠溶液)组成。玻璃体腔内注射用溶液的氟氢化可的松粉末根据需要的浓度与1.0ml或0.5ml的注射用稀释液配伍。配伍后,在0.1ml玻璃体腔内注射量,以lmg/0.1ml或2mg/0.1ml剂量递送为宜。用于溶液和稀释剂的氟氢可的松粉末是一次使用的,必须避光储存在2-8℃。药物剂型:氟氢可的松作为用于注射溶液的10mg粉末,用于玻璃体腔内给药。每瓶含有10mg氟氢化可的松粉末。稀释剂由等渗无菌生理盐水(0.9%的氯化钠溶液)组成。玻璃体腔内注射用溶液的氟氢化可的松粉末,根据需要的浓度,与1.0ml或0.5ml的注射用稀释液配伍。配伍后,在0.1ml玻璃体腔内注射量,以lmg/0.1ml或2mg/0.1ml剂量递送为宜。用于溶液和稀释剂的氟氢可的松粉末是一次使用的,必须避光储存在2-8℃。治疗适应症:玻璃体腔内注射氟氢可的松被开发用于年龄相关性黄斑变性(amd)的治疗。剂量和给药:氟氢可的松可以以一次性使用加塞玻璃瓶提供,其含50mg的无菌氟氢可的松。氟氢可的松的指示ivt剂量,以最多0.1ml的1mg/0.1ml及2mg/0.1ml氟氢可的松的玻璃体腔内注射给药。玻璃体腔内毒理学:在新西兰白兔的研究中,测试了0(载体对照)、400μg、1mg、2mg、4mg/眼的醋酸氟氢可的松玻璃体腔内剂量。所有动物在用间接检眼镜和裂隙灯生物显微镜注射前后进行检查。用视网膜电图(erg)对所有在玻璃体腔注射前和注射后2周的动物进行检查。此时对该动物用间接检眼镜和裂隙灯生物显微镜进行复查,并进行安乐死。摘除其眼球并用于光镜检查。在4mg/0.1ml的氟氢可的松的组中的一只眼,在erg中表现出明显的降低;该组中的一只眼有玻璃体积血。在其他组中的erg中无明显下降。在用4mg/0.1ml或更少的氟氢可的松注射后,所有的眼在裂隙灯检查、间接眼底镜、或光镜下没有视网膜毒性迹象。在白兔眼中的玻璃体腔内注射2mg/0.1ml氟氢可的松表现为安全。动物研究实施一项动物研究,以评估玻璃体腔内注射进入玻璃体腔内后,醋酸氟氢可的松的安全性和有效性[参见kivilcim,m.,etal.,evaluationoftheretinaltoxicityoffludrocortisoneacetateafterintravitrealinjection.investigativeophthalmology&visualscience,2006.47(13):p.4281-4281]。对25只新西兰白兔的眼睛进行手术。用无菌bss溶液滴定醋酸氟氢可的松,滴定至以下浓度:4mg/0.1ml、2mg/0.1ml、1mg/0.1ml、和400μg/0.1ml,将这些浓度的醋酸氟氢可的松通过玻璃体腔内注射进二十五只兔的一只眼中。对照眼接受0.1ml的无菌bss。所有动物在注射前后,用间接检眼镜和裂隙灯生物显微镜进行检查。在玻璃体腔内注射前和注射后2周,对所有动物进行视网膜电图(erg)检查。此时对该动物用间接检眼镜和裂隙灯生物显微镜进行复查,并进行安乐死。摘除它们的眼球并用光镜检查。从这些体内试验的结果对玻璃体腔内醋酸氟氢可的松的应用为阳性。在多次测定中,长达40天的观察,裂隙灯生物显微镜和间接眼底镜没有在对照组或治疗组中显示出眼睛的前段或后段明显炎症的任何迹象。所有组的iop均正常。在光镜下,视网膜切片组织学检查显示,除在4mg组中的一只眼外,视网膜各层保持完整性,没有毒性或空泡化(vacuolization)的迹象。在2-mg组中22+/-8天,以及4-mg组中33+/-7天中,醋酸氟氢可的松的所有团聚体消失。在erg检测中,注射4mg/0.1ml的一只眼在erg输出中表现出降低。所有其他眼具有正常的erg。这些结果代表了玻璃体腔内醋酸氟氢可的松适合于在临床上短期和长期使用的满意结果。来自小鼠干性amd光损伤模型的数据显示,在kenalog载体中递送fa导致细胞死亡显著减少,且携带ibal标记物7天后的巨噬细胞显著减少。组织学显示,用fa处理的动物具有更厚的外核层。处理的动物具有明显更稳健的视网膜电图a波(光感受器功能)和b波(内层视网膜功能)。基本原理:这项研究的基本原理:醋酸氟氢可的松是从pbs以片剂形式(0.1mg)获得,且在澳大利亚被批准用于人体。在一项121名患者的研究中,报道了氟氢可的松用于前段病变的极佳结果(参见gonzalez,c.,topicalfludrocortisone(9-alphafluorohydrocortisone)inophthalmology.amjophthalmol,1960.49:p.619-22)。本文引用了4篇类似经验的先前论文。有更古老的临床前期数据认为fa是有效的。其中,fitzgeraldetal.在通过佛波醇12-十四酸酯-乙酸酯(pma)刺激的猴脉络膜内皮细胞(cec)的研究中,发现fa在恢复静止形态和降低膜通透性上优于ta(fitzgerald,m.,etal.,mineralocorticoidsrestorequiescentmorphologyandreducevegfreceptorexpressionininflamedchoroidalendothelialcellsinvitro.ophthalmicres,2009.41(1):p.44-52)。教授janprovis.et.al有大量新的基础资料表明fa在干性amd大鼠模型中优于ta。fa在防止细胞死亡、巨噬细胞募集、和维持a波和b波erg波幅方面,是更有优势的。以上引用的kivilcim,检查了在25只正常兔中4mg/0.1ml、2mg/0.1ml、1mg/0.1ml和400μg/0.1ml的玻璃体腔内fa。4mg/0.1ml的两只眼发生玻璃体腔内出血且erg降低。没有其他erg降低的问题。兔眼的更小体积表明了4mg/0.1ml对人类是安全的。ta通常以4mg/0.1ml施用,所以比较相同剂量的每种激素是合理的。在现有的醋酸氟氢可的松临床研究中,皮质激素抑制补体激活,将用于ga患者的给药。本研究的目标是评估单剂量ivt注射醋酸氟氢可的松的安全性和耐受性。该研究中的结果将指导决策,进一步地开发用于ga的玻璃体腔内注射醋酸氟氢可的松。剂量选择:本研究中将对1mg/0.1ml或2mg/0.1ml的单剂量单次注射给药进行测试。在一组动物毒理学研究中,玻璃体腔内醋酸氟氢可的松耐受性良好。人的玻璃体体积约为4ml,其是兔的平均玻璃体体积(1.5ml)的大约2.7倍。基于人与兔之间玻璃体体积的差异,人的等效剂量被确定为每4周67mg/眼。将在这项临床研究中评估的醋酸氟氢可的松的剂量(1-或2mg/0.1ml注射剂),预计会导致药物浓度比在兔中观察的药物浓度低约1.3倍。风险/益处:该方案采用的安全监测措施(例如,全面眼科检查、iop监测、oct、生命体征、血液学、血清化学、和ae问询)足以保护受试者的安全。本研究参与者有需要眼科手术的风险。然而,这些都是在眼科中广泛执行的标准程序。在任何ivt注射后的几天中,患者有发生眼内炎的风险。如果眼睛变红、对光敏感、疼痛,或视力发生变化,患者将被指示立即寻求眼科医生的治疗。ivt注射的其他风险包括外伤性白内障、视网膜脱离和出血。暂时性iop升高也被认定为是ivt注射后的一种风险。本研究中将会仔细监测iop。在该研究的6个月中,计划从每个受试者采集的大约150ml血液,其不会在该患者群体中造成不适当的风险。基于迄今可获得的数据,在动物模型中,醋酸氟氢可的松的ivt给药似乎没有带来不合理的眼部或全身风险。醋酸氟氢可的松已安全地作为盐皮质激素的替代品,用于阿迪森氏病(addison'sdisease)和其他盐-水失衡中的严重的直立性低血压。然而,由于醋酸氟氢可的松从未用于人类参与者的玻璃体腔内,因此存在潜在的不可预见的风险。为了减轻这种风险,这项研究以两部分进行,在应用于其他参与者之前,将治疗限制在单个个体,同时延长评估时间。在评估计划表中,还为所有参与者制定了多次追踪访问和多次测试程序,以确保及时发现和解决出现的不良事件或其他安全问题。接受研究药物对试验参与者有潜在的健康益处。我们建议对ga患者以玻璃体腔内醋酸氟氢可的松进行给药。如果有效,玻璃体腔内醋酸氟氢可的松有望改变ga的进程,并减缓其进展速度。目的和终点:研究目的:本研究的主要目的是评估在与年龄相关性黄斑变性有关的ga受试者中ivt注射醋酸氟氢可的松的安全性和耐受性,以支持进一步发展到阶段ii的验证研究。研究终点:主要安全终点:基于通过眼底自发荧光(faf)测量的ga病变大小的平均变化,证明醋酸氟可的松ivt注射的安全性和耐受性。局部和全身治疗新发不良事件的数量和严重程度。次要终点:通过faf测定的从基线到6个月的地图状萎缩(ga)病变大小的平方根的变化。最佳矫正视力(bcva)变化;低亮度最佳矫正视力(ll-bcva)的变化。ga病变大小变化与bcva变化之间的关系。生命体征的变化。iop的增加。药代动力学(pk)参数。单剂量醋酸氟氢化可的松ivt注射后暴露。血清最大观察浓度。到最大测量浓度的时间。末端消除半衰期。研究人群:研究人群包括在大约一个(1)个站点登记的大约9(n=9)名受试者。为了参与这项研究,受试者必须被诊断出有双眼有amd相关的黄斑ga。如果两只眼睛都符合研究标准和资格,筛查就诊时视力最好的一只眼将被指定为研究眼。如果两只眼睛有相同的视力,右眼将被用作研究眼。上文给出了完整的纳入和排除标准。生育潜力妇女(wocbp):wocbp被定义为生理上有能力妊娠的绝经前妇女。非生育潜力的妇女woncbp被定义为符合以下任一标准的妇女:45岁以上闭经>2年或60岁以上闭经>1年,均经fsh和lh水平确认;接受过子宫切除术;接受过双侧卵巢切除术;和接受过双侧输卵管切除术。经批准的避孕方法:经批准的避孕方法包括:口服避孕药、宫内节育器、医学上可接受的屏障方法(即,避孕套)、可植入或可注射的避孕药或可拆卸的节育装置。禁欲和性交中断(拔出法)的受试者必须同意在研究期间使用经批准的避孕方法。受试者治疗:治疗分配:每个受试者在筛查前都会被分配一个唯一的筛查编号。完成研究筛查评估并符合所有资格标准的受试者将被安排进行研究,并将在第0天接受玻璃体腔内注射醋酸氟氢化可的松治疗。给药治疗:剂量水平和研究装备:本研究中测试1-和2mg醋酸氟氢可的松/0.1ml的单剂量。受试者将接受如表5所示的1ivt注射。药品供应:试验产品的同一性:醋酸氟氯可的松用于玻璃体腔内给药,以20mg的粉末用于注射溶液。每瓶含有50mg的氟氢化可的松粉末。稀释剂由羧甲基纤维素(0.6%)、聚山梨酯80(0.02%)和氯化钠溶液(0.9%)组成,足量至100%。玻璃体腔内注射用溶液的氟氢化可的松粉末根据需要的浓度与1.0ml或0.5ml的注射用稀释液配伍。配伍后,在0.1ml玻璃体腔内注射量以lmg/0.1ml或2mg/0.1ml剂量为宜。用于溶液和稀释剂的氟氢可的松粉末是一次使用的,必须避光储存在2-8℃。责任:ivt醋酸氟氢可的松药物产品将被提供给研究现场的指定人员,并必须储存在药房或以其他方式锁定和保护在温度在2℃至8℃之间的冷藏区,所述冷藏区有有限制的、可控的通道和温度监控;无需冷冻。ivt醋酸氟氢可的松药物应存放在提供的纸箱中以保护其免受光线照射。该药品产品供应仅对经pi授权的个人开放。赞助商将提供足够数量的醋酸氟氢可的松药物产品以完成本研究。指定的研究人员将依照其分配的受试者数量和随机时间表为受试者提供研究治疗。在研究期间,每个受试者的临床试点提供的药物和研究治疗分配的收据,将被归档在药物责任记录中。这些药品责任记录应与患者病历和其他原始文件分开保存。所有使用过的小瓶应由临床试点保留,直到执行药物责任监测,然后退还给赞助商或指定人,或按照赞助商说明书销毁。当研究结束时,任何未使用的试验用产品将由临床试点保留,退还给赞助商或指定人,或按照赞助商说明书销毁,且其将记录在药品责任记录中。玻璃体腔内注射醋酸氟氢可的松给药:接受积极治疗的受试者将根据pi,酌情使用27g薄壁针,以1mg/0.1ml或2mg/0.1ml的醋酸氟氢可的松的ivt注射进行给药。参与注射盘组装、麻醉剂制备以及药物制备和给药研究的诊所工作人员,将遵循适当的无菌技术,以最大限度地降低与ivt注射相关的潜在不良事件(如眼内炎)的风险。试验药物将放在一个试剂盒中,该试剂盒含有27g的12mm针头的1x1ml注射器、含有无菌氟氢可的松10mg的1x5ml小瓶、用于配伍的含有2ml稀释剂的1x小瓶,和在穿刺塞子前擦拭小瓶顶部的酒精棉签。溶液制备:注射医生将取出1.0ml或0.5ml稀释剂并配伍粉末。然后医生将抽出准备好的待注射的0.1ml液体。为了最大限度的降低醋酸氟氢可的松ivt注射后的iop的升高,必须在注射所有醋酸氟氢可的松之前进行眼的减压。这是通过在美容准备过程中,用棉签对眼球施加中等压力30-60秒来实现的。除了本方案中概述的步骤外,还要遵守与ivt注射有关的特定机构政策。伴随疗法:参与者在研究开始时正在接受的任何伴随药物或在研究期间出于任何原因给予的任何伴随药物(除方案要求的眼科手术常规药物,如局部美容)必须被记录在原始文件和crf中,其包括开始和停止日期和时间、剂量、途径和适应症。此外,所有眼科和非眼科手术,如外科手术(不包括研究治疗过程)也必须被记录在原始文件中,包括开始和停止日期。手术麻醉剂、辅助医疗或替代疗法(如针灸、按摩)也应被记录在原始文档和crf中。胃复安(metoclopramide)或其他预防荧光素注射引起的恶心的药物可以由pi自行决定给药。眼内炎治疗:根据pi的临床判断指导,治疗参加者的眼内炎或疑似眼内炎的决定。治疗方法(玻璃体切除术与玻璃体抽吸术)和抗菌剂的选择也由pi自行决定,并应遵循当前的标准实践模式。使用ivt激素(如地塞米松)治疗眼内炎的决定也由pi自行决定。研究程序:研究设计:这是一项ib阶段研究,以评估醋酸氟氢可的松ivt注射单剂量在与年龄相关性黄斑变性相关的ga患者中的安全性和耐受性。在眼研究中被诊断为与年龄相关性黄斑变性相关的ga,且符合所有纳入/排除标准的患者将被包括在该研究中。该研究计划招募一个剂量为1mg/0.1ml的3名患者的初始组。基于3+3算法,一共包括9名参与者以评估剂量递增。患者应该在接受醋酸氟氢可的松前进行长达14天的筛查。即将进入这项研究时,分配患者一个受试者筛查编号。符合所有纳入和排除标准且被crc确认为合格的受试者,将返回诊所进行如下所述的单剂量ivt醋酸氟氢可的松给药(第0天)。所有受试者将在注射后第1天和第7天返回临床试点以评估急性安全性。之后,所有受试者将在注射后6个月回来进行6次追踪访问。请参见下面的研究大纲。将在整个研究过程中对安全性进行评估;将收集系列血液样本和尿液样本。也将采集血液样本用于醋酸氟氯可的松的pk评估。每个受试者计划参与研究的时间约为6个月(从第0天到第6个月(第150天)追踪程序结束为止)。本研究计划进行大约12个月(从第一个受试者的筛选到最后一个受试者的出访结束为止)。受试者招募:调查者有责任确保受试者在登记之前和整个研究过程中都有资格参与研究。在开始筛查过程之前,需要使用研究特定的icf,要求归档每个受试者本人签名并注明日期的知情同意书。在获得书面知情同意书并参与资格认定后,研究试点人员将获得受试者的识别号。只有符合条件的受试者将会被分配到开放标记fa1mg/0.1ml或2mg/0.1ml。招募将依序分两部分进行,以便将受试者将暴露于风险的可能性降至最低。在部分1和部分2中,受试者将被逐一筛选,因为在试验部分1中,只有一名患者最初被招募。第一个登记的受试者将参与长达14天的筛查期和28天的追踪期,以检测眼压反应。在第一个受试者完成fa1mg/0.1ml注射后的28天的追踪后,将审查该受试者的安全性数据。该安全性数据将由一个独立的安全审查委员会进行审查,以决定是否着手在第一个fa1mg/0.1ml剂量的组中招募另外2名患者。如果>2名患者出现与研究药物相关的限制毒性不良事件,将停止招募。如果认为与研究药物相关的限制毒性不良事件不超过两个,将招募第二组。剂量限制毒性的定义为眼内炎症、iop升高、视力下降(>15个字母丢失)、或注射后28天内出血。如果3名受试者对剂量的耐受良好,部分2将开始。部分2最初涉及一个单个受试者,其剂量为2mg/0.1mlfa,以评估安全性和耐受性。该受试者将被追踪最多28天,并由一个独立的安全审查委员会进行审查,然后在第二组中招募另外5名接受2mg/0.1mlfa治疗的受试者,总共6名受试者。会议记录将在每次会议上生成,并包括在赞助商的研究文件中。正式报告将不会在这些会议之前或之后被准备好。作为一般指导,如果受试者没有临床上与药物相关的不良事件或实验室检查异常,将被视为已经耐受了某剂量。相反地,如果受试者在研究药物给药或给药后追踪期出现临床上明显的与药物有关不良事件或实验室检查异常,该剂量则不会认为具有耐受性。所有参与者将在150天的审查中审查白内障的安全性。应当理解,安全性是不能前瞻性详细定义的医学判断。受试者将通过临床观察和安全实验室测试进行密切监测。研究就诊日程表以下是研究就诊将要执行的步骤和检查的简要说明。请参照每月就诊日程步骤/评估的详细日程表的活动计划(soa)表格。如果pi自行决定认为有必要,可以实施此处未列出的附加安全评估。筛查-在治疗前的14天内就诊1-所有受试者:对双眼进行所有眼科步骤(包括成像):1.在执行任何研究的具体步骤之前,解释研究的目的和性质,并让患者阅读、签署机构审查委员会/独立道德委员会(irb/iec)批准的知情同意书(icf)并注明日期。个人征得患者和证人的同意,如果适用,在icf上签字并注明日期。2.获取受试者的筛查编号。3.获得在招募前90天内的人口统计学、医学/眼科病史、和使用的伴随药物的信息。其包括维生素、以及所有的非处方药和处方药。4.筛查患者的纳入/排除标准。5.采集血液(包括hcg/fsh/lh血液(如果适用))及尿液用作实验室分析并将样本送至中心实验室。6.收集生命体征。7.实施bcva。8.实施ll-bcva。9.实施全面的眼科检查,包括角膜、虹膜、前房、晶状体(如果注意到晶体上有混浊,进行locsiii)的裂隙灯检查和水相反应(细胞和光带)、玻璃体和视网膜的扩张眼底检查、以及iop测量。10.实施sd-oct成像,由pi确定资格。11.实施faf成像,由pi确定资格。12.实施nifr成像。13.实施dcfp,由pi确定资格。14.实施fa,由pi确定资格。就诊2(基线)-所有受试者:除非特别的,所有眼科步骤(包括成像)只能在研究眼上实施。1.核对满足所有纳入/排除标准,包括pi对资格的确定。2.获取有关医疗健康和/或伴随药物使用的任何变化的信息。3.采集给药前后的生命体征。生命体征将在给药前1小时内(作为给药前时间点)测量。给药后的生命体征读数将在给药后30分钟内进行。4.实施bcva。5.实施ll-bcva。6.实施全面的眼科检查,包括角膜、虹膜、前房、晶状体(如果注意到晶体上有混浊,进行locsiii)的裂隙灯检查和水相反应(细胞和光带)、玻璃体和视网膜的扩张眼底检查、以及iop测量。7.实施醋酸氟氢可的松ivt注射。8.在注射后15分钟内监测研究眼。9.监测不良事件。就诊3(第1天):所有受试者。初始治疗后检查:除非特别的,所有眼科步骤(包括成像)只能在研究眼上实施。1.获取有关医疗健康和/或伴随药物使用的任何变化的信息。2.采集生命体征。3.实施bcva。4.实施ll-bcva。5.实施全面的眼科检查,包括角膜、虹膜、前房、晶状体(如果注意到晶体上有混浊,进行locsiii)的裂隙灯检查和水相反应(细胞和光带)、玻璃体和视网膜的扩张眼底检查、以及iop测量。监测不良事件:追踪访问-第7、14、28、60、90天:除非特别的,所有眼科步骤(包括成像)只能在研究眼上实施。在所有追踪访问中将实施以下步骤:1.获取有关医疗健康和/或伴随药物使用的任何变化的信息。2.采集生命体征。3.采集血液用于pk分析(仅第7、28、90天)。4.实施全面的眼科检查,包括角膜、虹膜、前房、晶状体(如果注意到晶体上有混浊,进行locsiii)的裂隙灯检查和水相反应(细胞和光带)、玻璃体和视网膜的扩张眼底检查、以及iop测量。5.监测不良事件。终止就诊(或提前终止)-第150天:在双眼实施所有眼科步骤。1.获取有关医疗健康和/或伴随药物使用的任何变化的信息。2.采集血液及尿液用作实验室分析并将样本送至中心实验室。3.采集血液用于pk分析4.采集生命体征。5.实施尿液妊娠检测。-仅限wocbp。6.实施bcva。7.实施全面的眼科检查,包括角膜、虹膜、前房、晶状体(如果注意到晶体上有混浊,进行locsiii)的裂隙灯检查和水相反应(细胞和光带)、玻璃体和视网膜的扩张眼底检查、以及iop测量。7.实施sd-oct成像。8.实施faf成像。9.实施nifr成像。10.实施dcfp。11.实施fa成像。12.监测不良事件。非计划就诊:如果受试者为了不良事件评估或在pi的要求下进行下一次计划就诊之前返回临床试点,则在非计划就诊时完成的所有评估应归档在患者原始记录和ecrf中。追踪丢失:如果参与者无法返回参加预定的≥1次就诊,且研究站点工作人员无法联系到参与者,则该参与者被认为追踪丢失。如果参与者无法返回诊所进行所需的研究就诊,则必须采取以下措施:·站点将尝试联系参与者,并在一周内重新安排错过的就诊,并告知参与者维持指定的就诊计划的重要性,并确定参与者是否希望和/或继续研究。·在参与者被视为随访丢失之前,调查员或指定人员将尽一切努力恢复与参与者联系(如有可能,3次电话联系,以及如有必要,向参与者最后已知的邮寄地址或当地等效的方式发出一封挂号信)。这些联系尝试应归档在参与者的医疗记录或研究文件中。·如果参与者继续无法联系上,他或她将被认为以追踪丢失的主要原因已退出研究。研究评估和步骤在活动计划表中概述的研究期间将实施以下评估。知情同意步骤每个试点的首席调查员将确保给予受试者全面且充分的关于本研究的性质、目的以及可能的风险和益处的口头和书面信息。必须通知还受试者,他们可以在研究的任何时间停止研究。应给予受试者询问问题的机会,并允许有时间考虑所提供的信息。在进行任何研究步骤之前,必须获得受试者签署并注明日期的知情同意书。首席调查员必须保存原始的、已签署的知情同意书。必须向受试者提供签署的知情同意书的副本。生命体征在注射就诊时,将在给药前1小时内和给药后30分钟内测量生命体征。将在静脉穿刺前测量生命体征。生命体征包括血压(bp)和脉搏测量。在患者坐下3分钟后,背部支撑且双脚放在地板上,将使用自动验证设备测量收缩压和舒张压,并配有合适尺寸袖带。如果袖带尺寸对于患者的臂围来说不够大,可以使用有合适尺寸袖带的血压计。如果生命体征在筛查/资格时超出范围,调查员可以获得两次额外的读数,因此总共进行最多三次连续评估,患者在每次重复评估前静坐大约五分钟。至少最后的读数必须在上面提供的范围内,患者才能取得资格。在所有就诊时,以上所有检查将在休息3分钟后进行。在就诊1时,将测量以厘米(cm)计的身高和体重(最接近0.1千克[kg]的室内衣物,但不穿鞋)。体重指数(bmi)将使用以下公式计算:bmi=体重(kg)/[身高(m)]2血液和尿液的实验室分析血液和尿液的采集将在研究试点进行,且样本将被运往中心实验室进行分析。将进行以下临床实验:血液学:血红蛋白;红细胞压积;红细胞(rbc)计数;血小板计数;白细胞(wbc)分类计数;化学:血尿素氮(bun);肌酐;胆红素(总的、直接的和间接的);白蛋白;碱性磷酸酶(alp);天冬氨酸转氨酶(ast);丙氨酸转氨酶(alt);肌酸激酶;葡萄糖;电解质(钠、钾、氯、碳酸氢盐);尿液分析:ph;比重;蛋白质;葡萄糖;酮;胆红素;血液;亚硝酸盐;尿胆素原;白细胞酯酶;其他:人类绒毛膜促性腺激素(hcg)a;卵泡刺激素(fsh)b;黄体生成素(lh)b。调查员必须审查筛查就诊临床实验室检测结果(包括复查结果),并确认这些结果不显示任何使研究参与不当的医疗状况的证据。调查员还应在追踪访问和出访中评估来自基线的任何变化。注意:a.仅在筛查时对有生育潜力的女性进行血清妊娠检查(即hcg)。b.仅在筛查时对绝经女性进行fsh和lh。尿妊娠检查如研究流程图所述,尿妊娠检查仅在wocbp中进行。最佳矫正视力最佳矫正视力(包括ll-bcva)检测,由认证的va检查员进行,应在任何需要用眼药水扩张眼睛的检查或任何需要接触眼睛的检查之前进行。在筛查时(就诊1),将分别在每只眼中获得etdrs最佳矫正视力(bcva)。这项评估应在扩瞳前进行。正确读取的字母数(每只眼睛)将被记录在适合的研究文档中。对于其余的研究就诊(就诊2-8),只能在研究眼获得bcva。完成眼科检查全面的眼科检查由以下组成:眼睛和附件的外部检查;眼睑/瞳孔反应性的常规筛查(包括上睑下垂、瞳孔形状异常、瞳孔不均匀、对光的反应异常和瞳孔传入障碍(afferentpupillarydefect));裂隙灯检查[角膜、前房、虹膜、晶状体、水相反应(细胞和光带)]。在任一就诊中,如果在裂隙灯检查中注意到异常晶状体结果,该结果应进一步表现为locsiii特征。所有随后的就诊应包括locsiii。locsiii标准化程序和分级量表的完整描述被概括在mop中;扩张性眼底检查包括视网膜和玻璃体的评估(即后段异常、视网膜出血/脱离、玻璃体出血密度和玻璃体细胞);玻璃体出血密度和玻璃体细胞分级量表;根据研究站点的常规做法,在诊断1时测量双眼的眼压(iop),并将其记录在适当的研究文件中。对于其余的研究就诊(就诊2-9),只能在研究眼中获得iop。眼睛成像如上面就诊计划所概述的获得以下眼睛图像,另请见soa:数字彩色眼底摄影;荧光素血管造影;光谱域光学相干断层扫描(spectraldomainopticalcoherencetomography);眼底自发荧光;红外反射成像。仅在选定的临床试点使用heidelberg系统。注射后评估将在注射前后对研究眼进行评估,以确保注射过程和/或研究用药没有危害眼睛的健康。最初的注射后评估应在注射后15分钟内完成,且包括视力(光感)和iop监测的总评估。如果受试者通过总视力检查且iop为<30mmhg,受试者可以离开试点。如果受试者未通过总视力测试和/或iop>30mmhg,评估将每隔大约30分钟继续进行,直到受试者通过总视力检查且iop为30mmhg。任何受试者在注射后,出现iop显著且持续升高(>30mmhg),或视网膜中央动脉(cra)灌注不足,应根据pf的临床判断进行监测,并可以进行超出协议规定的iop的其他程序和测量,以及iop降低程序。如果注意到任何问题或即时毒性,则该对象将留在现场并根据pi的临床判断进行治疗。用于研究评估的血量研究期间的血量(上至第150天),参见表6。不良事件和严重不良事件所有不良事件(ae)(如上定义),无论是由pi或他们的医疗合作者之一观察到的,或由参与者自发报告的,或对直接提问的回应,都将被报告。所有不良事件(眼科、非眼科、严重、非严重、自愿、和引发)必须记录在研究记录中。不良事件的定义(ae)不良事件是在接受医药产品治疗的受试者中任何异常医疗事件。该事件不一定与治疗有因果关系。因此,ae是与药物使用相关的任何不利的和非计划中的体征、症状或疾病,无论是否被认为与药物有关。注意:对于本研究的目的,除非调查者认为具有临床意义,否则实验室数值异常将不会被视为不良事件。所有异常实验室数值将记录在数据库中,并在最终研究报告中提供适当的分析。严重不良事件(se)的定义严重不良事件(sae)的定义为在任何剂量下的任何异常医疗事件:导致死亡;危及生命:这意味着受试者在事件发生时有死亡风险;其并不意味着该事件如果以更严重的形式发生,就可以导致死亡;需要住院或延长现有住院时间;导致持续或严重的无行为能力或正常生活功能的实质破坏;或是先天异常或出生缺陷。当基于适当的医学判断,可能不会导致死亡、危及生命或需要住院的重要医疗事件则可将其视为严重事件,它们可能危及患者或受试者,并可能需要医学或外科手术干预,以防止上述定义中列出的结果之一。医学和科学判断应该被运用于决定ae是否严重,以及加急报告是否合适。特别关注的不良事件特别关注的不良事件是针对于赞助商的产品或项目的科学和医学关注之一,其中,调查员对赞助商进行持续监控并快速沟通是合适的。这些不良事件可以是严重或不严重的。适用的不良事件可能需要进一步调查以便于定性和了解,且根据事件的性质,可能还需要试验赞助商与其他方进行快速沟通。必须使用与严重不良事件所述的相同的机制和时间架构(即调查员或代表了解该事件的一个工作日内)报告这些特别关注的不良事件。特别关注的不良事件包括如下:眼内炎;4+眼部炎症;在事件发生30天内无法降至1+或更低的2-3+眼部炎症;注射fa后持续(>5分钟)光感失;注射后在/超过90分钟iop持续升高(30mmhg);任何需要手术干预(即穿刺)的iop升高;在事件发生14天内仍未消退的>2+严重程度的新的玻璃体出血;白内障进展。如果在研究对象中发生特别关注的不良事件,该研究受试者将被追踪以解决该不良事件。赞助商将通过进一步接触该研究、治疗和进一步参与该研究,做出决定。不良事件评估和记录通过与受试者的讨论,调查员将调查每次受试者就诊期间ae的发生,并将信息记录在试点的原始文件中。对于每一次ae,pi应记录开始和解决日期、严重程度、是否符合sae的定义、事件与研究药物的关系、对研究药物采取的措施、以及事件的结果。数据应按照crf指示,从原始文档转录到crf。当报告不良事件时,事件描述应使用“不良事件通用术语标准”(ctcae,v4.03)中找到的最佳匹配术语描述事件。如果可找到的ctcae术语很适合事件,可能不需要额外的描述符。然而,调查员应添加任何必要的描述,以便澄清事件或将其置于适当的文本中。如果在ctcae中找不到与不良事件匹配的适当术语,且你不知道优选的meddra术语,则不良事件描述应包括带有附加信息的诊断、体征或症状,以助于后续分类进meddra编码术语中。强度pi必须将所有报告的不良事件的严重程度分类为五个级别之一:1级(轻度)、2级(中度)、3级(严重)、4级(危及生命)或5级(与ae相关的死亡)。当有匹配的ctcae术语时,必须使用标准化ctcae严重程度分级量表以报告不良事件的特定类型。如果没有参考使用标准分级量表或暂时可用的,使用以下准则:1级-轻度:持续超过72小时的任何其他不重要的医疗事件,或由pi认为与研究药物有关的任何暂时性(<72小时)ae。无或最低需要的药物治疗或干预、不需要住院、正常活动没有或很少限制;可以采用非处方药或一次性处方治疗来缓解症状。对于任何给定的方案,轻度不良事件可能被列为治疗的预期后果,且对于这种预期事件的标准支持测定,不一定将事件提升到更高的级别。2级-中度:轻度到中度的活动受限,可能需要一些帮助;可能不需要,但通常需要最低的干预/治疗、有住院的可能。3级-严重:活动明显受限,通常需要一些帮助;需要医疗干预/治疗;可能或很可能住院。[具体地,对于在这项与视力有关的研究中的眼部不良事件,立即威胁视力的情况(例如,即将发生的角膜穿孔、视网膜脱离),如果会导致受影响的眼睛(多个眼睛)完全失明,可以归类为3级。]4级-危及生命:活动极度受限,需要重大且及时的援助;需要重大的医疗/治疗干预以防止生命损失;住院、紧急治疗或可能的临终关怀。在pi看来,当参与者在不良事件时有死亡的重大风险或怀疑供试品的使用或继续使用将会导致参与者死亡时,使用此等级。(这不包括如果其以更严重的形式发生,可能会导致死亡的反应。例如,药物性肝炎,其在没有肝衰竭的证据下,该药物性肝炎不会被认为是危及生命的,即使其可能是致命的。)5级-死亡:与ae相关的死亡因果关系:pi(或授权的研究医生)必须上交一份对于供试品或步骤的报告的不良事件因果关系的归因。归因应考虑到时态关联和任何已知的有关供试品的物理、生理或毒理学信息,该信息可以合理地推断因果关系。因果关系应仅用于实验供试品,而不适用于任何标准研究检查或诊断步骤。四种归因分类为:无关-从研究药物的给药开始没有遵循合理的时态顺序。该事件或实验室检查的异常显然是由外界原因(疾病、其他药物、环境等)引起的。不太可能相关-没有遵循研究药物的已知反应模式。从研究药物的给药开始没有遵循合理的时态顺序。疾病或其他药物提供了可信的解释。当研究药物重新给药时,不会再次出现或恶化可能与此相关-遵循研究药物的已知反应模式。从服用研究药物的给药开始的时间顺序是合理的。也可以用疾病或其他药物来解释。可能相关-遵循研究药物的已知反应模式。从服用研究药物开始的时间顺序是合理的。戒断反应在临床上是合理的。不能通过参与者临床状态、环境因素或给药受试者的其他疗法的已知特征来合理解释。严重不良事件报告所有sae(本文中所定义的),无论是否与研究药物相关,都将在调查员得知此类sae后24小时内,通过电话、电子邮件或传真报告给赞助商(或指定的医疗监督员)。联系方式可以在严重不良事件表中找到。最初的sae报告应应至少包括以下信息:方案编号;试点编号;受试者筛查编号、首字母缩写、性别和出生日期;pi姓名和调查员试点地址;sae的详细情况;分类为“严重”的标准;sae发生日期。追踪sae报告应在获得进一步信息后提交,且最终sae报告应包括sae强度、结果,和与研究药物的关系;研究给药日期、伴随药物、和任何其他相关信息。如有需要,pi还应提供清晰的支持文件副本(例如出院摘要、化验报告、验尸报告等),并除去受试者的个人识别码。所有sae都将被随访,直到急性事件已解决,即使受试者在解决之前不再继续参与研究。调查员必须按要求向irb/iec报告在她/他的试点发生的sae。预期不良事件与供试品相关的预期ae:在本方案中建议的剂量下,预期没有与研究药物相关的眼部或全身ae。与ivt注射步骤相关的预期ae:注射步骤相关的轻微不适(包括开睑器、麻醉剂滴眼液、散瞳剂滴眼液、抗生素滴眼液、聚维酮碘滴眼液或麻醉剂冲洗和结膜下注射的使用,以及ivt针头的实际插入)是可预期的。这些与步骤相关的不良事件包括但不限于:发红、轻度眼痛、眼刺激、视力障碍、眼睛内异常感觉等。并将如本文所示分级。疾病进展pi认为研究眼或对侧眼明确的amd疾病进展情况应在参与者的原始文档中予以标识,且不应记录为crf中的不良事件,如病变生长、病变出血、渗出液体的病变、rpe泪液,和脂质的大量沉积。所有其他情况都应记录为不良事件。必须在原始文档中记录疾病进展的明确性质。正在研究的医疗情况的正常进展或恶化(例如,amd发展导致的视力丧失),其本身,不一定构成不良事件,除非这种变化可以合理地归因于供试品的作用,而不仅仅是由于其缺乏疗效。退出参与者可以选择在任何时时间任何原因退出这项研究,且不会受到惩罚或禁止参加其他临床方案。希望完全退出研究的参与者将被提前终止就诊。该提前终止就诊将包括本文所概述的检查。在临床试验中的妊娠只要采用合格的节育方法,wocbp就不会被排除在研究之外。在招募参加临床试验之前,wocbp必须被告知在试验期间避免妊娠的重要性,以及与意外妊娠相关的潜在风险。在研究期间,wocbp和与wocbp有伴侣的男性,将被指导实行可接受的节育方法(如上所定义的)。男性受试者将被建议避免在第一天给药后捐献精子,直到最后一次外出诊断。在试验期间,如果女性受试者怀疑其可能妊娠,其将被指示立即与调查人员联系。必须立即联系研究赞助商,并将根据妊娠环境情况决定是否让孕妇继续在研究中。妊娠不能作为不良事件报告;但是,并发症是可以报告的。如果女性受试者或男性受试者的伴侣在研究期间妊娠,pi应在接到通知24小时内向医学监测员报告妊娠。调查员应追踪直到妊娠结束。妊娠结束时,调查员将记录并报告结果。如果妊娠结果符合sae分类标准(即产后并发症、死胎、新生儿死亡或先天异常),调查员应遵循程序报告sae。统计注意事项描述性汇总将包括连续变量的平均值、标准差、中位数和范围,以及分类变量的计数和百分比。人群分析安全性分析:所有接受过至少一次治疗剂量的受试者都将被包括于fa的安全性评价。疗效终点(多个终点):疗效分析将基于意向治疗人群(itt),其被定义为所有接受治疗单剂量且在第2个月或之后,至少就诊一次的受试者。第2个是治疗的首次就诊,其测量病变面积。每个方案(pp)的疗效分析将包括所有第150天追踪返回的随机受试者。安全性是主要分析人群的安全终点,且itt是主要分析人群的功效终点。每个分析人群的参与者的分配将基于所有数据收集、临床研究助理的监测,和数据管理和数据库锁定之前的第一轮查询解析。人口统计和基线特征参与者人口统计和基线变量(年龄、性别、民族、人种、身高、体重、和bmi)将用描述性统计汇总。性别、民族,和人种,将用频率计数和百分比汇总。基线眼部评估也将描述性汇总。每个参与者的怀孕测试结果、伴随药物和医学病史数据将显示在数据列表中。伴随药物将通过频率计数和百分比进行描述性汇总。主要安全终点分析不会对安全评估进行正式推论统计。安全性分析的统计方法实质上将主要是描述性的。基于出现与研究药物相关的严重ae的受试者的数量,醋酸氟氯可的松lmg/0.lml和2mg/0.1ml的注射将被认为是安全和可耐受的。据了解,安全性是一种医学判断,其不能被前瞻性的详细定义。然而,作为一般指导,如果受试者没有临床上显著药物相关不良事件或实验室检查异常,其将被认为已经耐受了该剂量。相反,如果受试者在研究药物给药期间或给药后追踪期间出现临床上药物相关不良事件或实验室检查异常,则不会被视为对该剂量是已耐受的。将使用安全人群显示所有安全数据的列表和汇总。连续安全数据汇总将计算描述性统计(平均值、sd、中位数、最小值和最大值),离散/分类安全数据汇总将计算频率计数和百分比(如适用)。不良事件(ae)将管理活动医学词典(meddra)编码,且数据将通过系统、器官、分类、和首选术语汇总。每个ae报告的参与者的数量和百分比将描述性汇总(n=9)。在同一概述等级内(即,系统、器官、类别或首选术语)有两个或更多ae的参与者将仅在该级别中计数一次。报告的ae数目也会显示。不良事件也将按严重程度以及与研究治疗的关系进行汇总。将提供由参与者提供的ae数据列表,包括逐字术语、首选术语、系统器官类别、严重程度以及与研究治疗的关系。将为导致的研究/治疗中断的sae和ae生成单独的列表。所有血液学、血液化学和尿液分析(连续变量)参数将使用描述性统计对所有评估的研究就诊进行汇总,包括所有手术后评估的从基线开始(手术前最后一个值)的变化。所有实验室检查数据都将包括在数据列表中,且所有超出正常范围的测试值都将被标记。研究就诊的所有生命体征参数将使用描述性统计进行汇总,包括对所有手术后评估的从基线开始(最后一次手术前)的变化。将为单个参与者列出个别生命体征评估。每名参与者的体格检查结果将被列出,并通过研究诊断使用计数和百分比进行描述性汇总。次要终点分析疗效终点是本研究的次要终点,其包括全面的眼科检查。etdrs最佳矫正视力(bcva)将参照早期治疗糖尿病视网膜病变研究etdrsletters)进行评分。etdrs将作为连续数据处理,且描述性统计(平均值、sd、中位数、最小值和最大值)将汇总用于etdrs观察值和每次手术后就诊的基于基线的变化。将通过使用混合模型对etdrs随时间变化的探索性分析评估。同一参与者的重复测量之间的相关性将通过混合模型说明。将评估基于基线etdrs变化的最小二乘平均值和每次就诊时的95%置信区间。将对眼压进行类似的分析。分类疗效终点(诸如裂隙灯生物显微镜检测结果、扩张眼底镜检测结果、彩色眼底摄影和oct结果),将通过合适的频率计数和百分比(比例)进行描述性汇总。中期分析本研究没有计划正式的中期分析。样本量本研究遵循3+3方法,计划招募最多12名参与者,其具有年龄相关性黄斑变性(amd)并伴有视力(20/32至20/2000,snellen当量)继发的地图状萎缩。本项研究选择的样本量是在没有正式统计评价的情况下选择的,但所选择的数字被认为足以评估研究目标。样本量是基于初步研究的实际和后勤考量确定的,而不是基于假设检验的统计能力或参数估计的精度。这项第1阶段试验旨在识别任何重要的限制性毒性,并确定该剂量是否适合第2阶段试验。其也旨在最大限度的降低可能性,即最小数量的受试者接触试验药物。这是一项开放性研究,且在研究中没有进行随机化。缺失数据缺失数据通常不会归因于安全性或有效性数据。数据收集、保留和监测数据收集工具调查员将准备和维持充足和准确的原始文件,所述原始文件是旨在记录使用研究药物治疗的每个参与者的所有观察和其他相关数据。当与参与者就诊对应的信息可用时,每个试点的研究人员将来自对应参与者就诊相对应的原始文件中的数据,输入到特定方案的电子案件报告表(ecrf)中。研究数据库或赞助商(或指定人)收集的任何研究文件中不会识别参与者的姓名,但会识别试点编号、参与者编号和首字母缩写。如果ecrf需要更正,时间和日期邮戳将追踪输入或更新ecrf数据的人员,并创建电子审计跟踪。调查员负责收集本研究登记的参与者的所有信息。调查员必须审查并验证在本研究过程中收集的所有数据的完整性和准确性。在研究完成时,crf的副本将保留在调查员的试点。数据管理步骤数据将被输入到经过验证的数据库中。根据程序文件,数据管理小组将负责数据处理。一旦完成质量保证步骤,将会进行数据库锁定。所有处理和分析数据的程序,都将使用符合fda指导方针的用于临床试验的数据处理和分析的良好计算规范进行。数据质量控制和报告在将数据被输入研究数据库后,将实施计算机化数据验证检查系统,并定期将其应用于数据库。查询直接通过edc系统输入、追踪和解决。研究数据库将根据已解决的查询进行更新。对研究数据库的所有更改都将被记录。档案数据数据库由建立的安全步骤保护,以防止未经授权的访问;将保留数据库和相关软件文件适当备份副本。数据库管理员结合数据库的任何更新或更改,来备份数据库。在方案的关键节点(例如,中期报告和最终报告的生成),按照既定程序锁定并清理分析数据。调查记录的可用性和保存性调查员必须应要求向监控员、赞助商(或指定人)的其他授权代表、irb/iec,和监管机构(例如fda、tga)检查员提供研究数据。必须为每个参与者保存一份文件,其包括签署的知情同意书、hipaa授权和批准同意书,以及与参与者相关的所有原始文件的副本。调查员必须确保作为ecrf信息来源的原始文件的可靠性和可用性。所有研究文件(患者档案、签署的知情同意书、ecrf副本、研究文件笔记本等)必须在研究完成后十五年内保持安全。监测根据美国cfr第21篇第50、56和312部分以及用于gcp的ich指南(e6),赞助商代表将进行就诊监测。通过签署本方案,研究人员允许赞助商(或指定人)、和适当的监管机构对所有适当的研究文件进行现场监测和/或审计。数据安全监控委员会将召集一个独立的dsmb。在这项研究中,dsmb的任务将是确保试验的道德行为,并保护患者的安全利益。dsmb将负责审查研究的累积安全结果。dsmb将在研究开始前召开会议,并将审查在部分1和3(研究的部分2&4前)中最初参与者的faivt注射后第0天和1个月的所有可获得的安全性/耐受性数据(如不良事件、严重不良事件、临床实验室评估、血压、血液学、泌尿学),并根据需要在整个研究期间进行召集以审查数据和潜在的安全风险。评价继续研究的标准将与研究安全性有关,包括眼部和/或全身副作用(不限于但包括;iop变化>10mmhg、bcva中丢失15个字母或以上、出现或眼内炎症、有或无眼部疼痛、30mmhg的血压变化(收缩或舒张)、住院或全身疾病的发生率、以及报告的任何其他眼部或全身不良事件)的发生率和严重程度。任何变化都将参考基线测定。然后,dsmb将在研究结束时和最终统计分析之后召开会议,以审查所有数据。dsmb将由一名眼科医生和一名生物统计学家组成,两人都独立于研究小组。参与者的保密性为了保持参与者的保密性,在提交给赞助商的ecrf和其他文件中,只有通过试点编号、参与者编号和参与者缩写识别所有研究参与者。其他参与者保密方面的问题(如果适用)被包含在临床研究协议中。行政、伦理和监管方面的考量本研究将据赫尔辛基宣言(declarationofhelsinki)、人类志愿者的保护(21cfr50)、机构审查委员会(21cfr56)、和临床研究人员的义务(21cfr312)进行。为维持保密性,所有实验室标本、评估表、报告和其他记录将仅通过编码和缩写识别。所有的研究记录将保存在一个上锁的文件柜中,且将患者姓名与患者身份号码联系起来的代码表将分开存储在另一个上锁的文件柜中。除非tga监测有必要,没有参与者的书面许可,临床信息不会发布。调查员还必须遵守所有适用的隐私法规(例如,2002健康记录和信息隐私法)。方案修正对方案的任何修改都将由赞助商撰写。除非有消除对患者的直接安全危害的必要,未经irb/iec书面批准前,方案修正不可以被实施。如果在五个工作日内通知irb,旨在消除对患者的明显直接危害的方案修正可以被立即实施。机构审查委员会和独立伦理委员会方案和同意表格将在研究开始之前,由每个参与中心的irb/iec审查和批准。无论因果关系,严重不良事件将根据irb/iec的标准操作程序和政策被报告给irb/iec,且调查员将向irb/iec持续通知研究进展。调查员将获得irb/iec遵守法规的保证书。可能需要irb/iec履行其职责的任何文件(如方案、方案修正、调查员手册、同意表格、涉及患者招募、报酬或赔偿程序的信息、或其他相关信息)将提交给irb/iec。研究方案和知情同意表格的irb/lec书面无条件批准,将在研究启动时归调查员所有。irb/iec无条件批准声明将在将研究用品运往试点之前,由调查员传送给赞助商或指定人。该批准必须按确切的方案名称和编号涉及到本研究,并应确定所审查的文件和审查日期。除非在有消除对患者的直接安全危害的必要,或当更改仅涉及研究的后勤或行政方面时,未经书面irb/iec批准之前,不可以启动方案和/或知情同意修改或更改。这样的修改将被提交给irb/iec,并书面核实修改已经提交,并且随后应获得批准。必须通知irb/iec最初提交供审查的其他文件的修订;依照irb的标准操作步骤和政策,在研究过程中发生的严重和/或意想不到的不良事件;可能对患者进行研究的安全性产生不利影响的新信息;年度更新和/或重新批准请求;以及研究何时完成。知情同意书(icf)知情同意将根据赫尔辛基宣言、ichgcp、美国联邦法规对人类受试者的保护(21cfr50.25[a,b]、cfr50.27和cfr第56部分、子部分a)、健康保险便携性与责任法案(hipaa,如果适用),以及当地法规获得。图2至6示出了根据1b阶段研究,向一个受试者注射氟氢可的松的结果。该数据是针对一个患有双侧ga的受试者,该受试者在左眼接受了1mg的玻璃体腔内fa治疗。在第28天没有毒性的证据,没有眼压(iop)和视力(va)的改善。研究还包括尿液妊娠检测(阴性);生命体征检查;外眼检查(均正常);裂隙灯生物显微镜检查(除前房的疤痕外,均正常);iop测量;眼底扩张检查(均正常,除在左眼(os)注射处的ga和也在右眼(od)中的ga;玻璃体混浊(无);光谱域光学相干断层扫描(sdoct);以及身体系统检查(均正常;除无关问题外)。在本说明书中,术语“包括”、“包含”或类似术语意在表示非排他性包含,使得包括元素列表的装置中,其不仅包含这些元素,而很可能包括未列出的其它元素。贯穿本说明书的目的是为了描述本发明,而将本发明限制于任何一个实施例或特征的特定集合。相关领域的技术人员可以从特定实施例中实现变体,尽管如此,所述变体仍将落入本发明范围内。表格表1:一些皮质酮的盐皮质激素受体和糖皮质激素受体活性关键词:mr=盐皮质激素受体;gr=糖皮质激素受体;i.m.肌肉注射表2:遗传分析探针*国家生物技术信息中心,国家卫生研究院,马里兰州贝塞斯达。http://www.ncbi.nlm.gov/sites/gene.表3:qrtpct自定义引物集基因符号ncbi参考序列上游引物(5’-3’)下游引物(5’-3’)cd46(mcp)nm_019190.1ctcttgggagccctctatccattccttcacggggactagggapdhnm_017008.3cctggagaaacctgccaagcctcagtgtagcccaggatg表4:活动计划表5:表6:参考文献arunagorusupudi,kellynelson,andpaulsbemstein,theage-relatedeyedisease2study:micronutrientsinthetreatmentofmaculardegeneration.americansocietyfornutrition.advnutr.2017;8:40-53;doi:10.3945/an.116.013177.riship.singh,advancesinthetreatmentofdryage-relatedmaculardegeneration:preventingandtreatinggeographicatrophy:https://consultqd.clevelandclinic.org/2017/01/advances-treatment-dry-age-related-macular-degeneration/riccardonatoli,nilishafernando,michelemadigan,joshuaa.chu-tan,krisztinavalter,janprovisandmattrutar,microglia-derivedil-1βpromoteschemokineexpressionbymüllercellsandrpeinfocalretinaldegeneration.molecularneurodegeneration(2017)12:31dol10.1186/s13024-017-0175-y(natolietal.b)riccardonatoli,nilishafemando,haihanjiao,tanjaracic,michelemadigan,nigell.barnett,joshuaa.chu-tan,krisztinavalter,janprovis,andmattrutar,retinalmacrophagessynthesizec3andactivatecomplementinamdandinmodelsoffocalretinaldegeneration.iovs,june2017,58:7,pp2977-2990http://iovs.arvojournals.org/pdfaccess.ashx?url=/data/iornals/iovs/936282/mattrutar,riccardonatoli,peterkozulin,krisztinavalter,paulgatenby,andjanm.provis,analysisofcomplementexpressioninlight-inducedretinaldegeneration:synthesisanddepositionofc3bymicroglia/macrophagesisassociatedwithfocalphotoreceptordegeneration.investigativeophthalmology&visualscience,july2011,vol.52,no.8.rozens,skaletskyh.primer3onthewwwforgeneralusersandforbiologistprogrammers.methodsmolbiol.2000;132:365-386.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1