含药物的颗粒的制备方法与流程
本发明涉及含有药物的含药物的颗粒的制备方法,具体涉及将药物作为主成分而包含在壁(壳)部分的中空颗粒的制备方法。
背景技术:
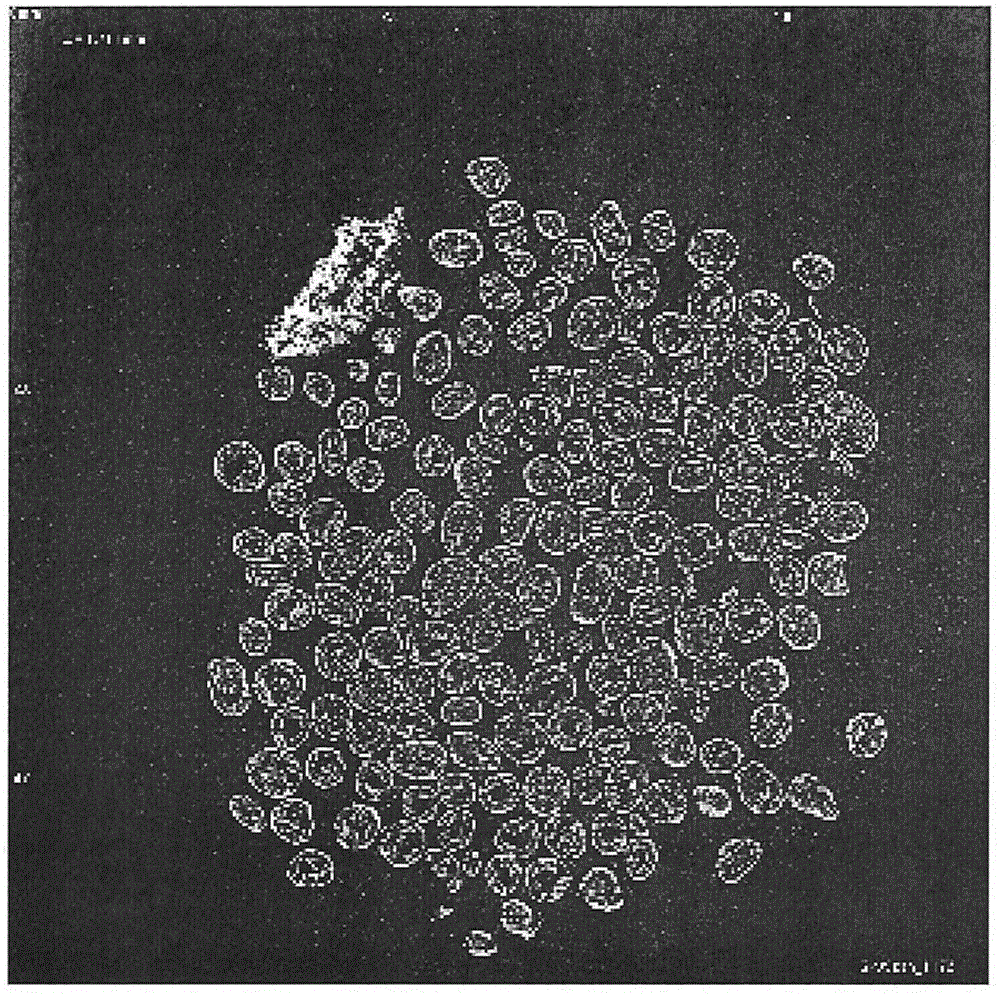
:对于固体药品制剂而言,通常仅将药物造粒,或者将药物与其它制剂化成分混合并造粒来制备含药物的颗粒,其后,与其它成分混合,与其它造粒物混合,或者添加其它成分、进一步进行造粒等,进行压片而制成片剂,或制成颗粒剂,或者装入胶囊中而制成胶囊剂。专利文献1公开了:通过将药物粉末与高分子、尤其是具有期望功能性的高分子进行粉末混合,一边喷雾能够溶解高分子的溶剂一边进行搅拌造粒这样的非常简便的手段,可高效地制备具有充分的颗粒强度且能够发挥出颗粒自身的良好崩解性、在期望部位的溶出控制等高分子功能的含药物的颗粒。并且,专利文献1还公开了:该含药物的颗粒是球形且具有中空结构,能够任意地控制含药物的颗粒的粒径和粒度分布宽度,流动性良好,能够提高药物含有率,颗粒的均质性优异,与其它成分的混合均匀性良好的颗粒。现有技术文献专利文献专利文献1:国际公开第2014/030656号。技术实现要素:发明要解决的课题专利文献1所记载的含药物的颗粒可通过一边喷雾能够溶解高分子的溶剂一边搅拌造粒的简便方法来制备,但喷雾溶剂的工序有时难以进行送液速度、喷雾空气的控制等条件设定。用于解决课题的方案本发明人等进行深入研究,结果发现:通过使用容器旋转型搅拌装置,一边使容器和搅拌叶片旋转,一边向包含药物的粉末中适量添加高分子和能够溶解高分子的溶剂后,使容器和搅拌叶片发生旋转而进行搅拌,由此能够在不喷雾溶剂的条件下制备含药物的颗粒。此外,本发明人等确认:通过该方法而制备的含药物的颗粒显示球形,具有中空结构。进而,本发明人等确认:通过使用安装有削刮工具的容器旋转型搅拌装置,利用滴加或喷雾中的任一者来添加溶剂均不需要在以往的搅拌造粒机中所见的复杂条件设定、装置的停止,减少在制备中对侧壁的附着,显著改善制备工序中的含药物的颗粒的回收效率。即,本发明涉及下述方案。[项1]制备方法,其是包含壳和中空部的颗粒、且壳包含药物和高分子的含药物的颗粒的制备方法,其特征在于,包括下述工序:使用容器旋转型搅拌装置,一边使容器和搅拌叶片旋转,一边向包含药物的粉末中添加高分子和能够溶解高分子的溶剂后,使容器和搅拌叶片发生旋转来造粒的工序,作为原料使用的高分子的平均粒径相对于作为原料使用的药物的平均粒径为5倍以上(其中,作为高分子而使用分散液状态的高分子时,该高分子在制成粉末后,以粉末的形式使用)。[项2]根据项1的制备方法,其中,作为原料使用的高分子的平均粒径相对于作为原料使用的药物的平均粒径为10倍以上。[项3]制备方法,其是包含壳和中空部的颗粒、且壳包含药物和高分子的含药物的颗粒的制备方法,其特征在于,包括下述工序:使用容器旋转型搅拌装置,一边使容器和搅拌叶片旋转,一边向包含药物的粉末中添加高分子和能够溶解高分子的溶剂后,使容器和搅拌叶片发生旋转来造粒的工序,高分子与药物的粒度分布比(d10/d90)为1以上(其中,作为高分子而使用分散液状态的高分子时,该高分子在制成粉末后,以粉末的形式使用)。[项4]制备方法,其是包含壳和中空部的颗粒、且壳包含药物、高分子和其它添加剂的含药物的颗粒的制备方法,其特征在于,包括下述工序:使用容器旋转型搅拌装置,一边使容器和搅拌叶片旋转,一边向包含药物和其它添加剂的粉末状混合物中添加高分子和能够溶解高分子的溶剂后,使容器和搅拌叶片发生旋转来造粒的工序,作为原料使用的高分子的平均粒径相对于作为原料使用的药物和其它添加剂的混合粉末的平均粒径为5倍以上(其中,作为高分子而使用分散液状态的高分子时,该高分子在制成粉末后,以粉末的形式使用)。[项5]根据项4的制备方法,其中,作为原料使用的高分子的平均粒径相对于作为原料使用的药物和其它添加剂的混合粉末的平均粒径为10倍以上。[项6]制备方法,其是包含壳和中空部的颗粒、且壳包含药物、高分子和其它添加剂的含药物的颗粒的制备方法,其特征在于,包括下述工序:使用容器旋转型搅拌装置,一边使容器和搅拌叶片旋转,一边向包含药物和其它添加剂的粉末状混合物中添加高分子和能够溶解高分子的溶剂后,使容器和搅拌叶片发生旋转来造粒的工序,作为原料使用的高分子与作为原料使用的药物和其它添加剂的混合粉末的粒度分布比(d10/d90)为1以上(其中,作为高分子而使用分散液状态的高分子时,该高分子在制成粉末后,以粉末的形式使用)。[项7]根据项1~6中任一项所述的制备方法,其中,容器旋转型搅拌装置具有削刮工具。[项8]根据项7所述的制备方法,其中,通过滴加或喷雾来添加高分子和能够溶解高分子的溶剂。[项9]根据项8所述的制备方法,其中,通过滴加来添加高分子和能够溶解高分子的溶剂。[项10]根据项8所述的制备方法,其中,通过喷雾来添加高分子和能够溶解高分子的溶剂。[项11]根据项1~10中任一项所述的制备方法,其中,含药物的颗粒中的中空相对于颗粒整体的体积比率为1%~50%,壳厚度为15μm以上。[项12]根据项1~11中任一项所述的制备方法,其中,高分子为选自水溶性高分子、水不溶性高分子、肠溶性高分子、胃溶性高分子和生物降解性高分子中的一种或两种以上。[项13]根据项12所述的制备方法,其中,水溶性高分子选自甲基纤维素、羟丙基纤维素、羟丙甲基纤维素、羟乙基纤维素、羟甲基纤维素、羧甲基纤维素、聚乙烯基吡咯烷酮、聚乙烯醇、共聚维酮、聚乙二醇、聚乙烯醇・丙烯酸・甲基丙烯酸甲酯共聚物、乙酸乙烯酯・乙烯基吡咯烷酮共聚物、聚乙烯醇・聚乙二醇・接枝共聚物、预糊化淀粉(α化デンプン)、糊精、葡聚糖、普鲁兰多糖、藻酸、明胶、果胶和它们中的一种或两种以上的混合物。[项14]根据项12所述的制备方法,其中,水不溶性高分子选自乙基纤维素、醋酸纤维素、甲基丙烯酸氨基烷基酯共聚物rs、丙烯酸乙酯・甲基丙烯酸甲酯共聚物分散液、乙酸乙烯酯树脂和它们中的一种或两种以上的混合物。[项15]根据项12所述的制备方法,其中,肠溶性高分子选自醋酸羟丙甲纤维素琥珀酸酯、羟丙甲基纤维素邻苯二甲酸酯、甲基丙烯酸共聚物l、甲基丙烯酸共聚物ld、干燥甲基丙烯酸共聚物ld、甲基丙烯酸共聚物s、甲基丙烯酸-丙烯酸正丁酯共聚物和它们中的一种或两种以上的混合物。[项16]根据项4~15中任一项所述的制备方法,其中,其它添加剂选自赋形剂、粘结剂、甜味剂、矫味剂、矫臭剂、香料、流动化剂、抗静电剂、着色剂、崩解剂、润滑剂、增塑剂、防聚集剂和包衣剂。[项17]根据项1~16中任一项所述的制备方法,其中,容器旋转速度为0.1~1m/s,搅拌叶片旋转速度为5.9~34m/s。发明效果通过使用本发明的制备方法,与使用一边喷雾能够溶解高分子的溶剂一边进行搅拌造粒的专利文献1所记载的制备方法时相比时间短,且无需控制喷雾时的送液速度,因此,能够更简便地制备含药物的颗粒,还能够缩短制备时间。进而,通过使用安装有削刮工具的容器旋转型搅拌装置的本发明的制备方法,利用滴加或喷雾中任一者来添加溶剂的方法均不需要以往的喷雾时的送液速度的控制等,能够有效地制备颗粒对于装置内侧壁的附着得以减少的含药物的颗粒。附图说明图1示出实施例1的外观的电子显微镜照片。图2示出实施例1的截面的电子显微镜照片。图3示出实施例2的外观的电子显微镜照片。图4示出实施例2的截面的电子显微镜照片。图5示出实施例1的显微ct扫描照片。图6示出实施例2的显微ct扫描照片。图7示出实施例3的外观的电子显微镜照片。图8示出实施例4的外观的电子显微镜照片。图9示出实施例5的外观的电子显微镜照片。图10示出实施例6的外观的电子显微镜照片。图11示出实施例7的外观的电子显微镜照片。图12示出实施例8的外观的电子显微镜照片。图13示出实施例9的外观的电子显微镜照片。图14示出实施例10的外观的电子显微镜照片。图15示出实施例11的外观的电子显微镜照片。图16示出实施例12的外观的电子显微镜照片。图17示出实施例13的外观的电子显微镜照片。图18示出实施例14的外观的电子显微镜照片。图19示出比较例1的外观的电子显微镜照片。图20示出比较例2的外观的电子显微镜照片。图21示出比较例3的外观的电子显微镜照片。图22示出比较例4的外观的电子显微镜照片。图23示出实施例3的显微ct扫描照片。图24示出实施例4的显微ct扫描照片。图25示出实施例5的显微ct扫描照片。图26示出实施例6的显微ct扫描照片。图27示出实施例7的显微ct扫描照片。图28示出实施例8的显微ct扫描照片。图29示出实施例9的显微ct扫描照片。图30示出实施例10的显微ct扫描照片。图31示出实施例11的显微ct扫描照片。图32示出实施例12的显微ct扫描照片。图33示出实施例13的显微ct扫描照片。图34示出实施例14的显微ct扫描照片。图35示出比较例1的显微ct扫描照片。图36示出比较例2的显微ct扫描照片。图37示出比较例3的显微ct扫描照片。图38示出比较例4的显微ct扫描照片。具体实施方式以下,针对本发明,更详细地进行说明。通过本发明的制备方法而制备的含药物的颗粒以药物和高分子作为必须构成要素。此外,该颗粒是指1个颗粒和多个颗粒的集合物这两者。本说明书中,“平均粒径”是指粉体颗粒的体积基准测定中的累积50%粒径d50。该平均粒径利用激光衍射式粒度分布测定装置(例如particleviewer(パウレック公司制)、sald-3000j(岛津制作所制)或helos&rodos(sympatec公司制))按照体积基准来测定。(i)药物作为药物,可无特别限定地使用。本发明的方法中使用的“药物”不论碱性、酸性、两性、中性等性质、溶解度,任意药物、化合物均可使用。其中,从稳定性、处理容易度的观点出发,优选为结晶性。此外,药物可以使用一种或混合使用两种以上。本发明的颗粒对于药物溶解性低的药物也发挥效果。例如,作为高分子而使用下述水溶性高分子时,能够发挥出速崩性和/或速溶性。本发明中作为原料使用的药物的平均粒径小时,能够获得表面更光滑的含药物的颗粒。药物的平均粒径优选为20μm以下、更优选为10μm以下、进一步优选为5μm以下、最优选为3μm以下。药物的平均粒径通常为0.1μm以上。本发明中使用的药物的平均粒径只要作为原料在上述范围即可,可以在含药物的颗粒的制备过程等中发生变化。药物可根据需要在制备颗粒之前粉碎成期望的粒径。粉碎通过使用微粉碎机的粉碎等惯用方法来进行,可以是非常微细的颗粒(平均粒径为1μm以下)。药物的含有率可任意设定,药物的用量通常相对于所制作的含药物的颗粒(中空颗粒)100重量%为96重量%以下、优选为94重量%以下、更优选为92重量%以下、进一步优选为90重量%以下。具体而言,相对于含药物的颗粒100重量%为0.1~96重量%、优选为0.1~95.9重量%、更优选为1~94重量%、进一步优选为5~92重量%、最优选为10~90重量%。本发明中,不仅能够制备以低含有率包含药物的颗粒,还能够制备以高含有率(例如相对于含药物的颗粒100重量%为50~96重量%、优选为70~96重量%、进一步优选为90~96重量%)包含药物的颗粒。以低含有率包含时,可通过混合下述记载的其它添加剂、优选混合不溶解于溶剂的添加剂来制备。(ii)高分子本说明书中,“高分子”是指相对分子质量大的分子,具有由相对分子质量小的分子多次重复而构成的结构,尤其是指功能性高分子。前述“相对分子质量大的分子”是指平均分子量(重均分子量)通常为1000以上的分子,优选是指5000以上的分子,进一步优选是指10000以上的分子。此外,分子量的上限没有特别限定,是指优选为10000000以下、更优选为5000000以下、进一步优选为2000000以下、特别优选为1000000以下的分子。作为功能性高分子的例子,可列举出水溶性高分子、水不溶性高分子、肠溶性高分子、胃溶性高分子、大肠靶向中使用的那样的壳聚糖等生物降解性高分子等,可优选列举出水溶性高分子、水不溶性高分子、肠溶性高分子和胃溶性高分子。高分子可以使用一种或混合使用两种以上。作为水溶性高分子,可列举出例如甲基纤维素(例如商品名:sm-4、sm-15、sm-25、sm-100、sm-400、sm-1500、sm-4000、60sh-50、60sh-4000、60sh-10000、65sh-50、65sh-400、65sh-4000、90sh-100sr、90sh-4000sr、90sh-15000sr、90sh-100000sr)、羟丙基纤维素(例如商品名:hpc-ssl、hpc-sl、hpc-l、hpc-m、hpc-h)、羟丙甲基纤维素(例如商品名:tc5-e、tc5-m、tc5-r、tc5-s、sb-4)、羟乙基纤维素(例如商品名:sp200、sp400、sp500、sp600、sp850、sp900、ep850、se400、se500、se600、se850、se900、ee820)、羟甲基纤维素、羧甲基纤维素(例如商品名:ns-300)等纤维素衍生物及其盐;聚乙烯基吡咯烷酮(例如商品名:プラスドンk12、プラスドンk17、プラスドンk25、プラスドンk29-32、プラスドンk90、プラスドンk90d)、聚乙烯醇(例如商品名:ゴーセノールeg-05、ゴーセノールeg-40、ゴーセノールeg-05p、ゴーセノールeg-05pw、ゴーセノールeg-30p、ゴーセノールeg-30pw、ゴーセノールeg-40p、ゴーセノールeg-40pw)、共聚维酮(例如商品名:コリドンva64、プラスドンs-630)、聚乙二醇、聚乙烯醇・丙烯酸・甲基丙烯酸甲酯共聚物(例如商品名:povacoat)、乙酸乙烯酯・乙烯基吡咯烷酮共聚物(例如商品名:コリドンva64)、聚乙烯醇・聚乙二醇・接枝共聚物(例如商品名:コリコートir)等水溶性乙烯基衍生物;预糊化淀粉(例如商品名:アミコールc)、糊精、葡聚糖、普鲁兰多糖、藻酸、明胶、果胶等,可以使用一种或混合使用两种以上。可优选列举出羟丙基纤维素、羟丙甲基纤维素、聚乙烯基吡咯烷酮、聚乙烯醇和预糊化淀粉,可进一步优选列举出羟丙基纤维素。作为水不溶性高分子,可列举出例如乙基纤维素(例如商品名:エトセル(エトセル10p))、醋酸纤维素等水不溶性纤维素醚;甲基丙烯酸氨基烷基酯共聚物rs(例如商品名:オイドラギットrl100、オイドラギットrlpo、オイドラギットrl30d、オイドラギットrs100、オイドラギットrspo、オイドラギットrs30d)、丙烯酸乙酯・甲基丙烯酸甲酯共聚物分散液(例如商品名:オイドラギットne30d)等水不溶性丙烯酸系共聚物;乙酸乙烯酯树脂等,可以使用一种或混合使用两种以上。可优选列举出乙基纤维素和甲基丙烯酸氨基烷基酯共聚物rs。本发明中,通过使用水不溶性高分子作为高分子,能够赋予缓释性、具有苦味的药物的苦味掩蔽功能。作为肠溶性高分子,可列举出例如醋酸羟丙甲纤维素琥珀酸酯(例如商品名:aqoatlf、aqoatmf、aqoathf、aqoatlg、aqoatmg、aqoathg)、羟丙甲基纤维素邻苯二甲酸酯(例如商品名:hpmcp50、hpmcp55、hpmcp55s)、甲基丙烯酸共聚物l(例如商品名:オイドラギットl100)、甲基丙烯酸共聚物ld(例如商品名:オイドラギットl30d-55)、干燥甲基丙烯酸共聚物ld(例如商品名:オイドラギットl100-55)、甲基丙烯酸共聚物s(例如商品名:オイドラギットs100)、甲基丙烯酸-丙烯酸正丁酯共聚物等甲基丙烯酸共聚物等,可以使用一种或混合使用两种以上。可优选列举出甲基丙烯酸共聚物l和干燥甲基丙烯酸共聚物ld。作为胃溶性高分子,可列举出例如聚乙烯醇缩乙醛二乙氨基乙酸酯等胃溶性聚乙烯基衍生物、甲基丙烯酸氨基烷基酯共聚物e(例如商品名:オイドラギットe100、オイドラギットepo)等胃溶性丙烯酸系共聚物等,可以使用一种或混合使用两种以上。可优选列举出甲基丙烯酸氨基烷基酯共聚物e。生物降解性高分子是指能够在生物体内发生分解的高分子。可列举出例如聚乳酸、聚乙醇酸、聚己内酯和它们的共聚物、胶原、几丁质、壳聚糖(例如商品名:フローナックc-100m)等,可以使用一种或混合使用两种以上。可优选列举出聚乳酸、聚乙醇酸、聚己内酯和它们的共聚物、明胶、胶原、几丁质和壳聚糖。本发明中,高分子可根据目的来选择。例如,为了实现药物在消化道内自药物颗粒的迅速溶出,作为高分子而优选使用水溶性高分子,为了实现药物的缓释性,作为高分子而优选使用水不溶性高分子,为了实现苦味掩蔽,优选使用水不溶性高分子、肠溶性高分子、胃溶性高分子等,为了抑制药物在胃内的溶出、加快其在小肠内的溶出,优选使用肠溶性高分子,为了实现大肠靶向,优选使用壳聚糖等。此外,可根据目的,将如水溶性高分子、水不溶性高分子等那样地具有不同功能的高分子混合两种以上来使用。本发明中的高分子优选使用粉末状态的高分子,可根据作为目标的含药物的颗粒的平均粒径、粒度分布来选择适当的平均粒径、粒度分布。此外,上述例示的高分子中还包括分散液状态的高分子,通过例如利用喷雾干燥等而制成粉末后,以粉末的形式使用,由此能够用于本发明。例如,为了获得粒度分布狭窄的含药物的颗粒,优选使用粒度分布狭窄的高分子粉末。进而,为了获得平均粒径大的含药物的颗粒,优选使用平均粒径大的高分子粉末,为了获得平均粒径小的含药物的颗粒,优选使用平均粒径小的高分子粉末。这表明:通过调整高分子粉末的大小和粒度分布,能够制作具有与目的相符的粒度分布的含药物的颗粒。本发明中作为原料使用的高分子的平均粒径为0.5μm以上,优选为5μm以上。其中,作为优选的方案,高分子的平均粒径为20μm以上、25μm以上、40μm以上、50μm以上。此外,高分子的平均粒径通常为5mm以下、优选为1mm以下、更优选为300μm以下、进一步优选为250μm、特别优选为200μm以下。高分子粉末也可以通过例如筛分法而选择性地使用特定粒度级分的粉末。具体而言,通过适当选择usp(美国药典)、ep(欧州药典)或jp(日本药典)中记载的筛编号的筛并进行分级,从而能够以具有期望粒度分布的高分子的形式来使用。此外,作为原料使用的高分子的粒度分布宽度(d90/d10)越小,含药物的颗粒的粒度分布宽度(d90/d10)越小。本发明中,高分子的平均粒径只要作为原料在上述范围即可,可以在含药物的颗粒的制备过程等中发生变化。本发明中,高分子的特征在于,其不用作溶液或悬浮状态的造粒液,而是使用容器旋转型搅拌装置,在粉体状态下与药物和溶剂混合,使容器和搅拌叶片发生旋转来造粒。但可以在能够发挥本发明效果的范围内,使一部分高分子、药物溶解或悬浮于溶剂中来使用。高分子的用量因药物的种类、其它添加剂的量、高分子的粒径、高分子的粘结力的强度等而异,通常相对于所制作的含药物的颗粒(中空颗粒)100重量%以4~50重量%、优选为4~40重量%、更优选为6~40重量%、8~40重量%、进一步优选为10~40重量%、更进一步优选为10~30重量%、特别优选为10~20重量%的范围来使用。此外,作为其它方案,对于高分子的用量,相对于所制作的含药物的颗粒(中空颗粒)100重量%,优选为5~50重量%、更优选为5~40重量%、进一步优选为5~30重量%、特别优选为5~25重量%的范围来使用。制备本发明的含药物的颗粒时,也可以根据需要来含有其它添加剂。其它添加剂的添加量可根据药物、高分子和/或溶剂的种类、量来适当调节。其它添加剂可以添加至添加高分子和溶剂之前的包含药物的粉末中。作为其它添加剂,只要是通常使用的添加剂就没有特别限定,可列举出例如赋形剂(例如大米淀粉等淀粉、d-甘露醇、碳酸镁)、粘结剂、甜味剂、矫味剂、矫臭剂、香料、流动化剂(例如aerosil)、抗静电剂、着色剂、崩解剂、润滑剂、增塑剂、防聚集剂、包衣剂等。该添加剂没有特别限定,即使在符合上述高分子的情况下,不溶解于所用溶剂时就不会发挥本发明的高分子的功能,作为添加剂来配合。其它添加剂优选为粉末。其它添加剂为粉末时,作为原料使用的其它添加剂的粉末的平均粒径为20μm以下、优选为10μm以下、更优选为5μm以下、进一步优选为3μm以下,优选与前述作为原料使用的药物粉末的平均粒径为相同程度或该程度以下。其它添加剂的平均粒径大时,无法形成包含高分子、药物和其它添加剂的期望颗粒,其它添加剂粗大时,呈现与本发明的含药物的颗粒发生分离的状态。其它添加剂的用量没有特别限定,用量越少则越能够获得药物含有率高的颗粒。药物含有率少的颗粒通过增加该添加剂的量来制备。也可以使其它添加剂溶解或分散于溶剂来添加,使其溶解时,其平均粒径没有特别限定,使其分散时,优选与前述添加剂的粉末的平均粒径为相同同程度或该程度以下。其它添加剂的平均粒径通常为0.005μm以上。本发明中,其它添加剂的平均粒径只要作为原料在上述范围即可,可以在含药物的颗粒的制备过程等中发生变化。作为本发明中的含药物的颗粒,可列举出:相对于含药物的颗粒100重量%,含有60~96重量%的药物和4~40重量%的高分子。其中可列举出:优选含有70~95重量%的药物和5~30重量%的高分子,更优选含有80~90重量%的药物和10~20重量%的高分子。作为包含其它添加剂时的本发明中的含药物的颗粒,可列举出:相对于含药物的颗粒100重量%,含有55~95.9重量%的药物、4~40重量%的高分子和0.1~5重量%的其它添加剂。其中可列举出:优选含有65~94.9重量%的药物、5~30重量%的高分子和0.1~5重量%的其它添加剂,更优选含有75~89.9重量%的药物、10~20重量%的高分子和0.1~5重量%的其它添加剂。此外,作为包含其它添加剂时的本发明的含药物的颗粒,可列举出:相对于含药物的颗粒100重量%,含有0.1~95.9重量%的药物、4~40重量%的高分子和0.1~95.9重量%的其它添加剂。其中可列举出:优选含有1~94重量%的药物、5~30重量%的高分子和1~94重量%的其它添加剂,更优选含有10~80重量%的药物、10~20重量%的高分子和10~80重量%的其它添加剂。此外,作为原料使用的高分子的平均粒径相对于作为原料使用的药物的平均粒径通常为5倍以上、优选为10倍以上、更优选为15倍以上、进一步优选为20倍以上、特别优选为25倍以上。此外,作为原料使用的高分子的平均粒径相对于作为原料使用的药物的平均粒径通常为10000000倍以下、优选为1000倍以下、更优选为500倍以下、进一步优选为100倍以下。使用其它添加剂时,对于制备含药物的颗粒而言,重要的是作为原料使用的药物和其它添加物的混合粉末的平均粒径。优选的是:作为原料使用的高分子的平均粒径相对于作为原料使用的药物和其它添加剂的混合粉末的平均粒径通常为5倍以上、优选为10倍以上、进一步优选为15倍以上、特别优选为25倍以上。此外,作为原料使用的高分子的平均粒径相对于作为原料使用的药物和其它添加剂的混合粉末的平均粒径通常为10000000倍以下、优选为1000倍以下、更优选为500倍以下、进一步优选为100倍以下。本说明书中,“包含药物的粉末”只要是包含药物的粉末状物即可,包括仅由一种药物组成的粉末、包含两种以上不同药物的粉末状混合物等。此处,本说明书中,作为原料使用的高分子的平均粒径相对于作为原料使用的药物的平均粒径为几倍用作为原料使用的高分子与作为原料使用的药物的平均粒径的粒度分布比(d50/d50)表示。同样地,作为原料使用的高分子的平均粒径相对于作为原料使用的药物和其它添加剂的混合粉末的平均粒径为几倍用作为原料使用的高分子与作为原料使用的药物和其它添加剂的混合粉末的平均粒径的粒度分布比(d50/d50)表示。此外,作为原料使用的高分子与作为原料使用的药物优选各自的粒度分布不重叠。具体而言,例如作为原料使用的高分子的体积基准测定中的累积10%粒径d10优选大于作为原料使用的药物的累积90%粒径d90。换言之,作为原料使用的高分子的累积10%粒径d10/作为原料使用的药物的累积90%粒径d90[高分子与药物的粒度分布比(d10/d90)]优选为1以上、更优选为2以上、进一步优选为4以上。此外,高分子与药物的粒度分布比(d10/d90)通常为5000000以下、优选为500以下、更优选为250以下、进一步优选为50以下。使用其它添加剂时,作为原料使用的高分子的体积基准测定中的累积10%粒径d10优选大于作为原料使用的药物和其它添加剂的混合粉末的累积90%粒径d90。换言之,作为原料使用的高分子的累积10%粒径d10/作为原料使用的药物和其它添加剂的混合粉末的累积90%粒径d90[高分子与药物和其它添加剂的混合粉末的粒度分布比(d10/d90)]优选为1以上、更优选为2以上、进一步优选为4以上。此外,作为原料使用的高分子与作为原料使用的药物和其它添加剂的混合粉末的粒度分布比(d10/d90)通常为5000000以下、优选为500以下、更优选为250以下、进一步优选为50以下。本说明书中,“溶剂”是指在药品、医药外用品、化妆品、食品等领域中允许的所有溶剂,只要是能够溶解所用高分子的溶剂即可。从将本发明的含药物的颗粒用作医药的观点出发,优选为医药上可允许的溶剂。这种溶剂根据药物、高分子、添加剂的种类等来适当选择,可以混合使用多种溶剂。作为本发明中的“溶剂”,可列举出例如水、醇系溶剂(例如甲醇、乙醇、正丙醇、异丙醇、2-甲氧基乙醇、2-乙氧基乙醇等可以取代的低级烷醇)、酮系溶剂(例如丙酮、甲乙酮等低级烷基酮)、酯系溶剂(例如乙酸乙酯等乙酸的低级烷基酯)和它们的混合溶剂。具体而言,本发明中,作为高分子而使用水溶性高分子时,作为溶剂,可以使用能够溶解该高分子的溶剂(例如水、含水醇系溶剂等),可特别适合地使用水或含水乙醇。此外,作为高分子而使用水不溶性高分子时,作为溶剂,可以使用能够溶解该高分子的溶剂(例如醇系溶剂、酮系溶剂、酯系溶剂等),对于胃溶性高分子、肠溶性高分子、壳聚糖等高分子,作为所有溶剂,可以使用能够溶解该高分子的溶剂(例如醇系溶剂、更具体为乙醇)。本发明中的溶剂用量因药物、高分子的种类、它们的量等而异,通常相对于构成含药物的颗粒的各成分的总量100重量份为5~60重量份、优选为10~40重量份、更优选为15~25重量份、进一步优选为18~22重量份。本说明书中,“添加”是指在药品的制备工序等中使用的通过例如滴加、喷雾等而添加溶剂的方法。所使用的溶剂只要能够应用即可,可根据本发明的含药物的颗粒所含的药物、高分子、添加剂等的种类或性质等来适当选择。作为本发明中的“添加”,通过在容器旋转型搅拌装置中进行滴加,从而不需要控制喷雾时的送液速度,能够用短时间来制备。此外,在安装有削刮工具的容器旋转型搅拌装置中,无论滴加或喷雾的添加方法,均能够减少颗粒对于装置内侧面的附着,改善从装置回收含药物的颗粒的效率。本发明的制备方法本发明的含药物的颗粒的制备方法的特征在于,通过使用容器旋转型搅拌装置,一边使容器和搅拌叶片旋转,一边向包含药物(上述(i))的粉末中添加高分子和能够溶解高分子的溶剂后,使容器和搅拌叶片发生旋转来造粒,并进行干燥,由此得到含药物的颗粒。对于本发明中的容器旋转速度和搅拌叶片旋转速度,只要混合物发生流动即可,没有特别限定。容器旋转速度通常为0.1~1m/s,优选为0.4~1m/s。搅拌叶片旋转速度通常为5.9~34m/s,优选为9.8~23m/s。根据所用的装置,旋转速度的设定为rpm(每1分钟的转数、rotationsperminute)时,可基于下式进行计算来设定。旋转速度(rpm)=旋转速度(m/s)×60/(容器或搅拌叶片的直径×圆周率(π))具体而言,在强力混合机(インテンシブミキサー)r02型(日本アイリッヒ公司制)的情况下,容器的直径为0.235m,搅拌叶片的直径为0.125m,因此,上述旋转速度的范围如下所述。即,容器旋转速度通常为10~84rpm,优选为30~60rpm。此外,搅拌叶片旋转速度通常为900~5000rpm,优选为1500~3500rpm。在eirichcleanline(アイリッヒクリーンライン)c5型(日本アイリッヒ公司制)的情况下,容器的直径为0.235m,搅拌叶片的直径为0.125m,因此,上述旋转速度的范围如下所述。即,容器旋转速度通常为34~87rpm,优选为34~60rpm。此外,搅拌叶片旋转速度通常为360~5400rpm,优选为1500~3500rpm。在eirichcleanlinec50型(日本アイリッヒ公司制)的情况下,容器的直径为0.600m,搅拌叶片的直径为0.280m,因此,上述旋转速度的范围如下所述。即,容器旋转速度通常为10~48.5rpm,优选为20~30rpm。此外,搅拌叶片旋转速度通常为500~2000rpm,优选为1000~2000rpm。关于本发明中的溶剂添加方法,没有特别限定,耗时30秒以上进行添加时,会均匀地添加至粉末或粉末状混合物中,故而是理想的。具体而言,可列举出使用了漏斗的注入、滴加;从容器中直接注入、滴加等。此外,也可以如以往那样地喷雾溶剂。关于本发明中的“添加高分子和能够溶解高分子的溶剂”的顺序,先添加哪一者均可,以任意顺序进行添加的方式也包括在本发明内。作为本发明所使用的装置,只要容器和搅拌叶片发生旋转即可。可列举出例如容器旋转型搅拌装置、容器旋转型搅拌混合机、容器旋转型强制搅拌混合机等,可优选列举出容器旋转型搅拌装置。具体而言,可列举出例如强力混合机(日本アイリッヒ公司制)、dmk型混合机(タイガーマシーン制作所制)(チヨダマシナリー制)、mz型混合机(エムアイジー公司制)、ツブラー(日工公司制)等。作为本发明所使用的装置,可进一步具备削刮工具,该削刮工具的材质通常可以是聚四氟乙烯、聚酰胺和sus等材质,优选为聚酰胺的材质。此外,为了减少含药物的颗粒对于容器旋转型搅拌装置内侧壁的附着,削刮工具相对于容器旋转型搅拌装置内的侧壁的设置距离通常为0~50mm,优选为0~10mm,更优选为0~3mm。作为本发明中的干燥方法,可适当选择自身公知的方法。可列举出例如盘式干燥机、基于流化床的干燥等,从制备性的观点出发,优选为基于流化床的干燥。通过本发明而制备的含药物的颗粒通过本发明的制备方法而得到的含药物的颗粒是包含壳(或壁)和中空部的颗粒,是壳包含药物和高分子的颗粒。或者,是具有由包含药物和高分子的组合物形成的壁将中空部包围的结构的颗粒。前述颗粒的特征是颗粒内部具有中空结构这一点。该“中空”与通常的片剂中存在那样的存在位置不固定的多个空隙的存在状态不同,是指被含有药物的组合物的壁(壳(shell))包围而完全独立的单一地存在于颗粒中心的空孔,可利用例如电子显微镜、光学显微镜来确认其存在。本发明的含药物的颗粒中的中空相对于颗粒整体体积的体积比率为1%~50%、优选为1%~30%、更优选为1.5%~30%、特别优选为2%~30%左右。前述中空的体积比率通过中空的体积除以颗粒的体积来求出。通过本发明的制备方法而制备的颗粒通常球形度高,因此,中空和颗粒均假设为球体来求出体积。中空和颗粒的体积通过利用x射线ct(计算机断层摄影装置)测定求出颗粒中心部分的中空和颗粒的长径和短径,并分别将其平均值假设为中空直径和颗粒直径,求出球体的体积来算出。详细而言,本发明中的“中空的体积比率”通过利用下式进行计算来求出。中空的体积比率[%]=(4/3×π×(中空部的直径/2)3)/(4/3×π×(含药物的颗粒的粒径/2)3)×100该含药物的颗粒的粒径和中空部的直径利用台式显微ct扫描(skyscan公司制、skyscan1172)非破坏性地进行测定,使用10次测定得到的平均值。通过本发明的制备方法而得到的含药物的颗粒在中空的外侧存在有壁(壳)。本发明中的含药物的颗粒的壳厚度可任意设定,若壳厚度小,则该颗粒的强度变弱。本发明中的含药物的颗粒的壳厚度优选为10μm以上、更优选为15μm以上、进一步优选为20μm以上、最优选为30μm以上。该壳厚度可通过例如x射线ct(计算机断层摄影装置)进行测定。此外,本发明中的含药物的颗粒的壳厚度比率是任意的,通过下式来求出。该壳厚度比率优选为20~80%,更优选为30~70%。壳厚度比率[%]=(壳厚度/(含药物的颗粒的粒径/2))×100通过本发明的制备方法而得到的含药物的颗粒的特征是能够自由调整颗粒大小这一点。因此,能够将该含药物的颗粒的平均粒径调整至1~7000μm左右、优选调整至5~1000μm左右、更优选调整至10~500μm左右、进一步优选调整至10~400μm左右、更进一步优选调整至20~300μm左右、特别优选调整至50~300μm左右的范围。从颗粒强度的观点出发,该含药物的颗粒的平均粒径优选为50~7000μm左右、更优选为50~1000μm左右、进一步优选为50~500μm左右。此外,作为其它方案,能够将该含药物的颗粒的平均粒径优选调整至70~7000μm左右、更优选调整至70~1000μm左右、进一步优选调整至70~500μm左右、尤其是更优选调整至70~300μm左右、最优选调整至100~300μm左右的范围。本发明中,所得含药物的颗粒大小如上所述,可通过调整高分子的平均粒径来调整。通过本发明的制备方法而得到的含药物的颗粒中存在中空部,中空部的直径通常为10μm以上。此外,该含药物的颗粒的中空部的直径能够自由调节,通常可调整至10~5000μm左右、优选调整至20~700μm左右、更优选调整至30~300μm左右、进一步优选调整至50~200μm左右。针对该含药物的颗粒,可配合上述颗粒的大小(平均粒径)来自由改变中空部的比例。本说明书中,“中空部的直径”通过利用下式进行计算来求出。中空部的直径[μm]=(中空部的长径+中空部的短径)/2该颗粒的中空部的长径和短径利用台式显微ct扫描(skyscan公司制、skyscan1172)非破坏性地进行测定,并使用10次测定得到的平均值。本说明书中,“壳厚度”通过利用下式进行计算来求出。壳厚度[μm]=(含药物的颗粒的粒径-中空部的直径)/2该含药物的颗粒的粒径和中空部的直径利用台式显微ct扫描(skyscan公司制、skyscan1172)非破坏性地进行测定,并使用10次测定得到的平均值。本说明书中,“壳厚度比率”通过利用下式进行计算来求出。壳厚度比率[%]=(壳厚度/(含药物的颗粒的粒径/2))×100该含药物的颗粒的粒径利用台式显微ct扫描(skyscan公司制、skyscan1172)非破坏性地进行测定,并使用10次测定得到的平均值。本说明书中,“中空的体积比率”通过利用下式进行计算来求出。中空的体积比率[%]=(4/3×π×(中空部的直径/2)3)/(4/3×π×(含药物的颗粒的粒径/2)3)×100该含药物的颗粒的粒径和中空部的直径利用台式显微ct扫描(skyscan公司制、skyscan1172)非破坏性地进行测定,并使用10次测定得到的平均值。此外,通过本发明的制备方法而得到的含药物的颗粒以具有球形作为一个方案。此处,“球形”是指长径比为1.0~1.5。优选为1.0~1.4、更优选为1.0~1.3。通过具有该形状,压片时、制备胶囊剂时等填充含药物的颗粒时的流动性良好,进而,进行包衣等加工时,效率也提高。本说明书中,“长径比”是指颗粒的短径与长径之比,成为表示真球度的标准。该长径比通过利用例如下式进行计算来求出。长径比=颗粒的长径/颗粒的短径该颗粒的长径、短径利用台式显微ct扫描(skyscan公司制、skyscan1172)非破坏性地进行测定,并使用10次测定得到的平均值。此外,可以使用ミリトラックjpa(日机装公司制)进行测定。本说明书中,“高分子与药物的粒度分布比(d50/d50)”通过利用下式进行计算来求出。高分子与药物的粒度分布比(d50/d50)=高分子的d50/药物的d50本说明书中,“高分子与药物和其它添加剂的混合粉末的粒度分布比(d50/d50)”通过利用下式进行计算来求出。高分子与药物和其它添加剂的混合粉末的粒度分布比(d50/d50)=高分子的d50/药物和其它添加剂的混合粉末的d50该高分子、药物、以及药物和其它添加剂的混合粉末的粒度分布通过利用激光衍射式粒度分布测定装置(例如particleviewer(パウレック公司制)、sald-3000j(岛津制作所制)或helos&rodos(sympatec公司制))按照体积基准来测定。本说明书中,“高分子与药物的粒度分布比(d10/d90)”通过利用下式进行计算来求出。高分子与药物的粒度分布比(d10/d90)=高分子的d10/药物的d90本说明书中,“高分子与药物和其它添加剂的混合粉末的粒度分布比(d10/d90)”通过利用下式进行计算来求出。高分子与药物和其它添加剂的混合粉末的粒度分布比(d10/d90)=高分子的d10/药物和其它添加剂的混合粉末的d90该高分子、药物、以及药物和其它添加剂的混合粉末的粒度分布通过利用激光衍射式粒度分布测定装置(例如particleviewer(パウレック公司制)、sald-3000j(岛津制作所制)或helos&rodos(sympatec公司制))按照体积基准进行测定。本说明书中,“粒度分布宽度小”是指具体的粒度分布比(例如d90/d10)为6.0以下。通过本发明的制备方法而得到的含药物的颗粒作为医药或医药原料是有用的,能够对人或动物进行口服给药或非口服给药。给药量根据所使用的药物来适当选择即可。通过本发明的制备方法而得到的含药物的颗粒通常以含有多个该含药物的颗粒的医药或药物组合物的形式使用。通过本发明的制备方法而得到的含药物的颗粒可根据其使用目的而制成各种剂型。例如,该含药物的颗粒可以直接用作颗粒剂、在使用时加以调制而使用的注射剂、体内包埋剂型等。此外,该含药物的颗粒也可以与任意添加剂混合,并进行压片而制成片剂(包括口腔内崩解片),还可以装入胶囊而制成胶囊剂。进而,该含药物的颗粒也可以以悬浮剂(水性悬浮剂、油性悬浮剂)、乳剂等的形式来使用。实施例以下,列举出实施例和试验例,更具体地说明本发明,但本发明不限定于它们。此外,可以在不超出本发明范围的范围内变更本发明。应予说明,下述实施例和试验例中示出的化合物名未必遵循iupac命名法。本实施例和试验例中,只要没有特别说明,则溶剂的%表示(w/w%),颗粒的%表示重量%。本实施例和试验例中使用的药物、高分子和添加剂只要没有特别说明,则使用下述物质。5,5-二苯基咪唑烷咪唑烷-2,4-二酮(苯妥英):室町ケミカル公司苯并[d]异噁唑-3-基甲烷磺酰胺(唑尼沙胺):十全化学公司n-(4-羟基苯基)乙酰胺(对乙酰氨基酚):山本化学工业公司乳糖(sorbolac400):メグレ・ジャパン公司玉米淀粉(玉米淀粉):火乃国食品公司羟丙基纤维素(hpc-l):日本曹达公司甲基丙烯酸季铵基烷基酯共聚物(アンモニオアルキルメタクリレートコポリマー)rs(オイドラギットrspo):エボニックデグサジャパン公司用于制备本实施例的制备设备如下所示。实施例1、2使用强力混合机r02型(日本アイリッヒ公司制)。削刮工具的材质为聚酰胺,削刮工具相对于容器旋转型搅拌装置内的侧壁的设置距离设定为0~3mm。实施例3~12使用eirichcleanlinec5型(日本アイリッヒ公司制)。削刮工具的材质为聚酰胺,削刮工具相对于容器旋转型搅拌装置内的侧壁的设置距离设定为0~3mm。实施例13~14使用eirichcleanlinec50型(日本アイリッヒ公司制)。削刮工具的材质为聚酰胺,削刮工具相对于容器旋转型搅拌装置内的侧壁的设置距离设定为0~3mm。本实施例和试验例中的试验方法如下所示。(通过本发明的制备方法而得到的含药物的颗粒的外观和截面)颗粒的外观和截面利用扫描型电子显微镜(3dリアルサーフェスビュー显微镜、キーエンス公司制、ve-8800型)进行观察。(含药物的颗粒的内部状态)含药物的颗粒的内部状态利用台式显微ct扫描(skyscan公司制、skyscan1172)非破坏性地进行观察。实施例1将下述表1记载的5,5-二苯基咪唑烷-2,4-二酮、乳糖和玉米淀粉投入至容器旋转型搅拌装置(强力混合机r02型、日本アイリッヒ公司制)中,进行30秒的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用漏斗用1分钟滴加205.34g的水后,搅拌10秒钟(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),一边用50秒钟投入表1记载的羟丙基纤维素,进而混合6分30秒(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制),使其干燥,由此得到实施例1的颗粒。需要说明的是,5,5-二苯基咪唑烷-2,4-二酮、乳糖和玉米淀粉的混合粉末的d50为8.85μm,d90为21.55μm,羟丙基纤维素的d50为142.37μm,d10为47.18μm,因此,由前述计算式算出的“高分子与药物和其它添加剂的混合粉末的粒度分布比(d50/d50)”和“高分子与药物和其它添加剂的混合粉末的粒度分布比(d10/d90)”分别为16和2.2。[表1]*不残留在含药物的颗粒内。实施例2将下述表2记载的5,5-二苯基咪唑烷-2,4-二酮、乳糖、玉米淀粉和羟丙基纤维素投入至容器旋转型搅拌装置(强力混合机r02型、日本アイリッヒ公司制)中,进行30秒的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用漏斗用1分钟滴加206.03g的水后,搅拌5分30秒(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例2的颗粒。需要说明的是,由前述计算式算出的“高分子与药物和其它添加剂的混合粉末的粒度分布比(d50/d50)”和“高分子与药物和其它添加剂的混合粉末的粒度分布比(d10/d90)”分别为16和2.2。[表2]*不残留在含药物的颗粒内。试验例1分别使用扫描型电子显微镜(3dリアルサーフェスビュー显微镜、キーエンス公司制、ve-8800型),观察实施例1和实施例2的含药物的颗粒的外观和截面(图1~图4)。根据图1~图4可确认:实施例1和实施例2的含药物的颗粒从外观来看为球状颗粒,从截面来看在颗粒的中央部存在空洞部。试验例2利用台式显微ct扫描(skyscan公司制、skyscan1172)非破坏性地观察实施例1、实施例2的含药物的颗粒的内部状态(图5、图6)。其结果可确认:在实施例1、实施例2的含药物的颗粒的内部存在中空。实施例3将下述表3记载的n-(4-羟基苯基)乙酰胺和羟丙基纤维素投入至容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用漏斗用约50秒钟滴加117.18g的水后,搅拌29分钟(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例3的颗粒。[表3]*不残留在含药物的颗粒内。实施例4将下述表4记载的n-(4-羟基苯基)乙酰胺和甲基丙烯酸季铵基烷基酯共聚物rs投入至容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用漏斗用约55秒钟滴加125.00g的无水乙醇后,搅拌1分45秒(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例4的颗粒。[表4]*不残留在含药物的颗粒内。实施例5将下述表5记载的5,5-二苯基咪唑烷-2,4-二酮和羟丙基纤维素投入至安装有削刮工具的容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用漏斗用48秒钟滴加119.85g的水后,搅拌15分钟(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,不实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例5的颗粒。[表5]*不残留在含药物的颗粒内。实施例6将下述表6记载的5,5-二苯基咪唑烷-2,4-二酮和羟丙基纤维素投入至安装有削刮工具的容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用喷射装置用26分钟喷雾149.60g的水后,搅拌2分钟(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例6的颗粒。[表6]*不残留在含药物的颗粒内。实施例7将下述表7记载的5,5-二苯基咪唑烷-2,4-二酮和甲基丙烯酸季铵基烷基酯共聚物rs投入至安装有削刮工具的容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用漏斗用40秒钟滴加98.50g的无水乙醇后,搅拌10分钟(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例7的颗粒。[表7]*不残留在含药物的颗粒内。实施例8将下述表8记载的5,5-二苯基咪唑烷-2,4-二酮和甲基丙烯酸季铵基烷基酯共聚物rs投入至安装有削刮工具的容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用喷射装置用23分钟喷雾139.88g的无水乙醇后,搅拌2分钟(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例8的颗粒。[表8]*不残留在含药物的颗粒内。实施例9将下述表9记载的苯并[d]异噁唑-3-基甲烷磺酰胺和羟丙基纤维素投入至安装有削刮工具的容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用漏斗用45秒钟滴加105.74g的水后,搅拌25分钟(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例9的颗粒。[表9]*不残留在含药物的颗粒内。实施例10将下述表10记载的苯并[d]异噁唑-3-基甲烷磺酰胺和羟丙基纤维素投入至安装有削刮工具的容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用喷射装置用22分30秒喷雾135.88g的水后,搅拌2分钟(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例10的颗粒。[表10]*不残留在含药物的颗粒内。实施例11将下述表11记载的苯并[d]异噁唑-3-基甲烷磺酰胺和甲基丙烯酸季铵基烷基酯共聚物rs投入至安装有削刮工具的容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用漏斗用40秒钟滴加103.84g的无水乙醇后,搅拌8分钟(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例11的颗粒。[表11]*不残留在含药物的颗粒内。实施例12将下述表12记载的苯并[d]异噁唑-3-基甲烷磺酰胺和甲基丙烯酸季铵基烷基酯共聚物rs投入至安装有削刮工具的容器旋转型搅拌装置(eirichcleanlinec5型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1500rpm(9.8m/s)、容器旋转速度:42rpm(0.5m/s))。接着,一边搅拌(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),一边使用喷射装置用23分钟喷雾133.51g的无水乙醇后,搅拌3分钟(搅拌叶片旋转速度:3000rpm(19.6m/s)、容器旋转速度:42rpm(0.5m/s)),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到实施例12的颗粒。[表12]*不残留在含药物的颗粒内。实施例13将下述表13记载的5,5-二苯基咪唑烷-2,4-二酮和羟丙基纤维素投入至容器旋转型搅拌装置(eirichcleanlinec50型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1400rpm(20.5m/s)、容器旋转速度:25rpm(0.78m/s))。接着,一边搅拌(搅拌叶片旋转速度:1400rpm(20.5m/s)、容器旋转速度:25rpm(0.78m/s)),一边使用漏斗用1分钟滴加1200g的水后,搅拌30分钟(搅拌叶片旋转速度:1400rpm(20.5m/s)、容器旋转速度:25rpm(0.78m/s)),得到湿粉状态的含药物的颗粒。通过使该湿粉颗粒进行自然干燥而得到实施例13的颗粒。[表13]*不残留在含药物的颗粒内。实施例14将下述表14记载的5,5-二苯基咪唑烷-2,4-二酮和羟丙基纤维素投入至容器旋转型搅拌装置(eirichcleanlinec50型、日本アイリッヒ公司制)中,进行2分钟的预混合(搅拌叶片旋转速度:1400rpm(20.5m/s)、容器旋转速度:25rpm(0.78m/s))。接着,一边搅拌(搅拌叶片旋转速度:1400rpm(20.5m/s)、容器旋转速度:25rpm(0.78m/s)),一边使用喷射装置用约45分钟喷雾1440g的水后,搅拌15秒钟(搅拌叶片旋转速度:1400rpm(20.5m/s)、容器旋转速度:25rpm(0.78m/s)),得到湿粉状态的含药物的颗粒。通过使该湿粉颗粒进行自然干燥而得到实施例14的颗粒。[表14]*不残留在含药物的颗粒内。比较例1将下述表15记载的5,5-二苯基咪唑烷-2,4-二酮和羟丙基纤维素投入至高速搅拌造粒机(バーチカルグラニュレーターvg05型、パウレック公司制)中,进行2分钟的预混合(桨旋转速度:400rpm、交叉螺杆(クロススクリュー)旋转速度:3000rpm)。接着,一边搅拌(桨旋转速度:400rpm、交叉螺杆旋转速度、3000rpm),一边使用喷射装置用17分30秒喷雾105.00g的水后,搅拌2分钟(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到比较例1的颗粒。[表15]*不残留在含药物的颗粒内。比较例2将下述表16记载的5,5-二苯基咪唑烷-2,4-二酮和甲基丙烯酸季铵基烷基酯共聚物rs投入至高速搅拌造粒机(バーチカルグラニュレーターvg05型、パウレック公司制)中,进行2分钟的预混合(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm)。接着,一边搅拌(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm),一边使用喷射装置用10分钟喷雾120.00g的无水乙醇后,搅拌2分钟(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到比较例2的颗粒。[表16]*不残留在含药物的颗粒内。比较例3将下述表17记载的苯并[d]异噁唑-3-基甲烷磺酰胺和羟丙基纤维素投入至高速搅拌造粒机(バーチカルグラニュレーターvg05型、パウレック公司制)中,进行2分钟的预混合(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm)。接着,一边搅拌(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm),一边使用喷射装置用12分30秒喷雾100.00g的水后,搅拌2分钟(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到比较例3的颗粒。[表17]*不残留在含药物的颗粒内。比较例4将下述表18记载的苯并[d]异噁唑-3-基甲烷磺酰胺和甲基丙烯酸季铵基烷基酯共聚物rs投入至高速搅拌造粒机(バーチカルグラニュレーターvg05型、パウレック公司制)中,进行2分钟的预混合(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm)。接着,一边搅拌(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm),一边使用喷射装置用28分20秒喷雾170.00g的无水乙醇后,搅拌2分钟(桨旋转速度:400rpm、交叉螺杆旋转速度:3000rpm),得到湿粉状态的含药物的颗粒。需要说明的是,制备含药物的颗粒时,未实施容器内的刮取操作。将该湿粉颗粒投入至流化床造粒机(mp-01、パウレック公司制)中,使其干燥,由此得到比较例4的颗粒。[表18]*不残留在含药物的颗粒内。试验例3分别使用扫描型电子显微镜(3dリアルサーフェスビュー显微镜、キーエンス公司制、ve-8800型)观察实施例3~14和比较例1~4的含药物的颗粒的外观(图7~图22)。根据图7~图22可确认:实施例3~14和比较例1~4的含药物的颗粒从外观来看是球状的颗粒。试验例4利用台式显微ct扫描(skyscan公司制、skyscan1172)非破坏性地观察实施例3~14和比较例1~4的含药物的颗粒的内部状态(图23~图38)。其结果可确认:实施例3~14和比较例1~4的含药物的颗粒的内部存在中空。试验例5制作实施例5~14和比较例1~4的含药物的颗粒后,将未附着于容器的含药物的颗粒全部回收,用500μm筛对回收品进行过筛。算出通过500μm筛的制品(合格品)相对于投料量的比率而得到结果(表19、表20),根据表19可确认:实施例5、7、9、11、13和14示出能够进行自动造粒的高收率,根据表20可确认:实施例6、8、10和12的通过500μm筛的制品(合格品)的比率比比较例1~4中得到的通过500μm筛的制品(合格品)要高。需要说明的是,(表20)是为了能够对比而使上段和下段为相同成分的记载方法。[表19]实施例5实施例7实施例9实施例11实施例13实施例1481.5%84.8%68.6%81.9%88.0%85.1%[表20]实施例6实施例8实施例10实施例1288.3%85.9%72.6%76.4%比较例1比较例2比较例3比较例460.7%74.9%57.6%69.4%产业上的可利用性根据本发明,与以往的制备方法相比,能够在短时间且简便地提供具有能够容易地进行压片、包衣等加工这一程度的充分强度,且具备药学上有用的期望功能的具有中空结构的球状的含药物的颗粒。此外,通过本发明,能够减少含药物的颗粒对于装置内侧壁的附着,大幅改善含药物的颗粒的制备工序中的收率。本申请基于日本特愿2018-026095,其内容全部援引至本说明书中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1