包含抗癌病毒和羟基脲作为有效成分的预防或治疗癌症的药物组合物的制作方法
本发明涉及预防或治疗癌症的药物组合物,其包含溶瘤病毒和羟基脲作为活性成分。
背景技术:
溶瘤病毒具有优异的肿瘤特异性靶向能力,在癌细胞中的增殖能力和癌细胞杀伤能力。近来,已经进行了基于溶瘤病毒的各种临床研究。2015年,随着作为基于单纯疱疹病毒的溶瘤病毒的塔立拉合(talimogenelaherparepvec,t-vec)成功商业化为晚期黑素瘤的治疗剂,溶瘤病毒领域在美国和欧洲展开了新纪元。
近来,溶瘤病毒的用途超过了它们自身的功效,并且病毒激活了肿瘤免疫力,从而显示出它们作为与另一种免疫治疗剂联用的治疗剂的潜力。直到2000年(溶瘤病毒发展的早期阶段),病毒的癌细胞特异性增殖引起的病毒直接杀伤作用仍相对更为重要。但是,随后的临床研究发现,激活肿瘤免疫力,而非直接的癌细胞杀伤作用是关键机制。基于这一发现,最近正在开发包含组合给予的溶瘤病毒和免疫治疗剂,例如免疫检查点抑制剂的治疗剂。这是因为已知溶瘤病毒将其中免疫力受到抑制的肿瘤微环境转变成适于免疫治疗的肿瘤微环境。
然而,到目前为止,在许多溶瘤病毒的临床研究中,肿瘤的微环境被忽视了。在临床研究中,利用溶瘤病毒作治疗可能会导致急性肿瘤坏死,持久反应或完全反应,但在某些情况下,可能会导致难以预测的结果(药效学变异性),例如疾病进展或早期死亡。举例来说,对于基于牛痘病毒的pexa-vec,在1期临床试验中,患者在用溶瘤病毒治疗后的一个月内过早死亡。
因此,为增强溶瘤病毒的治疗效果,有必要了解癌细胞、患者的免疫状态和溶瘤病毒之间的相互作用;并且基于这种理解,需要对可以增加溶瘤病毒的临床功效的技术进行研究。
技术实现要素:
技术问题
本发明人研究了(如何)增强溶瘤病毒的抗癌作用。结果,本发明人发现,与仅给予溶瘤病毒的常规案例相比,将溶瘤病毒和羟基脲组合给予患有癌症的个体时,实现了优异的抗癌效果,从而完成了本发明。
解决技术问题的技术方案
为解决上述技术问题,本发明在一方面提供了预防或治疗癌症的药物组合物,其包含溶瘤病毒和羟基脲作为活性成分。
本发明在另一方面提供了治疗癌症的方法,包括给予患有癌症的对象溶瘤病毒和羟基脲的步骤。
本发明的有利效果
与仅给予溶瘤病毒的常规案例相比,包含溶瘤病毒和羟基脲作为活性成分的预防或治疗癌症的本发明药物组合物具有优异的抗癌作用和安全性,能够抑制对溶瘤病毒具有抗性的癌细胞的增殖并能够杀伤溶瘤病毒可在其中增殖的癌细胞。因此,预防或治疗癌症的本发明药物组合物可以有效用于治疗癌症。
附图简述
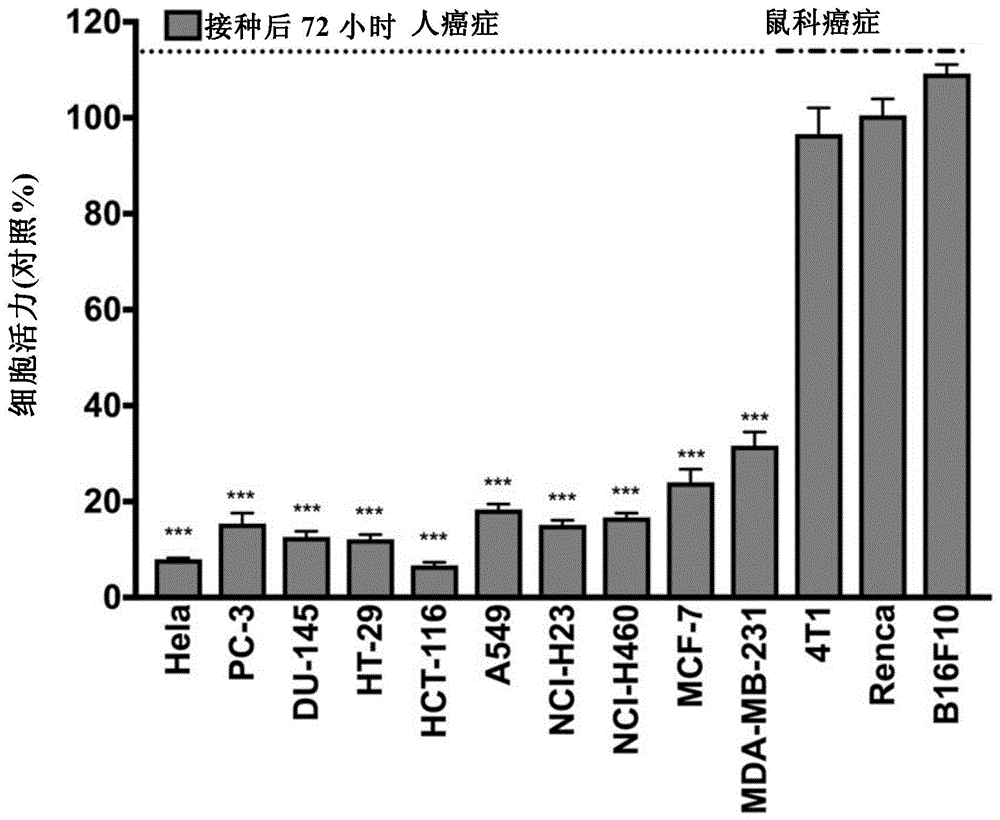
图1示出了通过用溶瘤病毒(ots-412)处理13种癌细胞系,然后观察其细胞活力而获得的结果。
图2显示了通过将溶瘤病毒(vvtk-)、基因重组人粒细胞集落刺激因子(rhg-csf)和羟基脲(hu)给予植入小鼠肾癌细胞的小鼠(rencai),然后测量小鼠肿瘤大小获得的结果。
图3显示了通过将溶瘤病毒(vvtk-)、rhg-csf和hu给予植入小鼠肾癌细胞的小鼠(rencai),然后测量小鼠体重获得的结果。
图4示意性显示了鉴定在植入小鼠肾癌细胞的小鼠(rencaii)中组合给予溶瘤病毒(vvtk-)和hu获得的抗癌疗效的实验方案。
图5显示了通过将溶瘤病毒(vvtk-)和hu给予植入小鼠肾癌细胞的小鼠(rencaii),然后测量小鼠肿瘤大小获得的结果。
图6显示了通过将溶瘤病毒(wrvvtk-)和hu全身给予植入小鼠肾癌细胞的小鼠(rencaiii),然后测量小鼠肿瘤大小获得的结果。
图7显示了通过将溶瘤病毒(ots-412)和hu给予植入小鼠乳腺癌细胞的小鼠(4t1),然后测量小鼠肿瘤大小获得的结果。
图8显示了通过将溶瘤病毒(ots-412)和hu施用于植入小鼠乳腺癌细胞的小鼠(4t1),然后对18天后处死小鼠的肿瘤表面上出现的结节数进行计数而获得的结果。
图9显示了通过将溶瘤病毒(ots-412)和hu给予植入小鼠乳腺癌细胞的小鼠(4t1),然后测量21天的体重变化获得的结果。
图10显示了通过将溶瘤病毒(ots-412)和高剂量hu给予植入小鼠乳腺癌细胞的小鼠(4t1),然后测量肿瘤大小获得的结果。
图11显示了通过将溶瘤病毒(ots-412)和高剂量hu给予植入小鼠乳腺癌细胞的小鼠(4t1),然后测量存活率获得的结果。
图12显示了通过将溶瘤病毒(ots-412)和hu给予植入人肺癌细胞(nci-h460)的小鼠,然后测量15天的肿瘤大小获得的结果。
图13显示了通过将溶瘤病毒(ots-412)和hu给予植入人结肠直肠癌细胞(hct-116)的小鼠,然后测量28天的肿瘤大小获得的结果。
图14显示了通过将溶瘤病毒(ots-412)和hu给予植入人结肠直肠癌细胞(hct-116)的小鼠,然后在给药后第17天比较各组中小鼠的肿瘤图像获得的结果。
图15显示了通过将溶瘤病毒(ots-412)和hu给予植入人结肠直肠癌细胞(hct-116)的小鼠,然后在给药后第28天比较各组中小鼠的肿瘤图像获得的结果。
图16显示了通过将溶瘤病毒(ots-412)和hu给予植入人结肠直肠癌细胞(ht-29)的小鼠,然后进行全小鼠肿瘤的h&e染色获得的结果。
图17显示了通过将溶瘤病毒(ots-412)和hu给予植入人结肠直肠癌细胞(ht-29)的小鼠,然后肿瘤组织的tunel染色获得的结果。
图18显示了通过将单纯疱疹病毒1(hsv1)和hu给予植入小鼠肾癌细胞的小鼠,然后测量肿瘤大小而获得的结果。
图19显示了通过将腺病毒和hu给予植入小鼠肾癌细胞的小鼠,然后测量肿瘤大小而获得的结果。
实施本发明的最佳方式
下文将详述本发明。
在一方面,本发明提供了预防或治疗癌症的药物组合物,其包含溶瘤病毒和羟基脲作为活性成分。
该药物组合物中包含的溶瘤病毒和羟基脲可以同时、顺序或以相反顺序组合给予。具体地说,溶瘤病毒和羟基脲可以同时给予。此外,可以首先给予羟基脲,然后给予溶瘤病毒。此外,可以首先给予溶瘤病毒,然后给予羟基脲。另外,可以首先给予羟基脲,然后给予溶瘤病毒,随后可以再次给予羟基脲。
本文所用的术语“溶瘤病毒”是指破坏癌细胞的重组病毒,该重组病毒通过操纵病毒基因以使其仅在癌细胞中特异性增殖而获得。溶瘤病毒可以源自腺病毒、单纯疱疹病毒、麻疹病毒、慢病毒、逆转录病毒、巨细胞病毒、杆状病毒、腺伴随病毒、粘液瘤病毒、水疱性口炎病毒、脊髓灰质炎病毒、新城疫病毒、细小病毒、柯萨奇病毒、塞内卡病毒、牛痘病毒或正痘病毒。优选地,溶瘤病毒可以源自牛痘病毒、单纯疱疹病毒或腺病毒。
牛痘病毒可以是但不限于西储(westernreserve,wr)、纽约牛痘病毒(nyvac)、惠氏(wyeth,纽约市卫生局;nycboh)、lc16m8、李斯特(lister)、哥本哈根、天坛(tiantan)、苏联、塔什干、埃文斯、国际卫生部-j(internationalhealthdivision-j,ihd-j)或国际卫生部-怀特(internationalhealthdivision-white,ihd-w)牛痘病毒株。
溶瘤病毒可以是其中胸苷激酶(tk)基因缺失的溶瘤病毒。溶瘤病毒可以是胸苷激酶基因缺失并且突变的单纯疱疹病毒1型胸苷激酶基因插入其中的溶瘤病毒。具体地说,溶瘤病毒可以是胸苷激酶基因缺失的重组牛痘病毒。具体地说,溶瘤病毒可以是牛痘病毒的胸苷激酶基因缺失并且单纯疱疹病毒1的胸苷激酶(hsv1-tk)基因插入其中重组牛痘病毒。具体地说,溶瘤病毒可以是未插入粒细胞-巨噬细胞集落刺激因子(gm-csf)和β-半乳糖苷酶基因,并且胸苷激酶基因缺失的重组牛痘病毒(vvtk-)。
此外,溶瘤病毒可以是胸苷激酶(tk)基因缺失并且在其中插入人gm-csf或人g-csf基因的重组牛痘病毒。
本文所用的表述“基因缺失”是指某基因由于该基因的部分或全部缺失或外源基因插入该基因而未表达。在基因被部分缺失的情况下,待表达多肽的n-末端或c-末端的一些氨基酸可以缺失。
本文所用的术语“胸苷激酶(tk)”是指参与核苷酸生物合成的酶。tk是用于细胞和病毒中核苷酸生物合成的酶。在此,对于细胞,由于正常细胞不再分裂,正常细胞中不存在tk;即便在迅速分裂的细胞(例如发根细胞)中,tk的数量亦不足以为病毒所用。利用这些发现,使tk基因在病毒中缺失能够使得病毒仅在癌细胞中存在tk的情况下才能增殖,从而病毒可以选择性地仅杀伤癌细胞。
本文所用的术语“gm-csf”是指粒细胞-巨噬细胞集落刺激因子,其是由巨噬细胞、t细胞、肥大细胞、天然杀伤细胞、内皮细胞和成纤维细胞分泌的蛋白。gm-csf刺激干细胞产生粒细胞(嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞)和单核细胞。此外,gm-csf急剧增加巨噬细胞的数量,因此诱导免疫应答。gm-csf可以是人类来源的,可以是具有genbank:aaa52578.1所示序列的蛋白。
本文所用的术语“g-csf”是指粒细胞集落刺激因子,其是在炎症或内毒素所致刺激后,由巨噬细胞、成纤维细胞、内皮细胞等产生的细胞因子。g-csf促进嗜中性粒细胞的产生。g-csf可以是人类来源的(rhgcsf),并且可以是具有genbank:aaa03056.1所示序列的蛋白。
本文所用的术语“羟基脲”是指下式所示的化合物
[式1]
尽管羟基脲的确切机理尚未阐明,但已知它是抑制dna合成的抗癌剂。另外,可以采用包含羟基脲的市售药物的形式将羟基脲包含在药物组合物中。包含羟基脲的市售药物可以是,但不限于
溶瘤病毒的剂量可以根据个体的状况和体重、疾病的严重程度、药物类型、给药途径和持续时间而变化,并且可以由本领域技术人员适当选择。可以给予患者1×105-1×1018病毒颗粒、感染性病毒单位(tcid50)或噬斑形成单位(pfu)的溶瘤病毒。具体地说,可以给予1×105、2×105、5×105、1×106、2×106、5×106、1×107、2×107、5×107、1×108、2×108、5×108、1×109、2×109、5×109、1×1010、5×1010、1×1011、5×1011、1×1012、1×1013、1×1014、1×1015、1×1016、1×1017的剂量,或更多病毒颗粒、感染性病毒单位或噬斑形成单位的溶瘤病毒,各种数值和范围可包括其中。优选地,可以给予1×1010pfu剂量的溶瘤病毒。更优选地,可以给予等于或大于1×105且小于1×109pfu剂量的溶瘤病毒。在本发明的实施方式中,给予1×105或1×107pfu的溶瘤病毒。
此外,可以给予0.1mg/kg/天-90mg/kg/天剂量的羟基脲。具体地说,可以给予0.1mg/kg/天-90mg/kg/天、1mg/kg/天-80mg/kg/天、5mg/kg/天-70mg/kg/天、10mg/kg/天-60mg/kg/天或20mg/kg/天-50mg/kg/天剂量的羟基脲。在本发明的实施方式中,可以给予20mg/kg/天、30mg/kg/天、60mg/kg/天或90mg/kg/天剂量的羟基脲。
癌症可以是实体癌或血液癌。具体地说,实体癌可以是选自下组的任一种:肺癌、结肠直肠癌、前列腺癌、甲状腺癌、乳腺癌、脑癌、头颈癌、食道癌、皮肤癌、胸腺癌、胃癌、结肠癌、肝癌、卵巢癌、子宫癌、膀胱癌、直肠癌、胆囊癌、胆道癌和胰腺癌。此外,血液癌症可以是选自下组的任一种:淋巴瘤、急性白血病和多发性骨髓瘤。
本发明的药物组合物可以进一步包含生理上可接受的运载体。此外,本发明的药物组合物还可包含在药物组合物的制备中通常使用的合适赋形剂和稀释剂。此外,可以根据常规方法将本发明的药物组合物配制成注射剂形式并使用。
药物组合物可以是用于肠胃外给药的制剂,包括无菌水溶液、非水溶剂、悬浮液、乳剂、冻干制剂、栓剂等。作为非水溶剂和悬浮液,可以使用丙二醇、聚乙二醇、植物油,如橄榄油,可注射酯,如油酸乙酯等。作为栓剂的基料,可以使用怀普索(witepsol)、聚乙二醇、吐温61、可可脂、月桂脂、甘油明胶等。
关于给药途径、剂量和给药频率,可以根据患者的病情和副作用存在与否采用各种方法和用量将药物组合物给予对象;本领域技术人员可以在适当的范围内选择最佳的给药方法、剂量和给药频率。此外,所述药物组合物可以与对于待治疗疾病的治疗效果已知的其它药物或生理活性物质组合给予,或者可以配制成与其它药物组合的制剂形式。
药物组合物可以肠胃外给药,例如通过适当的方法,包括瘤内、腹膜内、皮下、皮内、结节内或静脉内给药。优选地,给药可以是肿瘤内、腹膜内或静脉内给药。另一方面,可以根据给药方案、剂量、患者的健康状况等来确定药物组合物的剂量。
在本发明的另一方面,提供了预防或治疗癌症的试剂盒,其包含含有溶瘤病毒作为活性成分的第一组合物,和含有羟基脲作为活性成分的第二组合物。
所述溶瘤病毒如以上药物组合物中所述。
所述含有羟基脲作为活性成分的第二组合物可以是市售可得的药物。包含羟基脲作为活性成分的市售可得药物可以是
溶瘤病毒的剂量可以根据个体的状况和体重、疾病的严重程度、药物类型、给药途径和持续时间等而有所不同,并且可以由本领域技术人员适当地选择。可以给予患者1×105至1×1018病毒颗粒、感染性病毒单位(tcid50)或噬斑形成单位(pfu)的溶瘤病毒。具体地说,可以给予1×105、2×105、5×105、1×106、2×106、5×106、1×107、2×107、5×107、1×108、2×108、5×108、1×109、2×109、5×109、1×1010、5×1010、1×1011、5×1011、1×1012、1×1013、1×1014、1×1015、1×1016、1×1017的剂量,或更多病毒颗粒、感染性病毒单位或噬斑形成单位的溶瘤病毒,各种数值和范围可包括其中。优选地,可以给予1×105至1×1010pfu剂量的溶瘤病毒。更优选地,可以给予等于或大于1×105且小于1×109pfu剂量的溶瘤病毒。在本发明的实施方式中,以1×105或1×107pfu给予第一组合物。
此外,可以给予0.1mg/kg/天-90mg/kg/天剂量的第二组合物。具体地说,可以给予0.1mg/kg/天-90mg/kg/天、1mg/kg/天-80mg/kg/天、5mg/kg/天-70mg/kg/天、10mg/kg/天-60mg/kg/天或20mg/kg/天-50mg/kg/天剂量的第二组合物。在本发明的实施方式中,可以20mg/kg/天、25mg/kg/天、30mg/kg/天、60mg/kg/天或90mg/kg/天给予第二组合物。
癌症可以是实体癌或血液癌。具体地说,实体癌可以是选自下组的任一种:肺癌、结肠直肠癌、前列腺癌、甲状腺癌、乳腺癌、脑癌、头颈癌、食道癌、皮肤癌、胸腺癌、胃癌、结肠癌、肝癌、卵巢癌、子宫癌、膀胱癌、直肠癌、胆囊癌、胆道癌和胰腺癌。此外,血液癌症可以是选自下组的任一种:淋巴瘤、急性白血病和多发性骨髓瘤。
第一组合物和第二组合物可以进一步包含生理上可接受的运载体。此外,本发明的药物组合物还可包含通常用于制备药物组合物的合适赋形剂和稀释剂。此外,可以根据常规方法将本发明的药物组合物配制成注射剂形式并使用。
第一组合物和第二组合物可以是用于肠胃外给药的制剂,包括无菌水溶液、非水溶剂、悬浮液、乳剂、冻干制剂、栓剂等。作为非水溶剂和悬浮液,可以使用丙二醇、聚乙二醇、植物油,如橄榄油,可注射酯,如油酸乙酯等。作为栓剂的基料,可以使用怀普索(witepsol)、聚乙二醇、吐温61、可可脂、月桂脂、甘油明胶等。
关于给药途径、剂量和给药频率,可以根据患者的病情和副作用存在与否采用各种方法和用量将第一组合物和第二组合物给予对象;本领域技术人员可以在适当的范围内选择最佳的给药方法、剂量和给药频率。此外,所述药物组合物可以与对于待治疗疾病的治疗效果已知的其它药物或生理活性物质组合给予,或者可以配制成与其它药物组合的制剂形式。
第一组合物和第二组合物可以肠胃外给药,例如通过适当的方法,包括瘤内、腹膜内、皮下、皮内、结节内或静脉内给药。优选地,给药可以是肿瘤内、腹膜内或静脉内给药。另一方面,可以根据给药方案、剂量、患者的健康状况等来确定第一组合物和第二组合物的剂量。
此外,第一组合物可以给予两次,并且可以7至30天的间隔给予个体。具体地说,可以7天、14天、21天或30天的间隔给予第一组合物。
第二组合物可以在给予第一组合物后的24小时内给予。具体地说,第二组合物可以从给予第一组合物之前的3至5天开始每天连续给予一次,并且可以从给予第一组合物之后的24小时开始连续每天给予一次,持续9至28天。在本发明的一个实施方式中,从给予第一组合物之前的1至3天开始每天连续给予第二组合物,并且在给予第一组合物之后每天给予一次,持续13天、17天、18天或28天。
在本发明的另一方面,提供了一种治疗癌症的方法,包括将溶瘤病毒和羟基脲给予患有癌症的个体的步骤。
溶瘤病毒可以源自腺病毒、单纯疱疹病毒、麻疹病毒、慢病毒、逆转录病毒、巨细胞病毒、杆状病毒、腺伴随病毒、粘液瘤病毒、水疱性口炎病毒、脊髓灰质炎病毒、新城疫病毒、细小病毒、柯萨奇病毒、塞内卡病毒、牛痘病毒或正痘病毒。优选地,溶瘤病毒可以源自牛痘病毒、单纯疱疹病毒或腺病毒。
牛痘病毒可以是但不限于西储(westernreserve,wr)、纽约牛痘病毒(nyvac)、惠氏(wyeth,纽约市卫生局;nycboh)、lc16m8、李斯特(lister)、哥本哈根、天坛(tiantan)、苏联、塔什干、埃文斯、国际卫生部-j(internationalhealthdivision-j,ihd-j)或国际卫生部-怀特(internationalhealthdivision-white,ihd-w)牛痘病毒株。
溶瘤病毒的剂量可以根据个体的状况和体重、疾病的严重程度、药物类型、给药途径和持续时间等而有所不同,并且可以由本领域技术人员适当地选择。可以给予患者1×105至1×1018病毒颗粒、感染性病毒单位(tcid50)或噬斑形成单位(pfu)的溶瘤病毒。具体地说,可以给予1×105、2×105、5×105、1×106、2×106、5×106、1×107、2×107、5×107、1×108、2×108、5×108、1×109、2×109、5×109、1×1010、5×1010、1×1011、5×1011、1×1012、1×1013、1×1014、1×1015、1×1016、1×1017的剂量,或更多病毒颗粒、感染性病毒单位或噬斑形成单位的溶瘤病毒,各种数值和范围可包括其中。优选地,可以给予1×105至1×1010pfu剂量的溶瘤病毒。更优选地,可以给予等于或大于1×105且小于1×109pfu剂量的溶瘤病毒。在本发明的实施方式中,以1×105或1×107pfu给予溶瘤病毒。
此外,可以给予0.1mg/kg/天-90mg/kg/天剂量的羟基脲。具体地说,可以给予0.1mg/kg/天-90mg/kg/天、1mg/kg/天-80mg/kg/天、5mg/kg/天-70mg/kg/天、10mg/kg/天-60mg/kg/天或20mg/kg/天-50mg/kg/天剂量的羟基脲。在本发明的实施方式中,可以20mg/kg/天、30mg/kg/天、60mg/kg/天或90mg/kg/天给予羟基脲。
此外,溶瘤病毒可以给予两次,并且可以7至30天的间隔给予个体。具体地说,可以7天、14天、21天或30天的间隔给予溶瘤病毒。
羟基脲可以在给予溶瘤病毒后24小时内给予。具体地说,羟基脲可以从给予溶瘤病毒之前的3至5天开始每天连续给予一次,并且可以从给予溶瘤病毒之后的24小时开始连续每天给予一次,持续9至28天。在本发明的一个实施方式中,从给予溶瘤病毒之前的1至3天开始每天连续给予羟基脲一次,并且在给予溶瘤病毒之后每天给予一次,持续13天、17天、18天或28天。
癌症可以是实体癌或血液癌。具体地说,实体癌可以是选自下组的任一种:肺癌、结肠直肠癌、前列腺癌、甲状腺癌、乳腺癌、脑癌、头颈癌、食道癌、皮肤癌、胸腺癌、胃癌、结肠癌、肝癌、卵巢癌、子宫癌、膀胱癌、直肠癌、胆囊癌、胆道癌和胰腺癌。此外,血液癌症可以是选自下组的任一种:淋巴瘤、急性白血病和多发性骨髓瘤。
溶瘤病毒和羟基脲可以肠胃外给药,例如通过适当的方法,包括瘤内、腹膜内、皮下、皮内、结节内或静脉内给药。优选地,给药可以是肿瘤内、腹膜内或静脉内给药。另一方面,可以根据给药方案、剂量、患者的健康状况等来确定溶瘤病毒和羟基脲的剂量。
本文所用的术语“个体”是指患有癌症或患有某疾病的人,其状况可以通过给予本发明的药物组合物来减轻、抑制或治疗。
本文所用的术语“给予”是指以适当的方式将有效量的物质引入个体,并且溶瘤病毒和羟基脲的给予可以通过使它们能够到达靶组织的一般途径来实现。
另外,溶瘤病毒和羟基脲可以与对于待治疗疾病的治疗效果已知的其它药物或生理活性物质组合给予,或者可以配制成与其它药物组合的制剂形式。
在本发明的还有另一方面,提供了组合物在预防或治疗癌症中的用途,所述组合物包含溶瘤病毒和羟基脲。
在本发明的还有另一方面,提供组合物在制备预防或治疗癌症的药物中的用途,所述组合物包含溶瘤病毒和羟基脲。
本发明的方式
下文将借助实施例详细描述本发明。然而,以下实施例仅用于说明本发明,本发明不限于此。
制备实施例1.溶瘤病毒的产生
制备实施例1.1穿梭质粒载体的构建
为了产生其中胸苷激酶(tk)基因缺失的溶瘤病毒,从美国典型培养物保藏中心(atcc)购买了野生型牛痘病毒、纽约市卫生部种(惠氏株)和西储种。为了重组,使用具有萤火虫荧光素酶报道(p7.5启动子)基因的穿梭质粒,和具有萤火虫荧光素酶报道基因和单纯疱疹病毒胸苷激酶(hsv1-tk)基因的穿梭质粒,以及具有gfp基因的穿梭质粒作为载体置换野生型病毒中的tk位点。
制备实施例1.2.重组牛痘病毒的产生
为获得重组病毒,将hela细胞(atcc)以4×105个细胞/孔接种到6孔板中,并在含有10%胎牛血清的emem培养基中培养。随后,以0.05的moi利用野生型牛痘病毒进行处理。2小时后,用含有2%胎牛血清的emem培养基替换培养基,然后利用xfecttm聚合物(clonetech631317,美国),利用在制备实施例1.1中构建的4μg穿梭质粒载体作转染并进行线性化。培养4小时后,用含有2%胎牛血清的emem培养基替换培养基,然后将细胞进一步培养72小时。最后,收集被感染的细胞,然后重复冷冻和解冻3次。然后,通过超声粉碎将细胞裂解,并获得通过蔗糖垫层法分离的重组痘苗病毒。病毒命名为vvtk-、wrvvtk-。
此后,为获得含有突变的hsv1-tk基因的重组牛痘病毒,在有brdu(胸苷类似物,15μg/ml)存在下,在可以选择不具有tk功能的细胞的生化环境(tk选择压力)下连续传代10次,从而在tk-骨肉瘤(骨肉瘤143tk-)细胞系中诱导hsv1-tk突变。请求macrogen对突变的牛痘病毒进行氨基酸测序。
结果,鉴定了编码谷氨酰胺(gln)的密码子(caa)已经点突变为终止密码子,谷氨酰胺(gln)是在突变的牛痘病毒的hsv1-tk的c末端46位氨基酸。此外,鉴定了突变的牛痘病毒的hsv1-tk的c末端46位之后的氨基酸残基缺失。最后,获得了表达hsv1-tk片段的突变牛痘病毒(ots-412),其确保了遗传稳定性。
i.溶瘤病毒(ots-412)的细胞毒性实验
实验实施例1.鉴定溶瘤病毒的肿瘤细胞杀伤作用
为鉴定溶瘤病毒(ots-412)的细胞毒性,在10种人癌细胞系和3种小鼠癌细胞系中评估了毒性。具体地说,在hela、pc-3、du-145、ht-29、hct-116、a549、nci-h23、nci-h460、mcf-7、mda-mb-231、4t1、renca和b16f10癌细胞系中评估毒性。hela、a549、4t1和b16f10细胞获自atcc(美国),其余九种癌细胞系获自韩国细胞系库(koreacelllinebank,kclb)。
首先,以0.5(0.5pfu/细胞)的moi,利用溶瘤病毒感染各癌症细胞系,然后培养72小时。随后,使用细胞计数试剂盒8(cck8)分析细胞毒性。
结果,作为小鼠癌细胞系的4t1、renca和b16f10癌细胞系显示出80%或更高的存活率并且显示出相对较高的抗性。然而,鉴定到大多数其余癌细胞系在72小时后显示出30%或更低的活力,并显示出高细胞毒性(图1)。由此鉴定到溶瘤病毒几乎没有在小鼠癌细胞系中增殖。
此外,通过将具有不同溶瘤病毒增殖能力的人来源或小鼠来源的癌细胞系分别移植到小鼠中来产生人癌细胞移植小鼠(异种移植模型)和小鼠癌细胞移植小鼠(同种异体移植模型),从而进行了动物实验。具体地说,对于小鼠癌细胞移植小鼠,设计了实验以鉴定在溶瘤病毒的增殖受到限制的状态下与羟基脲组合给予,溶瘤病毒是否具有增强的抗癌作用。
ii.溶瘤病毒(vvtk-)和羟基脲在小鼠肾癌细胞移植小鼠中的抗癌治疗作用的鉴定:rencai
实施例2.1小鼠肾癌细胞移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/c小鼠(雌性,7周龄)适应环境一周,然后同种异体移植5×106个细胞的renca癌细胞系(韩国细胞系库)。进行观察直到肿瘤大小达到100mm3至150mm3,然后开始给予溶瘤病毒。另一方面,源自牛痘病毒的溶瘤病毒(vvtk-)在小鼠肾癌细胞移植小鼠模型中几乎不增殖。
将上述产生的小鼠肾癌细胞移植小鼠分为4组(n=4)。瘤内接受生理盐水的组为阴性对照组,接受溶瘤病毒(vvtk-,1×107pfu)的组为阳性对照组。此外,接受溶瘤病毒(vvtk-,1×107pfu)和重组人粒细胞集落刺激因子(rh-g-csf,75μg/kg)的组,以及接受溶瘤病毒(vvtk-,1×107pfu)和羟基脲(30mg/kg)的组为实验组。溶瘤病毒通过肿瘤内给药,在第一次给药后15天进行第二次给药。从溶瘤病毒给药前4天开始腹膜内给予rh-g-csf或羟基脲直至处死。
实施例2.2.鉴定肿瘤大小的改变
给予实施例2.1的各组小鼠药物。然后,在第16天处死小鼠并测量肿瘤大小。结果,观察到接受溶瘤病毒和rh-g-csf的组显示出肿瘤大小与阴性对照组和阳性对照组相似,并且与最初的相比,肿瘤大小增加了10倍以上。另一方面,观察到在接受溶瘤病毒和羟基脲组合的组中,小鼠的肿瘤大小比阴性对照组、阳性对照组和其他实验组的更小,并且最初的相比,肿瘤大小增加了约7倍(图2)。特别是,从与阳性对照组相比,肿瘤大小较小的观点来看,确定在将羟基脲和溶瘤病毒组合给予的情况下获得了增强的抗癌效果。
实施例2.3鉴定体重改变
在给药当天和给药后第4、10和15天,在对实施例2.1的对照组和实验组给予各药物之前,测量小鼠的体重。通过从第18天的体重中减去肿瘤重量来计算小鼠体重,并且将肿瘤重量(v)计算为v=x2y/2,其中x和y分别是最短和最长的直径。
结果,鉴定到阴性对照组和接受溶瘤病毒和rh-g-csf的组的小鼠体重降低约20%或更多,而实验组的小鼠体重维持稳定在给药前体重的85%或更高(图3)。
iii.溶瘤病毒(vvtk-)和羟基脲在小鼠肾癌细胞移植小鼠中抗癌治疗作用的鉴定:rencaii
实施例3.1.小鼠肾癌细胞移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/c小鼠(雌性,7周龄)适应环境一周,然后同种异体移植5×106个细胞的renca癌细胞系(韩国细胞系库)。进行观察直到肿瘤大小达到100mm3至150mm3,然后开始给予溶瘤病毒。另一方面,源自牛痘病毒的溶瘤病毒(vvtk-)在小鼠肾癌细胞移植小鼠模型中几乎不增殖。
将上述产生的小鼠肾癌细胞移植小鼠分为4组(n=13)。瘤内接受生理盐水的组为阴性对照组,接受溶瘤病毒(vvtk-,1×107pfu)或羟基脲(30mg/kg)的组为阳性对照组。接受溶瘤病毒和羟基脲组合的组为实验组。溶瘤病毒通过肿瘤内给药一次,在第一次给药后17天进行第二次给药。从溶瘤病毒给药前3天开始腹膜内给予羟基脲,每日一次,直至处死前一天,除了给予溶瘤病毒的那天(图4)。
实施例3.2.鉴定肿瘤大小的改变
给予实施例3.1的各组小鼠药物。然后,在第17天处死小鼠并测量肿瘤大小。结果,观察到阴性对照组和阳性对照组中的肿瘤大小快速增大10-15倍,而实验组中小鼠的肿瘤大小比阴性对照组和阳性对照组的几乎小三倍(图5)。由此,在溶瘤病毒和羟基脲组合给予的情况下,即使在溶瘤病毒几乎不增殖的肿瘤模型中也能获得极大提高的抗癌效果。
iv.溶瘤病毒(wrvvtk-)和羟基脲在小鼠肾癌细胞移植小鼠中抗癌治疗作用的鉴定:rencaiii
实施例4.1.小鼠肾癌细胞移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/c小鼠(雌性,7周龄)适应环境一周,然后同种异体移植5×106个细胞的renca癌细胞系(韩国细胞系库)。进行观察直到肿瘤大小达到100mm3至150mm3,然后开始给予溶瘤病毒。另一方面,源自西储种牛痘病毒的溶瘤病毒(wrvvtk-)在小鼠肾癌细胞移植小鼠模型中能够增殖。
将上述产生的小鼠肾癌细胞移植小鼠分为4组(n=6)。瘤内接受生理盐水的组为阴性对照组,接受溶瘤病毒(wrvvtk-,1×107pfu)或羟基脲(60mg/kg)的组为阳性对照组。接受溶瘤病毒和羟基脲组合的组为实验组。溶瘤病毒通过腹膜内给药一次。从溶瘤病毒给药前1天开始腹膜内给予羟基脲,每日一次,直至给药后第6天,除了给予溶瘤病毒的那天。
实施例4.2.鉴定肿瘤大小的改变
给予实施例4.1的各组小鼠药物。然后,测量肿瘤大小14天。结果,观察到阴性对照组和阳性对照组中小鼠的肿瘤大小增大接近8-10倍,而实验组中小鼠的肿瘤大小增大接近3倍。由此,在溶瘤病毒和羟基脲组合给予的情况下,肿瘤生长显著受抑制(图6)。
v.溶瘤病毒(ots-412)和羟基脲在小鼠乳腺癌细胞移植小鼠中抗癌治疗作用的鉴定:4t1i
实施例5.1.小鼠乳腺癌细胞移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/c小鼠(雌性,7周龄)适应环境一周,然后同种异体移植2×106个细胞的4t1癌细胞系(韩国细胞系库)。进行观察直到肿瘤大小达到100mm3至150mm3,然后开始给予溶瘤病毒。另一方面,源自牛痘病毒的溶瘤病毒(ots-412)在小鼠乳腺癌细胞移植小鼠模型中几乎不增殖。
将上述产生的小鼠乳腺癌细胞移植小鼠分为4组(n=4)。瘤内接受生理盐水的组为阴性对照组,接受溶瘤病毒(ots-412,1×107pfu)或羟基脲(30mg/kg)的组为阳性对照组。接受溶瘤病毒和羟基脲组合的组为实验组。溶瘤病毒通过腹膜内给药一次。从溶瘤病毒给药前3天开始腹膜内给予羟基脲,每日一次,直至处死前1天,除了给予溶瘤病毒的那天。
实施例5.2.鉴定肿瘤大小的改变
给予实施例5.1的各组小鼠药物。然后,测量肿瘤大小的改变10天。结果,观察到阴性对照组和阳性对照组中小鼠的肿瘤大小增大近5倍,而实验组中小鼠的肿瘤大小增大近3倍(图7)。由此,相比于各药物单独给予的情况,在溶瘤病毒和羟基脲组合给予的情况下,实现了显著的抗癌作用。
vi.溶瘤病毒(ots-412)和羟基脲在小鼠乳腺癌细胞移植小鼠中抗癌治疗作用的鉴定:4t1ii
实施例6.1.小鼠乳腺癌细胞移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/c小鼠(雌性,7周龄)适应环境一周,然后同种异体移植1×106个细胞的4t1癌细胞系(韩国细胞系库)。进行观察直到肿瘤大小达到100mm3至150mm3,然后开始给予溶瘤病毒。另一方面,源自牛痘病毒的溶瘤病毒(ots-412)在乳腺癌细胞移植小鼠模型中几乎不增殖。此外,植入4t1细胞系的小鼠是一种动物模型,其中存在向包括肺组织在内的整个身体转移;通常,通过肿瘤表面结节的数量来评估转移。
将上述产生的小鼠乳腺癌细胞移植小鼠分为4组(n=5)。瘤内接受生理盐水的组为阴性对照组,接受溶瘤病毒(ots-412,1×107pfu)或羟基脲(30mg/kg)的组为阳性对照组。接受溶瘤病毒和羟基脲组合的组为实验组。对于溶瘤病毒,其第二次给药在第一次肿瘤内给药后7天进行。从溶瘤病毒给药前3天开始腹膜内给予羟基脲,每日一次,直至处死前3天,除了给予溶瘤病毒的那天。
实施例6.2.鉴定肿瘤大小的改变
给予实施例6.1的各组小鼠药物。然后,在第21天处死小鼠,计数肿瘤结节的数量。结果,对于仅接受溶瘤病毒的组中的小鼠,结节数是阴性对照组的1.5倍。另一方面,对于实验组的小鼠,鉴定到产生的结节数是0.5倍,这是非常小的(图8)。由此,在溶瘤病毒和羟基脲组合给药的情况下,可抑制向其它器官的转移。
实施例6.3.鉴定反复给药后的安全性
如实施例6.1那样产生小鼠乳腺癌细胞植入的小鼠模型(n=10)并给药。然后,在给药后第7、14、17和21天测量小鼠的体重。结果,所有组的小鼠体重在2周后趋于降低;然而,实验组小鼠在第21天观察到最高体重。即使对于其它三组中的小鼠,在第21天也观察到约10%的体重减轻。由此鉴定到,即使在反复给予溶瘤病毒并与羟基脲组合给予的情况下,也可以确保安全性(图9)。
vii.溶瘤病毒(ots-412)和高剂量羟基脲在小鼠乳腺癌细胞移植小鼠中抗癌治疗作用的鉴定:4t1iii
实施例7.1.小鼠乳腺癌细胞移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/c小鼠(雌性,7周龄)适应环境一周,然后同种异体移植5×106个细胞的4t1癌细胞系(韩国细胞系库)。进行观察直到肿瘤大小达到50mm3至200mm3,然后开始给予溶瘤病毒。另一方面,源自牛痘病毒的溶瘤病毒(ots-412)在乳腺癌细胞移植小鼠模型中几乎不增殖。
将上述产生的小鼠乳腺癌细胞移植小鼠分为4组。瘤内接受生理盐水的组为阴性对照组,接受溶瘤病毒(ots-412,1×107pfu)或高剂量羟基脲(90mg/kg)的组为阳性对照组。接受溶瘤病毒和高剂量羟基脲组合的组为实验组。溶瘤病毒肿瘤内给药一次。从溶瘤病毒给药前3天开始腹膜内给予羟基脲,每日一次,直至处死前1天,除了给予溶瘤病毒的那天。
实施例7.2.鉴定肿瘤大小的改变
给予实施例7.1的各组小鼠药物。然后,测量肿瘤大小17天。结果,鉴定到阴性对照组和阳性对照组中小鼠的肿瘤大小增大近3.5倍,而实验组中小鼠的肿瘤大小增大近2.5倍。由此,相比于单独给予溶瘤病毒或羟基脲的情况,在溶瘤病毒和羟基脲组合给予的情况下,抑制了肿瘤生长(图10)。
此外,检查了各组中小鼠的存活直到第28天。结果,仅接受溶瘤病毒的组中的所有小鼠在第21天死亡,阴性对照组中有1只小鼠存活。另一方面,鉴定到在接受溶瘤病毒和羟基脲组合的组中小鼠存活至最后(图11)。由此,证实了组合给予大剂量羟基脲和溶瘤病毒的安全性和抗癌作用。
viii.溶瘤病毒(ots-412)和羟基脲在人肺癌细胞(nci-h460)移植小鼠中抗癌治疗作用的鉴定
实施例8.1.人肺癌细胞移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/cnu/nu小鼠适应环境一周,然后同种异体移植1×106个细胞的nci-h460肺癌细胞(韩国细胞系库)。当肿瘤大小达到300mm3至400mm3,开始给予溶瘤病毒。源自牛痘病毒的溶瘤病毒(ots-412)在肺癌细胞系移植小鼠模型中能够增殖。
将上述产生的人肺癌细胞移植小鼠分为4组。瘤内接受生理盐水的组为阴性对照组,接受羟基脲或溶瘤病毒(ots-412,1×105pfu)的组为阳性对照组。腹膜内接受溶瘤病毒和羟基脲(20mg/kg)组合的组为实验组。溶瘤病毒给药两次,其第二次给药在第一次给药后5天进行。从第一次溶瘤病毒给药前的那天开始给予羟基脲,每日一次,直至处死之日,除了给予溶瘤病毒的那天。
实施例8.2.鉴定肿瘤大小的改变
给予实施例8.1的各组小鼠药物。然后,在第15天处死小鼠并测量肿瘤大小。结果,观察到阴性对照组和阳性对照组中小鼠的肿瘤大小分别快速增大11、9和7倍。在另一方面,实验组中小鼠的肿瘤大小增大约2.5倍,并从第12天起有减小的趋势(图12)。由此,鉴定到与仅单独给予溶瘤病毒的情况相比,在溶瘤病毒和羟基脲的组合给药的情况下,有效地抑制了肿瘤生长。
ix.溶瘤病毒(ots-412)和羟基脲在人结肠直肠癌细胞(hct-116)移植小鼠中抗癌治疗作用的鉴定
实施例9.1.人结肠直肠癌细胞移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/cnu/nu小鼠(雌性,7周龄)适应环境一周,然后同种异体移植2.5×106个细胞的hct-116癌细胞系,人结肠直肠癌细胞系(韩国细胞系库)。进行观察,直至肿瘤大小达到20mm3至250mm3,然后开始给予溶瘤病毒。
将上述产生的人结肠直肠癌细胞移植小鼠分为4组(n=5)。瘤内接受生理盐水的组为阴性对照组,接受羟基脲或溶瘤病毒(ots-412,1×107pfu)的组为阳性对照组。腹膜内接受溶瘤病毒和羟基脲(30mg/kg)组合的组为实验组。溶瘤病毒给药一次,从溶瘤病毒给药前3天开始给予羟基脲,每日一次,直至处死之日,除了给予溶瘤病毒的那天。源自牛痘病毒的溶瘤病毒(ots-412)在结肠直肠癌细胞系移植小鼠模型中能够增殖。
实施例9.2.鉴定肿瘤大小的改变
给予实施例9.1的各组小鼠药物。然后,在第28天处死小鼠并测量肿瘤大小。结果,观察到阴性对照组和仅接受羟基脲的组中小鼠的肿瘤大小快速增大11倍。鉴定到,在单独接受溶瘤病毒的组中,在给予溶瘤病毒后第3天起,肿瘤大小逐渐降低并维持在原始肿瘤大小。在另一方面,对于实验组,鉴定到相比于原始肿瘤大小,从给予溶瘤病毒的那天起肿瘤大小逐渐降低,在给予溶瘤病毒后的第14天开始降低,在第28天几乎消失(图13)。特别是,在实验组的两只小鼠中,在第28天观察到完全消退(图14和15)。
x.溶瘤病毒(vvtk-)和羟基脲在人结肠直肠癌细胞(ht-29)移植小鼠中抗癌治疗作用的鉴定
实施例10.1.人结肠直肠癌细胞(ht-29)移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/cnu/nu小鼠(雌性,7周龄)适应环境一周,然后同种异体移植5×106个细胞的ht-19癌细胞系,人结肠直肠癌细胞系(韩国细胞系库)。进行观察,直至肿瘤大小达到150mm3至200mm3,然后开始给予溶瘤病毒。
将上述产生的人结肠直肠癌细胞移植小鼠分为以下两组并进行8周的实验:仅腹膜内接受溶瘤病毒(ots-412,1×107pfu)的组和额外接受羟基脲(25mg/kg)的组。从第1周到第4周,将溶瘤病毒给予各组,每周两次。在第5周和第7周给予溶瘤病毒,每周一次;在第6周和第8周,两组均不给予溶瘤病毒。从第6周到第8周给予羟基脲,每日一次。在另一方面,源自牛痘病毒的溶瘤病毒(vvtk-)在结肠直肠癌细胞系移植小鼠模型中能够增殖。
实施例10.2.鉴定肿瘤大小和肿瘤组织凋亡
在第8周的最后一天,处死各组中的小鼠并检测肿瘤大小。结果,与仅接受溶瘤病毒的组相比,鉴定到在接受溶瘤病毒和羟基脲的组中,肿瘤大小降低,肿瘤组织的情况缓解(图16)。
此外,利用苏木精和曙红对收集的肿瘤组织作h&e染色。在此,较深的h&e染色部分表示活细胞。结果,鉴定到与仅接受溶瘤病毒的组相比,接受溶瘤病毒和羟基脲的组显示出总体肿瘤大小较小和深色染色部分较小(图16)。即,鉴定到与仅接受溶瘤病毒的对照组相比,接受溶瘤病毒和羟基脲的实验组显示出优异的凋亡作用。
此外,通过h&e染色和tunel染色来分析收集的肿瘤组织。在此,较深的h&e染色部分表示有存活的细胞;在荧光染色中,溶瘤病毒具有红色荧光,而死细胞具有绿色荧光。
结果,在接受溶瘤病毒和羟基脲组合的组的肿瘤组织中,观察到的死细胞多于仅接受溶瘤病毒的组。此外,对于对照组,死细胞与溶瘤病毒在染色部分方面相匹配,从而鉴定了溶瘤病毒引起的癌细胞死亡。另一方面,鉴定到在接受溶瘤病毒和羟基脲组合的组中,死细胞的部分与溶瘤病毒的染色部分不同。这确定了在接受溶瘤病毒和羟基脲的组合的组中,即使在未被溶瘤病毒感染的癌细胞中也发生了凋亡(图17)。
xi.单纯疱疹病毒(hsv1)和羟基脲在小鼠肾癌细胞移植小鼠中抗癌治疗作用的鉴定
实施例11.1.小鼠肾癌细胞(renca)移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/c小鼠(雌性,7周龄)适应环境一周,然后同种异体移植5×106个细胞的renca癌细胞系,一种小鼠肾癌细胞系(韩国细胞系库)。进行观察,直至肿瘤大小达到50mm3至200mm3,然后开始给予溶瘤病毒。
将上述产生的小鼠肾癌细胞移植小鼠分为4组。瘤内接受生理盐水的组为对照组,接受羟基脲或单纯疱疹病毒(hsv1,1×106pfu)的组为阳性对照组。接受hsv1和羟基脲(30mg/kg)的组为实验组。给予羟基脲后3天,瘤内给予hsv1一次,给予溶瘤病毒后,腹膜内给予羟基脲,每周6次,20天。
实施例11.2.鉴定肿瘤大小的改变
给予实施例11.1的各组小鼠药物。在给药当日和给药后第3、7、10、14和17天测量肿瘤大小的改变。结果,鉴定到实验组显示肿瘤大小最低。由此确定与仅给予溶瘤病毒的情况相比,在组合给予hsv1和羟基脲的情况下,肿瘤生长得到更有效的抑制。
xii.溶瘤病毒和羟基脲在小鼠肾癌细胞移植小鼠中抗癌治疗作用的鉴定
实施例12.1.小鼠肾癌细胞(renca)移植小鼠的产生和给药
使orientbio(韩国釜山)提供的balb/c小鼠(雌性,7周龄)适应环境一周,然后同种异体移植5×106个细胞的renca癌细胞系,一种小鼠肾癌细胞系(韩国细胞系库)。进行观察,直至肿瘤大小达到50mm3至200mm3,然后开始给予溶瘤病毒。
将上述产生的小鼠肾癌细胞移植小鼠分为3组。瘤内接受生理盐水的组为阴性对照组,仅接受溶瘤病毒(腺病毒,1×107pfu)的组为阳性对照组。接受腺病毒(1×107pfu)和羟基脲(30mg/kg)的组为实验组。给予羟基脲3天后,瘤内给予腺病毒一次,给予溶瘤病毒后,腹膜内给予羟基脲,每周6次,16天。
实施例12.2.鉴定肿瘤大小的改变
给予实施例12.1的各组小鼠药物。在给药当日和给药后第3、7、10、14和17天测量肿瘤大小的改变。结果,鉴定到接受溶瘤病毒和羟基脲的组显示肿瘤大小最低。由此确定与仅给予溶瘤病毒的情况相比,在组合给予腺病毒和羟基脲的情况下,肿瘤生长得到更有效的抑制(图19)。
- 还没有人留言评论。精彩留言会获得点赞!