CT/直线加速器控制台中的用于自适应放射治疗的决策支持工具的制作方法
以下总体涉及辐射治疗领域、辐射治疗规划领域、自适应放射治疗领域、以及相关的领域。
背景技术:
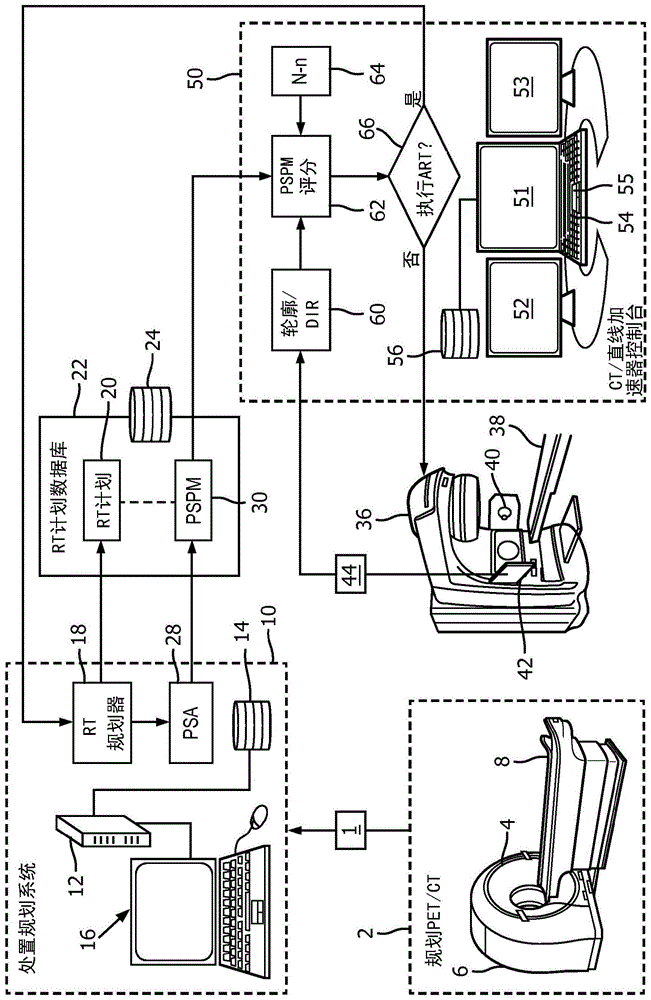
:辐射治疗是对于特定类型的癌症的常见处置。一般来说,目的是将规定剂量的辐射递送到肿瘤或其他恶性组织,同时最小化对周围健康组织并且尤其是对所谓的关键组织或风险器官(oar)的辐射暴露。线性加速器(直线加速器)或其他辐射治疗递送设备被用来递送治疗辐射(例如高能电子、质子或x射线)。直线加速器包括围绕患者在各种角度处实现治疗辐射的断层摄影递送的旋转机架,并且可以依据直线加速器设计和规定的辐射治疗方案而在步进击发或连续递送模式下操作。辐射射束在断层摄影递送期间被调节,因此该技术通常被称为强度调节辐射治疗(imrt)。其他辐射治疗递送技术可以被采用,诸如三维适形辐射治疗(3dcrt)、强度调制弧形治疗(imat)和体积调制弧形治疗(vmat)等等。同样地,除了直线加速器之外,可以采用其他辐射治疗递送设备,诸如同时递送多个辐射射束的设备。在许多辐射治疗方案中,采用分次辐射治疗递送,其中总辐射剂量经过可以被分开几天或更久的多个阶段(即“分次”)来递送。已经发现分次辐射治疗增加效率并且降低对oar的长期损害。为了递送有效的辐射治疗,针对个体患者开发了辐射处置计划。这需要通过放射学成像模态(例如透射计算机断层摄影(ct)或磁共振成像(mri))采集个体患者的相关解剖结构的详细规划图像,可能通过发射成像模态(例如正电子发射断层摄影(pet)或单光子发射计算机断层摄影(spect))提供的关于肿瘤或其他恶性组织的功能信息来补充。规划图像被轮廓勾画以使用手动、自动化或半自动化轮廓勾画来描绘(一个或多个)肿瘤和相邻的oar(通常其中任何自动生成的轮廓视情况被肿瘤医师或其他有资格的医学专业人员检查并调整)。肿瘤医师开发治疗的目标,例如要被递送到每个肿瘤的规定剂量和对于oar的最大剂量等。处置规划系统(tps)然后被应用以生成针对患者的个体化辐射处置计划。这通常由专门医师(有时被称为放射科医师)使用“逆”过程来完成,其中辐射递送设备(例如直线加速器)的初始设置或参数被设置,并且得到的辐射通量或剂量分布通过tps来模拟并与由肿瘤医师建立的计划目标进行比较,并且然后以迭代方式调整设置/参数并重新计算通量或剂量分布直至获得基本上满足目标的最佳设置/参数。在该过程期间,分次的数量(在分次辐射治疗方案的情况下)可以被改变以确定并优化分次的数量的影响。尽管具有大量设置/参数并且调整分次,但是在实践中,最终辐射处置计划可能不完全满足所有目标。肿瘤医师检查提议的辐射处置计划,并且可以同意其,或替代地,可以拒绝该计划并且识别需要改进的(一个或多个)地方。在拒绝的情况下,放射科医师使用tps执行进一步优化,并且将更新的处置计划提交给肿瘤医师,直至到达同意的计划。当辐射治疗阶段(即分次)要被执行时,患者到达处置位置并且被定位在患者支撑物上。这种定位是至关重要的,因为(一个或多个)肿瘤和oar应当处于与在根据ct或mri规划图像开发辐射治疗计划的ct或mri规划图像的采集期间基本上相同的位置。为了辅助定位,许多直线加速器或其他辐射递送设备包括嵌入式ct成像(子)系统以刚好在辐射治疗递送的开始之前采集被定位在治疗患者支撑物上的患者的图像。这通常是锥形射束ct(cbct)成像系统。这种cbct图像用来辅助患者定位。自适应放射治疗(art)是变型方法,其中针对分次的辐射治疗计划可以刚好在辐射递送的开始之前基于cbct图像来调整。art被设计为考虑患者解剖结构可以随着时间而改变的事实。例如,膀胱可能在一个阶段期间对比另一阶段更满或者更不满,器官可能在身体内移位,患者可能体重增加或减轻,(一个或多个)恶性肿瘤可能萎缩或生长等等。这些变化通过调整辐射治疗计划本身来适应。为此目的,通过cbct在直线加速器处新采集的图像被发送给tps,其中放射科医师对图像进行轮廓勾画,并且针对新采集的图像使用针对分次的当前辐射处置计划设置/参数模拟通量或剂量分布。基于这种模拟,关于art是否应当被执行以更新辐射处置计划进行确定。如果是这样的话,那么处置计划通过现在使用新采集的图像执行进一步优化来更新。如果确定不需要art,那么这种决策被传送回到辐射治疗递送实验室,其中辐射递送使用现有计划来执行。以下公开了特定改进。技术实现要素:在本文中公开的一些实施例中,一种非瞬态存储介质存储可由控制台读取并执行的指令,所述控制台包括显示器、至少一个用户输入设备和电子处理器,所述电子处理器执行包括以下的方法:确定与用来生成辐射治疗计划的辐射治疗规划图像比较的当前图像的至少一个扰动;通过包括应用辐射治疗计划特异性扰动模型的操作来计算指示自适应放射治疗是否应当被执行的自适应放射治疗推荐得分,所述辐射治疗计划特异性扰动模型特异于所述辐射治疗计划,并且在功能上依赖于所确定的至少一个扰动;并且在所述控制台的所述显示器上显示以下中的一项:(i)基于所计算的自适应放射治疗推荐得分的关于自适应放射治疗是否应当被执行的推荐和(ii)取决于所计算的自适应放射治疗推荐得分满足art推荐准则的警报。在本文中公开的一些实施例中,一种控制台包括显示器、至少一个用户输入设备、电子处理器和非瞬态存储介质,所述非瞬态存储介质存储可由所述电子处理器读取并执行以控制与所述控制台操作性地连接的辐射治疗递送设备的指令。所述指令进一步可由所述电子处理器读取并执行以执行包括以下的方法:接收患者的当前图像;确定与辐射治疗规划图像进行比较的所述当前图像的至少一个扰动,根据所述当前图像生成针对所述患者的辐射治疗计划;基于所确定的至少一个扰动计算指示自适应放射治疗是否应当被执行的自适应放射治疗推荐得分;以及在所述显示器上显示以下中的一个:(i)基于所计算的自适应放射治疗推荐得分的关于自适应放射治疗是否应当被执行的推荐和(ii)取决于所计算的自适应放射治疗推荐得分满足art推荐准则的警报。在本文中公开的一些实施例中,一种辐射治疗递送系统包括:辐射治疗递送设备,所述辐射治疗递送设备被配置为将治疗辐射递送到被设置在患者支撑物上的患者;成像设备,所述成像设备被配置为对被设置在所述辐射治疗递送设备的所述患者支撑物上的所述患者进行成像;以及如前一段落中阐述的控制台,所述控制台被操作性地连接以控制所述辐射治疗递送设备并且控制所述成像设备。在一些实施例中,所述辐射治疗递送设备包括线性加速器(直线加速器),并且所述成像设备包括计算机断层摄影(ct)扫描器。在本文中公开的一些实施例中,一种自适应放射治疗推荐方法包括:确定与所述患者的辐射治疗规划图像进行比较的当前图像的至少一个扰动,根据所述当前图像生成针对所述患者的辐射治疗计划;基于所确定的至少一个扰动并且在不模拟通过所述当前图像表示的所述患者中的剂量分布的情况下计算指示自适应放射治疗是否应当被执行的自适应放射治疗推荐得分;以及控制显示器以呈现以下中的一个:(i)基于所计算的自适应放射治疗推荐得分的关于自适应放射治疗是否应当被执行的推荐和(ii)取决于所计算的自适应放射治疗推荐得分满足art推荐准则的警报。所述自适应放射治疗推荐方法由电子处理器合适地执行。一个优点在于提供在确定自适应放射治疗(art)是否应当被执行方面的降低的延迟。另一优点在于提供用于决定art是否应当被执行的原理性基础。另一优点在于处置规划系统(tps)的放射科医师或其他操作者的减少的工作负荷。另一优点在于tps上的减少的计算工作负荷。给定的实施例可以提供前述优点中的零个、一个、两个或全部,和/或可以提供对于本领域技术人员来说在阅读并理解本公开后将会变得显而易见的其他优点。附图说明本发明可以采取各种部件和部件的布置,以及各种步骤和步骤的安排的形式。附图仅出于图示优选实施例的目的,并且不应被解释为对本发明的限制。图1图解性地图示了涉及辐射治疗的规划和递送的原理性系统和设备,包括如本文中公开的art推荐。图2图解性地图示了通过图1的设置被合适地执行的辐射治疗规划和递送处理。图3-5图解性地图示了如本文中描述的模拟结果。具体实施方式在自适应放射治疗(art)中,处置计划经常针对患者的变化的解剖结构进行调整。对计划进行调整涉及采集患者的新的cbct图像,新采集的图像中的肿瘤体积和器官的重新轮廓勾画,计划质量评价,以及针对改变的轮廓优化射束参数。不执行art会导致可能部分或完全错过目标体积和/或过多剂量被递送到周围正常组织(例如风险器官(oar))。另一方面,art耗费大量的计算资源、以及放射科医师或其他高度熟练的tps操作者的宝贵时间。art也延迟辐射分次的递送,这对于患者来说是烦扰的,并且对于辐射治疗递送实验室来说会引起工作积压。在现有的方法中,直到计划质量评价或评估针对改变的解剖结构完成,才知道art是否是适当的。通常,花费大约30至45分钟完成计划质量评价以决定对于art的需要(不包括采集cbct图像所花费的时间)。患者通常不能长时间停留在同一位置。基本上,图像采集后涉及以下过程以完成计划评估:1.将新采集的cbct图像集传输到处置规划系统(tps);2.执行重新轮廓勾画和/或可变形图像配准(dir);3.针对改变的轮廓执行计划评估;以及4.关于是否应当执art来进行决策。前述方法中的一些缺点是对将图像数据传输到tps的需要、影响或剂量分布的重新轮廓勾画和模拟的计算负荷(后者经常在tps中从头开始执行)、放射科医师的额外工作负荷、以及由对两个不同位置(tps和辐射治疗递送实验室)处的协调操作的需要而引入的可能延迟。在许多门诊部中,tps用于评估对于art的需要的可用性受限制,这增加了延迟。鉴于这些困难,在一些情况下,art可能被完全避免,这会导致递送次优的处置。在本文中公开的实施例中,关于art是否应当被执行的决策在患者躺在检查台上准备辐射治疗递送的情况下进行,并且花费短至几分钟(不包括采集cbct图像所花费的时间)。在一些实施例中,关于art是否应当被执行的决策在ct/直线加速器控制台处本地地进行,而无需咨询tps。如果在ct/直线加速器控制台处决定不需要art,那么辐射治疗递送能够立即开始使用现有的辐射治疗计划。另一方面,如果决定art应当被执行,那么cbct图像被传输到tps,其中art按照惯常的流程被执行。参考图1,图解性地示出了涉及辐射治疗的规划和递送的原理性系统和设备,包括如本文中公开的基于ct/直线加速器的art推荐器。为了开始过程,要在生成辐射治疗计划时使用的辐射治疗规划图像1通过合适的医学成像设备来采集,诸如具有通过共同的患者支撑物8被耦合的计算机断层摄影(ct)机架4和正电子发射断层摄影(pet)机架6的图示性pet/ct扫描器2,俯伏或仰卧患者能够经由患者支撑物8被移动到任一机架4、6内以便进行ct和/或pet成像。通常,ct图像示出详细的解剖结构并且被用于辐射治疗规划过程,而pet图像提供功能信息并且将肿瘤示为更亮的“热斑”。尽管pet有利地提供这样的功能信息,但是在一些实施例中,pet成像可以被省略,例如成像设备可以是单独的ct扫描器。此外,图示性pet/ct扫描器2仅仅是图示性范例,并且应意识到,其他成像模态可以额外地或替代地被用来采集辐射治疗规划图像1,诸如磁共振成像(mri)扫描器。辐射治疗规划图像1用作到处置规划系统(tps)10的输入,在图示性实施例中,处置规划系统(tps)10包括图示性服务器计算机12或具有大量计算能力的其他电子数据处理设备。电子处理器12读取并执行被存储在非瞬态存储介质14上的指令,以执行负责的辐射通量和/或剂量分布计算以及剂量优化。tps10包括或通过具有显示器和至少一个用户输入设备(例如,鼠标、键盘)的用户接口16来访问。更一般地,tps10可以使用替代的计算硬件(诸如基于云的计算资源或其他分布式计算系统)来实施,和/或可以采用替代的用户接口布置,例如图示性用户接口16可以由通过一般计算机、平板计算机等的登录访问替换以提供分布式tps访问和操作。tps10通过逆规划程序执行剂量优化,其中选择要被采用的辐射治疗设备的参数并模拟通过那些参数实现的患者中的得到的通量和/或剂量分布,并且合适的迭代优化被应用以调整参数从而使模拟的剂量分布(在实际上可实现的程度上)符合由患者的医师或肿瘤医师定义的一组目的或目标。通过非限制性图示,目标可以包括定义处置中的肿瘤的治疗有效剂量确定的剂量参数、以及对于位于靠近肿瘤并且因此必然接收一些(不期望的)辐射剂量的一个或多个风险器官(oar)的最大可允许剂量参数。剂量优化是计算上复杂的,并且通常涉及几十分钟至数小时的计算时间,并且由放射科医师或其他专门的医学专业人员进行管理,可能咨询患者的医师或肿瘤医师。在许多辐射治疗方案中,剂量递送在若干个相继的阶段(被称为“分次”)中被施予,在可能延长超过几周或几个月的时段的以后的日子里被递送——这样的辐射治疗方案被称为分次辐射治疗。在不失一般性的情况下,分次的数量被表示为n,并且到目前时间已经被完成的分次的数量被表示为n。因此,在目前时间处的剩余分次的数量为n-n。如图1中图解性地图示的,辐射处置规划由电子处理器12(例如服务器计算机)执行,电子处理器12执行被存储在非瞬态存储介质14上的指令以实施执行剂量分布模拟和剂量优化过程的辐射处置规划器18。通过非限制性图示性范例,辐射处置规划器18可以通过可从皇家飞利浦有限公司获得的pinnacle3处置规划工具来实施。通过由辐射处置规划器18执行的剂量优化生成并且被患者的医师或肿瘤医师认可的辐射治疗计划20被存储在辐射治疗计划数据库22(被存储在非瞬态存储设备24上)中,以便以后当辐射治疗方案的分次要被执行时进行检索。在本文中公开的实施例中,tps10还执行由执行被存储在非瞬态存储介质14上的指令的电子处理器12(例如服务器计算机)实施的计划敏感性分析(psa)28,以便生成计划特异性扰动模型(pspm)30。在放射科医师的管理下的辐射治疗规划器18基于辐射治疗规划图像1生成辐射治疗计划(并且被医师或肿瘤医师确认)之后,并且在开始处置的第一分次之前,计划敏感性分析(psa)28被执行。在psa之间,由临床医生提出(或被整体存储在psa28中)的各种变形情况在辐射治疗规划图像1本身中被模拟,并且对辐射处置计划质量的影响被存储。一组有效扰动可以按照解剖部位被定义,并且能够被保持在被存储在非瞬态存储介质14上的库(未示出)中,所述一组有效扰动能够是到psa28的输入。任选地,每个扰动的权重因子可以被指定,使得重要的变形情况在所生成的pspm30中被给予更多重要性。这样的加权可以提供用于依据诸如临床情况(例如与更不邻近膀胱的另一器官的辐射治疗相比,膀胱中的扰动对于前列腺的辐射治疗来说会是更重要的)、患者年龄、患者特异性优先(例如不同的患者可能更多或更少地担忧辐射治疗的某些潜在不利影响)等等的因素将适当的重要性分配给各种扰动的机制。例如,可以被如此分析的一些扰动包括(通过非限制性图示性范例):尿道膀胱的膨胀和收缩;处置中的肿瘤的膨胀和收缩;患者体重增加或减轻;各种内部器官的正常移位;其各种组合;等等。这些中的每一个可以被进一步细分,例如肿瘤沿前后方向的萎缩或生长可以是一个所分析的扰动;肿瘤沿上下方向的萎缩或生长可以是另一所分析的扰动;以及肿瘤沿横向方向的萎缩或生长可以是另一所分析的扰动;以及其他可能扰动中的类似各向异性。所分析的扰动也可以沿一定倾斜方向是解剖上适当的。尿道膀胱扰动可以被类似地建模;替代地,如果已知的是尿道膀胱以适当各向同性的方式增大或缩小(例如由于流体使膀胱沿所有方向均匀地膨胀),那么建模的膀胱膨胀/收缩可以是单个扰动。虽然物理移位、增大或缩小是适于psa分析的典型扰动,其他类型的扰动也被考虑,例如组织的硬化或钙化可以是另一所分析的扰动。此外,如果预期某些扰动是相关联的,那么组合的扰动可以被定义,例如肿瘤的萎缩可以产生收缩的oar的后续膨胀,使得组合的扰动是肿瘤的萎缩和oar的相关联的膨胀。更一般地,组合的扰动可以被定义为表示个体扰动的组合可以产生通过单独地考虑每个个体扰动不能被很好地描述的协同效果。给定量的扰动的影响可以以各种方式被量化,例如通过计算由扰动产生的在剂量优化中使用的复合目标函数的值的百分比变化(复合目标函数组合了针对肿瘤和各种oar的个体目标)。在模拟足够数量的情况(即各种量的扰动)之后,psa28生成pspm30,所述pspm30将解剖结构中的特定扰动(例如,尿道膀胱以特定量的增大;如之前提到的,特定扰动可以是组合的扰动(即两个或更多个个体扰动的组合),以便捕获相关效应)与对计划质量的对应影响相关。在一种方法中,对计划质量的影响的可接受水平的预先定义的解剖特异性模板用来生成自适应放射治疗推荐得分。自适应放射治疗推荐得分可以例如被表示为风险,即涉及递送关于针对当前解剖结构的处置的特定分次的特定计划的风险量。更一般地,自适应放射治疗推荐得分指示自适应放射治疗是否应当被执行,并且通过包括应用辐射治疗计划特异性扰动模型30的操作来计算,辐射治疗计划特异性扰动模型30特异于辐射治疗计划20并且在功能上依赖于如之前讨论的一个或多个扰动。pspm30合适地与辐射治疗计划20一起被存储,以便当辐射治疗方案的分次要被执行时进行检索。继续参考图1,生成患者特异性辐射治疗计划20和对应的pspm30的前述处理被“离线地”执行,即,在治疗辐射在分次辐射治疗的第一分次期间的递送之前。任选地,被执行以生成pspm30的psa28能够是自动化的,使得正好在辐射处置计划20的产生之后,tps10在此背景下自动运行psa28,并且将pspm30发送到存储设备22并且也任选地发送到(要被描述的)直线加速器控制台50。还考虑了使用额外的过程改进pspm30,例如基于以前的信息(诸如从之前的患者情况等挖掘的临床结果)使用深度学习技术来修改模型。辐射治疗(或在分次辐射治疗方案的情况下的每个辐射治疗分次)由辐射治疗递送设备36执行。在图示性范例中,辐射治疗递送设备36是通过将电子加速至高能量(通常在1mev之上)生成治疗辐射的线性加速器(直线加速器)。治疗辐射可以是高能电子,或可以是通过将高能电子射束引导到x射线生成靶(诸如钨靶)而被生成的x射线。在其他实施例中,辐射治疗递送设备可以是一些其他类型的粒子加速器,例如生成质子射束形式的治疗辐射,作为另一非限制性图示性范例。作为执行辐射治疗分次的准备,患者被定位在患者支撑物38上。这以使用基准标志和/或解剖标志来确保患者解剖结构与其在辐射治疗规划图像1的采集期间的定位的对准的精确方式完成,并且可能需要应用适当的约束以将患者保持在适当位置中。为了辅助定位患者并且为了评价患者解剖结构的主要变化自辐射治疗规划图像1的采集以后是否已经发生,成像设备40、42被配置为对被设置在辐射治疗递送设备36的患者支撑物38上的患者进行成像。该成像设备40、42不同于2用来采集辐射治疗规划图像1的成像设备。在图示性实施例中,成像设备40、42是辐射治疗递送设备36的锥形射束计算机断层摄影(cbct)成像部件40、42,并且包括锥形射束x射线源40和距x射线源40在患者支撑物38对面定位的x射线检测器阵列或面板42。cbct成像部件具有某些优点——它提供具有使它可与辐射治疗规划图像1直接比较(至少在规划图像1也是ct图像的图示性范例中)的透射ct对比的当前图像44。然而,更一般地,与辐射治疗递送设备36相关联的成像设备可以是能够采集患者的当前图像44的任何医学成像设备,患者的当前图像44能够与辐射治疗规划图像1进行比较。作为另一范例,与辐射治疗递送设备相关联的成像设备可以是磁共振成像(mri)设备,该磁共振成像(mri)设备是独立的或与直线加速器集成以形成mr-直线加速器,其中mr成像设备是直线加速器本身(类似于图1中图示的图示性ct-直线加速器36、40、42)的一部分。由于mri不将电离辐射发射到对象内(或通过对象),因此它能够在每个辐射治疗阶段之前在日常基础上用来采集当前图像而无需担忧增加对患者的累积性辐射剂量。mr图像的可用性能够被利用,并且art推荐计算在此背景下被执行,以便如果某事有误则警告直线加速器操作者。作为又一范例,与辐射治疗递送设备相关联的成像设备可以是提供mr和ct成像模态两者的mr/ct成像设备,其中mr和ct图像可以被对齐或相关联。mr/ct有利地提供不同并且有时互补的对比机制,该对比机制能够阐明比单独的mr或ct更多的信息。与辐射治疗递送设备36相关联的图示性成像设备40、42是辐射治疗递送设备36的部件,例如被安装到图示性直线加速器36的壳体上。然而,这不是必需的——在另一实施例中,与辐射治疗递送设备相关联的成像设备可以是带轮支撑物上的便携式成像设备,该带轮支撑物滚动到并与患者支撑物38对齐采集当前图像44。辐射治疗递送设备36和成像设备40、42由控制台50来控制,控制台50包括或具有到显示器(在图示性范例中,三个显示器51、52、53以提供足以显示要在治疗辐射的递送期间被考虑大量信息的显示区域;更一般地,一个、两个、三个或更多个显示器可以被提供)和一个或多个用户输入设备(例如图示性键盘54和跟踪球55或其他定点设备,任选地一个或多个这样的用户输入定点设备可以通过使显示器51、52、53中的一个或多个成为触敏显示器来实施)的操作性入口。控制台50包括电子处理器(例如微处理器、微控制器等),该电子处理器读取并执行被存储在非瞬态存储介质56上的指令,以控制与控制台50操作性地连接的辐射治疗递送设备36,并且控制与控制台50操作性地连接的成像设备40、42,并且执行如本文中公开的自适应放射治疗(art)推荐方法。控制台50被图示为邻近辐射治疗递送设备36设置;然而,应理解,这种接近度能够是依赖实施方式的,并且此外,控制台50的一些部件可以被远程地定位。例如,取决于辐射暴露控制实践,控制台50可以位于与辐射治疗递送设备36不同的房间中以便限制对工作者的杂散辐射暴露的可能性。电子处理器和非瞬态存储介质56可以被远程地定位(例如被实施在医院中央服务器处)。控制台50也可以具有“远程app”部件,例如可以为与辐射治疗设施相关联的肿瘤医师提供手机、平板电脑和/或台式计算机应用(“apps”),其提供辐射治疗阶段、当前图像44等等的远程检查。通常,art推荐需要模拟如辐射治疗计划20中给出的针对当前图像44的剂量分布和辐射治疗递送设备36的参数。这样的模拟使用大量的计算资源,并且可以需要放射科医师或具有专门训练的其他医学人员的管理。因此,在直线加速器控制台处提供剂量分布模拟器可能是不切实际的,并且在一些实施例中,所公开的直线加速器控制台50在以下情况下遵循这种惯例,只要直线加速器控制台50不包括剂量分布模拟能力,即,非瞬态存储介质56不存储可由控制台50读取并执行以针对当前图像44执行剂量分布模拟的指令。通常,直线加速器控制台的这种缺陷通过在tps10处关于art是否应当被执行进行决策来对待。因此,当前图像44通常将被传输到tps10,并且放射科医师将执行当前图像与规划图像1的可变形图像配准(dir),并且将在当前图像上执行轮廓勾画、紧接着针对当前图像的剂量分布模拟,并且然后在针对当前图像的模拟的剂量分布的基础上评鉴art是否是可取的。如果决策是不执行art,那么该决策将被传送回到直线加速器控制台50处的操作者,操作者然后能够继续跟进现有的辐射处置计划20递送治疗辐射。遗憾的是,即使art不被执行,决策过程本身也会花费30分钟或更久,将大量延迟引入到辐射治疗阶段内。因此,直线加速器操作者可以选择跳过art检查,可能由此失去art可以提供的益处。在本文中公开的实施例中,计划特异性扰动模型(pspm)30用来在直线加速器控制台50处生成art推荐,而无需执行任何剂量分布模拟并且无需咨询tps10。art推荐能够在大概几秒或最多几分钟内被生成。如果决策是不执行art,那么治疗辐射的递送能够在基于pspm30生成art推荐的仅几秒或几分钟的延迟的情况下立即开始。另一方面,如果art被推荐,那么当前图像44被传输到tps10,并且更新的辐射处置计划从tps10接收回来,并且治疗辐射根据该经调整的计划来递送。为了在直线加速器控制台50处执行art推荐方法,当前图像44照常在开始通过直线加速器36递送治疗辐射之前被采集。此外,辐射治疗规划图像1从数据库22检索。可变形图像配准(dir)和特征轮廓勾画处理60在直线加速器控制台50处被执行,以空间地配准当前图像44与规划图像1,并且在当前图像44中定义肿瘤和oar(和/或其他感兴趣特征)的轮廓。注意,这样的特征轮廓勾画已经由放射科医师和/或肿瘤医师或其他医学专业人员在规划图像1上完成,作为辐射处置规划18的一部分,并且轮廓优选地与规划图像1一起被存储在数据库22中,作为存储的辐射治疗计划20的一部分(或作为与存储的辐射治疗计划20相关联的额外数据)。因此,仅当前图像44需要被轮廓勾画。在操作62中,计算自适应放射治疗推荐得分,其指示自适应放射治疗是否应当被执行。操作62包括确定与辐射治疗规划图像1进行比较的当前图像44(其再次用来生成辐射治疗计划20)的至少一个扰动,并且应用于特异于针对患者的辐射治疗计划20的辐射治疗计划特异性扰动模型(pspm)30。每个扰动被确定为在当前图像中轮廓勾画的至少一个特征与在空间上配准的辐射治疗规划图像中轮廓勾画的至少一个特征相比的变化。如之前讨论的,pspm30在功能上依赖于经确定的至少一个扰动。在分次辐射治疗方案的情况下,pspm30可以进一步在功能上依赖于分次辐射治疗方案的剩余分次的数量64。如果该方案中的分次的总数量被表示为n并且到目前为止一定数量n个分次已经被执行,那么分次的剩余数量64等于n-n。例如,如果当前辐射治疗阶段是第一阶段,那么n=0(art推荐方法在当前阶段中实际应用治疗辐射之前被执行,因此还没有分次被执行),那么剩余分次的数量64是n。在操作66中,关于art是否应当被执行进行决策。在一种方法中,操作66包括在控制台50的显示器51、52、53上显示基于在操作62中计算的自适应放射治疗推荐得分的关于自适应放射治疗是否应当被执行的推荐,并且经由至少一个用户输入设备54、55接收关于是否执行自适应放射治疗的决策。如果决策是不执行自适应放射治疗,那么控制台50控制辐射治疗递送设备36根据辐射治疗计划20将治疗辐射递送到患者。在这种情况下,tps10决不被涉及,并且解决是否执行art的问题的延迟仅是几秒至几分钟。另一方面,如果决策是执行自适应放射治疗,那么当前图像44被传输到执行调整的tps10。控制台50然后从tps10接收辐射治疗计划的经调整的更新,并且处理以控制辐射治疗递送设备36根据辐射治疗计划的经调整的更新将治疗辐射递送到患者。此处,延迟可能显著更久(例如可能一小时或更多),以便tps执行计划调整。在实践中,pspm30通常建模大量的可预测扰动。例如,它可以建模肿瘤在三维上的增大/缩小、尿道膀胱在三维上的增大/缩小等等。在一种合适的方法中,这通过包括对应于多个不同扰动的多个辐射治疗计划特异性扰动模型的pspm30来适应。因此,在覆盖前述范例的一种实施方式中,存在针对肿瘤沿上下方向的增大/缩小的一个计划特异性扰动模型、针对肿瘤沿后前方向的增大/缩小的另一个计划特异性扰动模型、针对肿瘤沿横向方向的增大/缩小的另一个计划特异性扰动模型、针对尿道膀胱沿上下方向的增大/缩小的另一个计划特异性扰动模型、针对尿道膀胱沿后前方向的增大/缩小的另一个计划特异性扰动模型和尿道膀胱沿横向方向的增大/缩小的另一个计划特异性扰动模型。在组合这些的一种方式中,自适应放射治疗推荐得分被计算为由多个辐射治疗计划特异性扰动模型输出的最强地指示自适应放射治疗应当被执行的得分。这种方法确保art推荐是基于具有最大影响的扰动。(作为一范例,如果尿道膀胱尺寸未变并且肿瘤尺寸在上下和后前方向上未变,但是肿瘤已经沿横向方向显著地生长,那么art应当被推荐,以便不管针对其他扰动的改变的缺少,针对沿横向方向的肿瘤生长进行调整)。作为额外的或变型方法,操作66可以基于由多个计划特异性扰动模型输出的所有计算的自适应放射治疗推荐得分显示所有推荐,其中每个显示的推荐与对应的扰动相关联地被显示。在前述范例中,显示器可以呈现针对非art的推荐以解决尿道膀胱尺寸变化,而且呈现执行art的推荐以解决肿瘤的横向增大。这种方法为控制台操作者提供根据其进行art决策的全部信息。作为另一考虑的变型,如果控制台50具有“远程app”部件,那么显示器51、52、53可以是患者的肿瘤医师或其他处置医生的手机或平板计算机的移动设备显示器(并且同样地,至少一个用户输入设备54、55可以包括手机或平板计算机的至少一个输入),并且肿瘤医师或其他处置医生然后可以在检查被显示在移动设备显示器上的推荐之后经由远程app进行art决策。如果操作60、62是完全自动化的,例如通过使用自动化dir来定义当前图像44中的轮廓,那么在一些实施例中,art决策被自动地或半自动地执行。在这样的实施例中,art决策66被实施为警报。在采用这种方法的典型情况下,当前图像44在辐射治疗阶段内将患者定位在支撑物38上的适当时候被采集。例如当患者正被定位在支撑物38上时,以自动化方式对当前图像44执行操作60、62而无需用户干预。操作66需要自动决定是否推荐art,例如如果由所应用的pspm30针对任何所分析的扰动输出的自适应放射治疗推荐得分超过针对该扰动的一定阈值(或,更一般地,满足art推荐准则),执行art的推荐可以被生成。如果执行art的推荐由此被自动生成,那么以被显示在显示器51、52、53上的警报的形式向用户指示执行art的这种推荐。另一方面,如果自动生成的推荐是不执行art,那么没有这样的警报被显示(或,替代地,在显示器51、52、53上显示针对该辐射治疗阶段不推荐自适应放射治疗的消息)。在前述内容中,应意识到,每个电子处理器可以通过计算机、服务器、台式计算机、笔记本计算机或其他基于微处理器的电子处理设备来实施。每个非瞬态存储介质14、24、56可以例如被各种地实施为硬盘驱动器、raid阵列、或其他磁性存储介质、固态驱动器(ssd)或其他电子存储介质、光盘或其他光学存储介质、其各种组合等等。进一步地,应意识到,所公开的电子处理器可以被以各种方式组合,和/或各种非瞬态存储设备介质14、24、56可以被以各种方式组合。例如,单个服务器数据存储设备可以存储用于tps10和辐射处置计划数据库22的可执行代码存储。如上所述,tps10至少在此范围内一般与直线加速器控制台50分开,因为它们在物理上分开的位置中(例如不同的房间或医院地板/套间),采用不同的用户接口设备,并且在逻辑上是分开的(例如,采用不同的安全性密码或要不然不同的用户认证,但可以是,特定用户可以被授权以使用两个系统10、50)。参考图2,通过流程图图示了通过图1的设置执行的图示性art推荐过程。在操作70中,在tps10处接收辐射处置规划图像1。在操作72中,在tps10处执行辐射治疗规划以生成辐射处置计划20。如之前提到的,操作72需要针对旨在递送治疗辐射的辐射治疗递送设备36的参数的选定集合的通量和/或剂量分布模拟、以及剂量优化,所述剂量优化需要调整参数以关于包括针对(一个或多个)目标肿瘤和(一个或多个)oar的定量的一组目标的复合目标函数优化模拟的剂量分布。进一步地,虽然在图2中被指示为在tps处被执行,但是应意识到,操作72会需要一些外部咨询(例如咨询肿瘤医师),并且最终的辐射处置计划20通常必须被肿瘤医师或其他处置医师确认。在操作74中,在tps10处执行计划敏感性分析(psa)以定量地评价各种可预测扰动(例如肿瘤增大或缩小,尿道膀胱膨胀/收缩等)对计划质量的量化(例如用于针对受扰动的解剖结构的剂量分布的复合目标函数的值)的影响。psa72的输出是特异于辐射处置计划20的计划特异性扰动模型(pspm)30。前述操作70、72、74能够被视为被“离线地”执行,即,在辐射治疗的第一个分次的开始之前,以便生成处置计划20和(对于art推荐过程)pspm30。后续的art推荐操作在ct/直线加速器控制台50处被执行,如接下来讨论的。在操作80中,辐射治疗规划图像1从数据库22被检索到直线加速器控制台50,并且当前图像44(在图示性范例中,cbct图像44)被成像设备40、42的控制装置(控制台50)接收或采集。在控制台50处执行的操作82中,在直线加速器控制台50对当前(cbct)图像44的特征进行轮廓勾画,并且当前(cbct)图像44和规划图像1例如通过可变形图像配准(dir)被空间地配准。轮廓勾画可以经由由控制台50提供的图形用户接口(gui)被手动地或通过能量最小化轮廓拟合等被自动地执行(优选地在被控制台操作者检查/调整/认可的情况下)。在控制台50处执行的操作84中,至少一个扰动通过比较当前(cbct)图像44与(空间上配准的)规划图像1来确定。这可能需要在当前(cbct)图像44中绘制的轮廓与规划图像1的所绘制的对应轮廓的比较。例如,扰动可以被识别为当前图像44中的肿瘤轮廓与规划图像1中的肿瘤轮廓相比的差异(任选地大于某个阈值)。在控制台50处执行的操作86中,对于每个识别的扰动,(从数据库22被检索到控制台50的)pspm30被应用以确定针对该扰动的art推荐得分。这是快速且计算高效的操作,并且在一些实施例中,可能需要从包括pspm30的针对各种扰动值的art推荐得分的表格或查找表查找(并且可能内插或外推)art推荐得分。在操作88中,在直线加速器控制台50处进行art推荐决策。这可能需要在控制台50的显示器51、52、53上显示在操作84中被确定并且在操作86中被存储的针对每个扰动的art推荐得分。这种方法为控制台操作者提供根据其进行是否执行art的决策的最大信息。在另一方法中,选择并显示最强地指示art应当被执行的art推荐得分。这为控制台操作者提供更少的信息,但是该信息是最简明的并且应当是最相关的信息(例如如果一个扰动证明art正确而许多其他扰动证明art不正确,结果是art可能应当被执行)。在又一实施例中,执行art的决策可以基于最强地指示art应当被执行的art推荐得分而被完全自动化,即如果该得分在用于执行art的某个阈值之上,那么推荐是执行art。如果决策88是art应当被执行,那么当前图像44连同执行art的请求一起被发送到tps10,并且在操作90中,在tps10处执行自适应放射治疗优化。这是计算上复杂的过程,涉及针对当前图像44的剂量分布的模拟和剂量优化,通过调整参数以关于复合目标函数优化模拟的剂量分布。经更新调整的辐射处置计划然后被发送回到直线加速器控制台50,并且在操作92中,辐射治疗(分次)在直线加速器控制台50的控制下根据经更新调整的辐射处置计划来执行。另一方面,如果决策88是art不应当被执行,那么tps10不被咨询(即,art更新操作90被跳过),并且替代地过程流直接转变到操作92,在此处辐射治疗(分次)在直线加速器控制台50的控制下根据(原始)辐射处置计划20来执行。在下文中,描述了一些其他范例和变型实施例。在基于原始规划(例如ct)图像1生成辐射处置计划20之后,并且在开始处置的第一个分次之前,执行psa,其中临床目的(例如,在一些实施例中,被定量地表示为目的或目标)对不同变形情况的敏感性在原始ct中使用规划系统来模拟。例如,膀胱变形能够通过膨胀或收缩膀胱的轮廓并且相应地重新计算针对膀胱轮廓的剂量统计和剂量体积直方图(dvh)来模拟。应注意,每种变形情况的剂量统计的重新计算是计算高效的,并且能够被快速地完成,并且因此每个器官的大量的变形情况能够在短的时间段内被模拟。敏感性能够关于剂量学准则(或剂量体积准则)、和/或关于生物学计划评估准则(例如生物学模型)来进行评价。一些合适的生物学计划评估准则包括针对肿瘤的肿瘤控制概率(tcp)和针对正常器官/组织的正常组织并发症概率(ntcp)。作为一个非限制性图示性范例,对扰动的敏感性能够使用tcp、ntcp和一个或多个剂量体积参数来评价。在一些实施例中,此类膨胀和收缩情况的数量和膨胀和收缩情况的最大水平是预先定义的。类似地,对于所有其他器官和目标体积,相同的过程能够被重复。作为一个范例,假设存在n个总数量的分次并且到目前为止n个分次已经被递送。因此n-n个分次还未被递送。而且,在针对目标的规定的总剂量是d,并且每个分次的剂量d,并且因此肿瘤还要接收d-nd的剂量。在第(n-n)个分次处采集当前图像44以决定是否需要art。考虑第(n-n)个分次处的前列腺肿瘤情况和膀胱膨胀情况。考虑n个分次,针对膀胱的规定的平均剂量是dpres。如果膀胱沿前后方向膨胀,它将会在剩余分次中得到更多剂量。让我们假设膀胱膨胀引起累积性平均剂量(dcum)超过规定的平均剂量。这通过以下被数学地表示:dcum=dmean(n)θdmean(n-n)其中,dmean(n)是由于n个递送的分次的到膀胱的平均剂量,并且dmean(n-n)是由于递送剩余分次的到膀胱的平均剂量。此处,符号θ表示在dmean(n)和dmean(n-n)上面的累积函数。应注意,不足以简单地对dmean(n)和dmean(n-n)进行求和来获得dcum,因为对应于第n个分次和第(n+1)个分次的同一器官的体积不是相同的。这种计算能够使用tps10来模拟。因此,膀胱对变形情况的敏感性被计算如下:敏感性=sqrt[(dcum–dpres)2]类似的这种计算能够针对计划中的其他正常器官以及肿瘤体积来执行。每个器官和肿瘤体积的敏感性的和将会表示由于变形的组合的对计划的总影响。现在参考图3,基于敏感性分析,生成平滑的扰动模型。在图3中针对尿道膀胱示出了这样的扰动模型的范例。在图3的范例中,呈现了针对前列腺情况的沿前后方向的膀胱膨胀。在图3中,实线表示相对于体积的百分比变化的平均剂量敏感性的百分比变化,并且虚线是针对所述平均剂量敏感性的百分比变化的拟合曲线。被显示在图3的曲线图内部的公式是表示在膀胱轮廓中沿前后方向引入扰动如何影响敏感性的模型。换言之,该公式表示关于适用于给定患者和计划的对应器官的体积变化的临床目标特异性扰动。在该公式中,x表示体积的变化(以及变化的方向),并且y表示对变形的平均剂量敏感性的对应变化。图3针对单个辐射处置阶段对此进行绘制,即,假设剩余分次的固定数量n-n。参考图4,示出了图示关于30个分次递送完的分次的数量的平均剂量敏感性的百分比变化的模型曲线图。图4针对对于前列腺情况的沿前后方向的尿道膀胱的某一固定百分比变化对此进行绘制。参考图5,针对前列腺情况的沿着前后方向的尿道膀胱的可预测体积变化能够被建模为在功能上依赖于扰动的量值(即沿着前后方向的%变化)剩余分次的数量n-n的pspm。这种pspm在图5中被描绘为图示关于体积的%变化和30个分次递送完的分次的剩余数量预测敏感性如何变化的范例曲线图的曲面图。在一种图示性方法中,art推荐得分通过规范化从最小值0至最大值100的敏感性来获得,并且被呈现在截然不同的组中,例如五个组:0-10、11-20、21-40、41-70和71-100。在该范例中,art推荐得分可以被视为风险得分,即量化辐射治疗的退化的效果的风险(使得更高的风险构成执行art的更强推荐)。在该范例中,可接受的风险得分按照解剖部位从临床医生获得。在表1中示出了用于前列腺肿瘤沿前后方向的增大/缩小的扰动的样本模板,其根据art推荐得分对针对各种临床目标的art决策进行制表。在这种方法中,呈现了基于计算的风险得分的针对每个临床目标的提出的决策。一般来说,风险得分越高,对调整计划的需要越高。风险得分能够直接在ct/直线加速器控制台50处针对从当前图像44获得的当前患者解剖结构进行计算。对每个临床目标的影响基于临床目标特异性扰动模型(pspm)30被快速地计算。所公开的art推荐方法帮助控制台操作者很快地关于是否执行art进行有意义的临床决策(可能是几分钟的后图像采集),并且在决定对于art的需要时绕过对咨询tps10的需要。预期这在繁忙的辐射治疗门诊部中是非常有用的。所公开的art推荐方法利用直线加速器控制台50减少tps10上的负荷。关于art推荐过程的tps10上的负荷被降至psa期间的每个变形情况的剂量统计的重新计算。这是计算高效的,并且能够被快速地完成;因此,每个器官的大量的变形情况能够在短的时间段内被模拟。所公开的art推荐方法还提供用于决定在给定情况下是否执行art的原理性且系统性方法,并且显著减少检查台上的患者等待时间。art推荐得分考虑解剖结构的变化的量值以及变化的方向,因此使计算在临床上有意义。表1art推荐得分→0-1011-2021-4041-7071-100肿瘤-最小剂量无artartartartart肿瘤-最大剂量无artartartartart直肠-平均剂量无art无artartartart直肠-最大剂量无art无artartartart膀胱-平均剂量无art无art无artartart膀胱-最大剂量无art无art无artartart股骨-最大剂量无art无art无art无artart由于psa和pspm计算明确考虑要被递送的剩余分次,得到的风险得分将不会对解剖结构变形过度敏感。这种方法允许风险得分指示给定分次处的实际临床情况,并且因此导致最佳的临床决策。显著地,通过考虑剩余分次的数量n-n,对于更晚的分次,降低了推荐art的可能性,如图4和5中图示的。概念地,这获得了以下见解:如果解剖结构在分次辐射治疗方案即将结束的时候发生变化,那么到肿瘤和/或oar的“不正确”剂量的总量被减少,因为总剂量的大部分已经被递送,并且因此art的益处被有效地降低。相比之下,如果在分次辐射治疗方案即将开始的时候发生变化,那么到肿瘤和/或oar的“不正确”剂量的总量是高的,因为总剂量的大部分还要在未来的分次内被递送,使art更有益。相比之下,当使用常规方法时,当前图像被发送到tps,并且在tps处进行关于是否执行art的决策。在这种方法中,放射科医师会具有仅考虑当前图像在哪种程度上偏离原始规划图像(即对于原始规划图像被扰动)的倾向,并且会更不可能考虑剩余分次的数量。已经参考优选实施例描述了本发明。他人在阅读和理解以上具体实施方式的情况下可能想到修改或替代。本文旨在将示范性实施例解释为包括所有这种修改和替代,只要它们落入权利要求书及其等价方案的范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1