孕酮阴道内装置的制作方法
1.本发明涉及包含孕酮的阴道内装置(intravaginal device)、用于制造这样的装置的方法以及所述装置的用途。
背景技术:
2.孕酮(孕甾-4-烯-3,20-二酮;c
21
h
30
o2)属于称为孕激素的一类激素。其是主要的天然存在类固醇,并且是其他类固醇(特别是糖皮质激素、雄激素和雌激素)的生物合成中的前体。
[0003][0004]
从青春期开始到更年期,在卵巢中(通过黄体)高量产生孕酮,并且在雄性和雌性二者中在肾上腺功能初现(adrenarche)开始之后,肾上腺也少量产生孕酮。在较小程度上,孕酮在神经组织中产生,尤其是在脑中以及在脂肪组织中产生。在人妊娠期间,卵巢和胎盘以越来越高的量产生孕酮。首先,在月经周期的黄体期或分泌期期间以及在早期妊娠中,来源是黄体,然而,在妊娠的第8周之后,孕酮的产生转移至胎盘。
[0005]
孕酮使子宫为胚胎的植入做好准备,帮助子宫内膜变厚并变得更具血管,使其准备好来容纳受精卵。其还在妊娠中发挥数种作用,包括增大孕妇的乳房、抑制子宫收缩、免疫保护胚胎以及抑制前列腺素合成。
[0006]
孕酮已用于治疗许多临床病症,例如功能失调性子宫出血、子宫内膜异位症、子宫内膜癌、良性乳腺疾病、先兆流产、先兆子痫、围绝经期症状和黄体期缺陷。
[0007]
孕酮同样用于辅助生殖技术(也称为辅助受孕)中的黄体期支持。不幸地,并非所有生殖年龄的妇女均能够自然妊娠。许多所述妇女求助于辅助生殖技术(assisted reproductive technology,art)来实现妊娠。至少存在三种主要的art类型:体外受精(in vitro fertilization,ivf),其涉及提取卵子,在实验室中使卵子受精,并且通过子宫颈将所得胚胎移植至子宫;配子输卵管内移植(gamete intrafallopian transfer,gift),其涉及使用腹腔镜通过腹部切口将未受精卵和精子置入妇女的输卵管中;以及合子输卵管内移植(zygote intra-fallopian transfer,zift),其涉及提取卵子,在实验室中使卵子受精,并且使用腹腔镜将受精卵置入妇女的输卵管中。在art过程中,还考虑卵细胞质内单精子注射(intracytoplasmic sperm injection,icsi),其是其中将单精子直接注射到卵子中的ivf技术;以及冷冻胚胎移植(frozen embryo transfer,fet),其中将已经冷冻(冷冻保存)
的胚胎解冻并随后移植至妇女的子宫/输卵管。
[0008]
对于许多妇女,结合art,必须采取措施使子宫准备好用于胚胎植入。已开发许多工具来在该过程中进行辅助,其中外源性孕酮补充最为突出。
[0009]
孕酮常常在黄体期期间并且有时甚至在黄体期以外从外部供应,但是在子宫内膜适当地转化为分泌期以外继续进行孕酮补充并不是严格必需的。在大多数情况下,孕酮补充的目的是辅助可能已在art过程中受损并且无法提供足够量的孕酮以实现将子宫内膜转化为分泌期的黄体。
[0010]
不同的孕酮制剂是本领域已知的。
[0011]
孕酮可经口施用,但是由于其被肝脏迅速清除(肝首过效应),因此其在循环中(并且特别是在子宫中)的生物利用度低,导致经口孕酮制剂的无效性相当大。此外,为了实现确保子宫内膜增生的足够的子宫内孕酮水平,必需施用高剂量的经口孕酮,这不可避免地导致血液中孕酮代谢物的积累,这可进而产生不想要的副作用。
[0012]
肌内(intra-muscular,im)孕酮被广泛使用,并且虽然用im施用可实现高血清水平,但以这样的方式递送的孕酮在发挥其治疗作用之前经受子宫代谢(子宫首过效应),并且因此其效力显著降低。此外,im施用需要每天注射,并且对患者来说是痛苦的、不舒服的和不便的。
[0013]
当与以上施用途径相比时,孕酮的阴道施用通常会引起更高的子宫内膜孕酮水平,而当与im递送的孕酮相比时,引起更低的血清水平,并且因此可提供更高效的治疗以及降低的全身性副作用。孕酮阴道施用的不同类型是已知的。
[0014]
阴道孕酮凝胶与im孕酮相比不那么痛苦并且更易于使用,但是也需要每天给药,可以是麻烦的,并且由于潜在的泄漏,对于每次应用可能没有提供全剂量。
[0015]
使用孕酮阴道插入物用于片剂递送也是已知的,但是再次需要每天至少一次施用高剂量的孕酮。阴道微粉化孕酮胶囊也是已知的,但是需要每天多次施用,这对于患者来说可以是麻烦的并且可导致治疗中断。
[0016]
阴道制剂的另一种已知类型是阴道内环(intravaginal ring)。阴道内环旨在提供孕酮的连续释放,并因此通常不需要每天或甚至频繁地应用制剂(即每天或频繁地更换环),从而提供改善的患者舒适度。
[0017]
美国专利5869081公开了在一系列妇女患者中使用包含孕酮的阴道环来使子宫内膜准备好用于胚胎植入。zegers-hochschild et al.(human reproduction,2000,15(10),2093-2097)还报道了在患有卵巢功能早衰或缺乏对卵巢刺激响应的一系列患者中临床使用这样的阴道环之一以成功实现妊娠。
[0018]
stadtmauer et al.(fertility and sterility,2013,99(6),1543-1549)类似地报道了作为对于患有不孕的妇女的art治疗的一部分,每周一次孕酮阴道环的施用对于黄体补充和孕前支持是有效的。
[0019]
国际专利申请wo 2009/099586同样报道了包含孕酮以及脂肪酸的烃或甘油酯的阴道环用于治疗黄体期缺陷的用途。
[0020]
使用孕酮环用于确保适当的子宫内膜增生的临床研究通常记录在整个治疗中,特别是在所述治疗的最初数周期间在某一点在患者中的阴道出血。以上提及的阴道环就是这种情况。出血通常与低的子宫内孕酮水平相关并且在治疗期间有时通过向患者施用另外的
孕酮来解决。然而,由于由孕酮积累或由此产生的代谢产物而引起的可能的副作用,提高孕酮水平并不是特别期望的解决方案。另一方面,应考虑在内的是,即使其可能不是妊娠并发症的征兆,出血也总是使患者担忧并且其可能导致不必要的医疗咨询。因此,总是期望提供避免在早期妊娠期间出血或使其最小化的治疗。
[0021]
存在开发新的替代制剂的持续需求,该替代制剂克服现有的孕酮剂型的缺点。特别地,似乎相当有必要开发提供低血浆水平的孕酮同时维持治疗效力、改善患者的安全性/舒适概况并且使在早期妊娠期间出血最小化的制剂。
[0022]
发明概述
[0023]
本发明人出乎意料地发现,包含多晶型形式i的孕酮或显示出高的多晶型形式i百分比的孕酮的阴道装置在将子宫内膜转化为分泌期同时使阴道出血的风险最小化或不提高方面是有效的。因此,可向患者提供孕酮而不需要在治疗期间(报道了至少在子宫内膜转化为分泌期之前)更换装置或添加另一种孕酮制剂。优选地,本发明的阴道装置包含低量的孕酮,从而提供低的孕酮血清水平。
[0024]
因此,本发明涉及包含孕酮的阴道内装置,其中所述孕酮的至少75%为多晶型形式i。
[0025]
本发明的另一方面涉及用于制造根据本发明的阴道装置的方法,其包括以下步骤:
[0026]
a)将其中孕酮的至少75%为多晶型形式i的所述孕酮与可药用聚合组合物(polymeric composition)混合。
[0027]
b)使由步骤a)产生的混合物在120℃或更低的温度下固化。
[0028]
本发明人还发现,将本发明装置中的孕酮的量降低至低于现有技术的装置中通常使用的那些得到的阴道内装置可用于成功地将子宫内膜转化为分泌期并维持妊娠,同时在孕妇中使阴道出血最小化或甚至避免阴道出血。因此,在一个特别的实施方案中,本发明的装置包含相对于装置的总重量的17.4%至2.9%wt的孕酮,更优选11.6%至2.9%wt的孕酮,甚至更优选8.7%至2.9%wt的孕酮。
[0029]
本发明人出人意料地发现,根据本发明的方法制备的阴道装置在正常(室温)和加速(高至30℃)的储存条件下在至少3年期间是稳定的,表现出显著较少的孕酮“起霜”(迁移至环的表面),有助于较小的孕酮“突释(burst)”效应(最初过度释放),并且在体外显示出较慢的孕酮释放。
[0030]
本发明的一个不同方面涉及本发明的阴道内装置在雌性对象中治疗不孕中的用途。
[0031]
又一个方面涉及本发明的阴道内装置在治疗围绝经期症状中的用途。
[0032]
在本发明的一个优选实施方案中,装置是阴道内环。
[0033]
附图简述
[0034]
图1.从根据本发明的阴道内环获得的样品的x射线衍射图。
[0035]
图2.从根据本发明的阴道内环获得的样品的差示扫描量热法曲线。
[0036]
图3和4.在施用本发明的阴道环之后的血浆血清水平。
[0037]
发明详述
[0038]
有机化合物可以以称为多晶型物的不同结晶形式存在是公认的。特定物质的不同
多晶型物或多晶型比例可提供显著不同的治疗行为。
[0039]
孕酮是在水中难溶的药物,其可呈现出不同的多晶型形式,其中研究最多的是两种:形式i(或α)和形式ii(或β)(araya-sibaja et al.,scanning,2013,35(4),213-221)。
[0040]
为纯多晶型形式i或为富多晶型物i形式的孕酮可通过本领域已知的(例如,barrio et al.,journal of pharmaceutical sciences,2009,98(5),1657-1670中所述的)方法制备。当从稀醇中结晶时,孕酮多晶型形式i形成特征性的棱柱样晶体(o’neil et al.,the merck index,13
th ed.,2001,7866)。本领域使用不同的分析技术来检测和/或量化孕酮多晶型形式i,即差示扫描量热法(differential scanning calorimetry,dsc)、x射线衍射、红外光谱或拉曼光谱(wang et al.,organic process research&development,2000,4,391-395)。最通常使用的技术是差示扫描量热法,通过该方法,孕酮多晶型形式i在约128至130℃(对应于其熔点)下显示出特征吸热。
[0041]
在本发明的情况下,孕酮以其天然形式(即由卵巢产生)使用。然而,孕酮的药用盐或溶剂合物也在本发明的范围内。特别地,孕酮多晶型形式i的药物盐或溶剂合物在本发明的范围内。
[0042]
本公开内容通篇,除非另有说明,否则百分比、比例等的所有表述均是“按重量计”。本文中使用的“按重量计”与术语“按质量计”同义,并且指示本文中限定的比例或百分比是根据重量而不是体积、厚度或某种其他量度来完成的。
[0043]
本文中使用的术语“约”,当与百分比或其他数值量结合使用时,意指该百分比或其他数值量的正负1%。例如,术语“约80%”将涵盖80%正负0.8%。
[0044]
优选地,本发明的阴道内环为环形形状。本文中使用的“环形”是指涉及环或形成环的形状。适合用于本发明的环形形状包括环、卵形、椭圆形、圆环(toroid)等。本发明的阴道内环的形状可临时改变或变形,即例如当被插入到阴道中时可临时采取非环形形状。相对于未变形状态下的本发明的环,给出以下的环直径值。
[0045]
在本发明的一个实施方案中,装置中的基本上所有孕酮均为多晶型形式i。本文中使用的术语“基本上所有”意指阴道内装置中所包含的孕酮包含最多约5%、优选约2.5%、更优选约1.5%或更少、优选约0.5%或更少的其他多晶型形式,特别是多晶型形式ii,或者包含不可检测出的量的其他多晶型形式,特别是多晶型形式ii。
[0046]
本发明的阴道内装置中所包含的孕酮的至少约75%为多晶型形式i。在另一个实施方案中,阴道内装置中所包含的孕酮的至少约80%为多晶型形式i。在另一个实施方案中,阴道内装置中所包含的孕酮的至少约85%为多晶型形式i。在另一个实施方案中,阴道内环中所包含的孕酮的至少约90%为多晶型形式i。在一个优选实施方案中,阴道内装置中所包含的孕酮的至少约95%为多晶型形式i。
[0047]
在另一个实施方案中,阴道内装置中所包含的孕酮的约75%至约96%、97%、98%、99%或100%为多晶型形式i。在另一个实施方案中,阴道内装置中所包含的孕酮的约80%至约96%、97%、98%、99%或100%为多晶型形式i。在另一个实施方案中,阴道内装置中所包含的孕酮的约85%至约96%、97%、98%、99%或100%为多晶型形式i。在另一个实施方案中,阴道内装置中所包含的孕酮的约90%至约96%、97%、98%、99%或100%为多晶型形式i。在另一个实施方案中,阴道内装置中所包含的孕酮的约95%至约96%、97%、98%、99%或100%为多晶型形式i。在一个优选实施方案中,阴道内装置中所包含的孕酮的
约100%为多晶型形式i。
[0048]
本发明人出人意料地发现,在不孕,特别是与辅助生殖技术相关的那些的治疗中,可使用包含孕酮(其中所述孕酮的至少75%为多晶型形式i)的阴道内装置成功地补充所述激素。
[0049]
本发明人还不可预见地发现,将本发明装置中的孕酮的量降低至低于现有技术的装置中通常使用的那些(在该水平下在孕酮补充期期间可观察到阴道出血)得到的阴道内装置可用于成功地将子宫内膜转化为分泌期并维持妊娠,同时在孕妇中使阴道出血最小化或甚至避免阴道出血。
[0050]
在本发明的一个实施方案中或在任何上述实施方案中,阴道内装置包含约1.50g孕酮或更低。在另一个实施方案中,其包含约0.75g孕酮或更低。在另一个实施方案中,其包含约0.70g孕酮或更低。在另一个实施方案中,其包含约0.50g孕酮或更低。在另一个实施方案中,其包含约0.375g孕酮或更低。在另一个实施方案中,其包含约0.125g孕酮或更低。在另一个实施方案中,其包含约0.100g孕酮。
[0051]
在另一个实施方案中,其包含约1.50至约0.100g孕酮。在另一个实施方案中,其包含约1.50至约0.125g孕酮。在另一个实施方案中,其包含约1.50至约0.25g孕酮。在一个优选实施方案中,其包含约1.5至约0.375g孕酮。
[0052]
在另一个实施方案中,其包含约0.75至约0.100g孕酮。在另一个实施方案中,其包含约0.75至约0.125g孕酮。在另一个实施方案中,其包含约0.75至约0.25g孕酮。在一个优选实施方案中,其包含约0.75至约0.375g孕酮。
[0053]
在另一个实施方案中,其包含约0.70至约0.100g孕酮。在另一个实施方案中,其包含约0.70至约0.125g孕酮。在另一个实施方案中,其包含约0.70至约0.25g孕酮。在一个优选实施方案中,其包含约0.70至约0.375g孕酮。
[0054]
在另一个实施方案中,其包含约0.50至约0.100g孕酮。在一个优选实施方案中,其包含约0.50至约0.125g孕酮。在一个优选实施方案中,其包含约0.5至约0.25g孕酮。在一个更优选的实施方案中,其包含约0.5至约0.375g孕酮。
[0055]
在一个优选实施方案中,其包含约0.375至约0.100g孕酮。在一个更优选的实施方案中,其包含约0.375至约0.125g孕酮。在一个优选实施方案中,其包含约0.375至约0.25g孕酮。
[0056]
在一个特别的实施方案中,其包含约1.50g孕酮。在一个特别的实施方案中,其包含约0.75g孕酮。在一个特别的实施方案中,其包含约0.70g孕酮。在一个特别的实施方案中,其包含约0.50g孕酮。在一个优选实施方案中,其包含约0.375g孕酮。在一个特别的实施方案中,其包含约0.25g孕酮。在一个特别的实施方案中,其包含约0.125g孕酮。
[0057]
在本发明的一个实施方案中,阴道内装置包含相对于环的总重量的约34.8%的量的孕酮或更少。在另一个实施方案中,其包含约17.4%的孕酮或更低。在另一个实施方案中,其包含约16.2%的孕酮或更低。在一个优选实施方案中,其包含约11.6%的孕酮或更低。在一个更优选的实施方案中,其包含约8.7%的孕酮或更低。在另一个实施方案中,其包含约2.9%的孕酮。
[0058]
在另一个实施方案中,其包含约34.8%至约2.9%的孕酮。在另一个实施方案中,其包含约34.8%至约5.8%的孕酮。在另一个实施方案中,其包含约34.8%至约8.7%的孕
酮。
[0059]
在另一个实施方案中,其包含约17.4%至约2.9%的孕酮。在另一个实施方案中,其包含约17.4%至约5.8%的孕酮。在一个优选实施方案中,其包含约17.4%至约8.7%的孕酮。
[0060]
在另一个实施方案中,其包含约16.2%至约2.9%的孕酮。在另一个实施方案中,其包含约16.2%至约5.8%的孕酮。在一个优选实施方案中,其包含约16.2%至约8.7%的孕酮。
[0061]
在一个优选实施方案中,其包含约11.6%至约2.9%的孕酮。在一个优选实施方案中,其包含约11.6%至约5.8%的孕酮。在一个更优选的实施方案中,其包含约11.6%至约8.7%的孕酮。
[0062]
在一个更优选的实施方案中,其包含约8.7%至约2.9%的孕酮。在一个优选实施方案中,其包含约8.7%至约5.8%的孕酮。
[0063]
在一个特别的实施方案中,其包含约34.8%的孕酮。在一个特别的实施方案中,其包含约23.2%的孕酮。在一个特别的实施方案中,其包含约17.4%的孕酮。在一个特别的实施方案中,其包含约16.24%的孕酮。在一个优选实施方案中,其包含约11.6%的孕酮。在一个更优选的实施方案中,其包含约8.7%的孕酮。在一个优选实施方案中,其包含约5.8%的孕酮。在一个特别的实施方案中,其包含约2.9%的孕酮。
[0064]
在一些特别的实施方案中,在以上提及的特定百分比范围或百分比和/或特定重量范围或重量中的任一个和每一个中,阴道内装置中所包含的孕酮的至少约95%为多晶型形式i。在一个优选实施方案中,阴道内装置包含相对于环的总重量的约34%至约3%的量的孕酮,并且阴道内环中所包含的孕酮的约90%至约96%、97%、98%、99%或100%为多晶型形式i。
[0065]
在另一个优选实施方案中,阴道内装置包含相对于装置的总重量的约17%至6%的量的孕酮,并且阴道内装置中的孕酮的至少约95%为多晶型形式i.
[0066]
在另一个优选实施方案中,阴道内装置包含相对于装置的总重量的约12%至7%的量的孕酮,并且阴道内装置中的孕酮的至少约99%为多晶型形式i.
[0067]
在另一个优选实施方案中,阴道内装置包含相对于装置的总重量的约9%至约8%的量的孕酮,并且阴道内装置中所包含的孕酮的约100%为多晶型形式i。
[0068]
本发明人出人意料地发现,在不孕,特别是与辅助生殖技术相关的那些的治疗中,可使用包含按重量计低于35%的量的孕酮(其中所述孕酮的至少75%为多晶型形式i)的本发明阴道内装置(优选地为环的形式)成功地补充所述激素而在至少14天期间不需要替换成含有更高量的孕酮的另一种装置,也不需要添加其他孕酮制剂。
[0069]
在一个实施方案中或在任何先前实施方案中,所述装置还包含可药用聚合组合物作为可药用载体。用于本发明阴道内装置的可药用载体以及任何其他材料适合于放置在对象的阴道中并且对对象是无毒的。所述材料还适合于被形状设置为阴道内装置,优选环或类似形式。
[0070]
适合用于本文中公开的阴道内装置的可药用聚合组合物包括但不限于:烯烃和乙烯基型聚合物、碳水化合物型聚合物、缩合型聚合物、橡胶型聚合物和/或聚硅氧烷。可使用的另一些示例性聚合物包括:聚(乙烯-乙酸乙烯酯)、聚(丙烯酸甲酯)、聚(甲基丙烯酸丁
酯)、增塑的聚(氯乙烯)、增塑的尼龙、增塑的聚(对苯二甲酸乙二醇酯)、聚(乙烯)、聚(丙烯腈)、聚(三氟氯乙烯)、聚(4,4
’-
异丙烯-二亚苯基碳酸酯)、聚(乙烯乙烯基酯)、聚(氯乙烯富马酸二乙酯)、聚(丙烯酸酯和甲基丙烯酸酯的酯)、乙酸纤维素、酰化纤维素、部分水解的聚(乙酸乙烯酯)、聚(乙烯醇缩丁醛)、聚(酰胺)、聚(碳酸乙烯酯)、聚(氨基甲酸酯)、聚(烯烃)、聚(苯乙烯)、聚(苯乙烯-丁二烯),及其组合。这些聚合物及其物理特性以及合成方法是本领域已知的。
[0071]
在一些特别的实施方案中,可药用聚合组合物包含至少一种弹性体。
[0072]
术语“弹性体”是技术人员所理解的弹性体。特别地,其是指当聚合物或聚合物的混合物经受交联时形成的非晶态聚合物网络。每种聚合物由连接在一起以形成聚合物的单体单元构成。单体单元包含碳、氢、氧、硅、卤素,或其组合。弹性体可容易地弯曲、拉伸、扭曲或变形,并且在释放时快速恢复到其近似的原始尺寸和形状。弹性体提供具有足够的结构完整性的阴道内装置以确保治疗使用以及足够的柔性以适应患者的身体并且提供最大的患者舒适度。
[0073]
优选地,可药用聚合组合物包含至少一种基于硅酮的弹性体,例如聚硅氧烷。本文中使用的“聚硅氧烷”是指含有以线型或环状排列的交替的硅和氧原子的多种化合物中的任一种。在一些特别的实施方案中,聚硅氧烷是二有机聚硅氧烷,例如二芳基聚硅氧烷和二烷基聚硅氧烷。在一个特别的实施方案中,聚硅氧烷是乙烯基二甲基封端的。在一个更特别的实施方案中,聚硅氧烷是乙烯基封端的二甲基聚硅氧烷。
[0074]
在另一些实施方案中,可药用载体包含至少一种非硅酮弹性体,例如苯乙烯共聚物例如聚(苯乙烯-丁二烯)。
[0075]
在一个优选实施方案中,本发明的阴道内装置除孕酮和可药用聚合组合物之外不包含其他材料。但是,在一个不同的实施方案中,本发明的阴道内装置除孕酮和可药用聚合组合物之外可包含其他材料。
[0076]
在一个优选实施方案中,本发明的阴道内装置除以下之外不包含其他材料:孕酮、可药用聚合组合物以及来源于制备该装置所必需的并且在该装置制备之后形成其一部分的一种或多种物质的任何物质或一种物质,例如本文中所提及的那些中的任一种,例如交联催化剂或催化剂抑制剂。
[0077]
在一个优选实施方案中,本发明的阴道内装置除孕酮和可药用聚合组合物之外不包含可药用赋形剂。但是,在一个不同的实施方案中,本发明的阴道内装置除孕酮和可药用聚合组合物之外可包含可药用赋形剂。阴道用可药用赋形剂的一些非限制性实例包括:润湿剂、表面活性剂、泊洛沙姆(poloxamer)、卡波姆、聚乙烯醇、二氧化硅、羧甲基纤维素钠、乳化剂、非离子表面活性剂、吐温、吐温80、聚山梨酯80、α-硫辛酸、α-生育酚、抗坏血酸棕榈酸酯、苯甲醇、生物素、亚硫酸氢盐(bisulfite)、硼、丁基化羟基茴香醚、丁基化羟基甲苯、抗坏血酸、类胡萝卜素、柠檬酸钙、乙酰基-l-肉碱、螯合剂、软骨素、铬、柠檬酸、辅酶q-10、半胱氨酸、盐酸半胱氨酸、3-去氢莽草酸(3-dehydroshikimic acid)、edta、硫酸亚铁、叶酸、富马酸、没食子酸烷基酯(alkyl gallate)、大蒜(garlic)、葡萄糖胺、葡萄籽提取物、古古尔(gugul)、镁、苹果酸、偏亚硫酸氢盐、n-乙酰半胱氨酸、烟酸、烟酰胺(nicotinamide)、荨麻根、鸟氨酸、没食子酸丙酯、碧萝芷(pycnogenol)、锯棕榈、硒、亚硫酸氢钠、焦亚硫酸钠、亚硫酸钠、亚硫酸钾、酒石酸、硫代硫酸盐/酯、硫代甘油、硫代山梨糖醇
(thiosorbitol,)、生育酚、生育酚乙酸酯、生育酚琥珀酸酯、tocotrienal、d-α-生育酚乙酸酯、维生素a、维生素b、维生素c、维生素d、维生素e、锌、碳水化合物、脂肪酸的烃或甘油酯,或其组合。
[0078]
在一个优选实施方案中,本发明的阴道内装置除孕酮之外不包含其他活性药物成分。但是,在一个不同的实施方案中,本发明的阴道内装置除孕酮之外可包含其他活性药物成分。在一个特别的实施方案中,其他活性药物成分是使得能够排卵、胚胎植入和/或早期妊娠维持的物质。在一个特别的实施方案中,其他活性药物成分是雌激素。
[0079]
在另一个优选实施方案中,本发明的阴道内装置除孕酮和可药用聚合组合物、任选地来源于制备该装置所必需的并且在该装置制备之后形成其一部分的物质的任何物质或一种物质之外,既不包含可药用赋形剂也不包含其他活性药物成分。
[0080]
在包含可药用载体的一些实施方案中,相对于装置重量的以上指定的孕酮重量百分比或百分比范围中的任何一个代替地是指相对于孕酮与药物载体组合重量的孕酮重量。
[0081]
以上特定的重量或重量范围以及重量百分比或百分比范围中的任何一个可单独组合以得到新的实施方案。在一个优选实施方案中,0.375g孕酮对应于相对于环总重量或相对于孕酮与药物载体组合重量的约8.7%的孕酮,并且如上所述的其他特定重量对应于基于该比例的重量百分比。
[0082]
在一个实施方案中或在任何上述实施方案中,孕酮在阴道内装置中基本上均匀地分散。
[0083]
在一个实施方案中或在任何上述实施方案中,孕酮可以是经微粉化的。本文中使用的“经微粉化的”是指已被降低至微米尺寸的组合物的颗粒。在一个优选实施方案中或在任何上述优选实施方案中,孕酮是未经微粉化的。有利地,使用非微粉化的孕酮可防止“突释”效应,通过该效应,孕酮最初从阴道环中过度释放。
[0084]
在一个实施方案中或在任何上述实施方案中,阴道内装置为环的形式或大致类似于环的形式。优选地,环的外径为约40至约65mm。在另一个实施方案中,其外径为约50至约60mm。在一个优选实施方案中,阴道内环的外径为约58mm。本文中使用的“外径”是指穿过环的中心并且其端点在环的外周长上的任何直线段。在环的外径沿整个周长不恒定的情况下,外径是指穿过环的中心并且其端点在环的外周长上的最长直线段。
[0085]
在一个实施方案中或在任何上述实施方案中,阴道内装置(优选环)的截面直径为约4至约10mm。在另一个实施方案中,其截面直径为约5至约8mm。在一个优选实施方案中,阴道内环的截面直径为约5.5mm。本文中使用的“截面直径”是指其端点在环的内周长和外周长上的任何直线段。
[0086]
在一个特别的实施方案中,阴道内环的外径为约50至约60mm,并且截面直径为约5至约8mm。在一个优选实施方案中,阴道内环的外径为约58mm,并且截面直径为约5.5mm。
[0087]
在一个实施方案中,阴道内装置释放(体内)不超过或约10mg孕酮/天,持续至少7天。在另一个实施方案中,阴道内环释放(体内)不超过或约10mg孕酮/天,持续至少14天,优选持续14至18天的时间,更优选持续14天。在一个实施方案中,阴道内装置释放(体内)4至8mg孕酮/天,持续至少7天。在一个优选实施方案中,阴道内装置释放(体内)4至8mg孕酮/天,持续至少14天,优选持续14至18天的时间,更优选持续14天。在一个更优选的实施方案中,阴道内装置释放(体内)约6mg孕酮/天,持续至少14天,优选持续14至18天的时间,更优
选持续14天。通过将在治疗结束时(例如第14天)装置中孕酮的剩余量减去开始时(第0天)装置中孕酮的量并且将结果除以治疗天数(例如14)来测量释放速率。
[0088]
在一个实施方案中,阴道内装置使得能够达到1至4ng/ml的平均孕酮血清水平,持续至少7天。在一个实施方案中,阴道内装置使得能够达到1至4ng/ml的平均孕酮血清水平,持续至少14天,优选持续14至18天的时间,更优选14天。在一个特别的实施方案中,阴道内装置使得能够达到1.5至3.5ng/ml的孕酮血清水平,持续至少14天,优选持续14至18天的时间,更优选14天。在一个更特别的实施方案中,阴道内装置使得能够达到约2至3ng/ml的孕酮血清水平,持续至少14天,优选持续14至18天的时间,更优选14天。2至3ng/ml的孕酮对应于约6.3至9.5nmol/ml的孕酮。
[0089]
在一个实施方案中,由本发明的阴道装置或环提供的孕酮血清水平在所述环的使用时间(排除使用的前24小时,在此期间血清水平升高)内大致恒定。在一些特别的实施方案中,使用时间为至少14天,优选地为14至18天的时间,更优选14天。“恒定”意指孕酮血清水平维持在约3至14nmol/l,更特别地在约6至约14nmol/l,优选地在约6至12nmol/l。
[0090]
在另一个优选实施方案中,阴道内装置或环包含约1.50g至约0.125g孕酮,其对应于相对于装置总重量或相对于孕酮与药物载体组合重量的约34.8%至约2.9%的孕酮,并且在7至18天、优选约14天、更优选14天的使用时间期间提供约3至14nmol/l的恒定血清水平(排除使用的前24小时,在此期间血清水平升高)。
[0091]
在一个特别优选的实施方案中,阴道内装置包含约0.75至0.125g孕酮,其对应于相对于装置总重量或相对于孕酮与药物载体组合重量的约17.4%至2.9%的孕酮,并且在7至18天、优选约14天、更优选14天的使用时间期间提供约3至12nmol/l的恒定血清水平(排除使用的前24小时,在此期间血清水平升高)。
[0092]
在一个特别优选的实施方案中,阴道内装置包含约0.375g孕酮,其对应于相对于装置总重量或相对于孕酮与药物载体组合重量的约8.7%的孕酮,并且在7至18天、优选约14天、更优选14天的使用时间期间提供约6至12nmol/l的恒定血清水平(排除使用的前24小时,在此期间血清水平升高)。
[0093]
在另一个特别的实施方案中,阴道内装置包含约0.75至约0.25g孕酮,其对应于相对于孕酮与药物载体组合重量或相对于装置总重量的约17.4%至约5.8%的孕酮,并且在7至18天、优选约14天、更优选14天的使用时间期间提供1.5至3.5ng/ml的恒定血清水平(排除使用的前24小时,在此期间血清水平升高)。
[0094]
总之,本发明人出人意料地发现,在不孕,特别是与辅助生殖技术相关的那些的治疗方案中,可使用包含按重量计低于35%的量的孕酮(其中所述孕酮的至少75%为多晶型形式i)的本发明阴道内装置(优选地为环的形式)成功地补充所述激素而在至少14天期间不需要替换成含有更高量的孕酮的另一种装置,也不需要添加其他孕酮制剂。此外,本发明人已证明这样的阴道内装置(即使提供低于或等于10mg/天的血清孕酮水平)的使用出乎意料地避免了在孕酮补充期期间的阴道出血或使其最小化。
[0095]
图3和图4示出了对于根据本发明的阴道环,特别是包含约0.125g孕酮至约1.50g孕酮的阴道内环所观察到的血清孕酮浓度。
[0096]
如以上提及的,本发明还涉及用于制造如上所述的阴道装置或环的方法,所述方法包括以下步骤:
[0097]
a)将其中孕酮的至少75%为多晶型形式i的所述孕酮与可药用聚合物形成组合物混合;以及随后
[0098]
b)使由步骤a)产生的混合物在120℃或更低的温度下固化。
[0099]
孕酮的多晶型形式i的熔点通常报道为128至130℃。如果经受高于其熔点的温度,孕酮变成亚稳熔化物并且失去多晶型形式(barrio et al.,journal of pharmaceutical sciences,2009,98(5),1657-1670)。因此,通过使由步骤a)产生的混合物在120℃下固化,相对于起始材料,维持了装置中为多晶型形式i的孕酮的百分比;即,使多晶型形式i的损失最小化。
[0100]
其中孕酮的至少75%为多晶型形式i的孕酮可通过本领域已知的,例如由barrio et al描述的方法获得。为基本上纯的多晶型形式i的孕酮也可商购获得。
[0101]
在本发明的一个实施方案中,步骤a)中的基本上所有孕酮均为多晶型形式i。在另一个实施方案中,步骤a)中的孕酮的至少约75%为多晶型形式i。在另一个实施方案中,步骤a)中的孕酮的至少约80%为多晶型形式i。在另一个实施方案中,步骤a)中的孕酮的至少约85%为多晶型形式i。在另一个实施方案中,步骤a)中的孕酮的至少约90%为多晶型形式i。在另一个实施方案中,步骤a)中的孕酮的至少约95%为多晶型形式i。
[0102]
在另一个实施方案中,步骤a)中的孕酮的约75%至约100%为多晶型形式i。在另一个实施方案中,步骤a)中的孕酮的约80%至约100%为多晶型形式i。在另一个实施方案中,步骤a)中的孕酮的约85%至约100%为多晶型形式i。在另一个实施方案中,步骤a)中的孕酮的约90%至约100%为多晶型形式i。
[0103]
在一个优选实施方案中,步骤a)中多晶型形式i的纯度对应于上述阴道内装置和环的实施方案中的任一个中的多晶型形式i的纯度。如已经提及的,本发明的方法防止了阴道装置中的多晶型物i多晶型纯度相对于步骤a)中所使用的孕酮起始材料的损失。
[0104]
同样地,所使用的孕酮的重量或所使用的孕酮的重量百分比可以为上述阴道装置实施方案所述的那些中的任何一个。
[0105]
本发明人已发现,由步骤a)产生的混合物中为多晶型形式i的孕酮的存在(以上述阴道装置实施方案中所述的重量百分比)不抑制步骤b)中聚合组合物的固化。
[0106]
在一个特别的实施方案中或在任何上述方法实施方案中,步骤b)的固化在模具中进行。在一个优选实施方案中,本发明的方法包括将由步骤a)产生的混合物注射成型到步骤b)的模具中。在一个特别的实施方案中,模具限定适合于制造具有如上所述尺寸的阴道内环的腔。
[0107]
此外,本发明人出乎意料地注意到,与包含较少的为多晶型形式i的孕酮的装置或环相比,包含其至少75%为多晶型形式i的孕酮的所得阴道装置或环可具有以下有利特性:
[0108]-显著较少的孕酮“起霜”(迁移至环的表面);
[0109]-较小的孕酮“突释”效应(最初过度释放);
[0110]-较慢的孕酮释放。
[0111]
在一个优选实施方案中,当使用如下所述的弹性体形成组合物作为可药用聚合物形成组合物时,步骤b)的固化可在非常短的时间段内进行。有利地,在这样短的时间内进行步骤b)的可能性提供了制造本发明的孕酮阴道装置的方法,其特别好地适合工业应用。
[0112]
因此,在一个特别的实施方案中或在任何上述方法实施方案中,步骤b)在约10分
钟或更短的时间内、在约5分钟或更短的时间内、在约3分钟或更短的时间内、在约45秒或更短的时间内、在约30秒或更短的时间内进行。在一个特别的实施方案中,步骤b)在约10分钟至约15秒的时间内、在约5分钟至约30秒的时间内、在约3分钟的时间内、在约2分钟的时间内、在约90秒的时间内、在约1分钟的时间内、在约45秒的时间内、在约30秒的时间内进行。优选地,步骤b)在约3分钟至约45秒的时间内进行。
[0113]
在一个特别的实施方案中或在任何上述方法实施方案中,可药用聚合物形成组合物是聚合物形成材料,其在低于或等于120℃的温度下、优选在10分钟或更短的时间内交联以形成如在任何上述实施方案中所述的可药用聚合组合物。
[0114]
在一个特别的实施方案中或在任何上述方法实施方案中,可药用聚合物形成组合物是弹性体形成组合物。在一个特别的实施方案中,弹性体形成组合物包含至少一种聚硅氧烷,优选至少一种二有机聚硅氧烷,优选二甲基聚硅氧烷,其中的任何一种均可与弹性体交联。优选地,所述聚硅氧烷每分子包含至少两个具有脂肪族不饱和的硅酮键合基团,例如乙烯基封端的聚硅氧烷。在一个优选实施方案中,聚硅氧烷是乙烯基封端的。优选地,所述聚硅氧烷是乙烯基二甲基封端的。优选地,所述聚硅氧烷是乙烯基封端的二甲基聚硅氧烷。在另一些实施方案中,弹性体形成组合物包含非基于硅酮的聚合物材料,例如聚(苯乙烯-丁二烯)。
[0115]
在一个特别的实施方案中或在任何上述方法实施方案中,在适用的情况下,所述弹性体形成组合物包含交联剂,其可以是例如h或oh,优选h;封端的聚硅氧烷,优选h或oh,优选h;封端的二有机聚硅氧烷。在一个特别的实施方案中,聚硅氧烷是氢化物二甲基封端的。在一个更特别的实施方案中,交联剂是h-封端的二甲基聚硅氧烷。
[0116]
在一个特别的实施方案中或在任何上述方法实施方案中,在适用的情况下,所述弹性体形成组合物包含交联催化剂,其可以是有机金属化合物,例如辛酸亚锡、二月桂酸二丁基锡、钛酸烷基酯和钛螯合物或铂络合物。在一个优选实施方案中,交联催化剂是铂络合物,特别地,其促进不饱和基团(例如以上提及的乙烯基封端的那些)与硅键合的氢基团(例如以上提及的h封端的那些)之间的反应,例如氯铂酸、乙酰丙酮铂、亚铂卤化物与不饱和化合物(例如乙烯、丙烯、有机乙烯基硅氧烷和苯乙烯)的络合物、甲基二铂以及pt(cn)3。优选地,铂络合物是乙烯基二聚体中的铂络合物。
[0117]
在一个特别的实施方案中或在任何上述方法实施方案中,在适用的情况下,所述弹性体形成组合物包含催化剂抑制剂,例如炔基化合物,例如炔属不饱和仲或叔醇,例如乙炔基环己醇。脂肪族不饱和基团优选地为烯属不饱和的。
[0118]
在一个特别的实施方案中或在任何上述方法实施方案中,在适用的情况下,所述弹性体形成组合物包含二氧化硅填料,例如经处理的二氧化硅。
[0119]
从工业角度来看,特别优选的是在120℃或更低的温度下并且在约10分钟或更短的时间内交联的弹性体形成组合物,例如包含乙烯基二甲基封端的聚硅氧烷、氢化物二甲基封端的聚硅氧烷、促进氢化硅烷化(hydrosililation)的铂络合物催化剂和催化剂抑制剂的弹性体形成组合物。在一个特别的实施方案中,弹性体形成组合物包含乙烯基二甲基封端的聚硅氧烷、氢化物二甲基封端的聚硅氧烷、乙烯基二聚体中的铂络合物和乙炔基环己醇。在一个特别的实施方案中,弹性体形成组合物是ddr-4320或ddu-4320(可从nusil technology llc商购获得)。在另一个特别的实施方案中,弹性体形成组合物是lsr92或
lsr86(可从bluestar/elkem获得)。在另一个特别的实施方案中,弹性体形成组合物是silbione biomaterial lsr d140(可从bluestar/elkem获得)。
[0120]
如果装置(优选环)将包含一种或更多种另外的可药用赋形剂,则取决于每种可药用赋形剂的性质,每种可药用赋形剂将在步骤a)过程中、在步骤b)过程中或在步骤b)之后添加。技术人员理解何时以及如何可添加任一种赋形剂。在最优选的实施方案中,环除弹性体之外不包含可药用赋形剂。
[0121]
在本发明方法的一个优选实施方案中,步骤a)包括:
[0122]
a1)将孕酮与可药用聚合物形成组合物和交联催化剂混合以形成混合物a;以及
[0123]
a2)将孕酮与可药用聚合物形成组合物和交联剂以及催化剂抑制剂混合以形成混合物b;
[0124]
a3)将混合物a与b混合,
[0125]
其中可药用聚合物形成组合物、交联催化剂、交联剂和催化剂抑制剂是在任何上述方法实施方案中所述的那些。
[0126]
混合物a中的孕酮浓度可与混合物b中的相同或者其可不同,只要最终浓度为任何上述阴道装置实施方案所述的浓度即可。在一个特别的实施方案中,混合物a中的孕酮浓度与混合物b中的相同。混合物a中的孕酮的多晶型物i多晶型纯度可与混合物b中的相同或者其可不同,只要最终的多晶型物i多晶型纯度为任何上述阴道环实施方案所述的纯度即可。在一个特别的实施方案中,混合物a中的孕酮的多晶型物i多晶型纯度与混合物b中的相同。
[0127]
在一个实施方案中,当使用二氧化硅填料时,其形成混合物a的一部分。
[0128]
在一个特别的实施方案中,步骤a3)的混合意味着将混合物a和混合物b添加到高速混合器中并进行混合。在一个更特别的实施方案中,将混合物a和混合物b以约1∶1的比例添加到高速混合器中。在一个特别的实施方案中,所述添加是通过将混合物泵入混合器中来进行的。在一个特别的实施方案中,高速混合器是静态管线内(in-line)混合器。在一个特别的实施方案中,混合物a与b的混合是通过湍流(turbulence)进行的。
[0129]
在一个另外的方面,本发明提供了阴道装置(优选环),其可通过以上提及的方法实施方案中的任何一个获得。
[0130]
本发明另外涉及如在任何上述实施方案中所述的阴道内装置(优选环),其用于医学,所述阴道内装置包含:
[0131]
·
治疗有效量的孕酮;
[0132]
·
可药用载体。
[0133]
本发明还提供了如在任何上述实施方案中所述的阴道内装置(优选环),其用于治疗不孕(特别是在辅助生殖技术中),所述阴道内装置包含:
[0134]
·
治疗有效量的孕酮;
[0135]
·
可药用载体。
[0136]
本发明还提供了如在任何上述实施方案中所述的阴道内装置(优选环),其用于治疗围绝经期症状,所述阴道内装置包含:
[0137]
·
治疗有效量的孕酮;
[0138]
·
可药用载体。
[0139]
在本发明的情况下,所治疗的对象是雌性对象。在一个特别的实施方案中,雌性对
象是非人雌性对象。在另一个实施方案中,雌性对象是动物。在另一个实施方案中,雌性对象是人。
[0140]
本发明还涉及用于在有此需要的雌性对象中治疗不孕,特别是辅助生殖技术的方法,所述方法包括向患者施用如在任何上述实施方案中所述的阴道内装置(优选环),其包含:
[0141]
·
治疗有效量的孕酮;
[0142]
·
可药用载体。
[0143]
本发明还涉及用于在有此需要的雌性对象中治疗围绝经期症状的方法,所述方法包括向患者施用如在任何上述实施方案中所述的阴道内装置(优选环),其包含:
[0144]
·
治疗有效量的孕酮;
[0145]
·
可药用载体。
[0146]
本发明还涉及用于制造用于治疗不孕(特别是在辅助生殖技术中)的如在任何上述实施方案中所述的阴道内装置(优选环)的方法,其中所述阴道内装置包含:
[0147]
·
治疗有效量的孕酮;
[0148]
·
可药用载体。
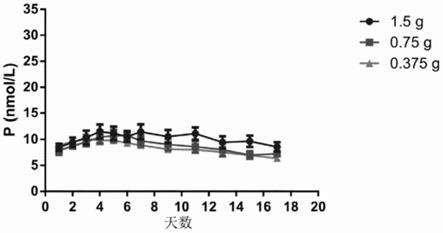
[0149]
本发明还涉及用于制造用于在雌性对象中治疗围绝经期症状的如在任何上述实施方案中所述的阴道内装置(优选环)的方法,其中所述阴道内装置包含:
[0150]
·
治疗有效量的孕酮;
[0151]
·
可药用载体。
[0152]
在本发明的情况下,术语“治疗有效量”是指阴道装置中的这样的孕酮量,其使得能够实现足以在子宫内膜中发挥足够的促孕作用以建立和维持早期妊娠的子宫内孕酮水平。关于围绝经期症状的治疗,术语“治疗有效量”是指阴道装置中成功地允许治疗或缓解围绝经期症状的孕酮的量。
[0153]
除非另有说明,否则本文中使用的表述“治疗不孕”、“不孕的治疗”以及类似表述意指逆转或预防雌性对象天然或诱导的无能力以建立胚胎植入并且维持早期妊娠,特别是指在辅助生殖技术(也称为辅助受孕)中支持黄体期。所述术语还指缓解、抑制围绝经期的进展,逆转或预防围绝经期症状。
[0154]
不孕治疗中的黄体期支持
[0155]
黄体期被定义为从发生排卵直至建立妊娠或在2周之后恢复月经的时期。在辅助生殖技术的背景下,黄体期支持(luteal phase support,lps)是用于描述旨在支持植入过程的药物的施用的术语。
[0156]
在ivf周期中黄体功能受到损害是公认的。art中黄体期异常的原因是多方面的。已显示黄体的功能受到用于卵母细胞取回的卵泡抽吸过程的损害,因为颗粒细胞被机械地破坏和吸出。已证明,黄体期缺陷在长期的gnrh-激动剂方案中发生,并且通常作为辅助生殖技术后遗症的黄体缺乏部分是由用于卵母细胞取回的卵泡抽吸过程以及用于排卵诱导或卵泡发育刺激的生育药物,特别是促性腺激素释放激素激动剂的使用引起的。在缺乏黄体期支持的情况下,孕酮的曲线下面积未达最佳标准,并且这伴有过早的黄体溶解。在非支持周期中,黄体期的长度缩短并且发生早期出血。许多荟萃分析(meta-analyse)认为黄体支持改善了ivf结局。与gnrh激动剂和非gnrh激动剂周期中的安慰剂或不治疗相比,用孕酮
的黄体期支持还引起临床妊娠率和活产显著提高。
[0157]
因此,认为黄体期支持,特别是通过孕酮补充,是必不可少的并且在一些情况下是强制的以应对在不孕治疗期间可能出现的任何黄体功能不全。特别地,已证明,用孕酮的黄体期支持在接受排卵诱导治疗的无排卵患者中以及在art(例如ivf)之前或在其他不孕治疗(例如子宫内授精(intra-uterine insemination,iui))之前接受多卵泡发育刺激的排卵患者中改善了妊娠结局。
[0158]
因此,在本发明的一个优选实施方案中,将如在任何上述实施方案中所述的阴道内装置(优选环)用于黄体期支持。在本发明的情况下,黄体期支持是指向雌性对象补充或替代孕酮以帮助或改善胚胎植入和早期妊娠维持。
[0159]
在一个优选实施方案中,在任何上述实施方案中,本发明的阴道内装置在接受不孕治疗方案的雌性对象中使用。在一个特别的实施方案中,不孕治疗方案包括施用生育药物。在一个特别的实施方案中,不孕治疗方案包括排卵诱导或多卵泡发育刺激。在一个特别的实施方案中,使用生育药物用于排卵诱导或多卵泡发育刺激。
[0160]
在一个特别的实施方案中,不孕治疗方案是art方案。在一个甚至更特别的实施方案中,art方案是ivf、icsi、gift、zift或fet。在一个优选实施方案中,art方案是ivf或icsi。在一个特别的实施方案中,art方案是ivf。在一个特别的实施方案中,art方案是icsi。
[0161]
在另一个特别的实施方案中,不孕治疗方案是人工授精方案。在一个更特别的实施方案中,人工授精方案是iui。应当注意的是,在本发明中使用的“方案”与“周期”等同义。
[0162]
在一个特别的实施方案中,雌性对象是不排卵的。在一个特别的实施方案中,雌性对象是不排卵的并且经受排卵诱导。在另一个特别的实施方案中,雌性对象是排卵的。在另一个特别的实施方案中,雌性对象是排卵的并且经受多卵泡发育刺激。
[0163]
在另一个实施方案中,无论雌性对象是否正在接受或将要接受不孕治疗方案,雌性对象均患有黄体期缺陷(luteal phase defect,lpd)。术语“黄体期缺陷”(lpd)是指正常雌性月经周期的破坏。lpd也称为黄体期功能不全、不足、缺陷或缺乏。其可能是由下丘脑/垂体、卵巢或子宫内膜的水平异常导致,由此雌性身体不产生足够的激素孕酮或对天然的激素水平没有完全响应。这导致在黄体期期间子宫的内壁(子宫内膜)发育的延迟。lpd可导致无法将子宫内膜转化为分泌期,由此子宫内壁开始破裂,引起月经出血并导致流产。在一个特别的实施方案中,lpd是由异常的卵泡生成、黄体生成素激增不足、通过黄体的孕酮分泌不足、原发性卵巢衰竭、卵巢缺失、卵巢功能早衰、卵巢储备功能下降、性腺发育不全、特发性卵巢衰竭、无性腺功能引起的。
[0164]
从前述清楚可见,设想本发明的阴道装置用于天然孕酮缺乏但未经受不孕治疗方案的雌性对象,非天然孕酮缺乏但由于不孕治疗方案变成这样或可能成为这样的雌性对象,或者天然孕酮缺乏并且经受不孕治疗方案的雌性对象。
[0165]
在一个特别的实施方案中,在任何上述实施方案中,使用本发明的阴道内装置在妊娠的前三个月中降低了自然流产(小产)的风险。在另一个特别的实施方案中,使用本发明的阴道内装置在妊娠的前两个月中降低了自然流产的风险。在一个甚至更特别的实施方案中,在妊娠的第一个月中降低了自然流产的风险。
[0166]
在另一个实施方案中,在任何上述实施方案中,治疗不孕涉及施用可用于使得能
够排卵、胚胎植入和/或早期妊娠维持的至少一种其他活性物质。在一个特别的实施方案中,所述至少一种其他活性物质是雌激素,其可通过本领域已知的途径施用。在一个特别的实施方案中,所述至少一种其他活性物质和孕酮包含在本发明的阴道装置中。
[0167]
根据本发明的阴道装置在提供黄体期支持方面是有效的,同时有利地预防或降低阴道出血的风险。本文中使用的术语“阴道出血”或“出血”是指通过阴道的任何种类的血液排出。其范围可从沾上血渍(spotting)(数滴血)到出血(更大的血液流)。优选地,其是指严重出血和出血。
[0168]
因此,在一个优选实施方案中,在任何上述实施方案中,本发明的阴道装置可用于治疗不孕中,并且同时用于预防或降低阴道出血的风险。在一个特别的实施方案中,使用本发明的阴道装置来代替已导致阴道出血或过度阴道出血的黄体支持治疗。
[0169]
在一个特别的实施方案中,在任何上述实施方案中,阴道内装置在至少7天(从插入阴道装置起开始计数)的时间内不更换。在一个优选实施方案中,阴道内装置在14天的时间内不更换。在一个特别的实施方案中,阴道内装置在15天、16天、17天或18天的时间内不更换。
[0170]
本发明人已发现,可使用根据本发明的装置(优选环)在这些时间段期间不被移除或更换的情况下成功地将子宫内膜转化为分泌期,而不会观察到患者的任何出血。在一个特别的实施方案中,阴道内装置在胚胎移植之前1至7天、在胚胎移植之前2至6天、在胚胎移植之前3至5天或在胚胎移植之前4天施用。在一个特别的实施方案中,其在胚胎移植之前1天施用。
[0171]
围绝经期
[0172]
如以上提及的,本发明还可用于治疗围绝经期症状。在本发明的情况下,孕酮缺乏是围绝经期症状的基础或促成该症状。
[0173]
绝经定义为在女性对象中在12个连续月内没有月经期。女性对象的身体变化开始于最后的月经周期之前的数年。这个过渡期被称为围绝经期,并且可持续长达6至10年。其以周期之间的时间长度变化开始,并且在最后的月经期之后12个月结束。在围绝经期期间,在每个月经周期期间均会募集并刺激更多的卵子,导致高于正常的雌激素水平和低于正常的孕酮水平。
[0174]
本发明的阴道内装置可用于围绝经期中的孕酮补充。所述装置可通过其他激素施用(孕酮或其他激素例如雌激素)而得到补充。
[0175]
可用本发明的阴道装置治疗的围绝经期症状的一些实例是:月经过多、不规则周期、热潮红、夜间盗汗、尿失禁、骨质疏松、睡眠障碍、情绪波动、神经质、焦虑、心悸、记忆丧失和/或集中力缺失、性欲缺乏、疲劳、泌尿生殖器萎缩、乳房萎缩或心血管疾病。在一个优选实施方案中,围绝经期症状是月经过多、骨质疏松、睡眠障碍或心血管疾病。
实施例
[0176]
以下实施例是为了举例说明本发明,并且不旨在以任何方式限制本发明的范围。因此,对于本领域技术人员显而易见的是,在不脱离本发明的范围和精神的情况下,可对本文中公开的本发明进行多种替换和修改。
[0177]
实施例1:阴道内环的制造过程和表征
[0178]
将ddr-4320(可从nusil technology llc商购获得)用于制备本发明的阴道环。ddr-4320的组成为以下:
[0179]
a部分-乙烯基二甲基封端硅酮聚合物;乙烯基二聚体中的铂络合物。
[0180]
b部分-乙烯基二甲基封端硅酮聚合物;氢化物二甲基封端硅酮聚合物,乙炔基环己醇。
[0181]
将1.9675g a部分与0.1875g孕酮(其中环中基本上所有孕酮均为多晶型形式i;商购获得)混合。在分开的容器中,将1.9675g b部分与0.1875g孕酮(与用于与a部分混合所使用的孕酮相同)混合。
[0182]
将两种混合物以1∶1的比例泵入静态管线内混合器中,在其中通过湍流将它们混合。将这种混合物注入模具中,在其中通过在120℃下固化45秒形成环。这样获得的阴道内环重量为4.31g并且由以下构成:
[0183][0184]
通过x射线衍射的阴道内环孕酮多晶型物i的鉴定和量化
[0185]
仪器和实验条件
[0186]
切割所获得的环以得到约1毫米厚度的圆盘形状样品。将圆盘形状样品夹在3.6微米厚度的聚酯膜之间。
[0187]
用具有聚焦镜和透射几何学的会聚光束配置的半径为240毫米的panalytical x’pert pro mpd θ/θ粉末衍射仪对样品进行分析,其中平样品夹在低吸收膜之间。采用以下条件:
[0188]
cu kα辐射
[0189]
工作功率:45kv-40ma。
[0190]
入射光束狭缝限定的0.4毫米的光束高度。
[0191]
入射和衍射光束0.02弧度的索勒狭缝(soller slit)。
[0192]
pixcel检测器:有效长度=3.347
°
。
[0193]
2至70
°
2θ的2θ/θ扫描,步长大小为0.026
°
2θ并且测量时间为600秒/步。
[0194]
结果
[0195]
观察到的结晶峰指示存在孕酮的结晶形式i(α形式),并且未发现其他多晶型物,特别是形式ii。图1描绘了样品的x射线粉末衍射图,其中峰对应于叠加的孕酮形式i(α形式)参考图样pdf#0-37-1690(参考图样描绘为竖线,所分析的样品描绘为峰)。使用这种仪器技术和样品类型,定量限为1%至5%。因此,可确保形式i的多晶型纯度为至少95%。
[0196]
通过差示扫描量热法
[0197]
仪器和实验条件
[0198]
在本发明的情况下,基于通过以下dsc方法所获得的焓读数来计算多晶型纯度值。
[0199]
在容量为40μl的铝坩埚中制备样品。用mettler toledo dsc822e对样品进行分析。采用以下条件:
[0200]
气体:干燥氮气50ml/分钟。
[0201]
方法:以10℃/分钟的速率从30℃加热至200℃。
[0202]
结果
[0203]
获得的曲线表明存在孕酮的结晶形式i(α形式),并且未发现其他多晶型物,特别是形式ii。图2描绘了dsc曲线,其显示了从129℃开始的吸热现象,相关热为5.83j/g。该吸热可归因于孕酮的多晶型物形式i(α形式)的熔化。没有鉴定出其他特征性吸热。
[0204]
实施例2:在健康绝经前女性志愿者中评价含有0.375g、0.125g和0.040g天然孕酮的3个阴道环的药动学、药效学和耐受性研究。
[0205]
这是i至ii期单中心、随机、主动控制、平行组、剂量响应的临床试验。
[0206]
目的:
[0207]
1.评价分别含有0.375g、0.125g和0.040g孕酮的3个阴道环的药动学特征
[0208]
2.评价3个阴道环在产生子宫内膜的妊娠转化中的作用
[0209]
3.评价孕酮阴道环的耐受性和可接受性
[0210]
对象数目:
[0211]
总共24个对象,每个受试组8个
[0212]
在调查研究中的医学病症或疾病:
[0213]
研究群体为健康志愿者,但是受试产品旨在用于在体外受精(ivf)/辅助生殖技术(art)的情况下治疗黄体期缺陷(lpd)。
[0214]
纳入标准:
[0215]
·
有生育潜能的健康成年妇女(包含18至45岁)。
[0216]
·
体重指数(bmi)范围限制为18至25kg/m2(包括两者)。
[0217]
·
正常的阴道状况。
[0218]
·
正常宫颈细胞学。
[0219]
·
乙型肝炎表面抗原(hepatitis b surface antigen,hbsag)、丙型肝炎病毒抗体(hepatitis c virus antibody,abhcv)、人免疫缺陷病毒(human immunodeficiency virus,hiv)呈血清阴性。
[0220]
·
说明了遵守方案程序和评估的意识和意愿的书面知情同意。
[0221]
·
愿意在研究期的持续时间内暂停经口避孕药。
[0222]
排除标准:
[0223]
·
相关的妇科病理学(子宫内膜异位、多囊卵巢综合征(polycystic ovary syndrome,pcos)、影响子宫内膜腔的子宫异常)。
[0224]
·
禁忌或禁止子宫内膜活检的任何近期或伴随的病理。
[0225]
·
在登记之前的月份中的任何时间的相关外阴阴道炎(感染性或非感染性)。
[0226]
·
使用雌激素的任何禁忌证(赘生物等)。
[0227]
·
伴随使用宫内节育器(intrauterine device,iud)和/或激素植入物。
[0228]
·
主动吸烟者(如果年长于35岁的话)。
[0229]
·
调查人员认为可能会危害研究依从性的任何伴随疾病。
[0230]
·
对本研究中使用的药物的活性成分或赋形剂(醋酸亮丙瑞林、雌二醇半水合物、孕酮)具有超敏性、变态反应或已知耐受。
[0231]
·
妊娠、意向妊娠或哺乳。
[0232]
·
在本研究中进行登记之前的3个月内参加了涉及新化学实体的另一项临床研究。(如果在本研究中进行登记之前4周内涉及仿制药)。
[0233]
·
不愿意并且能够使用屏障方法避孕。
[0234]
·
处女膜完整。
[0235]
·
静脉血栓栓塞病症(深静脉血栓形成、肺栓塞)或动脉的(心绞痛(angina)、心肌梗死、卒中)。
[0236]
·
凝血病(coagulopathy)或可能影响对象高凝状态的任何病症。
[0237]
研究治疗:
[0238]
受试产品和剂量:
[0239]
t3:含有0.375g天然孕酮的阴道环
[0240]
t4:含有0.125g天然孕酮的阴道环
[0241]
t5:含有0.040g天然孕酮的阴道环
[0242]
施用方式:每个对象中单一插入一个环
[0243]
除研究治疗之外,每个对象还接受以下治疗:
[0244]
·
用于抑制内源激素产生的gnrh-a注射
[0245]
·
用于产生子宫内膜增生期的雌激素贴剂
[0246]
·
任选地,对象可在研究结束时接受一个周期的经口避孕药
[0247]
治疗的持续时间:
[0248]
18
±
1天
[0249]
研究过程和评估:
[0250]
计划进行20次访视,包括筛选访视,在i期临床单位住院两晚,随访和最终电话联系。
[0251]
每个对象的参与被组织成长至5周的筛选/准备阶段、约18天的研究治疗期、约10天的随访期和3周的最终观察期:总共9周的研究访视和总共12周的研究参与。
[0252]
选择/筛选:
[0253]
每个对象均会到临床单位(clinical unit,cu)进行首次访视(访视0,在此访视期间对研究进行完全详细地解释并且需要得到正式同意。如果同意,则对象接受一般医学检查和一般实验室测试(临床化学、血液学、血清学、尿分析)以及细胞学检查。
[0254]
访视1包括妇科检查、妊娠测试、资格审查、阴道回波描记术、抽血(用于确定激素水平)和gnrh-a im注射(ginecrin depot 3.75mg)。
[0255]
访视2应在对象的月经一结束就进行,并且包括妇科检查、激素抑制确定(通过阴道回波描记术确定子宫内膜厚度小于7mm,并且抽血以确定17-β-雌二醇小于60pg/ml)。然后对象开始雌激素治疗(雌二醇75mcg/d贴剂)。
[0256]
访视3包括第二次以及最后一次gnrh-a im注射(ginecrin depot 3.75mg)。
[0257]
访视4包括妇科检查、阴道回波描记术以确定子宫内膜厚度>7mm,以及抽血以确定孕酮水平,其必须小于1ng/ml。
[0258]
访视5是在必须使对象在cu中住院以进行随机化、研究药物治疗和pk抽血的时候。访视6、7涉及进一步的pk采样。
[0259]
访视8包括妇科检查、阴道回波描记术和用于确定激素水平的抽血。
[0260]
访视9、10包括用于确定激素水平的抽血。
[0261]
访视11包括妇科检查、阴道回波描记术和用于确定激素水平的抽血。
[0262]
访视12包括用于确定激素水平的抽血。
[0263]
访视13包括妇科检查、阴道回波描记术和用于确定激素水平的抽血。
[0264]
访视14包括用于确定激素水平的抽血。
[0265]
访视15包括妇科检查、阴道回波描记术、用于确定激素水平的抽血和子宫内膜活检。
[0266]
访视16包括用于确定激素水平的抽血。
[0267]
访视17包括妇科检查、阴道回波描记术和用于确定激素水平的抽血。研究治疗到此结束,移除阴道环并且停止雌激素贴剂。
[0268]
访视18(研究结束)包括一般医学检查、妇科检查、阴道回波描记术、用于确定激素水平的抽血、一般实验室测试(临床化学、血液学、尿分析、血清妊娠测试)。将向对象提供一个周期的经口避孕药(非强制性)。
[0269]
访视19(安全性随访)在研究治疗结束之后4周通过电话进行,专门评估安全性。
[0270]
评价标准:
[0271]
1.药动学:
[0272]
主要pk参数
[0273]
·
从施用到在时间t时最后观察到的孕酮浓度高于定量限(不同于0)的曲线下面积:(auc0-t)。
[0274]
·
从施用到在408小时时最后抽血的曲线下面积(auc0-408小时)。
[0275]
·
从孕酮血清浓度中获得的最大浓度:(cmax)。
[0276]
·
从在408小时时的最后抽血时的孕酮血清浓度中获得的浓度(cmin)。
[0277]
·
平均浓度,计算为auc0-408小时的值/施用间隔(t)(cav)。
[0278]
次要pk参数
[0279]
·
达到最大浓度的时间(tmax)
[0280]
·
曲线下面积外推至无限时间:auc0-∞
[0281]
·
%fi计算为fi=((cmax-cmin)/cav)
×
100)。
[0282]
2.药效学:
[0283]
·
在14天的治疗之后子宫内膜的组织学转化
[0284]
·
响应于激素治疗的超声检查的子宫内膜特征
[0285]
3.耐受性和安全性:
[0286]
·
评价出血事件的发生率、强度、持续时间和演变
[0287]
·
通过局部症状和体征的评价来评价阴道环的耐受性
[0288]
·
评价阴道环的可接受性
[0289]
·
描述不良事件
[0290]
结果与结论
[0291]
1.药动学结果
[0292]
将每种治疗的孕酮血清浓度制成表格,如图4中所示,并且从其中获得或计算出药动学参数。
[0293]
下表中列出了每种制剂的药动学参数(平均值(sd))
[0294][0295]
2.药效学结果
[0296]
子宫内膜的组织学转化
[0297]
注意到研究治疗之间的差异。根据子宫内膜转化量表和noyes分期标准(noyes dating system)二者,关于t3和t4阴道环观察到实质性子宫内膜转化,而关于最小剂量的t5环所述转化是微弱的。在所有情况下,t3是产生中度或晚期子宫内膜转化的唯一制剂。
[0298]
t3和t4与t5之间的差异均具有统计学显著性(分别为p=0.004;p=0.011),然而在将t3与t4进行比较时没有达到显著性。
[0299]
每种制剂的子宫内膜转化量表结果列于下表中:
[0300][0301]
3.耐受性和安全性结果
[0302]
阴道出血
[0303]
在前14天的治疗期间,在接受阴道环的妇女中观察到一些出血事件。关于t3观察到的所有病例均为少量出血(沾上血渍),然而在此期间在接受t4和t5治疗的妇女中均观察到了所有严重出血事件。在t4治疗中的2名志愿者中和在t5治疗中的7名志愿者中,由于严重的阴道出血,过早移除了阴道环。这些患者过早地中断了研究,并且在14天的治疗之后在计划访视之前的一些天进行了活检以评价子宫内膜转化。在这些9名患者中,其中只有一名在t5治疗中的患者到必须进行活检时具有低的血清雌二醇水平,而其中的所有人均表现出低的血清孕酮水平。
[0304]
在研究的最后数天(访视17和18)期间,在所有治疗组中均观察到严重的撤退出血(withdrawal bleeding)。
[0305]
耐受性
[0306]
用阴道环治疗的所有妇女在所有访视中均表现出正常的阴道状况。她们中没有一个人表现出炎症、阴道黏膜糜烂、灼热、性交疼痛或其他局部体征和症状。在一次独特的访视中,只有在t3治疗中的一名志愿者表现出中度疼痛。用t4和t5治疗的妇女中没有一个人在任何访视中提及不适或瘙痒。在接受t3治疗的妇女中观察到一些不适(两名妇女在一次研究访视中表现出轻微不适,以及一名妇女在3次研究访视中表现出中等强度不适)以及一些瘙痒(轻微强度),但是在治疗之间既无临床相关性也无统计学显著性。研究参与者对所述3个阴道环的耐受性良好。
[0307]
可接受性
[0308]
所述3个阴道环为研究参与者完全可以接受。在耐受性、卫生和便利性方面,研究治疗之间未观察到显著性差异。
[0309]
不良事件
[0310]
在研究期间未记录到严重不良事件。报道了用t3的三十三(33)例轻度和三(3)例中度不良事件,其中二十八(28)例
[0311]
结论
[0312]
在所分析的最相关药动学参数中显示t3、t4和t5制剂之间具有统计学显著性差异。
[0313]
线性分析显示出随着剂量增加(0.040至0.375g),药动学参数的增加小于比例。
[0314]
由于从环释放的孕酮的作用,所有阴道环(0.375g、0.125g和0.04g)均产生子宫内膜的妊娠转化。
[0315]
当进行组织学分析时,关于子宫内膜的妊娠转化存在剂量响应作用。在3个受试剂量中,t3(0.375g)产生了最高的妊娠作用。
[0316]
0.375g剂量(t3)产生的孕酮全身暴露与先前的药动学和药效学研究中观察到的程度相同。在那项研究中,还对两个更高的剂量(1.5g和0.75g)进行了分析,并且在这3个剂量中显示主要药动学参数均无差异。
[0317]
考虑到这两项研究的结果,结论是,从药动学视角来看,0.375剂量是产生最大孕酮全身水平的最小研究剂量。另外,在这项研究中,0.375g剂量(t3)的药效学作用与在先前研究中观察到的程度相似,在所述先前研究中,显示3个受试剂量(1.5g、0.75g和0.375g)在其产生子宫内膜妊娠转化的能力方面均无差异。考虑到两项研究的结果,结论是,从药效学视角来看,0.375g(t3)剂量对应于最低有效剂量。
[0318]
在3种受试治疗中出血模式不同。在用t4和t5治疗的第二周期间发生了严重的阴道出血,然而用t3仅观察到轻微沾上血渍。在接受t5的妇女中观察到了较早的严重出血。9名妇女(2名接受t4和7名接受t5)由于严重出血而过早中断了研究。
[0319]
所有治疗均表现出良好的耐受性/安全性特征,并且未显示任何出乎意料的不良事件。大多数不良事件是轻度的,并且证实了组之间无差异。
[0320]
实施例3:在健康绝经前女性志愿者中评价含有1.5g、0.75g和0.375g天然孕酮的3个阴道环的药动学、药效学和耐受性研究。
[0321]
按照实施例2的相同方法进行临床试验。相对于时间的孕酮血清浓度示于图3中。
[0322]
实施例4:孕酮释放特征
[0323]
将根据本发明的阴道环的孕酮随时间的释放与包含其他多晶型形式的孕酮的阴道环的释放进行比较。
[0324]
孕酮多晶型物i(α)的熔点约为129℃。在使用多晶型形式i的孕酮来制备本发明的环并且在固化过程中使用高于其熔点的温度的情况下,已证实孕酮在聚合过程期间熔化并且出现孕酮多晶型物ii(β)。
[0325]
为了验证多晶型物ii的外观可如何影响最终产品,用表i中所述的组成和以下所述的方法,在低于(120℃)和高于(150℃)孕酮熔点的温度下制造了环。然后对环进行表征并且确定了其孕酮体外释放特征。
[0326]
表i.环组成
[0327] %(w/w)孕酮8.5lsr ddr-4320.a部分45.8lsr ddr-4320.b部分45.8
[0328]
对于制造,将一半的孕酮与lsr的每个部分混合,并随后将这两种组分混合并注入到模具中,在模具中使用不同的温度进行固化以获得以下环:第一个环在120℃(本发明)下
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1