用于改善的血糖控制系统和方法的同时多部位迷走神经的神经调节与流程
用于改善的血糖控制系统和方法的同时多部位迷走神经的神经调节
[0001]
相关申请的交叉引用
[0002]
本申请作为pct国际专利申请于2019年4月12日提交,并要求2018年4月12日提交的美国专利申请62/656,787的权益,其全部公开内容合并于此。
背景技术:
[0003]
在美国,估计有2900万人患有糖尿病,这是一种严重的终身病症。糖尿病的主要形式是1型和2型。1型糖尿病是一种自身免疫性疾病,会导致胰脏β细胞的破坏,胰脏因此产生很少或不产生胰岛素。患有1型糖尿病的人必须每天服用胰岛素才能生存。糖尿病最常见的形式是2型糖尿病。在美国,40至59岁的人中有大约10%和60岁以上的人中有20%患有2型糖尿病。该疾病是第六大死亡原因,并导致发展出心脏病、中风、高血压、肾脏疾病和神经损伤。尽管有几种针对糖尿病的治疗方法,但约15-32%的患者无法通过单一疗法维持血糖控制。(kahn等人,nejm 355:23(2006))2型糖尿病仍然是严重的健康问题,并且给健康保健系统带来至少1740亿美元的花费(dall等,diabetes care 31:1-20(2008))。
[0004]
2型糖尿病与老龄、肥胖、糖尿病家族史、先前妊娠糖尿病史、体能活动不足和种族相关。当诊断出2型糖尿病时,胰腺通常会产生足够的胰岛素,但由于未知原因,人体无法有效使用所述胰岛素,这种情况被称为胰岛素抵抗。几年后,胰岛素产出减少,必须如1型糖尿病那样口服或通过注射胰岛素来维持葡萄糖稳态。
[0005]
在2型糖尿病的早期阶段,治疗包括饮食,运动和减肥,之后再使用各种药物,这些药物可以增加胰腺的产出或降低胰岛素需求,最后直接给药胰岛素。用于治疗糖尿病的药品包括五类药物:磺酰脲类、氯茴苯酸类、双胍类、噻唑烷二酮和α-葡萄糖苷酶抑制剂。这五类药物以不同的方式工作以降低血糖水平。一些药物增加胰腺的胰岛素输出,一些药物通过影响肝功能降低葡萄糖产出。但即使采用这种治疗,一些患者也无法实现血糖控制。
[0006]
过去10年中出现了涉及胃部手术的2型糖尿病新疗法,并且在某些患者中越来越流行。这些疗法包括各种类型的胃旁路术和胃限制性技术。出乎意料的是,已证明,在实施这些手术的2~3天内,2型糖尿病消退(适用于75-85%的患者),并且与体重减轻无关。大多数患者已是病态肥胖(身体质量指数,bmi>40),但新发展出的技术使得所述手术可应用于bmi>35的患者,甚至是超重或轻度肥胖的患者。然而,这些外科手术选项成本高昂,并且在手术前后对患者都有风险。
[0007]
已经对通过上调神经活动来治疗糖尿病的方法有所描述。这些治疗糖尿病的方法中的一些涉及直接刺激胰腺细胞,或刺激直接神经支配胰腺的副交感/交感组织。例如,wernicke的美国专利5,231,988公开了将低频电信号施加到迷走神经以增加内源性胰岛素的分泌。whitehurst的美国专利us6,832,114描述了将低频信号递送到支配胰腺的至少一种副交感神经组织以刺激胰腺β细胞,从而增加胰岛素分泌。whitehurst的美国专利us 7,167,751描述了通过刺激迷走神经来减轻内分泌疾病的方法。
[0008]
其他研究表明迷走神经在调节胰岛素和血糖方面的作用尚不清楚。最近的一项研
究表明,在用地塞米松处理的小鼠中,破坏传入性肝迷走神经可以抑制胰岛素抵抗的发展。(bernal-mizrachi等人,cell metabolism,2007,5:91)。一些研究表明迷走神经切断术诱导胰岛素抵抗,而在其他研究中,电刺激则诱导胰岛素抵抗。(matsuhisa等人,metabolism 49:11-16(2000);peitl等人,metabolism 54:579(2005))。在另一个小鼠模型中,由于过氧化物酶体增殖物激活的受体表达,肝迷走神经切断术抑制了胰岛素敏感性的增加(uno等人,2006,science 312:1656)。
[0009]
尽管可获得许多疗法,但是2型糖尿病仍然是主要的健康问题。许多疗法具有不良的副作用,不能实现充分的血糖控制,或者不能维持足够的血糖控制导致因高血糖症和低血糖症(低血糖通常低于70mg/dl)引起的并发症。意图治疗高血糖症的药物和/或胰岛素的使用可能具有的不良作用是将血糖降低至引起病理状况的水平。血糖暂时下降会导致但不限于意识丧失、中风、昏迷、情绪变化或死亡。重复的低血糖发作与心血管疾病有关。治疗通常涉及食用单糖含量高的食物。但是,这种治疗方法并不理想。例如,低血糖症的发作很快,大约几分钟,并且认知能力的丧失可能使受试者无法获得和食用含单糖的食物。因此,仍然需要开发用于调节葡萄糖和/或治疗糖尿病的系统和方法。
技术实现要素:
[0010]
本发明描述了用于治疗受试者葡萄糖调节受损的方法和系统。一种系统,包括具有导线和至少一个电极的可编程脉冲发生器(神经调节器),所述电极放置在目标神经或器官上或紧邻目标神经或器官。在一些实施例中,该系统包括至少两个导线,并且通过导线上的每个电极递送所述治疗。
[0011]
本发明涉及用于治疗与血浆葡萄糖调节受损(例如2型糖尿病)、葡萄糖耐量受损和/或空腹血糖受损有关的病症的方法和系统。葡萄糖耐量受损和/或空腹血糖受损的患者也被称为患有前驱糖尿病。在一个实施方案中,治疗受试者中与血浆葡萄糖调节受损有关的病症的方法包括:将间歇性(或连续性)神经信号施加于位点处的目标神经,其中所述神经传导信号经选择用于下调或上调所述神经上的传入和/或传出神经活动,并在所述信号中断后恢复神经活动。在一些实施方案中,选择患有2型糖尿病的患者。在其他实施方案中,受试者是具有葡萄糖耐量受损和/或空腹血糖受损的患者。
[0012]
在实施方案中,提供一种用于治疗受试者与葡萄糖调节受损有关的病症的方法,该方法包括:将间歇性(或连续)电信号施加至具有血浆葡萄糖调节受损的受试者的目标神经,所述电信号经选择用于下调所述神经上的神经活动,并在所述信号中断后恢复神经上的神经活动。在实施例中,针对频率以及接通和断开时间来选择电信号治疗。在一些实施例中,该方法进一步包括在一天内间歇(或连续地)多次向第二目标神经或器官施加电信号治疗并且持续数天,其中该电信号具有经选择用于上调和/或下调目标神经上的活动的频率,并且具有接通时间和断开时间,其中,断开时间经选择用于使目标神经的活动至少部分恢复。在一些实施方案中,该方法进一步包括将包含有效量的改善血糖控制的试剂的组合物给予受试者。
[0013]
在其他实施例中,本申请的方法涉及改变血浆胰岛素、血糖或两者的量。在实施方案中,改变血浆胰岛素、血糖或两者的量的方法包括:将第一间歇(或连续)电信号施加至目标神经,所述第一电信号经选择下调所述神经上的神经活动,并在所述信号中断时恢复神
经上的神经活动,其中所选择的电信号用来改变血浆胰岛素、血糖或两者的量。在一些实施例中,该方法进一步包括将第二电信号治疗间歇地(或连续地)施加于第二目标神经或器官,其中第二电信号具有的频率经选择用于上调目标神经或器官上的神经活动并将第二目标神经的活动或将第二目标器官的活动恢复到基线水平。在本发明的另一方面,提供了一种用于治疗具有葡萄糖调节受损的患者的系统。在一些实施例中,该系统包括:至少两个可操作地连接至可植入脉冲发生器的电极,其中电极之一适于放置在目标神经上;以及可植入脉冲发生器,其包括电源模块和可编程的治疗递送模块,其中,可编程的治疗递送模块被配置为递送至少一个治疗程序,该程序包括在一天内间歇(连续)多次并且持续数天将电信号治疗应用到目标神经,其中电信号具有经选择用于下调目标神经上的活动的频率,并具有接通时间和断开时间,其中断开时间经选择用于使目标神经的活动至少部分恢复;该系统进一步包括:包括通信系统和可编程存储和通信模块的外部组件,其中,可编程存储和通信模块被配置为存储至少一个治疗程序并将该至少一个治疗程序传送到可植入脉冲发生器。在一些实施例中,可编程治疗递送模块被配置成递送第二治疗程序,该第二治疗程序包括在一天内间歇地多次将电信号治疗施加到第二目标神经或器官并且持续数天,其中该电信号具有经选择用于上调或下调目标神经上的活动的频率,并具有接通时间和断开时间,其中断开时间经选择用于使目标神经或器官的活动至少部分恢复。在其他相关实施例中,通信模块被配置为存储至少一个治疗程序并且使用选自天线、蓝牙技术、射频、wifi、光、声音及其组合(例如蓝牙技术、射频、wifi、光或声音)的通信系统将至少一个治疗程序传送到可植入脉冲发生器。
附图说明
[0014]
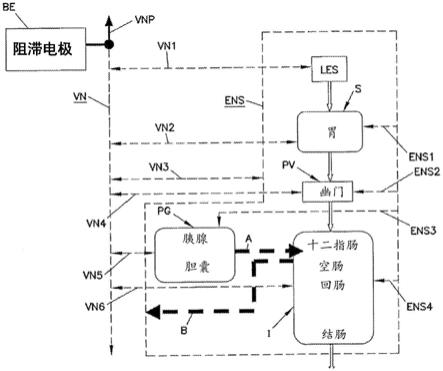
图1是消化道(胃肠道加上非胃肠器官,例如胰腺和肝脏)及其与迷走神经和肠神经支配(enervation)的示意图。
[0015]
图2是图1的视图,展示出了将阻滞电极施加到消化道上。
[0016]
图3是示例性脉冲发生器和导线的示意图,其包括放置在前迷走神经和后迷走神经上的电极。
[0017]
图4是孤立性迷走神经传导阻滞实验的设计示意图。
[0018]
图5是阻滞程度取决于hfac幅度的图示说明。
[0019]
图6描绘的装置显示将信号施加到不同的迷走神经分支。将阻滞信号或hfac信号施加到前迷走神经或腹迷走神经的肝分支,并将刺激信号施加到后迷走神经或背迷走神经的腹腔分支。
[0020]
图7示出了包括可植入部件的另一示例性实施方案的示意图。
[0021]
图8显示了在施加阻滞信号后迷走神经的恢复。
[0022]
图9显示了对于c波在阻滞电极部位发生的hfac诱导的迷走神经传导阻滞示例图。
[0023]
图10显示了肝迷走神经切断术与腹腔刺激相结合改善了ivgtt方面的性能。图10a是ivgtt后pg变化的图示。图10b是注射葡萄糖后曲线下面积分析的图形表示。
[0024]
图11示出了同时刺激腹腔分支和肝分支阻滞可逆性地改善了人的ivgtt;图11a是ivgtt后pg变化的图示;图11b是两次注射葡萄糖后曲线下面积分析的图形表示。
[0025]
图12显示了在非糖尿病大鼠对照中,同时刺激腹腔分支和hfac阻滞肝分支改善了
ivgtt方面的性能;图12a表示假手术后pg的变化;图12b是注射葡萄糖后曲线下面积分析的图形表示。
[0026]
图13示出了示例性腹腔神经刺激的刺激参数。
[0027]
图14示出了系统的示意图,其中可植入葡萄糖传感器与脉冲发生器通信以启动迷走神经刺激。
[0028]
图15示出了系统的示意图,其中可植入葡萄糖传感器首先与附接到皮肤外部的外部装置通信,该外部设备然后与脉冲发生器通信以启动迷走神经刺激。
[0029]
具体实施例方式
[0030]
以下共同转让的专利和美国专利申请通过引用并入本文:2013年7月9日授权给tweden等人的美国专利8,483,830;和2007年1月23日授予给knudson等人的美国专利7,167,750;2005年6月16日公开的美国专利2005/0131485 a1,2005年2月17日公开的美国专利2005/0038484 a1,2004年9月2日公开的美国专利2004/0172088 a1,2004年9月2日公开的美国专利2004/0172085 a1,2004年9月9日公开的美国专利2004/0176812 a1和2004年9月2日公开的美国专利2004/0172086 a1。2006年3月2日公开的国际专利申请公开号为wo 2006/023498 a1的专利也通过引用并入本文。
[0031]
与葡萄糖调节受损有关的病症
[0032]
人体将食物中的碳水化合物转化为葡萄糖,葡萄糖是一种简单的糖,是重要的能量来源。激素胰岛素和胰高血糖素在葡萄糖调节中起重要作用。胰腺中含有一组称为胰岛(islet of langerhans)的细胞,它们同时释放胰岛素和胰高血糖素。当人体无法转化足够的葡萄糖时,血糖持续维持高水平。胰腺分泌胰岛素,以帮助细胞吸收葡萄糖、降低血糖并为细胞提供葡萄糖以获取能量。当血糖下降时,胰腺中的细胞就会分泌胰高血糖素。胰高血糖素指示肝脏将储存的葡萄糖(即糖原)转化为葡萄糖,从而使葡萄糖在血液中更易获得。胰岛素和胰高血糖素循环工作。胰高血糖素与肝脏相互作用以增加血糖,而胰岛素则通过帮助细胞利用葡萄糖来降低血糖。
[0033]
与葡萄糖调节受损有关的疾病包括2型糖尿病、葡萄糖耐量受损、空腹血糖受损、妊娠糖尿病和1型糖尿病。“葡萄糖调节受损”是指葡萄糖吸收、葡萄糖产生、胰岛素分泌、胰岛素敏感性、glp-1调节和胰高血糖素调节中的一种或多种发生改变。
[0034]
2型糖尿病是一种肝脏、肌肉和脂肪细胞未正确使用胰岛素以将葡萄糖输入细胞并为细胞提供能量的疾病。当细胞开始缺乏能量时,向胰腺发出信号以增加胰岛素的产生。在某些情况下,胰腺最终产生减少的胰岛素,加剧了高血糖症状。2型糖尿病患者的空腹血(血浆)糖为126mg/dl或更高;口服葡萄糖耐量为200mg/dl或更高;和/或hba1c的百分比为6.5%或更高。在某些情况下,hba1c百分比为6-7%,7-8%,8-9%,9-10%和大于10%。
[0035]
尽管存在2型糖尿病的治疗方法,但并非所有患者都能实现血糖控制或维持血糖控制。未实现血糖控制的患者通常hba1c大于7%。在一些实施方案中,选择的患者即使在药物治疗下仍存在血糖控制问题。
[0036]
葡萄糖耐量受损和/或空腹血糖受损的患者中,有证据表明,他们具有最低水平的葡萄糖控制或缺乏葡萄糖控制。患者可以是没有接受过药物治疗的患者,也可以是已经接受过一种或多种药物治疗的患者。“前驱糖尿病”是美国糖尿病协会使用的一个术语,指的是血糖水平高于正常水平但又不足以满足糖尿病标准的人群。可以通过空腹血浆葡萄糖测
试(fpg)和/或口服葡萄糖耐量测试(ogtt)来确定是否缺乏血糖控制。这些测试后测得的血糖水平可确定患者是否具有正常的葡萄糖代谢,是否具有受损的葡萄糖耐量,是否具有受损的空腹血糖或是否具有糖尿病。如果在fpg之后的患者的血糖水平在指定范围内为异常的,则称为空腹血糖受损(ifg);如果在ogtt之后的患者的葡萄糖水平在指定范围内为异常的,则称为葡萄糖耐量受损(igt)。可通过fpg大于等于100至小于126mg/dl确定患者是否为空腹血糖受损和/或通过ogtt大于或等于140至小于200mg/dl确定患者是否为血糖耐受性受损。患有“前驱糖尿病”的人具有在这些范围内的ifg和/或igt。
[0037]
在一些实施方案中,患者是超重但不肥胖(bmi小于30)并患有2型糖尿病,超重但不肥胖且患有前驱糖尿病或患有2型糖尿病但不超重或肥胖。在一些实施方案中,所选择的患者是具有一种或多种2型糖尿病危险因素的患者。这些危险因素包括30岁以上、家族病史、超重、心血管疾病、高血压、甘油三酸酯升高、妊娠糖尿病史、ifg和/或igt。
[0038]
本发明公开了包括治疗受试者中葡萄糖调节受损的系统和方法。在实施方案中,一种用于治疗与受试者的葡萄糖调节受损有关的病症的方法包括向受试者的目标神经施加间歇性(或连续性)电信号,该电信号经选择用于下调所述神经上的神经活动和在阻滞中断后恢复神经上的神经活动。在一些实施方案中,目标神经是迷走神经。在一些实施例中,目标神经上的部位所在位置应避免影响心率,例如位于心脏的迷走神经支配下方。在一些实施例中,依据频率、幅度、脉冲宽度和时间设置(timing)选择电信号。
[0039]
电信号还可以进一步用来改善葡萄糖调节。可以通过hba1c、空腹血糖或葡萄糖耐量测试(ivgtt)中任何一种的百分比(%)变化来确定血糖调节的改善。在一些实施方案中,该方法进一步包括将施加电信号治疗与给予影响葡萄糖调节的试剂相结合。在一些实施例中,施加电信号治疗不包括对其他神经或器官施加电信号治疗。
[0040]
在本发明的一些方面,公开了一种方法和系统,包括通过施加如本文所述的神经传导阻滞或通过施加神经刺激或两者的组合来调节胰高血糖素或胰岛素的量和/或分泌,,以促进葡萄糖调节。
[0041]
在一些实施例中,公开了一种方法和系统,包括向受试者的目标神经或器官施加间歇的(或连续的)电信号,其中所述电信号经选择用于下调所述神经上的神经活动并在所述信号中断后恢复神经上的神经活动;和向受试者的第二目标神经或器官施加第二间歇的(或连续的)电信号,其中所述电信号经选择用于上调或下调神经上的神经活动,并在所述电信号中断后恢复神经上的神经活动。
[0042]
在实施方案中,第一目标神经选自下腹部迷走神经、迷走神经的肝分支、迷走神经的腹腔分支和背迷走神经。在至少这些实施例中,第二目标神经可包括迷走神经的腹腔分支、十二指肠神经、空肠神经、小肠神经、结肠神经和回肠神经,以及支配胃肠道的交感神经。在一些实施方案中,第一目标器官可以包括胃,食道和肝脏。在一些实施方案中,第二目标器官可包括脾、胰腺、十二指肠、小肠、空肠、结肠或回肠。
[0043]
在一些实施例中,下调节信号可施加至诸如腹迷走神经的目标神经,上调节信号可施加至诸如迷走神经的内脏或腹腔分支的第二目标神经。在一些实施方案中,可以将上调信号施加至位于诸如胰腺、脾、十二指肠、小肠、空肠、结肠或回肠的器官上的电极,并将下调信号施加至迷走神经的肝分支。在其他实施方案中,仅刺激迷走神经腹腔分支或在腹腔分支点以上的背迷走神经干,在5分钟或更短时间内引起血糖的显著增加。然而,由于高
血糖症的并发症,连续刺激不是理想的。更需要的是一种监测血糖水平,然后在血糖下降至不安全水平时启动或调节迷走神经刺激的系统。在一些实施例中,检测到血糖的增加施加上调信号。血糖的检测例如可通过使用与神经调节系统通信的葡萄糖监测器来实现。
[0044]
a.消化道迷走神经支配的描述
[0045]
图1是消化道(胃肠道加上非胃肠道器官,例如胰腺和胆囊(胰腺,肝和胆囊被认为是胃肠道器官),统称为pg)及其与迷走神经和肠神经支配关系的示意图。食道下括约肌(les)充当将食物传送到胃s的门户,并假设所有组成部分均具有适当的功能,可防止反流。幽门pv控制食糜从胃s进入小肠i(在图中笼统显示,包括大肠或结肠以及小肠(包括十二指肠、空肠和回肠))。肠i内容物的生物化学受向十二指肠排放的胰腺p和胆囊pg的影响。排放用虚线箭头a表示。
[0046]
迷走神经vn直接将信号传输到胃s、幽门pv、胰腺和胆囊pg。起源于大脑,在膈(diaphragm)区(未显示)有一条共同的迷走神经vn。在所述膈区,迷走神经vn分为腹侧部分和背侧部分,两者均起神经支配胃肠道的作用。在图1和图2中,未分别显示腹侧和背侧迷走神经。取而代之的是,迷走神经vn示意性地既包括腹侧也包括背侧神经。迷走神经vn包含传入和传出部分,分别向其支配的器官发送信号或从其支配的器官发出信号。
[0047]
迷走神经还包括肝分支和腹腔神经,在图6中作了最好的展示。肝分支参与提供有关肝脏中葡萄糖生成的信号。腹腔神经或分支由较大的内脏和迷走神经(特别是背侧迷走神经或右迷走神经)贡献的部分形成。
[0048]
再次参考图1至图2,除了迷走神经vn的影响外,胃肠道神经系统ens也极大地影响了胃肠道(gi)和消化道。肠神经系统ens是遍布胃肠道和胰腺和胆囊pg的神经、受体和促动器(actuator)的互连网络。胃肠器官的组织中有数百万个肠神经系统ens的神经末梢。为了便于说明,肠神经系统ens被显示为一条线,其包围被肠神经系统ens神经支配的器官。迷走神经vn至少部分地神经支配肠神经系统ens(示意性地表示为迷走神经干vn3,其代表整个肠道中的许多迷走神经-ens神经支配)。此外,肠道i中的受体也连接到肠神经系统ens。图中的箭头b说明了十二指肠内容物对肠神经系统ens的影响,其为对胰腺、肝脏和胆囊分泌功能的反馈。具体而言,肠i中的受体对肠内容物的生物化学有反应(由箭头a所示的胰-胆管输出进行化学调节)。这种生物化学包括ph值和克分子渗透压浓度。
[0049]
在图1和2中,迷走神经干vn1,vn2,vn4和vn6示意性地示出了les、胃s、幽门pv和肠i这些gi器官的迷走神经的直接神经支配。主干vn3示出了迷走神经vn和ens之间的直接通信。vn5主干显示了胰腺和胆囊的迷走神经的直接支配。肠神经ens1-ens4代表胃s,幽门pv,胰腺,胆囊pg和肠i中的多种肠神经。
[0050]
当与迷走神经vn通讯时,肠神经系统ens是可以独立于迷走神经和中枢神经系统发挥作用。例如,在迷走神经断裂(迷走神经切断术-一种以前用于治疗溃疡的手术)的患者中,肠神经系统可以操作肠道。大多数肠神经细胞不受迷走神经的直接神经支配。
[0051]
b.治疗递送设备
[0052]
本发明提供了用于治疗与葡萄糖调节受损有关的病症的系统和装置,其包括脉冲发生器,该脉冲发生器提供信号以调节目标神经或器官上的神经活动。
[0053]
在实施方案中,系统包括至少两个可操作地连接到可植入脉冲发生器的电极,其中电极中的一个适于放置在目标神经上;可植入脉冲发生器,其包括电源模块和可编程的
治疗递送模块,其中,所述可编程治疗递送模被配置为递送至少一个包括电信号治疗的治疗程序,所述电信号治疗在一天内多次间歇地施加到所述目标神经并且持续数天,其中电信号具有经选择下调和/或上调目标神经上的活动的频率,并且具有接通时间和断开时间,其中断开时间为经选择允许至少部分恢复目标神经的活动;外部组件,包括天线和可编程存储和通信模块,其中可编程存储和通信模块被配置为存储至少一个治疗程序并将所述至少一个治疗程序传送给可植入脉冲发生器。
[0054]
在一个实施方案中,用于治疗诸如糖尿病或“前驱糖尿病”的病症的系统(在图3中示意性地示出)包括脉冲发生器104,外部移动充电器101以及两个电导线组件106、106a。脉冲发生器104适于植入要治疗的患者体内。在一些实施例中,被植入的脉冲发生器104刚好在皮肤层103的下方。在相关实施方案中,系统包括一个或多个脉冲发生器104。
[0055]
在一些实施例中,导线组件106、106a通过导体114、114a电连接到脉冲发生器104的电路。提供行业标准的连接器122、122a,以将导线组件106、106a连接到导体114、114a。结果,导线116、116a和脉冲发生器104可以被分别植入。同样,在植入之后,导线116、116a可以留在原处,而最初放置的脉冲发生器104被不同的脉冲发生器代替。
[0056]
导线组件106、106a基于神经调节器104提供的治疗信号来上调和/或下调患者的神经。在一实施例中,导线组件106、106a包括远侧电极212、212a,其被放置在患者的一个或多个神经或器官上。例如,电极212、212a可以各自分别放置在患者的腹腔神经、迷走神经、迷走神经的肝分支或它们的某种组合上。例如,导线106、106a具有远侧电极212、212a,其各自分别放置在患者腹侧和背侧迷走神经vvn,dvn上,例如刚好在患者膈的下方。作为另一个例子,图6示出了放置在肝分支和腹腔神经上的导线。更少或更多的电极可以放置在更少或更多的神经上或附近。在一些实施例中,电极是卡夫电极(cuff electrode)。
[0057]
外部移动充电器101包括用于与植入的神经调节器(脉冲发生器)104通信的电路。在一些实施例中,通信是穿过皮肤103的双向射频(rf)信号路径,如箭头a所示。在外部充电器101和神经调节器104之间传输的示例性通信信号包括治疗指令、患者数据和其他信号,如本文所述。能量或功率也可以从外部充电器101传输到神经调节器104,如本文中所述。
[0058]
在所示的示例中,外部充电器101可以经由双向遥测(例如,经由射频(rf)信号)与植入的神经调节器104通信。图3所示的外部充电器101包括线圈102,其可以发送和接收rf信号。可以将类似的线圈105植入患者体内并耦合至神经调节器104。在一个实施方案中,线圈105与神经调节器104成一体。线圈105用于接收并传输来自外部充电器101的线圈102的信号以及将信号传输至外部充电器101的线圈102。
[0059]
例如,外部充电器101可以通过幅度调制或频率调制rf载波将信息编码为位流。在线圈102、105之间传输的信号优选地具有大约6.78mhz的载波频率。例如,在信息通信阶段,可以通过在半波整流和不整流之间切换整流水平来发送参数的值。然而,在其他实施例中,可以使用更高或更低的载波频率。
[0060]
在一个实施方案中,神经调节器104使用负载转移(例如,改变外部充电器101上诱导的负载)与外部充电器101通信。负载的这种变化可以由诱导耦合的外部充电器101感测到。但是,在其他实施例中,神经调节器104和外部充电器101可以使用其他类型的信号进行通信。
[0061]
在一个实施方案中,神经调节器104从诸如电池的可植入电源151接收电力以产生
治疗信号。在一优选实施例中,电源151是可再充电电池。在一些实施例中,当未连接外部充电器101时,电源151可以向植入的神经调节器104提供电力。在其他实施例中,外部充电器101还可以被配置为提供对神经调节器104的内部电源151的定期充电。然而,在替代实施方案中,神经调节器104可以完全取决于从外部来源接收的电力。例如,外部充电器101可以经由rf链路(例如,在线圈102、105之间)将电力传输到神经调节器104。
[0062]
在一些实施例中,神经调节器104启动治疗信号的生成,并将其传输至导线组件106、106a。在一个实施例中,当由内部电池151供电时,神经调节器104开始治疗。然而,在其他实施例中,外部充电器101触发神经调节器104开始产生治疗信号。在从外部充电器101接收到启动信号之后,神经调节器104产生治疗信号(例如,起搏信号),并将治疗信号传输至导线组件106、106a。
[0063]
在其他实施例中,外部充电器101还可以提供指令,根据该指令生成治疗信号(例如,脉冲宽度、幅度和其他这样的参数)。在一些实施例中,外部组件包括通信系统以及可编程存储和通信模块。可以将一个或多个治疗程序的指令存储在可编程存储和通讯模块中。在优选实施例中,外部充电器101包括存储器,其中可以存储几个预定的程序/治疗计划以传输到神经调节器104。外部充电器101还可以使用户选择存储在存储器中的程序/治疗计划以传输到神经调节器104。在另一个实施例中,外部充电器101可以提供具有每个起始信号的治疗指令。
[0064]
通常,医师可以调整存储在外部充电器101上的每个程序/治疗计划,以适合患者的个人需求。例如,计算设备(例如,笔记本计算机,个人计算机等)100可通信地连接到外部充电器101。通过建立这种连接,医生可以使用计算设备107将疗法编程到外部充电器101中,进而用于存储或传输到神经调节器104。
[0065]
神经调节器104还可以包括存储器,可以在其中存储治疗指令和/或患者数据。在一些实施例中,神经调节器包括电源模块和可编程治疗递送模块。例如,神经调节器104可以将一个或多个治疗程序存储在可编程治疗递送模块中,指示应该将哪种治疗递送给患者。神经调节器104还可以存储患者数据,该数据指示患者如何利用治疗系统和/或如何对所递送的治疗作出应答。
[0066]
在一些实施例中,外部组件和/或神经调节器用一个或多个治疗程序来编程。一种治疗程序可以包括在一天中内多次间歇地应用电信号治疗并且持续数天,其中电信号具有经选择下调目标神经上的活动的频率,并且具有接通时间和断开时间,其中断开时间经选择允许至少部分恢复目标神经的活动。另一个治疗程序可以包括在数天内连续施加的电信号治疗,其中电信号具有经选择下调或上调目标神经上的活动的频率。第二治疗程序可以包括在一天内多次间歇地应用的电信号治疗并且持续数天,其中电信号具有经选择上调或下调第二目标神经或器官上的活动的频率,并具有接通时间和断开时间,其中断开时间经选择允许至少部分恢复目标神经的活动。可以同时、在不同时间或在重叠时间应用第一和/或第二治疗程序。可以在一天的特定时间,或者响应于来自传感器的信号来递送第一和/或第二治疗程序。在一些实施例中,传感器被设计为测量患者的血糖水平。在一些实施例中,断开时间被配置为在检测到80mg/dl至110mg/dl之间的血糖水平时开始。在一些实施例中,接通时间被配置为在检测到高于110mg/ml、高于150mg/dl、高于200mg/dl或高于400mg/dl的血糖水平时开始。
[0067]
参考图3所示,外部移动充电器101的电路170可以连接到外部线圈102。线圈102与植入患者体内并连接到脉冲发生器104的电路150的相似线圈105通信。外部移动充电器101与脉冲发生器104之间的通信包括起搏参数和其他信号的传输,如下所述。
[0068]
脉冲发生器104已经被来自外部移动充电器101的信号编程,产生上调信号和/或下调信号,传输到导线106、106a。如下所述,外部移动充电器101可以具有附加功能,因为它可以为脉冲发生器104内的电池提供周期性的充电,并且还允许记录保持和监控。
[0069]
尽管用于脉冲发生器104的优选为可植入(可充电)电源,但是其它设计可以利用外部电源,电力经由rf链路(即,在线圈102、105之间)传输到植入模块。在此替代配置中,在外部供电时,特定阻滞信号的来源可能源自外部电源单元或植入的模块。
[0070]
如果需要,电子供能包可以主要在身体外部。rf功率设备可以提供必要的能量水平。植入的组件可能仅限于导线/电极组件,线圈和dc整流器。通过这种布置,利用rf载波将用期望参数编程的脉冲传输穿过皮肤,并且此后信号被整流以再生脉冲信号,以作为对迷走神经的刺激加以应用,从而调节迷走神经的活动。这实际上消除了更换电池的需要。
[0071]
但是,外部发射器必须携带在患者身上,这很不方便。而且,使用简单的整流系统检测起来更加困难,并且与完全植入系统相比,激活所需的功率更大。无论如何,由于大多数治疗应用的功率需求相对较小,因此,完全植入的系统有望表现出较长的使用寿命,可能长达数年。同样,如本文前面所指出的,尽管不那么需要,也可以采用外部脉冲发生器,其导线经皮延伸到植入的神经电极组。后一种技术遇到的主要问题是潜在的感染。它的优点是患者可以接受相对简单的手术以进行短期测试,从而确定与该特定患者超重相关的疾病是否适合成功治疗。如果是这样,则可以提供更永久的植入物。
[0072]
根据本发明的实施方案,公开了一种用于将电信号施加到患者的内部解剖特征的设备。该设备包括至少一个用于植入患者体内并放置在解剖特征(例如神经)上的电极,用于在将信号施加至电极后将所述信号施加至所述特征。将可植入组件放置在皮肤层下方的患者体内,并且具有与电极连接的植入电路。植入电路包括植入的通信系统。外部部件具有外部电路,该外部电路具有用于放置在皮肤上方的外部通信系统,外部通信系统适于通过射频传输穿过皮肤与植入的通信系统电耦合。外部电路具有多个用户界面,包括用于向用户提供信息的信息界面和用于从用户接收输入的输入界面。
[0073]
如图4所示,使用分离的迷走神经制品测试高频脉冲发生器阻断轴突传导的能力。如图所示,s
d
描绘了远端刺激电极,hfac是递送5000hz的电极,s
p
代表了近端刺激(对照)电极,r代表记录电极。现在参考图5,其中从上到下的迹线是在5000hz下以0、3、5、8和10ma的电流幅度施加60秒后立即引起的复合动作电位(cap)。较快的δδ波的峰值cv为9.4m s-1
。较慢的c波的峰值cv为0.85m s-1
。如图所示,δδ波在比c波(10ma)更低的hfac电流幅度(8ma)下被完全阻断。如图5所示,比例尺为5毫秒200μv。
[0074]
如图6所示,刺激迷走神经的腹腔分支可增加血浆胰岛素和胰高血糖素。肝分支的结扎可降低肝脏对胰高血糖素的敏感性以及降低胰岛素抵抗。刺激神经支配胰腺的迷走神经纤维会导致血浆胰岛素增加,但是血糖水平不变或升高。阻滞神经元纤维对肝脏的神经支配也可能影响血糖,但使神经支配胰腺的迷走神经传出去抑制降低了肝对胰高血糖素的敏感性和/或通过削弱pparα降低胰岛素抵抗。然而,针对在2型糖尿病动物模型中,神经支配胰腺的腹腔纤维(胰岛素分泌增加)和神经支配肝脏的神经元肝纤维阻断的联合刺激
(simulation)对血糖的影响知之甚少。
[0075]
参考图6,示出了用于将信号施加到不同的迷走神经分支的装置。为了便于理解施加迷走神经调制信号的目的,示意性地示出了胃。在如图6所示,食道在开口或裂孔处穿过膈。在食道穿过膈的区域,迷走神经的主干(图示为腹(前)迷走神经(avn)和背(后)迷走神经(pvn))位于食道的相对侧。应当理解,在患者群体中,腹侧(前)和背侧(后)迷走神经avn,pvn相对于彼此以及相对于食道的精确位置经受很大程度的变化。但是,对于大多数患者,腹迷走神经和背迷走神经avn,pvn在食管穿过膈的裂孔处紧邻食管。
[0076]
腹侧和背侧迷走神经avn,pvn分为多个主干,这些主干神经支配着器官,例如胰腺,胆囊,肝脏,胃和肠。通常,在食道和胃的交界处,腹迷走神经和背迷走神经avn,pvn仍紧邻食道和胃(尚未广泛分支出去)。
[0077]
图7显示了可用于治疗与本文所述的葡萄糖调节受损有关的病症的装置的另一实施方案。参照图7,设备包括可植入组件,该可植入组件包括电子组件510(“混合电路”)和接收线圈516;用于连接到电极导线的标准连接器512(例如is-1连接器)。两条导线连接到is-1连接器,用于连接到植入的电路。两者都有一个尖端电极,用于放置在神经上。固定螺钉在514中显示,可以调节电极的安置位置。在一些实施例中,提供了指示背侧或腹侧导线的标记器513。提供缝合片511以提供在合适部位的植入。在一些实施例中,提供应力消除(strain relief)515。患者接收包括连接到控制电路的通信系统的外部控制器。可以针对各种信号参数对外部控制单元进行编程,包括频率选择、脉冲幅度和工作循环(duty cycle)选项。
[0078]
在一个实施例中,通过使电信号通过神经周围的组织来间接刺激神经avn,pvn。在一些实施方案中,电极是双极对(即,交替的阳极和阴极电极)。在一些实施例中,可以将多个电极放置在腹侧和/或背侧迷走神经avn,pvn的上方。结果,对多个电极供能将导致向腹侧和背迷走神经avn,pvn和/或其分支施加信号。在一些治疗应用中,一些电极可以连接到阻滞电信号源(具有阻滞频率和如下所述的其他参数),而其他电极可以施加上调信号。当然,只能使用单个电极阵列,其中所有电极都连接到阻滞或下调信号。在一些治疗应用中,一些电极可以连接到上调电信号源(具有合适的频率和如下所述的其他参数)。
[0079]
在其他实施例中,多个电极被放置在avn,pvn神经的肝分支和腹腔分支上。在一些治疗应用中,一些电极可以连接到阻滞电信号源(具有阻滞频率和以下描述的其他参数),而其他电极可以施加上调信号。在一些治疗应用中,将连接至阻断电信号的电极置于迷走神经的肝分支上。在其他治疗应用中,将与上调信号相连的电极放在腹腔分支上。在其他治疗应用中,将与阻滞信号连接的第一电极放置在肝分支上,以及将与上调信号连接的第二电极放置在腹腔分支上。如图6中所示,在某些治疗应用中,对腹腔分支的刺激已显示出可增加血浆胰岛素和胰高血糖素,而对肝分支的下调已表明可降低肝脏对胰高血糖素的敏感性以及降低胰岛素抵抗。
[0080]
电极与脉冲发生器的电连接可以如前所述,通过导线(例如106,106a)将电极直接连接至可植入脉冲发生器(例如104)。替代地并且如前所述,电极可以连接到植入的通信系统,以接收信号,从而向电极供能。
[0081]
两个成对的电极可以连接到脉冲发生器用于双极性信号。在其他实施例中,将迷走神经vn的一部分从食道e切走。将电极放置在神经vn和食道e之间。将另一电极放置在迷
走神经vn上,位于与第一食管相对的神经的一侧,并且电极轴向排列(即彼此直接对接)。没有为了便于说明而示出,电极可承载在围绕神经vn的公用载体(例如,ptfe或硅树脂套囊)上。在2005年6月16日公开的us 2005/0131485中描述了电极的其他可能的放置,该专利公开通过引用合并于此。
[0082]
尽管任何前述电极可以是扁平金属垫(例如,铂),但是可以将电极进行构造以用于各种目的。在一个实施例中,电极被承载在贴片上。在其他实施例中,电极被分成两个部分,两个部分都连接到公用导线并且二者都连接到公用贴片。在一些实施例中,每个电极连接到导线并放置以将治疗从一个电极递送到另一电极。柔性贴片允许电极的各部分铰接以减轻神经vn上的压力。
[0083]
神经调节器(脉冲发生器)
[0084]
神经调节器(脉冲发生器)根据编程的方案以电脉冲的形式生成电信号。在实施例中,如本文所述施加阻滞信号。
[0085]
脉冲发生器利用常规的微处理器和其他标准的电气和电子组件,并通过异步串行通信与外部编程器和/或监视器通信,以控制或指示设备的状态。密码、“握手”联络方式和奇偶校验用于数据完整性。脉冲发生器还包括用于节约能量的装置,该装置在任何由电池操作的设备中尤其重要,尤其是在植入该设备以医学治疗疾病的装置中,以及用于提供各种安全功能(例如防止设备意外重新设定)的装置。
[0086]
为了患者的安全和舒适,可以将一些功能结合到脉冲发生器中。在一些实施例中,可以通过在前两秒内逐渐增大信号的施加来提高患者的舒适度。该设备还可以具有钳位电路,以限制可递送至迷走神经的最大电压(例如14伏),从而防止神经损伤。通过与上述手动启动类似的技术和手段,操作设备使其在响应于手动失活时停止信号施加,由此可以提供附加的安全功能。这样,如果由于某种原因突然变得无法忍受,患者可中断信号施加。
[0087]
电信号治疗的间歇性(或连续性)方面在于根据规定的工作循环施加信号。脉冲信号被编程为具有预定的接通时间,其中将一连串或一系列的预置参数的电脉冲施加到迷走神经分支,随后是预定的断开时间。然而,连续施加电脉冲信号也可能是有效的。在一些实施例中,对预定的接通时间和断开时间进行编程以允许神经至少部分恢复至非下调或上调状态。
[0088]
可以使用脉冲发生器,一个提供给肝迷走神经分支,另一个提供给腹腔迷走神经分支以提供双侧上调和/或下调。优选使用植入的脉冲发生器来执行本发明的方法,但是可以想到,可以使用外部设备在门诊病人的基础上进行治疗,尽管这种方式相比于完全住院只是稍微没有那么封闭。当然,植入一个或多个脉冲发生器可以使患者完全不卧床,因此正常的日常活动(包括工作表现)不会受到影响。
[0089]
可以使用编程棒(programming wand)和个人计算机对脉冲发生器进行编程,使用的是根据本申请已经描述的编程需求和信号参数开发的合适的编程软件。当然,其意图是允许在电子包被植入之后与该电子包进行无创通信,以用于监视和编程功能。除了基本功能外,编程软件应当被构造为应提供直接的菜单驱动的操作、帮助功能、提示和消息,以便于简单快速地进行编程,同时使用户完全了解一套操作中每个步骤所发生的一切。编程能力应包括修改电子包的可调参数、测试设备诊断以及存储和找回遥测数据的能力。期望的是,当植入的单元受到询问时,可调节参数的当前状态显示在pc监视器上,以便程序员随后
可以方便地同时更改任何或所有这些参数;并且,如果选择了一个特定的参数进行更改,则将显示该参数的所有允许值,以便程序员可以选择适当的期望值输入到脉冲发生器中。
[0090]
合适的软件和相关电子设备的其他理想功能包括存储和找回历史数据的能力,包括患者代码,设备序列号,电池运行小时数,输出小时数和磁激活次数(指示患者介入情况))显示在屏幕上,其中包含显示上一次或多次激活的日期和时间的信息。
[0091]
应该执行诊断测试以验证设备的正常运行,并指出是否存在问题,例如与通信、电池或导线/电极阻抗有关的问题。例如,低电池读数表明电池寿命即将终止,并且需要植入新设备。但是,电池寿命应该大大超过其他可植入医疗设备,例如心脏起搏器,因为需要激活本发明的脉冲发生器的频率相对较低。无论如何,神经电极都可以无限期使用,而没有指示它们在诊断测试中观察到的问题。
[0092]
该设备也可以利用昼夜节律或其他程序,因此该患者在正常进餐时间会自动进行激活。这可以是对如上文所述的手动的、进餐之间的周期性以及感测触发的激活的补充。
[0093]
脉冲发生器还可以由患者通过装置的适当实施经由各种手段中的任何一种来手动激活。这些技术包括患者使用外部磁体或外部rf信号发生器,或者敲击覆盖脉冲发生器的表面以激活脉冲发生器,从而将所需的调制信号施加到电极上。另一种治疗形式可以通过以下方式实现:对脉冲发生器进行编程,从而以设定的间隔周期性地递送产生血糖控制的迷走神经活动调节。
[0094]
在一些实施例中,该系统可以包括一个或多个传感器,其可以提供信号以向一个或多个电极发起治疗信号。例如,传感器可以测量血液中的葡萄糖量,并且如果血糖量超过某个阈值,则向神经或器官发出上调信号。
[0095]
c方法
[0096]
本公开提供了治疗受试者与葡萄糖调节受损有关的病症的方法。在一些实施例中,一种方法包括:将间歇性(或连续)电信号施加于部位的目标神经,其中所述电信号经选择用于下调和/或上调神经上的神经活动,并且在中断所述阻滞或上调后,正常或基线神经活动恢复。在实施方案中,该方法提供胰高血糖素、胰岛素或两者的分泌增加。在一些实施方案中,所述方法进一步包括向所述受试者施用包含有效量的增加血糖控制的药剂的组合物。在一些实施例中,通过植入如本文所述的装置或系统,将电信号施加至神经。
[0097]
在一些实施方案中,一种用于治疗与受试者的葡萄糖调节受损有关的病症的方法包括将间歇性(或连续)神经传导阻滞施加于在阻断部位处具有葡萄糖调节受损的受试者的目标神经,其中选择所述神经传导阻滞以下调神经上的神经活动并在中断所述阻滞后,恢复神经上的神经活动。
[0098]
在一些实施方案中,方法包括用同时治疗来治疗患者的糖尿病或血糖控制受损,包括:a)每天多次并在数天内将间歇性(或连续)神经阻滞施加于患者的目标神经,其中所述阻滞经选择用于下调神经上的传入和/或传出神经活动,并在所述阻滞中断后恢复神经活动;和b)每天多次且连续数天对患者的目标神经进行间歇性(或连续性)神经刺激,其中所述刺激经选择用于上调神经上的传入和/或传出神经活动,并且在所述刺激中断后恢复神经活动。
[0099]
在其他实施方案中,一种在患者中实现葡萄糖调节的方法包括在迷走神经分支上或附近放置电极,和放置与相邻组织接触的阳极电极;将耦合到电极的神经刺激器植入患
者体内,将具有界定的振幅,脉冲宽度,频率和工作循环特征的电脉冲施加到迷走神经分支,其中选择界定的特征以改善患者的葡萄糖调节。
[0100]
在实施方案中,所述方法包括增加或改变胰高血糖素、胰岛素或两者的量的方法,包括:向目标神经施加间歇性(或连续性)电信号,选择所述电信号以上调或下调神经上的神经活动,并且当所述信号中断后,恢复神经上的神经活动,其中选择电信号以改变胰高血糖素、胰岛素或两者的量。在一些实施例中,如本文所述,针对频率、脉冲宽度、幅度和时间设置选择电信号以下调神经活动。在一些实施例中,如本文所述,针对频率,脉冲宽度,幅度和时间设置选择电信号以上调神经活动。在一些实施方案中,选择电信号以改变胰腺的胰高血糖素和胰岛素的释放。在一些实施例中,选择电信号以增加胰岛素释放,尤其是在血糖升高时。在一些实施方案中,选择电信号以改变肝脏对胰高血糖素的敏感性。
[0101]
在实施方式中,在周期内间歇地施加电信号,所述周期包括信号施加的接通时间和随后的断开时间,在断开时间期间信号没有施加至神经,其中,接通和断开时间每天多次施加,持续数天。在一些实施例中,接通时间经选择具有约30秒至约5分钟的持续时间。当信号被选择用于下调神经上的活动时,电信号以约200hz至10,000hz的频率施加。当信号被选择为用于上调神经上的活动时,电信号以约0.01hz至高达200hz的频率施加。
[0102]
在实施方式中,电信号施加到位于迷走神经上的电极。在某些情况下,电信号施加到迷走神经的肝分支上。在其他情况下,电信号施加到迷走神经的腹腔分支上。在一些实施方案中,电信号被施加到参与葡萄糖调节的器官,例如肝脏,胰腺,十二指肠,空肠或回肠上。
[0103]
在实施例中,下调和上调信号都被施加。在某些情况下,可以同时,不同时间或重叠时间施加信号。在一些实施方案中,将下调信号施加到肝脏附近的迷走神经,并且将上调信号施加到胰腺附近的迷走神经。在一些实施例中,下调信号被施加到迷走神经的肝分支,并且上调信号被施加到迷走神经的腹腔分支。
[0104]
在一些实施方案中,治疗与受试者的葡萄糖调节受损有关的病症的方法包括在刺激迷走神经的腹腔分支和迷走神经肝分支的结扎或高频交流电(hfac)阻断期间,按照静脉(iv)葡萄糖耐量测试(ivgtt)测量血糖水平。不受理论的束缚,相信迷走神经刺激诱导的胰高血糖素的胰腺分泌可以解释为什么在本公开的一些实施方案中血糖不衰减。
[0105]
在实施例中,该方法还包括检测血糖或胰岛素的水平以确定是否进行电信号治疗。如果血糖水平和/或胰岛素水平增加到正常对照或基线水平(如从未患有糖尿病的受试者的对照样品所预测),则增加胰高血糖素和/或胰岛素的治疗可能会停止,直到该水平降至维持足够血糖控制所需的预期水平以下。这样的水平是已知的或可以使用本领域技术人员已知的方法确定。
[0106]
在实施方案中,该方法进一步包括施用改善葡萄糖控制的药剂。这样的药剂包括增加胰岛素的量和/或增加细胞对胰岛素的敏感性的药剂。药剂的非限制性实例包括胰岛素、胰岛素类似物、磺酰脲类、氯茴苯酸类、glp-1类似物、dpp4抑制剂和pparα,γ或δ激动剂。
[0107]
信号应用
[0108]
在本公开的一个方面,可逆的间歇性(或连续性)调节信号被施加至目标神经或器官,以便下调和/或上调神经的神经活动。在本文描述的方法的实施方式中,将神经传导阻
滞施加于部位的目标神经,其中选择所述神经传导阻滞以下调神经上的神经活动,并且在所述信号中断后恢复神经活动。在美国专利7,167,750;us2005/0038484中描述了用于施加这种信号的系统,将其以引用方式并入。
[0109]
在某些情况下,所述神经是神经支配一个或多个消化器官的神经,包括但不限于迷走神经、腹腔神经、迷走神经的肝分支和内脏神经。施加的信号可以上调和/或下调一条或多条神经上的神经活动。
[0110]
在一些实施例中,所述调制信号包括施加电信号。选择信号以下调或上调神经活动,并在信号中断后允许神经活动恢复。如上所述,可以使用脉冲发生器来调节信号的施加,以便改变信号的特性,从而提供可逆的间歇(或连续)信号。信号的特性包括信号的位置、信号的频率、信号的幅度、信号的脉冲宽度以及信号的施用周期。在一些实施方案中,选择信号特征以提供改善的葡萄糖调节。
[0111]
在一些实施例中,施加到目标神经的电极被间歇的(或连续的)阻断或下调信号供能。信号施加的时间有限(例如5分钟)。神经活动恢复的速度因受试者而异。但是,20分钟是恢复到基线所需时间的合理示例。恢复后,再次施加阻滞信号可下调神经活动,该神经活动然后可在信号停止后恢复。信号的重新施加可以在完全恢复之前进行。例如,在有限的时间段(例如10分钟)之后,可以重新进行阻断,从而导致平均神经活动不超过与基线相比显著降低的水平。在一些实施例中,电信号在周期内被间歇地(或连续地)施加,所述周期包括信号施加的接通时间和随后的断开时间,在断开时间期间不将信号施加至神经,其中每天多次施加接通和断开时间,持续数天。在实施例中,选择接通和/或断开时间以允许神经至少部分恢复。尽管无意限制本公开,但是据信允许神经的恢复期可以避免肠顺应。
[0112]
对诸如迷走神经活动之类的神经活动恢复的认识允许治疗疗法和设备具有增强的控制和增强的治疗选择。图8示出了迷走神经活动在响应于如上所述阻滞信号施加随时间的变化,并且进一步示出了在阻滞信号停止之后迷走神经活动的恢复。将理解的是,图8的图仅是说明性的。预计患者之间会有显著的差异。例如,一些患者对阻滞信号的反应可能不如所图示的那样剧烈。其他人可能会遇到比图示更陡峭或更浅的恢复斜率。此外,某些受试者的迷走神经活动可能会在朝向基线活动增加之前保持较低水平。然而,基于上述动物实验,据信,图8是对阻滞的生理反应的公正显示。
[0113]
在图8中,迷走神经活性被图示为基线的百分比(即未经本发明治疗的迷走神经活性)。迷走神经活动可以通过多种方法进行测量。例如,每单位时间产生的胰腺外分泌物的量是这种活动的间接测量。同样,可以通过监视迷走神经上或迷走神经附近的电极来直接测量活动。也可以定性地确定这种活性(例如,通过患者对肿胀感或胃肠蠕动正常的感知)。
[0114]
在图8中,纵轴是假设的患者的迷走神经活动,占患者基线活动的百分比(因患者而异)。横轴表示时间的流逝,并且展示了说明性间隔,其间患者正在接收如上所述的阻滞信号或关闭阻滞信号(标记为“无阻滞”)。如图8所示,在接收阻滞信号的短时间内,迷走神经活动急剧下降(在所示的实例中,下降至基线活动的约10%)。阻滞信号停止后,迷走神经活动开始向基线上升(上升的斜率因患者而异)。迷走神经活动可以被允许回到基线,或者如图8所示,当迷走神经活动仍降低时,可以重新建立阻滞信号。如图8所示,当迷走神经活动增加到基线的约50%时,阻滞信号开始。结果,平均迷走神经活性降低到基线活动的约30%。应当理解,通过改变阻滞的持续时间和“无阻滞”的持续时间,可以大大改变平均迷走
神经活动。
[0115]
如上所述和此处所述,信号可以是间歇的或连续的。优选的神经传导阻滞是由可植入脉冲发生器(例如脉冲发生器104或外部控制器)控制的电极在迷走神经上的信号所产生的电子阻滞。神经传导阻滞可以是任何可逆性阻滞。例如,可以使用超声波,低温技术(化学或电子诱导)或药物阻滞剂。电子低温阻滞可以是peltier固态装置,其响应于电流而冷却并且可以被电控制以调节冷却。药物阻滞物可以包括泵控制的皮下药物递送。
[0116]
使用这种电极传导阻滞,阻滞参数(信号类型和时间设置)可以通过脉冲调节器进行更改,并可以与上调信号进行协调。作为一个说明性例子,神经传导阻滞最好在参数范围内,所述参数范围批露在solomonow,et al.,"control of muscle contractile force through indirect high-frequency stimulation",am.j.of physical medicine,vol.62,no.2,pp.71-82(1983),其全部内容通过引用合并在此。在一些实施例中,向神经传导阻滞施加电信号,该电信号经选择用于在施加阻滞信号的位置阻滞神经的整个横截面(例如,传入和传出二者,有髓和无髓纤维二者)(而不是选择神经纤维亚组或仅选择传入而不选择传出或反之),并且更优选地,其频率经选择为至少200hz阈值频率。此外,更优选的参数是500hz的频率(作为非限制性示例,其他参数是4ma的幅度,0.5msec的脉冲宽度以及工作循环为5分钟接通和10分钟断开)。在其他相关实施例中,信号阻滞范围是从200hz到10,000hz。如将更全面描述的,本实施例在选择针对个体患者的刺激和阻滞参数方面给医师很大的自由度。
[0117]
在本文描述的方法的实施方式中,将信号施加到部位处的目标神经上,选择所述信号以上调神经上的神经活动,并且在所述信号中断后恢复神经活动。在一些实施方案中,上调信号可以与下调信号结合应用以改善葡萄糖调节。例如,上调信号可以施加到内脏神经和/或腹腔神经。
[0118]
选择信号以上调神经活动,并在信号中断后允许神经活动恢复。如上所述,脉冲发生器被用来调节信号的施加,以便改变信号的特性,从而提供可逆的间歇(或连续)信号。信号的特征包括信号的频率,信号的位置以及信号的给予周期。
[0119]
在一些实施例中,用上调信号向施加于目标神经的电极供能。信号施加的时间有限(例如5分钟)。神经活动恢复的速度因受试者而异。但是,20分钟是恢复到基线所需时间的合理示例。恢复后,再次施加向上信号以上调神经活动,该神经活动可在信号停止后恢复。信号的重新施加可以在完全恢复之前进行。例如,在有限的时间段(例如10分钟)之后,可以重新施加上调信号。
[0120]
在一些实施方案中,上调信号可以与下调信号组合应用,以改善葡萄糖调节,增加/改变胰高血糖素和/或胰岛素的量和/或分泌和/或减少血糖量。神经调节信号可影响肝脏对胰高血糖素的敏感性,从食物吸收的葡萄糖的量以及胰腺分泌的胰高血糖素和/或胰岛素的量。神经调节可减少受试者所需的胰岛素量。
[0121]
上调和下调信号可以同时应用于不同的神经,可以在不同的时间应用于同一神经,或者在不同的时间应用于不同神经。在实施例中,可以将上调信号施加到腹腔神经或内脏神经。在其他实施方案中,可以将上调或下调信号施加到迷走神经的肝分支,或者可以施加该信号以减少从肝脏分泌的葡萄糖量。
[0122]
在一些实施方案中,将下调信号在一天内间歇地多次施加于迷走神经分支并持续
数天,并与在一天内间歇地多次施加于另一神经或器官并且持续数天的上调信号相结合。在一些实施例中,由于感测到的事件例如存在的血糖量而施加上调信号。在其他实施方案中,施加于内脏神经或腹腔神经的上调信号可以在受试者的正常进餐时间之后的一段时间内施加,通常在进餐时间后的15至30分钟或血糖水平升高的时间施加。
[0123]
在某些情况下,信号会在特定时间施加。例如,可以在进餐前和进餐期间施加下调信号,然后在进餐后约30至90分钟施加刺激信号。在另一个示例中,当肝脏葡萄糖增加时,可以在清晨将下调信号施加到迷走神经或迷走神经的肝分支。
[0124]
在一些实施例中,当监测器检测到低血糖水平时,将刺激信号施加到迷走神经的腹腔分支。在其他实施方案中,下调信号持续递送到迷走神经的肝分支或肝神经分支点以上的腹迷走神经干,同时刺激腹腔分支或腹腔神经分支点以上的背迷走神经干。但是,如果内部监控器检测到血糖达到不良的降血糖状态,则停止阻滞信号,继续单独进行刺激。
[0125]
在一些实施方案中,调节信号参数以获得葡萄糖调节的改善。可以通过测量空腹血糖,口服葡萄糖耐量试验和/或hba1c或受试者所需胰岛素量的减少来确定葡萄糖调节的改善。在一个实施方案中,优选的是,hbalc的绝对百分比降低至少为0.4%,并且更优选为0.4%至5%范围内的任何%。在一些实施方案中,hba1c的绝对百分比降低是0.5%,1%,1.5%,2%,2.5%,3%,3.5%,4%,4.5%或5%或更高中的任何一个。例如,2型糖尿病患者的hba1c可能为9%,而将hba1c降低为6.5%则减少2.5%,这代表血糖调节得到改善。
[0126]
在一些实施方案中,葡萄糖调节的改善包括空腹血糖小于126mg/dl或更高和/或口服葡萄糖耐受量小于200mg/dl。在一些实施方案中,空腹血糖和/或口服葡萄糖耐受量降低至少5%,更优选在5至50%范围内的任何百分比。
[0127]
在一个实施方案中,葡萄糖调节的改善包括以下一个或多个特征:hba1c小于或等于6.5%;空腹血糖低于100mg/dl;和/或口服葡萄糖耐受量低于140mg/dl。
[0128]
信号应用位置
[0129]
可以通过上调和/或下调一个或多个目标神经或器官的神经活动来实现神经活动的调节。
[0130]
在一些实施例中,电极可以位于目标神经上或目标神经附近的许多不同的部位和位置。目标迷走神经分支分别包括患者的腹腔神经,肝神经,迷走神经,内脏神经或这些的某种组合。电极的位置也可以设置成向迷走神经附近的器官(例如肝脏,十二指肠,空肠,回肠,脾脏,胰腺,食道或胃)施加信号。在一些实施例中,将电极定位成在受试者的膈的远侧位置处向神经施加电信号。
[0131]
电极可以位于不同的神经上以施加下调信号而不是上调信号。例如,下调信号可以施加到肝神经上,而上调信号施加到腹腔神经上。在一些实施方案中,可通过阻滞通向肝脏的迷走神经来施加信号以减少神经介导的反射分泌,并同时或随后刺激腹腔神经以抑制胰岛素分泌和/或上调腹腔神经以刺激胰高血糖素的产生。
[0132]
在一些实施例中,将电极定位成向迷走神经的分支或主干施加信号。在其他实施例中,将电极定位成向腹侧主干,背侧主干或两者施加信号。在一些实施例中,电极可位于同一神经处或其附近的两个不同位置或位于神经上和消化道器官上。
[0133]
例如,图2示出了阻滞电极的布置。参照图2,基线迷走神经活动由近端迷走神经节段vnp的实线示出。迷走神经的其余部分和肠神经系统以颜色浅的线显示,以说明张力
(tone)的下调。胰-胆输出量(以及由此产生的反馈)也降低了。在图2中,相对于胃肠道神经支配,阻滞电极be在迷走神经上显示为处于较高位置(例如,刚好在膈下方),唯一的阻滞电极可以放置在较低的位置(例如,刚好在胰腺/胆管神经支配vn5的近端)。如上所述,整个迷走神经的阻滞可用于下调迷走神经以获得各种益处,包括治疗与血糖控制受损有关的病症。在一些实施例中,电极可以放置在迷走神经的腹腔分支上并提供上调信号。在2005年6月16日公开的us 2005/0131485中描述了电极的其他可能的放置,该专利公开通过引用合并于此。
[0134]
信号频率和时间设置
[0135]
在一些实施例中,下调信号具有至少200hz且高达5000hz的频率。在其他实施例中,以大约500到5000hz的频率施加信号。申请人已经确定了由两个或更多个双极性电极施加的最优选的阻滞信号具有3,000hz至5,000hz或更高的频率。此类信号的优选脉冲宽度为100微秒(与5,000hz的频率相关)。相信该频率和脉冲宽度通过避免脉冲周期中的无信号时间段而最佳地避免了神经自阻滞恢复并且避免了神经的复极。脉冲周期中短的“断开”时间(例如,在周期之间或在周期内)可以是可接受的,只要它短到足以避免神经复极即可。该波形可以是方波或正弦波或其他形状。在猪研究中,发现5,000hz或更高的高频率会导致更一致的神经传导阻滞。优选地,信号是双极性的,双相递送到神经上的两个或更多个电极。
[0136]
在一些实施例中,0.01至20.0ma的信号幅度足以用于阻滞。在其他实施例中,0.01到10ma的信号幅度足以用于阻滞。在其他实施例中,信号幅度为0.01至8ma足以进行阻滞。其他幅度可满足要求。可以改变其他信号属性以减少神经或器官顺应的可能性。其中包括更改功率,波形或脉冲宽度。
[0137]
上调信号通常包括频率小于200hz,更优选在0.01至200hz之间,更优选在10至50hz,更优选在5至20hz,更优选在5至10hz,更优选在1至5hz之间的信号,优选0.1至2hz,最优选1hz。这样的信号具有0.1-10微秒的优选脉冲宽度。在一些实施例中,0.1至12ma的信号幅度足以进行刺激。其他幅度可满足要求。可以改变其他信号属性以减少神经或器官顺应的可能性。其中包括更改功率,波形或脉冲宽度。
[0138]
上调和/或下调神经活动和/或允许神经活动恢复的信号的选择可以涉及选择信号类型和施加信号的时间设置。例如,对于电极传导阻滞,阻滞参数(信号类型和时间设置)可以通过脉冲发生器进行更改,并可以与刺激信号进行协调。实现阻滞的精确信号可能因患者和神经部位而异。可以分别调整精确的参数,以在阻滞部位实现神经传递阻滞。
[0139]
在一些实施例中,信号具有工作循环,该工作循环包括在其间将信号施加至神经的接通时间以及在其间没有将信号施加于神经的断开时间。例如,可以调节接通时间和断开时间以允许神经的部分恢复。在一些情况下,下调信号和上调信号可以被协调,使得当未施加下调信号时(例如,在特定时间或由于感测到的事件而施加上调信号时),上调信号被施加。在一些实施例中,感测到的事件指示在与感测到的事件有关的时间段内施加了上调信号而未施加下调信号。血糖超过一定阈值。在优选实施例中,信号被连续施加。
[0140]
在一些实施例中,受试者接收可植入组件104。(图3)电极212、212a被放置在患者刚好在膈下方的前(腹侧)迷走神经avn和后(背侧)迷走神经pvn上。外部天线(线圈102)(或其他通信系统)放置在患者皮肤上,覆盖在植入的接收线圈105上。外部控制单元101可以针对各种信号参数进行编程,包括频率选择,脉冲幅度和工作循环的选项。对于阻滞信号,频
率选项包括2500hz和5000hz(均远高于200hz的阈值阻滞频率)。绝大多数处理是在5,000hz的交流电信号下进行6秒,脉冲宽度为100微秒。幅度选项为0
–
10ma。为了刺激信号,选择小于200hz的频率。
[0141]
工作循环也可以控制。代表性的工作循环是5分钟的接通时间,然后是5分钟的无信号。在整个设备使用过程中重复工作循环。在一些实施例中,可以应用迷你型(mini)工作循环。在一个实施例中,迷你型工作循环包括在5,000hz在一定电流下的为期180毫秒的迷你接通时间,所述电流从迷你接通时间逐渐增加到迷你接通时间,直到实现了全电流(或者在电流逐渐下降的情况下渐进减小)。在每个这样的迷你型接通时间之间,存在一个迷你型断开时间,该时间可以变化,但是通常为大约20毫秒的持续时间,在此期间不施加任何信号。因此,在每20秒逐渐上升或逐渐下降中,大约有100个迷你型工作循环,每个迷你型工作循环的持续时间为200毫秒,并且每个迷你型工作循环包括大约180毫秒的接通时间和大约20毫秒的断开时间。
[0142]
在一些实施方案中,上调信号可以与下调信号结合应用以改善葡萄糖调节。
[0143]
通常,患者仅在清醒时才使用设备。临床医生可以将治疗递送的钟点编程在设备中(例如,在7:00am自动打开,在9:00pm自动关闭)。在某些情况下,治疗的钟点将被修改为对应于血糖波动的时间,例如饭前和饭后30-90分钟。例如,可以将治疗的钟点调整为在早餐前在5:00am开始并在9:00pm或以后结束,这取决于最后一餐或零食的摄入时间。在脉冲发生器的射频供电版本中,设备的使用受患者控制。例如,患者可以选择不佩戴外部天线。该设备通过记录接收天线何时通过穿过患者皮肤的射频(rf)耦合与外部天线耦合的时间来跟踪使用情况。
[0144]
在一些实施例中,外部组件101可以询问脉冲发生器组件104以获得各种信息。在一些实施方案中,每个工作循环30秒至180秒的治疗时间优选于每个工作循环小于30秒或每个工作循环大于180秒的治疗时间。
[0145]
在10分钟的工作周期内(即,预期进行5分钟的治疗,然后进行5分钟的断开时间),患者可以多次启动治疗。例如,如果在任何给定的预期5分钟的接通时间内,患者经历了35秒的接通时间和1.5分钟的实际接通时间(5分钟预期接通时间的其余时间是由于信号中断的无治疗期),即使只打算使用一次,患者也可以启动两次实际的治疗。启动治疗的次数与患者经历的接通时间长度成反比。
[0146]
改变平均神经活动(例如迷走神经活动)的灵活性为主治医师在治疗患者方面提供了很大的自由度。例如,在治疗糖尿病或前驱糖尿病时,可以以短的“无阻滞”时间来施加阻滞信号。如果患者由于运动障碍而感到不适,则可以增加“无阻滞”期的持续时间以改善患者的舒适度。同样,酶产生的减少会导致脂肪吸收减少,从而粪便中的脂肪随之增加。可以调整阻滞时间和无阻滞持续时间,以达到可忍受的大便(例如,避免过多的脂肪性腹泻)。由于迷走神经活动不像外科手术和永久迷走神经切断术那样完全被中断,因此本发明提供的对照可以用于防止肠神经系统的控制。
[0147]
虽然患者的舒适度足以作为确定阻滞和无阻滞的持续时间的适当参数的反馈,但可以开发出更加客观的测试。例如,可以调节阻滞和无阻滞的持续时间以及与上调信号的组合,以实现所需的葡萄糖调节水平。可以在每个患者的基础上对此类测试进行测量和应用,或者在对患者进行统计采样后进行,并将其应用于一般患者群体。
[0148]
在一些实施例中,可以采用传感器。可以添加感测电极se来监视神经活动,其为确定如何调节神经活动和工作循环的一种方式。尽管感测电极可以是阻滞电极的附加电极,但是应当理解,单个电极可以执行这两种功能。感测电极和阻滞电极可以连接到控制器,如图3所示。这种控制器与前述控制器102相同,具有从感测电极接收信号的附加功能。
[0149]
在一些实施例中,传感器可以是感测电极,葡萄糖传感器或感测其他感兴趣的生物分子或激素的传感器。当感测电极se产生代表目标的最大迷走神经活动或张力的信号时(例如,如图8所示,为基线的50%),具有从感测电极接收信号这一附加功能的控制器使用阻滞信号向阻滞电极be供能。如参考控制器102(图3)所述,具有从感应电极接收信号这一附加功能的控制器可以远程编程为阻滞持续时间和无阻滞持续时间的参数,以及启动阻滞信号或上调信号的目标。
[0150]
在一些实施例中,本文描述的装置和方法使用迷走神经的恢复来控制迷走神经活动的下调程度。这赋予了医师增强的控制患者治疗的能力,从而以最小的患者不适感获得最大的治疗效果。迷走神经阻滞模拟迷走神经切断术,但是与迷走神经切断术不同,其是可逆且可控的。
实施例
[0151]
本文的结果表明,在2型糖尿病的zucker肥(胖)大鼠(zdf fa/fa)模型中,对神经支配胰腺和肝脏的神经的电调节可改善ivgtt的性能。在这项研究中,刺激迷走神经的腹腔分支(神经支配胰腺),同时伴随着对迷走神经的肝分支同时结扎或在肝神经上应用hfac。
[0152]
ip注射戊巴比妥麻醉zucker肥胖糖尿病大鼠(zdf fa/fa)fa/fa)或sprague dawley对照大鼠。接下来,将大鼠放在加热毯上,并向右颈静脉插管。通过定期测试缩爪反应来评估麻醉深度。如果观察到反射,则静脉注射维持剂量的戊巴比妥。接下来,打开腹腔并使肝脏缩回。腹迷走神经的肝分支和背迷走神经的腹腔分支被分离并与食道分开。
[0153]
参考图10-13中,实验方案包括五个实验条件:1)假手术(仅神经分离),2)迷走神经切断术+刺激,3)hfac+刺激,4)单独进行迷走神经切断术,和5)单独刺激。在迷走神经+刺激组中,结扎了肝分支,并以1hz刺激了腹腔分支。在hfac+刺激组中,以5000hz阻滞肝分支,并以1hz刺激腹腔分支。在单独的迷走神经切断术组中,结扎了肝分支。在单独刺激组中,以1hz的频率刺激腹腔分支,肝分支保持完整。
[0154]
1hz刺激包括由grass s44刺激器(grass medical instruments,quincy,ma,美国)产生的负脉冲(4毫秒),该刺激通过恒定电流(8ma)刺激隔离单元(model a360,world precision instruments,sarasota,fl,usa)递送。hfac(5000hz)信号(8ma)由reshape lifesciences inc.(san clemente,ca)设计的专有设备生成。在所有步骤之后的一个小时(除了hfac+刺激步骤之后的15分钟),从大鼠尾巴的末端切口提取血液样本。使用alphatrak(美国伊利诺伊州北芝加哥艾伯特实验室(abbott laboratories))血糖监测仪测量血糖浓度(mg/dl)。
[0155]
接下来,进行ivgtt。ivgtt包括向孔(port)中静脉注射0.5g/kg剂量的葡萄糖,该葡萄糖由0.9%的盐水和20%的重量/体积浓度组成。然后在葡萄糖注射后30分钟采取血糖样品。在ivgtt期间维持hfac的刺激和/或递送。在某些情况下,在假手术组中以及在hfac停
止和hfac+刺激组中进行刺激之后,随后进行ivgtt。所有数据均以平均值
±
sem表示。使用以下公式计算葡萄糖浓度的变化百分比:
[0156]
%变化百分比=((在时间x时的血糖浓度-基线血糖浓度)/(基线血糖浓度))*100
[0157]
结果
[0158]
对神经支配胰腺和肝脏的神经的电调节改善了t2dm的zucker肥(胖)大鼠(zdf fa/fa)模型中ivgtt的性能。刺激迷走神经的腹腔分支(1hz),同时伴随对迷走神经的肝分支进行结扎或向肝神经施加hfac(5000hz)。本文的描述表明,腹腔刺激引起血浆胰岛素增加,但是血浆葡萄糖不变或增加。不受束缚,认为这是由于胰高血糖素的同时胰腺释放引起的;导致肝脏葡萄糖释放。据推断,通过对穿过肝分支的传导进行阻滞,可以降低肝脏对胰高血糖素的敏感性。而且,已经显示,在2型糖尿病的啮齿动物模型中,肝迷走神经切断术降低胰岛素抵抗。
[0159]
图9显示,对于c波,在阻滞电极部位发生的hfac诱导的对迷走神经的传导阻滞。如图所示,在随后的持续时间为120秒@10ma(10a)和@8ma(10b)的hfac过程中,与由远端电极引起的cap相比,近端(对照)电极产生的cap没有明显降低。数据表明,远端cap的衰减主要是由于阻滞电极部位的传导阻滞。如图9中,实线表示施加了hfac。
[0160]
图10描绘了肝迷走神经切断术与腹腔刺激相结合改进了ivgtt的性能。图10a显示了ivgtt后pg的变化。图10b显示了注射葡萄糖后曲线下面积的分析结果。图10a显示的是针对假手术、单独腹腔刺激、单独肝迷走神经切断术和腹腔分支刺激与肝迷走神经切断术结合,ivgtt后pg的变化。在图10b中,注射葡萄糖后的曲线下面积分析的p值为0.007。此外,受试者的空腹血糖水平为287
±
mg/dl。
[0161]
图11显示了同时刺激腹腔分支和肝分支阻滞可逆地改善了ivgtt的性能。图11a是ivgtt后pg的变化。对于假手术或刺激+迷走神经切断术,ivgtt后pg的变化。在这种情况下,在停止hfac刺激后15分钟,随后进行ivgtt(箭头)。图11b是两次注射葡萄糖后曲线下面积分析的图形表示。p值经确定为0.027。
[0162]
图12显示了在非糖尿病大鼠对照中,同时刺激腹腔分支和hfac阻滞肝分支改善了ivgtt的性能。图12a表示假手术后pg的变化。假手术、迷走神经切断术+刺激和hfac+刺激后pg的变化。图12b是在针对各种操作注射葡萄糖之后的曲线下面积分析的图形表示。非糖尿病对照组的空腹血糖水平为167
±
14mg/dl。
[0163]
图10-12的数据表明,当以1hz刺激迷走神经的腹腔分支(神经支配胰腺)的方法与同时结扎迷走神经的肝分支或向肝神经施加hfac(5000hz)结合时,对神经支配胰腺和肝脏的神经的电调节可改善ivgtt的性能。尽管不希望受特定理论的束缚,但这可能是由于胰腺同时释放胰高血糖素所致;导致肝脏葡萄糖释放。通过对穿过肝分支的传导进行阻滞,这减弱了肝脏对胰高血糖素的敏感性。
[0164]
参考图13-15,其中描述了用于治疗低血糖状态的神经调节。本文描述的系统为1型糖尿病患者的低血糖症提供治疗。患有1型糖尿病的普通个体每周约有两次症状性低血糖发作。严重的低血糖症每年患病率为30
–
40%,每名患者每年的发病率为1.0
–
1.7次发作。
[0165]
应当注意的是,低血糖症不仅在糖尿病患者中观察到,而且还源于其他疾病,例如但不限于肾衰竭、某些肿瘤、肝脏疾病、甲状腺功能低下,先天性代谢错误、严重感染、反应性低血糖和包括饮酒在内的多种毒品。本发明的设备可以帮助治疗患有这些医学疾病的病
人的低血糖症。
[0166]
图13示出了刺激参数是连续的1hz,4ms的脉冲宽度,8ma的电流幅度。该数据表明,仅对迷走神经腹腔分支或对腹腔分支点之上的后迷走神经干进行刺激会导致pg的快速(5分钟或更短)且显著增加(图13)。重要的是要注意,由于高血糖症并发症,连续刺激并不是理想的。理想的系统是监测pg水平,然后在pg降低至不安全水平时启动或调整迷走神经刺激。
[0167]
参照图14-15,其中系统包括脉冲发生器、放置在迷走神经上的导线和可植入葡萄糖传感器(以监测血糖水平)。传感器采样率约为1秒至10分钟。图14示出了系统的示意图,其中可植入葡萄糖传感器与脉冲发生器通信以启动迷走神经刺激。可植入传感器检测低血糖水平并发送信号以打开脉冲发生器。图15示出了系统的示意图,其中,可植入葡萄糖传感器首先与附接到皮肤外部的外部设备通信,然后该外部设备与脉冲发生器通信以启动迷走神经刺激。
[0168]
脉冲发生器与葡萄糖传感器之间的通信可以通过但不限于蓝牙技术、射频、wifi、光或声音进行。在一些实施例中,葡萄糖传感器在皮肤层之下,并且与皮肤外部的设备通信,所述皮肤外部的设备带有电池,从而为无线通信供能。葡萄糖传感器与体外设备之间的通信可以通过但不限于蓝牙技术、射频、wifi、光或声音进行。然后,皮肤外部的设备通过但不限于蓝牙技术、射频、wifi、光或声音与脉冲发生器进行通信。可植入葡萄糖传感器或与可植入葡萄糖传感器通信的外部设备也可以与智能设备(例如运行应用程序的电话)通信,以显示血糖水平并在血糖达到不安全的低水平时发送警报。与智能设备的通信可以通过但不限于蓝牙技术、射频、wifi、光或声音进行。刺激参数包括0.01hz至200hz之间的频率范围,电流或电压幅度范围:0.1ma至12ma或0.1至12伏,脉冲宽度范围:0.1ms至10ms。刺激可以是连续的,也可以是突发进行的(bursting),突发进行间的时间间隔范围从毫秒、秒到分钟。
[0169]
刺激部位包括迷走神经的任何部分,包括膈下前迷走神经干和后迷走神经干以及膈下迷走神经干的分支,例如源自后迷走神经干的腹腔分支,腹腔副支流,起源于前迷走神经干或肝分支,起源于前迷走神经干的分支。刺激部位还包括前或后胸迷走神经,或左或右颈迷走神经。包括迷走神经刺激部位的任何组合。
[0170]
对本申请概念的修改和等同物(例如本领域技术人员可能容易想到的那些)旨在包括在所附权利要求的范围内。另外,本发明预期通过将电极放置在一个或多个神经上涵盖电信号治疗的组合应用。本文提及的任何出版物均通过引用并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1