抗CD37免疫缀合物给药方案的制作方法
本发明的领域总体上涉及(例如与抗cd20治疗剂(例如,利妥昔单抗)组合)施用抗cd37免疫缀合物(例如,debio1562)的方法,以用于治疗疾病,例如癌症。
背景技术:
癌症是发达国家中死亡的主导原因之一,仅在美国每年就有超过一百万人被诊断患有癌症并且有500,000例死亡。总的来说,估计超过三分之一的人会在他们的一生中出现某种形式的癌症。非霍奇金淋巴瘤(nhl)是美国最常见的癌症之一,其中其约占所有癌症的4%。抗cd20抗体利妥昔单抗对患者的预后有显著作用,但患者可能显示出原发性和继发性耐药。
白细胞抗原cd37(“cd37”),也称为gp52-40、四跨膜蛋白-26或tspan26,其在前b细胞至外周成熟b细胞阶段过程中在b细胞上表达,但在终末分化为浆细胞时缺乏。(link等人,1987,jpathol.152:12-21)。cd37抗原仅微弱表达于t细胞、髓样细胞以及粒细胞(schwartz-albiez等人,1988,j.immunol.,140(3)905-914)。然而,cd37还表达于恶性b细胞,例如那些在非何杰金氏淋巴瘤(nhl)和慢性淋巴系白血病(cll)中发现的恶性b细胞(cll)(moore等人,1986,jimmunol.137(9):3013-8)。该表达情况表明,cd37表现为b细胞恶性肿瘤的有前景的治疗靶,并且目前,对b细胞恶性肿瘤的更有效的治疗有明显的未满足的医学需求。
技术实现要素:
本文提供了使用抗cd37免疫缀合物(例如debio1562)治疗人类患者的癌症的方法。
在某些情况下,一种用于治疗人类患者的癌症的方法包括在三周周期中每周一次向所述患者施用包含抗cd37免疫缀合物的药物组合物,其中:a)所述免疫缀合物在第一周施用0.2mg/kg,在第二周施用0.2mg/kg,而在第三周施用0.2mg/kg;b)所述免疫缀合物在第一周施用0.3mg/kg,在第二周施用0.3mg/kg,而在第三周施用0.3mg/kg;c)所述免疫缀合物在第一周施用0.3mg/kg,在第二周施用0.3mg/kg,而在第三周施用0.2mg/kg;d)所述免疫缀合物在第一周施用0.3mg/kg,在第二周施用0.2mg/kg,而在第三周施用0.2mg/kg;e)所述免疫缀合物在第一周施用0.4mg/kg,在第二周施用0.3mg/kg,而在第三周施用0.3mg/kg;f)所述免疫缀合物在第一周施用0.4mg/kg,在第二周施用0.3mg/kg,而在第三周施用0.2mg/kg;g)所述免疫缀合物在第一周施用0.4mg/kg,在第二周施用0.2mg/kg,而在第三周施用0.2mg/kg;h)所述免疫缀合物在第一周施用0.5mg/kg,在第二周施用0.3mg/kg,而在第三周施用0.2mg/kg;i)所述免疫缀合物在第一周施用0.5mg/kg,在第二周施用0.2mg/kg,而在第三周施用0.2mg/kg;或者j)所述免疫缀合物在第一周施用0.6mg/kg,在第二周施用0.2mg/kg,而在第三周施用0.2mg/kg;其中所述免疫缀合物包含(i)抗体或其抗原结合片段,所述抗体或其抗原结合片段包含含有seqidno:2的氨基酸序列的vh-cdr1、含有seqidno:3的氨基酸序列的vh-cdr2、含有seqidno:4的氨基酸序列的vh-cdr3、含有seqidno:5的氨基酸序列的vl-cdr1、含有seqidno:6的氨基酸序列的vl-cdr2、以及含有seqidno:7的氨基酸序列的vl-cdr3和(ii)美登木素。
在某些情况下,所述抗体或抗原结合片段包含含有seqidno:8的氨基酸序列的可变重链。在某些情况下,所述抗体或其抗原结合片段包含含有seqidno:10的氨基酸序列的可变轻链。在某些情况下,所述抗体或抗原结合片段包含含有seqidno:11的氨基酸序列的全长重链。在某些情况下,所述抗体或抗原结合片段包含含有seqidno:12的氨基酸序列的全长轻链。在某些情况下,所述抗体包含轻链和重链,所述轻链包含与由保藏为atcc保藏物pta-10722的phucd37-3lc质粒编码的轻链相同的氨基酸序列,所述重链包含与由保藏为atcc保藏物pta-10723的phucd37-3hcv1.0编码的重链相同的氨基酸序列。
在某些情况下,所述美登木素为dm1。在某些情况下,所述美登木素通过smcc接头与抗体或抗原结合片段连接。
在某些情况下,所述抗体包含含有seqidno:11的氨基酸序列的全长重链和含有seqidno:12的氨基酸序列的全长轻链,所述美登木素为dm1,并且所述dm1通过smcc接头与所述抗体连接。
在某些情况下,所述免疫缀合物每个抗体包含1-10个美登木素。
在某些情况下,所述药物组合物包含所述免疫缀合物中的至少两种,并且所述免疫缀合物每个抗体包含平均3至4个美登木素。在某些情况下,所述药物组合物包含所述免疫缀合物中的至少两种,并且所述免疫缀合物每个抗体包含平均3.5个美登木素。
在某些情况下,所述免疫缀合物被施用六个三周周期。
在某些情况下,所述免疫缀合物静脉内施用。
在某些情况下,所述免疫缀合物与抗cd20治疗剂(anti-cd20therapy)联合施用。在某些情况下,所述抗cd20治疗剂和所述免疫缀合物在分开的药物组合物中施用。
在某些情况下,所述抗cd20治疗剂是利妥昔单抗。在某些情况下,施用375mg/m2的所述利妥昔单抗。在某些情况下,所述利妥昔单抗每三周施用一次。在某些情况下,在所述三周周期的第一天施用所述利妥昔单抗。在某些情况下,所述免疫缀合物和所述利妥昔单抗在同一天施用。在某些情况下,在施用所述免疫缀合物之后施用所述利妥昔单抗。在某些情况下,所述利妥昔单抗被施用六个三周周期。在某些情况下,所述利妥昔单抗每四周(一个月)施用一次、每两个月施用一次或每三个月施用一次。
在某些情况下,所述药物组合物包含所述免疫缀合物中的至少两种,并且所述免疫缀合物每个抗体包含平均3至4个美登木素,其中所述抗体包含含有seqidno:11的氨基酸序列的全长重链和含有seqidno:12的氨基酸序列的全长轻链,其中所述美登木素是dm1,并且其中所述dm1通过smcc接头与所述抗体连接,其中所述免疫缀合物与375mg/m2的利妥昔单抗每三周联合施用一次,所述利妥昔单抗在所述三周周期的在施用所述免疫缀合物后的第一天施用。
在某些情况下,所述方法还包括对所述患者施用皮质类固醇。在某些情况下,在施用所述免疫缀合物之前施用所述皮质类固醇。在某些情况下,在施用所述免疫缀合物之前约30至约60分钟施用所述皮质类固醇。在某些情况下,所述免疫缀合物是静脉内施用的,并且所述皮质类固醇是围输液地施用的。在某些情况下,所述皮质类固醇在所述免疫缀合物的施用之后被施用。在某些情况下,在施用所述免疫缀合物后约一天至约四天施用所述皮质类固醇。在某些情况下,所述皮质类固醇在所述免疫缀合物施用后的第2和3天施用。
在某些情况下,所述皮质类固醇选自:泼尼松、泼尼松龙、甲基泼尼松龙、倍氯米松、倍他米松、地塞米松、氟可的松(fludrocortisone)、氢化可的松和曲安西龙。在某些情况下,所述皮质类固醇是地塞米松。
在某些情况下,所述方法还包括向所述患者施用生长因子。在某些情况下,所述生长因子选自粒细胞集落-刺激因子(g-csf)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落-刺激因子(m-csf)、非格司亭和培非格司亭。在某些情况下,所述生长因子是g-csf。
在某些情况下,所述癌症是b细胞恶性肿瘤。在某些情况下,所述癌症是白血病或淋巴瘤。在某些情况下,所述癌症是非霍奇金淋巴瘤(nhl)。在某些情况下,所述nhl是复发性nhl。在某些情况下,所述nhl是难治性nhl。在某些情况下,所述癌症是弥漫性大b细胞淋巴瘤(dlbcl)。在某些情况下,所述dlbcl是复发性dlbcl。在某些情况下,所述dlbcl是难治性dlbcl。在某些情况下,所述癌症选自复发性和/或难治性dlbcl、滤泡性淋巴瘤(fl)、边缘区淋巴瘤/与粘液相关的淋巴样组织(mzl/malt)或套细胞淋巴瘤(mcl)。在某些情况下,所述癌症选自:前体b细胞成淋巴细胞性白血病/淋巴瘤和成熟b细胞瘤,如b细胞慢性淋巴细胞白血病(cll)/小淋巴细胞淋巴瘤(sll),b细胞幼淋巴细胞白血病,淋巴浆细胞淋巴瘤,套细胞淋巴瘤(mcl),滤泡性淋巴瘤(fl),包括低级、中级和高级fl,皮肤滤泡中心淋巴瘤,边缘区b细胞淋巴瘤(malt型、淋巴结和脾型),毛细胞白血病,弥漫性大b细胞淋巴瘤(dlbcl),伯基特淋巴瘤,浆细胞瘤,浆细胞骨髓瘤,移植后淋巴增生性疾病,瓦尔登斯特伦巨球蛋白血症和间变性大细胞淋巴瘤(alcl)。
在某些情况下,所述癌症表达cd37。
在某些情况下,所述抗cd37免疫缀合物的每周施用维持三周的暴露。在某些情况下,所述抗cd37免疫缀合物的每周施用限制了中性粒细胞减少症和/或其他不良事件。在某些情况下,与每三周施用抗cd37免疫缀合物相比,每周施用抗c37免疫缀合物延长与利妥昔单抗的协同作用。
在某些情况下,所述抗cd37免疫缀合物每周施用至少一个三周周期、至少两个三周周期、至少三个三周周期、至少四个三周周期、至少五个三周周期、至少六个三周周期、至少七个三周周期、至少八个三周周期、至少九个三周周期、至少十个三周周期、至少十一个三周周期或至少十二个三周周期。在某些情况下,在所述至少一个三周周期、至少两个三周周期、至少三个三周周期、至少四个三周周期、至少五个三周周期、至少六个三周周期、至少七个三周周期、至少八个三周周期、至少九个三周周期、至少十个三周周期、至少十一个三周周期或至少十二个三周周期的每周施用后,每三周一次按0.7mg/kg的剂量施用所述抗cd37免疫缀合物。在某些情况下,在每周施用后观察到完全缓解、部分缓解或疾病稳定之后,以0.7mg/kg的剂量每三周一次施用所述抗cd37免疫缀合物。
附图说明
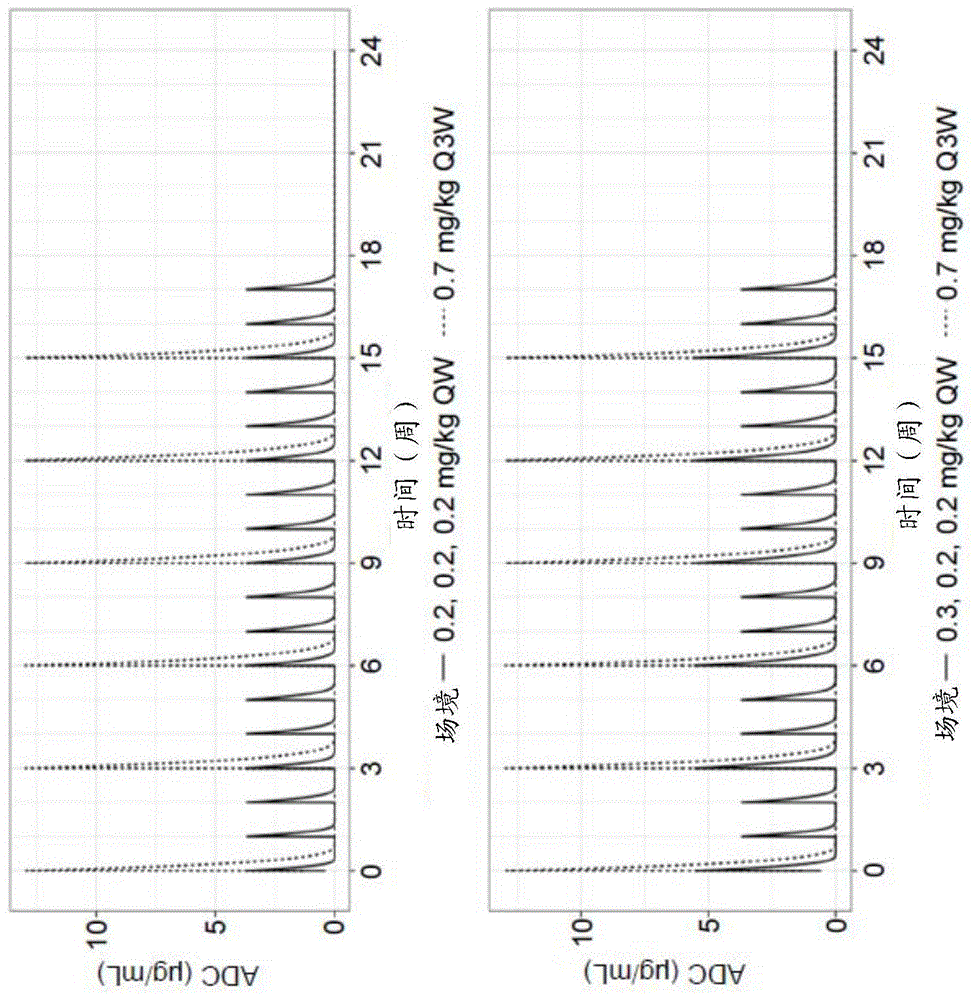
图1显示了通过将每周0.2mg/kg的剂量施用三次,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期进行比较(上图),或者将施用三次,分别按每周0.3、0.2和0.2mg/kg的剂量施用,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期进行比较(下图),对患者的debio1562(“adc”)血药浓度的模拟。
图2显示了通过将施用三次,分别按每周0.3、0.3和0.2mg/kg的剂量施用,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期进行比较(上图),或者将每周0.3mg/kg的剂量施用三次,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期进行比较(下图),对患者的debio1562(“adc”)血药浓度的模拟。
图3显示了通过将施用三次,分别按每周0.4、0.2和0.2mg/kg的剂量施用,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期进行比较(上图),或者将施用三次,分别按每周0.4、0.3和0.2mg/kg的剂量施用,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期(上图)进行比较(下图),对患者的debio1562(“adc”)血药浓度的模拟。
图4显示了通过将施用三次,分别按每周0.4、0.3和0.3mg/kg的剂量施用,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期进行比较(上图),或者将施用三次,分别按每周0.5、0.2和0.2mg/kg的剂量施用,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期(上图)进行比较(下图),对患者的debio1562(“adc”)血药浓度的模拟。
图5显示了通过将施用三次,分别按每周0.5、0.3和0.2mg/kg的剂量施用,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期进行比较(上图),或者将施用三次,分别按每周0.6、0.2和0.2mg/kg的剂量施用,持续六个周期,与每三周按0.7mg/kg施用一次,持续六个周期(上图)进行比较(下图),对患者的debio1562(“adc”)血药浓度的模拟。
图6显示了反映在群组a(q3w-每3周一次方案)和群组b(qw-3周每周施用方案)中暴露于debio1562的患者的药代动力学参数。auccycle=3周周期内的曲线下面积;clast=在下一次debio1562施用之前的一个周期中测得的最后浓度;cmax=每个周期观察到的最大浓度;n代表用于构建相应箱形图的观察次数-每个对象可能观察到多个值。箱形图表示中位数和第25-75个百分位数。
图7显示了在群组a(q3w)和群组b(qw)中测得的cd3+t细胞上cd37受体占有率(ro)。
图8显示了q3w方案(群组a,浅灰色)和qw方案(群组b,深灰色)根据2014lugano分类的最佳总体响应(bor)和总体响应率(orr)的分类图。左图显示的数据为每个类别的患者人数。右图显示的数据为相对于相应群组中可评估患者总数的每个类别中患者的百分比。此图基于群组a中10例患者和群组b中6例患者的数据。
具体实施方式
本发明提供了用于cd37结合免疫缀合物的新的给药方案。
i.定义
为了促进对本发明的理解,下文定义了一些术语和用语。
除非另有指明,否则本文使用的术语“cd37”是指任何天然cd37。cd37也被称为gp52-40、白细胞抗原cd37以及四跨膜蛋白-26。术语“cd37”包括“全长”、未加工的cd37以及由细胞中加工产生的任何形式的cd37。该术语还包括cd37的天然存在的变体,例如剪接变体、等位变体和同种型。本文所述的cd37多肽可分离自多种来源,例如来自人组织型或来自其他来源,或者通过重组或合成方法制备。
除非另有说明,否则本文使用的术语“cd20”是指任何天然cd20多肽。cd20也被称为跨膜4-结构域、亚家族a、成员1(ms4a1)、b-淋巴细胞表面抗原b1和白细胞表面抗原leu-16。术语“cd20”涵盖“全长”未经加工的cd20多肽以及由细胞中加工产生的任何形式或同种型的cd20多肽。该术语还包括cd20多肽的天然存在的变体,例如由剪接变体和等位变体编码的那些变体。本文所述的cd20多肽可以分离自多种来源,例如来自人组织类型或来自其他来源,或通过重组或合成方法制备。在具体指明的情况下,“cd20”可以用于指编码cd20蛋白的核酸。
术语“抗体”意指通过免疫球蛋白分子可变区内的至少一个抗原识别位点识别并特异性结合到靶标的免疫球蛋白分子,所述靶标诸如为蛋白、多肽、肽、碳水化合物、多核苷酸、脂质或前述物质的组合。如本文所使用的,术语“抗体”涵盖完整的多克隆抗体、完整的单克隆抗体、嵌合抗体、人源化抗体、人抗体、包含抗体的融合蛋白,以及任何其它经修饰的免疫球蛋白分子,只要这些抗体表现出所需的生物活性即可。抗体可以是以下五大类免疫球蛋白中的任何一类:iga、igd、ige、igg和igm,或其亚类(同种型)(例如igg1、igg2、igg3、igg4、iga1和iga2),基于它们的重链恒定结构域的特性分别称为α、δ、ε、γ和μ。不同类的免疫球蛋白具有不同的且熟知的亚基结构和三维构型。抗体可以是裸抗体或缀合到其它分子,诸如毒素、放射性同位素等。
术语“抗体片段”是指完整抗体的一部分。“抗原结合片段”、“抗原结合结构域”或“抗原结合区”是指完整抗体的与抗原结合的部分。抗原结合片段可包含完整抗体的抗原决定区(例如,互补决定区(cdr))。抗体的抗原结合片段的实例包括但不限于:fab,fab',f(ab')2,和fv片段,线性抗体和单链抗体。抗体的抗原结合片段可以源自任何动物物种,例如啮齿动物(例如,小鼠、大鼠或仓鼠)和人类,或者可以人工产生。
术语“抗cd37抗体|”或“与cd37结合的抗体”是指能够以足够亲和力与cd37结合的抗体,使得抗体可用作靶向cd37的诊断剂和/或治疗剂。抗cd37抗体与无关的、非cd37蛋白结合的程度可小于该抗体与cd37结合的约10%,这通过例如放射免疫测定(ria)来检测。在某些实施方案中,与cd37结合的抗体具有≤1μm、≤100nm、≤10nm、≤1nm或≤0.1nm的解离常数(kd)。类似地,术语“抗cd20抗体”或“与cd20结合的抗体”是指能够以足够亲和力与cd20结合的抗体,使得抗体可用作靶向cd20的诊断剂和/或治疗剂。抗cd20抗体与无关的、非cd20蛋白结合的程度可小于该抗体与cd20结合的约10%,这通过例如放射免疫测定(ria)来检测。在某些实施方案中,与cd20结合的抗体具有≤1μm、≤100nm、≤10nm、≤1nm或≤0.1nm的解离常数(kd)。
“单克隆抗体”是指在单个抗原决定簇或表位的高度特异性识别和结合中涉及到的均质性抗体群。这与多克隆抗体形成对比,多克隆抗体通常包括针对不同抗原决定簇的不同抗体。术语“单克隆”抗体或其抗原结合片段涵盖完整及全长单克隆抗体以及抗体片段(诸如fab、fab'、f(ab')2、fv)、单链(scfv)突变体、包含抗体部分的融合蛋白以及任何其它包含抗原识别位点的经修饰的免疫球蛋白分子。此外,“单克隆抗体”是指通过任何多种方式制备的此类抗体,包括但不限于通过杂交瘤、噬菌体筛选、重组表达和转基因动物制备的此类抗体。
如本文所用,术语“可变区”或“可变域”可互换使用并且在本技术领域中是常见的。可变区通常是指抗体的一部分,通常是轻链或重链的一部分,典型地为成熟重链中氨基末端约110至120个氨基酸或110至125个氨基酸,成熟轻链中氨基末端约90至115个氨基酸,其在抗体之间的序列差异很大,并且用于特定抗体对其特定抗原的结合和特异性。序列的变异性集中在称为互补决定区(cdr)的那些区域中,而可变结构域中保守性较高的区域称为框架区(fr)。不希望受任何特定机制或理论的束缚,相信轻链和重链的cdr主要负责抗体与抗原的相互作用和特异性。在某些实施方案中,可变区是人可变区。在某些实施方案中,可变区包含啮齿动物或鼠cdr和人框架区(fr)。在特定实施方案中,可变区是灵长类(例如,非人灵长类)可变区。在某些实施方案中,可变区包含啮齿动物或鼠cdr和灵长类(例如,非人灵长类)框架区(fr)。
术语“vl”和“vl结构域”可互换使用,是指抗体的轻链可变区。
术语“vh”和“vh结构域”可互换使用,是指抗体的重链可变区。
kabat编号系统通常用在提及可变结构域(大约轻链的第1-107位残基和重链的第1-113位残基)中的残基时(例如,kabat等人,sequencesofimmunologicalinterest.,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))。
如kabat中的氨基酸位置编号是指用于抗体汇编的重链可变结构域或轻链可变结构域的编号系统,见于:kabat等人,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991)。使用该编号系统,实际的线性氨基酸序列可含有与可变结构域的fr或cdr的缩短或插入相对应的更少的或另外的氨基酸。例如,重链可变结构域可以包括在h2的第52位残基后的单个氨基酸插入(根据kabat的第52a位残基)以及在重链fr第82位残基后的插入残基(例如,根据kabat的第82a、82b和82c位残基等)。对于给定的抗体,可通过在抗体序列同源性区域与“标准”kabat编号序列进行比对而确定残基的kabat编号。相反,chothia则是指结构环的位置(chothia和lesk,j.mol.biol.196:901-917(1987))。chothiacdr-h1环的末端在使用kabat编号惯例进行编号时在h32与h34之间根据环的长度而变化(这是因为kabat编号方案将插入置于h35a和h35b处;如果35a和35b均不存在,则环在第32位结束;如果仅存在35a,则环在第33位结束;如果35a和35b均存在,则环在第34位结束)。abm高变区代表了kabatcdr与chothia结构环之间的折中,并被oxfordmolecular'sabm抗体建模软件使用。
如本文所使用的,术语“恒定区”或“恒定结构域”是可互换的,并且本技术领域中具有其共同的含义。恒定区是抗体部分,例如轻链和/或重链的羧基末端部分,其不直接涉及抗体与抗原的结合,但是可以表现出多种效应子功能,例如与fc受体的相互作用。相对于免疫球蛋白可变结构域,免疫球蛋白分子的恒定区通常具有更保守的氨基酸序列。在某些方面,抗体或抗原结合片段包含足以用于抗体依赖性细胞介导的细胞毒性(adcc)的恒定区或其部分。
如本文所用,在提及抗体时所用的术语“重链”可以基于恒定域的氨基酸序列指任何不同的类型,例如,阿尔法(α)、德尔塔(δ)、伊普西隆(ε)、伽马(γ)和缪(μ),其分别产生iga、igd、ige、igg和igm类型的抗体,包括igg的亚类,例如igg1、igg2、igg3和igg4。重链氨基酸序列是本技术领域所公知的。在特定的实施方案中,重链是人的重链。
如本文所使用的,基于恒定域的氨基酸序列,在提及抗体时所用的术语“轻链”可以指任何不同的类型,例如卡帕(κ)或拉姆达(λ)。轻链氨基酸序列是本技术领域所公知的。在特定的实施方案中,轻链是人的轻链。
术语“嵌合”抗体或其抗原结合片段是指其中的氨基酸序列衍生自两个或更多个物种的抗体或其抗原结合片段。通常,轻链和重链两者的可变区都对应于具有所需特异性、亲和力和能力的来源于一个哺乳动物物种(例如小鼠、大鼠、兔子等)的抗体或其抗原结合片段的可变区,而恒定区则与来源于另一物种(通常为人)的抗体或其抗原结合片段中的序列同源,以避免在该物种中引发免疫反应。
术语“人源化”抗体或其抗原结合片段是指作为含有最少的非人(例如鼠)序列的特定免疫球蛋白链、嵌合免疫球蛋白或其片段的非人(例如鼠)抗体形式或其抗原结合片段形式。通常,人源化抗体或其抗原结合片段是其中来自互补决定区(cdr)的残基被来自具有所需特异性、亲和力和能力(“cdr移植的”)的非人物种(例如小鼠、大鼠、兔子、仓鼠)的cdr的残基替换的人免疫球蛋白(jones等人,nature,321:522-525(1986);riechmann等,nature,332:323-327(1988);verhoeyen等人,science,239:1534-1536(1988))。在一些情况下,人免疫球蛋白的fv框架区(fr)残基被来自具有所需特异性、亲和力和能力的非人物种的抗体或片段中的相应残基替换。人源化抗体或其抗原结合片段可在fv框架区中和/或被替换的非人残基内通过另外残基的替换来进一步修饰,以改善或优化抗体或其抗原结合片段的特异性、亲和力和/或能力。一般来讲,人源化抗体或其抗原结合片段将包含至少一个,通常两个或三个可变结构域的基本上全部,所述可变结构域含有对应于非人免疫球蛋白的cdr区的全部或基本上全部,而fr区的全部或基本上全部则为人免疫球蛋白共有序列(consensussequence)的那些fr区。人源化抗体或其抗原结合片段还可以包含通常为人免疫球蛋白的免疫球蛋白恒定区或结构域(fc)的至少一部分。用于生成人源化抗体的方法的实例在美国专利5,225,539;roguska等人,proc.natl.acad.sci.,usa,91(3):969-973(1994),和roguska等人,proteineng.9(10):895-904(1996)。在一些实施方案中,“人源化抗体”是表面重构抗体。
术语“人”抗体或其抗原结合片段是指具有来源于人免疫球蛋白基因基因座的氨基酸序列的抗体或其抗原结合片段,其中该抗体或其抗原结合片段是使用本技术领域中已知的任何技术制备的。人抗体或其抗原结合片段的该定义包括完整或全长抗体及其片段。
如本文所使用的术语“生物类似药”是指在结构、生物活性和功效、安全性和免疫原性方面与另一种生物药物高度相似的生物药物。
“结合亲和力”通常是指分子(例如抗体)的单个结合位点与其结合伴侣(例如抗原)之间的非共价相互作用的总强度。除非另外指明,否则如本文所用的“结合亲和力”是指反映结合对(例如抗体和抗原)成员之间的1:1相互作用的固有结合亲和力。分子x对其伴侣y的亲和力通常可由解离常数(kd)表示。亲和力可通过本领域已知的常见方法(包括本文所述的那些方法)进行测量。低亲和力抗体通常缓慢地结合抗原并倾向于容易解离,而高亲和力抗体通常更快地结合抗原并倾向于保持结合更长的时间。测量结合亲和力的多种方法在本领域中是已知的,它们中的任何一种均可用于本发明的目的。
“或更佳的”当在本文用于指代结合亲和力时是指分子与其结合伴侣之间更强的结合。“或更佳的”当在本文用于指代更强的结合时,由更小的kd数值表示。例如,对于具有“0.6nm或更佳的”抗原亲和力的抗体,该抗体的抗原亲和力<0.6nm,即0.59nm、0.58nm、0.57nm等或小于0.6nm的任何值。
所谓“特异性结合”一般是指抗体通过其抗原结合结构域结合到表位并且该结合使得在抗原结合结构域与表位之间需要一定的互补性。根据该定义,抗体在与其将会结合到随机、无关表位相比通过其抗原结合结构域更容易地结合到某表位时则称为“特异性结合”到该表位。术语“特异性”在本文中用于限定某一抗体结合某一表位的相对亲和力。例如,抗体“a”对于给定的表位可被视为比抗体“b”具有更高的特异性,或可称为抗体“a”以比其对于相关表位“d”所具有的特异性更高的特异性结合到表位“c”。
所谓“优先地结合”是指抗体比其将结合到相关、相似、同源或类似表位更容易地特异性结合到某表位。因此,与结合相关表位相比,“优先地结合”给定表位的抗体更容易结合该给定表位,即使此类抗体可与相关表位交叉反应也如此。
“分离的”多肽、抗体、多核苷酸、载体、细胞或组合物是指呈不存在于自然界中的形式的多肽、抗体、多核苷酸、载体、细胞或组合物。分离的多肽、抗体、多核苷酸、载体、细胞或组合物包括经过纯化一定程度上已不再呈自然界中所见形式的那些多肽、抗体、多核苷酸、载体、细胞或组合物。在某些情况下中,分离的抗体、多核苷酸、载体、细胞或组合物为基本上纯的。
如本文所使用的,“基本上纯的”是指至少50%纯(即,不含污染物)、至少60%纯、至少70%纯、至少80%纯、至少90%纯、至少95%纯、至少98%纯或至少99%纯的物质。
如本文所使用的,术语“免疫缀合物”或“缀合物”是指连接到细胞结合剂(即,抗cd37抗体或其片段)的化合物或其衍生物,并由以下通式定义:c-l-a,其中c=细胞毒素,l=接头以及a=抗cd37抗体或抗体片段。免疫缀合物也可由反向顺序的通式a-l-c定义。
术语“debio1562”是指本文所述的含有hucd37-3抗体(包含由seqidno:2-7表示的cdr、seqidno:8的vh和seqidno:10的vl)、smcc接头和dm1美登木素的免疫缀合物。它也被称为恩美那拉妥昔单抗(naratuximabemtansine),并且先前被称为imgn529。
“接头”是能够将化合物(通常为药物,诸如美登木素)以稳定的共价方式连接到细胞结合剂(诸如抗cd37抗体或其片段)的任何化学部分。在化合物或抗体保持活性的条件下,接头可容易受例如酸诱导的裂解、光诱导的裂解、肽酶诱导的裂解、酯酶诱导的裂解和二硫键裂解的影响或基本上对其耐受。合适的接头在本领域中是公知的,并且包括例如二硫基团、硫醚基团、酸不稳定基团、光不稳定基团、肽酶不稳定基团和酯酶不稳定基团。接头还包括带电荷的接头及其亲水形式,如本文所述和本领域已知的。
术语“癌”和“癌的”是指或描述其中细胞群的特征在于未调节的细胞生长的哺乳动物中的生理状况。癌的实例包括但不限于癌(carcinoma)、淋巴瘤、胚细胞瘤、肉瘤以及白血病。“肿瘤”和“赘生物”是指过度细胞生长或增殖(良性(非癌的)或恶性(癌的),包括癌前病变)而产生的一种或多种细胞。可以治疗和/或预防的“癌症”或“致瘤性”疾病的实例包括:b细胞淋巴瘤,包括nhl,前体b细胞成淋巴细胞性白血病/淋巴瘤和成熟b细胞瘤,如b细胞慢性淋巴细胞白血病(cll)/小淋巴细胞淋巴瘤(sll),b细胞幼淋巴细胞白血病,淋巴浆细胞淋巴瘤,套细胞淋巴瘤(mcl),滤泡性淋巴瘤(fl),包括低级、中级和高级fl,皮肤滤泡中心淋巴瘤,边缘区b细胞淋巴瘤(malt型、淋巴结和脾型),毛细胞白血病,弥漫性大b细胞淋巴瘤,伯基特淋巴瘤,浆细胞瘤,浆细胞骨髓瘤,移植后淋巴增生性疾病,瓦尔登斯特伦巨球蛋白血症和间变性大细胞淋巴瘤(alcl)。
术语“癌细胞”、“肿瘤细胞”和语法等效物是指来源于肿瘤或癌前病变的总细胞群,包括非致瘤性细胞(构成肿瘤细胞群的大部分)和致瘤性干细胞(癌干细胞)两者。如本文所用,术语“肿瘤细胞”在仅指缺乏分化能力的那些肿瘤细胞时将通过术语“非致瘤性”加以修饰,以将那些肿瘤细胞与癌干细胞区分。
术语“受试者”是指将为特定治疗的接受者的任何动物(例如哺乳动物),包括但不限于人、非人灵长类、啮齿类等等。一般来讲,术语“受试者”和“患者”在涉及人受试者时在本文可互换使用。
与一种或多种另外的治疗剂“组合”施用包括同时(并行)施用和以任何顺序连续施用。
术语“药物制剂”是指这样的制备物,其所呈现的形式允许活性成分的生物活性发挥效果,并且其不含对将要施用该制剂的受试者具有无法接受毒性的另外组分。制剂可以为无菌的。
如本文所公开的抗体或免疫缀合物的“有效量”是足以实现具体指定的目的的量。“有效量”可通过经验确定以及在涉及指定的目的时以常规方式确定。
术语“治疗有效量”是指有效“治疗”受试者或哺乳动物中的疾病或病症的抗体或其它药物的量。就癌症而言,治疗有效量的药物可以减少癌细胞的数量;减小肿瘤尺寸或负荷;抑制(即,在一定程度上减慢并在某个实施方案中停止)癌细胞对周围器官的浸润;抑制(即,在一定程度上减慢并在某个实施方式案停止)肿瘤转移;在一定程度上抑制肿瘤生长;在一定程度上缓解与癌症相关的一种或多种症状;和/或导致有利的反应,诸如延长的无进展生存期(pfs)、无病生存期(dfs)或总生存期(os)、完全缓解(cr)、部分缓解(pr),或在一些情况下,疾病稳定(sd)、进行性疾病(pd)的减少、减少进展的时间(ttp)、或其任何组合。参见本文中“治疗”的定义。就药物可防止癌细胞生长和/或杀伤现有癌细胞的程度而言,药物可以是细胞抑制性的和/或细胞毒性的。“预防有效量”是指在必要的剂量下和时间段内有效实现所需预防结果的量。通常但非必要地,由于预防剂量在疾病之前或疾病的早期阶段用于受试者,因此预防有效量将低于治疗有效量。
术语“有利地反应”通常是指在受试者中引起有益的状态。关于癌症治疗,该术语是指在受试者身上提供治疗效果。在癌症中的积极治疗效果可以按多种方式测量(参见w.a.weber,j.nucl.med.50:1s-10s(2009))。例如,肿瘤生长抑制、分子标记物表达、血清标记物表达以及分子成像技术均可用于评定抗癌治疗剂的疗效。有利的缓解在临床上可例如通过延长的无进展生存期(pfs)、无病生存期(dfs)或总生存期(os)、完全缓解(cr)、部分缓解(pr)或在一些情况下疾病稳定(sd)、进行性疾病(pd)的减少、减少的进展时间(ttp)或其任何组合来评定。
pfs、dor、dfs和os可以通过由美国国家癌症研究所(nationalcancerinstitute)和批准新药的美国食品药品监督管理局(u.s.foodanddrugadministration)设立的标准来测量。参见johnson等人,(2003)j.clin.oncol.21(7):1404-1411。
“无进展生存期”(pfs)是指从招募到疾病进展或死亡的时间。pfs一般使用kaplan-meier方法来总结。一般来讲,无进展生存期是指其中患者保持活着而无癌症恶化的情形。
“肿瘤进展时间”(ttp)被定义为从招募到疾病进展的时间。ttp一般使用recist1.1标准来测量。
“完全缓解”或“完全缓解”或“cr”指示响应于治疗,肿瘤或癌症的所有迹象消失。这并不总是意味着癌症已被治愈。例如,任何病理性淋巴结(无论是靶标还是非靶标)必须在短轴上减小至<10mm。通常使用recist1.1标准来测量实体瘤中的完全缓解。eisenhauer,e.a.,eur.j.cancer,45:228-47(2009)。通常使用lugano分类来评估nhl中的完全缓解。cheson,b.d等人,jclinoncol.,32:3059–3067(2014)。其他肿瘤缓解标准也可以适当地用于相关适应症。
“部分缓解”或“pr”是指响应于治疗,一个或多个肿瘤或病变的尺寸或体积减小,或癌症在体内的程度减轻。eisenhauer,e.a.,eur.j.cancer,45:228-47(2009)。cheson,b.d等人,jclinoncol.,32:3059–3067(2014)。
“疾病稳定”或“sd”是指不进展或复发的疾病。在研究时,以最小的总直径作为参考,在疾病稳定中,既不存在足够的肿瘤缩小以符合部分缓解也不存在足够的肿瘤增大以符合进行性疾病。eisenhauer,e.a.,eur.j.cancer,45:228-47(2009)。cheson,b.d等人,jclinoncol.,32:3059–3067(2014)。
“进行性疾病”或“pd”是指一种或多种新病变或肿瘤的出现和/或现有非靶标的明确进展和/或靶标病变直径总和至少增加20%,其中,以研究中的最小和作为参考(这包括基线和,如果其在研究中最小的话)。除了相对增加20%,总和还必须显示至少5mm的绝对增加。(注意:一种或多种新病变的出现也被视为进展)。eisenhauer,e.a.,eur.j.cancer,45:228-47(2009).。cheson,b.d等人,jclinoncol.,32:3059–3067(2014)。
“无病生存期”(dfs)是指患者保持无疾病的治疗期间和之后的时间长度。
“缓解的持续时间”(dor)是指从较早缓解(pr或更好)到疾病进展或死亡的时间。
“总生存期”(os)是指从患者招募到死亡或在最后得知活着的日期时的时间。os包括与首次接触试验的或未治疗个体或患者相比的预期寿命的延长。总生存期是指其中患者例如从随机化或治疗之时起保持活着持续限定的时间段,诸如一年、五年等的情形。
特定肿瘤、组织或细胞样品中的cd37的术语“过度表达”是指cd37(cd37多肽或编码这种多肽的核酸)以比存在于相同类型或来源的非病变组织或细胞中的水平高的水平存在。例如,这种过度表达可以通过突变、基因扩增、转录增加或翻译增加而引起。
诸如“治疗(treating/treatment/totreat)”或“缓解(alleviating/toalleviate)”之类的术语是指治愈、减缓、减轻所诊断的病理病状或病症的症状和/或阻止其进展的治疗性措施。因此,需要治疗的那些包括已诊断患有或疑似患有所述病症的那些。在某些实施方案中,如果患者显示出以下一个或多个方面,则受试者根据本发明的方法针对癌症得到了成功的“治疗”:癌细胞数量减少或完全不存在癌细胞;肿瘤负荷减小;癌细胞向周围器官的浸润(包括例如癌症扩散到软组织和骨骼中)受到抑制或不存在;肿瘤转移受到抑制或不存在;肿瘤生长受到抑制或不存在;与特定癌症相关的一种或多种症状减轻;发病率和死亡率降低;生活质量改善;肿瘤的致肿瘤性、致肿瘤频率或致肿瘤能力降低;肿瘤中癌干细胞的数量或频率降低;致肿瘤细胞向非致瘤状态分化;延长的无进展生存期(pfs)、无病生存期(dfs)或总生存期(os)、完全缓解(cr)、部分缓解(pr)、疾病稳定(sd)、进行性疾病(pd)的减少、减少的进展时间(ttp)或其任何组合。
术语“预治疗(pre-treat/pre-treatment)”是指在施用抗cd37治疗剂之前进行的治疗性措施。例如,如在本文更详细地描述,可在施用抗cd37治疗剂之前约一周、约五天、约三天、约两天或约一天或24小时内施用预防剂,诸如类固醇(例如皮质类固醇)。预防剂也可在抗cd37治疗剂当天在抗cd37治疗剂之前施用。
术语“多肽”、“肽”和“蛋白”在本文可互换使用,以指代任何长度的氨基酸聚合物。该聚合物可以是线性或支化的,其可以包含经修饰的氨基酸,并且可以被非氨基酸中断。这些术语还涵盖天然地或通过干预而修饰的氨基酸聚合物;例如二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其它操作或修饰,诸如与标记组分缀合。该定义还包括例如含有一个或多个氨基酸类似物(包括例如非天然氨基酸等)以及本领域已知的其它修饰的多肽。应当理解,由于本发明的多肽基于抗体,因此在某些实施方案中,多肽可作为单链或缔合链存在。
除非上下文另外清楚地规定,否则如本公开和权利要求中使用的单数形式“一个(种)(a)、”“一个(种)(an)”以及“所述(the)”包括复数形式。
应理解,无论本文何处用语言“包括”来描述实施方案,都还提供以“由…组成”和/或“基本上由…组成”的措辞来描述的其他相似实施方案。
如本文的短语如“a和/或b”中使用的术语“和/或”意指包括“a和b”、“a或b”、“a”以及“b”。同样地,如在短语如“a、b和/或c”中使用的术语“和/或”意指涵盖以下各实施方案中的每一种:a、b以及c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);以及c(单独)。
ii.抗cd37免疫缀合物
本文所述的方法提供了施用特异性结合cd37的免疫缀合物的方法。这些试剂在本文中称为“cd37-免疫缀合物”或“抗cd37-免疫缀合物”。这样的免疫缀合物包含抗cd37抗体或其抗原结合片段和药物(例如美登木素)。药物(例如美登木素)可以通过接头(例如smcc接头)连接至抗cd37抗体或其抗原结合片段。免疫缀合物可以包含多种药物(例如1-10种美登木素),其中每种药物(例如美登木素)可以通过接头(例如smcc接头)与抗体或其抗原结合片段连接。
抗cd37免疫缀合物可以结合到例如人cd37。人cd37的全长氨基酸序列是本领域已知的(np_001765.1),并且在本文中也以seqidno:1提供。
msaqesclslikyflfvfnlfffvlgslifcfgiwilidktsfvsfvglafvplqiwskvlaisgiftmgiallgcvgalkelrcllglyfgmllllfatqitlgilistqraqlerslrdvvektiqkygtnpeetaaeeswdyvqfqlrccgwhypqdwfqvlilrgngseahrvpcscynlsatndstildkvilpqlsrlghlarsrhsadicavpaeshiyregcaqglqkwlhnnlisivgiclgvgllelgfmtlsiflcrnldhvynrlayr(seqidno:1)
在某些情况下,抗cd37免疫缀合物(例如debio1562)具有以下作用中的一种或多种:抑制肿瘤细胞的增殖,通过减少肿瘤中癌症干细胞的频率来降低肿瘤的致瘤性,抑制肿瘤生长,增加存活率,触发肿瘤细胞的细胞死亡,将致瘤细胞分化为非致瘤状态或防止肿瘤细胞转移。在某些情况下,抗cd37免疫缀合物(例如debio1562)通过细胞毒性剂触发细胞死亡。在某些情况下,抗cd37免疫缀合物(例如debio1562)能够抑制肿瘤生长。在某些情况下,抗cd37免疫缀合物(例如debio1562)能够在体内(例如在异种移植小鼠模型中和/或在患有癌症的人中)抑制肿瘤生长。抗cd37免疫缀合物(例如debio1562)可包含抗体hucd37-3或其片段、变体和衍生物,如先前在美国公开no.2011/0256153中所述,该文献通过引用整体并入本文。
在一些情况下,抗cd37免疫缀合物包含人源化抗cd37抗体或其抗原结合片段。
在一些情况下,抗cd37免疫缀合物(例如debio1562)包含人源化抗cd37-3抗体(“hucd37-3”)的重链和轻链可变区cdr序列。hucd37-3的cdr序列在下表1和2中提供。
表1:可变重链cdr氨基酸序列
表2:可变轻链cdr氨基酸序列
在某些情况下,抗cd37免疫缀合物(例如debio1562)包含抗体或其抗原结合片段,其包含分别包含seqidno:2、3和4的可变重链cdr1、cdr2和cdr3序列以及分别包含seqidno:5、6和7的可变轻链cdr1、cdr2和cdr3序列。
在一些情况下,抗cd37免疫缀合物(例如debio1562)包含本文所述的可变轻链或可变重链。在一些情况下,抗cd37免疫缀合物(例如debio1562)同时包含本文提供的可变轻链和可变重链。下表3和4提供了hucd37-3抗体的可变轻链和可变重链序列(1.0版和1.1版)。
表3:可变重链氨基酸序列
表4:可变轻链氨基酸序列
抗cd37免疫缀合物(例如debio1562)也可以包含全长轻链或全长重链。在某些情况下,抗cd37免疫缀合物(例如debio1562)可以同时包含全长轻链和全长重链。hucd37-3(1.0版)的全长轻链和重链序列在下表5和6中提供。
表5:全长重链氨基酸序列
表6:全长轻链氨基酸序列
在某些情况下,抗cd37免疫缀合物(例如debio1562)可包含抗cd37抗体或其抗原结合片段,其包含具有与由重组质粒dnaphucd37-3lc编码的氨基酸序列相同的氨基酸序列的轻链或轻链可变区(atcc保藏名称为pta-10722,于2010年3月18日保藏在atcc)。在某些情况下,抗cd37抗体或其抗原结合片段可包含含有与由重组质粒dnaphucd37-3hcv.1.0编码的氨基酸序列相同的氨基酸序列的重链或重链可变区(atcc保藏名称为pta-10723,于2010年3月18日保藏在atcc)。在某些情况下,抗cd37抗体或其抗原结合片段可包含含有与由重组质粒dnaphucd37-3lc(pta-10722)编码的氨基酸序列相同的氨基酸序列的轻链或轻链可变区以及含有与由重组质粒dnaphucd37-3hcv.1.0(pta-10723)编码的氨基酸序列相同的氨基酸序列的重链或重链可变区。在某些情况下,抗cd37抗体或其抗原结合片段可包含(i)vl-cdr,其含有与重组质粒dnaphucd37-3lc(pta-10722)编码的vl-cdr相同的氨基酸序列,以及(ii)vh-cdr,其含有与由重组质粒dnaphucd37-3hcv.1.0(pta-10723)编码的vh-cdr相同的氨基酸序列。
如本文所提供的,在某些情况下,约1至约8个药物分子(例如美登木素类)与抗cd37抗体或其抗原结合片段连接。一方面,免疫缀合物包含1、2、3、4、5、6、7或8个美登木素/抗体或其抗原结合片段。一方面,免疫缀合物包含约1至约8个美登木素/抗体或其抗原结合片段,约2至约7个美登木素/抗体或其抗原结合片段,约2至约6个美登木素/抗体或其抗原结合片段,约2至约5个美登木素/抗体或其抗原结合片段,约3至约5个美登木素/抗体或其抗原结合片段,或约3至约4个个美登木素/抗体或其抗原结合片段。
在某些情况下,本文提供的组合物包含抗cd37免疫缀合物,所述抗cd37免疫缀合物的每个抗体或其抗原结合片段包含约1至约10个美登木素,例如,其中每个抗体或其抗原结合片段的美登木素的平均数为约2至约8(例如1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1)。
在某些情况下,本文提供的组合物包含抗cd37免疫缀合物,其中每个抗体或其抗原结合片段连接平均约2±0.5、约3±0.5、约4±0.5、约5±0.5、约6±0.5、约7±0.5或约8±0.5个药物分子(例如美登木素)。在某些方面,本文提供的组合物包含每个抗体平均具有约3.5±0.5个药物分子(例如美登木素)的抗cd37免疫缀合物。在某些方面,本文提供的组合物包含每个抗体平均具有3.5±0.5个药物分子(例如美登木素)的抗cd37免疫缀合物。
如本文所使用的,表述“连接到细胞结合剂”或“连接到抗cd37抗体或片段”是指缀合物分子,其包含通过合适的连接基团或其前体结合到细胞结合剂抗cd37抗体或片段的至少一种药物衍生物。一个连接基团为smcc。
合适的美登木素的实例包括美登木醇(maytansinol)和美登木醇类似物的酯。包括在内的是与美登木醇和美登木醇类似物一样的抑制微管形成并对哺乳动物细胞具有高度毒性的任何药物。
合适的美登木醇酯的实例包括具有修饰的芳环的那些以及在其它位置具有修饰的那些。此类合适的美登木素在美国专利no.4,424,219;no.4,256,746;no.4,294,757;no.4,307,016;no.4,313,946;no.4,315,929;no.4,331,598;no.4,361,650;no.4,362,663;no.4,364,866;no.4,450,254;no.4,322,348;no.4,371,533;no.5,208,020;no.5,416,064;no.5,475,092;no.5,585,499;no.5,846,545;no.6,333,410;no.7,276,497和7,473,796中公开。
在某些情况下,本发明的免疫缀合物利用正式名称为n2’-去乙酰基-n2’-(3-巯基-1-氧丙基)-美登素的含巯基的美登木素(dm1)作为细胞毒性剂。dm1由以下结构式(i)表示:
在另一情况下,本发明的缀合物利用含巯基的美登木素n2’-去乙酰基-n2’(4-甲基-4-巯基-1-氧戊基)-美登素(例如dm4)作为细胞毒性剂。dm4由以下结构式(ii)表示:
另一种包含含有空间位阻硫醇键的侧链的美登木素为n2’-去乙酰基-n-2’(4-巯基-1-氧戊基)-美登素(称为dm3),其由以下结构式(iii)表示:
一些缀合物的结构示意图显示如下:
本发明还包括的是通过以上任何结构描绘的任何化合物或缀合物的任何立体异构体及其混合物。
美登木素可以是,例如,n2’-脱乙酰基-n2’-(3-巯基-1-氧代丙基1)-美登素(dm1)。
根据本文所述的一些实例,免疫缀合物可以被内化到细胞中。因此,免疫缀合物可以在其被表达cd37的细胞吸收或内化表达时,发挥治疗作用。
iii.cd20治疗剂
在某些情况下,本文所述的方法包括与抗cd20治疗剂联合施用抗cd37免疫缀合物(例如debio1562)。
在某些情况下,抗cd20治疗剂是利妥昔单抗、其抗原结合片段或其生物类似药。在某些情况下,抗cd20治疗剂是奥法木单抗(ofatumumab)、其抗原结合片段或其生物类似药。在某些情况下,抗cd20治疗剂是奥比妥珠单抗(obinutuzumab)、其抗原结合片段或其生物类似药。在某些情况下,抗cd20治疗剂是维妥珠单抗(veltuzumab)、其抗原结合片段或其生物类似药。
在某些情况下,本文所述的方法包括与利妥昔单抗联合施用抗cd37免疫缀合物(例如debio1562)。利妥昔单抗是作为
表7:利妥昔单抗可变重链和可变轻链氨基酸序列
如本文所使用的,将利妥昔单抗与抗cd37免疫缀合物(例如debio1562)“联合”施用包括同时或依次施用利妥昔单抗和抗cd37免疫缀合物(例如debio1562)。在某些情况下,将利妥昔单抗和抗cd37免疫缀合物(例如debio1562)在分开的药物组合物中依次施用,例如,在将抗cd37免疫缀合物(例如debio1562)施用之后,在与抗cd37免疫缀合物(例如debio1562)施用的同一天,施用利妥昔单抗。
将抗cd37免疫缀合物(例如debio1562)与利妥昔单抗联合使用可提供“协同作用”并证明“协同”,即,当活性成分一起使用时所达到的效果大于分别使用这些化合物所导致的效果的总和。这已经在wo2016/200676中进行了描述,其通过引用整体并入本文。debio1562和利妥昔单抗的联合在一组代表各种nhl亚型的细胞系中表现出协同的促凋亡活性,这些细胞系包括活化的b细胞样(abc)和生发中心b细胞样(gcb)dlbcl、cll和mcl。
iv.施用包含抗cd37免疫缀合物的药物组合物的方法
本公开涉及每周剂量方案,其用于向人类患者施用抗cd37免疫缀合物(例如debio1562)(任选地与抗cd20治疗剂(例如利妥昔单抗)联合)以治疗癌症。癌症可以是例如b细胞恶性肿瘤。
在某些情况下,抗cd37免疫缀合物(例如debio1562)以三周周期每周一次施用,例如在21天周期的第1天、第8天、第15天施用。每周施用抗cd37免疫缀合物(例如debio1562)可以保持cd37抗原持续且长时间地暴露于debio1562。每周施用抗cd37免疫缀合物(例如debio1562)也可以限制安全风险问题(例如中性粒细胞减少症),同时维持靶细胞上cd37抗原的饱和度。利妥昔单抗也可以例如每三周施用一次(例如,在施用抗cd37免疫缀合物(例如,debio1562)之后的21天周期的第1天)。每周施用抗cd37免疫缀合物(例如debio1562)与利妥昔单抗组合可以延长与利妥昔单抗的协同作用。利妥昔单抗也可以每四周(一个月)施用一次,每两个月施用一次或每三个月施用一次。
患者可以接受至少两个三周(21天)周期的治疗。可以对患者进行至少三个三周(21天)周期的治疗。可以对患者进行至少四个三周(21天)周期的治疗。可以对患者进行至少五个三周(21天)周期的治疗。可以对患者进行至少六个三周(21天)周期的治疗。
患者可以接受一到六个三周(21天)周期的治疗。患者可以接受二到六个三周(21天)周期的治疗。患者可以接受三到六个三周(21天)周期的治疗。患者可以接受四到六个三周(21天)周期的治疗。患者可以接受五到六个三周(21天)周期的治疗。
在某些情况下,在第一周(例如,在第1天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,在第一周(例如,在第1天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,在第一周(例如,在第1天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,在第一周(例如,在第1天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,在第一周(例如,在第1天)施用0.4mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,在第一周(例如,在第1天)施用0.4mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,在第一周(例如,在第1天)施用0.4mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,在第一周(例如,在第1天)施用0.5mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.3mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,在第一周(例如,在第1天)施用0.5mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,在第一周(例如,在第1天)施用0.6mg/kg的抗cd37免疫缀合物(例如,debio1562),在第二周(例如,在第8天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562),并且在第三周(例如,在第15天)施用0.2mg/kg的抗cd37免疫缀合物(例如,debio1562)。利妥昔单抗也可以在第一周(例如,在施用抗cd37免疫缀合物(例如,debio1562)后的第一天)施用,剂量为例如375mg/m2。
在某些情况下,抗cd37免疫缀合物(例如debio1562)是静脉内施用的。在某些情况下,利妥昔单抗通过静脉内给药。在某些情况下,抗cd37免疫缀合物(例如debio1562)和利妥昔单抗都是静脉内施用(例如,在分开的组合物中同一天,在抗cd37免疫缀合物(例如debio1562)后施用利妥昔单抗)。
在某些情况下,在3周周期中以每周施用抗cd37免疫缀合物之后,可以每三周一次以0.7mg/kg的剂量施用抗cd37免疫缀合物。例如,抗cd37免疫缀合物可以在单个3周周期中每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在两个连续的三周周期中每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在三个连续的三周周期中每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在四个连续的三周周期中每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在五个连续的三周周期中每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可在六个连续的三周周期中每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以七个连续的三周周期每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在八个连续的三周周期中每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在九个连续的三周周期中每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以连续十个三周周期每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在连续的十一个三周周期中每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以连续十二个三周周期每周施用,然后每三周一次以0.7mg/kg的剂量施用。
抗cd37免疫缀合物可以在至少一个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少两个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少三个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少四个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少五个3周周期每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少六个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少七个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少八个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少九个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少十个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少十一个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。抗cd37免疫缀合物可以在至少十二个3周周期内每周施用,然后每三周一次以0.7mg/kg的剂量施用。
抗cd37免疫缀合物可以在一个或多个3周周期内每周施用,直到观察到良好的结果(例如,完全缓解、部分缓解或疾病稳定),然后以0.7mg/kg的剂量每三周施用一次。
本发明提供了治疗人受试者中的癌症的方法,其包括向受试者(例如,需要治疗的受试者)施用治疗有效量的cd37结合剂。在某些实施方式案中,癌症是b细胞恶性肿瘤。在某些实施方案中,癌症是白血病或淋巴瘤。在某些实施方案中,癌症选自:b细胞淋巴瘤,nhl,前体b细胞成淋巴细胞性白血病/淋巴瘤和成熟b细胞瘤,b细胞慢性淋巴细胞白血病(cll)/小淋巴细胞淋巴瘤(sll),小细胞淋巴瘤,b细胞幼淋巴细胞白血病,淋巴浆细胞淋巴瘤,套细胞淋巴瘤(mcl),滤泡性淋巴瘤(fl),低级、中级和高级(fl),皮肤滤泡中心淋巴瘤,边缘区b细胞淋巴瘤,malt型边缘区b细胞淋巴瘤,淋巴结边缘区b细胞淋巴瘤,脾型边缘区b细胞淋巴瘤,毛细胞白血病,弥漫性大b细胞淋巴瘤,伯基特淋巴瘤(burkitt'slymphoma),浆细胞瘤,浆细胞骨髓瘤,移植后淋巴增生性疾病,瓦尔登斯特伦巨球蛋白血症和间变性大细胞淋巴瘤(alcl)。在某些实施方案中,癌症选自:弥漫性大b细胞淋巴瘤(dlbcl),滤泡性淋巴瘤(fl),未指定的nhl,malt淋巴瘤,套细胞淋巴瘤(mcl),伯基特淋巴瘤(bl)和慢性淋巴细胞白血病(cll)。在某些实施方案中,癌症是复发性或难治性nhl。
在某些情况下,癌症是弥漫性大b细胞淋巴瘤(dlbcl)。dlbcl可以是复发的dlbcl。dlbcl可以是难治性(即在第一线治疗后无缓解或显示疾病进展)的dlbcl。在某些情况下,dlbcl不是难治性dlbcl。
在某些情况下,抗cd37免疫缀合物的施用(任选地与抗cd20治疗剂联合使用)可提高无进展生存期(pfs)、无疾病生存期(dfs)、缓解持续时间(dor)、总体生存期(os)、完全缓解(cr)、部分缓解(pr)或稳定疾病(sd)。
在某些情况下,人类受试者已经接受了至少一种针对癌症的先前治疗方案。在某些情况下,人类受试者已经接受了不超过六种先前的癌症治疗方案。在某些情况下,人类受试者已经接受了至少一种癌症的先前治疗,但不超过六种先前的癌症治疗方案。在某些情况下,人类受试者已经接受了利用抗cd20疗法进行的治疗。在某些情况下,抗cd20疗法包括用抗cd20抗体(例如利妥昔单抗)进行治疗。
如本文所提供的,抗cd37免疫缀合物可以药物组合物的形式施用。在某些情况下,药物组合物包含抗cd37免疫缀合物(例如,debio1562)和药学上可接受的载体。因此,本文提供了在生理上可接受的载体、赋形剂或稳定剂(remington’spharmaceuticalsciences(1990)mackpublishingco.,easton,pa)中施用包含具有所需纯度的抗cd37免疫缀合物(例如debio1562)的药物组合物的方法。可接受的载体、赋形剂或稳定剂在使用的剂量和浓度下对接受者无毒。(参见,例如,gennaro,remington:thescienceandpracticeofpharmacywithfactsandcomparisons:drugfactsplus,20thed.(2003);anseletal.,pharmaceuticaldosageformsanddrugdeliverysystems,7thed.,lippencottwilliamsandwilkins(2004);kibbeetal.,handbookofpharmaceuticalexcipients,3rded.,pharmaceuticalpress(2000))。用于体内施用的组合物可以是无菌的。这通过例如无菌过滤膜过滤很容易实现。
在某些情况下,本文提供了施用包含抗cd37免疫缀合物(例如debio1562)的药物组合物的方法,其中所述药物组合物中的抗cd37免疫缀合物每抗体或抗原结合片段包含1-10个美登木素。在某些情况下,药物组合物中的抗cd37免疫缀合物每个抗体或其抗原结合片段包含2-8个美登木素。
在某些情况下,本文提供了施用包含抗cd37免疫缀合物(例如debio1562)的药物组合物的方法,其中所述药物组合物中的抗cd37免疫缀合物每个抗体或抗原结合片段平均包含2-6个美登木素。在某些情况下,药物组合物中的抗cd37免疫缀合物每个抗体或其抗原结合片段平均包含2-5个美登木素。在某些情况下,药物组合物中的抗cd37免疫缀合物每个抗体或其抗原结合片段平均包含3-4个美登木素。在某些情况下,药物组合物中的抗cd37免疫缀合物每个抗体或其抗原结合片段平均包含3.5个美登木素。
在某些情况下,所述方法还包括向患者施用皮质类固醇。在某些情况下,皮质类固醇可以选自泼尼松、泼尼松龙、甲泼尼龙、倍氯米松、倍他米松、地塞米松、氟氢可的松、氢化可的松和曲安西龙。在某些情况下,皮质类固醇可以是地塞米松。在某些情况下,皮质类固醇可以作为预治疗剂施用,即在施用抗cd37免疫缀合物(例如,debio1562)之前施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中以及在施用抗cd37免疫缀合物(例如,debio1562)后的约1天至约5天的至少一个另外的时间施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中以及在施用抗cd37免疫缀合物(例如,debio1562)后的约1天至约4天的至少一个另外的时间施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中以及在施用抗cd37免疫缀合物(例如,debio1562)后的约1天至约3天的至少一个另外的时间施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中以及在施用抗cd37免疫缀合物(例如,debio1562)后约1天至后约2天的至少一个另外的时间施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中以及在施用抗cd37免疫缀合物(例如,debio1562)后约2天至后约5天的至少一个另外的时间施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中以及在施用抗cd37免疫缀合物(例如,debio1562)后的约2天至约4天的至少一个另外的时间施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中以及在施用抗cd37免疫缀合物(例如,debio1562)后的约2天至约3天的至少一个另外的时间施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中以及在施用抗cd37免疫缀合物(例如,debio1562)后的约2天和约3天施用。在某些情况下,皮质类固醇可以在施用抗cd37免疫缀合物(例如,debio1562)的过程中以及在施用抗cd37免疫缀合物(例如,debio1562)后的约2天和约3天施用。在某些情况下,皮质类固醇可以通过周围输注(peri-infusion)来施用。在某些情况下,在施用抗cd37免疫缀合物(例如,debio1562)之前30至60分钟施用皮质类固醇。在某些情况下,在施用抗cd37免疫缀合物(例如,debio1562)之前30至60分钟,以及在施用抗cd37免疫缀合物(例如,debio1562)后的第1至3天的至少一个另外的时间施用皮质类固醇。发现周围静脉输注皮质类固醇消除了血液学不利影响。在某些情况下,在输注后的第2天和第3天中的至少一天施用皮质类固醇。
在某些情况下,皮质类固醇通过iv施用。在某些情况下,类固醇是口服施用。
在某些情况下,在施用抗cd37免疫缀合物(例如,debio1562)之前30-60分钟静脉内施用皮质类固醇,并且在3周的抗cd37免疫缀合物施用周期的第2天和第3天口服施用皮质类固醇。
在某些情况下,待施用的皮质类固醇可以是地塞米松。在某些情况下,待施用的皮质类固醇可以是甲泼尼龙。在某些情况下,待施用的皮质类固醇可以是泼尼松龙。
在某些情况下,施用约5mg至约10mg地塞米松。在某些情况下,施用约8mg至约10mg地塞米松。在某些情况下,施用约10mg地塞米松。在某些情况下,施用约8mg地塞米松。在某些情况下,在施用抗cd37免疫缀合物(例如,debio1562)之前30至60分钟通过静脉内施用约10mg地塞米松。在某些情况下,在施用抗cd37免疫缀合物(例如,debio1562)时以及再次在施用抗cd37免疫缀合物(例如,debio1562)之后约1至约5天,通过静脉内施用约10mg地塞米松。在某些情况下,在施用抗cd37免疫缀合物(例如,debio1562)之前30-60分钟通过静脉内施用皮质类固醇,并且在输注后的第2天和第3天口服递送一剂8mg的地塞米松。
在某些情况下,在施用抗cd37免疫缀合物(例如,debio1562)之前30至60分钟静脉内施用10mg地塞米松,并且在3周抗cd37免疫缀合物施用周期的第2天和第3天口服施用8mg地塞米松。
在某些情况下,所述方法还包括向患者施用生长因子。施用白细胞生长因子的方法综述于例如smith等人,j.clin.oncol.24:3187-3205(2006)中,其通过引用整体并入本文。生长因子治疗可以降低中性粒细胞减少症的可能性。在某些情况下,生长因子可以是粒细胞集落刺激因子(g-csf)。在某些情况下,生长因子可以是粒细胞-巨噬细胞集落刺激因子(gm-csf)。在某些情况下,生长因子可以是巨噬细胞集落刺激因子(m-csf)。在某些情况下,生长因子可以是非格司亭(filgrastim)。在某些情况下,生长因子可以是聚乙二醇化的,例如聚乙二醇化的g-csf。在某些情况下,生长因子可以是培非格司亭(pegfilgrastim),其以商品名
在某些情况下,生长因子可以作为预治疗剂施用,即在施用抗cd37免疫缀合物(例如,debio1562)之前施用。在某些情况下,按3周(约21天)的周期施用抗cd37免疫缀合物(例如,debio1562),并且可以在3周(约21天)的周期期间的任何时间点施用生长因子。在某些情况下,抗cd37免疫缀合物(例如,debio1562)按3周(约21天)的周期施用,并且生长因子可以在3周(约21天)的周期的早期至中期循环施用。在某些情况下,可以在3周(约21天)的周期的第1天至约第21天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的第1天至约第20天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的第1天至约第19天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的第1天至约第18天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的第1天至约第17天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的第1天至约第16天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的第1天至约第14天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的第1天至约第12天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的约第15天至约第21天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的约第3天至约第10天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的约第3天至约第10天施用生长因子至少2次。在某些情况下,可以在3周(约21天)的周期的约第3天至约第10天施用生长因子至少3次。在某些情况下,可以在3周(约21天)的周期的约第4天至约第10天的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的约第5天至约第8天的至少一天中施用生长因子。在某些情况下,可以在选自3周(约21天)周期的第5天,第6天和第8天中的至少一天中施用生长因子。在某些情况下,可以在3周(约21天)的周期的第5、6和8天施用生长因子。
在某些情况下,在施用该生长因子的每天,g-csf以约1μg/kg体重至约15μg/kg体重的剂量施用。在某些情况下,g-csf以约5μg/kg/天的剂量施用。在某些情况下,g-csf以约10μg/kg/天的剂量施用。
在某些情况下,g-csf以每天约200μg至约600μg的剂量施用。在某些情况下,g-csf以每天约300μg至约500μg的剂量施用。在某些情况下,g-csf以每天约300μg至约480μg的剂量施用。在某些情况下,g-csf以约300μg/天的剂量施用。在某些情况下,g-csf以约400μg/天的剂量施用。在某些情况下,g-csf以约480μg/天的剂量施用。在某些情况下,g-csf以约500μg/天的剂量施用。
在某些情况下,gm-csf在施用该生长因子的每一天以约100μg/m2至约500μg/m2的剂量施用。在某些情况下,gm-csf以约250μg/m2/天的剂量施用。
在某些情况下,gm-csf以每天约200μg至约600μg的剂量施用。在某些情况下,gm-csf以每天约300μg至约500μg的剂量施用。在某些情况下,gm-csf以每天约300μg至约480μg的剂量施用。在某些情况下,gm-csf以约300μg/天的剂量施用。在某些情况下,g-csf以约400μg/天的剂量施用。在某些情况下,gm-csf以约480μg/天的剂量施用。在某些情况下,gm-csf以约500μg/天的剂量施用。
在某些情况下,培非格司亭以每周期约6mg的剂量施用。在某些情况下,培非格司亭以每周期约10μg/kg至约500μg/kg的剂量施用。在某些情况下,培非格司亭以每周期约10μg/kg至约400μg/kg的剂量施用。在某些情况下,培非格司亭以每周期约50μg/kg至约300μg/kg的剂量施用。在某些情况下,培非格司亭以每周期约50μg/kg至约200μg/kg的剂量施用。在某些情况下,培非格司亭以每周期约50μg/kg至约150μg/kg的剂量施用。在某些情况下,培非格司亭以每个周期约100μg/kg的剂量施用。
在某些情况下,对于剂量给药方案,皮质类固醇和/或g-csf的施用使得能施用较高的剂量。在某些情况下,患者由于皮质类固醇和/或g-csf的施用而更长时间地停留在治疗阶段。在某些情况下,由于施用皮质类固醇和/或g-csf,观察到较少的嗜中性白血球减少症。在某些情况下,由于施用皮质类固醇和/或g-csf,观察到更多的临床有益效果。
本公开的实施方案通过参考以下非限制性实施例而进一步定义,这些实施例详细描述了本公开的某些抗体的制备和使用本公开的抗体的方法。对本领域的技术人员将显而易见的是,可在不脱离本公开的范围的情况下对材料和方法两者进行许多改变。
实施例
应当理解,本文所述的实施例和实施方案仅是用于说明的目的,并且将教导本领域的技术人员对其作出的各种修改或更改,而这些修改或更改也将包括在本申请的精神和范围内。
实施例1:每周给药方案的设计
设计了debio1562的每周给药方案,以改善安全性并优化肿瘤对debio1562的暴露持续时间,以提高疗效。
基于先前研究中收集到的所有药代动力学(pk)、药效学(pd)和安全性数据,设计了一种建模算法,其可以进行给药方案模拟。与每三周施用相比,在不同的每周给药方案下患者中debio1562药物浓度的模拟如图1-5所示。每个场景(scenario)进行了1000次模拟,模拟结果总结为平均值和90%的预测间隔。模拟进行了6个治疗周期。与3周方案相比,模拟显示,这些debio1562的每周给药方案应在每个三周周期内延长cd37受体对debio1562的暴露并降低cmax(如果cmax太高,则其可能与毒性相关)。
作为此类每周剂量方案的一个示例,预计每个周期的第1、2和3周分别为0.4/0.2/0.2mg/kg(三周内累计0.8mg/kg)可优化debio1562对dlbcl患者的收益-风险。
关于安全性,三周内的总剂量不会超过1mg/kg,其先前被确定为1期的debio1562(无g-csf)的最大耐受剂量(mtd)。还值得请注意,在1期研究中,以0.2-0.4mg/kg剂量单次q3w给药期间,大多数患者的中性粒细胞计数均未降低。因此,以0.4/0.2/0.2mg/kg(与375mg/m2的利妥昔单抗q3w联合使用)更频繁的qw给药方案不应增加中性粒细胞减少症的风险。
关于功效:在单一疗法的1期研究中,从观察到的cmax得出的“理论”受体占有率(ro)值表明,即使在低剂量水平下,cd37位点的饱和度也有望达到>>95%(平均介于96.2%和99.9%之间)。因此,预期0.4mg/kg的负荷剂量,随后每周两次0.2mg/kg的剂量,将在3周周期内提供足够的目标饱和度。
因此,预计更频繁的给药可以延长与375mg/m2的利妥昔单抗的3周一次(q3w)给药联合的debio1562的协同效应和效应物介导的活性,从而提高疗效。
实施例2:debio1562(qw)与利妥昔单抗联合治疗复发或难治性dlbcl患者的研究。
已开始并进行了一项2期临床试验,其包括实施例1中研发的每周debio1562给药方案(与375mg/m2的q3w利妥昔单抗联合使用),以确认debio1562与利妥昔单抗联合在患有复发性和/或难治性弥漫性大b细胞淋巴瘤(dlbcl)和其他形式的非霍奇金淋巴瘤(nct02564744)的患者中的功效和耐受性。试验包括3个部分。第1部分是安全试运行,其中招募了经保荐人批准的被诊断为r/rdlbcl、滤泡性淋巴瘤(fl)、边缘区淋巴瘤/粘膜相关淋巴组织(mzl/malt)、套细胞淋巴瘤(mcl)或其他nhl亚型的约15例患者。第2部分是每三周一次(q3w)和每周一次(qw)施用debio1562的安全性和有效性的初步评估。招募了约30名诊断为复发性dlbcl的患者。第3部分是扩展期,其中招募了另外30例诊断为复发性dlbcl的患者。
研究设计
在第1部分中,参加dlbcl、fl、mcl、mzl/malt或其他nhl亚型的患者的安全检查。至少招募了6名dlbcl和6名flnhl患者。每三周(q3w)在同一天(即第1天)对患者静脉(iv)内给予debio1562和利妥昔单抗一次。先给予剂量为0.7mg/kg的debio1562,随后为375mg/m2的利妥昔单抗。在审查安全性和pk数据之后,将以0.7mg/kg剂量的imgn或更高剂量(1.0mg/kg)或更低剂量的debio1562继续q3w给药方案。
在第2部分中,对q3w和qw给药方案的安全性和有效性进行初步评估,根据debio1562的给药方案,将复发性dlbcl的患者招募到两个平行的群组中:群组a(21天治疗周期,q3w给药方案)和群组b(21天治疗周期,每周一次[qw]给药方案)。群组a中的患者在q3w给药方案的同一天(第1天)接受debio1562和利妥昔单抗iv。服用剂量为0.7mg/kg的debio1562(随后是375mg/m2的利妥昔单抗)。群组b接受debio1562的qw给药方案:在21天治疗周期的第1天、第8天和第15天分别向患者静脉注射0.4、0.2和0.2mg/kg的debio1562。利妥昔单抗在每个治疗周期的第1天以375mg/m2的剂量静脉内给药(在imgn529之后)。两个群组中的患者将接受最多六个21天周期的治疗。
在第3部分中,招募了扩大的另外的复发性dlbcl患者。患者用六个21天周期的q3w和/或qwdebio1562联合利妥昔单抗治疗。
在所有部分中,抗肿瘤活性均通过卢加诺分类法(luganoclassification)进行评估。
在所有部分中,患者均接受类固醇预防。在接受debio1562和利妥昔单抗之前,以iv方式给予患者8mg(或同等剂量)的地塞米松,以po或iv方式给予325-650mg的对乙酰氨基酚和抗组胺药(例如25-50mg苯海拉明或等效物),在约30-60分钟后输注debio1562。在输注后第2天和第3天,还指示患者以8mg/天的剂量口服地塞米松。如果需要,还可以使用粒细胞集落刺激因子支持物治疗患者,以减轻中性粒细胞减少症。
患者
根据2008年世界卫生组织(who)分类,成人(≥18岁)患者在组织病理学上已确认复发和/或难治性dlbcl、fl、mzl/malt、mcl或其他nhl亚型。根据国际淋巴瘤工作组指南(internationalworkinggroupguidelinesforlymphoma),患者已接受不超过六种先前的治疗方案,并且具有可评估或可测量的疾病。患者的ecog绩效状态为0-2。
对于研究的第2部分和第3部分,患者具有组织病理学和临床证实的复发性dlbcl诊断。如果患者在其第一线治疗后显示出至少24周的缓解持续时间,则被视为患有复发性疾病。
没有患者患有cll或sll。在参与的14天内,没有患者接受过先前的抗cd36治疗或抗cd20单克隆抗体治疗。
安全性和药代动力学评估
在整个研究过程中,持续监测不良事件。不良事件包括通过在临床研究的任何阶段中发生的物理、体征、症状或实验室变化所指示的解剖、生理或代谢功能的任何有害、病理性或意外变化,无论是否与研究药物相关。评估的pk参数包括但不限于:cmax、tmax、末端半衰期(t1/2)、vss、cl、auc0-t、aucinf。这些将来源于debio1562、总和/或裸露的人源化cd37抗体(hucd37-3)、dm1(游离和结合)以及潜在的分解代谢产物和总利妥昔单抗的血浆浓度。
效能评估
确定每位可评估患者的最佳总体缓解(or)为cr、pr、稳定疾病(sd)或复发性疾病/pd。总体缓解速率(orr)通过剂量群组和发生缓解的剂量以及95%置信区间(ci)制成表格。为了满足可评估缓解的定义,患者必须在基线时经历了放射线照相评估,至少接受一剂debio1562和利妥昔单抗,并且必须接受至少一剂给药后肿瘤评估。使用kaplan-meier方法分析一年时的总生存期(os)。中位数os和95%ci(如果可行的话)。对所有达到客观缓解(pr或cr)的可评估患者,估计缓解持续时间(dor)。使用kaplan-meier方法分析六个月和一年的无进展生存期(pfs)。
将qw给药方案的暴露量、cmax、功效和安全性与q3w方案进行比较。
实施例3:在q3w和qw给药方案中对debio1562药代动力学和药效学的研究
对来自实施例2中的群组a和群组b的受试者进行了药代动力学和药效学研究。在该周期的几个时间点取血,并将其用于药代动力学测量。
初步结果显示,暴露率(cmax)近似于q3w给药方案和qw给药方案之间的剂量比例(图6)。但令人惊讶的是,以qw给药方案的曲线下面积(auc)为特征的血浆中三周周期的暴露程度与q3w给药方案的相似(图6)。这是令人惊讶的,因为即使三周内施用的总剂量大致相同(q3w为0.7mg/kg,相比而言,qw为0.4+0.2+0.2=0.8mg/kg),以前的报告发现debio1562的清除率在低剂量(例如0.4mg/kg和0.2mg/kg)下显著更高,并且半衰期更低(参见stathis等人,investnewdrugs36:869-876(2018))。但是,按照群组b方案施用这样较低的剂量并没有导致暴露量(auc)的大幅降低。此外,clast(在下一次debio1562施用之前的一个周期中测量的最后debio1562浓度)表明,qw给药方案在整个3周周期内都可以维持比q3w给药方案更高的debio1562浓度(图6)。
该数据表明,将每3周一次的剂量分成三个每周一次的剂量具有暴露益处。尽管两种给药方案均保持暴露程度(auc),但qw方案中较高的clast表示qw给药方案在整个3周周期内均维持了较高的肿瘤细胞平均浓度压力。例如,当与抗cd20疗法组合时,这有望提高debio1562的功效。此外,qw方案的cmax低于q3w方案,表明qw施用不会增加不良反应的风险。
在从群组a和b的受试者获得的样本上,测量在cd19+b,cd3+t和cd56+nk细胞上debio1562的受体占有率(ro)。由于b细胞的快速耗竭,对该特异性淋巴细胞的ro评估是不可能的。在群组a和群组b中,cd3+t和cd56+nk淋巴细胞群上表达的cd37分子的80%以上是由debio1562在施用后迅速占用的c1d1(第1周期-第1剂量)。对于两个群组,在c1d2(第1周期-第2剂量)和c1d3处观察到的最大ro均大于90%。在所分析的患者中,在第2周期和第3周期重新施用debio1562之前收集的样品中未观察到ro。因此,在两个群组中均观察到快速(c1d1)和完全(>80%)ro,两者之间无明显差异。图7显示了cd3+细胞在第1、2和3周期的初步个体ro测量。
药代动力学和ro数据表明,将q3w剂量分成每周一次施用(qw)不会危害暴露量或目标达到率。每周施用可以在3周周期内(例如与利妥昔单抗联合使用时)维持携带cd37的细胞的“暴露压力”。
还比较了对debio1562有不同反应的患者的药代动力学暴露(图8)。qw方案的初步缓解率似乎更高。qw方案的完全缓解者(cr)的暴露(auc)高于q3w方案的cr。同时,在qw方案和q3w方案中,安全性相当。
总而言之,这些结果表明,与每三周施用一次相比,在三周周期内每周一次地分次施用debio1562会导致每三周周期较低的暴露率(cmax)、相似的暴露程度(auc)和对肿瘤细胞的浓度压力(clast)升高。
****
应当意识到,具体实施方式部分而不是发明内容和说明书摘要部分旨在用于解释权利要求书。如本发明人所设想的,发明内容和说明书摘要部分阐述本发明的一个或多个而非全部示例性实施方案,并因此不旨在以任何方式限制本发明和所附权利要求书。
上面借助示出了实施指定功能及其关系的功能性构造块来描述了本发明。为了方便描述,这些功能性构造块的边界在本文中任意地限定。可以限定替代边界,只要适当地执行指定的功能及其关系即可。
前述具体实施方案的说明因此将全面揭示本发明的一般性质,他人可通过应用本技术领域内的知识不用过度实验在不脱离本发明的一般构思的情况下容易地对此类具体实施方案进行修改和/或使其适应于各种应用。因此,基于本文提供的教导和指导,此类适应和修改旨在落在所公开的实施方案的等效形式的含义和范围内。应当理解,本文的用语或术语是用于说明性目的而非限制性目的,使得本说明书的术语或用语将由技术人员按照教导和指导进行解读。
本发明的宽度和范围不应由任何上述示例性实施方案限制,而是应当根据以下权利要求书及其等效形式加以限定。
序列表
<110>德彪发姆国际有限公司
<120>抗cd37免疫缀合物给药方案
<130>4018.009pc01/eks/cld/m-s
<150>us62/677,782
<151>2018-05-30
<160>14
<170>patentin版3.5
<210>1
<211>280
<212>prt
<213>人工序列
<220>
<223>人cd37
<400>1
metseralaglnglusercysleuserleuilelystyrpheleuphe
151015
valpheasnleuphephephevalleuglyserleuilephecysphe
202530
glyiletrpileleuileasplysthrserphevalserphevalgly
354045
leualaphevalproleuglniletrpserlysvalleualaileser
505560
glyilephethrmetglyilealaleuleuglycysvalglyalaleu
65707580
lysgluleuargcysleuleuglyleutyrpheglymetleuleuleu
859095
leuphealathrglnilethrleuglyileleuileserthrglnarg
100105110
alaglnleugluargserleuargaspvalvalglulysthrilegln
115120125
lystyrglythrasnproglugluthralaalagluglusertrpasp
130135140
tyrvalglnpheglnleuargcyscysglytrphistyrproglnasp
145150155160
trppheglnvalleuileleuargglyasnglyserglualahisarg
165170175
valprocyssercystyrasnleuseralathrasnaspserthrile
180185190
leuasplysvalileleuproglnleuserargleuglyhisleuala
195200205
argserarghisseralaaspilecysalavalproalagluserhis
210215220
iletyrarggluglycysalaglnglyleuglnlystrpleuhisasn
225230235240
asnleuileserilevalglyilecysleuglyvalglyleuleuglu
245250255
leuglyphemetthrleuserilepheleucysargasnleuasphis
260265270
valtyrasnargleualatyrarg
275280
<210>2
<211>5
<212>prt
<213>人工序列
<220>
<223>vh-cdr1
<400>2
thrserglyvalser
15
<210>3
<211>9
<212>prt
<213>人工序列
<220>
<223>vh-cdr2
<400>3
valiletrpglyaspglyserthrasn
15
<210>4
<211>7
<212>prt
<213>人工序列
<220>
<223>vh-cdr3
<400>4
glyglytyrserleualahis
15
<210>5
<211>11
<212>prt
<213>人工序列
<220>
<223>vl-cdr1
<400>5
argalasergluasnileargserasnleuala
1510
<210>6
<211>7
<212>prt
<213>人工序列
<220>
<223>vl-cdr2
<400>6
valalathrasnleualaasp
15
<210>7
<211>9
<212>prt
<213>人工序列
<220>
<223>vl-cdr3
<400>7
glnhistyrtrpglythrthrtrpthr
15
<210>8
<211>115
<212>prt
<213>人工序列
<220>
<223>hucd37-3(版1.0)vh
<400>8
glnvalglnvalglngluserglyproglyleuvalalaprosergln
151015
thrleuserilethrcysthrvalserglypheserleuthrthrser
202530
glyvalsertrpvalargglnproproglylysglyleuglutrpleu
354045
glyvaliletrpglyaspglyserthrasntyrhisproserleulys
505560
serargleuserilelyslysasphisserlysserglnvalpheleu
65707580
lysleuasnserleuthralaalaaspthralathrtyrtyrcysala
859095
lysglyglytyrserleualahistrpglyglnglythrleuvalthr
100105110
valserser
115
<210>9
<211>115
<212>prt
<213>人工序列
<220>
<223>hucd37-3(版1.1)vh
<400>9
glnvalglnvalglngluserglyproglyleuvalalaprosergln
151015
thrleuserilethrcysthrvalserglypheserleuthrthrser
202530
glyvalsertrpvalargglnproproglylysglyleuglutrpleu
354045
glyvaliletrpglyaspglyserthrasntyrhisserserleulys
505560
serargleuserilelyslysasphisserlysserglnvalpheleu
65707580
lysleuasnserleuthralaalaaspthralathrtyrtyrcysala
859095
lysglyglytyrserleualahistrpglyglnglythrleuvalthr
100105110
valserser
115
<210>10
<211>108
<212>prt
<213>人工序列
<220>
<223>hucd37-3vl
<400>10
aspileglnmetthrglnserproserserleuservalservalgly
151015
gluargvalthrilethrcysargalasergluasnileargserasn
202530
leualatrptyrglnglnlysproglylysserprolysleuleuval
354045
asnvalalathrasnleualaaspglyvalproserargphesergly
505560
serglyserglythrasptyrserleulysileasnserleuglnpro
65707580
gluasppheglythrtyrtyrcysglnhistyrtrpglythrthrtrp
859095
thrpheglyglnglythrlysleugluilelysarg
100105
<210>11
<211>444
<212>prt
<213>人工序列
<220>
<223>hucd37-3(版1.0)全长重链
<400>11
glnvalglnvalglngluserglyproglyleuvalalaprosergln
151015
thrleuserilethrcysthrvalserglypheserleuthrthrser
202530
glyvalsertrpvalargglnproproglylysglyleuglutrpleu
354045
glyvaliletrpglyaspglyserthrasntyrhisproserleulys
505560
serargleuserilelyslysasphisserlysserglnvalpheleu
65707580
lysleuasnserleuthralaalaaspthralathrtyrtyrcysala
859095
lysglyglytyrserleualahistrpglyglnglythrleuvalthr
100105110
valserseralaserthrlysglyproservalpheproleualapro
115120125
serserlysserthrserglyglythralaalaleuglycysleuval
130135140
lysasptyrpheprogluprovalthrvalsertrpasnserglyala
145150155160
leuthrserglyvalhisthrpheproalavalleuglnsersergly
165170175
leutyrserleuserservalvalthrvalproserserserleugly
180185190
thrglnthrtyrilecysasnvalasnhislysproserasnthrlys
195200205
valasplyslysvalgluprolyssercysasplysthrhisthrcys
210215220
proprocysproalaprogluleuleuglyglyproservalpheleu
225230235240
pheproprolysprolysaspthrleumetileserargthrproglu
245250255
valthrcysvalvalvalaspvalserhisgluaspprogluvallys
260265270
pheasntrptyrvalaspglyvalgluvalhisasnalalysthrlys
275280285
proargglugluglntyrasnserthrtyrargvalvalservalleu
290295300
thrvalleuhisglnasptrpleuasnglylysglutyrlyscyslys
305310315320
valserasnlysalaleuproalaproileglulysthrileserlys
325330335
alalysglyglnproarggluproglnvaltyrthrleuproproser
340345350
argaspgluleuthrlysasnglnvalserleuthrcysleuvallys
355360365
glyphetyrproseraspilealavalglutrpgluserasnglygln
370375380
progluasnasntyrlysthrthrproprovalleuaspseraspgly
385390395400
serphepheleutyrserlysleuthrvalasplysserargtrpgln
405410415
glnglyasnvalphesercysservalmethisglualaleuhisasn
420425430
histyrthrglnlysserleuserleuserprogly
435440
<210>12
<211>214
<212>prt
<213>人工序列
<220>
<223>hucd37-3全长轻链
<400>12
aspileglnmetthrglnserproserserleuservalservalgly
151015
gluargvalthrilethrcysargalasergluasnileargserasn
202530
leualatrptyrglnglnlysproglylysserprolysleuleuval
354045
asnvalalathrasnleualaaspglyvalproserargphesergly
505560
serglyserglythrasptyrserleulysileasnserleuglnpro
65707580
gluasppheglythrtyrtyrcysglnhistyrtrpglythrthrtrp
859095
thrpheglyglnglythrlysleugluilelysargthrvalalaala
100105110
proservalpheilepheproproseraspgluglnleulyssergly
115120125
thralaservalvalcysleuleuasnasnphetyrproarggluala
130135140
lysvalglntrplysvalaspasnalaleuglnserglyasnsergln
145150155160
gluservalthrgluglnaspserlysaspserthrtyrserleuser
165170175
serthrleuthrleuserlysalaasptyrglulyshislysvaltyr
180185190
alacysgluvalthrhisglnglyleuserserprovalthrlysser
195200205
pheasnargglyglucys
210
<210>13
<211>121
<212>prt
<213>人工序列
<220>
<223>利妥昔单抗可变重链
<400>13
glnvalglnleuglnglnproglyalagluleuvallysproglyala
151015
servallysmetsercyslysalaserglytyrthrphethrsertyr
202530
asnmethistrpvallysglnthrproglyargglyleuglutrpile
354045
glyalailetyrproglyasnglyaspthrsertyrasnglnlysphe
505560
lysglylysalathrleuthralaasplysserserserthralatyr
65707580
metglnleuserserleuthrsergluaspseralavaltyrtyrcys
859095
alaargserthrtyrtyrglyglyasptrptyrpheasnvaltrpgly
100105110
alaglythrthrvalthrvalserala
115120
<210>14
<211>106
<212>prt
<213>人工序列
<220>
<223>利妥昔单抗可变轻链
<400>14
glnilevalleuserglnserproalaileleuseralaserprogly
151015
glulysvalthrmetthrcysargalaserserservalsertyrile
202530
histrppheglnglnlysproglyserserprolysprotrpiletyr
354045
alathrserasnleualaserglyvalprovalargpheserglyser
505560
glyserglythrsertyrserleuthrileserargvalglualaglu
65707580
aspalaalathrtyrtyrcysglnglntrpthrserasnproprothr
859095
pheglyglyglythrlysleugluilelys
100105
- 还没有人留言评论。精彩留言会获得点赞!