免疫提取物及生产方法与流程
1.本发明涉及从包含燕窝原料和任选的其他材料的混合物中制备免疫提取物的方法,以及可从这些方法获得的提取物。
背景技术:
2.可食用燕窝(ebn)是由东南亚地区天然存在的金丝燕的唾液制成的巢。这些被遗弃的鸟巢是从野外或从专门为金丝燕建造的房屋中收获的。据报道,ebn表现出多种生物活性和营养价值,包括促有丝分裂反应的潜能、表皮生长因子(egf)样活性、抗流感病毒、血细胞凝集抑制活性、凝集素结合活性、改善骨强度和真皮厚度以及激素水平。根据应用,ebn的加工可以不同。为了阐明可食用燕窝的生物学功能和医学功能,人们正在进行研究。
3.目前,ebn是以汤或其他饮品的形式使用的,通过将ebn于水中煮沸并食用。在这种情况下,ebn的分子是人体很难消化和吸收的大的生物大分子。因此,以这种方式制备的ebn的有益成分的生物利用度低,且ebn的有益效果没有被最大化。
4.然而,食用整个ebn可能会导致免疫球蛋白e(ige)介导的过敏反应(goh等人,2001,j.allergy clin.immun.,107(6),1082
–
1088),并且ebn被认为是食物诱发过敏反应的最常见原因,这种过敏反应在儿童中可能危及生命。
5.粗ebn的另一问题是由于自然原因或加工期间有意添加而存在不良化合物。ebn的掺杂通常会降低ebn的质量。使用的掺杂物包括猪皮、琼脂、红海藻和卡拉亚胶。为了掩盖掺杂物和废物,经常添加漂白剂。
6.尤其值得关注的是亚硝酸盐的存在,其主要来源于金丝燕的粪便。亚硝酸盐也可能在加工期间被添加到白色燕窝中,以使其变成更具有商业价值的红色燕窝。过量亚硝酸盐的摄入已经与癌症相关联(bryan等人,food chem.toxicol.2012,50(10),3646
‑
3654)。
7.病毒、细菌和真菌可能在野外或在工厂中在加工期间污染ebn。对野生鸟类禽流感的担忧可能导致整个ebn本身的进口受到限制。
8.因此,需要改进ebn的加工,以提高整体质量和对消费者有益的性质。通过从ebn中提取和分离所需的化合物,避免或最小化有害影响,同时最大化ebn的治疗效益。
9.此外,生物活性分子,如调理素、补体蛋白、凝集素、纤胶凝蛋白(ficolin)、胶原凝集素和正五聚蛋白,主要是从动物部分或在生物反应器中克隆的遗传修饰微生物中提取的。对于提取的产物的纯度和产量以及安全性方面缺乏一致性标准。本文所述的工艺解决了安全性和可持续性问题,因为可食用燕窝(ebn)或含有雪蛤膏(hasma)或珊瑚海藻(coral seaweed)的ebn混合物是此类生物活性因子的非常丰富且大量的来源。
10.在本说明书中列出或讨论明显在先公布的文件不一定被视为承认该文件是本领域现有技术的一部分或是公知常识。
11.本文提及的任何文件均通过援引在此整体并入本文。
技术实现要素:
12.在本发明的第一方面中,提供了从可食用燕窝中制备提取物的方法,该方法包括:制备可食用燕窝(ebn)混合物;以及将该混合物与提取溶液接触以结合该混合物中的分子,其中该提取溶液包括至少一种结合部分,该结合部分选自包括以下的组:调理素结合部分、补体蛋白结合部分、凝集素结合部分、纤胶凝蛋白结合部分、胶原凝集素结合部分和正五聚蛋白结合部分。
13.术语“接触”是指ebn混合物和提取溶液的成分相互作用,优选地,该相互作用应导致结合部分和靶标分子之间形成可逆的键。
14.术语“结合部分”是指任何分子和/或官能团,其选择性地靶向并结合于感兴趣的分子。例如,调理素结合部分是结合于调理素分子的任何分子。合适的结合部分的实例可包括抗体、抗体片段、抗体模拟物、具有受体的细胞以及模拟受体的结合功能的分子。例如,“凝集素结合部分”可以是在细胞表面表达凝集素结合受体的细胞,等等。在其他实例中,“凝集素结合部分”包括结合凝集素的抗体,或抗体、抗体片段或抗体模拟物的凝集素(抗原)结合位点,等等。结合部分应优选地结合于k
d
在微摩尔或更低区域中的分子。例如,结合部分可结合于具有小于10
‑4、10
‑5、10
‑6、10
‑7、10
‑8、10
‑9、10
‑
10
、10
‑
11
、10
‑
12
或更小的k
d
的分子。k
d
值越低,结合亲和力越强。提取溶液的结合部分优选地能够以是其结合于其他非靶标分子的亲和力的至少二倍、10倍、50倍、100倍或更大的亲和力结合于其靶标。
15.要使用的结合部分可以是天然存在的、半合成的或合成的,例如可以使用能够促进将结合部分从ebn混合物中分离的带标签的结合部分。此外,用于提取靶标分子的结合部分可以结合于固体支撑体。该固体支撑体可由铁磁性材料或常规惰性支撑材料制成。该结合部分可以是商购的,并且可以这样使用。如果需要对结合部分进行修饰,则有许多如文献中通常所知的方法来修饰以获得所需的特性。
16.图9示出了具有所需受体的细胞可以是如何产生的。在图9图片(a)中,所有的mrna都是从正常表达感兴趣的受体的细胞中提取的,并反转录成双链cdna。整个cdna群体被插入到质粒表达载体中,在强启动子和转录终止子之间。质粒被转染到通常不表达感兴趣受体的细菌细胞中。得到的cdna库被分成多个池,每个包含约1000个不同的cdna。图9的图片(b)进一步示出了,每个池中的质粒被转染到缺乏感兴趣受体的培养细胞(例如,cos细胞)的群体中。含有编码所需受体的cdna的转染细胞才合成它;其他转染细胞产生不相关的蛋白质。为了检测产生所需受体的少数细胞,向含有转染细胞的培养皿中添加特异于该受体的放射性标记配体;将该细胞固定并经受放射自显影。合成特异性受体的阳性细胞将覆盖有许多粒。可替换地,转染的细胞可以用荧光标记的配体处理,并通过荧光激活的细胞分选仪。表达受体的细胞将与荧光标记结合,并与不表达的那些细胞分离。产生阳性信号的质粒cdna池保持在细菌中,并细分为更小的池,每个更小的池通过转染到培养的细胞中而被再次筛选。经过几个周期的筛选和细分阳性cdna池之后,获得了编码所需受体的纯cdna克隆。详细的方法可以在a.aruffo和b.seed,molecular cloning of a cd28 cdna by a high
‑
efficiency cos cell expression system,proc.nat’l.acad.sci.usa,1987,84,8573;以及a.d’andrea、h.f.lodish和g.wong,expression cloning of the murine erythropoietin receptor,cell,1989,vol.57,277中找到,这两个都通过援引并入本文。然后,纯cdna克隆可用于生产具有所需感兴趣受体的细胞。
17.cdna是指互补dna,且是指具有与所需编码多核苷酸(例如rna,尤其是mrna)互补的核苷酸序列的核酸分子。术语“互补”是指多核苷酸的序列能够在整个互补区域内与其他特定的多核苷酸的序列形成沃森和克里克碱基配对。互补碱基通常为a和t(a和u)或c和g。所需编码多核苷酸包括与编码所需多肽的多核苷酸序列具有至少50%、60%、70%、80%、90%、95%或99%同一性的序列。
18.在实例中,结合部分可以是通过在表达系统中表达cdna而产生的蛋白质。表达系统的常见实例包括基于细胞的系统和无细胞系统。基于细胞的系统包括那些源自细菌、酵母、昆虫细胞、哺乳动物细胞和丝状真菌的系统。细菌表达系统的非限制性实例包括大肠杆菌(e.coli)和荧光假单胞菌(p.fluorescens)。真核系统的非限制性实例包括酵母如酿酒酵母(s.cerevisiae)和毕赤酵母(pichia pastoris),丝状真菌如曲霉菌(aspergillus)、木霉菌(trichoderma)和嗜热真菌(myceliphthora thermophile),感染或不感染杆状病毒的昆虫细胞如来自草地贪夜蛾(spodoptera frugiperda)细胞的sf9和sf21,以及哺乳动物细胞如中国仓鼠卵巢(cho)细胞和人胚胎肾(hek)细胞。蛋白质的无细胞生产也可使用纯化的rna聚合酶、核糖体、trna和核糖核苷酸在体外进行,其可从细胞和/或从基于细胞的表达系统中合成获得。不同的表达系统各有其优点,且表达系统的选择在一定程度上取决于蛋白质的性质和预期用途。例如,如果需要对蛋白质进行翻译后修饰,那么真核系统通常是更好的选择。也可以在表达系统中使用多种细胞来产生蛋白质。通常,表达系统包括附着于蛋白质的亲和标签,以促进表达蛋白的纯化。这些亲和标签与特异性配对配体特异性结合,例如固定在固体支撑体上,使亲和标签和蛋白质结构分离。表达蛋白可以用亲和标签分离,或通过切割亲和标签来释放所需的蛋白。非限制性实例包括his标签和strep标签。his标签强烈结合于二价金属离子如镍和钴,而strep标签则特异性结合于工程化链霉亲和素(链霉抗生物素蛋白,streptavidin)。也可根据需要利用其他纯化方法。
19.如果使用抗体,则抗体可以多种形式存在,包括例如多克隆抗体、单克隆抗体、人源化抗体和人抗体。抗体片段的实例可包括fab、fab'、f(ab’)2、fv、线性抗体、单链(scfv)抗体、单域抗体(sdab)。产生这些结合部分的方法可由任何合适的方法制成。获得抗体的一种方法是用免疫原使合适的宿主动物免疫,并遵循多克隆或单克隆抗体生产的标准程序。免疫原将促进免疫原在细胞表面上的呈现。合适的宿主的免疫可以以多种方式进行。编码多肽或其免疫原性片段的核酸序列可在递送承载体中提供给宿主,该递送承载体由宿主的免疫细胞摄取。该细胞继而将在细胞表面上表达受体,从而在宿主中产生免疫原性反应。可替换地,编码多肽或其免疫原性表面的核酸序列可在体外于细胞中表达,随后分离多肽并将该多肽给药至合适的宿主,在其中产生抗体。可替换地,针对该多肽的抗体可源自抗体噬菌体展示库。噬菌体能够在细菌内感染和繁殖,当与人类抗体基因结合时,其可以被设计成展示人类抗体蛋白。噬菌体展示是使噬菌体在其表面上“展示”人类抗体蛋白的过程。将来自人类抗体基因库的基因插入噬菌体的群体中。每个噬菌体携带不同抗体的基因,并因此在其表面上展示不同的抗体。
20.通过本领域已知的任何方法制成的抗体可进一步从宿主中纯化。抗体纯化方法可包括盐沉淀法、离子交换色谱法、凝胶过滤色谱法和亲和色谱法,例如用蛋白a、蛋白g、羟基磷灰石和抗免疫球蛋白。
21.从工程化表达抗体的杂交瘤细胞可以方便地产生抗体。制造杂交瘤的方法是本领
域公知的。杂交瘤细胞可以在合适的培养基中培养,且用过的培养基可以作为抗体源使用。编码感兴趣抗体的多核苷酸可依次从产生抗体的杂交瘤中获得,并然后可从这些dna序列合成或重组产生抗体。为了产生大量的抗体,通常获得腹水更方便。产生腹水的方法通常包括将杂交瘤细胞注射到原初免疫组织相容性或免疫耐受性哺乳动物尤其是小鼠中。哺乳动物可通过预先给药合适的组合物(例如降植烷(pristane))来准备腹水产生。
22.术语“抗体模拟物”或“抗体模仿物”意为特异性结合抗原但在结构上与抗体无关的分子。典型地,通过筛选诱变分子支架的库来产生特异性结合于靶标的抗体模拟物。分子支架的实例包括但不限于纤维粘连蛋白iii(fn3)结构域。分子支架典型地是比抗体更小的分子(例如约50
‑
200个残基)。抗体模拟物的实例包括但不限于亲和体(affibody)、附属物(affilin)、亲和素(affitin)、抗运载蛋白(anticalin)、亲和力多聚体(avimer)、设计的锚蛋白重复蛋白(darpin)、kunitz结构域衍生肽、打结素(knottin)和单体。单体包括作为分子支架的纤维粘连蛋白iii型结构域(fn3)。单体是从组合库中产生的,其中fn3支架的部分通过利用噬菌体展示和酵母表面展示技术,使用高度定制的氨基酸混合物进行多样化。
23.在本发明的上下文中,术语“凝集素”是一种碳水化合物结合蛋白,且不包括纤胶凝蛋白和胶原凝集素。术语“调理素”是指增强吞噬作用的任何化合物或分子,不包括补体蛋白、凝集素、纤胶凝蛋白、胶原凝集素和正五聚蛋白。
24.优选地,混合物进一步包括海藻和/或雪蛤膏。雪蛤膏(雪蛤(hashima))是由真青蛙输卵管附近的干脂肪组织制成的。海藻或大型藻类是指几种宏观的、多细胞的海洋藻类,且仅包括可食用的那些。可以使用的常见可食用海藻包括红藻、褐藻和绿藻。
25.优选地,调理素结合部分具有约10kda至约750kda的分子量。在实例中,调理素结合部分包括seq id no.1。
26.优选地,补体蛋白结合部分具有约20kda至约7000kda的分子量。补体蛋白结合部分的实例包括约50kda至约7000kda的分子量,以及约20kda至约1000kda的分子量。在实例中,补体蛋白结合部分包括seq id no.2。
27.优选地,凝集素结合部分具有约20kda至约1000kda的分子量。在实例中,凝集素结合部分包括seq id no.3。
28.优选地,纤胶凝蛋白结合部分具有约15kda至约900kda的分子量。在实例中,纤胶凝蛋白结合部分包括seq id no.4。
29.优选地,胶原凝集素结合部分具有约15kda至约900kda的分子量。在实例中,胶原凝集素结合部分包括seq id no.5。
30.优选地,正五聚蛋白结合部分具有约20kda至约1000kda的分子量。在实例中,正五聚蛋白结合部包括seq id no.6。
31.优选地,结合部分是受体蛋白。在实例中,受体蛋白被锚定于细胞或可以以纯化形式被分离。上述结合部分的分子量是指受体蛋白分子量。
32.优选地,所述至少一种结合部分包括选自以下中的任一种:
33.i)凝集素结合部分和调理素结合部分;
34.ii)凝集素结合部分、补体蛋白结合部分、调理素结合部分、纤胶凝蛋白结合部分、胶原凝集素结合部分和正五聚蛋白结合部分;
35.iii)凝集素结合部分、补体蛋白结合部分和调理素结合部分;
36.iv)调理素结合部分和正五聚蛋白结合部分;
37.v)纤胶凝蛋白结合部分、胶原凝集素结合部分和正五聚蛋白结合部分;
38.vi)补体蛋白结合部分、纤胶凝蛋白结合部分和胶原凝集素结合部分;以及
39.vii)凝集素结合部分、调理素结合部分和胶原凝集素结合部分。
40.更优选地,所述至少一种结合部分包括选自以下中的任一种:
41.i)50%至90%的凝集素结合部分和10%至50%的调理素结合部分;
42.ii)10%至30%的凝集素结合部分、10%至30%的补体蛋白结合部分、10%至30%的调理素结合部分、5%至15%的纤胶凝蛋白结合部分、5%至15%的胶原凝集素结合部分和10%至30%的正五聚蛋白结合部分;
43.iii)5%至45%的凝集素结合部分、35%至65%的补体蛋白结合部分和5%至45%调理素结合部分;
44.iv)10%至90%的调理素结合部分和10%至90%的正五聚蛋白结合部分;
45.v)30%至50%的纤胶凝蛋白结合部分、10%至50%的胶原凝集素结合部分和10%至50%的正五聚蛋白结合部分;
46.vi)55%至85%的补体蛋白结合部分、5%至15%的纤胶凝蛋白结合部分和10%至30%的胶原凝集素结合部分;以及
47.vii)5%至15%的凝集素结合部分、10%至30%的调理素结合部分和55%至85%的胶原凝集素结合部分。为各结合部分提供的百分比是各结合部分的重量相对于存在的结合部分的总重量的百分比。因此,结合部分可溶解于溶剂(如水)或缓冲剂中,但所述百分比针对存在的结合部分/多个结合部分。
48.优选地,所述至少一种结合部分包括选自以下中的任一种:
49.i)70%凝集素结合部分和30%调理素结合部分;
50.ii)20%凝集素结合部分、20%补体蛋白结合部分、20%调理素结合部分、20%正五聚蛋白结合部分、10%纤胶凝蛋白结合部分和10%胶原凝集素结合部分;
51.iii)50%补体蛋白结合部分、25%凝集素结合部分和25%调理素结合部分;
52.iv)50%调理素结合部分和50%正五聚蛋白结合部分;
53.v)40%纤胶凝蛋白结合部分、30%胶原凝集素结合部分和30%正五聚蛋白结合部分;
54.vi)10%纤胶凝蛋白结合部分、20%胶原凝集素结合部分和70%补体蛋白结合部分;以及
55.vii)70%胶原凝集素结合部分、20%调理素结合部分和10%凝集素结合部分。
56.优选地,制备ebn混合物包括洗涤该混合物和过滤洗涤后的混合物。
57.更优选地,洗涤步骤包括将混合物暴露于第一酶溶液,以及将混合物和第一酶溶液浸泡在水中。例如,暴露步骤在环境温度下进行约5分钟,且浸泡步骤再进行5分钟。环境温度或室温是指20至30℃范围内的温度。甚至更优选地,第一酶溶液包括亚硝酸盐还原酶。在实施方式中,水是从反渗透过程中获得的。更优选地,洗涤步骤包括在含氧水中洗涤混合物约10分钟,然后是在70℃下约12小时的干燥期。
58.优选地,制备ebn混合物包括在接触步骤之前,特别是在混合物被洗涤之后,将混合物浸入油中。油应该是食用油,即可食用的油如植物油。油的存在可通过确保混合物被油
包围以增加结合部分和靶标分子的亲和力来促进接触步骤。据信油的存在使混合物更被脂类所容许,并与通常与细胞膜(主要是脂质结构)相关的靶标分子相容。
59.优选地,制备ebn混合物包括在接触步骤之前对洗涤的ebn或ebn混合物进行灭菌,任选地在121℃下至少10分钟,例如约10到20分钟。
60.优选地,在抗坏血酸和金纳米颗粒的存在下进行接触步骤。抗坏血酸提供抗氧化性能,而金纳米颗粒提供稳定的非反应性环境。单独地或联合地,抗坏血酸和金纳米颗粒保持并保存提取物混合物的完整性,而对靶标分子的改变最小或没有改变。
61.优选地,在4℃到37℃之间进行接触步骤至少20分钟。例如,接触步骤在25℃到37℃之间进行约20至120分钟。
62.优选地,该方法进一步包括用酸性溶液水解结合的分子。
63.优选地,分离分子包括从混合物中分离至少一种结合部分和结合的分子;释放结合的分子;以及通过透析获得释放的分子。
64.优选地,该方法进一步包括用包括植物蛋白酶和/或水果蛋白酶的第二酶溶液处理透析的分子。
65.优选地,该方法包括以下条件中的至少一种:
66.(a)第二酶溶液的浓度为约10μg/ml至100μg/ml;以及
67.(b)在45℃、ph值6.5至9.0的条件下用第二酶溶液对分离的分子进行处理60分钟,并使第二酶溶液变性,即仅使第二酶溶液中的酶变性,而不使靶标分子变性。
68.优选地,该方法进一步包括干燥该分子。干燥应该在分子被分离后进行,且典型地是通过冷冻干燥以保存分子的质量和性质。
69.在本发明的第二方面中,存在可由第一方面的方法获得的燕窝提取物。在实施方式中,燕窝提取物可进一步包括来自海藻和/或雪蛤膏的提取物。
70.在本发明的第三方面中,存在包括多种分子的燕窝提取物,所述多种分子选自包括以下的至少两个组:调理素、补体蛋白、凝集素、纤胶凝蛋白、胶原凝集素和正五聚蛋白。在实施方式中,燕窝提取物可进一步包括来自海藻和/或雪蛤膏的提取物。
71.优选地,所述多种分子是选自以下中的任一种:
72.i)凝集素和调理素;
73.ii)凝集素、补体蛋白、调理素、纤胶凝蛋白、胶原凝集素和正五聚蛋白;
74.iii)凝集素、补体蛋白和调理素;
75.iv)调理素和正五聚蛋白;
76.v)纤胶凝蛋白、胶原凝集素和正五聚蛋白;
77.vi)补体蛋白、纤胶凝蛋白和胶原凝集素;以及
78.vii)凝集素、调理素和胶原凝集素。
79.更优选地,所述多种分子是选自以下中的任一种:
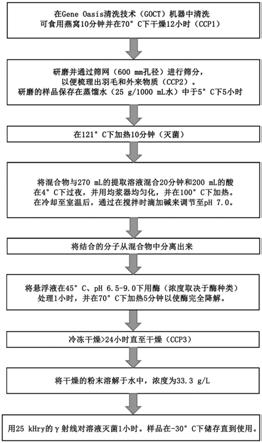
80.i)50%至90%的凝集素和10%至50%的调理素;
81.ii)10%至30%的凝集素、10%至30%的补体蛋白、10%至30%的调理素、5%至15%的纤胶凝蛋白、5%至15%的胶原凝集素和10%至30%的正五聚蛋白;
82.iii)5%至45%的凝集素、35%至65%的补体蛋白和5%至45%的调理素;
83.iv)10%至90%的调理素和10%至90%的正五聚蛋白;
84.v)30%至50%的纤胶凝蛋白、10%至50%的胶原凝集素和10%至50%的正五聚蛋白;
85.vi)55%至85%的补体蛋白、5%至15%的纤胶凝蛋白和10%至30%的胶原凝集素;以及
86.vii)5%至15%的凝集素、10%至30%的调理素和55%至85%的胶原凝集素。
87.为每种类型的分子提供的百分比是每种类型的分子的重量相对于存在的类型的分子的总重量的百分比。
88.更优选地,所述多种分子是选自以下中的任一种:
89.i)70%的凝集素和30%的调理素;
90.ii)20%的凝集素、20%的补体蛋白、20%的调理素、10%的纤胶凝蛋白、10%的胶原凝集素和20%的正五聚蛋白;
91.iii)25%的凝集素、50%的补体蛋白和25%的调理素;
92.iv)50%的调理素和50%的正五聚蛋白;
93.v)40%的纤胶凝蛋白、30%的胶原凝集素和30%的正五聚蛋白;以及
94.vi)70%的补体蛋白、10%的纤胶凝蛋白和20%的胶原凝集素;
95.vii)10%的凝集素、20%的调理素和70%的胶原凝集素。
96.优选地,通过用酸溶液和/或酶溶液处理来水解燕窝提取物。这就把已提取的分子分解成了更容易被身体吸收的更小的分子。在实例中,水解产物包括分子量低于1000道尔顿、750道尔顿、500道尔顿或300道尔顿的肽和/或游离氨基酸。
97.优选地,燕窝提取物进一步包括麦芽糊精。
98.可提供一种组合物,其包括根据第二方面和第三方面的燕窝提取物;以及药学上可接受的载体、赋形剂或稀释剂。如本文所用,“药学上可接受的载体”包括生理上相容的任何及所有溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等张剂和吸收延迟剂等。
99.优选的药学上可接受的载体包括水性载体或稀释剂。可用于本发明的药物组合物的合适的水性载体的实例包括水、缓冲水和盐水。其他载体的实例包括乙醇,多元醇(诸如甘油、丙二醇、聚乙二醇等),以及其合适的混合物,植物油诸如橄榄油,以及可注射的有机酯诸如油酸乙酯。例如通过使用包衣材料诸如卵磷脂,在分散体的情况下通过保持所需颗粒的尺寸,以及通过使用表面活性剂,可以保持适当的流动性。在许多情况下,组合物中优选地包括等渗剂,例如,糖、多元醇诸如甘露醇、山梨醇或氯化钠。
100.优选地,该组合物或制剂是含有活性成分的每日剂量或单位、每日亚剂量或其适当部分的单位剂量。本发明的组合物通常可以包括免疫浓缩物的药物组合物的形式,任选地以无毒的有机、或无机、酸、或碱、加成盐的形式,在药学上可接受的剂型中,通过口服或通过任何肠胃外途径给药。根据待治疗的情况、病症和患者以及给药途径,可以以不同剂量给药该组合物。
101.在人类治疗中,本发明的免疫浓缩物/提取物或组合物可单独给药,但通常将与根据预期给药途径和标准药学实践选择的合适的药物赋形剂稀释剂或载体混合给药。它们可以口服(经片剂和胶囊)或肠胃外给药,例如静脉、动脉内、腹膜内、鞘内、脑室内、椎管内(intrastemally)、颅内、肌肉内或皮下,或者它们可通过输注技术给药。它们最好以无菌水性溶液的形式使用,该水性溶液可以含有其他物质,例如,使溶液与血液等渗的足够的盐或
葡萄糖。如果必要的话,该水性溶液应适当地缓冲(优选至3至9的ph)。合适的肠胃外制剂在无菌条件下的制备可通过本领域技术人员众所周知的标准药学技术来完成。
102.适于肠胃外给药的组合物或制剂包括水性和非水性无菌注射液,其可以含有抗氧化剂、缓冲液、抑菌剂和使该制剂与预期接受者的血液等渗的溶质;以及水性和非水性无菌悬浮液,其可包括悬浮剂和增稠剂。这些组合物还可含有佐剂诸如防腐剂、润湿剂、乳化剂和分散剂。可通过灭菌程序(见上文)以及通过包括各种抗菌剂和抗真菌剂(例如,对羟基苯甲酸酯、氯丁醇、苯酚山梨酸等)二者来确保防止微生物的存在。也可期望将等渗剂诸如糖、氯化钠等包括在组合物中。此外,可注射药物形式的延迟吸收可能是由包括延迟吸收的剂诸如单硬脂酸铝和明胶而实现的。治疗组合物在制造和储存的条件下典型地必须是无菌且稳定的。该组合物可配制成适合高药物浓度的溶液、微乳、脂质体或其他有序结构。
103.制剂可以提供于单位剂量或多剂量容器中,例如密封的安瓿和小瓶中,也可以储存在冷冻干燥(冻干)条件下,只需要在使用前即时添加无菌液体载体,例如注射用水。临时注射液和悬浮液可以由上述种类的无菌粉末、颗粒和片剂制备。
104.对于向人类患者口服和肠胃外给药,本发明的化合物的日剂量水平通常为1mg/kg至30mg/kg。因此,例如,本发明的化合物的片剂或胶囊可包含用于一次给药单个或二个或更多的活性化合物的剂量,视情况而定。在任何情况下,医生都将确定最适合任何个体患者的实际剂量,它将随具体患者的年龄、体重和反应而变化。以上剂量为平均情况的典型。当然,可以存在个别情况,其中更高或更低的剂量范围是应得的,并且这些都在本发明的范围内。
105.可替换地,本发明的组合物可以以栓剂或阴道栓的形式给药,或者它们可以以洗剂、溶液、乳膏、软膏或撒布粉的形式局部应用。本发明的组合物,特别是燕窝提取物,也可以经皮给药,例如通过使用皮肤贴片。它们也可以通过眼途径给药,特别是用于治疗眼部疾病。对于局部应用于皮肤,本发明的化合物可配制为含有活性化合物的合适软膏,悬浮或溶解在例如以下中的一种或多种的混合物中:矿物油、液体矿脂、白矿脂、丙二醇、聚氧乙烯聚氧丙烯化合物、乳化蜡和水。可替换地,它们可配制为合适的洗剂或乳膏,悬浮或溶解在例如以下中的一种或多种的混合物中:矿物油、山梨醇酐单硬脂酸酯、聚乙二醇、液体石蜡、聚山梨酯60、十六烷基酯蜡、鲸蜡硬脂醇(cetearyl alcohol)、2
‑
辛基十二醇、苯甲醇和水。
106.一般而言,在人类中,口服或局部给药本发明的组合物是最方便的优选途径。在接受者在口服给药后经受吞咽障碍或经受药物吸收缺陷的情况下,则可通过肠胃外途径,例如舌下、口腔、经粘膜或经皮方式给药。
107.在实施方式中,根据第二方面和第三方面的燕窝提取物可作为营养制剂或健康补充剂食用。例如,用于调节受试者免疫系统的营养制剂,该营养制剂包括根据本发明的第二方面或第三方面的燕窝提取物。提取物可以作为粉末食用,或者与其他食物或饮料组合食用。
108.在本发明的第四方面中,第二方面和第三方面的燕窝提取物可用于医药,或用于药物的制造。
109.优选地,燕窝提取物可用于抑制登革热(dengue)病毒复制,或用于调节受试者的免疫系统,或用于诱导干扰素调节因子3(irf3)磷酸化。受试者可以是任何动物,优选哺乳动物,更优选人类。更优选地,调节免疫系统是通过诱导炎性细胞因子的产生,或诱导nf
‑
κb
通路和/或mapk通路。抑制登革热病毒复制是优选地防止至少50%的登革热病毒复制、至少60%的登革热病毒复制、至少70%的登革热病毒复制、至少80%的登革热病毒复制、至少90%的登革热病毒复制、至少95%的登革热病毒复制或者基本上100%的登革热病毒复制。
110.可替换地,燕窝提取物可用于抑制登革热病毒复制,或调节受试者的免疫系统,或诱导干扰素调节因子3(irf3)磷酸化的方法中,该方法包括向受试者特别地以生物有效量给药第二方面和第三方面的燕窝提取物。
111.所述方法允许制备燕窝提取物,并且任选地含有海藻和/或雪蛤膏,与天然燕窝相比,其富含化合物。此外,该工艺水解所提取的产物以在消耗后提供高纯度和高生物利用度的化合物。可以通过改变提取溶液而改变所提取的化合物用于不同目的。在此工艺中所分离的产物能够以多种方式和方法递送至使用者,从而允许生物活性分子有效且快速地递送至作用位点。燕窝提取物可提供免疫增强作用和抗病毒特性,并且可作为营养制剂或保健品食用。该产品是一种低成本的活性营养制剂成分(ani)来源,但具有活性药物成分(api)的高效性。
112.在图中:
113.图1示出了从燕窝制备浓缩物的方法流程图。
114.图2示出了10%燕窝提取物(e1)混合物对抑制登革热病毒(dv1)在巨噬细胞中复制的效应。dv1阴性链(dv1neg)mrna的rt
‑
pct在dv1感染后72小时测定。gapdh作为加载对照。
115.图3示出了10%燕窝提取物(e2)混合物对巨噬细胞的效应。该图示出了e2能诱发巨噬细胞中产生ifn
‑
β和其他炎性细胞因子。图片a
‑
e示出了用e2处理后巨噬细胞的qpcr结果,其中poly(i:c)(聚肌胞苷酸)以及2株菌株(0111:b4和055:b5)的lps为阳性对照。方框强调由e2诱导各种细胞因子基因的表达。
116.图4示出了ebn诱导的巨噬细胞的免疫印迹分析。图片a示出了在阴性对照(sf)的10%混合物泳道中没有pirf3带。图片b示出了在燕窝提取物(e3)的10%混合物泳道中存在pirf3带。
117.图5在图片a和图片b中分别示出了在nfκb通路和mapk通路上可食用燕窝提取物(e4)的50%混合物和阴性对照(sf)的50%混合物诱导的巨噬细胞的免疫印迹分析。
118.图6示出了可食用燕窝提取物(e5)的10%混合物在4小时的时间点诱导的b淋巴细胞中细胞因子的相对表达。图片a示出了ifnβ,图片b示出了il
‑
10,图片c示出了tnfα,图片d示出了il
‑
6,以及图片e示出了il
‑
12。
119.图7示出了b细胞对于细胞因子产生的剂量依赖性效应。可食用燕窝提取物(e6)的10%和50%混合物诱导的过夜收获的b淋巴细胞中细胞因子的相对表达。图片a示出了ifnβ,图片b示出了il
‑
10,图片c示出了tnfα,图片d示出了il
‑
6,以及图片e示出了il
‑
12。
120.图8示出了用可食用燕窝提取物(e7)处理后b淋巴细胞的qpcr结果。肌动蛋白用作内源性对照,所有基因表达均归一化至此。以poly(i:c)和lps(0111:b4)为阳性对照,将靶标基因的表达与培养基比较。
121.图9示出了通过质粒表达克隆来识别和分离编码所需细胞表面受体的cdna。
具体实施方式
122.除非另有限定,否则本文使用的所有技术术语和科学术语具有本发明所属领域的技术人员通常理解的含义。
123.术语“约”、“大约”、“基本上”必须参照本申请的上下文作为整体来解读,并考虑到由这类词限定的特定技术术语在相关领域通常具有的含义。例如,可以理解的是,可以在一定的公差范围内执行或获得特定的参数、函数(功能)、效果或结果,并且相关技术领域的技术人员知道如何获得这类术语的公差。
124.在下文的描述中,列出了很多具体细节,以提供对本发明的不同说明性实施方式的透彻理解。然而,本领域技术人员应理解,无需这些具体细节的一些或全部即可实践本发明的实施方式。应理解,本文使用的术语仅为描述具体实施方式的目的,并不意在限制本发明的范围。在附图中,类似附图标记是指贯穿多个视图的相同或相似的功能或特征。
125.人体免疫系统保护身体免受外来生物的侵害,并包括先天性免疫系统和适应性免疫系统。先天性免疫系统提供对抗感染的即时防御,而适应性免疫系统提供对抗特定外来生物的持久免疫。parkin和cohen(lancet 2001,357,1777
‑
1789)提供了人体免疫系统和主要成分的概述。
126.先天性免疫系统的主要功能包括通过产生包括细胞因子在内的化学因子来聚集免疫细胞至感染位点,并促进外来生物的清除;激活补体级联反应;以及激活适应性免疫系统。
127.调理素是增强吞噬作用的任何分子,且包括抗体、补体蛋白和循环蛋白(例如正五聚蛋白、胶原凝集素和纤胶凝蛋白)。调理素典型地标记用于免疫反应的抗原或标记用于回收的死细胞。大多数(如果不是全部)细胞膜保持非零跨膜电位,并使得两个细胞很难结合。调理素通常通过结合于它们的靶标细胞而起作用并增强吞噬作用,即调理素作为连接基。补体系统是免疫系统的一部分,其增强抗体和吞噬细胞清除来自生物体的微生物和受损细胞的能力。补体系统包括许多补体蛋白,其作为非活性前体在血液中循环,并通过生化途径被激活。正五聚蛋白、胶原凝集素和纤胶凝蛋白是可溶的先天性免疫模式识别蛋白,其识别死亡细胞表面上的非自分子模式或改变的自分子模式,并促进程序性细胞死亡(例如凋亡)以及由巨噬细胞和其他吞噬细胞清除死亡细胞和细胞物质。如上文所定义,在本发明的上下文中术语“调理素”不包括补体蛋白、凝集素、纤胶凝蛋白、胶原凝集素和正五聚蛋白。
128.凝集素是碳水化合物结合蛋白,并在细胞和分子水平上进行识别。在动物凝集素中,c型凝集素最为丰富,且分为三大家族:选择素、胶原凝集素和内吞凝集素。胶原凝集素被认为涉及呼吸道病毒和致病菌的模式识别。实例包括胶原凝集素诸如甘露糖结合蛋白(mbp)、肺表面活性物质sp
‑
a和sp
‑
d以及胶固素。mbp是能够结合细菌和真菌细胞表面寡糖的低聚甘露糖残基的保护性胶原凝集素的实例。mbp还能激活经典补体途径和替代补体途径。另一种内源性胶原凝集素是甘露糖受体,且在巨噬细胞和树突状细胞表面上表达,并能够识别和结合细菌。如上文所定义,在本发明的上下文中,术语“凝集素”不包括纤胶凝蛋白和胶原凝集素,即除了纤胶凝蛋白和胶原凝集素之外的凝集素。
129.图1示出了从可食用燕窝(ebn)中提取和分离感兴趣的生物活性分子的方法:
130.(a)清洁ebn以去除污染物;
131.(b)研磨清洁后的ebn并通过筛网过滤;
132.(c)将ebn粉末置于水中以提供ebn混合物;可任选地清洁雪蛤膏和/或海藻并也添加到ebn混合物中;
133.(d)对ebn或ebn混合物进行灭菌;
134.(e)将ebn或ebn混合物浸入油中;
135.(f)用包括至少一种结合部分的提取溶液处理ebn混合物,所述结合部分选自包括以下的组:调理素结合部分、补体蛋白结合部分、凝集素结合部分、纤胶凝蛋白结合部分、胶原凝集素结合部分和正五聚蛋白结合部分;
136.(g)用酸溶液部分水解结合的分子;
137.(h)从ebn混合物中分离结合部分和生物活性分子;
138.(i)通过添加大分子量的肽释放结合的分子;
139.(j)经透析获得释放的生物活性分子;
140.(k)用第二酶溶液处理来自透析的分离的部分,以进一步分解生物活性分子;
141.(l)使第二酶溶液的酶变性并将其去除;
142.(m)干燥分离的部分以获得固体产物。
143.所述的某些步骤可以省略,或者以不同的顺序执行。例如,步骤(a)
‑
(e)单独或组合可被视为制备用于用提取溶液处理(或接触提取溶液)的ebn混合物的步骤。靶标分子的水解有利于最大化其生物效应。根据所提取的酶、结合部分和生物活性分子,可以改变工艺的时间和温度以确定最佳参数。
144.粗ebn(1块大约10至50g)通过浸泡在水中进行清洁以去除亚硝酸盐、螨虫类和其他污染物。被去除的其他可能污染物可包括重金属、漂白剂和其他微小碎片,包括污渍。
145.去除亚硝酸盐的有效方法是使用含有来自水果、植物和土壤的亚硝酸盐还原酶的溶液。此外,该溶液可含有其他酶以灭活产生亚硝酸盐的任何伴生细菌。为了去除螨虫类,使用含有特定水果蛋白酶的溶液。此类实例包括来自番木瓜(木瓜蛋白酶)、猕猴桃(猕猴桃蛋白酶)、菠萝(菠萝蛋白酶)、无花果(无花果蛋白酶)等的任何此类蛋白酶。这些蛋白酶可以以将允许灭活细菌的任何适合的浓度使用。
146.在室温至40℃下,用每种酶溶液依次处理ebn混合物至少5分钟。得到的ebn于酶溶液中的悬浮液的纳米气泡将引起降解的细胞碎片浮到水的表面上,在水的表面上可以容易地将其去除。随后从固体ebn中去除酶溶液。可以进一步洗涤固体ebn以去除任何残留的酶和污染物。将清洁后的ebn干燥以去除多余的水,优选在70℃下持续12h。
147.研磨清洁后的ebn并通过筛网过滤。筛网的尺寸应足以去除任何残留的大杂质,优选200至700μm的尺寸。最优选的筛孔尺寸为600μm。
148.在5℃下将ebn粉末置于水(优选蒸馏水或去离子水)中5小时。适合的浓度为25g的ebn于1000ml的水中。如有需要,可以将混合物在121℃下进一步灭菌10至20分钟。雪蛤膏和/或海藻也可以如上所述进行清洁,并浸泡在具有ebn的混合物中。可替换地,可以单独制备雪蛤膏和/或海藻,并添加至ebn混合物中。随后,将ebn混合物浸入油中以通过增强结合部分与生物活性分子的相互作用和亲和力来增强随后处理中与结合部分的结合。
149.用含有至少一种结合部分的水性溶液在4至37℃的温度范围下处理ebn混合物至少20分钟。在25至37℃的温度下,20至120分钟就足够了,但是可以在较低的温度下保持更久过夜。在4℃的温度下,抗体和ebn的混合物保持至少9小时。通常,温度越低,结合部分溶
液完全结合于靶标化合物所需的时间越长。结合部分选自包括以下的组:调理素结合部分、补体蛋白结合部分、凝集素结合部分、纤胶凝蛋白结合部分、胶原凝集素结合部分和正五聚蛋白结合部分。在实施方式中,在抗坏血酸和/或金纳米颗粒的存在下进行ebn混合物和结合部分的接触或混合步骤。抗坏血酸提供抗氧化特性,并防止或最小化生物活性分子的降解,例如由活性氧物种的降解。金纳米颗粒提供了稳定且非反应性环境,其增强了靶标分子和结合部分的结合。提取溶液中存在的至少一种结合部分将结合于靶标分子,并允许将结合的分子从ebn混合物中提取出来。
150.结合部分的实例
151.调理素结合部分蛋白的实例为gp
‑
340,即肺表面活性物质蛋白d的假定调理素受体。该蛋白质具有以下序列(seq id no.1),分子量为260.79kda:
[0152][0153][0154]
补体蛋白结合部分蛋白的实例是补体受体2型异构体1前体[智人]。该蛋白质具有以下序列(seq id no.2),分子量为119.18kda:
[0155][0156]
凝集素结合部分蛋白的实例是c杀伤细胞凝集素样受体亚家族b成员1。该蛋白质具有以下序列(seq id no.3),分子量为25.42kda:
[0157][0158]
纤胶凝蛋白结合部分蛋白的实例具有以下序列(seq id no.4),分子量为35.08kda:
[0159][0160]
胶原凝集素结合部分蛋白的实例是胶原凝集素
‑
12。该蛋白质具有以下序列(seq id no.5),分子量为81.53kda:
[0161][0162]
正五聚蛋白结合部分蛋白的实例是神经元正五聚蛋白受体(智人)。该蛋白质具有以下序列(seq id no.6),分子量为52.86kda:
[0163][0164]
可与上述结合部分一起使用的合适的提取溶液的实例包括:
[0165]
提取溶液1:50%至90%的凝集素结合部分和10%至50%的调理素结合部分;
[0166]
提取溶液2:10%至30%的凝集素结合部分、10%至30%的补体蛋白结合部分、10%至30%的调理素结合部分、5%至15%的纤胶凝蛋白结合部分、5%至15%的胶原凝集素结合部分和10%至30%的正五聚蛋白结合部分;
[0167]
提取溶液3:5%至45%的凝集素结合部分、35%至65%的补体蛋白结合部分和5%至45%调理素结合部分;
[0168]
提取溶液4:10%至90%的调理素结合部分和10%至90%的正五聚蛋白结合部分;
[0169]
提取溶液5:30%至50%的纤胶凝蛋白结合部分、10%至50%的胶原凝集素结合部分和10%至50%的正五聚蛋白结合部分;
[0170]
提取溶液6:55%至85%的补体蛋白结合部分、5%至15%的纤胶凝蛋白结合部分和10%至30%的胶原凝集素结合部分;以及
[0171]
提取溶液7:5%至15%的凝集素结合部分、10%至30%的调理素结合部分和55%至85%的胶原凝集素结合部分。
[0172]
提取溶液8:70%的凝集素结合部分和30%的调理素结合部分;
[0173]
提取溶液9:20%的凝集素结合部分、20%的补体蛋白结合部分、20%的调理素结合部分、10%的纤胶凝蛋白结合部分、10%的胶原凝集素结合部分和20%的正五聚蛋白结合部分;
[0174]
提取溶液10:25%的凝集素结合部分、50%的补体蛋白结合部分和25%的调理素结合部分;
[0175]
提取溶液11:50%的调理素结合部分和50%的正五聚蛋白结合部分;
[0176]
提取溶液12:40%的纤胶凝蛋白结合部分、30%的胶原凝集素结合部分和30%的正五聚蛋白结合部分;
[0177]
提取溶液13:70%的补体蛋白结合部分、10%的纤胶凝蛋白结合部分和20%的胶原凝集素结合部分;以及
[0178]
提取溶液14:10%的凝集素结合部分、20%的调理素结合部分和70%的胶原凝集素结合部分。
[0179]
为各结合部分提供的百分比是各结合部分的重量相对于存在的结合部分的总重量的百分比。结合部分/多个结合部分可溶解于任何合适的溶剂中或用作混合物。溶剂的实例包括水和缓冲溶液。
[0180]
在接触或混合步骤后,将混合物用均浆器均匀化,用酸性溶液处理,并加热至100℃以引起靶标化合物的部分水解。酸优选为食物酸,例如抗坏血酸、柠檬酸、苹果酸、乙酸、酒石酸、富马酸和乳酸。将混合物冷却至室温并中和至ph 7。
[0181]
水解后,至少一种结合部分和结合的分子可通过任何已知的方法从混合物中分离出来。这些方法中的一些包括物理化学分级、类特异性亲和和抗原特异性亲和。物理化学分级包括基于抗体的尺寸、电荷或其他共同的化学特性的免疫球蛋白的差异沉淀、尺寸排阻或固相结合。类特异性亲和包括通过对免疫球蛋白具有特异性亲和力的固定化生物配体的特定抗体类(例如igg)的固相结合。抗原特异性亲和包括使用特异性抗原通过其特异性抗原结合域纯化抗体。
[0182]
结合的化合物通过添加过量的较大肽从至少一种结合部分释放。例如,较大肽应具有50kda的最小分子量,并包括天然糖胺聚糖和其他蛋白质。
[0183]
释放的化合物随后经由使用透析袋从添加的肽、酶和至少一种结合部分分离。
[0184]
可替换地,含有ebn的混合物可以用包括不同结合部分的提取溶液按顺序处理,并分离以按顺序提取出所需化合物。这确保了ebn、海藻和/或雪蛤膏的最佳使用,并避免浪费。
[0185]
分离/浓缩的化合物可在45℃、6.5至9.0的ph下用植物蛋白酶和/或食物蛋白酶进一步水解1小时。所使用的酶的浓度为了有效水解应为至少10μg/ml,并且优选最高达100μg/ml。适合的酶的实例包括玉米(corn)和玉米(maize)终端蛋白酶。随后通过将混合物在70℃下加热5分钟使酶变性。酶在高于55℃的温度下沉淀出来,因此可以在高于55℃的温度下过滤混合物以在滤液中提供所需的化合物溶液。
[0186]
将所需化合物的溶液干燥以得到粉末状化合物。优选地,通过冷冻干燥或喷雾干燥来干燥该化合物。冷冻干燥是通过以下执行的:用液氮或干冰将溶液冷却至
‑
180℃至
‑
70℃之间的温度,并将冷冻混合物送至真空以使冰升华。如果需要得到干燥的粉末产物,可以重复冷冻干燥。
[0187]
从上述工艺获得的燕窝浓缩物或提取物包括从所述工艺中提取的生物活性分子。在一些实施方式中,生物活性分子可能已被分解并且可能难以表征。在一些实施方式中,生物活性分子很大程度上可以是完整的。
[0188]
因此,燕窝提取物包括选自以下组中的至少两个组的多种分子:调理素、补体蛋白、凝集素、纤胶凝蛋白、胶原凝集素和正五聚蛋白。燕窝提取物可进一步包括来自雪蛤膏和/或海藻的提取物。
[0189]
在实施方式中,燕窝提取物包括选自以下中的任一种:
[0190]
i)凝集素和调理素;
[0191]
ii)凝集素、补体蛋白、调理素、纤胶凝蛋白、胶原凝集素和正五聚蛋白;
[0192]
iii)凝集素、补体蛋白和调理素;
[0193]
iv)调理素和正五聚蛋白;
[0194]
v)纤胶凝蛋白、胶原凝集素和正五聚蛋白;
[0195]
vi)补体蛋白、纤胶凝蛋白和胶原凝集素;以及
[0196]
vii)凝集素、调理素和胶原凝集素。
[0197]
具体而言,燕窝提取物包括选自以下中的任一种:
[0198]
i)50%至90%的凝集素和10%至50%的调理素
[0199]
ii)10%至30%的凝集素、10%至30%的补体蛋白、10%至30%的调理素、5%至15%的纤胶凝蛋白、5%至15%的胶原凝集素和10%至30%的正五聚蛋白;
[0200]
iii)5%至45%的凝集素、35%至65%的补体蛋白和5%至45%的调理素;
[0201]
iv)10%至90%的调理素和10%至90%的正五聚蛋白;
[0202]
v)30%至50%的纤胶凝蛋白、10%至50%的胶原凝集素和10%至50%的正五聚蛋白;
[0203]
vi)55%至85%的补体蛋白,5%至15%的纤胶凝蛋白和10%至30%的胶原凝集素;
[0204]
vii)5%至15%的凝集素、10%至30%的调理素和55%至85%的胶原凝集素。
[0205]
所给出的百分比是特定生物活性分子相对于存在的生物活性分子的总重量的重量百分比。
[0206]
以下燕窝提取物1至7分别使用提取溶液8至14基于上述工艺制备,并反映了提取物所具有的特性,范围包括这些实例:
[0207]
提取物1使用ebn制备并包括:70%的凝集素和30%的调理素;
[0208]
提取物2使用ebn、雪蛤膏和海藻制备,并包括:20%的凝集素、20%的补体蛋白、20%的调理素、10%的纤胶凝蛋白、10%的胶原凝集素和20%的正五聚蛋白;
[0209]
提取物3使用ebn和海藻制备,并包括:25%的凝集素、50%的补体蛋白和25%的调理素;
[0210]
提取物4使用ebn和海藻制备,并包括:50%的调理素和50%的正五聚蛋白;
[0211]
提取物5使用ebn制备并包括:40%的纤胶凝蛋白、30%的胶原凝集素和30%的正五聚蛋白;
[0212]
提取物6使用ebn和雪蛤膏制备,并包括:70%的补体蛋白、10%的纤胶凝蛋白和20%的胶原凝集素;
[0213]
提取物7使用ebn和雪蛤膏制备,并包括:10%的凝集素、20%的调理素和70%的胶原凝集素。
[0214]
干燥的粉末产物可与其他添加剂混合以得到食品或药品。可替换地,产物可与其他添加剂一起溶解在水中。
[0215]
在以下各种制剂中干燥的产物可与麦芽糊精混合:
[0216]
1. 75%的ebn/ebn混合物浓缩物/提取物产物和25%麦芽糊精;
[0217]
2. 50%的ebn/ebn混合物浓缩物/提取物产物和45%麦芽糊精;
[0218]
3. 50%的ebn/ebn混合物浓缩物/提取物产物和50%麦芽糊精;
[0219]
4. 30%的ebn/ebn混合物浓缩提取物产物和70%麦芽糊精。
[0220]
可以看出,该产物包括ebn浓缩物/提取物产物和麦芽糊精。优选地,30至75wt.%的ebn浓缩物/提取物和25至70wt.%的麦芽糊精。
[0221]
由于这些生物活性分子的高水溶性,它们的生物利用度通常很低。常见的给药途径经局部应用于皮肤和关节或者口服给药由于通过皮肤或肠内疏水膜的差的渗透性而被阻碍。生物活性分子很难到达身体中必需的位点以具有所需的效应。还有给药的其他方法,但一般不适合在没有卫生专业人员的情况下给药。通过酸性和/或酶水解部分地水解生物活性分子可被证明有益于将分子分解成更容易吸收的化合物,使提取物更有益。
[0222]
特别是在适合的制剂下,各自的专有免疫浓缩物可以以有效和有用的剂量递送至疼痛和炎症的位点。
[0223]
本浓缩物/提取物以脂质形式配制,可用于生产市场上第一经济产品,其是经皮的并由安全和可持续的生物活性分子组成,从天然但大量供应的ebn/ebn混合物回收碎屑中纯化/提取。
[0224]
提取物1至7(e1
‑
e7)在体外细胞培养的巨噬细胞/b细胞上进行检测,以测定它们对1型ifn的产生、细胞因子产生和登革热病毒复制的效应。本申请中的巨噬细胞/b细胞是指源自小鼠股骨骨髓祖细胞的干细胞的分化的初级巨噬细胞/b细胞。所有这些特征都是体外巨噬细胞/b细胞的保护性免疫反应的常用指标。
[0225]
生物测定方法和结果
[0226]
1.细胞培养和登革热病毒复制测定的方法
[0227]
骨髓源性巨噬细胞培养
[0228]
通过将培养液注入股骨和胫骨获得骨髓细胞。所有细胞通过在4℃下1000rpm离心5min而旋转下降。为了消除红细胞,通过在冰上孵育用1ml的红细胞裂解缓冲液处理细胞5min。将细胞在10ml培养液中洗涤,并通过在4℃下以1000rpm离心5min收集。使用血细胞计数仪(血球计)计数骨髓细胞,并在含有含10ml mcsf的培养液的10cm培养板上分化106个细胞6天。
[0229]
巨噬细胞的登革热病毒感染
[0230]
登革热1型病毒(新加坡株s275/90,d1)在c6/36细胞中增殖。骨髓源性巨噬细胞(3x106)接种于6孔组织培养板(nunc)的每孔中。过夜孵育后,用d1以1的感染复数(moi)感染巨噬细胞2天。为了检测负链d1 rna,使用trizol(invitrogen)从感染d1的细胞中提取总rna。将1μg的总rna用引物5'
‑
gtgctgcctgtggctccatc
‑
3'进行反转录,并随后用作模板用于用引物对5'
‑
agaacctgttgattcaacagcacc
‑
3'和5'
‑
catggaagctgtacgcatgg
‑3’
合成pcr片段。为了通过逆转录酶pcr检测gapdh,用oligodt引物从上述总rna中合成细胞cdna。分别用以下引物合成gapdh片段:小鼠gapdh、5
’‑
gacaactttggcattgtggaa
‑3’
和5
’‑
ccaggaaatgagcttgaca
‑3’
。
[0231]
参照图2,可以看出,在上述测定中,具有用提取物1(e1)处理的巨噬细胞的中间泳道示出不存在或弱存在白色带,表明提取物1限制了登革热病毒在巨噬细胞中的复制。这可用作控制登革热病毒复制的手段。
[0232]
2.细胞培养的方法,实时基因表达定量pcr(qpcr)
[0233]
骨髓源性巨噬细胞培养
[0234]
通过将培养液注入股骨和胫骨获得骨髓细胞。所有细胞通过在4℃下1000rpm离心5min而旋转下降。为了消除红细胞,通过在冰上孵育用1ml的红细胞裂解缓冲液处理细胞5min。将细胞在10ml培养液中洗涤,并通过在4℃下以1000rpm离心5min收集。使用血细胞计数仪(血球计)计数骨髓细胞,并在含有含10ml mcsf的培养液的10cm培养板上分化106个细胞6天。
[0235]
定量实时pcr
[0236]
将2x106个细胞/ml的骨髓巨噬细胞接种到opti
‑
mem(gibco,美国)中的6孔板上。在使用trizol(invitrogen,美国)提取rna之前,用50μg/ml poly(i:c)(invivogen,美国)、1μg/ml lps 0111:b4(从lps 0111:b4纯化)和1μg/ml lps 055:b5(sigma,美国)刺激细胞2小时。根据制造商的协议,使用superscript iii第一链合成系统(invitrogen,美国)从总
rna合成1μg cdna。用细胞因子特异性引物,在applied biosystems quantstudio 6flex实时pcr系统上进行qpcr。
[0237]
参照图3,可以看出,阳性对照不同程度地诱发ifnβ、tnfα、il
‑
10、il
‑
6和il
‑
12的产生。提取物2(e2)诱发巨噬细胞中产生ifnβ和炎性细胞因子,并提供最完整的免疫平衡平台,在这个平台上可以收获关键的免疫分子来影响各种促炎和抗炎分子的协作,从而达到免疫系统的平衡状态,不仅体现在巨噬细胞,还有其他重要细胞。免疫分子的协调(symphony)将产生预防微生物感染的增强的效应以及对癌症的更好的管理。提取物2也可具有抗登革热的特性。
[0238]
3.巨噬细胞中irf3的磷酸化
[0239]
提取物3(e3)在应用于巨噬细胞时诱导巨噬细胞中irf3的磷酸化,如图4图片b中所示。免疫印迹分析中标记e3的泳道示出了irf3的磷酸化与阳性对照poly(i:c)和lps相同。图4的图片a示出了sf标记的泳道中的阴性对照。活化的irf3通过与irf7的相互作用,与增强的抗癌和病毒预防特性有关。经采用不同范围的触发免疫肽进行适当调节,这也可以成功地应用于心肌梗死后的心脏保护。
[0240]
阴性对照(sf)是指未经提取工艺的可食用燕窝,且可通过将可食用燕窝浸泡在水中制备并配成与被检测提取物质量浓度相同。sf对照可类似于其他测定来制备。
[0241]
4.诱导免疫细胞中的nf
‑
κb和mapk通路
[0242]
提取物4(e4)在应用于免疫细胞时诱发免疫细胞中nfκb和mapk通路的诱导,如图5所示。在免疫印迹分析中可以看出,用提取物4处理的免疫细胞诱导p65、jnk、erk和p38的磷酸化,如用提取物4标记的泳道中所示的,而用阴性对照(sf泳道)的那些没有示出磷酸化带。
[0243]
nf
‑
κb在调节对感染的免疫反应中起着关键作用。nf
‑
κb的不正确调节与癌症、炎症和自身免疫性疾病、感染性休克、病毒感染和免疫发育不良有关。nf
‑
κb也参与突触可塑性和记忆的过程。
[0244]
mapk涉及引导对多种刺激的细胞反应,诸如有丝分裂原、渗透压、热休克和促炎细胞因子。它们调节细胞功能,包括增殖、基因表达、分化、有丝分裂、细胞存活和凋亡。
[0245]
提取物4可用于增强对各种形式的压力、热休克和感染性休克的管理。
[0246]
5.诱导b细胞产生细胞因子
[0247]
提取物5(e5)可诱导b细胞在培养中产生细胞因子,如图6所示。从图6中可以看出,与阴性对照(培养基)和10%sf(阴性对照)相比,标记10%提取物5(水性溶液中10%wt.的提取物5)的泳道示出了ifnβ、tnfα、il
‑
10、il
‑
6和il
‑
12的产生增加。虽然正五聚蛋白与b细胞相关,但纤胶凝蛋白和胶原凝集素可不与之相关。然而,这三种不同类型的生物活性分子的存在可以诱导大量不同的b细胞产生大量不同的细胞因子,从而更好地应对各种极具挑战性的慢性疾病,诸如糖尿病、关节炎、多发性硬化症等。
[0248]
6.细胞因子产生对b细胞的剂量依赖性效应
[0249]
提取物6(e6)在应用于b细胞时示出了细胞因子产生对b细胞的剂量依赖性效应,如图7所示,尤其是对于ifnβ、il
‑
10和il
‑
6。通过用补体蛋白代替正五聚蛋白,用可能与b细胞不密切相关的免疫肽的组合,可以实现细胞因子产生对b细胞的剂量依赖性效应。这些剂量依赖性和长时间的过夜效应可以使用上述提取物6而不是提取物5来表现。其基本原理
是,由于所有的纤胶凝蛋白、胶原凝集素和补体蛋白都是先天性免疫的非体液臂的成分,即先天性免疫的较早阶段,由于该组合物的作用时期的跨度可能更长,因此它们的整体效应可能更可持续,因为较早阶段所涵盖的时间可能被列入更多。
[0250]
7.在b细胞中选择性诱导ifnβ、tnfα和il
‑
6,而不是il
‑
10和il
‑
12
[0251]
提取物7(e7)在应用于b细胞时选择性地诱导b细胞中的ifnβ、tnfα和il
‑
6,而不是il
‑
10和il
‑
12,如图8所示。ifnβ、tnfα和il
‑
6的表达增加用方框标记以表明提取物7的有益效应。
[0252]
tnf的主要作用是调节免疫细胞。tnf是一种内源性热原,能够诱导发热、凋亡细胞死亡、恶病质、炎症并抑制肿瘤发生和病毒复制,且经由产生il1&il6的细胞对脓毒症作出响应。
[0253]
β干扰素(ifnβ)平衡脑内促炎剂和抗炎剂的表达,并减少穿过血脑屏障的炎性细胞数量。总的来说,用β干扰素治疗导致神经元炎症的减少。此外,它还被认为增加神经生长因子的产生,并从而提高神经元的存活率。
[0254]
白细胞介素6(il
‑
6)是一种白细胞介素,其既可作为促炎细胞因子,又可作为抗炎肌动因子(myokine)。白细胞介素6由t细胞和巨噬细胞分泌,以刺激免疫反应,例如在感染期间和创伤后,特别是烧伤或其他导致炎症的组织损伤。il
‑
6在抵抗感染方面也起作用。此外,成骨细胞分泌il
‑
6以刺激破骨细胞形成。许多血管的中膜中的平滑肌细胞也产生il
‑
6作为一种促炎细胞因子。il
‑
6作为抗炎细胞因子的作用是通过其对tnf
‑
α和il
‑
1的抑制效应以及il
‑
1ra和il
‑
10的激活而介导的。
[0255]
tnf、ifnβ和il
‑
6共同构成了非常新颖但平衡的免疫调节平台,在这个平台上,促炎因子和抗炎因子可以自我平衡。新奇结合在免疫浓缩物中可能存在的调理素、凝集素和胶原凝集素(尽管它们是相关的肽)使b细胞能够同时诱导tnf、ifnβ和il
‑
6的表达。当存在平衡的免疫调节平台时,症状诸如体重减轻、肌肉萎缩、疲劳、虚弱、食欲明显减退、骨质疏松或甚至神经退行性变都会得到缓解。由于健康和平衡的免疫系统,癌症也不太可能发生。
[0256]
从测定和讨论的结果可以看出,燕窝提取物1至7能够诱导各种免疫细胞增加细胞因子的产生,促炎和抗炎细胞因子二者。这调节了免疫系统,因为两种类型的细胞因子都增加了,促进了存在于身体中的细胞因子的平衡。这防止了特定细胞因子的过度生产。
[0257]
燕窝提取物,无论是根据工艺还是产品本身的定义,都适合作为营养制剂或健康补充剂食用。它可潜在地在某些组合物中可用作药物。
[0258]
本文所述的工艺允许从ebn中提取有价值的生物活性分子,并提供了具有成本效益且重要的免疫促进剂的来源。
[0259]
虽然在前面的描述中已经描述了本发明的优选实施方式,但是相关领域的技术人员将理解,可以在不脱离本发明的情况下对设计或构造的细节进行许多变更或修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1