培养上清液制剂的制造方法与流程
[0001]
本发明是涉及培养上清液制剂的制造方法等。若具体说明,则是涉及使用能用于注射或点滴的输液等电解质溶液,且使用培养细胞所得的培养上清液,并且细胞培养用的培养基的混入少的培养上清液制剂的制造方法。
背景技术:
[0002]
培养上清液包含在培养细胞时由细胞所分泌的物质(分泌物)。因此,培养上清液所含的各种疾病的治疗或预防用的组合物(培养上清液制剂)被认为对各式各样的疾病等的改善是有效的。例如,日本特许第6296622号公报中记载一种包含培养上清液的损伤部治疗用组合物的制造方法。日本特许第6152205号公报中记载一种含有培养上清液的抗过敏治疗用组合物。
[0003]
现有技术文献
[0004]
专利文献
[0005]
专利文献1:日本特许第6296622号公报
[0006]
专利文献2:日本特许第6152205号公报
技术实现要素:
[0007]
发明所欲解决的课题
[0008]
另一方面,此等培养上清液制剂包含最终培养工序的培养基。在培养基的种类中,也有无血清培养基或无动物培养基等已减少人类以外生物来源的成分的培养基。但是,培养基本身是依据培养细胞的目的而被调整。因此,在对活体内给予培养上清液的情形,有引起各式各样的问题的可能性。于是,本发明的目的是提供一种生物相容性优异的培养上清液制剂。并且,培养基是将培养细胞作为主要目的,并不是将一定要对患者给予细胞上清液作为目的。因此,本发明的优选例的目的是提供一种包含大量特定的基因或蛋白质的培养上清液制剂。
[0009]
解决课题的技术方案
[0010]
本发明基本上是基于下述见解:通过将最终培养阶段的培养基作为能用于注射剂或点滴等的输液等电解质溶液,而可获得生物相容性优异的培养上清液制剂。并且,如同由后述的实施例所实证,是基于下述见解:相较于一般的细胞培养用培养基,使用输液的培养基会在培养上清液中包含大量的某种基因或蛋白质,而有各种治疗、预防、改善效果也高的情形。
[0011]
本说明书所公开的最初发明是涉及培养上清液制剂的制造方法。
[0012]
此方法包含第1培养工序、第2培养工序及培养上清液制剂取得工序。
[0013]
第1培养工序是使用第1培养基将细胞培养至汇合为止的工序。细胞优选为脂肪组织来源间充质间质细胞,表皮来源上皮系细胞或牙髓来源间充质干细胞。
[0014]
第2培养工序是在第1培养工序之后将不同于第1培养基的第2培养基作为培养基
并且培养细胞的工序。
[0015]
第2培养基是包含钙离子及缓冲剂的电解质溶液。第2培养基可以是注射用的输液或点滴用的输液。第2培养工序优选为不使用co2培养器且不进行co2培养的工序。第2培养工序优选为将细胞培养5小时以上且5天以下的工序。第2培养基优选为进一步包含前列腺素的培养基。
[0016]
培养上清液制剂取得工序是在第2培养工序之后获得包含第2培养基的培养上清液制剂的工序。培养上清液制剂优选为包含50重量%以上且100重量%以下的第2培养工序后的第2培养基。培养上清液制剂取得工序优选为包含添加海藻糖的工序。
[0017]
上述方法优选为进一步包含:培养上清液回收工序,在第2培养工序之后回收培养上清液;及冷冻工序,将培养上清液回收工序所回收的培养上清液进行冷冻。优选为培养上清液制剂是化妆品、医药品、食品或饮料的原料。
[0018]
本说明书所公开的不同于上述的发明是涉及培养上清液制剂。此培养上清液制剂是通过上述的任一方法所制造的培养上清液制剂。
[0019]
也就是说,此培养上清液制剂是通过包含以下工序的培养上清液制剂的制造方法所制造的培养上清液制剂:
[0020]
第1培养工序,使用第1培养基将细胞培养至汇合为止;及
[0021]
第2培养工序,在第1培养工序之后,将不同于第1培养基的第2培养基作为培养基,并且培养细胞。而且,培养上清液制剂包含50重量%以上且100重量%以下的第2培养工序后的第2培养基,第2培养基包含钙离子及缓冲剂。
[0022]
本说明书所公开的不同于上述的发明是一种药液,是发挥作为细胞培养用培养基及输液的功能的药液,药液包含钙离子、前列腺素及缓冲剂。
[0023]
发明效果
[0024]
若根据本发明,可提供生物相容性优异的培养上清液制剂。
具体实施方式
[0025]
以下,针对用于实施本发明的方式进行说明。本发明不受限于以下所说明的方式,也包含在本领域技术人员能清楚明白的范围内从以下的方式进行适当修改的方式。
[0026]
本说明书所公开的最初发明是涉及培养上清液制剂的制造方法。所谓培养上清液制剂,是指将培养上清液作为有效成分并包含有效量的组合物、医药、化妆品或营养辅助食品。此方法包含第1培养工序、第2培养工序及培养上清液制剂取得工序。
[0027]
第1培养工序是使用第1培养基将细胞培养至汇合为止的工序。细胞可以是人类或非人类哺乳动物来源,也可以是昆虫来源,也可以是鸟类来源,也可以是植物来源。细胞优选为脂肪组织来源间充质间质细胞或表皮来源上皮系细胞。第1培养工序只要适当采用众所周知的培养方法即可。
[0028]
培养方法只要根据成为对象的细胞进行适当调整即可。培养液的例子是可使用已补充10-15%的自体血清或胎牛血清(fbs)及抗生素的α-mem或dmem。也可以使用不包含人类或动物来源的成分的培养基。也可以根据所需添加成纤维细胞生长因子(bfgf)或肾上腺髓质素等成长因子。培养可利用适于培养哺乳动物细胞的任意条件实施,但一般而言只要以37℃、5%co2培养数天,并且根据所需交换培养基即可。
[0029]
第2培养工序是在第1培养工序之后将不同于第1培养基的第2培养基作为培养基并且培养细胞的工序。
[0030]
第2培养基是包含钙离子及缓冲剂等的电解质溶液。并且,第2培养基优选为糖质少的培养基,糖质(例如葡萄糖)的含量优选为1g/l以下,也可以为0.8g/l以下,也可以为0.5g/l以下,也可以为0.1g/l以上且1.5g/l以下,也可以为0.1g/l以上且1.2g/l以下,也可以为0.1g/l以上且1g/l以下,也可以为0.5g/l以上且1.2g/l以下,也可以为0.8g/l以上且1.1g/l以下。
[0031]
第2培养基所含的钙离子优选为0.045mm以上且1.802mm以下,也可以为0.074mm以上且1.505mm以下,也可以为0.045mm以上且2mm以下,也可以为0.180mm以上且2mm以下,也可以为1mm以上且2mm以下,也可以为1.3mm以上且1.8mm以下,也可以为1.2mm以上且1.6mm以下,也可以为1mm以上且1.6mm以下,也可以为0.045mm以上且1.352mm以下,也可以为0.180mm以上且0.901mm以下,也可以为20mg/l以上且100mg/l以下。第2培养基所含的盐类的例子是nacl、kcl及cacl2,可以包含1g/l以上且30g/l以下,也可以包含4g/l以上且30g/l以下,也可以包含6g/l以上且11g/l以下。
[0032]
缓冲剂的例子是mgso4·
7h2o、na2hpo4、kh2po4及羟乙基哌嗪乙烷磺酸。此等也可和其他盐(例如碳酸氢钠、碳酸钠、丙酮酸、柠檬酸及其盐类等)合并使用。此等缓冲剂的含量优选为1mg/l以上且5g/l以下,也可以为2mg/l以上且500mg/l以下,也可以为10mg/l以上且300mg/l以下。
[0033]
第2培养基的酸性度例如是ph5.5以上且ph9以下,也可以为ph7.2以上且ph7.8以下。并且,第2培养基优选为氨基酸少,或完全不包含氨基酸,氨基酸含量优选为1mg/ml以下,优选为0.8mg/l以下,更优选为0.5mg/l以下。第2培养基优选为维生素类少,或完全不包含维生素类,维生素类的含量优选为1mg/ml以下,优选为0.8mg/l以下,更优选为0.5mg/l以下。第2培养基优选为不包含抗生素(例如青霉素)、成长因子或细胞因子。第2培养基优选为仅包含少量的铁、铜、铅等重金属元素及微量元素,或完全不包含。因为此种元素少,所以可抑制含有金属的蛋白质的合成,并促进生长因子的合成。第2培养基优选为不包含多胺(例如,putrescine 2hcl)等致癌性物质。第2培养基优选为不包含嘌呤碱基。在第2培养基不包含嘌呤碱基的情形,可活化核酸的补救途径。
[0034]
第2培养基因为不包含维生素及氨基酸,或仅包含少量,所以可促进自噬并增加生长因子的合成。
[0035]
第2培养基在一般的培养环境中可将培养中的环境保持固定(例如,可抑制酸性度的变动,在培养中,因为具有缓冲能力,所以变得不需要进行co2培养等)。
[0036]
第2培养基优选为水份量比一般的培养基多。例如,将第2培养基设为100重量%的情形,水份量优选为95重量%以上且99.99重量%以下,也可以为96重量%以上且99.9重量%以下,也可以为97重量%以上且99.9重量%以下。通过培养基的水份量多,可使渗透压下降。如此,例如在将细胞进行附着培养的情形,通常使用胰蛋白酶等动物来源的消化酵素而将细胞从培养容器剥下,但若使用第2培养基,则变得不需要使用消化酵素。如此,在对患者给药包含第2培养基的剂时,可减轻由动物来源成分所导致的感染等副作用。
[0037]
第2培养基可以是仅由糖质(例如,葡萄糖)、盐类(包含钙离子源,例如仅由nacl、kcl及cacl2所组成或包含此等作为主要盐类的盐类)、及缓冲剂(例如仅由mgso4·
h2o、
na2hpo4·
2h2o、kh2po4、nahco3及hepes所组成或包含此等作为主要缓冲剂的缓冲剂)及残余部份为溶剂(例如水)所组成的培养基。只要是此种组成,则如同由后述实施例所确认的其有效性,会高表达特定基因或蛋白质,同时是生物相容性优异的培养基且发挥作为输液的功能。
[0038]
第2培养基也可以是注射用的输液或点滴用的输液。此情形,可适当使用作为注射用的输液或点滴用的输液而被制造贩售的输液。注射用的输液的例子是糖液剂、细胞外液补充液(生理盐水、林格氏溶液、乳酸林格氏溶液、细胞外液补充液、醋酸林格氏溶液、重碳酸林格氏溶液)、低张性电解质液、氨基酸制剂(高浓度氨基酸液、肾功能衰竭用氨基酸液、肝功能衰竭用氨基酸液、儿童用氨基酸液)、ppn(末梢静脉营养输送液)、tpn(高卡路里输液)、脂肪乳剂及代用血浆增量剂。此等之中,优选为细胞外液补充液(生理盐水、林格氏溶液、乳酸林格氏溶液、细胞外液补充液、醋酸林格氏溶液、重碳酸林格氏溶液)及等张性电解质液。具体的输液是pareplus(注册商标)。
[0039]
第2培养基因为氨基酸含量少,所以可避免与被合成分泌的生长因子的相互作用(主要是氧化还原)及聚合反応,可防止成分的变质且防止由混入的氨基酸所导致的吸湿和变质。并且,第2培养基因为氨基酸含量少,所以在作为化妆品原料时会减少细菌的繁殖,因此即使不添加防腐剂、抗氧化剂,也可确保产品的稳定性。在第2培养基不包含氨基酸的情形,变得不需要用于使用在患部的脱氨基酸工序,且不会成为经常存在于患部的细菌等用于增殖的营养。此事意指在利用于创伤面时,不会成为恶臭的原因。并且,在制剂化之后,因为不会成为将包含第2培养基的剂进行点滴给药时的味觉障碍、体臭的原因,所以使用作为化妆品及医药时的便利性高。在第2培养基不包含氨基酸的情形,容易进行脱盐。因此,在大量培养细胞时,可简便地获得由冷冻干燥化所制成的高浓度生长因子干燥物。在一般的培养基的情形,不论在任何情形都要在48-72小时交换培养基。在第2培养基不是含有氨基酸的培养基的情形,因为抑制培养细胞的代谢活性,所以若保管在4℃冷处,则可维持长期间(例如7天左右)生存环境,之后通过交换培养基便可再次增殖细胞。第2培养基是包含钙离子及缓冲剂的培养基,优选为具有简单组成的培养基,所以泛用性高,可适用于所有动物细胞(包含es细胞、ips细胞、干细胞)及植物细胞(特别是植物的愈伤组织培养、植物干细胞的维持)。
[0040]
第2培养工序优选为不使用co2培养器且不进行co2培养的工序。也就是说,优选为使用培养容器,不进行co2孵育,而进行培养。第2培养工序优选为将细胞培养5小时以上且5天以下(10小时以上且2天以下,或5小时以上且3天以下)的工序。根据所培养的细胞,培养可以是附着培养也可以是悬浮培养,在去除细胞的情形,只要利用容易去除细胞的方法进行培养即可。
[0041]
培养上清液制剂取得工序是在第2培养工序之后获得包含第2培养基的培养上清液制剂的工序。培养上清液制剂优选为包含50重量%以上且100重量%以下的第2培养工序后的第2培养基。培养上清液制剂可以将第2培养工序后的第2培养基(包含培养上清液)包含60重量%以上且100重量%以下,优选为包含70重量%以上且99重量%以下、70重量%以上且90重量%以下、80重量%以上且99重量%以下、90重量%以上且100重量%以下、90重量%以上且95重量%以下。一般而言,干细胞等的培养上清液通常是使用通过离心分离而将培养上清液进行固液分离所得的上清液成分。此说明书所记载的方法因为可积极地在制
剂中包含第2培养基,所以也可使用仅将第2培养工序后的培养基进行过滤而得的培养上清液。
[0042]
培养上清液制剂可以是将如上述进行所得的培养上清液通过冷冻干燥去除水分而得的处理物、使用蒸发器等将培养上清液进行减压浓缩而得的处理物、使用超滤膜等将培养上清液进行浓缩而得的处理物,或使用过滤器将培养上澄清液进行固液分离而得的处理物,或者进行如上述的处理前的培养上清液的原液。并且,例如也可以将已培养过细胞的上澄清液进行离心分离(例如,1,000
×
g、10分钟)后,利用硫酸铵(例如,65%饱和硫酸铵)进行划分,将沉淀物悬浮在适当的缓冲液后,进行透析处理,利用针头式过滤器(例如,0.2μm)进行过滤,而获得无菌的培养上清液。所采取的培养上清液可以直接使用,也可以先冷冻保存等到要使用时再解冻使用。并且,也可以添加药剂学上允许的载体,以成为容易操作的液量例如0.2ml或0.5ml等的方式分注至灭菌容器。再者,作为感染性病原体风险的对策,可以将培养上清液通过病毒清除过滤器或γ射线照射而进行处理。
[0043]
如同上述,在第2培养工序之后,也可以包含:培养上清液回收工序,将培养上清液进行回收;及冷冻工序,将培养上清液回收工序所回收的培养上清液进行冷冻。为了将培养上清液进行冷冻,例如只要使培养上清液为-200℃以上且0℃以下即可,也可为-100℃以上且-5℃以下。
[0044]
此外,培养上清液制剂可以是将第2培养工序后的细胞进行破碎,在离心分离后,使用过滤器进行过滤的培养上清液制剂,也可以是进一步将过滤物进行冷冻、干燥的培养上清液制剂。
[0045]
培养上清液制剂(本发明的剂)只要使用本领域技术人员众所周知的方法进行制造即可。本发明的剂,可被制造成口服用制剂及非口服用制剂,但优选为非口服用制剂。此种非口服用制剂可以是液剂(水性液剂、非水性液剂、悬浮性液剂、乳浊性液剂等),也可以是固形剂(粉末填充制剂、冷冻干燥制剂等)。并且,本发明的剂可以是控释制剂。作为在将活细胞作为剂的情形的剂形,优选为液剂,作为将细胞的部份成分或死细胞整体作为剂的情形的剂形,可选择液剂也可选择固形剂。
[0046]
包含培养上清液作为有效成分的剂,例如,如同日本特开2013-18756号公报、日本特许第5139294号及日本特许第5526320号公报所公开,是众所周知的。因此,可使用众所周知的方法制造包含本发明的培养上清液的剂。
[0047]
作为由本发明所制造的培养上清液的剂型,可选择液剂和固形剂这两种。在将蛋白质作为主剂的生物医药品中,由稳定性的问题而言,常常选择保存性优异的粉体化。本发明的培养上清液为了提升稳定性和保存期间,也期望被制造成固形剂。
[0048]
包含本发明的培养上清液的剂,可使用静脉内给药、动脉内给药、肌肉内给药、皮下给药、腹腔内给药、鼻腔内给药、脊椎管腔内给药、关节内给药、牙龈内给药、涂布等众所周知的给药方法进行给药。本发明的剂可直接对患部或对象部位进行给药,也可通过外科手术在患部开口而将本发明的剂进行给药,也能在内视镜以及导管下不见血地进行给药。依据成为对象的疾病,能使用所有最适合的给药方法。在选择静脉内注射作为移植法的情形中,优选为将培养上清液以0.1ml以上且1,000ml以下作为1给药单位进行给药,更优选为以30ml以上且300ml以下进行给药。
[0049]
制造液剂的方法可利用众所周知的方法进行制造。例如,可将间充质干细胞混合
至药学上允许的溶剂,并填充至已灭菌的液剂用容器,借此进行制造。药学上允许的溶剂的例子是注射用水、蒸馏水、生理盐水、电解质溶液剂或按照培养液的组成的液剂,优选为使用已灭菌的溶剂。已灭菌的液剂用容器的例子是安瓿、小瓶、注射器及小包。此等容器可使用玻璃制或塑料制等众所周知的容器。具体而言,塑料制容器的例子是使用聚氯乙烯、聚乙烯、聚丙烯、乙烯-醋酸乙烯共聚物等材质的塑料制容器。此等容器及溶剂的灭菌法的例子是加热法(火焰法、干燥法、高温蒸汽法、流通蒸汽法、煮沸法等)、过滤法、照射法(放射线法、紫外线法、高频法等)、气体法及药液法。此种灭菌法是根据容器的材质、溶剂的性质,只要是本领域技术人员便可适当选择使用。
[0050]
此外,本说明书也公开一种包含培养细胞的制剂。在将细胞做成为液剂并使用于治疗的情形,作为移植法,最常能使用静脉内注射。举例而言,在静脉内注射的情形中,优选为调整成1
×
105细胞/ml以上且5
×
107细胞/ml以下并且为液剂,更优选为1
×
106细胞/ml以上且1
×
107细胞/ml。并且,作为被调整成在人类中进行静脉内注射的1给药单位的间充质干细胞剂,优选为1
×
105细胞以上且1
×
109细胞,更优选为2
×
107细胞以上且2
×
108细胞。关于其他给药途径,可在能移植至组织的液量及能在所述液量中悬浮的最大细胞数以下的范围内使用。
[0051]
作为制造固形剂的方法,例如可使用冷冻干燥法、spray drying(喷雾干燥)法及无菌再结晶法。
[0052]
包含细胞的剂,可使用静脉内给药、动脉内给药、肌肉内给药、皮下给药、腹腔内给药、鼻腔内给药、脊椎管腔内给药、关节内给药、牙龈内给药等众所周知的给药方法进行给药。给药方式的优选例是利用注射的给药,在静脉内给药的情形,也可以利用点滴注入本发明的剂。
[0053]
细胞也可以和药学上允许的载体或介质一起被调整。药学上允许的载体或介质可列举例如,赋形剂、稳定化剂、溶解辅助剂、乳化剂、悬浮化剂、缓冲剂、等张化剂、抗氧化剂或保存剂等药学上允许的物质。并且,也可使用聚乙二醇(peg)等高分子材料高分子材料、环糊精等共轭化合物。赋形剂的例子是淀粉或乳糖等本身不具有药理作用的物质。稳定化剂的例子是白蛋白、明胶、山梨糖醇、甘露醇、乳糖、蔗糖、海藻糖、麦芽糖及葡萄糖。此等之中,优选为蔗糖或海藻糖。溶解辅助剂的例子是乙醇、甘油、丙二醇及聚乙二醇。乳化剂的例子是卵磷脂、硬脂酸铝,或山梨醇酐倍半油酸酯。悬浮化剂的例子是聚乙二醇、聚乙烯吡咯烷酮(pvp),或羧甲纤维素(cmc)。等张化剂的例子是氯化钠及葡萄糖。缓冲剂的例子是柠檬酸盐、醋酸盐、硼酸及磷酸盐。作为用于使细胞悬浮的水性媒质,例如,只要适当使用将渗透压及ph调整成血液的值的附近且已调整盐类浓度等的注射用水溶液等即可,例如,可使用醋酸林格氏溶液、糖加醋酸林格氏溶液等林格氏溶液其他输液、生理盐水,或葡萄糖液等,但不限于此等。例如,在使用输液用林格氏溶液的情形,也可以在此之中添加允许量的二甲基亚砜(dmso)或人类血清白蛋白(hsa)。抗氧化剂的例子是抗坏血酸、亚硫酸氢钠及焦亚硫酸钠。保存剂的例子是苯酚、硫柳汞及苯扎氯铵。
[0054]
本发明也提供一种方法,包含为了治疗对象(人类或人类以外的哺乳动物)的各种疾病并提升各种能力,而将培养上清液(或培养细胞、培养细胞来源精制品)给药至对象的工序。
[0055]
本说明书所公开的不同于上述的发明是一种药液,是发挥作为细胞培养用培养基
及输液的功能的药液,药液包含钙离子、前列腺素及缓冲剂。此药液只要适当采用上述第2培养基即可。
[0056]
如同日本特许6497827号公报所记载,培养上清液发挥作为类花生酸产生促进剂的功能。此剂优选为动脉硬化或糖尿病的治疗剂。日本特许第6250196号公报中记载ppar激动剂是糖尿病的治疗剂。日本特许第4515026号中公开将pparγ进行活化对糖尿病的治疗是有效的。在日本特许第6157041号中公开pparγ活化剂在动脉硬化及糖尿病的治疗上是有效的。本发明的剂因为会活化pparγ,所以在动脉硬化及糖尿病的治疗上是有效的。此剂优选为类风湿性关节炎的治疗剂。在类风湿性关节炎模型中,已知15-脱氧δ-12,14-前列腺素j2会抑制风湿病临床评分、疼痛及浮肿(mediators inflamm.2016;2016:9626427.epub 2016oct 31.)。本发明的剂是促进产生来自巨噬细胞的pparγ的活化剂亦即类花生酸的剂,例如,因为促进产生15-脱氧δ-12,14-前列腺素j2,所以在类风湿性关节炎的治疗上是有效的。此剂优选为前列腺癌、脑梗塞或脑功能障碍的预防剂或治疗剂。例如,在cancer res.2001jan 15;61(2):497-503.中,报告15-hete抑制前列腺癌细胞株(pc3)的增殖,在多种恶性肿瘤中有抑制作用。并且,在j lipid res.2015mar;56(3):502-14中,报告15-hete的给药会抑制脑梗塞模型的脑缺血后的脑组织障碍级别、脑中的炎症反应。本发明的剂是促进产生来自巨噬细胞的pparγ的活化剂亦即类花生酸的剂,例如因为促进产生15-羟二十烷四烯酸(15-hete),所以在前列腺癌的治疗上是有效的。日本特许第5940261号公报中记载,过氧物酶体增殖剂反应性受体γ(pparγ)活化剂会预防及改善高血压症、胰岛素抵抗性疾病、脑梗塞、阿尔茨海默病、神经疾病的至少一种。本发明的剂因为会活化pparγ,所以在脑梗塞及脑功能障碍的预防及治疗上是有效的。此剂优选为疼痛的预防剂或治疗剂。例如,在exp.ther.med.2016oct;12(4):2644-2650.中,公开pparγ的活化剂亦即吡格列酮的给药会抑制神经障碍性疼痛中的活化小神经胶质细胞,结果会缓和对于机械刺激的疼痛临界值。本发明的剂是促进产生来自巨噬细胞的pparγ的活化剂亦即类花生酸的剂,例如,因为会促进产生15-脱氧δ-12,14-前列腺素j2,所以在疼痛的预防或治疗上是有效的。
[0057]
在日本特许6132459号公报中,记载包含间充质干细胞的培养上清液的肠炎的预防治疗剂。因此,包含本发明的培养上清液的剂,在肠炎的预防治疗上是有效的。
[0058]
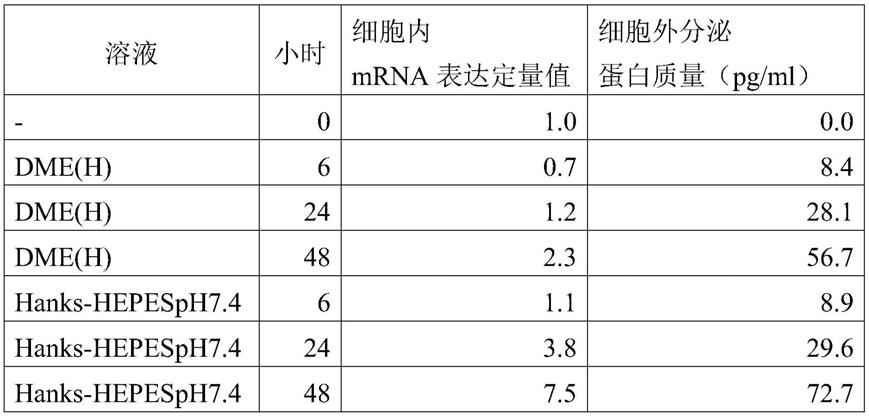
实施例1
[0059]
细胞培养、培养上清液回收
[0060]
将正常人类脂肪组织进行酵素处理,将所提取的脂肪组织来源间质细胞,使用含有20%fbs(胎牛血清)的dme培养基(gibco公司制达尔伯克改良伊格尔培养基,高葡萄糖),在无涂层的培养烧瓶(falcon公司制)中进行培养,作为初代培养。将即将要汇合的初代培养细胞通过酵素处理进行回收后,利用相同培养基播种在无涂层培养用12孔板(住友电木株式会社制),进行培养直到汇合为止。
[0061]
确认汇合后,去除培养基,利用pbs(ds pharma biomedical公司制杜氏磷酸缓冲液)清洗细胞表面。
[0062]
将清洗后的细胞置换到不含fbs的dme培养基,或hbss(sigma-aldrich公司制汉克平衡盐溶液)-hepes。之后将12孔分成每3孔一组共4组,不含fbs的dme培养基是在5%co2培养器内(参考例)进行培养,hbss-hepes是在培养器内(实施例)进行培养。在刚置换后(0小时)、3小时后、6小时后、24小时后、48小时后,回收各孔内的培养上清液。
[0063]
不含fbs的dme培养基是不包含fbs的达尔伯克改良伊格尔培养基。dme培养基包含葡萄糖、l-谷氨酰胺等各种成分。
[0064]
hbss(汉克平衡盐溶液)是(1)等张液亦即碳酸氢钠溶液、(2)包含nacl、kcl、mgso4·
7h2o、na2hpo4、葡萄糖及kh2po4的缓冲液及(3)cacl2溶液及缓冲液。
[0065]
hepes是羟乙基哌嗪乙烷磺酸、缓冲剂或ph调整剂。
[0066]
不含fbs的dme培养基所含的糖质的量是4.5g/l,氨基酸(l-谷氨酰胺酸以外)的总量是1.6g/l,钙离子是1.8mm。
[0067]
另一方面,hbss-hepes培养基(hanks-hepesph7.4)所含的糖质的量是1.0g/l,nacl是8.0g/l,kcl是0.4g/l,cacl2是0.14g/l,mgso4·
h2o是0.2g/l,na2hpo4·
2h2o是0.06g/l,kh2po4是0.06g/l,nahco3是0.35g/l,20mm hepes的ph7.4,氨基酸(l-谷氨酰胺酸以外)的总量是0g/l,钙离子是1.5mm。
[0068]
基因表达量的测量方法
[0069]
如上述所示将培养上清液回收后,在所述孔中分别添加400微升的rna提取液isogen(nippon gene no.319-90211),依照通用方法从细胞提取总rna,使利用ethachinmate(nippon gene no.312-01791)所得的总rna的沉淀物溶解于无核酸酶水中。使用其中的1.5微升,通过nanodrop(赛默科技公司)而测量总rna的浓度。使用iscript cdna合成套组(bio radno.1708891)从所得的100纳克的总rna合成互补dna,并使用于利用实时聚合酶链反应(qiagen公司制rotor-gene q)的各基因表达量的定量。
[0070]
利用实时聚合酶链反应法的基因表达的定量化
[0071]
混合所合成的dna、对进行检测定量化的基因具有特异性的引物(quantitect primer assay,qiagen)、实时聚合酶链反应试剂(rotorgene sybr green,qiagen),利用rotorgeneq系统(qiagen公司)进行实时聚合酶链反应,将进行检测定量化的基因的片段进行扩增。此时,将看家基因亦即β-actin特异性引物同样地进行扩增,将其扩增曲线作为指标,相对地计算想要检测定量化的基因的定量值。
[0072]
使用qiagen公司的以下引物混合液作为对于各基因具有特异性的引物。
[0073]
人类β-actin
[0074]
hs_actb_1_sg目录编号qt00095431
[0075]
人类fgf2
[0076]
hs_fgf2_1_sg目录编号qt00047579
[0077]
人类vegfa
[0078]
hs_vegfa_1_sg目录编号qt01010184
[0079]
培养上清液所含的蛋白质的定量化方法
[0080]
将如细胞培养、培养上清液回收所示而回收的培养上清液通过0.22微米直径的过滤器,作为蛋白质定量用的样品。
[0081]
在样品的蛋白质定量中,使用r&d systemsr公司的quantikine elisa(human vegf,fgf-2)套组,依据其操作指南,获得各蛋白质的定量值。
[0082]
将其结果显示于表1及表2。
[0083]
[表1]
[0084]
vegf
[0085][0086]
[表2]
[0087]
fgf-2
[0088][0089]
实时聚合酶链反应的结果
[0090]
细胞内的vegf基因的表达量在hanks-hepes溶液中最多。
[0091]
细胞内的fgf-2基因的表达量在hanks-hepes溶液中最多。
[0092]
蛋白定量的结果
[0093]
培养上清液中的vegf的量在hanks-hepes溶液中最多。
[0094]
培养上清液中的fgf-2的量在dme培养基中最多。
[0095]
考察
[0096]
0、6、24、48小时、经时的基因的表达量、培养上清液中的蛋白质的量呈现一起增加的倾向。vegf基因的表达量、培养上清液中的蛋白质的量在hanks-hepes溶液(实施例)中最多。fgf-2的基因表达量在hanks-hepes溶液中最多,但关于培养上清液中的蛋白质的量则是在dme(h)(参考例)较多。
[0097]
实施例2
[0098]
细胞培养、培养上清液回收
[0099]
将正常人类皮肤组织进行酵素处理,将所提取的表皮角化细胞使用含有s7-添加
物(gibco公司制no.s0175)的无血清细胞用培养基(gibco公司制no.mepi500ca),在无涂层的培养烧瓶(falcon公司制)中进行培养,作为初代培养。将即将汇合的初代培养细胞通过酵素处理进行回收后,利用相同培养基播种在无涂层培养用12孔板(住友电木株式会社制),进行培养直到汇合为止。
[0100]
确认汇合后,去除培养基,利用pbs(ds pharma biomedical公司制杜氏磷酸缓冲液)清洗细胞表面,置换到不含7-添加物的无血清细胞用培养基(epilife:参考例),或hbss-hepesph7.4溶液(实施例)。之后,将12孔分成每3孔一组共4组,在刚置换后(0小时)、3小时后、6小时后、24小时后,回收各孔内的培养上清液。
[0101]
不含7-添加物的无血清细胞用培养基(epilife:参考例)所含的糖质的量是1.0g/l,氨基酸(l-谷氨酰胺酸以外)的总量是1.5g/l,钙离子是8.4mg/l。
[0102]
基因表达量的测量方法
[0103]
如上述所示回收培养上清液后,在所述孔中分别添加400微升的rna提取液isogen(nippon gene no.319-90211),依据通用方法从细胞提取总rna,使利用ethachinmate(nippon gene no.312-01791)而得的总rna的沉淀物溶解于无核酸酶水中。使用其中的1.5微升,通过nanodrop(赛默科技公司)而测量总rna的浓度。使用iscript cdna synthesis kit(bio radno.1708891)从所得的100纳克的总rna合成互补dna,并使用于利用实时聚合酶链反应(qiagen公司制rotor-gene q)的各基因表达量的定量。
[0104]
利用实时聚合酶链反应法的基因表达的定量化
[0105]
混合所合成的对进行dna定量化的基因具有特异性的引物(quantitact primer assay,qiagen)、实时聚合酶链反应试剂(rotor-gene sybr green,qiagen),利用rotor-geneq系统(qiagen公司),进行实时聚合酶链反应,将进行检测定量化的基因的片段进行扩增。此时,将看家基因亦即β-actin特异性引物同样地进行扩增,将其扩增曲线作为指标,相对地计算想要检测定量化的基因的定量值。
[0106]
使用qiagen公司的以下引物混合液作为对于各基因具有特異性的引物。
[0107]
人类β-actin
[0108]
hs_actb_1_sg目录编号qt00095431
[0109]
人类egf
[0110]
hs_egf_1_sg目录编号qt00051646
[0111]
人类vegfa
[0112]
hs_vegfa_1_sg目录编号qt01010184
[0113]
人类fgf2
[0114]
hs_fgf2_1_sg目录编号qt00047579
[0115]
培养上清液所含的蛋白质的定量化方法
[0116]
将如细胞培养、培养上清液回收所示而回收的培养上清液通过0.22微米直径的过滤器,作为蛋白质定量用的样品。
[0117]
在样品的蛋白质定量中,使用r&d systemsr公司的quantikine elisa(human vegf)套组,依据其操作指南,获得各蛋白质的定量值。将其结果显示于表3-表5。
[0118]
[表3]
[0119]
egf
[0120][0121][0122]
[表4]
[0123]
vegf
[0124][0125]
[表5]
[0126]
fgf-2
[0127][0128][0129]
实时聚合酶链反应结果
[0130]
细胞内的egf基因的表达量,比起在epilife培养基(参考例)中,在hanks-hepes溶液(实施例)中较多。细胞内的fgf-2基因表达量,比起在epilife中,在hanks-hepes溶液中较多。
[0131]
细胞内的vegf基因表达量,比起在epilife中,在hanks-hepes溶液中较多。蛋白定量的结果,培养上清液中的vegf的量在hanks-hepes中较多。
[0132]
实施例3
[0133]
将已汇合的脂肪组织来源间质细胞的培养液利用3种类的溶液进行置换,定量48小时后的细胞内各mrna的表达量。已置换的溶液是不含有fbs的dme培养基、hbss-hepes培养基及pareplus输液。将定量mrna的表达量的结果显示于表6。
[0134]
pareplus意指pareplus输液,包含葡萄糖、氯化钠、l-乳酸钠、水合氯化钙、水合硫酸镁、水合硫酸锌、氯化硫胺盐酸盐、盐酸吡哆醇、氰钴胺、泛酰醇、冰醋酸、氨基酸、电解质、稳定剂及ph调节剂。
[0135]
[表6]
[0136][0137][0138]
由表6可知,比起培养基(dme(h)),电解质溶液(hanks-hepes,pareplus)中的基因的表达量较多。在电解质溶液中,可知更优选为hanks-hepes。
[0139]
实施例4
[0140]
将已汇合的脂肪组织来源间质细胞的培养液利用下述溶液进行置换,定量48小时
后的细胞内各mrna的表达量。
[0141]
[表7]
[0142]
vegf
[0143][0144][0145]
kn2号是表示kn2号输液。kn2号输液包含氯化钠、氯化钾、l-乳酸鈉、氯化镁、磷酸二氢钠水合物、二氧化钾及葡萄糖。
[0146]
[表8]
[0147]
fgf-2
[0148][0149]
在比较hbss-hepesph7.4和hbss的情形,通过添加hepesph7.4,ph成为酸性的速度变慢,因此可知会促进基因表达。
[0150]
实施例5
[0151]
培养上清液的回收、冷冻干燥
[0152]
将在第二培养工序经过48小时后的培养上清液回收至50ml离心管(住友电木株式会社)后,进行离心分离(740g,5分钟),将其上清液通过膜孔径0.2微米的过滤过滤器(仓敷纺织株式会社),分注至注射器(泰尔茂株式会社)。将注射器封入灭菌袋中,使其在-80℃的冷冻室内冷冻后,移至冷冻干燥装置(yamato scientific株式会社)內,進行冷冻干燥。冷冻干燥結束后,利用注射器用鲁尔帽(泰尔茂株式会社)進行封盖。
[0153]
实施例6
[0154]
和实施例1同样地,确认脂肪组织来源间质细胞已汇合后,去除培养基,利用pbs清洗细胞表面。
[0155]
将清洗后的细胞置换到hbss-hepes。之后,将12孔分成每2孔一组共6组,hbss-hepes在培养器内(实施例)进行培养。在刚置换后(0小时)、1天后、2天后、3天后、4天后、5天后、6天后,使用isogen(nippon gene公司制),从各孔的细胞提取总rna,通过实时聚合酶链反应,进行vegf基因的表达的相对定量。将其结果显示于表9。如同表9所示,可知基因表达维持到5天后为止。
[0156]
[表9]
[0157]
vegf
[0158][0159]
实施例7
[0160]
和实施例1同样地,确认脂肪组织来源间质细胞已汇合后,去除培养基,利用pbs清洗细胞表面。
[0161]
将清洗后的细胞置换到hbss-hepesph6.5、hbss-hepesph7.0、hbss-hepesph7.4、hbss-hepesph7.8、hbss-hepesph9.0。在刚置换后(0小时)、48小时后,使用isogen(nippon gene公司制),从各孔的细胞提取总rna,通过实时聚合酶链反应,进行vegf基因的表达的相对定量。将其结果显示于表10。如表10所示,可知基因表达从hbss-hepesph7.0维持到hbss-hepesph7.8为止。
[0162]
[表10]
[0163]
vegf
[0164][0165]
实施例8
[0166]
和实施例1同样地,在12孔板培养脂肪组织来源间质细胞,确认已汇合后,去除培养基,利用pbs清洗细胞表面。
[0167]
将清洗后的细胞分成每3孔一组共4组,分别置换到已添加0ng/ml、4ng/ml、40ng/ml、400ng/ml的浓度的pge1(prostandin丸石制薬株式会社制)的hbss-hepes,在培养器内(实施例)进行培养。在置换后48小時后,从各孔回收培养上清液,利用quantikine elisa human vegf(r&d systems公司制)进行蛋白定量。并且,从培养上清液回收后的各孔,使用isogen(nippon gene公司制)提取总rna后,使用iscript cdna合成套组(bio rad公司制)合成互补dna,并使用于利用实时聚合酶链反应(rotor-gene q,qiagen公司制)的vegf基因表达量的相对定量。将其结果显示于表11。如表11所示,mrna的表达量的相对定量値不受pge1的添加量影响,几乎为相同程度。关于蛋白量,可知会根据pge1的添加量而呈现增加倾向。由此可知,通过将培养基置换成含有pge1的hbss-hepes并培养48小时,能获得包含更高浓度的vegf的培养上清液。
[0168]
[表11]
[0169][0170]
实施例9
[0171]
将正常人类脂肪组织进行酵素处理,将所提取的脂肪组织来源间质细胞(asc),使用含有20%fbs(胎牛血清)的dme培养基(gibco公司制达尔伯克改良伊格尔培养基,高葡萄糖),在培养烧瓶t75(bd falcon公司制)中进行培养,作为初代培养。将即将汇合的初代培养细胞通过酵素处理回收后,进行适当稀释,将适当细胞数利用相同培养基播种到1片培养
用6孔板(住友电木株式会社制),进行培养直到汇合为止。
[0172]
将已汇合的各孔的细胞分成每3孔一组共2组,去除各自的培养基,利用pbs(ds pharma biomedical公司制杜氏磷酸缓冲液)清洗各孔的细胞表面。
[0173]
清洗后,在第1组中添加dme高葡萄糖培养基,在第2组中添加以最终浓度成为10mmhepesph7.4的方式制备的hbss(sigma-aldrich公司制汉克平衡盐溶液),在第3组中添加以最终浓度成为20mmhepesph7.4的方式制备的hbss。在培养器内(实施例)培养48小時后,分别将培养上清液回收到5ml容量的管(bd falcon公司制),利用quantikine elisa human vegf(r&d systems公司制)进行vegf蛋白质的定量。再使用isogen(nippon gene公司制),从各孔的细胞提取总rna,进行浓缩,使用iscript cdna合成套组(bio rad公司制)而获得互补dna。然后,使用此互补dna,通过实时聚合酶链反应(rotor-gene q,qiagen公司制)进行vegf、fgf2basic、mmp1、efna3、bmp1、wnt5a基因的各表达量的相对定量。将其结果显示于表12-表17。相对定量值是将β-actin作为内部标准而进行样品间的校正,并将在dme高葡萄糖培养基的值作为参考值所算出。如同表12-表17所示,可见到细胞内的各mrna有在利用hbss-10mmhepesph7.4进行培养的细胞内会表达的比在利用dme培养基进行培养的细胞内更多的倾向,进一步可知hepes的浓度在20mm较多。
[0174]
[表12]
[0175]
vegf
[0176][0177]
[表13]
[0178]
fgf2basic
[0179]
[0180]
[表14]
[0181]
mmp1
[0182][0183][0184]
[表15]
[0185]
efna3
[0186][0187]
[表16]
[0188]
bmp1
[0189][0190]
[表17]
[0191]
wnt5a
[0192][0193][0194]
实施例10
[0195]
和实施例4同样地,将脂肪组织来源间质细胞(asc)播种到5片培养用6孔板(住友电木株式会社制),进行培养直到汇合为止。
[0196]
同样地,将人类牙髓干细胞(shed)播种到5片6孔板,进行培养直到汇合为止。
[0197]
针对已汇合的asc和shed,将各孔的细胞分成每2孔一组共3组,去除各自的培养基,利用pbs(ds pharma biomedical公司制杜氏磷酸缓冲液)清洗各孔的细胞表面。
[0198]
清洗后,在3组中,分别添加3ml、2ml、1ml的hbss(sigma-aldrich公司制汉克平衡盐溶液)-hepesph7.4,在培养器内(实施例)培养48小時后,将培养上清液分别回收到5ml容量的管(bd falcon公司制),利用quantikine elisa human vegf(r&d systems公司制)进行vegf蛋白质的定量。再使用isogen(nippon gene公司制)从各孔的细胞提取总rna,进行浓缩,使用iscript cdna合成套组(bio rad公司制)而获得互补dna。然后,使用此互补dna,通过实时聚合酶链反应(rotor-gene q,qiagen公司制),进行vegf基因表达量的相对定量。
[0199]
相对定量値是将β-actin作为内部标准而进行样品间的校正,并将一般的培养基量2ml的值作为参考值所算出。
[0200]
[表18]
[0201]
结果
[0202][0203]
[表19]
[0204][0205]
关于细胞内的mrna的表达量,未见到由培养上清液的量所导致的变化。培养上清液中所含的vegf蛋白质的量,在培养上清液的容积多的组别变少,在培养上清液的容积少的组别则变得更多。由此可知,通过使用比通常使用的培养基的容积更少量的培养基,能获得包含更多的成长因子的培养上清液。
[0206]
实施例11
[0207]
和实施例5同样地,将在第二培养工序经过48小时后的培养上清液进行回收,将进行离心分离(740g,5分钟)所得的培养上清液分成无添加组、添加250mm海藻糖(株式会社林原制)组共2组。之后,通过膜孔径0.2微米的过滤过滤器(仓敷纺织株式会社),分注到注射器(泰尔茂株式会社)。将注射器封入灭菌袋,使其在-80℃的冷冻室内冷冻后,移至冷冻干燥装置(yamato scientific株式会社)内,进行冷冻干燥。冷冻干燥结束后,利用注射器用鲁尔帽(泰尔茂株式会社)栓紧。在栓紧的状态下,以-80℃、4℃、25℃这3个温度条件分别保管3周。经过3周后,利用注射用水(大冢制药株式会社制)将冷冻干燥样本再悬浮,利用quantikine elisa human vegf(r&d systems公司制)进行蛋白定量。定量値是将在-80℃保管3周后的培养上清液所含的vegf蛋白质的定量値作为基准,计算在各保管温度中的vegf蛋白质的相对定量値。将其结果显示于表20。如同表20所示,在无添加的冷冻干燥培养上清液中,通过在25℃环境下的保管,可确认到vegf蛋白质明显减少。此暗示伴随着吸湿、光氧化的蛋白质的分解。另一方面,可知若添加最终浓度250mm的海藻糖,则会抑制vegf蛋白质的减少。
[0208]
[表20]
[0209][0210]
实施例12
[0211]
将正常人类脂肪组织进行酵素处理,将所提取的脂肪组织来源间质细胞,使用含有20%fbs(胎牛血清)的dme培养基(gibco公司制达尔伯克改良伊格尔培养基,高葡萄糖),在培养烧瓶(falcon公司制)中进行培养,作为初代培养。将即将汇合的初代培养细胞通过酵素处理回收后,利用相同培养基播种到5个培养用烧瓶t75(bd falcon公司制),进行培养直到汇合为止。
[0212]
确认已汇合后,去除培养基,利用pbs(ds pharma biomedical公司制杜氏磷酸缓
冲液)清洗细胞表面。
[0213]
将清洗后的细胞置换到hbss(sigma-aldrich公司制汉克平衡盐溶液)-hepes中,在培养器内(实施例)培养48小時后,将培养上清液分别回收到20ml容量的注射器(泰尔茂公司制),每个注射器各15ml的培养上清液。
[0214]
使所回收的培养上清液进行冷冻干燥。
[0215]
将2个在20ml注射器中已冷冻干燥的培养上清液,分别在注射用水15ml中悬浮,使用vivaspin20,vs2041(赛多利斯公司制)和离心分离機kubota2800(久保田公司制),进行浓缩操作直到成为0.6ml为止。
[0216]
浓缩操作后,针对其中1个,使用exosome isolation kit(富士胶片和光公司制),依据通用方法,单一提取培养上清液中的exosome(样品1)。所提取的exosome提取液是0.1ml。针对剩下的1个,直接保管在1.5ml管(艾本德公司制)中(样品2)。
[0217]
进行浓缩操作,关于已单一提取exosomen的样品1和仅进行浓缩操作的培养上清液样品2,使用exosomeelisa kit(富士胶片和光公司制),依据通用方法,将其等所含的exosome相对地进行定量。定量値是求出450nm的吸光度和650nm的吸光度的差,利用空白组的值进行校正,基于其吸光度的值,以培养上清液15ml所含的吸光度的累计值的形态所表示。将其结果显示于表21。如同表21所示,由两者的吸光度的值的比较可知,在利用本制造方法所制的培养上清液中包含exosome,即使不刻意进行单一提取,也可活用相等量的exosome。
[0218]
[表21]
[0219]
exosome相对定量的结果
[0220] exosome的定量值样品1116.94样品2150.06
[0221]
实施例13
[0222]
将正常人类脂肪组织进行酵素处理,将所提取的脂肪组织来源间质细胞(asc),使用含有20%fbs(胎牛血清)的dme培养基(gibco公司制达尔伯克改良伊格尔培养基,高葡萄糖),在培养烧瓶t75(bd falcon公司制)中进行培养,作为初代培养。将即将汇合的初代培养细胞通过酵素处理回收后,利用相同培养基播种至2片培养用6孔板(住友电木株式会社制),进行培养直到汇合为止。
[0223]
将已汇合的各孔的细胞分成每3孔一组共2组,去除各自的培养基,利用pbs(ds pharma biomedical公司制杜氏磷酸缓冲液)清洗各孔的细胞表面。
[0224]
清洗后,在2组中添加2ml的hbss(sigma-aldrich公司制汉克平衡盐溶液)-hepesph7.4,在培养器内(实施例)培养24小時或48小時。经过24小時或48小時后,针对第1组,如同一般地,将上清液回收到5ml容量的管(bd falcon公司制)中。关于第2组,使用细胞刮刀(旭硝子公司制),将附着细胞和培养上清液一起回收到5ml容量的管中,使用physcotron(日音医理科器械制作所公司制)将细胞打碎,作为测量样本。将各样本使用quantikine elisa human vegf(r&d systems公司制)进行vegf蛋白质的定量。将从第1组(培养上清液)所得的vegf蛋白质的定量値作为基准,计算含有细胞的培养上清液所含的vegf蛋白质的相对定量値。将其结果显示于表22及表23。在表23中,相对定量値是将从培养
24小時后的培养上清液所得的vegf蛋白质的定量値作为基准,计算培养48小時后的各样本所含的vegf蛋白质的相对定量値的相对定量値。如同表22及表23所示,可知通过使用含有细胞的培养上清液,可活用更多的生长因子。
[0225]
[表22]
[0226]
结果
[0227]
培养时间24小时
[0228]
样本vegf相对定量値培养上清液1.00含有细胞的培养上清液1.25
[0229]
[表23]
[0230]
培养时间48小时
[0231]
样本vegf相对定量値*(相对定量值)培养上清液1.002.90含有细胞的培养上清液1.263.65
[0232]
实施例14
[0233]
从健康正常的人类皮肤组织来源表皮细胞,依据通常方法,选择培养成纤维细胞。将所得的初代培养进行维持培养,将其第4继代播种到5片6孔板(住友电木株式会社制),进行培养直到汇合为止。将已汇合的各孔的细胞分成每3孔一组共2组,去除各自的培养基,利用pbs(ds pharma biomedical公司制杜氏磷酸缓冲液)清洗各孔的细胞表面。清洗后,第1组利用各2ml的hbss(sigma-aldrich公司制汉克平衡盐溶液)-hepesph7.4进行置换,第2组、第3组则是利用在相同量的hbss-hepesph7.4中以最终浓度分别成为10%、50%的方式添加由实施例1所示的脂肪组织干细胞来源培养上清液(ascsup.)而成的溶液进行置换。之后,在培养器内培养3、6、24或48小时。经过各自的时间后,使用isogen(nippon gene公司制),从各孔提取总rna后,使用iscript cdna合成套组(bio rad公司制)合成互补dna,将此互补dna使用于利用实时聚合酶链反应(rotor-gene q,qiagen公司制)的fgfbasic、vegf基因表达量的相对定量。相对定量值是将β-actin作为内部标准而进行样品间的校正,并将在已汇合的时间点的细胞的各基因表达量的値作为参考值所算出。将其结果显示于表24及表25。
[0234]
[表24]
[0235]
fgf-basic定量值
[0236]
经过小时无添加ascsup.添加10%ascsup.添加50%ascsup.01.001.001.0030.880.811.1660.971.511.32242.391.992.46482.022.082.62
[0237]
[表25]
[0238]
vegf定量值
[0239]
经过小时无添加ascsup.添加10%ascsup.添加50%ascsup.01.001.001.0031.141.313.9460.931.396.57245.785.1712.47486.9210.2710.78
[0240]
如表24及表25所示,关于fgf-basic基因,在无添加asc-sup.组中,直到培养基置换后24小时间为止有伴随着时间经过而表达增加的倾向,但在48小时后停滞。另一方面,在添加组中,直到置换后48小时前,可见随着时间经过而表达增加,且增加率随着其添加量而变高。
[0241]
关于vegf基因,无添加组、添加组均在置换后48小时前,随着时间经过而呈现表达增加的倾向,且其增加率随着asc-sup.的添加量而明显变高。
[0242]
通过在成纤维细胞中添加脂肪组织来源间质细胞培养上清液,而促进所述细胞本身的生长因子的表达,暗示在组织再生上是有效的。
[0243]
实施例15
[0244]
利用通常方法提取健康正常的人类皮肤组织来源表皮细胞,并播种至6孔板。此时,分成epilife培养基、在epilife培养基中添加由实施例1所示的脂肪组织干细胞来源培养上清液这2组,进行培养直到汇合为止。确认已汇合后,依据通常方法,实施l-dopa染色,定量表皮细胞所含的色素干细胞的色调。定量値是使用影像软件imagej,由已实施l-dopa染色的色素干细胞的黑色部份的面积的比例而得。将其结果显示于表26。
[0245]
[表26]
[0246]
结果
[0247][0248]
如同表26所示,已添加脂肪组织干细胞来源的培养上清液的培养基,存在于表皮细胞中的色素干细胞的由l-dopa染色所导致的色调的定量値低,因此暗示在脂肪组织干细胞来源的培养上清液中,发挥抑制色素干细胞的增殖、往色素细胞的分化的作用。因此可知,作为美白成分是有效的。
[0249]
实施例16
[0250]
和实施例5制造培养上清液的冷冻干燥品。使从1ml分量的培养上清液所制造的冷冻干燥培养上清液融解于2种类的透明质酸制剂亦即restylane lido(galdetrama公司制)及belotero(merz公司)1ml中。冷冻干燥培养上清液已知会融解于透明质酸。因此,在将透明质酸给药至皮下或关节内等时,因为可将冷冻干燥培养上清液和透明质酸一起给药,所以可使用作为医药品的原料。
[0251]
实施例17
[0252]
和实施例5制造培养上清液的冷冻干燥品。将从1ml分量的培养上清液所制造的冷冻干燥培养上清液融解于蒸馏水1ml中,使用作为化妆水及食品、饮料。并且,使其融解于亲水软膏亦即喜疗妥软膏(maruho公司制)1g,使用作为软膏。因此,可使用作为化妆品、医药品、食品、饮料的原料。
[0253]
工业实用性
[0254]
本发明能被利用于医药产业。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1