含有A型CpG寡脱氧核糖核苷酸的脂质颗粒的制作方法
含有a型cpg寡脱氧核糖核苷酸的脂质颗粒
发明领域
[0001]
本发明涉及脂质颗粒、制造脂质颗粒的方法,以及含有该脂质颗粒的药物、试剂、干扰素产生促进剂、抗癌剂等。
背景技术:
[0002]
cpg寡脱氧核糖核苷酸以toll样受体(tlr)9依赖性方式诱导天然免疫反应,并且预期作为疫苗佐剂,在与疫苗抗原一起施用时增强疫苗的免疫效果,或者作为由于它们自身诱导的天然免疫反应的免疫调节剂。a/d型、b/k型、c型、p型等称为cpg寡脱氧核糖核苷酸。
[0003]
b/k型可溶于生理盐水,并且已知主要诱导白介素(il)-6产生。这种类型已经作为有前景的核酸药物在临床上应用。c型和p型除il-6外还可以诱导ifn-α;然而,c型诱导的程度弱。所有这三种类型都具有高比例的硫代磷酸酯骨架,并且它们的毒性堪忧。
[0004]
另一方面,a/d型不溶于生理盐水,但已知强烈地诱导干扰素(ifn)-α产生。这种类型与b/k型、c型和p型具有不同的生物活性。另外,a/d型的硫代磷酸酯骨架的比例低,被视为毒性问题也低。
[0005]
a/d型的强ifn-α诱导与该类型的高级结构密切相关。a/d型多聚鸟嘌呤(poly-g)尾在盐溶液中形成鸟嘌呤-四链体dna结构,导致形成纳米颗粒/聚集体。已经反复报道,聚集体的形成对于a/d型产生高ifn-α是必需的,这是a/d型odn临床应用的主要障碍。这是因为a/d型多聚化的自发发生导致不受控制的聚集和沉降,导致产品之间差异巨大和给药困难。因此,难以稳定地表现a/d型的效果。
[0006]
为了解决这个问题,ptl 1公开了一种将多聚腺嘌呤(poly-a)添加至a/d型末端的技术。然而,poly-a的添加增加了核酸中的碱基数量,这导致比如合成困难和合成成本高涨的问题。而且,poly-a具有硫代磷酸酯骨架;然而,从毒性的观点来看,需要硫代磷酸酯骨架比例较低的poly-a。
[0007]
引用列表
[0008]
专利文献
[0009]
ptl 1:wo2016/103703
技术实现要素:
[0010]
技术问题
[0011]
本发明的目的是提供一种能够稳定地表现a型cpg寡脱氧核糖核苷酸的效果的技术。
[0012]
问题的解决方案
[0013]
本发明人进行了深入研究,结果发现,包括a型cpg寡脱氧核糖核苷酸的脂质颗粒可以稳定地表现a型的效果,例如诱导ifn-α产生的作用。令人惊奇的是,本发明人发现,a型cpg寡脱氧核糖核苷酸的效果通过将它们形成进脂质颗粒而得以增强。作为基于这些发现
的进一步研究的结果,完成了本发明。
[0014]
具体地,本发明包括以下实施方式。
[0015]
第1项.
[0016]
一种脂质颗粒,其包括a型cpg寡脱氧核糖核苷酸。
[0017]
第2项.
[0018]
根据第1项所述的脂质颗粒,其中脂质颗粒包括外层和位于外层内部的离子复合物。
[0019]
第3项.
[0020]
根据第2项所述的脂质颗粒,其中离子复合物含有a型cpg寡脱氧核糖核苷酸。
[0021]
第4项.
[0022]
根据第2或3项所述的脂质颗粒,其中外层是脂质单层膜,其中两亲性脂质亲水部分面向外而排列。
[0023]
第5项.
[0024]
根据第1-4项中任一项所述的脂质颗粒,其中基于100质量%的构成脂质颗粒的脂质,含有含量为0-10质量%的水溶性聚合物改性脂质。
[0025]
第6项.
[0026]
根据第1-5项中任一项所述的脂质颗粒,其中构成脂质颗粒的脂质中的氮原子(n)数与含有a型cpg寡脱氧核糖核苷酸的核酸中的磷原子(p)数的比(n/p)为2.5以上。
[0027]
第7项.
[0028]
根据第1-6项中任一项所述的脂质颗粒,其包括阳离子脂质。
[0029]
第8项.
[0030]
根据第7项所述的脂质颗粒,其中阳离子脂质是选自1,2-二油酰氧基-3-三甲基铵-丙烷(1,2-dioleoyloxy-3-trimethylammonium-propane)(dotap)和1,2-二油烯氧基-3-三甲基铵-丙烷(又称1,2-双十八烯氧基-3-三甲基铵-丙烷,1,2-dioleyloxy-3-trimethylammonium-propane)(dotma)中的至少一种。
[0031]
第9项.
[0032]
一种制造脂质颗粒的方法,其包括以下步骤:将含有脂质的醇溶液与含有a型cpg寡脱氧核糖核苷酸的水溶液混合。
[0033]
第10项.
[0034]
根据第9项所述的制造方法,其中上述步骤在使用微通道的反应系统中进行。
[0035]
第11项.
[0036]
一种药物,其包括根据第1-8项中任一项所述的脂质颗粒。
[0037]
第12项.
[0038]
一种试剂,其包括根据第1-8项中任一项所述的脂质颗粒。
[0039]
第13项.
[0040]
一种免疫刺激剂,其包括根据第1-8项中任一项所述的脂质颗粒。
[0041]
第13a项.
[0042]
一种免疫刺激方法,其包括将根据第1-8项中任一项所述的脂质颗粒施用于需要免疫刺激的受试者。
[0043]
第13b项.
[0044]
根据第1-8项中任一项所述的脂质颗粒,其用作免疫刺激剂。
[0045]
第13c项.
[0046]
根据第1-8项中任一项所述的脂质颗粒用于产生免疫刺激剂的用途。
[0047]
第13d项.
[0048]
根据第1-8项中任一项所述的脂质颗粒作为免疫刺激剂的用途。
[0049]
第14项.
[0050]
一种抗癌剂,其包括根据第1-8项中任一项所述的脂质颗粒。
[0051]
第14a项.
[0052]
一种治疗癌症的方法,其包括将根据第1-8项中任一项所述的脂质颗粒施用于需要癌症治疗的受试者。
[0053]
第14b项.
[0054]
根据第1-8项中任一项所述的脂质颗粒,其用作抗癌剂。
[0055]
第14c项.
[0056]
根据第1-8项中任一项所述的脂质颗粒用于产生抗癌剂的用途。
[0057]
第14d项.
[0058]
根据第1-8项中任一项所述的脂质颗粒作为抗癌剂的用途。
[0059]
发明的有益效果
[0060]
本发明提供一种可以稳定地且更强力地表现a型cpg寡脱氧核糖核苷酸的效果的技术,具体地,提供一种包括a型cpg寡脱氧核糖核苷酸的脂质颗粒。该脂质颗粒可以用作药物、试剂、免疫刺激剂、抗癌剂等。
附图说明
[0061]
图1示出含有阳离子脂质(#41:dotap,#45:dotma,或#47:dodap)的含有a型cpg寡脱氧核糖核苷酸(d35:seq no.1)的脂质纳米颗粒对人pbmc中ifn-α产生的诱导的考察结果(测试例1)。纵轴显示培养物上清液中ifn-α的浓度。备注示出就加入到人pbmc培养基中的d35而言的脂质纳米颗粒的量。
[0062]
图2示出具有不同n/p比(#41:3,或#42:1)的含有d35的脂质纳米颗粒对人pbmc中ifn-α产生的诱导的考察结果(测试例2)。纵轴显示培养物上清液中ifn-α的浓度。备注示出就加入到人pbmc培养基中的d35而言的脂质纳米颗粒的量。
[0063]
图3示出通过加入(或不加入)ph敏感脂质(dope)改变透析溶液获得的含有d35的脂质纳米颗粒对人pbmc中ifn-α产生的诱导的考察结果。纵轴显示培养物上清液中ifn-α的浓度。备注示出就加入到人pbmc培养基中的d35而言的脂质纳米颗粒的量。dope的存在情况和透析溶液的组合如下:#35:不含dope/磷酸盐缓冲盐水(pbs)透析,#36:不含dope/5%葡萄糖透析,和#38:含有dope/5%葡萄糖透析。
[0064]
图4示出通过改变dspe-peg-ome的含量和peg链长度获得的含有d35的脂质纳米颗粒对人pbmc或小鼠脾细胞中ifn-α产生的诱导的考察结果(测试例4)。上图示出人pbmc的结果(纵轴显示培养物上清液中ifn-α的浓度)。下图示出小鼠脾细胞的结果(纵轴显示培养物上清液中ifn-i的浓度)。备注示出就加入到人pbmc培养基中的d35而言的脂质纳米颗粒的
培养基终浓度。dspe-peg-ome的含量与peg链长度的组合如下:2k peg:0.0质量%(048),2k peg:0.5质量%(007),2k peg:1.0质量%(008),2k peg:3.0质量%(009),2k peg:6.0质量%(010),5k peg 0.5质量%(011)。
[0065]
图5示出含有d35的脂质纳米颗粒的tlr9依赖性考察结果(测试例5)。上图示出ifn-i浓度的考察结果,下图示出il-6浓度的考察结果。“d35lnp”表示加入含有d35的脂质纳米颗粒的情况(培养基终浓度:1μg/ml),“0.5%”和“3%”表示脂质颗粒中每100质量%脂质的dspe-peg-ome含量。r848和d35的值(“1μg/ml”和“10μm”)表示培养基终浓度。
[0066]
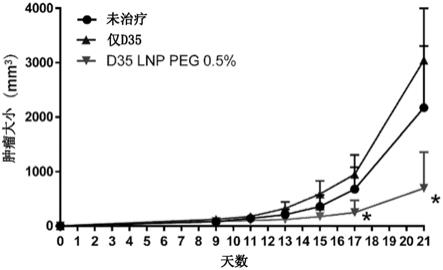
图6示出含有d35的脂质纳米颗粒的抗癌效果的考察结果(测试例6)。纵轴表示肿瘤大小,横轴表示皮下移植肿瘤细胞后经过的天数。备注表示所施用的药剂的存在和类型。每条曲线均显示平均值(n=5),并且每条曲线上的标尺显示标准偏差。*表示相对于没有药剂(“未治疗”)时的p值(dunn’s多重比较检验)小于0.05。
[0067]
图7示出含有d35的脂质纳米颗粒的抗癌效果的考察结果(测试例7)。纵轴表示肿瘤大小,横轴表示皮下移植肿瘤细胞后经过的天数。备注表示所施用的药剂和抗体的存在和类型。每条曲线均显示平均值(n=5),并且每条曲线上的标尺显示标准偏差。*表示相对于没有药剂(“未治疗”)时的p值(dunn’s多重比较检验)小于0.05。
[0068]
图8示出含有d35的脂质纳米颗粒的抗癌效果的考察结果(测试例9)。纵轴表示肿瘤大小,横轴表示皮下移植肿瘤细胞后经过的天数。备注表示所施用的药剂的存在和类型。每条曲线均显示平均值(n=5),并且每条曲线上的标尺显示标准偏差。
[0069]
图9示出含有d35的脂质纳米颗粒的抗癌效果的考察结果(测试例11)。纵轴表示肿瘤大小,横轴表示皮下移植肿瘤细胞后经过的天数。备注表示所施用的药剂和抗体的存在和类型。每条曲线均显示平均值(n=5),并且每条曲线上的标尺显示标准偏差。
[0070]
图10示出含有d35的脂质纳米颗粒的抗癌效果的考察结果(测试例12)。在上图中,纵轴表示肿瘤大小,横轴表示皮下移植肿瘤细胞后经过的天数,备注表示所施用的药剂的存在和类型。在下图中,纵轴表示肿瘤重量,横轴表示药剂的存在和类型。“comb”表示含有d35脂质纳米颗粒和抗pd-1抗体的组合。在上图中,每条曲线均显示平均值(n=8),并且每条曲线上的标尺显示标准偏差。在下图中,每条曲线显示每个样品的数据,标尺中心的横线显示中值,两端的横线显示标准偏差,**表示p值(one-way anova)小于0.01。
[0071]
图11示出含有d35的脂质纳米颗粒的抗癌效果的考察结果(测试例12)。在左上图中,纵轴表示肿瘤大小,横轴表示皮下移植肿瘤细胞后经过的天数,备注表示所施用的药剂的存在和类型。在右上图中,纵轴表示肿瘤重量,横轴表示药剂的存在和类型。在下图中,纵轴表示肿瘤大小,横轴表示皮下移植肿瘤细胞后经过的天数。每张图上均示出所施用的药剂的存在和类型。“comb”表示含有d35的脂质纳米颗粒和抗pd-1抗体的组合。在左上图中,每条曲线均显示平均值(n=7),并且每条曲线上的标尺显示标准偏差。在右上图中,每条曲线显示每个样品的数据,标尺中心的横线显示中值,两端的横线显示标准偏差,*表示p值(one-way anova)小于0.01,**表示p值(one-way anova)小于0.01。
[0072]
图12是示出本发明的液体颗粒的优选实施方式的示意图。在示出磷脂、阳离子脂质和peg-脂质的图中,圆圈部分表示亲水部分,双条表示疏水部分。在示出peg-脂质的图中,从圆圈部分延伸的波状条表示peg链。
具体实施方式
[0073]
如本文所用,术语“含有/包括(contain/comprise)”包括“包含”、“包括”、“基本上由...组成”和“由...组成”的概念。
[0074]
1.脂质颗粒
[0075]
在一实施方式中,本发明涉及包括a型cpg寡脱氧核糖核苷酸的脂质颗粒(本文也称为“本发明的脂质颗粒”)。下文将对此加以描述。
[0076]
a型cpg寡脱氧核糖核苷酸(odn)是具有诱导浆细胞样树突状细胞产生i型ifn(特别是ifn-α)的功能的odn,其没有特别限定,只要具有这种功能即可。
[0077]
典型的a型cpg odn含有以中心碱基序列(cg(未甲基化))为中心的回文序列的核心部分和位于核心部分一侧的g-寡聚物部分。
[0078]
核心部分的碱基长度没有特别限定,例如,为5-30,优选为7-20,更优选为9-15,再更优选为10-14。
[0079]
核心部分的碱基序列没有特别限定,只要它是以中心碱基序列(cg)为中心的回文序列即可。实例包括seq id no:2所示的碱基序列。
[0080]
核心部分中的核苷之间的所有键都是磷酸二酯键。
[0081]
g寡聚体的碱基长度没有特别限定,例如为2-10。碱基长度优选为3-8,更优选为5-7,再更优选为6。
[0082]
g寡聚体优选地位于核心部分的3
’-
侧。
[0083]
在核心部分中,另一碱基可以不存在,或者可以存在于g寡聚体所在侧的相对侧。其它碱基优选为,例如,由g组成的碱基/碱基序列。碱基/碱基序列的碱基长度没有特别限定,例如,为1-10,优选为1-4,更优选为2。
[0084]
在除核心部分(g-寡聚体部分和其它碱基部分)以外的部分中,优选地,从末端(3
’-
末端或5
’-
末端)开始的若干个(例如2-5个,优选2-3个,更优选2个)核苷与相邻的核苷以硫代磷酸酯键合。硫代磷酸酯键以外的键合部分通常是磷酸二酯键。
[0085]
a型cpg寡脱氧核糖核苷酸可以单独使用,或者两种或更多种组合使用。
[0086]
本发明的脂质颗粒的结构没有特别限定,只要它是a型cpg寡脱氧核糖核苷酸和脂质的复合物即可。本发明的脂质颗粒的实例包括其中包括两亲性脂质的脂质形成外层、两亲性脂质以其亲水性部分面向外而排列的颗粒。这种颗粒的实例包括外层包括脂质单层膜(脂质单重膜)的颗粒和外层包括脂质双层膜(脂质双重膜)的颗粒,优选为外层包括脂质单层膜的颗粒,更优选为外层包括其中两亲性脂质的亲水性部分面向外而排列的脂质单层膜的颗粒。颗粒的内层可以包括均一的水相或油相,但优选地含有一种或多种离子复合物。离子复合物优选地含有a型cpg寡脱氧核糖核苷酸,更优选地在其内层中含有a型cpg寡脱氧核糖核苷酸。离子复合物的优选实施方式包括a型cpg寡脱氧核糖核苷酸和阳离子脂质的复合物,更优选具有疏水结合的胆固醇的复合物。在本发明的脂质颗粒的优选实施方式中,本发明的脂质颗粒包括外层和置于所述外层内部的一种或多种离子复合物。图12示出本发明的脂质颗粒的优选实施方式。
[0087]
本发明的脂质颗粒的粒径没有特别限定。粒径优选为纳米尺度,具体地,例如,10-700nm,优选为10-500nm,更优选为10-250nm,再更优选为20-200nm,再更优选为20-150nm,特别优选为20-120nm。
[0088]
本发明的脂质颗粒含有两亲性脂质例如磷脂和糖脂作为颗粒构成脂质。颗粒构成脂质可以包括其它脂质。其它脂质的具体实例包括甾醇、饱和或不饱和脂肪酸等。
[0089]
磷脂的具体实例包括磷脂酰胆碱,例如,二月桂酰基磷脂酰胆碱、二肉豆蔻酰基磷脂酰胆碱、二棕榈酰基磷脂酰胆碱(dppc)、二硬脂酰基磷脂酰胆碱、二油酰基磷脂酰胆碱、二亚油酰基磷脂酰胆碱、肉豆蔻酰基棕榈酰基磷脂酰胆碱、肉豆蔻酰基硬脂酰基磷脂酰胆碱和棕榈酰基硬脂酰基磷脂酰胆碱;磷脂酰甘油,例如,二月桂酰基磷脂酰甘油、二肉豆蔻酰基磷脂酰甘油、二棕榈酰基磷脂酰甘油、二硬脂酰基磷脂酰甘油、二油酰基磷脂酰甘油、二亚油酰基磷脂酰甘油、肉豆蔻酰基棕榈酰基磷脂酰甘油、肉豆蔻酰基硬脂酰基磷脂酰甘油和棕榈酰基硬脂酰基磷脂酰甘油;磷脂酰乙醇胺,例如,二月桂酰基磷脂酰乙醇胺、二肉豆蔻酰基磷脂酰乙醇胺、二棕榈酰基磷脂酰乙醇胺、二硬脂酰基磷脂酰乙醇胺(dspe)、二油酰基磷脂酰乙醇胺(dope)、二亚油酰基磷脂酰乙醇胺、肉豆蔻酰基棕榈酰基磷脂酰乙醇胺、肉豆蔻酰基硬脂酰基磷脂酰乙醇胺和棕榈酰基硬脂酰基磷脂酰乙醇胺;阳离子脂质,例如,1,2-二油酰氧基-3-三甲基铵-丙烷(dotap)、1,2-二油烯氧基-3-三甲基铵-丙烷(dotma)和1,2-二油酰氧基-3-二甲基铵-丙烷(dodap);磷脂酰丝氨酸;溶血磷脂酰胆碱;磷脂酸;磷脂酰肌醇;鞘磷脂;心磷脂;蛋黄卵磷脂;大豆卵磷脂;及其氢化添加物。
[0090]
糖脂的具体实例包括甘油糖脂,例如,二糖基甘油二酯、二半乳糖基甘油二酯、半乳糖基甘油二酯和糖基甘油二酯;鞘糖脂,例如,半乳糖基脑苷脂和神经节苷脂;硬脂基葡糖苷、酯化硬脂基葡糖苷等。
[0091]
甾醇的具体实例包括胆固醇、胆固醇琥珀酸单酯(cholesteryl hemisuccinate)、羊毛甾醇、二氢羊毛甾醇、链甾醇、二氢胆固醇、植物甾醇、豆甾醇、酵母甾醇、麦角甾醇、谷甾醇、菜油甾醇、菜子甾醇(brassicasterol)等。特别地,由于使脂质体膜稳定和调节脂质体膜流动性的作用,合意地含有这类甾醇作为脂质体膜的构成脂质。
[0092]
饱和或不饱和脂肪酸的具体实例包括具有10-22个碳原子的饱和或不饱和脂肪酸,例如,癸酸、肉豆蔻酸、棕榈酸、硬脂酸、花生四烯酸、油酸、二十二烷酸。
[0093]
构成本发明的脂质颗粒的脂质可以单独使用,或者两种或更多种组合使用。
[0094]
本发明的脂质颗粒优选地含有两亲性脂质和甾醇作为颗粒构成脂质。
[0095]
两亲性脂质的实例优选地包括磷脂,更优选地阳离子脂质、磷脂酰胆碱、磷脂酰乙醇胺等。在优选的实施方式中,本发明的脂质颗粒含有阳离子脂质,更优选阳离子脂质和其它磷脂(优选磷脂酰胆碱、磷脂酰乙醇胺等)。阳离子脂质的优选实例包括1,2-二油酰氧基-3-三甲基铵-丙烷(dotap)、1,2-二油烯氧基-3-三甲基铵-丙烷(dotma)等。其它磷脂的实例包括其中疏水部分的烃基优选具有例如10-25个碳原子、优选12-21个碳原子、更优选14-18个碳原子的磷脂(例如,二棕榈酰基磷脂酰胆碱(dppc)和二油酰基磷脂酰乙醇胺(dope))。
[0096]
两亲性脂质的含量没有特别限定,例如,相对于100质量%的构成本发明的脂质颗粒的脂质,含量为20-95质量%,优选为40-90质量%,更优选为50-85质量%,再更优选为60-80质量%,再更优选为65-75质量%,特别优选为67-73质量%。
[0097]
当含有阳离子脂质作为两亲性脂质时,阳离子脂质的含量没有特别限定,例如,含量为10-75质量%,优选为20-70质量%,更优选为30-65质量%,再更优选为40-60质量%,再更优选为45-55质量%,特别优选为47-53质量%。
[0098]
当含有阳离子脂质以外的磷脂作为两亲性脂质时,其它磷脂的含量没有特别限
定,例如,含量为5-50质量%,优选为10-30质量%,更优选为15-25质量%,再更优选为17-23质量%。
[0099]
甾醇的优选实例包括胆固醇。
[0100]
甾醇的含量没有特别限定,例如,相对于100质量%的构成本发明的脂质颗粒的脂质,含量为15-60质量%,优选为20-40质量%,更优选为25-35质量%,再更优选为27-33质量%。
[0101]
合意地,除了上述优选的颗粒构成脂质(两亲性脂质和甾醇)以外,本发明的脂质颗粒含有水溶性聚合物改性脂质作为颗粒构成脂质。水溶性聚合物没有特别限定,其实例包括聚乙二醇(peg)链。水溶性聚合物的分子量没有特别限定,例如,分子量为200-10000,优选为500-7000,更优选为500-4000,再更优选为1000-3000,再更优选为1500-2500。用水溶性聚合物改性的脂质的实例优选地包括两亲性脂质,更优选磷脂,再更优选磷脂酰乙醇胺。
[0102]
水溶性聚合物改性脂质的含量没有特别限定,例如,相对于100质量%的构成本发明的脂质颗粒的脂质,含量为0-10质量%,优选为0-5质量%,更优选为0-2质量%,再更优选为0-1质量%,再更优选为0.2-1质量%,特别优选为0.3-0.7质量%。
[0103]
构成脂质颗粒的脂质中的氮原子(n)数与含有a型cpg寡脱氧核糖核苷酸的核酸中的磷原子(p)数的比(n/p)优选为2.5以上,更优选为2.5-5,再更优选为2.5-4,再更优选为2.5-3.5。
[0104]
除了上述组分以外,本发明的脂质颗粒可以含有一种或多种其它组分。其它组分的实例包括膜稳定剂、带电物质、抗氧化剂、膜蛋白、聚乙二醇(peg)、抗体、肽、糖链等。
[0105]
可以含有抗氧化剂以防止膜的氧化,根据需要,可以将其用作膜构成成分。用作膜构成成分的抗氧化剂的实例包括丁基化羟基甲苯、没食子酸丙酯、生育酚、生育酚乙酸酯、浓缩混合生育酚、维生素e、抗坏血酸、l-抗坏血酸硬脂酸酯、抗坏血酸棕榈酸酯、亚硫酸氢钠、亚硫酸钠、乙二胺四乙酸钠、异抗坏血酸、柠檬酸等。
[0106]
出于增加膜功能或者使膜结构稳定的目的,可以含有膜蛋白,根据需要,可以将其用作膜构成成分。膜蛋白的实例包括表面膜蛋白、整合膜蛋白、白蛋白、重组白蛋白等。
[0107]
相对于100质量%的本发明的脂质颗粒,一种或多种其它组分的含量为,例如,10%以下,优选为5%以下,更优选为2%以下,再更优选为1%以下。
[0108]
本发明的脂质颗粒可以通过或根据用于脂质颗粒的已知方法制造。本发明的脂质颗粒可以优选地通过包括以下步骤的方法制造:将含有脂质的醇溶液和含有a型cpg寡脱氧核糖核苷酸的水溶液混合(步骤1)。
[0109]
用作醇溶液的溶剂的醇没有特别限定,只要其是能够溶解磷脂的醇即可。优选地使用乙醇作为醇。
[0110]
除了水溶性药物和作为溶剂的水之外,水溶液可以含有冷冻保护剂,例如糖(例如蔗糖或海藻糖)或聚乙二醇。
[0111]
水溶液与醇溶液的混合比(酸性水溶液/醇溶液,v/v)为,例如,20/1至1/1,优选4/1至2/1。
[0112]
混合没有特别限定,只要可以形成脂质颗粒即可;然而,混合物通常用涡流等剧烈搅拌。另外可选地,当混合在使用微通道的反应体系中进行时,混合物在反应体系中混合。
[0113]
步骤1通常在室温或加热下进行。步骤1的温度为,例如,15℃至60℃,优选15℃至45℃。
[0114]
2.用途
[0115]
本发明的脂质颗粒可以稳定地且更强地表现a型cpg寡脱氧核糖核苷酸的效果。因此,本发明的脂质颗粒可以用于利用a型cpg寡脱氧核糖核苷酸的效果(例如,诱导i型inf产生的作用和诱导inf-α产生的作用)的各种应用。例如,本发明的脂质颗粒可以用作药物、试剂等(在本文中也称为“本发明的药剂”)的活性成分;更具体地,作为抗癌剂、免疫刺激剂等的活性成分。更具体地,本发明的脂质颗粒可以用作i型inf产生促进剂、inf-α产生促进剂、th1相关基因表达促进剂等的活性成分。
[0116]
本发明的药剂没有特别限定,只要其含有本发明的脂质颗粒即可,并且根据需要可以进一步含有一种或多种其它组分。这些其它组分没有特别限定,只要它们是药学上可接受的组分即可。这些其它组分的实例包括具有药理作用的组分和添加剂。添加剂的实例包括基剂(base)、载体、溶剂、分散剂、乳化剂、缓冲剂、稳定剂、赋形剂、粘合剂、崩解剂、润滑剂、增稠剂、湿润剂、着色剂、芳香剂、螯合剂等。
[0117]
单独的本发明的脂质颗粒便可以发挥上述效果。因此,本发明的药剂可以在不含任何具有上述效果和/或作用的其它组分的情况下表现出其所期望的效果,但是也可以含有一种或多种具有药理作用的其它组分。
[0118]
本发明的脂质颗粒可以与其它抗癌剂组合使用。这种组合可以提供增强的效果。其它抗癌剂没有特别限定,可以使用各种抗癌剂。抗癌剂的实例包括烷化剂、代谢拮抗剂、微管抑制剂、抗生素抗癌剂、拓扑异构酶抑制剂、铂类药物、分子靶向药物、激素类药物、生物制剂等。优选的实例包括代谢拮抗剂、抗生素抗癌剂、铂类药物等。烷化剂的实例包括环磷酰胺、异环磷酰胺、亚硝基脲、达卡巴嗪、替莫唑胺、尼莫司汀、白消安、美法仑、丙卡巴肼(procarbazine)、雷莫司汀等。代谢拮抗剂的实例包括依诺他滨、卡莫氟(carmofur)、卡培他滨、替加氟、替加氟-尿嘧啶、替加氟-吉莫斯特-奥替拉西钾、吉西他滨、阿糖胞苷、阿糖胞苷烷磷酯、奈拉滨、氟尿嘧啶、氟达拉滨、培美曲塞、喷司他丁、氨甲蝶呤、克拉屈滨、去氧氟尿苷、羟基尿素、巯嘌呤等。微管抑制剂的实例包括生物碱抗癌剂,例如长春新碱;和紫杉烷抗癌剂,例如多西紫杉醇和紫杉醇。抗生素抗癌剂的实例包括丝裂霉素c、阿霉素、表柔比星、柔红霉素、博来霉素、放线菌素d、阿柔比星、伊达比星、吡柔比星、培洛霉素、米托蒽醌、氨柔比星、净司他丁斯酯(zinostatin stimalamer)等。拓扑异构酶抑制剂的实例包括具有拓扑异构酶i抑制作用的cpt-11、伊立替康和nogitecan;和具有拓扑异构酶ii抑制作用的依托泊苷和索布佐生。铂类药物的实例包括顺铂、奈达铂、奥沙利铂、卡铂等。激素类药物的实例包括地塞米松、非那雄胺、他莫昔芬(tamoxifen)、astrozole、依西美坦、炔雌醇、氯地孕酮、戈舍瑞林、比卡鲁胺、氟他胺、泼尼松龙、亮丙瑞林、来曲唑、雌莫司汀、托瑞米芬、磷雌酚、米托坦、甲基睾酮、甲羟孕酮、美雄烷等。生物制剂的实例包括干扰素α、干扰素β、干扰素γ、白介素2、乌苯美司、干bcg等。分子靶向药物的实例包括纳武单抗、派姆单抗、利妥昔单抗、阿仑单抗、曲妥珠单抗、西妥昔单抗、帕尼单抗、伊马替尼、达沙替尼、尼罗替尼、吉非替尼、厄洛替尼、坦罗莫司(temsirolimus)、贝伐单抗、阿柏西普(vegf trap)、舒尼替尼、索拉非尼、tosituzumab、硼替佐米、吉姆单抗-奥佐米星(gemutuzumab-ozogamicin)、替伊莫单抗-奥佐米星(ibritumomab-ozogamicin)、替伊莫单抗(ibritumomab tiuxetan)、他米巴罗
汀、维甲酸等。除上述分子靶向药物外,实例还包括以下分子靶向药物:靶向血管生成的抑制剂,例如人表皮生长因子受体2抑制剂、表皮生长因子受体抑制剂、bcr-abl酪氨酸激酶抑制剂、表皮生长因子酪氨酸激酶抑制剂、mtor抑制剂和内皮生长因子受体2抑制剂(α-vegfr-2抗体);各种酪氨酸激酶抑制剂,例如map激酶抑制剂;靶向细胞因子的抑制剂;蛋白酶体抑制剂;和抗体-抗癌剂复合物。这些抑制剂还包括相应的抗体。
[0119]
使用本发明的药剂的方式没有特别限定。可以根据药剂的种类选择适当的使用方式。根据使用目的,本发明的药剂可以例如在体外使用(例如,添加至培养细胞的培养基中)或在体内使用(例如,施用给动物)。
[0120]
本发明的药剂的应用对象没有特别限定。目标哺乳动物的实例包括人、猴子、小鼠、大鼠、狗、猫、兔子、猪、马、牛、绵羊、山羊和鹿。细胞的实例包括动物细胞等。细胞的种类也没有特别限定。细胞的实例包括血细胞、造血干细胞/祖细胞、配子(精子、卵母细胞)、成纤维细胞、上皮细胞、血管内皮细胞、神经细胞、肝细胞、角质形成细胞、肌肉细胞、表皮细胞、内分泌细胞、es细胞、ips细胞、组织干细胞、癌细胞等。
[0121]
当本发明的药剂用作抗癌剂或应用于癌细胞时,对目标癌症没有特别限定。实例包括肝细胞癌、胰腺癌、肾癌、白血病、食道癌、胃癌、结直肠癌、肺癌、前列腺癌、皮肤癌、乳腺癌、宫颈癌等。
[0122]
本发明的药剂可以是任何剂型。剂型的实例包括口服剂型,例如片剂(例如口服崩解片、咀嚼片、泡腾片、锭剂(lozenges)和果冻样滴剂)、丸剂、颗粒剂、细颗粒剂、散剂、硬胶囊剂、软胶囊剂、干混悬剂(dry syrups)、液体(包括健康饮料、混悬剂和糖浆剂)和果冻制剂;和肠胃外剂型,例如注射用制剂(例如滴注剂(例如用于静脉滴注的制剂)、静脉注射剂、肌肉注射剂、皮下注射剂和皮内注射剂)、局部制剂(例如软膏剂、硬膏剂(plasters)和洗剂)、栓剂、吸入剂、眼科制剂、眼用软膏、滴鼻剂、滴耳剂和脂质体制剂。
[0123]
本发明的药剂的给药途径没有特别限定,只要能够获得期望的效果即可。实例包括口服给药;肠胃外给药,其包括经肠给药例如管饲和灌肠给药、静脉内给药、动脉内给药、肌肉内给药、心内给药、皮下给药、皮内给药和腹膜内给药等。
[0124]
本发明的药剂中的活性成分的含量取决于例如使用方式、应用对象、应用对象的状况等而不同;并且没有限制。例如,活性成分的含量为0.0001-100重量%,优选为0.001-50重量%。
[0125]
对动物给药时,本发明的药剂的剂量没有特别限定,只要是药物有效量即可。在口服给药的情况下,通常,以活性成分的重量计,剂量通常为每天0.1-1000mg/kg体重,优选为每天0.5-500mg/kg体重。在肠胃外给药的情况下,剂量为每天0.01-100mg/kg体重,优选为每天0.05-50mg/kg体重。上述剂量也可以取决于年龄、疾病状态、症状等适当地增加或减少。
[0126]
除了药物和试剂之外,本发明的脂质颗粒还可以,例如,用作组合物的组分,上述组合物例如食品添加剂、食品组合物(包括健康食品、健康增进剂和营养产品(例如补充剂))和化妆品(在本文中也称为“本发明的组合物”)。具体地,本发明的脂质颗粒可以用作用于抗癌和免疫刺激用途的组合物。更具体地,本发明的脂质颗粒可以用作i型inf产生促进剂、inf-α产生促进剂、th1相关基因表达促进剂等的活性成分。
[0127]
对本发明的组合物的形式没有特别限定,并且可以根据使用目的采取通常在每种
用途中使用的形式。
[0128]
用于食品添加剂、健康增强剂、营养产品(例如补充剂)等的本发明的组合物形式的实例包括片剂(包括口腔崩解片、咀嚼片、泡腾片、锭剂和果冻样滴剂)、丸剂、颗粒剂、细颗粒剂、散剂、硬胶囊剂、软胶囊剂、干混悬剂、液体(包括混悬剂和糖浆剂)、果冻制剂等。
[0129]
用于食品组合物中的本发明的组合物形式的实例包括液体、凝胶或固体食品,例如果汁、软饮料、茶、汤、豆浆和其它饮料;色拉油、调味料、酸奶、果冻、布丁、糖屑(sprinkles)、用于育儿的奶粉、蛋糕粉、乳制品(例如粉末、液体、凝胶和固体)、面包、糖果糕点(confectionery)(例如饼干)等。
[0130]
本发明的组合物可以根据需要进一步含有一种或多种其它组分。这些其它组分没有特别限定,只要它们可以掺入食品添加剂、食品组合物、健康增进剂、营养产品(例如补充剂)、化妆品等中即可。实例包括基剂、载体、溶剂、分散剂、乳化剂、缓冲剂、稳定剂、赋形剂、粘合剂、崩解剂、润滑剂、增稠剂、着色剂、芳香剂、螯合剂等。
[0131]
与本发明的组合物有关的其它部分与本发明的药剂相同。
[0132]
实施例
[0133]
以下基于实施例对本发明进行详细说明。然而,本发明不限于这些实施例。除了那些称为微尺寸颗粒的脂质颗粒的粒径,以下测试例中产生的脂质颗粒的粒径为30-100nm。
[0134]
测试例1.核酸/阳离子脂质复合物的体外评估
[0135]
对含有阳离子脂质(#41:dotap,#45:dotma,或#47:dodap)的含有a型cpg寡脱氧核糖核苷酸(d35:seq no.1:g_g_tgcatcgatgcagggg_g_g;下划线(_)表示下划线两侧的核苷彼此以硫代磷酸酯键合;未连接下划线的核苷彼此以磷酸二酯键键合)的脂质纳米颗粒对人pbmc(外周血单核细胞)中ifn-α产生的诱导进行考察。具体方法如下。
[0136]
相对于100质量%的构成脂质颗粒的脂质,每种脂质的含量如下:阳离子脂质(#41:dotap,#45:dotma,或#47:dodap):50质量%,dppc:19.5质量%,胆固醇:30质量%,dspe-peg(2k(peg链长))-ome:0.5质量%。将构成脂质颗粒的脂质中的氮原子(n)数与核酸中的磷原子(d35)(p)数之比(n/p)设定为3。使用nanoassemblr(由precision nanosystems制造)将含有d35的水溶液和含有脂质的乙醇溶液混合,以获得脂质纳米颗粒,然后将其用5%葡萄糖水溶液透析。将脂质纳米颗粒(以d35计为50ng、100ng或200ng)添加至人pbmc培养基中,然后培养24小时,通过elisa方法对培养上清液中ifn-α的量进行定量。
[0137]
结果在图1中示出。当使用dotap作为阳离子脂质(#41)时,促进ifn-α产生的能力最高,随后为使用dotma(#45)和使用dodap(#47)时。当使用dodap时,稳定性相对较低,在4℃下储存3个月内出现混浊聚集。
[0138]
测试例2.对n/p比进行考察
[0139]
对具有不同n/p比的含有d35的脂质纳米颗粒对人pbmc中ifn-α产生的诱导进行考察。具体方法如下。
[0140]
相对于100质量%的构成脂质颗粒的脂质,每种脂质的含量如下:阳离子脂质(dotap):50质量%,dppc:19.5质量%,胆固醇:30质量%,和dspe-peg(2k(peg链长度)-ome:0.5质量%。将构成脂质颗粒的脂质中的氮原子(n)数与核酸中的磷原子(d35)(p)数之比(n/p)设定为3(#41)或1(#42)。使用nanoassemblr(由precision nanosystems制造)将含有d35的水溶液和含有脂质的乙醇溶液混合,以获得脂质纳米颗粒,然后将其用5%葡萄糖
水溶液透析。将脂质纳米颗粒(以d35计为50ng、100ng或200ng)添加至人pbmc培养基中,然后培养24小时,通过elisa方法对培养上清液中ifn-α的量进行定量。
[0141]
结果在图2中示出。当n/p比为3(#41)时,促进ifn-α产生的能力比当n/p比为1(#42)时更高。此外,当n/p比为1时,粒径相对较大并且为微米级。
[0142]
测试例3.对ph敏感脂质的存在和透析溶液的效果进行考察
[0143]
对通过改变透析溶液(添加(或不添加)ph敏感脂质(dope))而获得的含有d35的脂质纳米颗粒对人pbmc中ifn-α产生的诱导进行考察。具体方法如下。
[0144]
相对于100质量%的构成脂质颗粒的脂质,每种脂质的含量如下:阳离子脂质(dotap):50质量%,dope或dppc:19.5质量%,胆固醇:30质量%,dspe-peg(2k(peg链长))-ome:0.5质量%。将构成脂质颗粒的脂质中的氮原子(n)数与核酸中的磷原子(d35)(p)数之比(n/p)设定为3。dope的存在情况和透析溶液的组合如下:#35:无dope/pbs透析;#36:无dope/5%葡萄糖透析;#38:含dope/5%葡萄糖透析。使用nanoassemblr(由precision nanosystems制造)将含有d35的水溶液和含脂质的乙醇溶液混合,以获得脂质纳米颗粒,然后将其用5%葡萄糖水溶液或pbs透析。将脂质纳米颗粒(以d35计为50ng、100ng或200ng)添加至人pbmc培养基中,然后培养24小时,通过elisa方法对培养上清液中ifn-α的量进行定量。
[0145]
结果在图3中示出。图3表明,5%葡萄糖水溶液作为透析溶液是合意的。此外,当不含ph敏感脂质时,促进ifn-α产生的能力更高。
[0146]
测试例4.对dspe-peg-ome的含量和peg链长进行考察
[0147]
对通过改变dspe-peg-ome(n-(甲基聚氧乙烯氧羰基)-1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺)的含量和peg链长度获得的含有d35的脂质纳米颗粒对人pbmc中ifn-α产生的诱导进行考察。具体方法如下。
[0148]
相对于100质量%的构成脂质颗粒的脂质,每种脂质的含量如下:阳离子脂质(dotap):50质量%,dppc(含量调节成dppc和dspe-peg-ome的总和为20质量%),胆固醇:30质量%和dspe-peg(2k或5k(peg链长))-ome:0.0质量%、0.5质量%、1.0质量%、3.0质量%或6.0质量%。将构成脂质颗粒的脂质中的氮原子(n)数与核酸中的磷原子(d35)(p)数之比(n/p)设定为3。dspe-peg-ome的peg链长如下:2k peg:0.0质量%(048),2k peg:0.5质量%(007),2k peg:1.0质量%(008),2k peg:3.0质量%(009),2k peg:6.0质量%(010)和5k peg:0.5质量%(011)。使用nanoassemblr(由precision nanosystems制造)将含有d35的水溶液和含脂质的乙醇溶液混合,以获得脂质纳米颗粒,然后将其用5%葡萄糖水溶液或pbs透析。将脂质纳米颗粒添加至人pbmc培养基或balb/c小鼠脾细胞培养基,使得培养基终浓度以d35计为1μg/ml、0.5μg/ml或0.25μg/ml,然后培养24小时。对于人pbmc培养基,通过elisa方法对培养上清液中ifn-α的量进行定量。对于小鼠脾细胞培养基,使用鼠i型ifn传感器细胞(b16-blue ifn-α/β细胞)通过生物活性测量方法对培养上清液中的ifn-i的量进行定量。
[0149]
结果在图4中示出。当含有2k peg时,稳定性最高并且生物活性高达0.5%,并且生物活性随着peg含量的增加而降低。当peg含量为3%或更高时,生物活性显著下降。2k peg 0.5%(007)和5k peg 0.5%(011)之间的比较表明,2k peg 0.5%具有更高的生物活性。
[0150]
测试例5. tlr9依赖性分析
[0151]
对含有d35的脂质纳米颗粒的tlr9依赖性进行考察。具体方法如下。
[0152]
相对于100质量%的构成脂质颗粒的脂质,每种脂质的含量如下:dotap:50质量%,dppc:19.5质量%,胆固醇:30质量%,dspe-peg(2k(peg链长))-ome:0.5质量%或3.0质量%。将构成脂质颗粒的脂质中的氮原子(n)数与核酸中的磷原子(d35)(p)数之比(n/p)设定为3。使用nanoassemblr(由precision nanosystems制造)将含有d35的水溶液和含脂质的乙醇溶液混合,以获得脂质纳米颗粒,然后将其用5%葡萄糖水溶液透析。在本测试例和之后的测试例中,均使用在此获得的含有d35的脂质纳米颗粒。
[0153]
从wt、tlr7ko和tlr9ko小鼠中的每一种制备骨髓细胞,并用r848(tlr7/8激动剂;培养基终浓度:1μg/ml),d35(tlr9激动剂;培养基终浓度:10μm=63.4μg/ml)和含有d35的脂质纳米颗粒(以d35计,培养基终浓度:1μg/ml)刺激,然后培养24小时。然后,分别通过使用鼠i型ifn传感器细胞(b16-blue ifn-α/β细胞)的生物活性测量方法和通过常规elisa方法对培养上清液中的ifn-i和il-6的量进行定量。。
[0154]
结果在图5中示出。用r848刺激的il-6的产生在tlr7ko中消失,但在tlr9ko中没有消失,而用d35(tlr9激动剂)和含有d35的脂质纳米颗粒(dspe-peg-ome含量:0.5质量%和3.0质量%)刺激的il-6的产生在tlr7ko中没有消失,但在tlr9ko中几乎完全消失。对于ifn-i,显示出相似的结果,尽管用r848刺激的ifn-i的产生非常弱。此外,用基本上不与脂质复合的d35(10μm=63.4μg/ml)刺激,和用含有d35的脂质纳米颗粒(1μg/ml)刺激,显示出几乎相同的ifn-i产生水平;然而,用含有d35的脂质纳米颗粒(1μg/ml)刺激的il-6的产生,是d35(10μm=63.4μg/ml)情况下的大约四分之一。这表明脂质纳米颗粒促进ifn-i产生比il-6产生要更多。
[0155]
测试例6.用源自mc38小鼠结直肠癌的肿瘤模型-1进行考察
[0156]
皮下移植mc38(1
×
106个细胞)后的第9、11、13、15和17天,将药剂(d35或含有d35的脂质纳米颗粒(dspe-peg-ome含量:0.5质量%))肿瘤内施用总共5次。然后,测量肿瘤大小。将一次施用的d35核酸的量调节至4.5μg/shot。
[0157]
结果在图6中示出。对于含有d35的脂质纳米颗粒,在第17天和第21天观察到肿瘤大小的显著减小。以未与脂质复合的d35给药则未观察到效果。
[0158]
测试例7.用源自mc38小鼠结直肠癌的肿瘤模型-2进行考察(肿瘤内给药+耗尽)
[0159]
皮下移植mc38(第1
×
106个细胞)的第9、11、13、15和17天,将含有d35的脂质纳米颗粒(dspe-peg-ome含量:0.5质量%)肿瘤内施用总共5次。然后,测量肿瘤大小。此外,为了耗尽cd8 t细胞,在皮下移植后的第6和13天腹膜内施用抗cd8a抗体(100μg/shot)或对照抗体(100μg/shot)。将一次施用的d35核酸的量调节至4.5μg/shot。
[0160]
结果在图7中示出。对于含有d35的脂质纳米颗粒,在第21天观察到肿瘤大小的显著减小。这种减小通过耗尽cd8t细胞而消失。这表明含有d35的脂质纳米颗粒的抗癌效果依赖于cd8t细胞。
[0161]
测试例8.用源自mc38小鼠结直肠癌的肿瘤模型-2进行考察(免疫相关基因评估)
[0162]
从测试例7的肿瘤(皮下移植后第12天)的冷冻切片制备mrna,并通过qpcr方法测量各种免疫相关基因的表达。结果,肿瘤内施用含有d35的脂质纳米颗粒增加了许多免疫相关基因的表达,并且这种增加通过耗尽cd8t细胞而消失。此外,由于在th1相关基因(stat4、t-bet、ifng)中观察到显著的基因表达诱导,这表明,肿瘤内施用含有d35的脂质纳米颗粒,
通过将肿瘤内免疫环境转移至th1类型导致了肿瘤消退。
[0163]
测试例9.用源自mc38小鼠结直肠癌的肿瘤模型-3进行考察(静脉内给药)
[0164]
皮下移植mc38(1
×
106个细胞)后的第9、11、13、15和17天,将药剂(d35或含有d35的脂质纳米颗粒(dspe-peg-ome含量:0.5质量%))静脉内施用总共5次。然后,测量肿瘤大小。将一次施用的d35核酸的量调节至25μg/shot。
[0165]
结果在图8中示出。对于含有d35的脂质纳米颗粒,观察到肿瘤大小显著减小。这表明,即使当静脉内施用时,含有d35的脂质纳米颗粒也可以发挥抗癌效果。
[0166]
测试例10.用源自mc38小鼠结直肠癌的肿瘤模型-3进行考察(免疫相关基因评估)
[0167]
从测试例9的肿瘤(皮下移植后第12天)的冷冻切片制备mrna,并通过qpcr方法测量各种免疫相关基因的表达。结果,观察到ifng和cxcl9的表达增加,表明肿瘤内免疫激活。这表明静脉内给药引起了与肿瘤内给药相同的免疫改变。
[0168]
测试例11.用源自mc38小鼠结直肠癌的肿瘤模型-4进行考察(肿瘤内给药+耗尽)
[0169]
皮下移植mc38(第1
×
106个细胞)后的第9、11、13、15和17天,将含有d35的脂质纳米颗粒(dspe-peg-ome含量:0.5质量%)静脉内施用总共5次。然后,测量肿瘤大小。此外,为了耗尽cd8t细胞,在皮下移植后的第6和13天腹膜内施用抗cd8a抗体(100μg/shot)或对照抗体(100μg/shot)。将一次施用的d35核酸的量调节至25μg/shot。
[0170]
结果在图9中示出。对于含有d35的脂质纳米颗粒,在第21天观察到肿瘤大小的显著减小。这种减小通过耗尽cd8t细胞而消失。这表明含有d35的脂质纳米颗粒的抗癌效果依赖于cd8t细胞。
[0171]
测试例12.用源自mc38小鼠结直肠癌的肿瘤模型-5进行检测(肿瘤内给药+抗pd-1抗体)
[0172]
皮下移植mc38(1
×
106个细胞)后的第9、11、13、15和17天,将药剂(含有d35的脂质纳米颗粒(dspe-peg-ome含量:0.5质量%),抗pd-1抗体或其组合)总共施用5次。然后,测量肿瘤大小。肿瘤内施用含有d35的脂质纳米颗粒,腹膜内施用抗pd-1抗体。将一次施用的d35核酸的量调节至4.5μg/shot。
[0173]
结果显示在图10中。含有d35的脂质纳米颗粒和抗pd-1抗体的组合,比起单独使用它们每一种的单药治疗,显示出更强的抗癌效果。测试例13.用源自mc38小鼠结直肠癌的肿瘤模型-5进行考察(静脉内给药+抗pd-1抗体)
[0174]
皮下移植mc38(1
×
106个细胞)后的第9、11、13、15和17天,将药剂(含有d35的脂质纳米颗粒(dspe-peg-ome含量:0.5质量%)、抗pd-1抗体或其组合)总共施用5次。然后,测量肿瘤大小。静脉内施用含有d35的脂质纳米颗粒,腹膜内施用抗pd-1抗体。将一次施用的d35核酸的量调节至25μg/shot。
[0175]
结果显示在图11中。含有d35的脂质纳米颗粒和抗pd-1抗体的组合,比起单独使用它们每一种的单药治疗,显示出更强的抗癌效果。
[0176]
测试例14.毒性评估
[0177]
向小鼠(c57bl/6j)静脉内施用d35或含有d35的脂质纳米颗粒(dspe-peg-ome含量:0.5质量%或3.0质量%)。给药后一天,采血,并制备肝的石蜡切片。用测量试剂盒(transaminase cii-test wako,由fujifilm wako pure chemical corporation制造)测量血液中的alt和ast水平。此外,石蜡切片用he染色,以确定红细胞溶血的发生。
[0178]
结果,施用含有d35的脂质纳米颗粒的血液中的alt和ast水平与不施用它们的那些相同。另外,未观察到红细胞溶血。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1