含有治疗失智症的治疗剂的缓释药物组合物及其用途的制作方法
本申请案主张2018年7月24日提交的美国专利申请号62/702,563的效益,其全部内容通过引用并入本文。本发明是针对一种包含用于治疗失智症的治疗剂、使用至少一捕获剂的具有高药物脂质比(drugtolipidratio)及高药物包埋效率(encapsulationefficiency)的缓释药物组合物。高药物脂质比、高包埋效率及药物组合物持续的释放图谱(releaseprofile)减少施予的频率、增加患者顺从性(patientcompliance)及改善治疗效果(therapeuticoutcome)。先前技术在许多国家已核准利斯的明(rivastigmine)、多奈派齐(donepezil)、加兰他敏(galantamine)及美金刚(memantine)用于阿兹海默症(alzheimer’sdisease)及帕金森氏症(parkinson’sdisease)相关的失智症(dementia)的治疗。这些药物可以锭剂、胶囊或溶液形式经口服施予或通过经皮贴片(transdermalpatch)施予。然而,失智症的患者经常忘记或抗拒服药、或在疾病进程中具有吞咽上的困难,使得每日一次或每日两次的给药频率的患者顺从性仍低。因此,难以确保患者的药物依从性(medicationadherence)以维持循环药物浓度在治疗范围(therapeuticwindow)中。另一方面,即使是每日一次的施予,聘用保健专业人员或照护者来施予药物是昂贵的。脂质体作为药物传递系统为一成功的技术,且已被广泛地用于各种药物的缓释配方的开发。药物装载至脂质体中可经被动地(passively)(在脂质体形成的期间包埋药物)或远端地(remotely)/主动地(actively)(在脂质体形成的期间制造跨膜(transmembrane)ph-或离子梯度,而后药物在脂质体形成后通过因梯度产生的驱动力装载)达成(美国专利号5,192,549及5,939,096)。虽然在文献中详细记载药物装载至脂质体的一般方法,仅有极少数的治疗剂得以高包埋效率的装载至脂质体中。各种因子能够影响脂质体的药物脂质比及包埋效率,其包含但不限于治疗剂的物理及化学特性,例如亲水性/疏水性特征、解离常数、溶解度及分配系数,脂质组成、捕获剂或反应溶剂的选择及粒径(procnatlacadsciusa.2014;111(6):2283-2288以及drugmetabdispos.2015;43(8):1236-45)。一些利斯的明或多奈派齐的脂质体配方已被有限的描述。yang等人揭露一种利斯的明脂质体配方,其中脂质体的直径为大约170nm并使用硫酸铵(ammoniumsulfate)作为捕获剂远端装载利斯的明。此配方的包埋效率为大约30%,其最终药物脂质比(d/l)为0.15(intjpharm.2013;452(1-2):344-54)。一多层囊泡(multilamellarvesicle,mlv)利斯的明脂质体可由被动装载法取得,但其大鼠活体研究显示,经由鼻内途径(intranasalroute)施予此mlv利斯的明脂质体的半衰期仅有109分钟(actapharm.2008;58(3):287-97)。与经由鼻内施予的游离多耐派齐比较,通过被动装载法制备的多奈派齐脂质体配方证实在大鼠中的半衰期延长1.4倍(drugdesdevelther.2016;10:205-15)。对于具有高药物包埋效率以降低抗失智症药物的给药频率并改善治疗效果的缓释配方仍存在未被满足的需求。本发明解决此需求以及其他需求。技术实现要素:在一实施例中,提供缓释药物组合物。药物组合物包含(a)至少一包含双层膜的脂质体,所述双层膜包含至少一脂质;(b)捕获剂;以及(c)用于治疗失智症的治疗剂,其中治疗剂对脂质的摩尔比值等于或大于大约0.2。根据本发明的另一实施例,提供用以治疗失智症的方法,所述方法包含对所需的个体施予本文所描述的药物组合物的步骤。亦提供本文所描述的药物组合物在制造用于治疗及/或预防性治疗(prophylactictreatment)失智症的药物的用途。进一步提供用于治疗失智症的药物,其包含本文所描述药物组合物的治疗有效剂量。在本专利中所使用的用语“发明(invention)”、“该发明(theinvention)”、“此发明(thisinvention)”以及“本发明(thepresentinvention)”意于广泛指的是本专利及下列的权利要求的所有申请标的。包含这些用语的叙述应理解为不限制本文所描述的申请标的、或不限制下列权利要求的含义或范畴。通过本专利涵盖的本发明的实施例系通过下列权利要求定义,而非此
发明内容。此
发明内容为本发明各种态样的高层次概述(high-leveloverview),并引导进一步描述于下列实施方式的段落中的部分概念。此
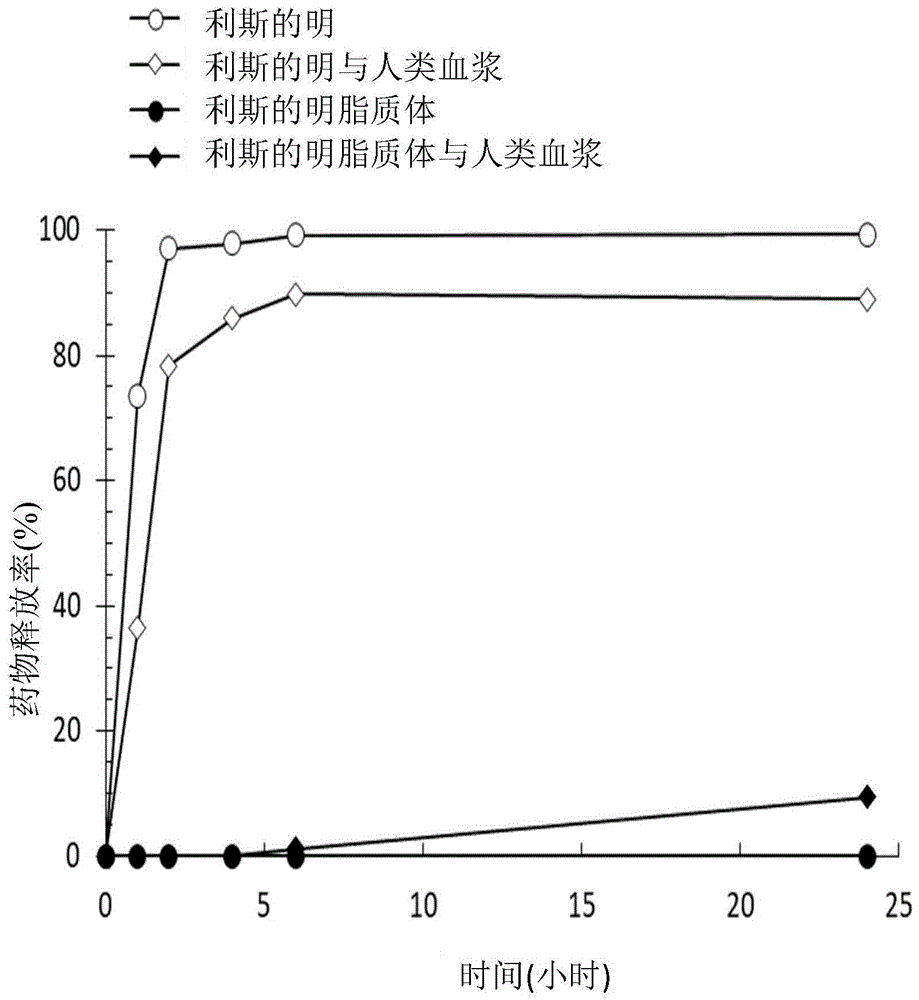
发明内容不意于定义所请申请标的的关键或必要特征,亦非意于用在单独使用而定义所请申请标的的范畴。申请标的应通过参考说明书全文、任何或所有图式及各权利要求合适的部分而理解。可通过参照说明书的其余部分及图式进一步理解本发明的本质及优点。附图简述第1图显示利斯的明脂质体及游离利斯的明的体外释放图谱的折线图。第2图显示大鼠经皮下注射利斯的明脂质体及游离利斯的明后血浆利斯的明(plasmarivastigmine)浓度的折线图。第3图显示大鼠经皮下注射多奈派齐脂质体及游离多奈派齐后血浆多奈派齐(plasmadonepezil)浓度的折线图。实施方式除非本文中另行明确地表示,如上及本揭露全文所采用的下列用语,否则“一(a)”、“一(an)”以及“该(the)”等单数型式包含复数型式。本文的所有数字可被理解成通过“大约(about)”修饰。如本文所用,用语“大约(about)”指的是特定值±10%的范围。如本文所用,用语“有效剂量(effectiveamount)”指的是减少失智症的症状及病征(signs)的药物组合物剂量,失智症的症状及病征,如记忆丧失、对时间及地点的困惑及重复行为,可经由临床地、放射学地各种成像方式或经由检查特定生物标记物侦测。用语“有效剂量(effectiveamount)”及“治疗有效剂量(therapeuticallyeffectiveamount)”可互换使用。如本文所用,用语“治疗(treating)”、“治疗(treated)”或“治疗(treatment)”包含预防(preventative)(例如,预防(prophylactic))、舒缓(palliative)及治疗方法(curativemethods)、用途或结果。用语“治疗(treatment)”或“治疗(treatments)”亦可指的是组合物或药物。本申请案全文中,治疗(bytreating)意指如通过所属领域已知技术侦测的减轻或延缓一种或多种失智症的症状或病征或完全改善(amelioration)失智症的方法,所属领域已知技术包含但不限于临床检查、成像或脑脊髓液(csf)生物标记(例如,低csf类淀粉蛋白β1–42(csfamyloidβ1–42)及高csf总-tau(csftotal-tau)或磷酸化-tau(phospho-tau)的侦测)。例如,当相较于个体治疗之前或控制个体,若在个体中失智症的一种或多种症状减少大约0.1%,所揭露的方法被判断为治疗。因此,可以为减少大约0.1、1、5、10、20、30、40、50、60、70、80、90、100%或任何在其之间减少的数值。如本文所用,用语“失智症(dementia)”涵盖不论已知或未知的各种病因及原因的失智症的各种类型及子类型,其包含但不限于帕金森氏症、阿兹海默症及血管型失智症(vasculardementia)。如本文所用,用语“个体(subject)”可指患有或有失智症发展风险的脊椎动物或视为需要失智症治疗的脊椎动物。个体包含如哺乳动物、如灵长类动物且更佳为人类的所有恒温动物。非人类灵长类动物亦为个体。用语个体包含如猫、狗等的驯养动物、家畜(例如,牛、马、猪、羊、山羊等)及实验动物(例如,小鼠、兔、大鼠、沙鼠(gerbil)、豚鼠(guineapig)等)。因此,本文涵盖兽医用途及医药剂型。脂质体如本文所用,用语“脂质体(liposome)”、“脂质体(liposomal)”及相关用语的特征为通过一种或多种双层膜形成的囊泡,将内部水性空间(interioraqueousspace)与外部介质(outermedium)隔离。在某些实施例中,脂质体的内部水性空间实质上不含中性脂质,如甘油三酯(triglyceride)、非水(non-aqueous)相(油相)、水-油乳液、第二脂质体或其它含有非水相的混合物。脂质体的非限制性实例包含小单层囊泡(smallunilamellarvesicles,suv)、大单层囊泡(largeunilamellarvesicles,luv)及多层囊泡(multilamellarvesicle,mlv),其具有平均直径范围从50-500nm、50-450nm、50-400nm、50-350nm、50-300nm、50-250nm、50-200nm、100-500nm、100-450nm、100-400nm、100-350nm、100-300nm、100-250nm或100-200nm,且其皆能够穿过无菌过滤器。脂质体的双层膜通常通过至少一脂质形成,即,包含空间上分离的疏水域及亲水域的合成或天然的两性分子(amphiphilicmolecules)。脂质的实例包含但不限于,如磷脂(phospholipids)、双甘油酯(diglycerides)、二脂肪基糖脂(dialiphaticglycolipids)的双脂链脂质(dialiphaticchainlipids),如鞘磷脂(sphingomyelin)及鞘糖脂(glycosphingolipid)的单脂质及其组合物。根据本发明的磷脂的实例包含但不限于1,2-二月桂酰基-sn-甘油-3-磷酸胆碱(1,2-dilauroyl-sn-glycero-3-phosphocholine,dlpc)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(1,2-dimyristoyl-sn-glycero-3-phosphocholine,dmpc)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(1,2-dipalmitoyl-sn-glycero-3-phosphocholine,dppc)、1-棕榈酰基-2-硬脂酰基-sn-甘油-3-磷酸胆碱(1-palmitoyl-2-stearoyl-sn-glycero-3-phosphocholine,pspc)、1-棕榈酰基-2-油酰基-sn-甘油-3-磷脂酰胆碱(1-palmitoyl-2-oleoyl-sn-glycero-3-phosphatidylcholine,popc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(1,2-distearoyl-sn-glycero-3-phosphocholine,dspc)、1,2-二油酰基-sn-甘油-3-磷脂酰胆碱(1,2-dioleoy1-sn-glycero-3-phosphocholine,dopc)、氢化大豆磷脂酰胆碱(hydrogenatedsoyphosphatidylcholine,hspc)、1,2-二肉豆蔻酰-sn-甘油-3-磷酸-(1’-rac-甘油)(钠盐)(1,2-dimyristoyl-sn-glycero-3-phospho-(1’-rac-glycerol)(sodiumsalt),dmpg)、1,2-二棕榈酰-sn-甘油-3-磷酸-(1’-rac-甘油)(钠盐)(1,2-dipalmitoyl-sn-glycero-3-phospho-(1’-rac-glycerol)(sodiumsalt),dppg)、1-棕榈酰基-2-硬脂酰基-sn-甘油-3-磷酸-(1’-rac-甘油)(钠盐)(1-palmitoyl-2-stearoyl-sn-glycero-3-phospho-(1’-rac-glycerol)(sodiumsalt),pspg)、1,2-二硬脂酰-sn-甘油-3-磷酸-(1’-rac-甘油)(钠盐)(1,2-distearoyl-sn-glycero-3-phospho-(1’-rac-glycerol)(sodiumsalt),dspg)、1,2-二油酰-sn-甘油-3-磷酸-(1’-rac-甘油)(1,2-dioleoyl-sn-glycero-3-phospho-(1’-rac-glycerol),dopg)、1,2-二肉豆蔻酰-sn-甘油-3-磷酸-l-丝胺酸(钠盐)(1,2-dimyristoyl-sn-glycero-3-phospho-l-serine(sodiumsalt),dmps)、1,2-二棕榈酰-sn-甘油-3-磷酸-l-丝胺酸(钠盐)(1,2-dipalmitoyl-sn-glycero-3-phospho-l-serine(sodiumsalt),dpps)、1,2-二硬脂酰-sn-甘油-3-磷酸-l-丝胺酸(钠盐)(,2-distearoyl-sn-glycero-3-phospho-l-serine(sodiumsalt),dsps)、1,2-二油酰-sn-甘油-3-磷酸-l-丝胺酸(1,2-dioleoyl-sn-glycero-3-phospho-l-serine,dops)、1,2-二肉豆蔻酰-sn-甘油-3-磷酸(钠盐)(1,2-dimyristoyl-sn-glycero-3-phosphate(sodiumsalt),dmpa)、1,2-二棕榈酰-sn-甘油-3-磷酸(钠盐)(1,2-dipalmitoyl-sn-glycero-3-phosphate(sodiumsalt),dppa)、1,2-二硬脂酰-sn-甘油-3-磷酸(钠盐)(1,2-distearoyl-sn-glycero-3-phosphate(sodiumsalt),dspa)、1,2-二油酰-sn-甘油-3-磷酸(钠盐)(1,2-dioleoyl-sn-glycero-3-phosphate(sodiumsalt),dopa)、1,2-二棕榈酰-sn-甘油-3-磷酸乙醇胺(1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine,dppe)、n-(羰基-甲氧基聚乙二醇)-1,2-二棕榈酰-sn-甘油-3-磷酸乙醇胺(n-(carbonyl-methoxypolyethyleneglycol)-1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine,peg-dppe)、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸乙醇胺(1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine,pope)、1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺(1,2-distearoyl-sn-glycero-3-phosphoethanolamine,dspe)、n-(羰基-甲氧基聚乙二醇)-1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺(n-(carbonyl-methoxypolyethyleneglycol)-1,2-distearoyl-sn-glycero-3-phosphoethanolamine,peg-dspe)、1,2-二油酰-sn-甘油-3-磷酸乙醇胺(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine,dope)、1,2-二棕榈酰-sn-甘油-3-磷酸-(1’-肌醇)(铵盐)(1,2-dipalmitoyl-sn-glycero-3-phospho-(1’-myo-inositol)(ammoniumsalt),dppi)、1,2-二硬脂酰基-sn-甘油-3-磷酸肌醇(铵盐)(1,2-distearoyl-sn-glycero-3-phosphoinositol)(ammoniumsalt),dspi)、1,2-二硬脂酰基-sn-甘油-3-磷酸-(1’-肌醇)(铵盐)(1,2-dioleoyl-sn-glycero-3-phospho-(1’-myo-inositol)(ammoniumsalt),dopi)、心磷脂(cardiolipin)、l-α-磷脂酰胆碱(l-α-phosphatidylcholine,epc)及l-α-磷脂酰乙醇胺(l-α-phosphatidylethanolamine,epe)。在一些实施例中,脂质为一种或多种前述脂质的脂质混合物,或一种或多种前述脂质与一种或多种未列出的脂质、薄膜稳定剂(membranestabilizer)或抗氧化剂的混合物。在一些实施例中,在双层膜中的脂质的摩尔百分比系等于或小于大约85、84、83、82、81、80、79、78、77、76、75、74、73、72、71、70、69、68、67、66、65、64、63、62、61、60、59、58、57、56、55、54、53、52、51、50、49、48、47、46、45或在其之间的任何值或范围(例如,大约45-85%、大约45-80%、大约45-75%、大约45-70%、大约45-65%、大约50-85%、大约50-80%、大约50-75%、大约50-70%或大约50-65%)。在一些实施例中,双层膜的脂质包含第一脂质及第二脂质的混合物。在一些实施例中,第一脂质选自基本上由磷脂酰胆碱(phosphatidylcholine,pc)、hspc、dspc、dppc、dmpc、pspc及其组合所组成的群组,而第二脂质选自基本上由磷脂酰乙醇胺(phosphatidylethanolamine)、磷脂酰甘油(phosphatidylglycerol)、peg-dspe、dppg及其组合所组成的群组。在另一实施例中,在双层膜中第一脂质的摩尔百分比为等于或小于大约84.9、84、83、82、81、80、79、78、77、76、75、74、73、72、71、70、69、68、67、66、65、64、63、62、61、60、59、58、57、56、55、54、53、52、51、50、49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30或在其之间的任何值或范围(例如,大约30-84.9%、大约30-80、大约35-75、大约40-70、大约30-70、大约30-60、大约35-84.9%、大约35-80、大约35-70、大约35-60、大约40-84.9%、大约40-80、大约40-75或大约40-62),而在双层膜中第二脂质的摩尔百分比为等于或小于大约30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、1至0.1或在其之间的任何值或范围(例如,0.1-30%、大约0.1-25%、大约0.1-23%、大约0.5-30%、大约0.5-25%、大约0.5-23%、大约0.7-30%、大约0.7-25%或大约0.7-23%)。脂质体的双层膜进一步包含小于大约55摩尔百分比的类固醇,较佳为胆固醇。在某些实施例中,在双层膜中的胆固醇%为大约15-55%、大约20-55、大约25-55%、大约20-50%、大约25-50%、大约15-45%、大约20-45%、大约25-45%、大约15-40%、大约20-40%、大约25-40%、大约15-35%、大约20-35%或大约25-35%。在一个例示性实施例中,在双层膜中脂质及胆固醇的摩尔%为大约50-80%:20-50%、45-75%:25-55%或45-85%:15-55%。在另一例示性实施例中,在双层膜中第一脂质、第二脂质及胆固醇的摩尔%为大约30-84.9%:0.1%-30%:15-55%、45-80:0.1-30%:20-50%、50-75%:0.1-25%:20-45%或50-95%:0.1-25%:10-50%。远端装载如本文所用,用语“远端装载(remoteloading)”为涉及通过多原子离子梯度(polyatomicion-gradient)将药物从外部介质跨越脂质体的双层膜传输至内部水性空间的程序的药物装载法。这些梯度通过在脂质体的内部水性空间中包埋至少一多原子离子作为捕获剂,并以例如,具有较低多原子离子浓度的纯水、蔗糖溶液(sucrosesolution)或生理食盐水的额外介质通过如管柱分离(columnseparation)、透析(dialysis)或离心(centrifugation)的已知技术置换脂质体的外部介质而产生。在脂质体的内部水性空间及外部介质之间制造多原子离子梯度以将治疗剂捕获于脂质体的内部水性空间。作为捕获剂的例示性多原子离子包含但不限于硫酸盐(sulfate)、亚硫酸盐(sulfite)、磷酸盐(phosphate)、磷酸氢盐(hydrogenphosphate)、钼酸盐(molybdate)、碳酸盐(carbonate)及硝酸盐(nitrate)。例示性的捕获剂包含但不限于硫酸铵(ammoniumsulfate)、磷酸铵(ammoniumphosphate)、钼酸铵(ammoniummolybdate)、蔗糖八硫酸酯铵(ammoniumsucroseoctasulfate)、蔗糖八硫酸酯三乙铵(triethylammoniumsucroseoctasulfate)、硫酸葡聚糖(dextransulfate)或其组合。在一实施例中,蔗糖八硫酸酯三乙铵的浓度为大约10至200mm或大约50至大约150mm。在另一实施例中,硫酸铵的浓度为大约100至大约600mm、大约150至大约500mm或大约200至大约400mm。在又一实施例中,磷酸铵的浓度为大约100至大约600mm、大约150至大约500mm或大约200至大约400mm。在又一实施例中,硫酸葡聚糖的浓度为大约0.1至10mm、大约0.1至5mm或大约0.1至1mm。根据本发明,包埋捕获剂的脂质体可通过任何已知或后来开发的技术制备。例如,可通过将经选择的脂质组成物与捕获剂通过水合脂膜(hydratedlipidfilm)、喷雾干燥粉末或冻干饼(lyophilizedcake)直接形成mlv脂质体;通过声处理(sonication)、均质化(homogenization)、微射流作用(microfluidization)或挤压(extrusion)从mlv脂质体成形为suv脂质体及luv脂质体。药物组合物本发明针对缓释药物组合物,缓释药物组合物包含:(a)至少一包含双层膜的脂质体;(b)捕获剂;以及(c)用于治疗失智症的治疗剂,其中双层膜包含至少一脂质,且治疗剂对脂质的摩尔比值为大于或等于0.2。在一些实施例中,治疗剂对脂质的摩尔比值为大于或等于0.2至小于大约20、小于大约15、小于大约10、小于大约5。在一个实施例中,缓释药物组合物进一步包含至少一药学上可接受的赋形剂、稀释剂、载具(vehicle)、载体、用于活性成分的介质、防腐剂、冷冻保护剂或其组合。在一个例示性实施例中,在药物组合物中的双层膜的重量百分比为大约0.1-15%;在药物组合物中的捕获剂的重量百分比为大约0.1-12%;以及在药物组合物中的药学上可接受的赋形剂(如蔗糖、组氨酸(histidine)、氯化钠及超纯水)、稀释剂、载具、载体、用于活性成分的介质、防腐剂、冷冻保护剂或其组合的重量百分比为大约75.0-99.9%。在某些实施例中,用于治疗失智症的治疗剂或抗失智症药物为乙酰胆碱酯酶抑制剂(acetylcholinesteraseinhibitor)或美金刚。在例示性实施例中,乙酰胆碱酯酶抑制剂选自利斯的明、多奈派齐、加兰他敏及其组合所组成的群组。在另一实施例中,用于治疗失智症的治疗剂或抗失智症药物为美金刚,且捕获剂为蔗糖八硫酸酯三乙铵。药物组合物的缓释曲线(profile)延长抗失智症药物的半衰期,并维持抗失智症药物的治疗血浆浓度(therapeuticplasmaconcentration)于较长的一段期间,因而维持治疗效果并减少施予的频率。在一方面,药物组合物的缓释曲线是由于高的药物包埋效率。药物组合物的包埋效率为至少50%、55%、60%、65%、70%、75%或80%。在另一方面,药物组合物的缓释曲线是由于较高的药物对脂质的摩尔比值。在例示性实施例中,用于治疗失智症的治疗剂对一种或多种脂质的摩尔比值为大于或等于大约0.20、0.21、0.22、0.23、0.24或0.25,选择性地从大约0.2至10、从大约0.2至5、从大约0.2至2或从大约0.2至1。在又一方面,相较于用于治疗失智症的游离治疗剂,在本文所描述的药物组合物用于治疗失智症的治疗剂的半衰期延长至少2倍、至少5倍、至少7.5倍、至少10倍或至少20倍。本发明亦提供一种用于治疗失智症的方法,所述方法包含对所需的个体施予有效剂量的本文所描述的药物组合物,因而减轻在个体中失智症的症状及/或病征。药物组合物系被配制成适合用于如皮下(subcutaneous)、表皮下(subdermal)、皮内(intradermal)、经皮(transdermal)或肌内(intramuscular)途径的皮肤给药(cutaneousadministration)。药物组合物亦配制成适合以经皮贴片施予。本发明的医药组合物的剂量可由所属
技术领域:
具有专业知识者根据实施例决定。涵盖各在某些临床环境中提供优势的单剂量或多剂量形式。根据本发明,被施予的医药组合物的实际量可根据被治疗的个体的年龄、体重、条件、任何存在的医疗条件,并取决于医学专家的判断。在一实施例中,本文所揭露的药物组合物展现治疗剂显著的缓释图谱。例如,不论与于大鼠经由口服施予fda核准的利斯的明配方(0.4小时,exelon胶囊新药申请提交的包装(exeloncapsulesnewdrugapplicationsubmittedpackage),诺华制药公司(novartispharmaceuticalscorporation),申请号:020823)或是经由鼻内施予公开发表的利斯的明脂质体配方(1.8小时,actapharm.2008;58(3):287-97)比较时,本发明的药物组合物在大鼠中延长皮下施予利斯的明的半衰期至15.8小时(如实例4所揭露)。在另一实例中,不论与文献中所报导(drugdesdevelther.2016;10:205-15)的经由口服(4.3小时)及鼻内施予(4.2小时)游离多奈派齐、或是经由鼻内施予多奈派齐脂质体配方(5.8小时)的半衰期比较时,本文所揭露的药物组合物在大鼠中延长皮下施予多奈派齐的的半衰期至34.3小时(如实例5所揭露)。这些药物组合物被开发以减少给药频率从每日两次至每日、每两日一次、每三日一次、每五日一次、每六日一次、每周、每两周一次、每个月一次、每两个月一次、每三个月一次、每四个月一次、每五个月一次或每六个月一次。实例本发明的实施例通过下列实例说明,其不应以任何方式解释为对其范围强加限制。相反地,应被清楚理解的是在不脱离本发明的精神下,所属
技术领域:
具有专业知识者在阅读本文说明书之后,可采取各种其它实施例、修改及其等效物。除非另有指出,在下列实例中描述的研究中,将遵循习知程序。实例1、利斯的明脂质体配方的制备空的脂质体通过脂质膜水合挤压法(lipidfilmhydration-extrusionmethod)制备。在氯仿(chloroform)中溶解hspc、胆固醇及dspe-peg2000(摩尔百分比59.5/39.6/0.9),通过旋转蒸发器(rotaryevaporator)于真空下移除有机溶剂以形成一薄脂质膜。此干燥脂质膜以75mm蔗糖八硫酸酯三乙铵(ph6.0)于60℃水合30分钟,而形成水性中心(aqueouscore)包埋蔗糖八硫酸酯三乙铵的脂质体。在液态氮与60℃水间六次冷冻-解冻循环之后,随后将脂质体以孔径0.2μm的聚碳酸酯过滤器挤压10次。未包埋的蔗糖八硫酸酯三乙铵以9.4%蔗糖溶液透析移除。含有2.0mg/ml酒石酸利斯的明(rivastigminetartrate)(caymanchemicalcompany,美国(us))、根据前段制备的空的脂质体(含有20.0mm脂质)以及10mm组氨酸缓冲液(ph6.5)的反应混合物在60℃下培养30分钟。通过sephadextmg-50细胶粒(finegel)(gehealthcare)或透析袋(spectrumlabs)以9.4%蔗糖溶液分离反应混合物中未包埋的酒石酸利斯的明,而得到利斯的明脂质体配方。利斯的明脂质体中包埋的酒石酸利斯的明浓度及脂质浓度使用紫外线/可见光(uv/vis)分光光谱仪测量,以计算利斯的明脂质体配方的药物对脂质摩尔比值(d/l)。包埋效率通过将利斯的明脂质体配方的药物对脂质摩尔比值(d/l)与反应混合物的标称(nominal)d/l比较来计算,标称d/l系将酒石酸利斯的明的浓度除以空的脂质体的脂质浓度。粒径分布系通过动态光散射仪(zetasizernano-zs90,malvern)测量。使用75mm蔗糖八硫酸酯三乙铵作为捕获剂,利斯的明脂质体配方最终d/l为0.24、包埋效率为96.8%而脂质体的平均直径为193.7nm。实例2、多奈派齐脂质体配方的制备根据实例1制备空的脂质体。干燥脂质膜以300mm硫酸铵溶液于60℃水合30分钟,而形成水性中心包埋硫酸铵的脂质体。在液态氮与60℃水间六次冷冻-解冻循环之后,随后将脂质体以孔径0.2μm的聚碳酸酯过滤器挤压10次。未包埋的硫酸铵以9.4%蔗糖溶液透析移除,在脂质体的内部水相与外层水相之间制造硫酸盐类梯度。含有2.5mg/ml多奈派齐盐酸盐(donepezilhydrochloride)(medchemexpress)及根据前述段落制备的空的脂质体(含有16.7mm脂质)的反应混合物在60℃下培养30分钟。通过sephadextmg-50细胶粒(finegel)(gehealthcare)或透析袋(spectrumlabs)以9.4%蔗糖溶液分离未包埋的多奈派齐盐酸盐而得到多奈派齐脂质体配方。根据实例1计算多奈派齐脂质体配方的d/l及包埋效率。使用300mm硫酸铵作为捕获剂,多奈派齐脂质体配方最终d/l为0.28而包埋效率为79.4%。脂质体的平均粒径为191.1nm。实例3、不同捕获剂对药物装载曲线的影响根据实例1制备具有下列捕获剂的脂质体配方:(1)75mm的蔗糖八硫酸酯三乙铵、(2)300mm的硫酸铵、(3)300mm的硫酸铵及0.3mm的硫酸葡聚糖的混合物、(4)200mm的磷酸铵、及(5)250mm的硫酸铵。表1显示不同捕获剂对药物装载曲线的影响。表1、不同捕获剂的药物装载曲线表1中组合物的包埋效率如下:组合物1:71.9%、组合物2:96.8%、组合物3:62.3%、组合物4:55.8%、组合物5:59.2%、组合物6:57.6%、组合物7:89.3%、组合物8:79.4%、组合物9:91.9%、组合物10:>99%、组合物11:78.6%、组合物12:62.2%、组合物13:67.9%、组合物14:49.5%、组合物15:56.8%及组合物16:60.2%。实例4、利斯的明脂质体的延长释放曲线本研究中使用两个体外释放系统,第一个系统为无血浆环境而第二个系统为人类血浆环境。为了设置第一个体外释放系统,将1.0ml根据实例1制备的利斯的明脂质体配方及1.0ml游离酒石酸利斯的明分别置放于透析袋中(6透析膜,mwco50kda,spectrumlabs),并密封透析袋的两端。为了设置第二个体外释放系统,将1.0ml根据实例1制备利斯的明脂质体配方及1.0ml游离酒石酸利斯的明分别置放在各含有1ml人类血浆(valleybiomedical,inc.)的透析袋中,并密封透析袋的两端。将每个透析袋浸入于含有25mlph7.4的pbs的50ml离心管中,并在37±1℃水浴中培养24小时。在培养后选定的时间点(1、2、4、6及24小时)从25mlpbs取样0.5ml等分试样(aliquot),并加入0.5ml新鲜pbs替代取样的等分试样。使用高效液相层析仪分析(highperformanceliquidchromatography,hplc)分析每个时间点所取样的等分试样的药物浓度,以建立体外释放曲线(invitroreleaseprofile)。参照第1图,在第一个体外无血浆释放系统中,加入配方2小时内,几乎百分之百的利斯的明从游离利斯的明配方中经透析袋释放,而在超过24小时的期间,在利斯的明脂质体配方中低于1%的利斯的明透过透析袋释放。在第二个体外人类血浆释放系统中,加入配方4小时内,90%的利斯的明从游离利斯的明配方中释放,而在超过24小时的期间,仅有10%的利斯的明从利斯的明脂质体配方中释放。实例5、利斯的明脂质体的药物动力学(pk)研究使用7-8周龄雌性sd(sprague-dawley)大鼠执行利斯的明脂质体配方的体内pk评估。大鼠圈养于12小时光照/12小时黑暗的昼夜循环操作且不限制饮水及摄食的系留室(holdingroom)中。将大鼠分成两组(各组n=3),一组接受10mg/kg游离酒石酸利斯的明的皮下注射,所述游离酒石酸利斯的明以超纯水溶解制备而得,最终浓度为2mg/ml。另一组接受10mg/kg酒石酸利斯的明脂质体的皮下注射,所述酒石酸利斯的明脂质体系根据实例1制备而得。注射后15分钟、1小时、2小时、4小时、6小时、8小时、24小时、48小时及72小时收集血液样品。通过离心取得血浆样品,在-80℃下保持冷冻并使用在pksolver非区室模型分析模组(noncompartmentalanalysismodel)分析(computmethodsprogramsbiomed.2010;99(3):306-314)。两种利斯的明配方的pk参数总结于表2中。表2中结果显示利斯的明脂质体组的cmax为游离利斯的明组的8.1%,且与游离利斯的明组比较,利斯的明脂质体的半衰期(t1/2)显著较长。与象征100%的利斯的明于注射后72小时释放的游离利斯的明的曲线下面积(areaunderthecurve,auc0-t)比较,利斯的明脂质体的曲线下面积指出注射后72小时90.2%的利斯的明从利斯的明脂质体配方释放。表2、单次皮下注射游离利斯的明及利斯的明脂质体后大鼠衍生的pk参数参数单位游离利斯的明利斯的明脂质体t1/2h0.9315.8cmaxng/ml427.334.7auc0-thíng/ml896.4809.0auc0-infhíng/ml898.7855.0此外,第2图显示,在游离利斯的明注射后8小时后的大鼠血浆中未能侦测到利斯的明,而在接受利斯的明脂质体配方药物注射后的大鼠的血浆中直至72小时仍可侦测到利斯的明。此结果支持所请的药物组合物持续释放利斯的明的结论。实例6、多奈派齐脂质体的药物动力学研究根据实例5的方法执行多奈派齐脂质体配方的体内pk评估。将大鼠分成两组(各组n=3),一组接受10mg/kg游离多奈派齐的皮下注射,所述游离多奈派齐以超纯水溶解多奈派齐盐酸盐制备而得,最终浓度为2.5mg/ml。另一组接受10mg/kg多奈派齐盐酸盐脂质体皮下注射,所述多奈派齐盐酸盐脂质体系根据实例2制备而得。注射后15分钟、1小时、2小时、4小时、8小时、24小时、48小时、72小时、96小时及168小时收集血液样品。两种多奈派齐配方的pk参数总结于表3中。表3中结果显示多奈派齐脂质体组的cmax是游离多奈派齐组的5.7%,且与游离多奈派齐组比较,多奈派齐脂质体的t1/2延长10倍。与象征100%的多奈派齐于注射后168小时释放的游离多奈派齐的曲线下面积(auc0-t)比较,多奈派齐脂质体的曲线下面积(auc0-t)指出注射后168小时64.4%的多奈派齐从多奈派齐脂质体配方释放。表3、单次皮下注射游离多奈派齐及多奈派齐脂质体后大鼠衍生的pk参数参数单位游离多奈派齐多奈派齐脂质体t1/2h3.3734.3cmaxng/ml45726.2auc0-thíng/ml25711656auc0-infhíng/ml25911722此外,第3图显示,在接受游离多奈派齐的药物注射后24小时后的大鼠血浆中未能侦测到多奈派齐,而在接受多奈派齐脂质体药物注射后的大鼠的血浆中直至168小时仍可侦测到多奈派齐。此结果支持所请的药物组合物持续释放多奈派齐的结论。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1