用于吸入用干粉制剂的新型载体颗粒的制作方法
1.本发明涉及用于用在吸入用干粉制剂中的载体颗粒(particle)及其制备方法。
2.发明背景
3.多年来,干粉吸入(dpi)药物疗法已经用于治疗呼吸道病症,诸如哮喘、慢性阻塞性肺疾病(copd)和全身性疾病。
4.与口服药物摄入相比,有效的治疗仅需要相对小剂量,因为首过代谢被分流和/或显著减少。
5.这样的小剂量减少身体暴露于药物,并使副作用最小化。全身性的不良作用也会减少,因为局部的肺递送将药物直接送至作用部位。更低的剂量方案也可以提供显著的费用节省,特别在涉及昂贵治疗剂的情况下。
6.为了有效地递送到肺中,要求药物颗粒的粒度在几微米(micrometers)、通常为1-5微米(microns)的范围内。
7.通常如下配制干粉制剂:将药物与粗载体颗粒混合,产生有序的混合物,其中微粉化的活性颗粒附着于载体颗粒的表面上,同时在吸入器装置中。
8.所述载体会使得微粉化的粉末具有更少的粘合性(cohesive),并改善它的流动性,使得在生产过程中更容易地操作所述粉末(倾倒、填充定量给料(dosing)等)。此外,当药物的治疗剂量在微克范围内时,将载体用作增量剂(bulk agent)。
9.在吸入过程中,药物颗粒从载体颗粒的表面分离,并渗入肺下部,而更大的载体颗粒大部分沉积在口咽腔中。
10.药物颗粒从载体表面的分离被视作控制药物向肺的可用性的最关键因素。这取决于:粉末混合物的机械稳定性、药物和载体之间的附着(adhesion)特征影响所述稳定性的方式、以及破坏附着颗粒之间形成的非共价键所需的外力。在附着颗粒之间的过强的键可能实际上阻止微粉化的药物颗粒从载体颗粒的表面分离。
11.在本领域中已经提出目的在于调节附着的不同方案,以促进药物颗粒从载体颗粒的释放,并因此增加可吸入分数(respirable fraction)。例如,为了满足所述目的,已经提出了添加具有润滑或抗粘附性(anti-adherent)的细赋形剂颗粒和/或细添加剂(以下统称为细颗粒)作为所述技术问题的解决方案。通常,所述细颗粒的尺寸小于50微米,优选地小于20微米。
12.但是,由于细颗粒的流动性差,所以随着细颗粒含量的增加,相关粉末制剂的流动性趋于变差。
13.另一方面,所述吸入途径越来越多地用于以相当高的单次剂量施用的活性成分。
14.这已经成为一项具有挑战性的任务,因为众所周知,活性成分的剂量和浓度越高,形成不均匀附聚物(agglomerate)(即由强内聚力保持在一起的微粉化药物颗粒)的风险就越大,这对于在粉末混合物中实现药物分布的良好均匀性的可能性,和因此具有良好的剂量准确性以及在患者吸入时适当的解聚作用的可能性是有害的。而且,活性成分的剂量和因此浓度越高,具有令人满意的可吸入分数所需的细颗粒的数目就越高。
15.大量的微粉化的活性成分和/或细赋形剂颗粒可能对相关制剂的流动性产生有害影响,这继而将影响装置在吸入器启动时递送正确剂量的能力。
16.因此,有利的是,提供这样的载体颗粒:其能够容纳相当大量的微粉化的药物,而不损害相关粉末制剂的流动性能(properties)。
17.甚至更有利的是,提供这样的载体颗粒:其能够容纳相当大量的微粉化的药物,同时在不使用细赋形剂颗粒和/或细添加剂的情况下维持好的气雾剂性能(performance)。
18.该问题通过本发明的载体颗粒及其制备方法解决。
技术实现要素:
19.在第一方面,本发明涉及由甘露糖醇制成的熔化喷雾凝固的颗粒(例如喷雾冻凝的颗粒),其用作吸入用干粉制剂的载体,所述颗粒具有在10-300微米范围内的质量直径,其中所述颗粒的特征在于由形状系数(shape factor)表示的规则形状,所述形状系数是在0.80至1.00之间,优选在0.90至1.00之间,更优选在0.95至1.00之间。
20.在第二方面,本发明涉及可通过包括以下步骤的方法得到的上述载体颗粒:
21.i)加热甘露醇直至完全熔化;
22.ii)将熔化的甘露醇通过合适的喷嘴喷入喷雾冻凝室以得到微滴;
23.iii)冷却所述微滴以诱导凝固和颗粒形成,
24.iv)分离得到的颗粒;
25.v)对所述颗粒进行调理步骤。
26.在第三方面,本发明涉及通过包括以下步骤的方法得到的上述载体颗粒:
27.i)加热甘露醇直至完全熔化;
28.ii)将熔化的甘露醇通过合适的喷嘴喷入喷雾冻凝室以得到微滴;
29.iii)冷却所述微滴以诱导凝固和颗粒形成,
30.iv)分离得到的颗粒;
31.v)对所述颗粒进行调理步骤。
32.在第四方面,本发明涉及一种用于制备要求保护的喷雾冻凝的颗粒的方法,所述方法包括以下步骤:
33.i)加热甘露醇直至完全熔化;
34.ii)将熔化的甘露醇通过合适的喷嘴喷入喷雾冻凝室以得到微滴;
35.iii)冷却所述微滴以诱导凝固和颗粒形成;
36.iv)分离得到的颗粒;和
37.v)对所述颗粒进行调理步骤。
38.在第五方面,本发明涉及用于吸入的干粉形式的药物组合物,其包含本发明的载体颗粒和一种或多种活性成分。
39.在第六方面,本发明涉及一种填充有上述干粉药物组合物的干粉吸入器。
40.在第七方面,本发明涉及一种制备上述药物组合物的方法,所述方法包括将本发明的载体颗粒与一种或多种活性成分在高剪切混合器中混合的步骤。
41.在进一步的方面,本发明还涉及包含根据本发明的干粉药物制剂和干粉吸入器的包装(package)。
42.定义
43.除非另外指出,术语“活性药物”、
‘
活性成分’、
‘
活性物’和
‘
活性物质’、
‘
活性化合物’和
‘
治疗剂’用作同义词。
44.术语“微米(microns)”用作”微米(micrometer)”的同义词。
45.一般而言,通过激光衍射测量特征性的等价球体直径(称作体积直径),从而定量颗粒的大小。
46.通过借助于技术人员已知的合适仪器和技术(诸如筛析)测量质量直径,也可以定量粒度。
47.体积直径(vd)通过颗粒密度与质量直径(md)相关联(假定大小独立于颗粒密度)。
48.可替换地,可以用体积直径表示粒度。特别地,粒度分布用以下形式表示:i)体积中位直径(vmd),其对应于50重量%的颗粒的直径,例如d(v0.5)和ii)10%和90%的颗粒的微米体积直径(vd),分别例如d(v0.1)和d(v0.9)。
49.术语“细颗粒”表示具有优选地小于20微米、更优选地小于15微米的中位体积直径的颗粒,其由生理上可接受的赋形剂制成和/或由具有润滑或抗粘附性能的添加剂制成,或其混合物。
50.术语
‘
良好流动性能’表示这样的制剂:其在生产过程中容易操作,且能够确保治疗有效剂量的准确且可再现的递送。
51.通过测量卡氏指数(carr’s index),可以评价流动特征(characteristics);通常认为小于25的卡氏指数会指示良好流动特征。
52.可替换地,通过用粉末流变仪的剪切池模块测量流动函数系数(ffc),可以评价流动特征。通过ffc值,可以将粉末分类为硬化(ffc≤1)、强粘合(ffc 1-2)、粘合(ffc 2-4)到容易流动(ffc 4-10)、以及自由流动(ffc≥10)。通常采用大于10的值指示自由流动的粉末和良好流动特征。
53.表述
‘
良好同质性’表示这样的制剂:其中,在混合以后,活性成分的含量均匀度(表示为相对标准差(rsd))小于5%。
54.表述
‘
在使用之前在装置中是物理上稳定的’表示这样的制剂:其中在生产干粉过程中和在使用之前在递送装置中,活性颗粒基本上不离开和/或脱离载体颗粒的表面。
55.表述
‘
可吸入分数’表示,可以到达患者的肺深处的活性成分颗粒的百分比的指标。一般而言,使用合适的体外装置,通常是多阶级联冲击器(multistage cascade impactor)或多阶液体冲击式吸收管(multi stage liquid impinger,mlsi)、快速筛选冲击器(fsi)或下一代冲击器(ngi),根据在常见的药典中报道的规程,评价可吸入分数,也称作细颗粒分数(fpf)。其通过可吸入的剂量和递送的(发射的)剂量之间的比例来计算。
56.从装置阶梯(stage)中药物的累积沉积计算递送剂量,而从对应于直径≤5.0微米的颗粒的阶梯中的沉积计算可吸入剂量(细颗粒剂量)。本领域技术人员应根据常见药典中报告的指南调整其它参数,例如吸气流。
57.高于30%的可吸入分数是良好吸入性能的指标。
58.术语
‘
治疗量’是指当经由本文所述的干粉制剂递送至肺时,会提供希望的生物学效应的活性成分的量。
59.‘
单次剂量’是指在启动吸入器以后,通过吸入一次施用的活性成分的量。
[0060]“启动”是指通过单次激发(例如机械的或呼吸)从装置释放出活性成分。
[0061]
定义
‘
相当高的单次治疗有效剂量’是指等于或高于800微克(μg)的标称剂量。
[0062]
术语
‘
高剪切混合器’表示这样的混合器,其中在装有要混合的粉末的罐中使用转子或叶轮以及被称为定子的固定组件(stationary component)以产生剪切力。
[0063]
术语
‘
甘露醇’表示甘露醇的三种多晶型形式:α、β和δ。β形式是在20℃和更高的热力学上稳定的形式。δ形式是甘露醇的最低熔点形式。δ形式是热力学上不稳定的,且可以自发地转变为热力学上更稳定的形式β。从δ-至-β的多晶型转变可以由例如水分触发。
[0064]
附图
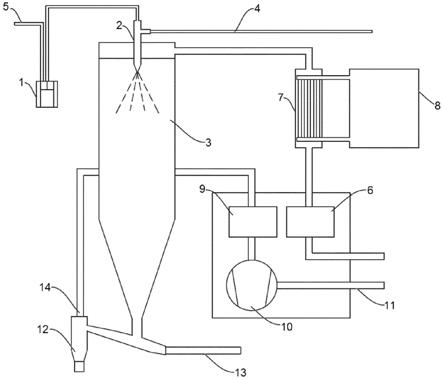
[0065]
图1-喷雾冻凝装置的示意图。
[0066]
图2-甘露醇颗粒的sem照片。
[0067]
图3-在6个月期间喷雾冻凝的甘露醇的waxs图谱(稳定性研究)。
[0068]
图4-喷雾冻凝的甘露醇在制备后和在调理后的waxs图谱。
[0069]
图5-喷雾冻凝的甘露醇在制备后和在调理后的waxs图谱(放大)。
[0070]
图6-光学显微术照片。
[0071]
发明详述
[0072]
本发明涉及由甘露糖醇制成的喷雾冻凝的颗粒,其用作用于吸入用干粉制剂的载体。
[0073]
喷雾冻凝,也被称作喷雾冷却,是一种将熔化物转变为界限清楚(well-defined)的球形颗粒的无溶剂过程。
[0074]
在图1中报告了喷雾冻凝装置的代表性示意图:
[0075]
将熔化的样品从加热的液体容器(1)送入加热的喷嘴(2)从而将样品喷雾到冻凝室(3)中。加热的喷嘴和加热的容器连接到压缩气体供应管线(4)和(5)。空气经由连接到热交换器(7)和冷却器单元(8)的入口hepa(高效颗粒状物(particulate)空气)过滤器(6)送入冻凝室(3)的顶部。来自室(3)的空气经由出口hepa过滤器(9)和风扇(10)排放到排气口(11)。
[0076]
干燥的颗粒经由出口管道(12)从冻凝室(3)的底部回收,所述出口管道(12)供有从气体供应管线(13)和(14)供应的压缩气体。
[0077]
可以使用以相同原理工作的其它类似装置。
[0078]
考虑到与其它糖如乳糖相反在熔化过程中不发生降解的事实,使用了甘露醇。
[0079]
所有颗粒应具有在10-300微米、优选20-280微米、更优选30-250微米范围内的以质量或体积直径表示的粒度。
[0080]
在本发明的一个优选实施方案中,当以体积直径表示时,载体颗粒的粒度分布满足以下参数:在25-45微米之间的d(v,0.1),在70-110微米之间的d(v,0.5),和在150-220微米之间的d(v,0.9)。
[0081]
所述载体颗粒的粒度分布的宽度表示为跨度,可以有利地是在1.3至2.2之间,优选在1.6至2.0之间。根据chew等人j pharm pharmaceut sci 2002,5,162-168,所述跨度对应于[d(v,0.9)-d(v,0.1)]/d(v,0.5)。
[0082]
形状系数用于表征本发明的载体颗粒的形状。
[0083]
因此,本发明的载体颗粒的特征在于是在0.80至1.00之间、优选在0.90至1.00之
间、更优选在0.95至1.00之间的形状系数。
[0084]
可以根据在kumar s等人curr appl.phys.influence of metal powder shape on drag coefficient in a spray jet,2009,9,678-682中报道的以下方程式确定形状系数:
[0085]
sf=1/rn
[0086]
其中:
[0087]
rn指示颗粒的圆度,并通过应用以下公式计算:
[0088]
rn=p2/4πa
[0089]
其中p和a分别是从扫描电子显微术(sem)图像测量的十个球形颗粒的平均周长和面积值。
[0090]
可替换地,可以通过光学显微镜测量平均周长和面积。
[0091]
在kumar s等人中报道了圆的形状系数(sf)为1.00。还报道了与整体的偏差(deviation from unity)导致颗粒的不规则性,但是具有高于0.8的sf值的颗粒可被认为具有球形形状。
[0092]
在一个典型的实施方案中,所产生的载体颗粒表现出通过malvern morphology g3 8.12版(malvern instruments inc,pennsylvania,usa)测得的0.986的形状系数。
[0093]
扫描电子显微术(sem)或光学显微术也可用于定性地理解本发明的粉末微粒的特征,诸如颗粒形状和它们的表面形态。
[0094]
本发明的载体颗粒显示出改善的流动性,这可以例如用ft4粉末流变仪(freeman technology,tewkesbury,英国)测量。因此,本发明的载体颗粒的特征在于大于10、通常在14至16之间的ffc值。
[0095]
也可以使用几种其它方法来确定本发明的载体颗粒的特征,例如真密度、表观和振实密度(tapped densities)以及比表面积。
[0096]
可以根据下述规程通过氦比重测定法(pycnometry)(比重瓶:accupyc ii 1340,micromeritics,norcross,ga,usa)测量本发明的颗粒的真密度:在19.5psi下进行20次吹扫,在19.5psi下进行五次分析,其中平衡速率为0.0050psi/min。测量颗粒体积,以计算颗粒密度。
[0097]
通常,真密度是在1.3至1.6g/cm3之间,优选在1.4至1.5g/cm3之间。
[0098]
可以根据已知方法确定表观和振实密度。
[0099]
例如,将样品插入10ml量筒中以达到体积的70-90%(记录量筒中的确切重量和高度)。
[0100]
通过下式确定表观堆密度(abd)
[0101]
abd=m/v0(以g/ml表示)
[0102]
其中,m是样品的重量,且v0是量筒中的样品的初始体积。
[0103]
通常,表观堆密度是在0.55至0.75g/ml之间,优选在0.6至0.7g/ml之间。
[0104]
施加累进的敲击数目:10、40、50、100、300、250和500,并记录相应的振实总体积(tapped bulk volume)。如果高度从250至500敲击步骤没有变化,则在总计1250次敲击完成分析:如果观察到变化,则添加额外的1250次敲击直到达到平衡。
[0105]
使用下式测量振实堆密度(tbd):
[0106]
tbd=m/vt(以g/ml表示)
[0107]
其中m是样品的重量,且vt是量筒中样品的最终体积。
[0108]
通常,振实堆密度是在0.7至0.9g/ml之间,优选在0.75至0.85g/ml之间。
[0109]
从ibd和tbd,使用下式可以计算卡氏指数:
[0110]
卡氏指数=100x(tbd-ibd)/tbd(以%表示)
[0111]
通常,证明该值远低于25,表明本发明的载体颗粒具有良好的流动特征。
[0112]
根据已知规程通过brunauer-emmett-teller(bet)氮吸附方法可以确定比表面积。
[0113]
本发明的载体颗粒的比表面积是在0.09至0.26m2/g之间,优选在0.10至0.20m2/g之间。
[0114]
令人惊奇地,包含本发明的载体颗粒的药物制剂可以产生良好的气溶胶性能,而无需使用细赋形剂颗粒和/或细添加剂。
[0115]
此外,如果在高剪切混合器中掺合短的混合时间(等于或小于20分钟),所述制剂表现出要在相当高的剂量(例如每次启动吸入器800微克)递送的活性成分的良好同质性。
[0116]
但是,通过使用常规混合器使粉末经受更长的混合时间,可以实现良好同质性。
[0117]
所述最佳特征是用于制备载体颗粒的方法的结果。
[0118]
因此,本发明涉及一种用于制备本发明的载体颗粒的方法,所述方法包括以下步骤:
[0119]
i)加热甘露醇直至完全熔化;
[0120]
ii)将熔化的甘露醇通过合适的喷嘴(2)喷入喷雾冻凝室(3)以得到微滴;
[0121]
iii)冷却所述微滴以诱导凝固和颗粒形成,
[0122]
iv)分离得到的颗粒;
[0123]
v)对所述颗粒进行调理步骤。
[0124]
甘露醇是商购可得的,并且可以以其结晶性多晶型形式(α、β和δ形式)中的每一种和/或它们的混合物以及无定形和/或结晶形式以及它们的混合物使用。
[0125]
喷雾冻凝装置是商购可得的,例如从procept(zelzate,比利时)获得。
[0126]
有利地,在步骤i)中,在真空下将甘露醇加热至至少185℃、优选190-200℃的温度。
[0127]
在步骤ii)中,可以使用双流体喷嘴作为合适的喷嘴。
[0128]
可替换地,可以有利地利用其它类型的喷嘴,例如超声雾化器和旋转雾化器。
[0129]
与喷嘴的类型、其内径、压强和喷射速率有关的参数应由技术人员根据批次的大小进行调整。
[0130]
通常,为了得到具有所要求的粒度的载体颗粒,双流体喷嘴的内径为1.2mm,并且将喷射速率调节至18.3至21.5g/min之间的范围。将喷嘴空气调节至5l/min,其对应于0.44巴的压强。
[0131]
通过环境温度或在喷雾期间在至少-10至-20℃的温度施加冷却空气,可以实现在步骤iii)中的微滴的冷却。
[0132]
在某些装置中,可以通过将微滴倒入液氮中来实现颗粒的喷雾熔化凝固。
[0133]
然后在步骤iv)中,在例如旋风分离器和/或滤袋中将颗粒与气流分离。
[0134]
由于在凝固过程中发生了甘露醇的亚稳定δ形式的形成,因此将步骤v)中的颗粒进行调理步骤以将亚稳定形式转化为稳定的β形式。
[0135]
有利地,通过在室温将粉末在密闭室中暴露于90-97%相对湿度、优选93%相对湿度保持12-48小时、优选24小时,进行调理步骤。
[0136]
期望的湿度环境可以用硫酸钾或硝酸钾、优选硝酸钾的饱和盐溶液得到。
[0137]
根据技术人员已知的规程,可以通过dsc和/或waxs分析来监测从δ-形式到β形式的转变。
[0138]
一旦所有的δ-形式都转化为更稳定的多晶型物,就不可观察到进一步的变化。
[0139]
广角x-射线(waxs)散射可用于确定粉末样品的结晶度和多晶型形式。应在室温使用点聚焦照相机系统s3-micro照相机(bruker axs gmbh,德国)进行测量。样品应装入2mm直径玻璃毛细管中,并在600s内以30计数/秒在恒定旋转速度(9rpm/min)进行分析。
[0140]
调理后的waxs结果可以揭示在约22
°
的δ形式特征性布拉格峰(bragg peak)的消失和在约23
°
的β形式最卓越的布拉格峰的出现。如果是这种情况,则可以得出结论,所选择的调理规程成功地产生了所希望的δ-至-β多晶型转变。
[0141]
可替换地,可以将具有以下设置的示差扫描量热仪(dsc 204f1netzsch gmbh,selb,德国)用于固态表征。
[0142]-样品质量为10-12mg(n=3)
[0143]-带穿孔盖的密封铝锅
[0144]-使用纯氮气作为吹扫气体在20ml/min的流速以10℃/min的加热速率从25℃加热到200℃。
[0145]
甘露醇颗粒基本上以结晶形式存在。
[0146]
有利地,以结晶颗粒相对于颗粒总重量的重量%表示的结晶度程度高于90%,优选高于95%。
[0147]
使用x-射线粉末衍射或技术人员已知的其它技术,诸如示差扫描量热法(dsc)、广角x-射线散射(waxs)或微量量热法,可以确定其结晶度及其程度。
[0148]
调理过的载体颗粒被证实在室温物理稳定至少6个月,从而使提供稳定的药物制剂成为可能。
[0149]
因此,本发明也涉及用于吸入的干粉形式的药物组合物,其包含本发明的载体颗粒和一种或多种活性成分的物理混合物。
[0150]
活性成分实际上可以是任何可以通过以干粉吸入施用的药物活性化合物。
[0151]
为了使活性物质可吸入,即它可以进入肺深部,如末梢和呼吸性细支气管以及肺泡管和囊,其必须为颗粒状物形式,具有至多约10微米、例如1至10微米、优选1至6微米的平均粒径(以质量平均直径测量)。这样的微粉化颗粒可以以本身已知的方式获得,例如通过微粉化,从选择的溶剂中受控沉淀,喷雾干燥,超临界流体,或根据wo 2004/073827、wo 2008/155570、wo 2008/114052和wo 2010/007447中所述的方法。
[0152]
活性物质的治疗量可以根据活性物质的性质、待治疗的病症的类型和严重程度以及需要治疗的患者的病症在宽范围内变化。
[0153]
通常,通过根据已知规程优选地在高剪切混合器中混合,将活性物质颗粒添加到本发明的载体颗粒中。
[0154]
典型的高剪切混合器是p 100和p 300(diosna gmbh,德国)、roto mix(ima,意大利)和cyclomix
tm
(hosokawa micron group ltd,日本)。
[0155]
具体地,技术人员应调节混合器的旋转速度和混合时间,以获得活性成分在制剂中的良好分布均匀度。
[0156]
通常,在施加至少5分钟的混合时间和100-500r.p.m的速度、优选以100-250r.p.m的速度进行20分钟后,在高剪切混合器中实现活性成分的极佳分布均匀度。
[0157]
作为一个实例,活性成分可以选自:短效和长效β
2-激动剂,诸如特布他林、瑞普特罗、沙丁胺醇、沙美特罗、福莫特罗、卡莫特罗、米维特罗、茚达特罗、奥达特罗、非诺特罗、克仑特罗、班布特罗、溴沙特罗、肾上腺素、异丙肾上腺素或海索那林或它们的盐和/或溶剂化物形式;短效和长效抗胆碱能药,诸如噻托溴铵、异丙托铵、氧托品、奥昔布宁、阿地溴铵、曲司氯铵(trospium)、格隆铵盐或具有代码gsk 573719和gsk 1160274的已知化合物、它们的盐和/或溶剂化物形式;用于吸入的双功能的毒蕈碱拮抗剂-β2激动剂(maba)化合物,诸如gsk 961081;嗜中性粒细胞弹性蛋白酶抑制剂诸如ono-6818和mk0339;p38 map激酶抑制剂诸如vx-702、sb-681323和gw-856553;短效和长效皮质类固醇类,诸如布替可特(butixocart)、罗氟奈德、氟尼缩松布地奈德、环索奈德、莫米松和它的酯(即糠酸酯)、氟替卡松和它的酯(即丙酸酯和糠酸酯)、倍氯米松和它的酯(即丙酸酯)、氯替泼诺或曲安奈德和它们的溶剂化物形式;白三烯-拮抗剂,诸如安多司特、伊拉司特、普仑司特、咪曲司特、塞曲司特、齐留通、扎鲁司特或孟鲁司特;磷酸二酯酶抑制剂,诸如非明司特、吡拉米司特或罗氟司特;paf-抑制剂,诸如阿帕泛、rorapafant或伊拉帕泛;镇痛药,诸如吗啡、芬太尼、喷他佐辛、丁丙诺啡、哌替啶、替利定或美沙酮;壮阳剂(potency agents)诸如西地那非、前列地尔或酚妥拉明;或任意前述化合物或化合物类别的药学上可接受的衍生物或盐。由于这些化合物中的任一种具有手性中心,可以使用光学纯形式的化合物,或可以呈现为非对映异构的混合物或外消旋混合物。
[0158]
干粉制剂还可以含有以下物质作为活性成分:抗生素诸如环丙沙星、左氧氟沙星和粘菌素(colistin)、妥布霉素、阿米卡星和庆大霉素;蛋白诸如胰岛素和α1-抗胰蛋白酶;抗病毒药物诸如扎那米韦和利巴韦林;抗真菌药诸如伊曲康唑和磷酸二酯酶(pde)-5抑制剂诸如西地那非和他达拉非。优选地,吸入用干粉制剂包含本发明的载体颗粒和一种或多种选自以下类别的活性成分:双功能的毒蕈碱拮抗剂-β2激动剂(maba)化合物、嗜中性粒细胞弹性蛋白酶抑制剂、p38 map激酶抑制剂、短效的和长效皮质类固醇和磷酸二酯酶-抑制剂。
[0159]
粉末制剂中活性成分的浓度将取决于启动吸入器时递送的制剂的喷射重量。
[0160]
例如,考虑到预期的800微克单次剂量,如果在启动吸入器时递送的制剂的喷射重量为10mg,则这将对应于8%w/w的活性成分浓度。
[0161]
类似地,对于20mg的喷射重量,活性成分的浓度将为4%w/v。
[0162]
在一个优选的实施方案中,包含本发明的载体颗粒的干粉制剂尤其可用于施用以吸入器每次启动800微克至1mg的单次剂量递送的活性成分。
[0163]
尽管不是必须实现良好的气雾剂性能,粉末制剂还包含细颗粒部分,其中位体积直径小于20微米、更有利地小于15微米、优选小于10微米。
[0164]
所述细颗粒可以由如上定义的生理上可接受的赋形剂制成和/或可以由选自以下
类别的添加剂材料制成:抗粘剂诸如氨基酸、例如亮氨酸和异亮氨酸,或润滑剂、诸如硬脂酸镁;硬脂酰醇富马酸钠、十八烷醇、硬脂酸和蔗糖单棕榈酸酯。
[0165]
在一个特定的实施方案中,细颗粒可以由任何比例的生理上可接受的赋形剂的颗粒和添加剂的颗粒组成,并且它们根据wo 01/78695的教导制备。
[0166]
在另一个实施方案中,细颗粒可以由90至99.5重量%的α-乳糖一水合物颗粒和0.5至10重量%的硬脂酸镁的混合物组成,其中至少90%的所述颗粒具有小于12微米的体积直径,且所述颗粒的体积中位直径是在4至6微米之间。
[0167]
可以将所述细颗粒加入制剂中并根据已知方法混合。
[0168]
包含本发明的载体颗粒的吸入用干粉制剂可以与任何干粉吸入器一起使用。
[0169]
干粉吸入器可以主要分成:i)单次剂量(单元剂量)吸入器,用于施用单个细分剂量的活性化合物;ii)预定量的多次剂量吸入器或贮库吸入器,其预装载足够更长的治疗周期的大量活性物质。
[0170]
所述干粉制剂可以以单元剂型存在。用于通过吸入局部递送至肺的干粉组合物可以例如存在于胶囊和药筒(cartridge)(例如明胶胶囊和药筒)或泡罩(例如层压的铝箔泡罩)中,用于吸入器或吹入器中。
[0171]
根据本发明的用于吸入的干粉制剂特别适用于包含贮库的多次剂量干粉吸入器中,通过所述装置的启动,可以根据需要从所述贮库取出单个治疗剂量。
[0172]
一种优选的多次剂量装置是在wo 2004/012801特别是从第1页的第一行到第39页的最后一行中描述的吸入器。
[0173]
可以使用的其它多次剂量装置是,例如,glaxosmithkline的ellipta
tm
或diskus
tm
,astrazeneca的turbohaler
tm
,schering的twisthaler
tm
和innovata的clickhaler
tm
。
[0174]
作为面市的单次剂量装置的例子,可以提及glaxosmithkline的rotohaler
tm
和boehringer ingelheim的handihaler
tm
。
[0175]
下述实施例详细地阐述了本发明。
[0176]
实施例1-本发明的甘露醇载体颗粒的制备
[0177]
甘露醇pearlitol 300dc购自roquette(法国)。
[0178]
使用可从procept(比利时)得到的喷雾冻凝装置。
[0179]
制备了三种不同的样品(60g,2x 500g,包括4x125 g)。
[0180]
将甘露醇在真空下在200℃加热至完全熔化,并通过1.2mm内径的双流体喷嘴进行喷雾,在温度为-7℃至-10℃(冷却器温度设定点-20℃)的室内施加冷却空气进入凝固室。
[0181]
在旋风分离器中从气流中分离得到的颗粒(收率:约45%)
[0182]
在喷雾冻凝过程中δ甘露醇的形成引起了对最终颗粒的稳定性的担忧。实际上,δ形式是甘露醇的亚稳定多晶型物,其具有2种稳定的多晶型物(α和β)。对选定的喷雾冻凝批次进行的为期一个月的稳定性研究表明,在waxs之后检测到的δ形式随时间转变为稳定的β或α形式(图3)。但是,通过喷雾冻凝后的调理步骤(在93%rh下24h,并在密闭室中用硝酸钾的饱和盐溶液固定(set)),可以将δ形式成功转化为稳定的β甘露醇(图4和5)。调理过的材料稳定多达6个月(图3)。
[0183]
使用在5kv运行的扫描电子显微镜(sem)(zeiss ultra 55,zeiss,oberkochen,德
国)检查颗粒的形态。在分析之前,将样品安装在碳带上并用金-钯溅射(图2)。
[0184]
如下进行形状系数分析。借助于刻度刮刀分离喷雾冻凝的粉末的样品(19mm3的样品),将等分试样装入morphology g3样品容器(光学显微术图像分析系统,malvern morphology g3 8.12版),并使用专用的分散室将其分散在具有受控压强(1巴)的专用载玻片上。使用5倍物镜在选定区域(半径为25mm的圆形区域)上执行图像分析,以确保测量了至少20000个颗粒。设置测量参数以获取单个颗粒用于形状分析,并通过软件过滤器去除任何采样异常即多个颗粒。
[0185]
使用方程式rn=p2/4πa确定圆度因子(rn),其中p是周长,且a是面积。使用方程式1/rn通过morphology软件计算颗粒形状系数(psf)(该因子在malvern morphology术语中被称为hs圆形度)。如光学显微术和sem照片所示,粉末显示出均匀的球形形态(图2和6)。通过约40000个单个颗粒的图像分析确定的颗粒形状系数(psf)给出0.986的平均值并确认了颗粒的球形形态。
[0186]
使用点聚焦照相机系统s3-micro照相机(bruker axs gmbh,德国)在室温通过waxs研究了物理状态。将样品填充到2mm直径玻璃毛细管中,并在600s中以30次计数/秒在恒定转速(9rpm/min)下进行分析。
[0187]
waxs结果指示,调理过的样品的实测峰图谱对应于α和β多晶型物的混合物(δ甘露醇产生β甘露醇),主要是α(burger等人,journal of pharmaceutical science,2000,energy/temperature diagram and compression behavior of the polymorphs of d-mannitol)。
[0188]
根据以下方法报道了其微粒学表征。
[0189]
使用r1透镜(sympatec helos)通过激光衍射确定粒度。将粉末样品分散给分别使用0.5和3巴的气压(sympatec rodos)的两种测量条件,并从受控的温度和湿度定量给料单元(humidity dosing unit)(sympatec aspiros)以5m/s的速率采样。从一式三份测量结果计算平均d[v,10],d[v,50],d[v,90]值。
[0190]
使用下述方程式计算跨度:
[0191]
跨度=[d(v,0.9)-d(v,0.1)]/d(v,0.5)
[0192]
使用micromeritics tristar ii 3020(norcross,美国)研究了甘露醇颗粒的比表面积。使用micromeritics vacprep 061脱气单元(norcross,美国)在25℃将所有样品真空干燥两天。使用氮气吸附和解吸等温线在液体n2温度下(-196℃)的进行测量;将brunauer、emmett和teller(bet)(emmett,1936)的吸附理论用于计算比表面积,使用的压强范围为相对于吸附物的饱和压强归一化的0.05-0.30。
[0193]
使用了1.5g粉末,产生了高于0.999的bet相关因子,表明该方法的适用性。一式三份进行每次测量。
[0194]
通过氦比重测定法(accupyc ii 1340,micromeritics,usa)测定真密度。准确地称量粉末样品,并使用20次在19.5psi的气体吹扫和0.005psi/min的平衡速率,在五次连续运行中测量它们的体积。将颗粒密度计算为样品质量与体积之比。
[0195]
树形批次的特征报告在表1中。
[0196]
表1
[0197] 批次60g规模批次500g n.1批次500g n.2
比表面积(m2/g)0.16210.14670.1173真密度(g/cm3)1.43731.45331.4569psd(x
10-μm)31.0732.031.2psd(x
50-μm)94.0889.088.3psd(x
90-μm)208.20189.6184.1psd(span-μm)1.81.81.7
[0198]
实施例2-包含本发明的载体颗粒的制剂的制备
[0199]
根据在wo 2010/089107中公开的方法,制备了3-环丙基甲氧基-4-[(甲磺酰基)-氨基]-苯甲酸的化合物1-(s)-1-[(3-环丙基甲氧基-4-二氟甲氧基)苯基]-2-[(3,5-二氯-1-氧基)-4-吡啶基]乙酯,在下文中称作chf 6001。
[0200]
如在实施例1中所报道,制备甘露醇颗粒。
[0201]
通过在高剪切混合器(hosokawa lab cyclomix,日本)中在100rpm或250rpm混合20min,制备含有4%w/w药物的chf 6001制剂(批次大小25g)。
[0202]
在混合过程结束时检查制备的混合物的同质性。对于每种制剂,从粉末床的不同位置收集十个样品(每个20-60mg)。将每个样品溶解在50ml适当溶剂(ch3cn/水60:40v/v溶液)中,并通过hplc-uv进行药物的定量。
[0203]
在低于5%的变异系数(计算为10次测量的标准差与平均值之比的百分比)假定同质性。相对于理论含量要求以%表示测定。
[0204]
结果报告在表2中。
[0205]
表2.
[0206][0207]
实施例3-体外空气动力学性能
[0208]
在将它装载到在wo 2004/012801中描述并被称作的多剂量干粉吸入器中以后,以气雾剂性能的方式表征实施例3的粉末制剂。平均制剂喷射重量取决于粉末的密度,并且对于该制剂,为约20mg。被测制剂的标称强度(4%w/w药物载荷)对应于每次喷射800μg/20mg。
[0209]
使用配有usp诱导口、预分离器、七个冲击阶梯和最后的微孔收集器的下一代冲击器(ngi,copley scientific,uk)进行了体外空气动力学评估。
[0210]
在完成组装后,将ngi连接到真空泵(通过质量流量计测量穿过冲击器的流速)。
[0211]
在60ml/min的采样流速,临界流量(p3/p2比率)≤0.5。
[0212]
将装置通过气密的橡胶嘴连接到冲击器后,将真空泵以60l/min的流量激活4秒,以便根据ph.eur.8.0,2.9.18抽取4l的空气。
[0213]
使用分配到诱导口(包括吸口-50ml)、预分离器(100ml)和每个阶梯(10ml)的溶剂
ch3cn:h2o(60:40%v/v),从ngi回收沉积在冲击器的每个阶梯上的药物chf 6001。通过hplc-uv分析所有样品。
[0214]
空气动力学粒度分布是基于来自(在wo 2004/012801中、特别是从第1页第一行到第39页最后一行描述的一种多次剂量装置)的2次启动,每次均采样到4升空气中(相当于4s的吸入时间)。
[0215]
通过计算以下项目来评价空气动力学性能:
[0216]
·
发射剂量(ed),作为在冲击器的所有部分中回收的药物部分的总和(以μg表示)及其相对于标称剂量的百分比;
[0217]
·
细颗粒质量(fpm),即截止直径小于5μm的药物的量,根据欧洲药典(ph.eur.8.0,2.9.18.)通过内插进行计算并以μg表示;
[0218]
·
细颗粒分数(fpf),计算为fpm与ed之比,表示为百分比;
[0219]
·
平均质量空气动力学直径(mmad),计算为相对于空气动力学直径的空气传播的颗粒质量的分布的中位数。
[0220]
气雾剂性能的结果报告在表3中。
[0221]
表3.
[0222][0223]
可以理解,所有制剂均得到了良好的气雾剂性能,fpf显著高于40%。
[0224]
得到了在发射剂量的百分比方面的极佳值。
[0225]
在相同的标称喷射剂量(800μg/20mg),用二丙酸倍氯米松替代chf 6001,得到了类似的关于发射剂量的百分比的结果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1