干细胞来源外排体的冻干制剂和包含其作为活性成分的抗炎组合物的制作方法
本发明涉及用于预防、抑制、减轻、改善或治疗炎症的干细胞来源外排体的冻干制剂,以及包含其作为活性成分的抗炎组合物。
此外,本发明涉及使用该抗炎组合物来预防、抑制、减轻、改善或治疗炎性疾病的方法。
背景技术:
炎症是身体针对物理或化学损伤,细菌、真菌或病毒的感染的防御反应,或者由多种变应原引起的病理状况等。炎性应答显示为固有免疫应答的一部分。多种物质以及生理和化学现象参与炎性应答,并且最近的研究已表明,多种炎性细胞因子在炎性应答中发挥重要作用。参与炎性应答的主要细胞因子包括il-1β、tnf-α、il-6、il-8、il-12、ifn-β等。这些细胞因子的表达和分泌的提高以及其激活与一系列复杂的生理应答以及症状(例如红斑、水肿、发热和疼痛)相关,所述生理应答包括炎性介质的分泌、免疫细胞浸润、细胞迁移和组织破坏。
一般而言,如果感染原从身体中去除并且受损组织再生,则炎性应答不会成为一个重要的问题,并且受影响的区域会恢复至其正常状态。然而,如果感染原未从身体中去除或者由于身体的内部物质,炎性应答过度或持续,则发生急性或慢性炎性疾病。
免疫抑制药物,例如非甾体抗炎药、甾体抗炎药、神经肽拮抗剂、cox抑制剂、抗组胺剂和环孢素a用于减轻或治疗由此引起的炎性应答或炎性疾病,但是具有这样的问题:它们引起不良作用,例如皮肤萎缩、血管舒张、色素脱失、超敏反应、耐受性、中性粒细胞减少等。另外,存在这样的限制:上述药物仅有助于将与炎症有关的症状控制至一定水平,而不是因此进行根本治疗。
近年来,已经积极地进行了关于使用天然物质来开发炎性疾病治疗剂或功能性化妆品的研究。在基于这些天然物质的炎性疾病治疗剂或功能性化妆品的情况下,天然提取物中活性成分的量低,并因此需要使用大量的天然提取物以获得抗炎作用。在大多数情况下,在市场营销中已经强调了这些治疗剂或功能性化妆品是基于天然物质的事实,但是需要关于天然物质对抗炎作用的实际效力的更多的科学研究。
最近,有报道称细胞分泌组(secretome)包含调节细胞行为的多种生物活性分子。特别地,细胞分泌组包含具有细胞间信号传导功能的“外排体(exosome)”,并因此已积极地对其组分和功能进行了研究。
细胞将多种膜囊泡脱落到其胞外环境,并且这些释放的囊泡通常称为胞外囊泡(extracellularvesicle,ev)。ev也被称为细胞膜来源囊泡、核外颗粒体(ectosome)、脱落囊泡、微粒、外排体等,并且在一些情况下也与外排体区别使用。
外排体是尺寸为数十至数百纳米的囊泡,其由与细胞膜具有相同结构的磷脂双层膜组成。该外排体包含被称为外排体载物(cargo)的蛋白质、核酸(mrna、mirna等)等。已知外排体载物包括范围广泛的信号传导因子,并且这些信号传导因子对细胞类型具有特异性并且根据分泌细胞的环境而受到不同的调节。已知外排体是由细胞分泌的细胞间信号传导介质,并且通过其传输的多种细胞信号调节细胞行为,包括靶细胞的活化、生长、迁移、分化、去分化、凋亡和坏死。根据外排体来源于其中的细胞的性质和状态,外排体包含特定的遗传物质和生物活性因子。来源于增殖中干细胞的外排体调节细胞行为,例如细胞迁移、增殖和分化,并且概括参与组织再生的干细胞的特征(naturereviewimmunology2002(2)569-579)。
即,称为细胞的“化身”的外排体包含类似于细胞的生物活性因子,例如生长因子。然而,当外排体在室温下储存时,出现其稳定性问题,其中所包含的生物活性因子的活性降低。另外,当将外排体简单地冷储存时,可发生外排体的总体物理特性和稳定性的变化,这取决于其储存时间和方法,并因此其中所包含的生物活性因子的活性也可降低。
然而,尽管已进行了表明使用外排体来治疗一些疾病的可能性的多个外排体研究,但是,对于可稳定地维持并进行外排体储存的新制剂开发以及将外排体与多种医学或美容技术联系起来以提高外排体的便利性和效力没有给予太多的关注。
本发明人已经进行了关于能够稳定地维持和储存干细胞来源外排体的新制剂的开发以及将该制剂应用于医学或美容技术的大量研究,并且作为结果,已经开发了使干细胞来源外排体稳定并表现出优异抗炎作用的干细胞来源外排体的冻干制剂,以及包含其的抗炎组合物,从而完成了本发明。
同时,应理解的是,作为背景技术描述的内容仅旨在帮助理解本发明的背景,并不被认为是针对本发明的现有技术。
技术实现要素:
技术挑战
本发明的一个目的是提供用于预防、抑制、减轻、改善或治疗炎症的干细胞来源外排体的冻干制剂,以及包含其作为活性成分的抗炎组合物。
本发明的另一个目的是提供包含上述抗炎组合物的抗炎药物组合物、功能性化妆品组合物和皮肤外用制剂。
本发明的另一个目的是提供使用上述抗炎组合物来预防、抑制、减轻、改善或治疗炎性疾病的方法。
然而,如上所述的本发明目的是举例说明性的并且本发明的范围不受此限制。另外,通过以下描述、所附权利要求书和附图,本发明的其他目的和优点将更加明显。
技术方案
本发明提供了用于预防、抑制、减轻、改善或治疗炎症的干细胞来源外排体的冻干制剂,以及包含其作为活性成分的抗炎组合物。
本文中使用的术语“外排体”是指尺寸为数十至数百纳米(优选地,约30至200nm)的囊泡,其由与细胞膜具有相同结构的磷脂双层膜组成(然而,根据分离出外排体的细胞的类型、分离方法和测量方法,外排体的颗粒尺寸是可变的)(vasiliys.chernyshevetal.,“sizeandshapecharacterizationofhydratedanddesiccatedexosomes”,analbioanalchem,(2015)doi10.1007/s00216-015-8535-3)。这些外排体包含被称为外排体载物的蛋白质、核酸(mrna、mirna等)等。已知外排体载物包括范围广泛的信号传导因子,并且这些信号传导因子对细胞类型具有特异性并且根据分泌细胞的环境而受到不同的调节。已知外排体是由细胞分泌的细胞间信号传导介质,并且通过其传输的多种细胞信号调节细胞行为,包括靶细胞的活化、生长、迁移、分化、去分化、凋亡和坏死。
同时,本文中使用的术语“外排体”旨在包括从干细胞分泌并释放到胞外空间中且具有纳米尺寸囊泡结构和与外排体的组成类似的组成的所有囊泡(例如,外排体样囊泡)。干细胞不限于其种类,但是可优选地为间充质干细胞,例如,脂肪、骨髓、脐带或脐带血来源的干细胞,更优选脂肪来源干细胞。脂肪来源干细胞不限于其种类,只要其不具有感染病原体的风险并且不引起免疫排斥即可,但是可优选地为人脂肪来源干细胞。
然而,作为用于本发明的外排体,当然可使用本领域中正在使用或可在将来使用的多种外排体,只要其具有抗炎作用并且不对人体造成不良作用即可。因此,应当注意的是,根据下述实施例的分离方法分离的外排体应理解为可用于本发明的外排体的一个实例,并且本发明不限于此。
本文中使用的术语“离子透入(iontophoresis)”是指这样的方法:使微电流流过已施加活性成分的皮肤,从而产生势差并改变皮肤的电环境,并由此使离子化的活性成分通过电斥力穿透皮肤。在本发明的一个实施方案中使用的离子透入的一些实例包括:通过使微电流从外部电源流入到皮肤上的电极贴片中而将微电流引入到皮肤中的方法,所述微电流由外部电源产生;将微电流引入到皮肤中的方法,所述微电流由皮肤上的电极贴片中提供的电池产生;以及通过用逆向电渗析装置提供的皮肤上的贴片将微电流引入到皮肤中的方法,所述微电流由逆向电渗析装置中的高浓度电解质溶液与低浓度电解质溶液之间的浓度差产生。然而,本发明不限于此,并且当然可使用多种类型的离子透入。
本发明的抗炎组合物用于预防、抑制、减轻、改善或治疗炎性疾病。作为一个实例而不是限制本发明,炎性疾病的一些实例包括皮炎、特应性皮炎、湿疹、由细菌、病毒或真菌感染引起的炎症、烧伤、由烧伤引起的炎症、伤口、由伤口引起的炎症、溃疡性结肠炎、关节炎、类风湿性关节炎、肝炎、肾炎等。
本发明还提供了用于预防、抑制、减轻、改善或治疗炎症的干细胞来源外排体的冻干制剂,其包含:作为活性成分的干细胞来源外排体;以及甲硫氨酸、甘露糖醇和海藻糖。例如,冻干制剂中甲硫氨酸、甘露糖醇和海藻糖的重量比可为1∶1∶1。
根据本发明一个实施方案的干细胞来源外排体的冻干制剂还可包含抗坏血酸和视黄醇。例如,冻干制剂中甲硫氨酸、甘露糖醇、海藻糖、抗坏血酸和视黄醇的重量比可为9∶9∶9∶0.5∶0.5。
根据本发明一个实施方案的抗炎组合物可包含干细胞来源外排体的冻干制剂和稀释剂。例如,稀释剂可以是注射用水、生理盐水、磷酸盐缓冲盐水、纯化水或去离子水。另外,稀释剂还可包含透明质酸或透明质酸盐(例如,透明质酸钠)。例如,抗炎组合物可被制备为混悬剂。
在本发明一个实施方案中,抗炎组合物可通过微针法
在本发明一个实施方案中,抗炎组合物可以是药物组合物、化妆品组合物或皮肤外用制剂。例如,抗炎组合物可被制备为可注射制剂。
在本发明一个实施方案中,当抗炎组合物用作药物组合物时,其可包含可药用的载体、赋形剂或稀释剂。载体、赋形剂和稀释剂包括但不限于:乳糖、右旋糖、海藻糖、蔗糖、山梨糖醇、甘露糖醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、金合欢胶、藻酸类、明胶、磷酸钙、碳酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油。另外,根据本发明一个实施方案的药物组合物的有效量意指为了实现抗炎作用而需要施用的量。
制剂中根据一个实施方案的药物组合物的含量可根据如上所述的另外组分的种类、量、形式等适当地选择。例如,本发明的药物组合物可以以基于可注射制剂的总重量的约0.1wt%至99wt%、优选约10wt%至90wt%的量包含在内。此外,根据本发明一个实施方案的药物组合物的合适剂量可根据以下进行调整:炎性疾病的种类,炎性疾病的严重程度,制剂的类型,配制方法,患者的年龄、性别、体重、健康状况、饮食、排泄率,施用时间和施用方案。例如,当将根据本发明一个实施方案的药物组合物施用于成人时,其可以以每天0.001mg/kg至100mg/kg的剂量施用一次至数次。
同时,当将根据本发明一个实施方案的抗炎组合物制备为皮肤外用制剂和/或化妆品组合物时,在不损害本发明效果的范围内,根据需要,其可适当地包含在化妆品产品或皮肤外用制剂中通常使用的组分,例如,保湿剂、抗氧化剂、油性组分、uv吸收剂、乳化剂、表面活性剂、增稠剂、醇、粉组分、着色剂、水性组分、水以及多种皮肤营养素等。
此外,在不损害其效果(例如抗炎效果)的范围内,根据本发明一个实施方案的皮肤外用制剂和/或化妆品组合物除干细胞来源外排体的冻干制剂或包含其的抗炎组合物之外,还可包含在现有技术中已使用的抗炎剂和/或消炎药。例如,干细胞来源外排体的冻干制剂或包含其的抗炎组合物可包含在以下中的至少一种中或与以下中的至少一种混合:水凝胶、透明质酸、透明质酸的盐(例如,透明质酸钠等)或透明质酸凝胶。在根据本发明一个实施方案的皮肤外用制剂和/或化妆品组合物中,水凝胶的种类没有特别限制,但是水凝胶可优选地通过将胶凝聚合物分散在多元醇中来获得。胶凝聚合物可以是选自以下的至少一种:普朗尼克、纯化琼脂、琼脂糖、结冷胶、藻酸、卡拉胶、肉桂胶、黄原胶、半乳甘露聚糖、葡甘露聚糖、果胶、纤维素、瓜尔胶和槐豆胶,并且多元醇可以是选自以下的至少一种:乙二醇、丙二醇、1,3-丁二醇、异丁二醇、二丙二醇、山梨糖醇、木糖醇和甘油。
根据本发明一个实施方案的皮肤外用制剂和/或化妆品组合物可以以多种形式使用,例如,贴剂
根据本发明一个实施方案的化妆品组合物用于预防、抑制、减轻或改善炎症的目的,并且所述化妆品组合物可制备为本领域中通常制备的任何制剂。例如,其可配制为:贴剂、片装面膜、面膜巾、皮肤软化剂
根据本发明一个实施方案的皮肤外用制剂和/或化妆品组合物包含在皮肤外用制剂和/或化妆品产品中通常使用的组分。例如,皮肤外用制剂和/或化妆品组合物可包含常规的辅料和载体,例如抗氧化剂、稳定剂、增溶剂、维生素、色素和香料。另外,根据皮肤外用制剂和/或化妆品组合物的类型或预期用途,本领域技术人员可毫无困难地适当选择皮肤外用制剂和/或化妆品组合物的每种制剂中的其他组分。
本发明还提供了使用所述抗炎组合物来预防、抑制、减轻、改善或治疗炎性疾病的方法。
根据本发明一个实施方案的预防、抑制、减轻、改善或治疗炎性疾病的方法包括以下步骤:(a)制备抗炎组合物;以及(b)用所述抗炎组合物处理对象的炎性区域。
在根据本发明一个实施方案的预防、抑制、减轻、改善或治疗炎性疾病的方法中,可通过微针法、离子透入或注射将抗炎组合物施用于哺乳动物皮肤。
根据本发明一个实施方案的预防、抑制、减轻、改善或治疗炎性疾病的方法还包括以下步骤:(c)通过使微电流流过用抗炎组合物处理的皮肤来进行离子透入;以及(d)通过微电流在皮肤内递送抗炎组合物。
在根据本发明一个实施方案的预防、抑制、减轻、改善或治疗炎性疾病的方法中,抗炎组合物可以以多种形式使用,例如贴剂、片装面膜、面膜巾、霜、活肤水、软膏、混悬剂、乳剂、糊剂、乳液、凝胶剂、油剂、剥撕式面膜、喷雾剂、气雾剂、雾剂、粉底、粉和油纸。例如,可将抗炎组合物施加至贴剂、片装面膜或面膜巾的至少一个表面或者浸在贴剂、片装面膜或面膜巾的至少一个表面中。
在根据本发明一个实施方案的预防、抑制、减轻、改善或治疗炎性疾病的方法中,步骤(b)可通过以下进行:(b1)将抗炎组合物直接施加至皮肤;或者(b2)使片装面膜、面膜巾或贴剂与皮肤接触或附着至皮肤,所述片装面膜、面膜巾或贴剂具有向其施加或浸在其中的抗炎组合物;或者先后进行(b1)和(b2)。
在根据本发明一个实施方案的预防、抑制、减轻、改善或治疗炎性疾病的方法中,可将以下中的至少一种施加至片装面膜、面膜巾或贴剂的至少一侧:水凝胶、透明质酸、透明质酸的盐(例如,透明质酸钠等)或透明质酸凝胶。水凝胶的种类没有限制,但是水凝胶可优选地通过将胶凝聚合物分散在多元醇中来获得。胶凝聚合物和多元醇可以是前述内容中例示的那些。
在根据本发明一个实施方案的预防、抑制、减轻、改善或治疗炎性疾病的方法中,步骤(c)可通过使离子透入装置与皮肤接触或附着至皮肤来进行。
在根据本发明一个实施方案的预防、抑制、减轻、改善或治疗炎性疾病的方法中,离子透入装置可包含选自以下的至少一种电池:柔性电池、锂离子二次电池、碱性电池、干电池、汞电池、锂电池、镍镉电池和逆向电渗析电池。
有利效果
根据本发明的干细胞来源外排体的冻干制剂和包含其作为活性成分的抗炎组合物能够使干细胞来源外排体稳定并表现出优异的抗炎作用,并且特别地,与从干细胞的条件培养基中分离和纯化的未冻干的干细胞来源外排体相比,表现出显著的抗炎作用。
因此,干细胞来源外排体的冻干制剂和包含其作为活性成分的抗炎组合物能够有效地预防、抑制、减轻、改善或治疗炎性应答或炎性疾病。
应当理解,本发明的范围不限于前述效果。
附图说明
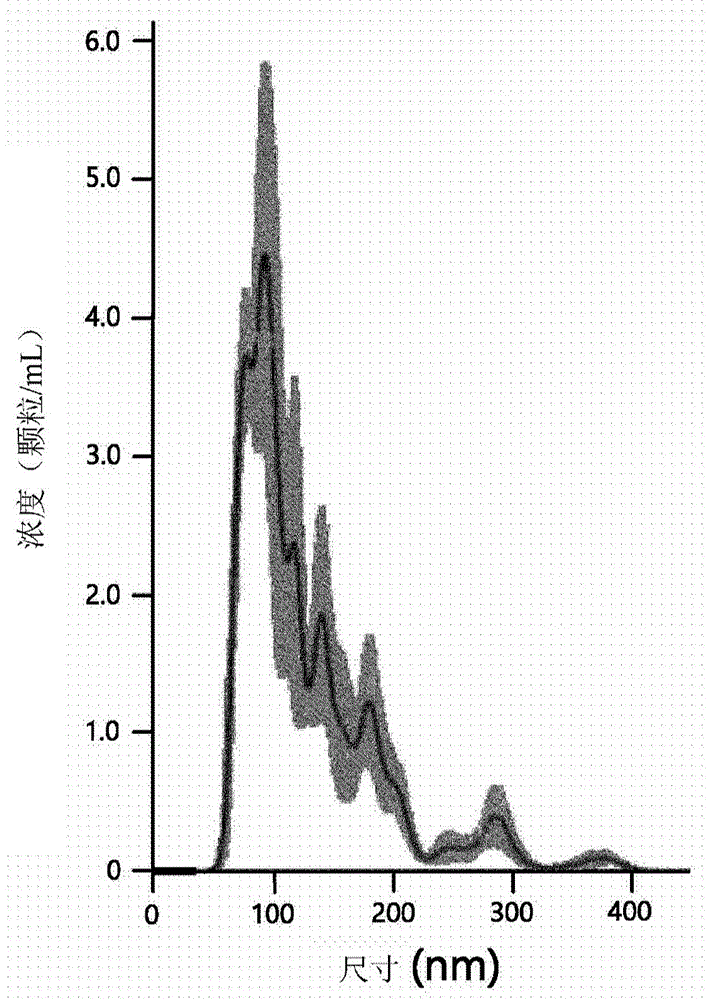
图1示出了分析根据本发明一个实施方案获得的干细胞来源外排体的物理特性的结果。“图1a”示出了通过纳米粒追踪分析(nanoparticletrackinganalysis,nta)获得的颗粒尺寸分布和颗粒数目。“图1b”示出了通过透射电子显微术(transmittedelectronmicroscopy,tem)获得的颗粒图像。“图1c”示出了根据本发明一个实施方案获得的干细胞来源外排体的阳性标志物的western印迹分析的结果。“图1d”示出了根据本发明一个实施方案获得的干细胞来源外排体的阴性标志物的western印迹分析的结果。“图1e”示出了根据本发明一个实施方案获得的干细胞来源外排体的标志物的分析中,cd9、cd63和cd81的流式细胞术的结果。
图2示出了显示在用根据本发明一个实施方案的干细胞来源外排体处理人成纤维细胞hs68细胞之后,该外排体不具有细胞毒性的结果。
图3展示了示出根据本发明一个实施方案的所冻干外排体的良好外观的照片。
图4a至4g是各自示出了在使用冷冻保护剂组分的不同组合进行冻干之后,根据冷冻保护剂组分的组合中的每一种获得的冻干外排体的外观的照片。
图5至8示出了使用多重组对炎性细胞因子进行分析的结果。在图5至8中,当将raw264.7细胞用不同浓度(表示为颗粒数目/ml)的实施例2中制备的干细胞来源外排体(从干细胞的条件培养基中分离和纯化的外排体)处理,并随后用lps处理时,细胞中il-β、il-6、il-27和ifn-β的lps诱导的产生以依赖于外排体浓度的方式降低。
图9至12示出了使用多重组对炎性细胞因子进行分析的结果。在图9至12中,当将raw264.7细胞用不同浓度(表示为颗粒数目/ml)的通过将干细胞来源外排体的冻干制剂(实施例5-1中制备的)与培养基混合而获得和稀释的水溶液处理,并随后用lps处理时,细胞中il-β、il-6、il-27和ifn-β的lps诱导的产生以依赖于冻干制剂浓度的方式显著降低。
具体实施方式
在下文中,将参照以下实施例更详细地描述本发明。然而,以下实施例仅是举例说明本发明并且不旨在限制或约束本发明的范围。本领域技术人员可从本发明的详细描述和实施例中容易地推断出的那些被解释为落入本发明的范围内。本发明中提及的参考文献均通过引用并入本文。
在本说明书通篇,应理解,除非另外指明,否则当任何部分被提及“包含/包括”任何组分时,其不排除其他组分,而是还可包含/包括其他组分。
实施例
实施例1:细胞培养
将购自atcc的人真皮成纤维细胞(humandermalfibroblast,hdf)hs68细胞在包含10%胎牛血清(fbs;购自thermofisherscientific)和1%抗生素-抗真菌剂(购自thermofisherscientific)的dmem(购自thermofisherscientific)培养基中在37℃、5%co2下进行传代培养。
根据本发明所属技术领域中已知的细胞培养方法,在37℃、5%co2下培养脂肪来源干细胞。接下来,将细胞用磷酸盐缓冲盐水(购自thermofisherscientific)洗涤,并随后用无血清、无酚红的培养基替代该培养基,并将细胞培养1至10天。回收上清液(在下文中称为“条件培养基”)。
为了在外排体分离过程中获得具有均一颗粒尺寸分布和高纯度的外排体,向条件培养基添加2wt%的海藻糖。在添加海藻糖之后,通过0.22μm过滤器过滤条件培养基以去除杂质,例如细胞碎片、废物、大颗粒等。立即从经过滤的条件培养基分离外排体。另外,将经过滤的条件培养基储存在冰箱(10℃或低于10℃)中,并随后用于外排体分离。此外,将经过滤的条件培养基冷冻储存在-60℃或低于-60℃的超低温冷冻箱中,解冻,并随后进行外排体分离。此后,通过切向流过滤(tangentialflowfiltration,tff)从条件培养基分离外排体。
实施例2:通过tff方法进行的外排体的分离和纯化
为了从实施例1中经通过0.22μm过滤器过滤的条件培养基中分离外排体、对其进行浓缩和渗滤,使用了tff方法。作为用于tff方法的过滤器,使用了筒式过滤器(称为中空纤维过滤器;购自gehealthcare)或盒式过滤器(购自pall、sartorius或merckmillipore)。可选择具有不同截留分子量(mwco)的tff过滤器。使用具有所选mwco的过滤器,将外排体分离并浓缩,并去除小于mwco的颗粒、蛋白质、脂质、核酸、低分子量化合物等。
为了分离和浓缩外排体,使用mwco为100,000da(道尔顿)、300,000da或500,000da的tff过滤器。通过tff方法通过去除小于mwco的物质并将条件培养基浓缩至约1/100至1/25的体积从条件培养基分离外排体。
对分离并浓缩的外排体溶液另外进行渗滤。渗滤使用体积为起始体积的至少4倍、优选至少6至10倍、更优选至少12倍的缓冲液连续地(连续渗滤)或不连续地(不连续渗滤)进行。为了获得具有均一颗粒尺寸分布和高纯度的外排体,向缓冲液添加pbs中的2wt%海藻糖。
实施例3:分离的外排体的特征分析
通过纳米粒追踪分析(nta)仪器(购自malvern)测量分离的外排体的颗粒尺寸和浓度。通过透射电子显微术(tem)分析分离的外排体的均一性和尺寸。图1a和1b示出了通过根据本发明一个实施方案的分离方法分离的外排体的nta和tem的结果。
图1c示出了通过根据本发明一个实施方案的分离方法分离的外排体的阳性标志物的western印迹分析的结果。如其中所示,确定了cd63、cd9、cd81、alix和tsg101标志物的存在。作为每种标志物的抗体,分别使用了抗cd63、抗cd9、抗cd81、抗alix和抗tsg101。
图1d示出了通过根据本发明一个实施方案的分离方法分离的外排体的阴性标志物的western印迹分析的结果。作为每种标志物的抗体,分别使用了抗gm130和抗钙连蛋白。当分析外排体的特征时,gm130和钙连蛋白是不应存在于外排体中的阴性标志物。如图1d中所示,确定了gm130和钙连蛋白存在于脂肪来源干细胞中的裂解物中,但不存在于通过根据本发明一个实施方案的分离方法分离的外排体中。因此,当一起考虑图1c和图1d中所示的结果时,可以看出,通过根据本发明一个实施方案的分离方法分离的外排体是满足阳性标志物和阴性标志物的特征的外排体。
图1e示出了通过根据本发明一个实施方案的分离方法分离的外排体的流式细胞术的结果。如其中所示,确定了cd9、cd63和cd81标志物的存在。为了分离cd81阳性外排体,根据制造商的说明书使用外排体-人cd81分离/检测试剂盒(购自thermofisherscientific)。用pe-小鼠抗人cd9(购自bd)、pe-小鼠抗人cd63(购自bd)或pe-小鼠抗人cd81(购自bd)对标志物进行染色,并随后使用流式细胞仪(aceabiosciences)进行分析。
实施例4:外排体处理之后细胞毒性的测量
为了评价通过根据本发明一个实施方案的分离方法分离的外排体在人皮肤成纤维细胞hs68细胞中的细胞毒性,将细胞用多种浓度的外排体处理,并检查细胞的增殖率。特别地,将hs68细胞悬浮于含10%fbs的dmem中,并随后接种,产生80%至90%汇合,并在37℃、5%co2下在培养箱中培养24小时。在24小时之后,去除培养基,并用多种浓度的实施例2中制备的外排体对细胞进行处理。然后,在将细胞培养24至72小时时评价细胞的生存力。细胞生存力使用wst-1试剂(购自takara)、mtt试剂(购自sigma)、celltiter-glo试剂(购自promega)或alamarblue试剂(购自thermofisherscientific)用微板阅读仪(购自moleculardevices)进行测量。
作为对照,使用未用外排体处理的在常规细胞培养基中培养的细胞。确定了本发明的外排体在该测试中使用的浓度范围内没有表现出细胞毒性(图2)。
实施例5:外排体的冻干
实施例5-1:冻干条件
为了使外排体冻干,制备了包含甲硫氨酸、甘露糖醇和海藻糖的冷冻保护剂。通过将冷冻保护剂添加至包含0.5mg/ml的抗坏血酸和视黄醇(由bio-fd&cco.,ltd,hwasun-gun,jeollanam-do,korea制备)中的每一种的1ml水溶液来制备水溶液。尽管在该实施例中将冷冻保护剂添加至包含抗坏血酸和视黄醇的溶液,但是也可通过将冷冻保护剂添加至注射用水、纯化水、生理盐水或去离子水来制备水溶液。将水溶液中甲硫氨酸、甘露糖醇和海藻糖中的每一种的浓度调节至9mg/ml。
将实施例2中制备的外排体(5×108个颗粒/ml)与包含冷冻保护剂的水溶液混合,并随后在示于下表1中的条件下使用冻干系统(由virtis制造,项目no.:34424)冻干。冻干以如示于下表1中条件1、2、3、4、5、6、7和8的顺序进行。
表1:冻干条件
在用包含甲硫氨酸、甘露糖醇和海藻糖的冷冻保护剂处理外排体并冻干之后,检查其外观。作为结果,可以看出,外排体为乳白色,并显示出维持多孔海绵形状的良好外观(图3)。即,根据本发明的用于使外排体冻干的方法能够通过延长真空下的干燥时间并使用具有甲硫氨酸、甘露糖醇和海藻糖的组合的冷冻保护剂来产生具有良好外观的冻干产品。
实施例5-2:取决于冷冻保护剂组分的冻干外排体的外观比较
同时,对使用包含甲硫氨酸、甘露糖醇和海藻糖(在下文中,称为冷冻保护剂组分)中的至少一种的多种冷冻保护剂冻干的外排体的外观进行比较。根据以上实施例5-1中描述的方法,通过添加单独的冷冻保护剂组分、两种组分的组合或三种组分的组合来制备七种不同的水溶液。将每种水溶液中每种冷冻保护剂组分的浓度调节至9mg/ml。根据以上实施例5-1中描述的冻干条件和方法,将以上实施例2中制备的外排体(5×108个颗粒)与分别包含每种单独的冷冻保护剂组分、两种组分的组合中的每一种或三种组分的组合的水溶液混合,并随后冻干。
对冻干外排体产品的外部外观拍照并进行评价(图4a至4g)。根据冻干外排体产品的蛋糕状形状的状态,对冻干外排体产品的外观进行排序,并以1(最差的蛋糕状外观)至5(最佳的蛋糕状外观)的5分制标尺进行相对评价。下表2示出了根据冷冻保护剂组分的组合,评价冻干外排体产品的外观的结果。
表2:根据冷冻保护剂组分的组合,对冻干外排体产品的外观的比较
如图4a至4g以及上表2中所示,可以看出,通过使用具有甲硫氨酸、甘露糖醇和海藻糖的组合的冷冻保护剂使外排体冻干而获得的产品具有最佳的外部外观,然而,通过使用一种组分或两种组分的组合使外排体冻干获得的产品的外部外观差于本发明产品的外部外观。
实施例6:降低炎性细胞因子产生的作用的评价
如下评价干细胞来源外排体(实施例2)和干细胞来源外排体的冻干制剂(实施例5-1)对降低小鼠巨噬细胞raw264.7细胞中炎性细胞因子产生的作用。
将raw264.7细胞悬浮于包含10%fbs(fetalbovineserum,胎牛血清)和1%青霉素-链霉素的dmem(杜氏改良eagle培养基;购自thermofisherscientific)中,并随后将其以2.5×104个细胞/孔的密度接种到96孔板中。接下来,将细胞用不同浓度(表示为颗粒数目/ml)的实施例2中制备的干细胞来源外排体(从干细胞的条件培养基中分离和纯化的外排体)处理,并随后在37℃、5%co2下于培养箱中培养24小时。另外,以与用干细胞来源外排体进行处理的上述方法相同的方式,将raw264.7细胞用通过将实施例5-1的干细胞来源外排体的冻干制剂(5×109个颗粒/小瓶)与培养基混合而获得和稀释的水溶液处理,并随后将经处理的raw264.7细胞在37℃、5%co2下于培养箱中培养24小时。同时,作为阳性对照,使用地塞米松(在图5至12中表示为dex)。
之后,将raw264.7细胞用100ng/ml的lps(购自sigma)处理,并在37℃、5%co2下于培养箱中培养24小时,从而诱导细胞的活化。
在培养完成之后,收集raw264.7细胞的培养上清液,并使用基于legendplextm珠的免疫测定(购自biolegend)之小鼠炎症组以及novocyte流式细胞仪(购自acea)测量培养上清液中il-β、il-6、il-27和ifn-β的产生以评价抗炎作用。
另外,进行mtt测定以分别测量由本发明的干细胞来源外排体和抗炎组合物引起的细胞生存力的变化,并使通过其的细胞因子产生归一化。在培养完成之后,用包含0.5mg/ml的噻唑蓝溴化四唑(thiazolylbluetetrazoliumbromide)(购自sigma)的dmem培养基更换raw264.7细胞的培养基,并培养1小时。接下来,以这样的方式除去上清液:在细胞培养板底部形成的甲瓒不分散。随后,将甲瓒通过二甲亚砜(购自amresco)溶解,并在570nm下测量吸光度以确定细胞生存力。另外,通过细胞生存力使每种细胞因子(il-β、il-6、il-27和ifn-β)的产生归一化。
如图5至8中所示,从使用多重组对炎性细胞因子进行分析的结果中可以看出,当用干细胞来源外排体处理raw264.7细胞,然后用lps处理细胞时,il-β、il-6、il-27和ifn-β中的每一种的lps诱导的产生以依赖于外排体浓度的方式降低。另外,如图9至12中所示,从使用多重组对炎性细胞因子进行分析的结果可以看出,当用本发明的抗炎组合物处理raw264.7细胞,然后用lps处理细胞时,il-β、il-6、il-27和ifn-β中的每一种的lps诱导的产生以依赖于抗炎组合物浓度的方式显著降低。
从这些结果可以看出,根据本发明的抗炎组合物能够稳定地维持其中包含的作为活性成分的干细胞来源外排体的抗炎效力,并因此在冻干、储存和分配期间外排体的物理特性没有可能的变化。特别地,当对未冻干的干细胞来源外排体的抗炎效力(图5至8)与根据本发明一个实施方案的抗炎组合物的抗炎效力(图9至12)进行比较时,确定了浓度为2.0×109个颗粒/ml的未冻干的干细胞来源外排体不会抑制四种炎性细胞因子的产生或仅约40%抑制其产生,而根据本发明一个实施方案的抗炎组合物在2.5×109个颗粒/ml的浓度(其类似于未冻干的干细胞来源外排体的浓度)下约90%或更多地抑制四种炎性细胞因子的产生。因此,与未冻干的干细胞来源外排体相比,根据本发明的抗炎组合物能够使干细胞来源外排体稳定,这使得该组合物在商业上可用,并且表现出显著的抗炎作用。因此,根据本发明的抗炎组合物可用于预防、抑制、减轻、改善或治疗炎性疾病。
尽管已参照一些实施方案描述了本发明,但是本发明的范围不限于这些实施方案。本领域的任何技术人员将理解,在不脱离本发明的精神和范围的情况下可进行多种修改和改变,并且这些修改和改变也落入本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!