针对CD47的阻断抗体及其使用方法与流程
针对cd47的阻断抗体及其使用方法
1.相关申请的交叉引用
2.本申请要求于2018年6月15日提交的美国临时申请序列号62/685,594基于35u.s.c.
§
119(e)的权益,其全部内容通过引用并入此文。
背景技术:
3.cd47是一种多跨跨膜受体,是免疫球蛋白(ig)超家族的成员,作用是调节巨噬细胞和树突状细胞的吞噬作用。cd47在正常组织中广泛表达,但在许多类型的癌症的细胞表面高度表达,包括人类急性髓性白血病(aml)、非霍奇金淋巴瘤(non
‑
hodgkin's lymphoma,nhl)和实体瘤,例如小细胞肺癌(sclc)。基本上所有已知的人类癌症(包括实体瘤和白血病)都表达cd47,使cd47成为普遍的癌症治疗靶标。
4.癌细胞利用多种机制来逃避程序性细胞清除,例如,通过先天免疫细胞(包括巨噬细胞、树突状细胞和中性粒细胞)吞噬清除异常细胞。程序性细胞清除的抑制作用主要被关键分子cd47所抑制。cd47过表达代表癌细胞所采用的以逃避免疫监视的机制之一,并且与癌症的不良预后相关。
5.cd47与多种蛋白相互作用,包括顺式与整合素相互作用,以及反式与两个配体(血小板反应蛋白(thrombospondin
‑
1,tsp
‑
1)和信号调节蛋白α(sirpα))相互作用。sirpα编码ig超家族受体,sirpα的胞质区包含免疫受体酪氨酸抑制基序(immunoreceptor tyrosine
‑
based inhibition motif,itim),并在巨噬细胞、树突状细胞和神经元上表达。cd47与其在巨噬细胞上的受体sirpα的结合导致巨噬细胞活化的抑制和吞噬作用的抑制。先前的临床前研究表明,通过抗cd47阻断抗体或sirpα诱饵受体阻断cd47与其配体sirpα相互作用可以导致巨噬细胞吞噬作用增强和肿瘤生长降低。
技术实现要素:
6.本公开提供与人cd47蛋白具有一系列结合亲和力并且能够有效地阻断人cd47与其配体sirpα之间的相互作用的抗cd47抗体。同样重要的是,实施例表明这些抗cd47抗体增强了巨噬细胞吞噬癌细胞(如b淋巴瘤细胞)的吞噬活性。与已知的在体外环境可以诱导红细胞血凝的抗cd47抗体不同,这些抗体中的一些不诱导体外血凝。这些抗体在体内可以对人红细胞具有较低的副作用。这些抗cd47抗体可用于治疗目的,例如治疗各种类型的癌症以及感染,并且还可以用于诊断目的和预后目的。另一方面,可以诱导血凝的抗原结合片段可以用于制备将抗体递送至靶细胞内部的双特异性抗体或前药。
7.在一个实施方案中,本公开提供对人cd47(分化簇47)蛋白具有结合特异性的抗体或其片段,其中所述抗体或其片段可以与细胞上的cd47结合,阻断cd47与人信号调节蛋白α(sirpα)的结合,并且促进细胞的巨噬细胞吞噬作用。在一些实施方案中,所述抗体或其片段在体外不诱导血凝。在一些实施方案中,所述抗体或其片段在体外诱导血凝。
8.在另一个实施方案中,提供对人cd47(分化簇47)蛋白具有结合特异性的抗体或其片段,其中所述抗体或其片段包含轻链可变区和重链可变区,所述轻链可变区包含轻链互
补决定区cdrl1、cdrl2和cdrl3,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,其中cdrl1、cdrl2和cdrl3以及cdrh1、cdrh2和cdrh3独立地选自表a中的cdrl1、cdrl2和cdrl3组合以及cdrh1、cdrh2和cdrh3组合,其中表a中的cdrl1、cdrl2、cdrl3、cdrh1、cdrh2和cdrh3中的每一个可以包括一个、两个或三个氨基酸的添加、缺失、保守氨基酸取代或其组合。
9.在一些实施方案中,cdrl1、cdrl2和cdrl3以及cdrh1、cdrh2和cdrh3独立地选自表a中的cdrl1、cdrl2和cdrl3组合以及cdrh1、cdrh2和cdrh3组合。
10.同样地,在另一个实施方案中,提供对人cd47(分化簇47)蛋白具有结合特异性的抗体或其片段,其中所述抗体或其片段包含轻链可变区和重链可变区,所述轻链可变区包含轻链互补决定区cdrl1、cdrl2和cdrl3,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,其中:cdrl1包含tdiddd(seq id no:1)的氨基酸序列或具有seq id no:1的一个、两个或三个氨基酸取代的氨基酸序列,cdrl2包含egn(seq id no:2)的氨基酸序列或具有seq id no:2的一个或两个氨基酸取代的氨基酸序列,cdrl3包含lqsdnlpyt(seq id no:3)的氨基酸序列或具有seq id no:3的一个、两个或三个氨基酸取代的氨基酸序列,cdrh1包含gftftsyg(seq id no:4)的氨基酸序列或具有seq id no:4的一个、两个或三个氨基酸取代的氨基酸序列,cdrh2包含intggsyt(seq id no:5)的氨基酸序列或具有seq id no:5的一个、两个或三个氨基酸取代的氨基酸序列,并且cdrh3包含htikslmdy(seq id no:6)的氨基酸序列或具有seq id no:6的一个、两个或三个氨基酸取代的氨基酸序列。在一些实施方案中,cdrl1、cdrl2、cdrl3、cdrh1、cdrh2和cdrh3分别包含seq id no:1
‑
6的氨基酸序列。
11.在一些实施方案中,根据kabat编号,所述抗体或片段包含在第46位具有亮氨酸的轻链可变区。在一些实施方案中,所述抗体或片段包含轻链可变区和重链可变区,所述轻链可变区包含选自由seq id no:44和64
‑
69组成的组的氨基酸序列,所述重链可变区包含选自由seq id no:42和61
‑
63组成的组的氨基酸序列。在一些实施方案中,所述抗体或片段包含轻链可变区,所述轻链可变区包含选自由seq id no:40、44、48、52、56和60组成的组的氨基酸序列,或与选自由seq id no:40、44、48、52、56和60组成的组的氨基酸序列具有至少90%序列同一性的肽。
12.在一些实施方案中,所述抗体或片段包含重链可变区,所述重链可变区包含选自由seq id no:38、42、46、50、54和a22组成的组的氨基酸序列,或与选自由seq id no:38、42、46、50、54和a22组成的组的氨基酸序列具有至少90%序列同一性的肽。
13.本公开的另一个实施方案提供对人cd47(分化簇47)蛋白具有结合特异性的抗体或其片段,其中所述抗体或其片段包含轻链可变区和重链可变区,所述轻链可变区包含轻链互补决定区cdrl1、cdrl2和cdrl3,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,其中:cdrl1包含qslfksrtrkny(seq id no:13)的氨基酸序列或具有seq id no:13的一个、两个或三个氨基酸取代的氨基酸序列,cdrl2包含was(seq id no:14)的氨基酸序列或具有seq id no:14的一个或两个氨基酸取代的氨基酸序列,cdrl3包含kqsyyllt(seq id no:15)的氨基酸序列或具有seq id no:15的一个、两个或三个氨基酸取代的氨基酸序列,cdrh1包含gftfsryw(seq id no:16)的氨基酸序列或具有seq id no:16的一个、两个或三个氨基酸取代的氨基酸序列,cdrh2包含irlksdnyet(seq id no:17)的氨基酸序列或具
有seq id no:17的一个、两个或三个氨基酸取代的氨基酸序列,并且cdrh3包含ieeggyyvpfay(seq id no:18)的氨基酸序列或具有seq id no:18的一个、两个或三个氨基酸取代的氨基酸序列。
14.在一些实施方案中,cdrl1、cdrl2、cdrl3、cdrh1、cdrh2和cdrh3分别包含seq id no:13
‑
18的氨基酸序列。在一些实施方案中,所述抗体或片段包含轻链可变区和重链可变区,所述轻链可变区包含选自由seq id no:48和c04
‑
c05组成的组的氨基酸序列,所述重链可变区包含选自由seq id no:a10和c01
‑
c03组成的组的氨基酸序列。
15.在一些实施方案中,所述抗体或片段进一步对第二靶蛋白具有结合特异性。在一些实施方案中,所述第二靶蛋白选自由il
‑
1、cd3、cd16、cd19、cd28、cd64、pd
‑
1、pd
‑
l1、ctla
‑
4、lag
‑
3、cd28、cd122、4
‑
1bb、tim3、ox
‑
40、ox40l、cd40、cd40l、light、icos、icosl、gitr、gitrl、tigit、cd27、vista、b7h3、b7h4、hevm、btla和kir组成的组。
16.在一个实施方案中,还提供一种融合蛋白,其包含本公开的抗体或片段、阻断肽以及连接所述抗体或片段与所述阻断肽的肽接头,其中所述肽接头可以被肿瘤环境中表达的蛋白酶消化。在一些实施方案中,所述蛋白酶选自由mmp
‑
1、mmp
‑
2、mmp
‑
3、mmp
‑
8、mmp
‑
9、mmp
‑
14、upa、psa、psma、组织蛋白酶(cathepsin)d、组织蛋白酶k、组织蛋白酶s、adam10、adam12、adamts、caspase
‑
1、caspase
‑
2、caspase
‑
3、caspase
‑
4、caspase
‑
5、caspase
‑
6、caspase
‑
7、caspase
‑
8、caspase
‑
9、caspase10、caspase
‑
11、caspase
‑
12、caspase
‑
13、caspase
‑
14和tace组成的组。
17.还提供组合物。在一个实施方案中,所述组合物包含本公开的抗体或其片段或融合蛋白以及药学上可接受的载体。还提供一种分离细胞,其包含编码本公开的抗体或其片段或融合蛋白的一个或多个多核苷酸。
18.在一个实施方案中,本公开提供一种治疗有需要的患者的癌症或纤维化的方法,包括向所述患者施用本公开的抗体或其片段或融合蛋白。癌症的非限制性实例包括膀胱癌、肝癌、结肠癌、直肠癌、子宫内膜癌、白血病、淋巴瘤、胰腺癌、小细胞肺癌、非小细胞肺癌、乳腺癌、尿道癌、头颈癌、胃肠道癌、胃癌、食道癌、卵巢癌、肾癌、黑素瘤、前列腺癌和甲状腺癌。
19.然而在另一个实施方案中,提供一种检测样品中cd47蛋白表达的方法,包括在使抗体或其片段与cd47蛋白结合的条件下使样品与本公开的抗体或其片段接触,并且检测指示样品中cd47蛋白表达的结合。
附图说明
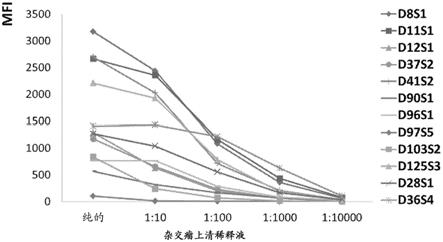
20.图1显示抗人cd47杂交瘤上清液与表达人cd47的cho细胞结合。
21.图2显示抗人cd47抗体与板结合的人cd47结合。96孔elisa板用pbs中1μg/ml的人cd47ecd hufc蛋白包被。
22.图3a和3b显示抗cd47抗体与乳腺癌细胞系mda
‑
mb 231的结合。
23.图4显示sirpα与cho细胞表面的cd47结合的阻断。0.2μg/ml的sirpαhufc蛋白用于试验。
24.图5a和5b显示抗人cd47阻断sirpα与板结合的人cd47结合。a)用1μg/ml的人cd47 ecd hf标签蛋白包被elisa板,并以1μg/ml加入可溶性人sirpαecd hufc。b)elisa结果的
ic50计算。
25.图6a和6b显示通过抗cd47嵌合抗体阻断sirpα与cho细胞上表达的cd47的结合。a)以4μg/ml使用sirpαfitc。b)试验结果的ic50计算。
26.图7显示抗人cd47与食蟹猴cd47的交叉反应性。
27.图8显示抗人cd47与小鼠cd47的交叉反应性。
28.图9a
‑
b显示,使用人全血,大多数小鼠抗cd47杂交瘤抗体不引起红细胞凝集,而d36s4、d90s1、d96s1和d89s4引起血凝。
29.图9c
‑
d显示,使用纯化的人红细胞,大多数小鼠抗cd47杂交瘤抗体不引起红细胞凝集,而d36s4、d90s1、d96s1和d89s4引起中度凝集。
30.图10a
‑
c显示,小鼠/人嵌合抗cd47抗体增强人b淋巴瘤raji细胞的巨噬细胞吞噬作用,其中d8s1、d28s1、d36s4和d96s1显示出与ab6.12相似或更好的吞噬活性。
31.图11显示,使用纯化的人红细胞,大多数小鼠/人嵌合抗cd47抗体不引起红细胞血凝,而仅d36s4引起中度血凝。
32.图12显示在facs分析中通过人源化的d36s4抗体阻断sirpα与cho细胞上的人cd47结合。以5μg/ml使用sirp fitc。
33.图13显示在elisa中通过人源化的d36s4抗体阻断sirpα与板结合的人cd47结合。用1μg/ml人cd47 ecd hf标签蛋白包被elisa板,并以1μg/ml添加可溶性人sirpαecd mufc。
具体实施方式
34.定义
35.应当注意,术语“一个”或“一种”实体是指该实体中的一个(种)或多个(种);例如,“一种抗体”应理解为表示一种或多种抗体。这样,术语“一个”(或“一种”)、“一个(种)或多个(种)”和“至少一个(种)”在本文中可以互换使用。
36.如本文所用,术语“多肽”旨在涵盖单数“多肽”以及复数“多肽”,并且是指由通过酰胺键(也称为肽键)线性连接的单体(氨基酸)组成的分子。术语“多肽”是指两个或更多个氨基酸的任何一条或多条链,并不指特定长度的产物。因此,“多肽”的定义中包括肽、二肽、三肽、寡肽、“蛋白质”、“氨基酸链”或用于指代两个或多个氨基酸的一条或多条链的任何其他术语,并且术语“多肽”可以代替任何这些术语使用,或与这些术语中的任何术语互换使用。术语“多肽”还旨在指多肽的表达后修饰的产物,包括但不限于糖基化、乙酰化、磷酸化、酰胺化、通过已知的保护/封闭基团衍生化、蛋白水解切割或通过非天然存在的氨基酸进行的修饰。多肽可以源自天然生物来源或通过重组技术产生,但不一定从指定的核酸序列翻译而来。它可以以任何方式产生,包括通过化学合成产生。
37.如本文关于细胞、核酸(如dna或rna)所使用的术语“分离的”是指从其他dna或rna中分离出来的分子,其存在于大分子的天然来源中。如本文所用,术语“分离的”还指当通过重组dna技术生产时基本不含细胞物质、病毒物质或培养基的核酸或肽,或当化学合成时基本不含化学前体或其他化学物质的核酸或肽。此外,“分离的核酸”是指包括不作为片段天然存在并且不会以天然状态被发现的核酸片段。术语“分离的”在本文中还用于指从其他细胞蛋白或组织分离的细胞或多肽。分离的多肽意在涵盖纯化的和重组的多肽。
38.如本文所用,关于多肽或多核苷酸的术语“重组”意指多肽或多核苷酸的一种非天
然存在的形式,其非限制性实例可以通过将通常不会一起存在的多核苷酸或多肽组合来产生。
[0039]“同源性”或“同一性”或“相似性”是指两条肽之间或两个核酸分子之间的序列相似性。同源性可以通过比较每个序列中的位置来确定,所述位置可以为了比较的目的而被比对。当比较序列中的一个位置被相同的碱基或氨基酸占据时,则在该位置分子是同源的。序列之间的同源性程度是序列共享的匹配位置或同源位置数量的函数。“不相关的”或“非同源的”序列与本公开的序列之一共享小于40%的同一性,但优选小于25%的同一性。
[0040]
多核苷酸或多核苷酸区(或多肽或多肽区)具有与另一个序列一定百分比(例如60%、65%、70%、75%、80%、85%、90%、95%、98%或99%)的“序列同一性”是指,当比对时,在比较两个序列时碱基(或氨基酸)相同的百分比。可以使用本领域已知的软件程序,例如在ausubel等编辑,(2007)current protocols in molecular biology中描述的那些软件程序,来确定这种比对和百分比同源性或序列同一性。优选地,使用默认参数用于比对。一种比对程序是blast,使用默认参数。
[0041]
术语“等效核酸或等效多核苷酸”是指具有与核酸或其互补物的核苷酸序列具有一定程度的同源性或序列同一性的核苷酸序列的核酸。双链核酸的同源物旨在包括具有与其或其互补物具有一定程度同源性的核苷酸序列的核酸。一方面,核酸的同源物能够与核酸或其互补物杂交。同样地,“等效多肽”是指与参考多肽的氨基酸序列具有一定程度的同源性或序列同一性的多肽。在一些方面,序列同一性为至少约70%、75%、80%、85%、90%、95%、98%或99%。在一些方面,与参考多肽或多核苷酸相比,等效多肽或等效多核苷酸具有1、2、3、4或5个添加、缺失、取代及其组合。在一些方面,等效序列保留参考序列的活性(例如,与表位结合)或结构(例如,盐桥)。
[0042]
杂交反应可以在不同“严格度(stringency)”的条件下进行。通常,低严格度杂交(low stringency hybridization)反应在约40℃下在约10
×
ssc中或在等离子强度/温度的溶液中进行。中度严格度杂交(moderate stringency hybridization)通常在约50℃下在约6
×
ssc中进行,高严格度杂交(high stringency hybridization)反应通常在约60℃下在约1
×
ssc中进行。杂交反应也可以在本领域技术人员熟知的“生理条件”下进行。生理条件的非限制性实例是通常在细胞中发现的温度、离子强度、ph和mg
2+
浓度。
[0043]
多核苷酸由四种核苷酸碱基的特定序列构成:腺嘌呤(a);胞嘧啶(c);鸟嘌呤(g);胸腺嘧啶(t);以及当多核苷酸为rna时,对应胸腺嘧啶的尿嘧啶(u)。因此,术语“多核苷酸序列”是多核苷酸分子的字母表示。可以将该字母表示输入到具有中央处理单元的计算机中的数据库中,并用于生物信息学应用,例如功能基因组学和同源性搜索。术语“多态性”是指一种以上形式的基因或其部分的共存。基因的存在至少两种不同形式(即两种不同核苷酸序列)的部分被称为“基因的多态区”。多态区可以是单个核苷酸,其同一性在不同的等位基因中不同。
[0044]
术语“多核苷酸”和“寡核苷酸”可互换使用,是指任何长度的核苷酸的聚合形式,或脱氧核糖核苷酸或核糖核苷酸或其类似物的聚合形式。多核苷酸可以具有任何三维结构,并且可以执行任何已知或未知的功能。以下是多核苷酸的非限制性实例:基因或基因片段(例如,探针、引物、est或sage标签)、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、核酶、cdna、dsrna、sirna、mirna、重组多核苷酸、分支多核苷酸、质粒、载体、任何序列
的分离dna、任何序列的分离rna、核酸探针和引物。多核苷酸可以包含修饰的核苷酸,例如甲基化的核苷酸和核苷酸类似物。如果存在,则可以在多核苷酸组装之前或之后赋予核苷酸结构修饰。核苷酸序列可以被非核苷酸组分打断。多核苷酸可以在聚合后进一步被修饰,例如通过与标记组分缀合。该术语还指双链和单链分子。除非另有说明或要求,否则本公开的任何实施方案(即多核苷酸)包括双链形式,以及包括已知或预测构成双链形式的两个互补单链形式的每一个。
[0045]
当应用于多核苷酸时,术语“编码”是指多核苷酸(如果被称为“编码”多肽),以其天然状态或当通过本领域技术人员公知的方法操作时,可以被转录和/或被翻译以产生该多肽和/或其片段的mrna。反义链是这种核酸的互补物,并且可以由此推断出编码序列。
[0046]
如本文所用,“抗体”或“抗原结合多肽”是指特异性识别并结合抗原的多肽或多肽复合物。抗体可以是完整抗体及其任何抗原结合片段或其单链。因此,术语“抗体”包括含有至少免疫球蛋白分子中具有与抗原结合的生物学活性的部分的分子的任何蛋白质或肽。这样的实例包括但不限于重链或轻链或其配体结合部分的互补决定区(cdr)、重链或轻链可变区、重链或轻链恒定区、框架(fr)区或其任何部分,或结合蛋白的至少一个部分。
[0047]
如本文所用的术语“抗体片段”或“抗原结合片段”是抗体的一部分,例如f(ab')2、f(ab)2、fab'、fab、fv、scfv等。无论结构如何,抗体片段都与被完整抗体识别的同一抗原结合。术语“抗体片段”包括适配体(aptamer)、镜像异构体(spiegelmer)和双体(diabody)。术语“抗体片段”还包括通过像抗体一样与特定抗原结合形成复合物而起作用的任何合成的或基因工程的蛋白。
[0048]“单链可变片段”或“scfv”是指免疫球蛋白的重链(v
h
)和轻链(v
l
)的可变区的融合蛋白。在一些方面,所述区用10至约25个氨基酸的短接头肽连接。接头可以富含甘氨酸以提高柔性,并富含丝氨酸或苏氨酸以提高溶解度,并且可以将v
h
的n
‑
末端与v
l
的c
‑
末端相连,反之亦然。尽管去除了恒定区并引入了接头,但该蛋白仍保留了原始免疫球蛋白的特异性。scfv分子是本领域已知的,并且在例如美国专利5,892,019中被描述。
[0049]
术语抗体涵盖了各种广泛类别的多肽,其可从生物化学上被区分。本领域技术人员将理解,重链被分类为gamma、mu、alpha、delta或epsilon(γ、μ、α、δ或ε),其中有一些子类(例如γl
‑
γ4)。该链的性质决定了抗体的“类别”分别为igg、igm、iga、igg或ige。免疫球蛋白亚类(同种型),例如igg1、igg2、igg3、igg4、igg5等,已被很好地表征,并且已知具有功能特异性。鉴于本公开,这些类别和同种型的每一个的修饰形式对于本领域技术人员而言是容易辨别的,并且因此在本公开的范围内。所有的免疫球蛋白类别显然都在本公开的范围内,下面的讨论通常将针对免疫球蛋白分子的igg类别。关于igg,标准免疫球蛋白分子包含两个相同的分子量约为23,000道尔顿的轻链多肽和两个相同的分子量为53,000
‑
70,000的重链多肽。四条链通常通过二硫键以“y”构型连接,其中轻链将重链括起来,从“y”口开始,一直延伸到可变区。
[0050]
本公开的抗体、抗原结合多肽、其变体或衍生物包括但不限于多克隆、单克隆、多特异性、人类、人源化、灵长类化(primatized)或嵌合的抗体、单链抗体、表位结合片段,例如fab、fab'和f(ab')2、fd、fv、单链fv(scfv)、单链抗体、二硫键连接的fv(sdfv)、包含vk或vh结构域的片段、由fab表达文库产生的片段和抗独特型(anti
‑
idiotypic)(抗
‑
id)抗体(包括例如本文公开的针对light抗体的抗
‑
id抗体)。本公开的免疫球蛋白或抗体分子可以
是任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如,igg1、igg2、igg3、igg4、iga1和iga2)或亚类的免疫球蛋白分子。
[0051]
轻链分为kappa或lambda(κ,λ)。每个重链类别都可以与κ或λ轻链结合。通常,当免疫球蛋白由杂交瘤、b细胞或基因工程宿主细胞产生时,轻链和重链彼此共价键合,两条重链的“尾”部分通过共价二硫键或非共价键彼此键合。在重链中,氨基酸序列从y构型的分叉末端的n
‑
末端延伸到每条链底部的c
‑
末端。
[0052]
轻链和重链均分为结构和功能同源区。术语“恒定”和“可变”在功能上使用。在这方面,应当理解,轻链部分的可变结构域(vk)和重链部分的可变结构域(vh)决定了抗原的识别和特异性。相反地,轻链的恒定结构域(ck)和重链的恒定结构域(ch1、ch2或ch3)赋予重要的生物学特性,如分泌、经胎盘移动性(transplacental mobility)、fc受体结合、互补物结合等。按照惯例,恒定区结构域的编号随着它们变得更远离抗体的抗原结合位点或氨基末端而增加。n
‑
末端部分是可变区,c
‑
末端部分是恒定区;ch3和ck结构域实际上分别包含重链和轻链的羧基末端。
[0053]
如上所述,可变区允许抗体选择性识别并特异性结合抗原上的表位。即,抗体的vk结构域和vh结构域或互补决定区(cdr)的子集结合形成定义三维抗原结合位点的可变区。这种四级抗体结构形成了存在于y的各臂末端的抗原结合位点。更具体地说,抗原结合位点由vh和vk链各自上的三个cdr定义(即cdr
‑
h1、cdr
‑
h2、cdr
‑
h3、cdr
‑
l1、cdr
‑
l2和cdr
‑
l3)。在某些情况下,例如某些源自骆驼科物种或基于骆驼科免疫球蛋白工程改造的免疫球蛋白分子,完整的免疫球蛋白分子可以仅由重链组成,而没有轻链。参见,例如,hamers
‑
casterman等,nature 363:446
‑
448(1993)。
[0054]
在天然存在的抗体中,在每个抗原结合结构域中所存在的六个“互补决定区”或“cdr”是短的、非连续的氨基酸序列,所述氨基酸序列被特异性定位为当在水性环境中该抗体呈现出其三维构型时形成抗原结合结构域。抗原结合结构域中的其余氨基酸(称为“框架”区)显示出较小的分子间可变性。框架区主要采用β
‑
折叠结构,并且cdr形成环,该环连接β
‑
折叠结构,并在某些情况下形成β
‑
折叠结构的一部分。因此,框架区起形成支架的作用,该支架通过链间非共价相互作用将cdr定位在正确的方向上。由定位的cdr形成的抗原结合结构域限定了与免疫反应性抗原上的表位互补的表面。这种互补表面促进抗体与其同源表位的非共价结合。本领域的普通技术人员可以容易地针对任何给定的重链或轻链可变区鉴定包含cdr和框架区的氨基酸,因为它们已经被精确地定义(参见“sequences of proteins of immunological interest”,kabat,e.等,美国卫生与公共服务部(u.s.department of health and human services),(1983);以及chothia和lesk,j.moi.biol.,196:901
‑
917(1987))。
[0055]
在本领域内使用和/或接受的术语有两个或更多个定义的情况下,除非另有明确说明,否则如本文所用术语的定义旨在包括所有这些含义。一个具体实例是使用术语“互补决定区”(“cdr”)来描述在重链和轻链多肽的可变区内均发现的非连续抗原结合位点。这种特定区已经由kabat等,美国卫生与公共服务部(u.s.dept.of health and human services),“sequences of proteins of immunological interest”(1983)和chothia等,j.moi.biol.196:901
‑
917(1987)描述,通过引用将其整体并入本文。当彼此比较时,根据kabat和chothia的cdr定义包括氨基酸残基的重叠或子集。然而,任何一种定义用于指代抗
体或其变体的cdr都意图在本文所定义和使用的术语的范围内。作为比较,下表中列出了涵盖如上述引用的参考文献的每个所定义的cdr的合适氨基酸残基。涵盖特定cdr的确切残基数将根据cdr的序列和大小而变化。给定了抗体的可变区氨基酸序列,本领域技术人员可以常规地确定哪些残基包含特定cdr。
[0056] kabatchothiacdr
‑
h131
‑
3526
‑
32cdr
‑
h250
‑
6552
‑
58cdr
‑
h395
‑
10295
‑
102cdr
‑
l124
‑
3426
‑
32cdr
‑
l250
‑
5650
‑
52cdr
‑
l389
‑
9791
‑
96
[0057]
kabat等还定义了适用于任何抗体的可变结构域序列的编号系统。一个本领域普通技术人员可以明确地将这种“kabat编号”系统分配给任何可变结构域序列,而不依赖序列本身以外的任何实验数据。如本文所用,“kabat编号”是指由kabat等,美国卫生和公共服务部(u.s.dept.of health and human services),“sequence of proteins of immunological interest”(1983)中所示的编号系统。
[0058]
除上表外,kabat编号系统还如下描述了cdr区:cdr
‑
h1在大约第31位氨基酸处开始(即大约在第一个半胱氨酸残基之后9个残基),包括大约5
‑
7个氨基酸,并在下一个色氨酸残基处终止。cdr
‑
h2在cdr
‑
h1末端之后的第15个残基处开始,包含约16
‑
19个氨基酸,并在下一个精氨酸或赖氨酸残基处终止。cdr
‑
h3在cdr
‑
h2末端后大约第33个氨基酸残基处开始;包括3
‑
25个氨基酸;并在序列w
‑
g
‑
x
‑
g处终止,其中x是任意氨基酸。cdr
‑
l1在大约第24位残基处开始(即在半胱氨酸残基之后);包括大约10
‑
17个残基;并在下一个色氨酸残基处终止。cdr
‑
l2在cdr
‑
l1末端之后大约第16个残基处开始,包括大约7个残基。cdr
‑
l3在cdr
‑
l2末端之后大约第33个残基处(即在半胱氨酸残基之后)开始;包括大约7
‑
11个残基,并在序列f或w
‑
g
‑
x
‑
g处终止,其中x是任意氨基酸。
[0059]
本文公开的抗体可以来自任何动物来源,包括鸟类和哺乳动物。优选地,抗体是人、鼠、驴、兔、山羊、豚鼠、骆驼、美洲驼、马或鸡的抗体。在另一个实施方案中,可变区的起源可以是condricthoid(例如来自鲨鱼)。
[0060]
如本文所用,术语“重链恒定区”包括衍生自免疫球蛋白重链的氨基酸序列。包含重链恒定区的多肽包含至少一个:ch1结构域、铰链(例如,上、中和/或下铰链区)结构域、ch2结构域、ch3结构域或其变体或片段。例如,用于本公开的抗原结合多肽可以包括包含ch1结构域的多肽链;包含ch1结构域、铰链结构域的至少一部分和ch2结构域的多肽链;包含ch1结构域和ch3结构域的多肽链;包含ch1结构域、铰链结构域的至少一部分和ch3结构域的多肽链,或包含ch1结构域、铰链结构域的至少一部分、ch2结构域和ch3结构域的多肽链。在另一个实施方案中,本公开的多肽包括包含ch3结构域的多肽链。进一步地,用于本公开的抗体可以缺少ch2结构域的至少一部分(例如,ch2结构域的全部或部分)。如上所述,本领域普通技术人员将理解,可以修饰重链恒定区,使得它们在氨基酸序列上与天然存在的免疫球蛋白分子不同。
[0061]
本文公开的抗体的重链恒定区可以衍生自不同的免疫球蛋白分子。例如,多肽的
重链恒定区可以包含衍生自igg1分子的ch1结构域和衍生自igg3分子的铰链区。在另一个实例中,重链恒定区可以包含部分衍生自igg1分子且部分衍生自igg3分子的铰链区。在另一个实例中,重链部分可以包含部分衍生自igg1分子且部分衍生自igg4分子的嵌合铰链。
[0062]
如本文所用,术语“轻链恒定区”包括衍生自抗体轻链的氨基酸序列。优选地,轻链恒定区包括恒定κ结构域或恒定λ结构域中的至少一个。
[0063]“轻链
‑
重链对(light chain
‑
heavy chain pair)”是指轻链和重链的集合,其可以通过轻链的cl结构域和重链的ch1结构域之间的二硫键形成二聚体。
[0064]
如前所述,各种免疫球蛋白类别的恒定区的亚基结构和三维构型是公知的。如本文所用,术语“vh结构域”包括免疫球蛋白重链的氨基末端可变结构域,术语“ch1结构域”包括免疫球蛋白重链的第一(最氨基末端)恒定区结构域。ch1结构域与vh结构域相邻,并且在免疫球蛋白重链分子的铰链区的氨基末端。
[0065]
如本文所用,术语“ch2结构域”包括重链分子的例如从抗体的约第244位残基延伸至第360位残基(使用常规编号方案)(第244至360位残基,kabat编号系统;和第231
‑
340位残基,eu编号系统;请参见kabat等,美国卫生与公共服务部,“sequences of proteins of immunological interest”(1983))的部分。ch2结构域的独特之处在于它不与另一个结构域紧密配对。而是,两个n
‑
连接的分支碳水化合物链插入完整的天然igg分子的两个ch2结构域之间。还充分证明,ch3结构域从ch2结构域延伸至igg分子的c
‑
末端,并包含约108个残基。
[0066]
如本文所用,术语“铰链区”包括重链分子的连接ch1结构域和ch2结构域的部分。该铰链区包含约25个残基并且是柔性的,因此允许两个n
‑
末端抗原结合区独立移动。铰链区可细分为三个不同的结构域:上、中、下铰链结构域(roux等,j.immunol 161:4083(1998))。
[0067]
如本文所用,术语“二硫键”包括在两个硫原子之间形成的共价键。氨基酸半胱氨酸包含可以与第二个巯基形成二硫键或桥连的巯基。在大多数天然存在的igg分子中,ch1和ck区通过二硫键连接,并且两个重链通过两个在对应于第239和242位(使用kabat编号系统)(第226或229位,eu编号系统)的二硫键连接。
[0068]
如本文所用,术语“嵌合抗体”将被保持为意指其中免疫反应性区或免疫反应性位点获自或衍生自第一物种并且恒定区(根据本公开,其可以是完整的、部分的或修饰的)获自第二物种的任何抗体。在某些实施方案中,靶结合区或靶结合位点将来自非人类来源(例如小鼠或灵长类),并且恒定区是人类的。
[0069]
如本文所用,通过确定人源化结构域和种系结构域之间的框架氨基酸差异(即非cdr差异)的数目,从氨基酸总数中减去该数目,然后将该数目除以氨基酸总数并乘以100来计算“百分比人源化”。
[0070]“特异性结合”或“对
……
具有特异性”通常是指抗体通过其抗原结合结构域与表位结合,并且所述结合需要在抗原结合结构域和表位之间具有一定的互补性。根据该定义,当抗体通过其抗原结合结构域与表位结合比抗体与随机的、不相关的表位结合更容易时,抗体被称为与表位“特异性结合”。术语“特异性”在本文中用于限定某种抗体与某种表位结合的相对亲和力。例如,可以认为抗体“a”对给定的表位具有比抗体“b”更高的特异性,或者可以说抗体“a”以比对相关表位“d”更高的特异性结合表位“c”。
[0071]
如本文所用,术语“治疗”(“treat”或“treatment”)是指治疗性治疗和预防性(prophylactic或preventative)措施,其中目的是预防或减缓(减轻)不期望的生理变化或疾病,例如癌症的进展。有益的或期望的临床结果包括但不限于无论是可检测的还是不可检测的症状缓解、疾病程度减轻、疾病状态稳定(即不恶化)、疾病进展延迟或减慢、疾病状态改善或减轻,以及缓解(无论是部分还是全部)。“治疗”还可能意味着与如果未接受治疗所预期的生存期相比,生存期延长。需要治疗的那些受试者包括已经患有病症或疾病的那些受试者以及那些易于患病症或疾病的那些受试者或要预防病症或疾病的那些受试者。
[0072]“受试者”或“个体”或“动物”或“患者”或“哺乳动物”是指需要诊断、预后或治疗的任何受试者,特别是哺乳动物受试者。哺乳动物受试者包括人类、家畜、农场动物以及动物园动物、运动动物或宠物,例如狗、猫、豚鼠、兔子、大鼠、小鼠、马、家牛、奶牛等。
[0073]
如本文所用,短语例如“需要治疗的患者”或“需要治疗的受试者”包括将从施用本公开所使用的抗体或组合物例如以用于检测、用于诊断程序和/或用于治疗而受益的受试者,例如哺乳动物受试者。
[0074]
抗cd47抗体
[0075]
许多肿瘤细胞过表达cd47,以逃避宿主免疫系统的免疫监视(immunosurveilance)。cd47与其受体信号调节蛋白α(sirpα)结合并下调肿瘤细胞的吞噬作用。因此,抗cd47疗法旨在恢复对肿瘤细胞的清除。许多治疗剂正在开发中,包括抗cd47抗体、工程诱饵受体、抗sirpα抗体和双特异性试剂。
[0076]
然而,如上所述,cd47蛋白也在正常细胞上表达。因此,过于广泛地靶向cd47可能会引起不期望的副作用。进一步地,还观察到一些已知的抗cd47抗体在体外诱导红细胞血凝。
[0077]
根据本公开的一个实施方案,提供与人cd47蛋白特异性结合的抗体及其片段。在一个实施方案中,以d28s1及其嵌合的人源化对应物为代表,抗体及其片段可以以相对较高的亲和力与细胞表面cd47蛋白结合,并以较高的抑制效率阻断cd47蛋白与人信号调节蛋白α(sirp)的结合。
[0078]
在一些实施方案中,抗体或片段可以以0.09μg/ml至1.94μg/ml的ic50的抑制效率来阻断cd47蛋白与人sirpα的结合。
[0079]
在一些实施方案中,抗体或片段在体外或体内不诱导血凝。在一些实施方案中,使用人全血或纯化的人红细胞在血凝试验中测量血凝的诱导。
[0080]
还就其cdr序列描述了本公开的抗体和片段。在一个实施方案中,提供对人cd47蛋白具有结合特异性的抗体或其片段,其中所述抗体或其片段包含轻链可变区和重链可变区,所述轻链可变区包含轻链互补决定区cdrl1、cdrl2和cdrl3,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,其中cdrl1、cdrl2和cdrl3组合以及cdrh1、cdrh2和cdrh3组合可以独立地选自表a。
[0081]
表a.抗cd47抗体的cdr组合
[0082][0083]
容易理解,可以对一个或多个cdr序列进行某些修饰(例如,一个、两个或三个氨基酸的添加、缺失、保守氨基酸取代),同时保留抗体或片段的结合活性。在一些实施方案中,修饰是一个、两个或三个残基的氨基酸取代。
[0084]
在一些实施方案中,修饰是在每个cdr的不超过一个热点位置处的取代。在一些实施方案中,修饰是在一个、两个或三个这样的热点位置处的取代。在一个实施方案中,修饰是在一个热点位置处的取代。在一些实施方案中,这样的取代是保守取代。
[0085]“保守氨基酸取代”是其中氨基酸残基被具有相似侧链的氨基酸残基替代的取代。具有相似侧链的氨基酸残基家族已在本领域中被定义,包括碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,免疫球蛋白多肽中的非必需氨基酸残基优选被来自相同侧链家族的另一个氨基酸残基替代。在另一个实施方案中,一串氨基酸可以被侧链家族成员的顺序和/或组成不同但结构上相似的串替代。
[0086]
下表中提供了保守氨基酸取代的非限制性实例,其中相似性得分为0或更高表明两个氨基酸之间的保守取代。
[0087]
氨基酸相似性矩阵
[0088] cgpsatdenqhkrvmilfyww
‑8‑7‑6‑2‑6‑5‑7‑7‑4‑5‑3‑
32
‑6‑4‑5‑
20017y0
‑5‑5‑3‑3‑3‑4‑4‑2‑
40
‑4‑5‑2‑2‑1‑
1710 f
‑4‑5‑5‑3‑4‑3‑6‑5‑4‑5‑2‑5‑4‑
10129
ꢀꢀ
l
‑6‑4‑3‑3‑2‑2‑4‑3‑3‑2‑2‑3‑
32426
ꢀꢀꢀ
i
‑2‑3‑2‑1‑
10
‑2‑2‑2‑2‑2‑2‑
2425
ꢀꢀꢀꢀ
m
‑5‑3‑2‑2‑1‑1‑3‑
20
‑1‑
20026
ꢀꢀꢀꢀꢀ
v
‑2‑1‑1‑
100
‑2‑2‑2‑2‑2‑2‑
24
ꢀꢀꢀꢀꢀꢀ
r
‑4‑
300
‑2‑1‑1‑
101236
ꢀꢀꢀꢀꢀꢀꢀ
k
‑5‑2‑
10
‑
10001105
ꢀꢀꢀꢀꢀꢀꢀꢀ
h
‑3‑
20
‑1‑1‑
111236
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
q
‑5‑
10
‑
10
‑
12214
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n
‑
40
‑
1100212
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
e
‑
50
‑
100034
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
d
‑
51
‑
10004
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
t
‑
200113
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
a
‑
21112
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
s0111
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
p
‑3‑
16
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
g
‑
35
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
c12
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[0089]
保守氨基酸取代
[0090][0091][0092]
特定示例性抗体包括具有seq id no:38、42、46、50、54和a22的重链序列和/或具有seq id no:40、44、48、52、56和60的轻链序列的那些抗体,以及它们各自的生物学变体。
[0093]
在一个实施方案中,所述抗体或其片段包含轻链可变区和重链可变区,所述轻链可变区包含轻链互补决定区cdrl1、cdrl2和cdrl3,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,其中cdrl1包含tdiddd(seq id no:1)的氨基酸序列或具有seq id no:1的一个、两个或三个氨基酸取代的氨基酸序列,cdrl2包含egn(seq id no:2)的氨基酸序列或具有seq id no:2的一个或两个氨基酸取代的氨基酸序列,cdrl3包含lqsdnlpyt(seq id no:3)的氨基酸序列或具有seq id no:3的一个、两个或三个氨基酸取代的氨基酸序列,cdrh1包含gftftsyg(seq id no:4)的氨基酸序列或具有seq id no:4的一个、两个或三个氨基酸取代的氨基酸序列,cdrh2包含intggsyt(seq id no:5)的氨基酸序列或具有seq id no:5的一个、两个或三个氨基酸取代的氨基酸序列,以及cdrh3包含htikslmdy(seq id no:6)的氨基酸序列或具有seq id no:6的一个、两个或三个氨基酸取代的氨基酸序列。
[0094]
本公开的抗体和片段可以是小鼠抗体或片段、嵌合抗体或片段或人源化抗体或片段。对于人源化抗体和片段,例如,可以引入小鼠对应物的某些回复突变(back mutation)。
[0095]
表4中显示了示例性回复突变,可用于保留抗cd47抗体的某些特征。因此,在一些实施方案中,本公开的抗cd47抗体或其片段包括一个或多个回复突变。在一些实施方案中,重链中的回复突变可以是30t、49a或44r中的一种或多种。在一个实施方案中,重链中的回复突变包括30t和49a。
[0096]
在一些实施方案中,轻链中的回复突变可以是46l、58v、47l、49s、20t和22r中的一种或多种。在一个实施方案中,轻链中的回复突变包括46l。在一个实施方案中,轻链中的回复突变包括46l和58v。在一个实施方案中,轻链中的回复突变包括46l和47l。在一个实施方案中,轻链中的回复突变包括46l、47l和49s。在一个实施方案中,轻链中的回复突变包括46l、20t和22r。
[0097]
在一些实施方案中,本公开的抗cd47抗体包括seq id no:42和61
‑
63中任一个的vh,seq id no:44和64
‑
69中任一个的vl或它们各自的生物学等效物。vh或vl的生物学等效物是包括指定氨基酸,同时具有总体80%、85%、90%、95%、98%或99%序列同一性的序列。例如,seq id no:61的生物学等效物可以是与seq id no:61具有总体80%、85%、90%、95%、98%或99%序列同一性,但保留cdr,并且任选保留一个或多个或全部回复突变的vh。
[0098]
在另一个实例中,在抗体或其片段中,cdrl1包含qslfksrtrkny(seq id no:13)的氨基酸序列,cdrl2包含was(seq id no:14)的氨基酸序列,cdrl3包含kqsyyllt(seq id no:15)的氨基酸序列,cdrh1包含gftfsryw(seq id no:16)的氨基酸序列,cdrh2包含irlksdnyet(seq id no:17)的氨基酸序列,cdrh3包含ieeggyyvpfay(seq id no:18)的氨基酸序列。
[0099]
本公开的抗体和片段可以是小鼠抗体或片段、嵌合抗体或片段或人源化抗体或片段。对于人源化抗体和片段,例如,可以引入小鼠对应物的某些回复突变。
[0100]
在表7中显示了这些抗体或片段的示例性回复突变,可用于保留抗cd47抗体的某些特征。在一些实施方案中,重链中的回复突变可以是99i、100e或49a中的一种或多种。在一个实施方案中,重链中的回复突变包括99i和100e。
[0101]
在一些实施方案中,本公开的抗cd47抗体包括seq id no:46和79
‑
81中任一个的vh,seq id no:48和82
‑
83中任一个的vl或它们各自的生物学等效物。vh或vl的生物学等效物是包括指定氨基酸,同时具有总体80%、85%、90%、95%、98%或99%序列同一性的序
列。例如,seq id no:c01的生物学等效物可以是与seq id no:79具有总体80%、85%、90%、95%、98%或99%序列同一性,但保留cdr,并且任选保留一个或多个或全部回复突变的vh。
[0102]
在一个实施方案中,抗体或其片段包含轻链可变区和重链可变区,所述轻链可变区包含轻链互补决定区cdrl1、cdrl2和cdrl3,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,其中cdrl1包含seq id no:7的氨基酸序列或具有seq id no:7的一个、两个或三个氨基酸取代的氨基酸序列,cdrl2包含seq id no:8的氨基酸序列或具有seq id no:8的一个或两个氨基酸取代的氨基酸序列,cdrl3包含seq id no:9的氨基酸序列或具有seq id no:9的一个、两个或三个氨基酸取代的氨基酸序列,cdrh1包含seq id no:10的氨基酸序列或具有seq id no:10的一个、两个或三个氨基酸取代的氨基酸序列,cdrh2包含seq id no:11的氨基酸序列或具有seq id no:11的一个、两个或三个氨基酸取代的氨基酸序列,并且cdrh3包含seq id no:12的氨基酸序列或具有seq id no:12的一个、两个或三个氨基酸取代的氨基酸序列。
[0103]
在一些实施方案中,本公开的抗cd47抗体包括seq id no:38和50的vh,seq id no:40或52的vl或它们各自的生物学等效物。vh或vl的生物学等效物是包括指定氨基酸,同时具有总体80%、85%、90%、95%、98%或99%序列同一性的序列。例如,seq id no:38的生物学等效物可以是与seq id no:38具有总体80%、85%、90%、95%、98%或99%序列同一性,但保留cdr,并且任选保留一个或多个回复突变的vh。
[0104]
在一个实施方案中,抗体或其片段包含轻链可变区和重链可变区,所述轻链可变区包含轻链互补决定区cdrl1、cdrl2和cdrl3,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,其中cdrl1包含seq id no:19的氨基酸序列或具有seq id no:19的一个、两个或三个氨基酸取代的氨基酸序列,cdrl2包含seq id no:20的氨基酸序列或具有seq id no:20的一个或两个氨基酸取代的氨基酸序列,cdrl3包含seq id no:21的氨基酸序列或具有seq id no:21的一个、两个或三个氨基酸取代的氨基酸序列,cdrh1包含seq id no:22的氨基酸序列或具有seq id no:22的一个、两个或三个氨基酸取代的氨基酸序列,cdrh2包含seq id no:23的氨基酸序列或具有seq id no:23的一个、两个或三个氨基酸取代的氨基酸序列,并且cdrh3包含seq id no:24的氨基酸序列或具有seq id no:24的一个、两个或三个氨基酸取代的氨基酸序列。
[0105]
在一些实施方案中,本公开的抗cd47抗体包括seq id no:38和50的vh,seq id no:40或52的vl或它们各自的生物学等效物。vh或vl的生物学等效物是包括指定氨基酸,同时具有总体80%、85%、90%、95%、98%或99%序列同一性的序列。例如,seq id no:38的生物学等效物可以是与seq id no:38具有总体80%、85%、90%、95%、98%或99%序列同一性,但保留cdr,并且任选保留一个或多个回复突变的vh。
[0106]
在一个实施方案中,抗体或其片段包含轻链可变区和重链可变区,所述轻链可变区包含轻链互补决定区cdrl1、cdrl2和cdrl3,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,其中cdrl1包含seq id no:25的氨基酸序列或具有seq id no:25的一个、两个或三个氨基酸取代的氨基酸序列,cdrl2包含seq id no:26的氨基酸序列或具有seq id no:26的一个或两个氨基酸取代的氨基酸序列,cdrl3包含seq id no:27的氨基酸序列或具有seq id no:27的一个、两个或三个氨基酸取代的氨基酸序列,cdrh1包含seq id no:28的
氨基酸序列或具有seq id no:28的一个、两个或三个氨基酸取代的氨基酸序列,cdrh2包含seq id no:29的氨基酸序列或具有seq id no:29的一个、两个或三个氨基酸取代的氨基酸序列,并且cdrh3包含seq id no:30的氨基酸序列或具有seq id no:30的一个、两个或三个氨基酸取代的氨基酸序列。
[0107]
在一些实施方案中,本公开的抗cd47抗体包括seq id no:54的vh,seq id no:56的vl或它们各自的生物学等效物。vh或vl的生物学等效物是包括指定氨基酸,同时具有总体80%、85%、90%、95%、98%或99%序列同一性的序列。例如,seq id no:54的生物学等效物可以是与seq id no:54具有总体80%、85%、90%、95%、98%或99%序列同一性,但保留cdr,并且任选保留一个或多个回复突变的vh。
[0108]
在一个实施方案中,抗体或其片段包含轻链可变区和重链可变区,所述轻链可变区包含轻链互补决定区cdrl1、cdrl2和cdrl3,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,其中cdrl1包含seq id no:31的氨基酸序列或具有seq id no:31的一个、两个或三个氨基酸取代的氨基酸序列,cdrl2包含seq id no:32的氨基酸序列或具有seq id no:32的一个或两个氨基酸取代的氨基酸序列,cdrl3包含seq id no:33的氨基酸序列或具有seq id no:33的一个、两个或三个氨基酸取代的氨基酸序列,cdrh1包含seq id no:34的氨基酸序列或具有seq id no:34的一个、两个或三个氨基酸取代的氨基酸序列,cdrh2包含seq id no:35的氨基酸序列或具有seq id no:35的一个、两个或三个氨基酸取代的氨基酸序列,并且cdrh3包含seq id no:36的氨基酸序列或具有seq id no:36的一个、两个或三个氨基酸取代的氨基酸序列。
[0109]
在一些实施方案中,本公开的抗cd47抗体包括seq id no:58的vh,seq id no:60的vl或它们各自的生物学等效物。vh或vl的生物学等效物是包括指定氨基酸,同时具有总体80%、85%、90%、95%、98%或99%序列同一性的序列。例如,seq id no:58的生物学等效物可以是与seq id no:58具有总体80%、85%、90%、95%、98%或99%序列同一性,但保留cdr,并且任选保留一个或多个回复突变的vh。
[0110]
本领域普通技术人员还将理解,本文公开的抗体可以被修饰,使得它们在氨基酸序列上与衍生它们的天然存在的结合多肽不同。例如,衍生自指定蛋白质的多肽或氨基酸序列可以与起始序列相似,例如与起始序列具有一定百分比的同一性,例如可以为与起始序列具有60%、70%、75%、80%、85%、90%、95%、98%或99%的同一性。
[0111]
在某些实施方案中,所述抗体包含通常不与抗体相关的氨基酸序列或一个或多个部分。下面将更详细地描述示例性修饰。例如,本公开的抗体可以包含柔性接头序列或可以被修饰以添加功能性部分(例如,peg、药物、毒素或标记物)。
[0112]
本公开的抗体、变体或其衍生物包括被修饰的衍生物,即通过任何类型的分子与抗体的共价连接而被修饰,使得共价连接不会阻止抗体与表位结合。例如但不限于,抗体可以例如通过糖基化、乙酰化、聚乙二醇化、磷酸化、磷酸化、酰胺化、通过已知的保护/封闭基团衍生化、蛋白水解切割、与细胞配体或其他蛋白质的连接等来修饰。可以通过已知技术进行多种化学修饰中的任何一种,所述已知技术包括但不限于特异性化学解裂、乙酰化、甲酰化、衣霉素的代谢合成等。另外,抗体可以包含一种或多种非经典氨基酸。
[0113]
在一些实施方案中,抗体可以与治疗剂、前药、肽、蛋白质、酶、病毒、脂质、生物反应修饰剂、药剂或peg缀合。
[0114]
抗体可以与治疗剂缀合或融合,所述治疗剂可以包括可检测的标记物,例如放射性标记物、免疫调节剂、激素、酶、寡核苷酸、光活性治疗剂或光活性诊断剂、细胞毒素剂(其可以是药物或毒素)、超声增强剂、非放射性标记、其组合以及本领域已知的其他此类试剂。
[0115]
可以通过将抗体与化学发光化合物偶联,从而对抗体进行可检测的标记。然后通过检测在化学反应过程中产生的发光的存在来确定带化学发光标签的抗原结合多肽的存在。特别有用的化学发光标记化合物的实例是鲁米诺、异鲁米诺、热性吖啶酯(theromatic acridinium ester)、咪唑、吖啶盐和草酸酯。
[0116]
还可以使用荧光发射金属(例如
152
eu或镧系元素的其他金属)可检测地标记抗体。可以使用诸如二乙烯三胺五乙酸(dtpa)或乙二胺四乙酸(edta)的金属螯合基团将这些金属连接至抗体。将不同部分结合到抗体上的技术是公知的,参见,例如arnon等,“monoclonal antibodies for immunotargeting of drugs in cancer therapy”,《monoclonal antibodies and cancer therapy》,reisfeld等(编辑),243
‑
56页(alan r.liss公司(1985));hellstrom等,“antibodies for drug delivery”,《controlled drug delivery(第二版)》,robinson等(编辑),marcel dekker公司,623
‑
53页(1987);thorpe,“antibody carriers of cytotoxic agents in cancer therapy:a review”,《monoclonal antibodies'84:biological and clinical applications》,pinchera等(编辑),475
‑
506页(1985);“analysis,results,and future prospective of the therapeutic use of radiolabeled antibody in cancer therapy”,《monoclonal antibodies for cancer detection and therapy》,baldwin等(编辑),学术出版社,303
‑
16页(1985),和thorpe等“the preparation and cytotoxic properties of antibody
‑
toxin conjugates”,immunol.rev.(52:119
‑
58(1982))。
[0117]
抗体前药
[0118]
可以构建具有改善的肿瘤细胞特异性和/或降低的非靶细胞结合的抗体前药,从而导致改善的抗肿瘤效率。抗体前药可以是融合蛋白,其包括任选地通过肽接头与靶向cd47的抗体或片段融合的阻断肽。
[0119]“阻断肽”是一种肽,该肽鉴于其相对于抗体或片段的大小和位置,抑制或降低抗体或片段与靶表位的结合。将阻断肽融合至抗体或片段的重链或轻链的n
‑
末端,或置于c
‑
末端。阻断肽的实例可见于例如desnoyers等,“tumor
‑
specific activation of an egfr
‑
targeting probody enhances therapeutic index”,sci transl med.,2013年10月16日;5(207):207ra144。
[0120]
在一些实施方案中,前药不一定是融合蛋白。相反,阻断肽可以与抗cd47重链或轻链内的任何残基连接或缀合。
[0121]
肽接头可以包括在肿瘤或肿瘤微环境中以较高或较高水平表达的蛋白酶的结合位点。蛋白酶的非限制性实例包括mmp
‑
1、mmp
‑
2、mmp
‑
3、mmp
‑
8、mmp
‑
9、mmp
‑
14、upa、psa、psma、组织蛋白酶(cathepsin)d、组织蛋白酶k、组织蛋白酶s、adam10、adam12、adamts、caspase
‑
1、caspase
‑
2、caspase
‑
3、caspase
‑
4、caspase
‑
5、caspase
‑
6、caspase
‑
7、caspase
‑
8、caspase
‑
9、caspase10、caspase
‑
11、caspase
‑
12、caspase
‑
13、caspase
‑
14和tace。
[0122]
本公开的前药可以不与循环中的正常人红细胞上的人cd47结合。因此,抗cd47前
药将对rbc或其他非肿瘤细胞具有降低的毒性,并且在循环中具有改善的pk特性。在肿瘤微环境中,蛋白酶可以将阻断肽从抗cd47前药上切割下来,抗cd47前药将具有结合肿瘤细胞上cd47的活性。在一些实施方案中,前药中的抗体或片段是本公开中公开的任何抗体或片段。在一些实施方案中,所述抗体或片段是诱导血凝的那些抗体或片段中的一种,例如d36s4及其衍生物。
[0123]
双功能分子
[0124]
cd47在免疫和血管生成反应中起重要作用。预期将抗cd47抗体或片段与对细胞因子、免疫检查点或癌症抗原具有特异性(第二特异性)的另一种分子或片段组合的双功能分子在治疗中将具有协同作用。
[0125]
在一些实施方案中,第二特异性针对选自il
‑
1、cd3、cd16、cd19、cd28和cd64的分子。其他实例包括pd
‑
1、pd
‑
l1、ctla
‑
4、lag
‑
3(也称为cd223)、cd28、cd122、4
‑
1bb(也称为cd137)、tim3、ox
‑
40或ox40l、cd40或cd40l、light、icos/icosl、gitr/gitrl、tigit、cd27、vista、b7h3、b7h4、hevm或btla(也称为cd272)、杀伤细胞免疫球蛋白样受体(kir)。
[0126]
作为免疫检查点抑制剂,可以将对cd47具有特异性的抗体或抗原结合片段与对肿瘤抗原具有特异性的第二抗原结合片段组合,以产生双特异性抗体。“肿瘤抗原”是在肿瘤细胞中产生的抗原性物质,即,它触发宿主中的免疫应答。肿瘤抗原可以用于鉴定肿瘤细胞,并且是用于癌症治疗的潜在候选物。体内的正常蛋白质不是抗原性的。但是,某些蛋白质是在肿瘤发生过程中产生的或过表达的,因此对人体来说是“外来的”。这可以包括与免疫系统完全隔离的正常蛋白质、正常情况下以极少量产生的蛋白质、正常情况下仅在某些发育阶段产生的蛋白质或结构因突变而被修饰的蛋白质。
[0127]
大量的肿瘤抗原在本领域中是已知的,并且可以通过筛选容易地鉴定出新的肿瘤抗原。肿瘤抗原的非限制性实例包括egfr、her2、epcam、cd20、cd30、cd33、cd47、cd52、cd133、cd73、cea、gpa33、黏蛋白、tag
‑
72、cix、psma、叶酸结合蛋白、gd2、gd3、gm2、vegf、vegfr、整合素、αvβ3、α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和腱生蛋白(tenascin)。
[0128]
还提供不同形式的双特异性抗体。在一些实施方案中,抗cd47片段和第二片段中的每一个各自独立地选自fab片段、单链可变片段(scfv)或单域抗体。在一些实施方案中,双特异性抗体进一步包括fc片段。
[0129]
还提供不是仅包括抗体或抗原结合片段的双功能分子。作为肿瘤抗原靶向分子,对cd47具有特异性的抗体或抗原结合片段,例如本文所述的那些,可以任选地通过肽接头与免疫细胞因子或配体组合。连接的免疫细胞因子或配体包括但不限于il
‑
1、il
‑
2、il
‑
3、il
‑
4、il
‑
5、il
‑
6、il
‑
7、il
‑
10、il
‑
12、il
‑
13、il
‑
15、gm
‑
csf、tnf
‑
α、cd40l、ox40l、cd27l、cd30l、4
‑
1bbl、light和gitrl。这样的双功能分子可以将免疫检查点阻断作用与肿瘤位点局部免疫调节相结合。
[0130]
编码抗体的多核苷酸及制备抗体的方法
[0131]
本公开还提供编码本公开的抗体、其变体或衍生物的分离的多核苷酸或核酸分子(例如,seq id no:37、39、41、43、45、47、49、51、53、55、57和59)。本公开的多核苷酸可以在相同多核苷酸分子上或在分别的多核苷酸分子上编码抗原结合多肽、其变体或衍生物的整个重链和轻链可变区。另外,本公开的多核苷酸可以在相同多核苷酸分子上或在分别的多
核苷酸分子上编码抗原结合多肽、其变体或衍生物的重链和轻链可变区的部分。
[0132]
制备抗体的方法是本领域公知的并且在本文中描述。在某些实施方案中,本公开的抗原结合多肽的可变区和恒定区都是全人的。可以使用本领域描述的和如本文描述的技术制备全人抗体。例如,可以通过向转基因动物施用抗原来制备针对特定抗原的全人抗体,所述转基因动物已被修饰以应答抗原攻击产生这种抗体,但其内源性基因座(endogenous loci)已被禁用。可以用于制备这种抗体的示例性技术在美国专利:6,150,584、6,458,592、6,420,140中进行了描述,其通过引用以其整体并入本文。
[0133]
癌症治疗
[0134]
如上所述,已经在肿瘤部位或全身性的多种癌症中观察到高的cd47水平。这些癌症包括但不限于急性髓性白血病(aml)、非霍奇金淋巴瘤(nhl)和实体瘤,例如小细胞肺癌(sclc)。目前描述的抗体或片段的施用被认为可以用于治疗或抑制癌症,并且在癌症的临床前模型中的研究表明,cd47的抗肿瘤活性源于其增强效应细胞(如巨噬细胞、t细胞和nk细胞)的能力。
[0135]
因此,在一些实施方案中,提供用于治疗有需要的患者的癌症的方法。在一个实施方案中,该方法需要向患者施用有效量的本公开的抗体。在一些实施方案中,患者中的至少一种癌细胞(例如,基质细胞)表达、过表达或被诱导表达cd47。
[0136]
可以适当治疗的癌症包括膀胱癌、非小细胞肺癌、肾癌、乳腺癌、尿道癌、结肠直肠癌、头颈癌、鳞状细胞癌、默克尔细胞癌(merkel cell carcinoma)、胃肠道癌、胃癌、食道癌、卵巢癌、肾癌和小细胞肺癌。因此,本公开的抗体可以用于治疗任何一种或多种此类癌症。在一些实施方案中,所述癌症选自乳腺癌、食道癌、胃肠道癌、肺癌、肝癌和卵巢癌。
[0137]
在本公开中还提供细胞疗法,例如嵌合抗原受体(car)t细胞疗法。可以使用合适的细胞,使其与本公开的抗cd47抗体接触。经过这样的接触或工程改造后,然后可以将细胞引入需要治疗的癌症患者中。癌症患者可以患有如本文公开的任何类型的癌症。细胞(例如,t细胞)可以是,例如,肿瘤浸润性t淋巴细胞、cd4+t细胞、cd8+t细胞、或它们的组合,没有限制。
[0138]
在一些实施方案中,该细胞是从癌症患者自身分离的。在一些实施方案中,该细胞由供体或细胞库提供。当从癌症患者中分离出细胞时,不期望的免疫反应可以被最小化。
[0139]
可以用本公开的抗体或其变体或衍生物治疗、预防、诊断和/或预后的与细胞存活增加有关的其他疾病或病症包括但不限于:恶性肿瘤以及相关的疾病的进展和/或转移,恶性肿瘤以及相关的疾病为例如白血病(包括急性白血病(例如,急性淋巴细胞白血病、急性髓性白血病(包括髓母细胞性(myeloblastic)、早幼粒细胞性(promyelocytic)、髓单核细胞性、单核细胞性和红细胞性白血病))和慢性白血病(例如,慢性髓性(粒细胞性(granulocytic))白血病和慢性淋巴细胞性白血病))、真性红细胞增多症、淋巴瘤(例如霍奇金氏病(hodgkin's disease)和非霍奇金氏病)、多发性骨髓瘤、华氏巨球蛋白血症(waldenstrom's macroglobulinemia)、重链病和实体瘤,实体瘤包括但不限于肉瘤和癌瘤,例如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤(lymphangioendotheliosarcoma)、滑膜瘤、间皮瘤、尤因氏肿瘤(ewing's tumor)、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、甲状腺癌、子宫内膜癌、黑色素瘤、前列腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂
腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、威尔姆氏肿瘤(wilm's tumor)、宫颈癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤(menangioma)、黑素瘤、神经母细胞瘤和视网膜母细胞瘤。
[0140]
纤维化
[0141]
纤维化是在修复性或反应性过程中在器官或组织中过量的纤维结缔组织的形成。这可以是反应性的、良性的或病理性的状态。在生理上,纤维化起沉积结缔组织的作用,结缔组织可以破坏下层器官或组织的结构和功能。已经显示抗cd47抗体可以逆转肺纤维化。
[0142]
因此,在一个实施方案中,本公开提供一种通过向患有纤维化的患者施用本公开的抗体或片段来治疗纤维化的方法。该方法可用于治疗多种类型的纤维化,例如肺纤维化、肝纤维化、心脏纤维化、纵隔纤维化、腹膜后腔纤维化、骨髓纤维化、皮肤纤维化、硬皮病和全身性硬化症。在一个具体的实例中,纤维化是肺纤维化。
[0143]
诊断方法
[0144]
在某些肿瘤样品中观察到cd47的过表达,并且此类患者可能对用本公开的抗cd47抗体的治疗有反应。因此,本公开的抗体也可以用于诊断和预后目的。
[0145]
优选的样品包括可从患者获得的细胞,该患者可以是癌症患者或需要诊断的患者。该细胞是肿瘤组织或肿瘤块、血液样品、尿液样品或来自患者的任何样品的细胞。在对样品进行任选的预处理之后,可以在允许抗体与样品中潜在存在的cd47蛋白相互作用的条件下,将样品与本公开的抗体一起孵育。可以使用elisa等方法,利用抗cd47抗体,来检测样品中cd47蛋白的存在。
[0146]
样品中cd47蛋白的存在(任选以一定的量或浓度存在)可以用于诊断癌症,作为患者适合用抗体治疗的指示,或作为患者对癌症治疗有(或没有)反应的指示。对于预后方法,可以在开始癌症治疗后,在某个阶段进行一次、两次或多次检测,以指示治疗进展。
[0147]
组合物
[0148]
本公开还提供药物组合物。这样的组合物包含有效量的抗体和可接受的载体。在一些实施方案中,该组合物进一步包括第二抗癌剂(例如,免疫检查点抑制剂)。
[0149]
在一个具体的实施方案中,术语“药学上可接受的”是指由联邦或州政府的监管机构批准或在美国药典或其他公认的药典中列出用于动物的,更特别地是人类的。此外,“药学上可接受的载体”通常是任何类型的无毒固体、半固体或液体填充剂、稀释剂、封装材料或制剂助剂。
[0150]
术语“载体”是指与治疗剂一起施用的稀释剂、辅助剂、赋形剂或媒介物。这样的药物载体可以是无菌液体,例如水和油,包括石油、动物、植物或合成来源的那些,例如花生油、大豆油、矿物油、芝麻油等。当药物组合物静脉内施用时,水是优选的载体。盐溶液以及葡萄糖水溶液(aqueous dextrose)和甘油溶液也可以用作液体载体,特别是用于注射溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇等。如果需要,该组合物还可以含有少量的湿润剂或乳化剂,或ph缓冲剂,例如乙酸盐、柠檬酸盐或磷酸盐。还设想了抗菌剂,例如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸
氢钠;螯合剂,如乙二胺四乙酸;以及用于调节张度(tonicity)的试剂,例如氯化钠或右旋糖(dextrose)。这些组合物可以采取溶液、悬浮液、乳剂、片剂、丸剂、胶囊、粉剂、缓释制剂等形式。该组合物可以与传统的粘合剂和载体(例如甘油三酸酯)一起配制成栓剂。口服制剂可以包括标准载体,例如药用级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。合适的药物载体的实例在e.w.martin的《remington's pharmaceutical sciences》中有描述,通过引用并入本文。这样的组合物将包含治疗上有效量的抗原结合多肽,优选地以纯化形式,以及合适量的载体,以提供用于向患者适当施用的形式。该制剂应适合于施用方式。可以将肠胃外制剂封装在玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
[0151]
在一个实施方案中,根据常规程序将所述组合物配制成适于静脉内施用于人类的药物组合物。通常,用于静脉内施用的组合物是在无菌等渗水性缓冲液中的溶液。必要时,该组合物还可包括增溶剂和局部麻醉剂,例如利多卡因,以减轻注射部位的疼痛。通常,将成分以单位剂型单独提供或混合提供,例如,作为干燥的冻干粉或无水浓缩物提供在密闭容器中,例如指示活性剂的量的安瓿或小药囊中。在组合物将通过输注施用的情况下,可以用装有无菌药用级水或盐水的输液瓶分配。在组合物通过注射施用的情况下,可以提供一安瓿的无菌注射用水或盐水,以使得可以在施用之前将成分混合。
[0152]
本公开的化合物可以被配制成中性的或盐形式。药学上可接受的盐包括那些与阴离子形成的盐,例如那些衍生自盐酸、磷酸、乙酸、草酸、酒石酸等的盐,以及那些与阳离子形成的盐,例如衍生自钠、钾、铵、钙、铁氢氧化物、异丙胺、三乙胺、2
‑
乙基氨基乙醇、组氨酸、普鲁卡因等的盐。
[0153]
实施例
[0154]
实施例1:针对人cd47的小鼠单克隆抗体的产生
[0155]
使用杂交瘤技术产生抗人cd47小鼠单克隆抗体。
[0156]
抗原:人cd47ecd人fc蛋白
[0157]
免疫:为了产生针对人cd47的小鼠单克隆抗体,用人cd47ecd人fc蛋白以40μg/小鼠的量免疫4
‑
6周的雌性swiss webster小鼠。第一次免疫后第21天和第35天,用30μg人cd47ecd人fc蛋白/每只小鼠对免疫小鼠进行加强。为了选择产生结合人cd47的抗体的小鼠,通过elisa测试来自免疫小鼠的血清。简而言之,微量滴定板用在pbs中1μg/ml的人cd47ecd人fc蛋白以100μl/孔在4℃下包被过夜,并在室温下以100μl/孔的2%bsa封闭1小时。将来自免疫小鼠的血浆稀释液添加到每个孔中,并在室温下孵育1
‑
2小时。将板用pbs/吐温洗涤,然后与与辣根过氧化物酶(hrp)缀合的抗小鼠igg抗体在室温孵育1小时。洗涤后,将板用tmb过氧化物酶底物显色,并通过分光光度计在od 450nm下分析。在融合前3
‑
4天,用30μg人cd47hufc蛋白加强具有足够效价的抗cd47 igg的小鼠。
[0158]
使用btx2001电
‑
细胞操纵器(哈佛仪器公司(harvard apparatus))和杂交瘤电融合的标准方案完成杂交瘤融合。将从淋巴结和脾脏分离出的总的小鼠淋巴细胞与sp2/0细胞(atcc)融合,并使用含重氮丝氨酸(sigma)的培养基选择杂交瘤。使用elisa和facs试验筛选杂交瘤上清液。使用有限稀释法进一步亚克隆阳性孔。
[0159]
选择杂交瘤克隆d8s1、d28s1、d36s4、d41s2、d96s1和d125s3进行杂交瘤测序。简而言之,使用trizol试剂(invitrogen)从杂交瘤细胞中提取rna,并使用primescript
tm
逆转录酶制备cdna。使用cdna和小鼠ig
‑
primer set(novagen,tb326 rev.b 0503)对抗体重链和
轻链v区进行pcr扩增,并使用标准dna测序技术获得序列。
[0160]
抗体的可变区的氨基酸和多核苷酸序列提供在下表1中。
[0161]
表1抗cd47 mab重链和轻链可变区序列。抗体cdr加粗并用下划线标出。
[0162]
[0163]
[0164][0165]
实施例2:抗cd47小鼠单克隆抗体对人cd47的结合活性
[0166]
为了评估抗cd47小鼠杂交瘤抗体的结合活性,使用表达人cd47的cho细胞通过facs分析来分析来自12个克隆的杂交瘤上清液。简而言之,向96孔微量滴定板以200,000个细胞/孔接种人cd47/cho细胞。将50μl抗cd47杂交瘤上清液以纯的形式或不同稀释度添加到每个孔中。将细胞与抗体上清液充分重悬,并在4℃孵育15分钟。然后将细胞用pbs洗涤3次,然后与pe标记的抗小鼠fcγ特异性抗体(jackson immuno
‑
research)在4℃孵育15分
钟。再次用pbs洗涤细胞3次,并使用facs caliber仪器(becton
‑
dickinson)进行分析。如图1所示,12种抗人cd47抗体中的11种对表达天然人cd47受体的cho细胞具有高结合活性。只有一种抗体d97s5对cho/cd47细胞具有低结合活性。
[0167]
在elisa试验中评估了抗人cd47抗体对人cd47的结合亲和力。简而言之,将96孔微量滴定板用pbs中1μg/ml的人cd47ecd hufc蛋白以100μl/孔在4℃下包被过夜,然后在室温下用100μl/孔的2%bsa封闭1小时。将从100μg/ml开始的纯化的小鼠杂交瘤抗体的十倍稀释液添加到每个孔中,并在室温下孵育1
‑
2小时。用pbs/吐温洗涤板,然后与与辣根过氧化物酶(hrp)缀合的山羊抗小鼠igg抗体在室温孵育1小时。洗涤后,将板用tmb底物显色,并通过分光光度计在od 450nm下分析。如图2所示,12种抗体全部都可以以高活性(ec
50
=10
‑
50ng/ml)与人cd47结合。
[0168]
facs试验还用于评估抗cd47抗体与乳腺癌细胞系mda
‑
mb 231的结合。如图3a和3b所示,所测试的九种抗体全部以良好的亲和力与mda
‑
mb 231细胞结合。
[0169]
实施例3:抗人cd47小鼠mab阻断人cd47与其配体sirpα的结合
[0170]
使用重组人cd47ecd
‑
his蛋白进行配体阻断试验
[0171]
为了评估抗人cd47小鼠mab对重组人cd47与其配体sirpα结合的阻断能力,采用了基于elisa的配体阻断试验。简而言之,将微量滴定板用pbs中1μg/ml的人cd47ecd his标签蛋白以100μl/孔在4℃下包被过夜,然后用100μl/孔的2%bsa封闭。将50μl人sirpαhufc蛋白(1μg/ml)和50μl的从50μg/ml开始的抗人cd47抗体的5倍稀释液添加到每个孔中,并在37℃下孵育1小时。将板用pbs/吐温洗涤,然后与抗人igg
‑
hrp在37℃下温育1小时。洗涤后,将板用tmb底物显色,并通过分光光度计在od 450nm下分析。如图5a所示,大多数抗人cd47抗体可以有效抑制人sirpα与人cd47的结合。d28s1的ic
50
为1nm,而d36s4的ic
50
为0.59nm(图5b)。
[0172]
使用哺乳动物细胞表达的人cd47进行配体阻断试验
[0173]
为了评估抗人cd47小鼠mab对在cho细胞上表达的人全长cd47的阻断作用,使用了基于facs的配体阻断试验。简而言之,首先将cd47
‑
cho细胞与从50μg/ml开始的5倍系列稀释的小鼠mab在冰上孵育30分钟。用facs缓冲液(含2%fbs的pbs)洗涤一次后,将0.2μg/ml的人sirpa hufc蛋白添加到细胞中,并在冰上再孵育15分钟。然后将细胞用facs缓冲液洗涤3次。将pe标记的抗人fcγ特异性抗体(jackson immuno
‑
research)添加到细胞中,并将细胞在4℃下孵育15分钟。再次将细胞在facs缓冲液中洗涤3次,并通过facs caliber评估pe的平均荧光强度(mfi)。如图4所示,14种评估的抗人cd47杂交瘤抗体中的大多数可以有效抑制sirpα与表达cd47的cho细胞的结合。其中,d28s1、d36s4、d96s1是最有效的。
[0174]
实施例4:抗人cd47小鼠/人嵌合抗体阻断人cd47与其配体sirpα的结合
[0175]
为了评估抗人cd47小鼠/人嵌合抗体对人cd47与其配体sirpα结合的阻断作用,由hek293细胞产生了抗人cd47小鼠/人嵌合抗体。简而言之,将小鼠抗体重链和轻链v区克隆到含人抗体重链igg1和轻链恒定区的瞬时表达载体中。所得的抗体重链和轻链表达构建体用于转染hek293细胞。收集培养物上清液,并上样到蛋白a sepharose柱(ge healthcare)上。洗涤柱,然后用洗脱缓冲液(0.1m甘氨酸缓冲液,ph 3.0)洗脱抗体。收集的级分用1m tris
‑
hcl(ph 8.0)中和,合并在一起,然后用pbs透析。在还原条件下和非还原条件下,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds
‑
page)分析抗体的纯度。通过考马斯亮蓝染色使
蛋白条带可视化。
[0176]
为了评估抗人cd47小鼠/人嵌合抗体对在cho细胞上表达的人全长cd47的阻断作用,使用了基于facs的配体阻断试验。首先将cd47
‑
cho细胞与从100μg/ml开始的3倍系列稀释的小鼠/人嵌合mab在冰上孵育30分钟。用facs缓冲液(含2%fbs的pbs)洗涤一次后,将4μg/ml的fitc标记的人sirpαhufc蛋白添加到细胞中,并在冰上再孵育15分钟。然后将细胞用facs缓冲液洗涤3次,并通过facs caliber评估fitc的平均荧光强度(mfi)。如图6a所示,6种抗人cd47嵌合抗体全部可以有效抑制sirpα与表达cd47的cho细胞的结合。ic50在5
‑
20μg/ml之间(图6b)。ab6.12是来自celgene的抗cd47抗体2a1的人源化版本,在试验中用作参比抗体。
[0177]
实施例5:抗人cd47小鼠/人嵌合抗体的结合亲和力
[0178]
使用捕获方法用biacore
tm
确定抗人cd47小鼠/人嵌合抗体对人cd47蛋白的结合亲和力。使用包被在cm5芯片上的抗人fc抗体捕获抗人cd47小鼠/人嵌合抗体。将从400nm开始的人cd47ecd小鼠fc蛋白的系列稀释液以30μl/ml的流速注射到捕获的抗体上1分钟。或者,将从800nm开始的人cd47ecd his标签蛋白的系列稀释液以30μl/ml的流速注射到捕获的抗体上1分钟。使抗原解离900s。所有实验均在biacore 3000上进行。使用biacore 3000评估软件进行数据分析。结果如下表2和表3所示。
[0179]
表2.抗人cd47mab与二价cd47ecd mufc蛋白的结合亲和力
[0180][0181]
表3.抗人cd47mab与单价cd47ecd his标签蛋白的结合亲和力
[0182][0183][0184]
实施例6:抗人cd47抗体与食蟹猴和小鼠cd47结合的交叉反应
[0185]
为了评估抗人cd47抗体与食蟹猴和小鼠cd47的结合交叉反应性,使用了基于elisa的结合试验。简要地,用带his标签的食蟹猴cd47或带his标签的小鼠cd47蛋白(购自acro biosystem)包被微量滴定板。两种蛋白均以pbs中2μg/ml的浓度100μl/孔在4℃下包被过夜。然后用100μl/孔的2%bsa封闭板。将十倍稀释的小鼠抗人cd47杂交瘤抗体从70μg/ml开始添加到每个孔中,并在室温下孵育1
‑
2小时。将板用pbs/吐温洗涤,然后与与辣根过氧化物酶(hrp)缀合的山羊抗小鼠igg抗体在室温下孵育1小时。洗涤后,将板用tmb底物显
色,并通过分光光度计在od 450nm下分析。如图7所示,所有测试的抗体均显示出与食蟹猴cd47的不同程度的交叉反应性。但是,如图8所示,大多数抗体不与小鼠cd47结合。只有d36s4对小鼠cd47具有弱的结合。
[0186]
实施例7:小鼠抗人cd47抗体d28s1的人源化
[0187]
使用mab d28s1可变区基因来创建人源化mab。在此过程的第一步中,将mab d28s1的vh和vk氨基酸序列与人ig基因序列的可用数据库进行比较,以找到总体上最匹配的人种系ig基因序列。对于轻链,最接近的人类匹配是kv5
‑
2/jk2基因,而对于重链,最接近的人类匹配是v3
‑
21/jh6基因。
[0188]
然后设计人源化可变结构域序列,其中将d28s1轻链的cdr1(seq id no.1)、cdr2(seq id no.2)和cdr3(seq id no.3)接枝到kv5
‑
2/jk2基因的框架序列上,并将d28s1重链的cdr1(seq id no.4)、cdr2(seq id no.5)和cdr3(seq id no.6)序列接枝到vh3
‑
21/jh6的框架序列上。然后生成3d模型,以确定是否存在其中将小鼠氨基酸替换为人氨基酸可能会影响结合和/或cdr构象的任何框架位置。在轻链的情况下,鉴定出框架中的20t、22r、46l、47l、49s和58v(kabat编号,参见表4)。在重链的情况下,框架中的30t、44r和49a参与了回复突变。
[0189]
表4.d28s1的人源化设计
[0190][0191][0192]
下表5中列出了一些人源化抗体的氨基酸和核苷酸序列。
[0193]
表5.人源化d28s1抗体序列(以粗体表示cdr)
[0194]
[0195]
[0196][0197]
人源化的vh和vk基因是合成产生的,然后分别克隆到含人γ1恒定域和人κ恒定域的载体中。人vh和人vk的配对产生了18种人源化抗体(参见表6)。
[0198]
表6.人源化d28s1抗体及其vh和vl区
[0199][0200]
实施例8:小鼠抗人cd47抗体d36s4的人源化
[0201]
使用mab d36s4可变区基因来创建人源化mab。在此过程的第一步中,将mab d36s4的vh和vk氨基酸序列与人ig基因序列的可用数据库进行比较,以找到总体上最匹配的人种系ig基因序列。对于轻链,最接近的人类匹配是vk4
‑
1/jk1和vk2
‑
40/jk1基因,对于重链,最接近的人类匹配是vh3
‑
72/jh4基因。
[0202]
然后设计人源化可变结构域序列,其中将d36s4轻链的cdr1(seq id no.13)、cdr2(seq id no.14)和cdr3(seq id no.15)接枝到vk4
‑
1/jk1或vk2
‑
40/jk1基因的框架序列上,并将d36s4重链的cdr1(seq id no.16)、cdr2(seq id no.17)和cdr3(seq id no.18)序列接枝到vh3
‑
72/jh4的框架序列上。然后生成3d模型,以确定是否存在其中将小鼠氨基酸替换为人氨基酸可能会影响结合和/或cdr构象的任何框架位置。在重链的情况下,框架中的g49a、a99i、r100e参与了回复突变(kabat编号,参见表7)。
[0203]
表7.d36s4的人源化设计
[0204][0205]
下表8中列出了一些人源化抗体的氨基酸和核苷酸序列。
[0206]
表8.人源化d36s4抗体序列(以粗体表示cdr)
[0207]
[0208][0209]
人源化的vh和vk基因是合成产生的,然后分别克隆到含人γ1恒定域和人κ恒定域的载体中。人vh和人vk的配对产生了6种人源化抗体(参见表9)。
[0210]
表9.人源化d36s4抗体及其vh和vl区
[0211]
[0212][0213]
实施例9:人源化d36s4抗体阻断人cd47与其配体sirpα的结合活性
[0214]
为了评估人源化d36s4抗体对人cd47与其配体sirpα结合的阻断作用,从hek293细胞中产生了人源化d36s4抗体。简而言之,将hud36s4抗体重链和轻链v区克隆到含人抗体重链igg1和轻链恒定区的瞬时表达载体中。所得的抗体重链和轻链表达构建体用于转染hek293细胞。收集培养物上清液,并上样到蛋白a sepharose柱(ge healthcare)上。洗涤柱,然后用洗脱缓冲液(0.1m甘氨酸缓冲液,ph 3.0)洗脱抗体。收集的级分用1m tris
‑
hcl(ph 8.0)中和,合并在一起,然后用pbs透析。在还原条件和非还原条件下,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds
‑
page)分析抗体的纯度。
[0215]
为了评估人源化d36s4抗体对cho细胞上表达的人全长cd47及其配体sirpα之间相互作用的阻断能力,使用了基于facs的配体阻断试验。首先将cd47
‑
cho细胞与从100μg/ml开始的系列稀释的人源化d36s4抗体在冰上孵育30分钟。用facs缓冲液(含2%fbs的pbs)洗涤一次后,将5μg/ml的fitc标记的人sirpαhufc蛋白添加到细胞中,并在冰上再孵育15分钟。然后将细胞用facs缓冲液洗涤3次,并通过facs caliber评估fitc的平均荧光强度(mfi)。如图12所示,六种人源化的d36s4抗体全部可以有效地抑制sirpα与表达cd47的cho细胞的结合。ic50在1.9
‑
13μg/ml之间(图12)。hud36s4h2/l1、hud36s4h2/l2、hud36s4h3/l1、hud36s4h3/l2具有与嵌合d36s4抗体相似的ic50(图12)。
[0216]
为了评估人源化d36s4抗体对重组人cd47与其配体sirpα结合的阻断活性,采用了基于elisa的配体阻断试验。简而言之,将微量滴定板用pbs中1μg/ml的人cd47ecd his标签蛋白以100μl/孔在4℃下包被过夜,然后用100μl/孔的2%bsa封闭。将50μl人sirpαmufc蛋白(1μg/ml)和50μl的从50μg/ml开始的人源化d36s4抗体的系列稀释液添加到每个孔中,并在37℃下孵育1小时。将板用pbs/吐温洗涤,然后与抗小鼠igg
‑
hrp在37℃温育1小时。洗涤后,将板用tmb底物显色,并通过分光光度计在od 450nm下分析。如图13所示,人源化d36s4抗体全部可以有效地抑制人sirpα与人cd47的结合。hud36s4h2/l1、hud36s4h2/l2、hud36s4h3/l1和hud36s4h3/l2具有与嵌合d36s4抗体相似的ic50(图13)。
[0217]
实施例10:抗cd47抗体的血凝活性
[0218]
为了确定抗cd47抗体的血凝活性,使用了人全血或纯化的红细胞。为了纯化红细胞(rbc),将人全血在4℃下以500xg离心10分钟,用pbs洗涤3次,如(hanson,m.s.等.2008)所述。将人全血或rbc在pbs中稀释至10%,并在抗cd47抗体存在的情况下,在u型底96孔板中于37℃下孵育4小时。具有雾状外观的未定型rbc的出现表明血凝。
[0219]
如图9a
‑
d所示,某些抗cd47抗体(包括d36s4、d89s4、d90s1和d96s1)在人全血中引起血凝(图9a,9b),而另一些(包括d8s1、d11s1、d12s1、d28s1、d37s2、d41s2、d97s5、d125s3、d103s2、d101s5)和阴性对照抗体则不会引起血凝(图9a,9b)。使用纯化的rbc获得了相似的抗cd47抗体的血凝结果,表明d8s1、d11s1、d12s1、d28s1、d37s2、d41s2、d97s5、d125s3、d103s2和d101s5缺乏血凝活性(图9c,9d)。
[0220]
实施例11:嵌合抗cd47抗体增强对b淋巴瘤细胞的巨噬细胞吞噬作用
[0221]
使用cfse标记的人淋巴瘤细胞系raji和人外周血来源的巨噬细胞进行了体外吞噬作用试验。将cfse标记的raji细胞与人巨噬细胞在抗cd47抗体或阴性对照抗体的存在下于37℃孵育2小时。然后将细胞培养板用pbs洗涤3次以除去未被吞噬的raji细胞,并通过荧光显微镜法分析细胞以确定吞噬指数(每100个巨噬细胞摄入的细胞数)。
[0222]
在吞噬试验中选择对cd47
‑
sirpα相互作用具有有效阻断活性的嵌合抗cd47抗体进行分析。如图10a和10b所示,嵌合抗cd47抗体增强了人b淋巴瘤raji细胞的巨噬细胞吞噬作用,其中与阳性对照抗体ab6.12相比,d8s1、d28s1、d36s4和d96s1的吞噬活性相似或更好。定量被吞噬的raji细胞以确定吞噬指数。如图10c所示,嵌合抗体d36s4具有最高的吞噬指数。与阳性对照抗体ab6.12相比,d8s1、d28s1和d96s1还具有相似或更高的吞噬活性。嵌合抗体d41s2和d125s3也表现出吞噬活性(图10c)。
[0223]
实施例12:嵌合抗cd47抗体的血凝活性
[0224]
还使用人全血分析了嵌合抗cd47抗体的血凝活性。如图11所示,浓度高于50ng/ml的嵌合d36s4抗体引起血凝,而所有其他嵌合抗cd47抗体,包括d8s1、d28s1、d41s2、d96s1和d125s3,以及阳性对照ab6.12抗体和阴性对照higg1均不引起血凝(图11)。
[0225]
***
[0226]
除非另有定义,否则本文所用的所有技术术语和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。
[0227]
本文示例性描述的发明可以在本文未具体公开的任何一个或多个元素,一个或多个限制不存在的情况下适当地实践。因此,例如,术语“包括”、“包含”,“含有”等应被广泛地且不受限制地理解。另外,本文所采用的术语和表达已被用作描述性而非限制性的术语,并且在使用这些术语和表达时并不打算排除所示出和描述的特征或其部分的任何等同形式,但是应当认识到,在所要求保护的本发明的范围内可以进行各种修改。
[0228]
因此,应当理解,尽管已经通过优选实施方式和任选特征具体公开了本发明,但是本领域技术人员可以对本文所公开的、在此所包含的发明进行修改、改进和变化,并且这些修改、改进和变化被认为在本发明的范围内。本文提供的材料、方法和实施例代表优选实施方式,是示例性的,并且不旨在限制本发明的范围。
[0229]
本文已经广泛和概括地描述了本发明。落入一般公开范围内的每个较窄的种类和亚类分组也构成本发明的一部分。这包括对本发明的一般性描述,其附带条件或否定限制从该属中去除了任何主题,无论被删除的材料是否在本文中被特别引用。
[0230]
另外,在根据马库什组描述本发明的特征或方面的情况下,本领域技术人员将认识到,由此本发明也根据马库什组的任何单个成员或成员的子组进行描述。
[0231]
本文所提及的所有出版物、专利申请、专利和其他参考文献都通过引用以其整体明确地并入本文,其程度与各自单独通过引用并入本文的程度相同。在有冲突的情况下,以本说明书(包括定义)为准。
[0232]
应当理解,尽管已经结合以上实施方式描述了本公开,但是前述描述和实施例旨在示出而不是限制本公开的范围。在本公开范围内的其他方面、优点和修改对于本公开所属领域的技术人员而言将是显而易见的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1