慢性咳嗽、呼吸急促和呼吸困难的治疗的制作方法
慢性咳嗽、呼吸急促和呼吸困难的治疗
1.相关申请的交叉引用
2.本申请要求2018年7月23日提交的美国临时申请序列号62/701,902的优先权权益,所述临时申请的内容特此以引用的方式整体并入。
技术领域
3.在各种实施方案中,本发明涉及使用纳布啡治疗患者的慢性咳嗽、呼吸急促或呼吸困难的方法和组合物。
背景技术:
4.咳嗽是个体寻求医嘱的最常见症状。咳嗽是一种三阶段排出运动行为,其特征在于吸气努力(吸气阶段),然后是针对闭合的声门的强制呼气努力(压缩阶段),然后打开声门和迅速呼气气流(排出阶段)。存在两种一般类型的咳嗽:急性咳嗽和慢性咳嗽。慢性咳嗽是持续至少8周并且可具有解释的起源(例如,鼻后滴注、哮喘、胃食管反流疾病(gerd)、慢性支气管炎)或原因不明的起源的咳嗽。慢性咳嗽严重影响患者的生活质量,患者由于担心咳嗽引起的呕吐、失禁或晕厥而常常避免社交互动。
5.呼吸急促是呼吸不适的主观体验,其由定性上不同的强度不同的呼吸短促感组成。呼吸困难是伴随活动、运动或劳累经历的呼吸急促。在基本生理水平下,呼吸急促或呼吸困难由指导呼吸功能的中枢神经驱动需求与实现所述需求的呼吸系统的能力之间的不平衡造成。呼吸急促或呼吸困难患者所经历的主要感官知觉包括吸气后未得到满足的空气饥饿的感觉以及大量体力负荷来呼吸的感觉。“ipf急性加重”的存在包括呼吸困难和肺功能两者的恶化,并且是ipf患者中患者死亡率的有效预测因子。
6.慢性咳嗽、呼吸急促和呼吸困难是特发性肺纤维化的常见症状。然而,慢性咳嗽、呼吸急促和呼吸困难(尤其是与ipf相关的慢性咳嗽、呼吸急促和呼吸困难)通常难以用常见的止咳剂、抗呼吸急促剂和抗呼吸困难剂进行治疗,并且对于慢性咳嗽、呼吸急促和呼吸困难的有效治疗存在需求。
技术实现要素:
7.本公开尤其提供了治疗咳嗽、呼吸急促或呼吸困难的方法,所述方法包括向需要这种治疗的患者施用有效量的纳布啡或其药学上可接受的盐、溶剂合物或酯。
8.在一些实施方案中,本公开提供了治疗慢性咳嗽的方法,所述方法包括向需要这种治疗的患者施用有效量的纳布啡或其药学上可接受的盐、溶剂合物或酯。在一些实施方案中,所述需要治疗慢性咳嗽的患者是患有原因不明的慢性咳嗽、难治性慢性咳嗽或咳嗽超敏性综合征的患者。在一些实施方案中,所述患者的慢性咳嗽对于用曲马多治疗是难治性的。
9.在一些实施方案中,所述需要治疗慢性咳嗽的患者是未患肺病的患者。在一些实施方案中,所述需要治疗慢性咳嗽的患者是患有肺病的患者。在一些实施方案中,所述肺病
是间质性肺病。在一些实施方案中,所述肺病是慢性阻塞性肺病(copd)。
10.在一些实施方案中,所述需要治疗咳嗽、呼吸急促或呼吸困难的患者是患有与特发性肺纤维化相关的咳嗽、呼吸急促或呼吸困难(“ipf咳嗽、呼吸急促或呼吸困难”)的患者。在一些实施方案中,所述患者患有与ipf相关的慢性咳嗽。
11.在一些实施方案中,所述需要治疗ipf咳嗽、呼吸急促或呼吸困难的患者是患有其他疗法难治的ipf咳嗽、呼吸急促或呼吸困难的患者。在一些实施方案中,所述患者的ipf咳嗽对于用其他止咳剂治疗是难治性的。在一些实施方案中,所述患者的ipf咳嗽、呼吸急促或呼吸困难对于用μ
‑
阿片样激动剂治疗是难治性的。在一些实施方案中,所述患者的ipf咳嗽对于用吡非尼酮治疗是难治性的。在一些实施方案中,所述患者的ipf咳嗽对于用沙利度胺治疗是难治性的。在一些实施方案中,所述患者的ipf咳嗽对于用色甘酸钠治疗是难治性的。
12.在一些实施方案中,所述需要治疗咳嗽、呼吸急促或呼吸困难的患者是还接受对于选自以下的疾病的治疗的患者:肺动脉高压、阻塞性睡眠呼吸暂停、肺癌、copd/肺气肿、缺血性心脏病和gerd。
13.根据本公开的一些实施方案,所述治疗咳嗽、呼吸急促或呼吸困难的方法包括向有需要的患者施用至少约15mg纳布啡或其药学上可接受的盐、溶剂合物或酯的每日剂量持续至少一周。在一些实施方案中,所述治疗咳嗽、呼吸急促或呼吸困难的方法包括向有需要的患者施用至少约120mg纳布啡或其药学上可接受的盐、溶剂合物或酯的每日剂量持续至少一周。在一些实施方案中,所述治疗咳嗽、呼吸急促或呼吸困难的方法包括向有需要的患者施用至少约180mg纳布啡或其药学上可接受的盐、溶剂合物或酯的每日剂量持续至少一周。在一些实施方案中,所述治疗咳嗽、呼吸急促或呼吸困难的方法包括向有需要的患者施用至少约360mg纳布啡或其药学上可接受的盐、溶剂合物或酯的每日剂量持续至少一周。在一些实施方案中,每天两次施用约10mg的纳布啡。在一些实施方案中,每天两次施用约15mg的纳布啡。在一些实施方案中,每天两次施用约20mg的纳布啡。在一些实施方案中,每天两次施用约30mg的纳布啡。在一些实施方案中,每天两次施用约60mg的纳布啡。在一些实施方案中,每天两次施用约90mg的纳布啡。在一些实施方案中,每天一次施用约180mg的纳布啡。在一些实施方案中,每天两次施用约180mg的纳布啡。在一些实施方案中,每天一次施用约360mg的纳布啡。
14.在一些实施方案中,施用所述纳布啡或其药学上可接受的盐、溶剂合物或酯持续约2周。在一些实施方案中,施用所述纳布啡或其药学上可接受的盐、溶剂合物或酯持续约4周。在一些实施方案中,施用所述纳布啡或其药学上可接受的盐、溶剂合物或酯持续约8周。在一些实施方案中,施用所述纳布啡或其药学上可接受的盐、溶剂合物或酯持续约10周。在一些实施方案中,施用所述纳布啡或其药学上可接受的盐、溶剂合物或酯持续约12周。在一些实施方案中,施用所述纳布啡或其药学上可接受的盐、溶剂合物或酯持续约18周。在一些实施方案中,施用所述纳布啡或其药学上可接受的盐、溶剂合物或酯持续约50周。
15.在一些实施方案中,与所述治疗之前相比,在所述治疗之后,所述患者经历咳嗽的显著减轻。在一些实施方案中,与所述治疗之前相比,在所述治疗之后,所述患者经历呼吸急促的显著减轻。在一些实施方案中,与所述治疗之前相比,在所述治疗之后,所述患者经历呼吸困难的显著减轻。
16.在一些实施方案中,所述治疗咳嗽、呼吸急促或呼吸困难的方法还包括以下步骤:滴定纳布啡或其药学上可接受的盐、溶剂合物或酯的剂量持续至少约一周,直到在所述患者中达到稳定状态。在一些实施方案中,进行所述滴定持续约2周,直到在所述患者中达到稳定状态。在一些实施方案中,进行所述滴定持续约7天至约30天,直到在所述患者中达到稳定状态。在一些实施方案中,进行所述滴定持续约12天至约20天,直到在所述患者中达到稳定状态。
17.在一些实施方案中,在所述滴定期间施用递增剂量的纳布啡或其药学上可接受的盐、溶剂合物或酯,直到在所述患者中达到稳定状态。在一些实施方案中,在所述滴定期间施用递增剂量的纳布啡或其药学上可接受的盐、溶剂合物或酯,直到在所述患者中达到有效量60mg、90mg、120mg、180mg、240mg或360mg。
18.在一些实施方案中,以每天一次或两次约15mg的剂量开始所述滴定。在一些实施方案中,以每天一次或两次约30mg的剂量开始所述滴定。在一些实施方案中,所述滴定包括以约15mg至约30mg范围内的增量施用纳布啡。在一些实施方案中,所述滴定包括以约15mg至约60mg范围内的增量施用纳布啡。在一些实施方案中,每天两次滴定用am剂量和pm剂量进行,其中所述pm剂量高于所述am剂量或与所述am剂量相同。
19.根据本公开的一些实施方案,在用纳布啡或其药学上可接受的盐、溶剂合物或酯治疗后的不良事件发生率与施用安慰剂持续相同时间段后的不良事件发生率基本上相同。
20.根据本公开的一些实施方案,临床研究表明,与用安慰剂治疗的患者相比,用纳布啡或其药学上可接受的盐、溶剂合物或酯治疗的患者经历咳嗽、呼吸急促或呼吸困难的统计学上显著的减轻。在一些实施方案中,由小于或等于约0.05的p值指示咳嗽、呼吸急促或呼吸困难的统计学上显著的减轻。
21.根据本公开的一些实施方案,与所述治疗之前相比,在所述治疗之后,所述患者经历疲劳的显著减轻。
22.根据本公开的一些实施方案,如通过客观量度(胸部x射线、肺功能测试等)所定量,与所述治疗之前相比,在所述治疗之后,所述患者经历肺纤维化进展率的显著降低。
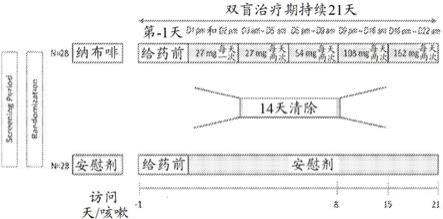
23.在一些实施方案中,在所述治疗之后,基于呼吸急促、呼吸困难或咳嗽状态的改善,所述患者经历住院率的显著降低。
24.在一些实施方案中,在所述治疗之后,由于与肺功能恶化有关的ipf急性加重(ae
‑
ipf)的发生率降低和/或继发于递增强度的呼吸困难的逐渐更频繁发作的“呼吸困难周期”正反馈回路中断的呼吸困难减轻,所述患者经历发病率和死亡率的显著降低。
25.根据本公开的一些实施方案,所述治疗咳嗽、呼吸急促或呼吸困难的方法不会产生显著促排水效应。
26.在一些实施方案中,所述治疗咳嗽、呼吸急促或呼吸困难的方法还包括施用至少一种另外的止咳、抗呼吸急促和抗呼吸困难药物。在一些实施方案中,所述治疗咳嗽、呼吸急促或呼吸困难的方法还包括施用至少一种另外的止咳、抗呼吸急促或抗呼吸困难药物。
27.在一些实施方案中,所述纳布啡呈延长释放口服剂型的形式。
28.在一些实施方案中,所述纳布啡以包含盐酸纳布啡、甘露醇、羟丙基纤维素、刺槐豆胶、黄原胶、二水合硫酸钙和硬脂酸镁的制剂施用。
29.通过以下非限制性具体实施方式(包括实施例),进一步说明了本发明的方法及其
优点。
附图说明
30.图1是两个随机分组的患者的筛选和治疗方案的示意图。qd=每天一次;bid=每天两次;pbo=安慰剂。纳布啡剂量表示为纳布啡游离碱的等效量。
31.定义
32.术语“约”在紧接在数值之前时是指范围(例如,所述值的加或减10%)。例如,除非本公开的上下文另外指示,或与这种解释不一致,则“约50”可意指45至55,“约25,000”可意指22,500至27,500等。例如,在诸如“约49、约50、约55、
…”
的数值列表中,“约50”是指延伸至小于先前值与后续值之间的间隔的一半的范围,例如大于49.5至小于52.5。此外,应鉴于本文所提供的术语“约”的定义来理解短语“小于约”某个值或“大于约”某个值。类似地,术语“约”当在一系列数值或数值范围之前时(例如,“约10、20、30”或“约10
‑
30”)分别指所述系列中的所有值,或所述范围的端点。
33.在整个本公开中,引用了各种专利、专利申请和出版物(包括非专利出版物)。这些专利、专利申请和出版物的公开内容出于所有目的以引用的方式整体并入本公开,以便更充分地描述本领域技术人员已知的截至本公开日期的现有技术水平。在所引用的专利、专利申请和出版物与本公开之间存在任何不一致的情况下,以本公开为准。
34.为了方便起见,在此集中了在说明书、实施例和权利要求书中采用的某些术语。除非另外定义,否则本公开中所用的所有技术术语和科学术语具有与本公开所属领域的普通技术人员通常所理解的相同意义。
35.如本文所用,术语“施用(administer)”、“施用(administering)”或“施用(administration)”是指将化合物或化合物的药学上可接受的盐或酯或者包含化合物或化合物的药学上可接受的盐或酯的组合物直接施用至患者。
36.如本文所用,术语“不良事件”(ae)被定义为在第一次筛选日期或之后报告的临床研究患者中的任何不良医学事件。ae不一定必须与治疗具有因果关系。因此,ae可以是任何不利和意外的体征(包括异常的实验室检查结果)、症状(无论是否与药物(研究用)产品有关)或与药物(研究用)产品的使用时间上相关的疾病。典型的不良事件包括恶心、呕吐、嗜睡、头晕和幻觉。根据本公开,治疗后的不良事件发生率与施用安慰剂持续相同时间段后的不良事件发生率基本上相同。
37.如本文所用的术语“载体”涵盖载体、赋形剂和稀释剂,意指涉及将药剂从身体的一个器官或者部分携带或运输到身体另一个器官或部分的材料、组合物或媒介物,如液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料。
38.术语“慢性咳嗽”在本公开中用于意指持续至少8周的咳嗽。
39.术语“咳嗽超敏性综合征”在本公开中用于意指特征在于通常由低水平的热、机械或化学暴露引发的麻烦咳嗽的临床综合征。这种综合征的临床表现是由看似无害的刺激(如环境温度的变化、笑、电话交谈或气溶胶暴露)引起的咳嗽。
40.除非另外指示,否则术语“病症”在本公开中用于意指术语疾病、疾患或患病,并且与所述术语可互换地使用。
41.术语“有效量”和“治疗有效量”在本公开中可互换使用,并且是指化合物或其盐、
溶剂合物或酯的当施用至患者时能够执行预期结果的量。例如,纳布啡的有效量是减轻患者中ipf的至少一种症状所需的量,例如减轻患者的咳嗽频率或呼吸急促所需的量。包括“有效量”或“治疗有效量”的实际量将根据许多条件而变化,所述条件包括但不限于病症的严重程度、患者的体型和健康状况以及施用途径。熟练的医学从业者可使用医学领域中已知的方法容易地确定合适的量。
42.如本文使用的短语“药学上可接受的”是指在合理医学判断范围内、适用于与人和动物组织接触而无过量毒性、刺激、过敏反应或其它问题或并发症、与合理的利益/风险比相称的那些化合物、材料、组合物和/或剂型。
43.如本文所用的术语“盐”包括通常用于形成游离酸的碱金属盐和用于形成游离碱的加成盐的药学上可接受的盐。盐的性质不是关键性的,只要它是药学上可接受的。术语“盐”还包括加成盐的溶剂合物,如水合物,以及加成盐的多晶型物。合适的药学上可接受的酸加成盐可由无机酸或有机酸制备。此类无机酸的实例是盐酸、氢溴酸、氢碘酸、硝酸、碳酸、硫酸和磷酸。适当的有机酸可选自脂族酸、环脂族酸、芳族酸、芳基脂族酸以及含杂环基的羧酸和磺酸,例如甲酸、乙酸、丙酸、琥珀酸、乙醇酸、葡萄糖酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、葡糖醛酸、马来酸、富马酸、丙酮酸、天冬氨酸、谷氨酸、苯甲酸、邻氨基苯甲酸、甲磺酸、硬脂酸、水杨酸、对羟基苯甲酸、苯乙酸、扁桃酸、双羟萘酸(embonic)(帕莫酸(pamoic))、甲烷磺酸、乙烷磺酸、苯磺酸、泛酸、甲苯磺酸、2
‑
羟基乙烷磺酸、磺胺酸、环己基氨基磺酸、海藻酸、3
‑
羟基丁酸、半乳糖二酸和半乳糖醛酸。
44.如本文关于患者使用的术语“治疗”是指改善患者病症的至少一种症状。治疗可以是治愈、改善或至少部分改善病症。
45.如本文所用的术语“治疗作用”是指通过所述方法和/或组合物提供的所需或有益作用。例如,当用于治疗ipf的方法减轻患者中ipf的至少一种症状,例如咳嗽频率或呼吸急促时,所述方法提供治疗作用。
具体实施方式
46.特发性肺纤维化(ipf)是未知原因的慢性进行性纤维化间质性肺炎的特定形式,主要在老年人中发生,仅限于肺部,并且与普通型间质性肺炎(uip)的组织病理学和/或放射学模式相关(raghu g,等人;american thoracic society,european respiratory society,japanese respiratory society,and latin american thoracic society.diagnosis of idiopathic pulmonary fibrosis.an official ats/ers/jrs/alat clinical practice guideline.am j respir crit care med.2018年9月1日;198(5).)。大多数ipf患者随时间推移经历缓慢进展,一些患者保持相对稳定;然而,其他患者患有快速进展疾病。ipf患者的常见合并症包括肺动脉高压、阻塞性睡眠呼吸暂停、肺癌、copd/肺气肿、缺血性心脏病和gerd。咳嗽和呼吸困难是ipf患者的常见症状,在诊断时报告这些症状的患者分别为81%和90%。
47.与ipf相关的咳嗽(“ipf咳嗽”)是在运动和交谈时变得更重的持续性干咳(c.vigeland,等人,etiology and treatment of cough in idiopathic pulmonary fibrosis,respiratory medicine,2017,123,98
‑
104.)。据报告,咳嗽频率介于每小时1.9
‑
39.4次咳嗽之间,其中白天咳嗽中值频率为每小时14.6次。慢性咳嗽对ipf患者生活质量的
影响是显著且使人衰弱的。咳嗽导致难以入睡,患者避免社交互动,并且患者担心咳嗽引起的呕吐、失禁或晕厥。此外,最近的研究表明,咳嗽是ipf患者中疾病进展和死亡的独立预测因子(c.ryerson,等人,cough predicts prognosis in idiopathic pulmonary fibrosis.respirology.2011;16:969
‑
75.)。
48.ipf咳嗽的病因尚不确定(下文);然而,净效应是ipf患者发展咳嗽反射的超敏反应。不受任何理论束缚,推测ipf咳嗽的病因与疾病产生的化学介质(例如炎性细胞因子、组胺等)有关,所述化学介质改变咳嗽反射的传入臂的c和a
‑
δ神经纤维的兴奋性以及继发于纤维化的肺组织的结构变形,从而导致从机械感受器到引起咳嗽的脑干中的咳嗽反射中心的神经信号传导增加。
49.ipf患者中的呼吸困难与生活质量下降密切相关(例如,失调和抑郁与呼吸困难相关)(c.ryerson,等人,dyspnea in idiopathic pulmonary fibrosis:a systematic review,j.pain and symptom management 2012,43(4);771
‑
82)。死亡率也与呼吸困难的程度相关,因此呼吸困难得分的一个单位增加与死亡风险的10%增加相关,并且两个单位变化导致死亡的49%增加(使用[在l.watters的,a clinical,radiographic,and physiologic scoring system for the longitudinal assessment of patients with idiopathic pulmonary fibrosis,am.rev.respir.dis.1986;133:97
–
103.中描述的0
‑
20呼吸困难量表])(t.king,等人,idiopathic pulmonary fibrosis:relationship between histopathologic features and mortality,am.j.respir.crit.care med.2001,164,第1025
–
1032页.)。
[0050]
μ和κ阿片受体存在于与呼吸功能和咳嗽反射相关的中枢神经系统和周围神经系统的区域中。例如,μ阿片受体以高密度存在于前扣带皮层、脑岛、杏仁核、脑干、脊髓以及c型和a型
‑
δ纤维的外周末梢中(n.volkow,等人,opioid abuse in chronic pain
‑
misconceptions and mitigation strategies,n engl j med,2016,374(13),1253
‑
63.),其涉及肺通气力学、呼吸反射和围绕呼吸功能的感知。κ阿片受体存在于前扣带皮层、脑岛和杏仁核中。μ、κ和δ阿片受体在脑干和脊髓的呼吸相关区域中发现。内源性阿片剂在延髓和脑桥呼吸区域中发现,并且据信在调节呼吸中起着重要但尚不明确的作用(p.lalley,opioidergic and dopaminergic modulation of respiration,respir physiol neurobiol.2008,164(1
‑
2):160
–
167.)。
[0051]
慢性咳嗽、呼吸急促和呼吸困难受皮层神经生理学影响。施用咳嗽刺激物辣椒素的健康志愿者中的功能性脑成像研究显示前脑岛以及前扣带皮层的离散区域的激活(mazzone sb,等人,mapping supramedullary pathways involved in cough using functional brain imaging:comparison with pain.pulm pharmacol ther.2009;22(2):90
‑
6.)。
[0052]
mahler和o’donnell(mahler da,o'donnell de.recent advances in dyspnea.chest.2015;147(1):232
‑
41.)解释,皮层
‑
边缘系统(扣带回前部、脑岛、杏仁核)激活呼吸窘迫的情绪方面以及对呼吸急促和/或呼吸困难的不适感知。神经影像学研究表明,涉及岛叶皮层和前扣带皮层的皮层
‑
边缘网络参与呼吸困难的感知(mahler和o'donnell 2015)。不受任何理论束缚,在皮质水平下的药物干预(例如,通过施用阿片受体活性化合物纳布啡)改善慢性咳嗽、呼吸急促和呼吸困难,因为阿片受体以高密度存在于前扣
带皮层、脑岛和杏仁核中(volkow nd,mclellan at.opioid abuse in chronic pain
‑‑
misconceptions and mitigation strategies.n engl j med.2016;374(13):1253
‑
63.)。
[0053]
此外,脑干具有高密度的阿片受体(volkow等人2016)。脑干对于调节呼吸以及咳嗽反射的活化和设定咳嗽反射的敏化水平至关重要。不受任何理论束缚,因为在皮层与脑干之间存在神经通讯回路,纳布啡直接在脑干水平下以及经由纳布啡介导的皮层对脑干的影响的药理作用改变神经生理学脑干活性,并且因此改善慢性咳嗽、呼吸困难和呼吸急促的症状。
[0054]
在一个方面,本公开提供了一种治疗咳嗽、呼吸急促或呼吸困难的方法,所述方法包括施用有效量的纳布啡或其药学上可接受的盐、溶剂合物或酯。根据本公开的一些实施方案,施用至少约30mg、60mg、90mg、120mg或180mg的纳布啡或其药学上可接受的盐、溶剂合物或酯。
[0055]
在一些实施方案中,本公开的方法用于治疗慢性咳嗽。在一些实施方案中,所述慢性咳嗽选自难治性慢性咳嗽、原因不明的慢性咳嗽、原因不明且难治性的慢性咳嗽、特发性慢性咳嗽、咳嗽超敏性综合征、hypertussia、allotussia和神经源性咳嗽以及对咳嗽冲动感觉的遏制。
[0056]
在一些实施方案中,所述需要治疗慢性咳嗽的患者是未患肺病的患者。
[0057]
在一些实施方案中,所述需要治疗慢性咳嗽的患者是患有肺病的患者。在一些实施方案中,所述肺病是间质性肺病。在一些实施方案中,所述间质性肺病选自由以下组成的组:特发性肺纤维化、超敏性肺炎、结节病、石棉沉着症、闭塞性细支气管炎、组织细胞增生症x、慢性嗜酸粒细胞性肺炎、胶原血管病、肉芽肿性血管炎、古德帕斯丘综合征和肺泡蛋白沉积症。在一些实施方案中,所述间质性肺病选自由以下组成的组:特发性肺纤维化、超敏性肺炎、结节病和石棉沉着症。在一些实施方案中,所述肺病是慢性阻塞性肺病(copd)。在一些实施方案中,所述copd与选自由以下组成的组的疾患相关:肺气肿、慢性支气管炎和α
‑1‑
抗胰蛋白酶(aat)缺乏症。在一些实施方案中,所述copd与选自由以下组成的组的刺激物相关:香烟烟雾、二手烟雾、管道烟雾、空气污染和工作场所暴露于粉尘、烟雾或烟气。
[0058]
在一些实施方案中,慢性咳嗽对于用曲马多治疗是难治性的。在一些实施方案中,慢性咳嗽对于用吗啡治疗是难治性的。在一些实施方案中,慢性咳嗽对于用可待因治疗是难治性的。
[0059]
在一些实施方案中,本公开的方法用于治疗与ipf相关的咳嗽、呼吸急促或呼吸困难。在一些实施方案中,本公开的方法用于治疗ipf咳嗽、呼吸急促或呼吸困难,其中在所述治疗之前,患者的咳嗽严重呈度在视觉模拟量表(vas)咳嗽量表上是至少40mm。在一些实施方案中,本公开的方法用于治疗ipf咳嗽、呼吸急促或呼吸困难,其中在所述治疗之前,患者的白天平均咳嗽计数是使用咳嗽计数装置测量的每小时至少15次。
[0060]
在一些实施方案中,纳布啡用于或被指示用于治疗患有与ipf相关的慢性咳嗽的患者的咳嗽、呼吸急促或呼吸困难。在一些实施方案中,纳布啡用于或被指示用于治疗患有与ipf相关的难治性慢性咳嗽的患者的咳嗽、呼吸急促或呼吸困难。
[0061]
在一些实施方案中,纳布啡用于或被指示用于治疗患者的ipf咳嗽、呼吸急促或呼吸困难,所述患者还接受对于选自由以下组成的组的疾病的治疗:肺动脉高压、阻塞性睡眠呼吸暂停、肺癌、copd/肺气肿、缺血性心脏病和gerd。
[0062]
根据本公开,按每天一次或两次施用纳布啡以提供通过其他疗法不能有效缓解的咳嗽、呼吸急促或呼吸困难的症状的有效缓解(即,所述咳嗽、呼吸急促或呼吸困难对于其他治疗是难治性的)。
[0063]
在一些实施方案中,本公开的方法用于治疗ipf咳嗽,其中所述咳嗽对于用其他止咳剂治疗是难治性的。在一些实施方案中,所述止咳剂选自利多卡因、吉法匹生(gefapixant)、司洛匹坦和奥维匹坦。
[0064]
在一些实施方案中,本公开的方法用于治疗ipf咳嗽、呼吸急促或呼吸困难,其中所述咳嗽、呼吸急促或呼吸困难对于用μ
‑
阿片样激动剂治疗是难治性的。在一些实施方案中,所述μ
‑
阿片样激动剂选自吗啡、曲马多、二氢可待因和二乙酰吗啡。
[0065]
在一些实施方案中,本公开的方法用于治疗ipf咳嗽,其中所述咳嗽对于用吡非尼酮治疗是难治性的。在一些实施方案中,本公开的方法用于治疗ipf咳嗽、呼吸急促或呼吸困难,其中所述咳嗽、呼吸急促或呼吸困难对于用尼达尼布治疗是难治性的。在一些实施方案中,本公开的方法用于治疗ipf咳嗽,其中所述咳嗽对于用沙利度胺治疗是难治性的。在一些实施方案中,本公开的方法用于治疗ipf咳嗽,其中所述咳嗽对于用色甘酸钠治疗是难治性的。
[0066]
根据本公开的一些实施方案,所述方法提供治疗作用而不产生显著不良事件。在一些实施方案中,在用纳布啡治疗后的不良事件发生率与施用安慰剂持续相同时间段后的不良事件发生率基本上相同。
[0067]
根据本公开的一些实施方案,所述治疗咳嗽、呼吸急促或呼吸困难的方法不会产生显著促排水效应。
[0068]
在一个方面,本公开提供了一种治疗与选自以下的疾患相关的咳嗽的方法:哮喘、胃食管反流疾病(gerd)/其他原因引起的食道刺激和上呼吸道疾病。
[0069]
在一个方面,本公开提供了一种治疗慢性咳嗽的方法,所述方法包括向有需要的患者施用有效量的κ激动剂。在一些实施方案中,κ激动剂是地克法林(difelikefalin)或其药学上可接受的盐、溶剂合物或酯。在一些实施方案中,κ激动剂是纳呋拉啡或其药学上可接受的盐、溶剂合物或酯。
[0070]
在一个方面,本公开提供了一种治疗ipf咳嗽、呼吸急促或呼吸困难的方法,所述方法包括向有需要的患者施用有效量的κ激动剂。在一些实施方案中,κ激动剂是地克法林或其药学上可接受的盐、溶剂合物或酯。在一些实施方案中,κ激动剂是纳呋拉啡或其药学上可接受的盐、溶剂合物或酯。
[0071]
在一些实施方案中,对于治疗慢性咳嗽、ipf咳嗽、呼吸急促或呼吸困难,地克法林的每日总剂量是每天约0.25mg至每天约5mg,包括每天约0.25mg、每天约0.5mg、每天约1.0mg、每天1.5mg、每天约2.0mg、每天约2.5mg、每天约3.0mg、每天约3.5mg、每天约4.0mg、每天约4.5mg和每天约5.0mg(包括其间的所有范围)。
[0072]
在一些实施方案中,对于治疗慢性咳嗽、ipf咳嗽、呼吸急促或呼吸困难,纳呋拉啡的每日总剂量是每天约1.5μg至每天约6.0μg,包括每天约1.5μg、每天约2.0μg、每天约2.5μg、每天约3.0μg、每天约3.5μg,每天约4.0μg、每天约4.5μg、每天约5.0μg、每天约5.5μg和每天约6.0μg(包括其间的所有范围)。
[0073]
纳布啡
[0074]
通过将纳布啡或其药学上可接受的盐、溶剂合物或酯与药学上可接受的载体组合,本发明方法中使用的纳布啡可形成药物组合物的一部分。另外,所述组合物可包含选自由以下组成的组的添加剂:佐剂、赋形剂、稀释剂、释放调节剂和稳定剂。所述组合物可以是立即释放制剂、延迟释放制剂、持续释放制剂或延长释放制剂。
[0075]
盐酸纳布啡(17
‑
(环丁基甲基)
‑
4,5α
‑
环氧吗啡喃
‑
3,6α,14
‑
三醇,盐酸盐)是合成阿片剂。在结构上,纳布啡是14羟基吗啡的衍生物。
[0076][0077]
盐酸纳布啡目前仅以可注射形式作为普通药物提供。自1978年以来,可注射形式的纳布啡已成为批准的药物制剂。是目前销售的通用生物等效可注射制剂所基于的创新品牌可注射形式的纳布啡。所述可注射制剂目前被批准用于缓解中度至重度疼痛,对平衡麻醉的补充剂,用于术前和术后镇痛以及阵痛和分娩期间的产科镇痛。
[0078]
本公开还包括纳布啡的药学上可接受的酯。术语“酯”表示含有酯官能团的剂的衍生物(如本文所述),当将所述酯形式施用至患者时,其能够释放所述剂。活性成分的释放在体内发生。药学上可接受的酯可通过本领域技术人员已知的技术来制备。这些技术通常对给定化合物中的适当官能团进行改性。然而,这些改性的官能团通过化合物在体内的代谢而再生原始官能团。酯包括其中羟基、羧基或类似基团被改性的化合物。
[0079]
对于羟基合适的药学上可接受的酯包括无机酯如磷酸酯和α
‑
酰氧基烷基醚以及相关的化合物,所述化合物由于酯的体内水解而提供母体羟基。羟基的体内可水解酯形成基团包括烷酰基(例如,c1‑
10
直链、支链或环状烷基)、苯甲酰基、苯乙酰基和取代的苯甲酰基和苯乙酰基、烷氧基羰基(以得到碳酸烷基酯)、二烷基氨基甲酰基和n
‑
(n,n
‑
二烷基氨基乙基)
‑
n
‑
烷基氨基甲酰基(以得到氨基甲酸酯)、n,n
‑
二烷基氨基乙酰基和羧乙酰基。
[0080]
在一些实施方案中,用于本公开的制剂和方法中的纳布啡是纳布啡的药学上可接受的共晶体。
[0081]
制剂
[0082]
本公开的方法可采用各种制剂以用于以单位剂型施用至患者(例如人和动物),所述单位剂型如含有合适量的纳布啡或其药学上可接受的盐或酯的片剂、胶囊、丸剂、粉末、颗粒剂、无菌胃肠外溶液或悬浮液、可吸入干粉、分散剂、溶液或悬浮液和口服溶液或悬浮液以及油
‑
水乳液。
[0083]
口服药物剂型可以是固体或液体。固体剂型可以是片剂、胶囊、颗粒剂和散装粉末。口服片剂的类型包括压制的可咀嚼锭剂和片剂,其可以是肠溶包衣、糖包衣或薄膜包衣的。胶囊可以是硬明胶胶囊或软明胶胶囊,而颗粒剂和粉末可以非泡腾或泡腾的形式与本领域技术人员已知的其他成分组合提供。在其他实施方案中,口服剂型可以是渗透控制释
放口服递送系统(oros)。在其他实施方案中,口服剂型可包括基质包埋的剂型或相关装置。在一些实施方案中,本发明的口服剂型可包括口腔崩解片剂。
[0084]
片剂中使用的药学上可接受的载体包括粘合剂、润滑剂、稀释剂、崩解剂、着色剂、调味剂和湿润剂。
[0085]
液体口服剂型包括水溶液、乳液、悬浮液、溶液和/或由非泡腾颗粒重构的悬浮液以及由泡腾颗粒重构的泡腾制剂。
[0086]
水溶液包括例如酏剂和糖浆。乳液可以是水包油或油包水乳液。酏剂是澄清的、甜味的水醇溶液。酏剂中使用的药学上可接受的载体包括溶剂。糖浆可以是糖,例如蔗糖的浓缩水溶液,并且可含有防腐剂。乳液是双相体系,其中一种液体以小球体形式分散于整个另一种液体中。乳液中使用的药学上可接受的载体是非水性液体、乳化剂和防腐剂。悬浮液可使用药学上可接受的悬浮剂和防腐剂。待重构为液体口服剂型的非泡腾颗粒中使用的药学上可接受的物质包括稀释剂、甜味剂和湿润剂。待重构为液体口服剂型的泡腾颗粒中使用的药学上可接受的物质可包括有机酸和二氧化碳源。着色剂和调味剂可用于所有以上剂型中。
[0087]
本公开的制剂的胃肠外施用包括立即、持续(例如,储库)、延长和/或改良释放制剂(例如,如本文所述)的静脉内、皮下和肌内施用。用于胃肠外施用的制剂包括准备注射的无菌溶液、准备就在使用前与溶剂组合的无菌干燥可溶性产品(包括皮下注射片剂)、准备注射的无菌悬浮液、准备就在使用前与媒介物组合的无菌干燥不溶性产品和无菌乳液。溶液可以是水性的或非水性的。胃肠外制剂中使用的药学上可接受的载体包括水性媒介物、非水性媒介物、抗微生物剂、等渗剂、缓冲剂、抗氧化剂、局部麻醉剂、悬浮剂和分散剂、乳化剂、螯合(sequestering)或螯合(chelating agent)剂以及其他药学上可接受的物质。
[0088]
可调节药物活性化合物的浓度,以使注射剂提供有效量以产生所需的药理学作用。如本领域中已知的,确切的剂量取决于患者或动物的年龄、体重和状况。单位剂量胃肠外制剂包装在安瓿瓶或带针注射器中。如本领域已知和实践的,用于胃肠外施用的所有制剂必须是无菌的。说明性地,含有纳布啡的无菌水溶液的静脉内或动脉内输注是有效的施用方式。
[0089]
用于直肠施用的药物剂型可以是用于全身作用的直肠栓剂、胶囊和片剂。如本文所用的直肠栓剂是指用于插入直肠的固体,其在体温下熔融或软化,从而释放本公开的组合物中所含的药理和/或治疗活性成分。直肠栓剂中使用的药学上可接受的物质是碱或媒介物以及用于提高熔点的剂。碱的实例包括可可脂(可可油)、甘油
‑
明胶、碳蜡(carbowax)、聚氧乙二醇以及脂肪酸的甘油单酯、甘油二酯和甘油三酯的混合物。可使用各种碱的组合。用于提高栓剂熔点的剂包括鲸蜡和蜡。直肠栓剂可通过压制方法或通过模制来制备。直肠栓剂的典型重量是约2至3gm。可使用与用于经口施用的制剂相同的药学上可接受的物质并通过相同的方法来制造用于直肠施用的片剂和胶囊。
[0090]
当被有需要的患者吸入时,本发明方法中采用的组合物可缓解咳嗽或呼吸困难。缓解可以是暂时的或永久的,并且在单剂量的组合物后甚至也可以是明显的。
[0091]
用于吸入施用的药物剂型可以是用于局部/局部(local/topical)和/或全身作用的溶液、悬浮液或干粉。干粉可以干燥粉末的形式或以包含非水相的稳定化分散体的形式使用。制备和使用用于吸入施用的干粉组合物的方法公开于美国专利号5,874,064和5,
855,913以及美国专利申请公布号2008/0160092中,所述专利特此出于所有目的以引用的方式整体并入。制备和使用稳定化分散体的方法描述于美国专利号6,946,117和6,565,885以及美国专利申请公布号2010/0329984和2004/0241101中,所述专利特此出于所有目的以引用的方式整体并入。
[0092]
干粉、稳定化分散体、溶液或悬浮液可与计量剂量吸入器(mdi)、干粉吸入器(dpi)、雾化器或喷雾器结合使用,以提供吸入递送(例如,气管内或鼻内)。
[0093]
意图用于吸入施用的本公开的组合物含有一定量的有效递送止咳、抗呼吸急促或抗呼吸困难量的组合物,浓度通常介于约0.01%w/w至约80%w/w之间。所述组合物的余量可以是合适的媒介物(如水、合适的有机溶剂或其他合适的溶剂或缓冲剂)或一种或多种药物载体。配制为干粉、稳定化分散体、溶液或悬浮液的组合物可气管内或鼻内施用。
[0094]
组合物应以足以提供缓解咳嗽、呼吸急促或呼吸困难的在fda所制定的安全指南内的量施用。确定向患者施用的适当量在与本公开所提供的教义相关领域的普通技术人员的能力范围内。
[0095]
适合于施用组合物的药物赋形剂或媒介物包括本领域技术人员已知适合于特定施用方式的任何此类载体。纳布啡可以足以发挥治疗有用作用而对所治疗个体没有严重毒性作用的量包含在载体中。
[0096]
持续释放
[0097]
可用于本发明方法中的纳布啡制剂包括口服持续释放纳布啡制剂,如美国临时专利申请号60/772,466、60/710,772和62/011,936;美国专利申请号11/509,347(公布为us 2007/0048376)、12/154,496(公布为us 2009/0030026)和14/738,550;以及pct申请号pct/us2015/035650;所述专利申请各自以引用的方式整体并入本文。
[0098]“持续释放”或“延长释放”是指纳布啡或其药学上可接受的盐、溶剂合物或酯以受控的速率从制剂中释放,以使得纳布啡或其药学上可接受的盐、溶剂合物或酯的治疗有益的血液水平(但低于毒性水平)在延长的时间段内保持。或者,“持续释放”或“延长释放”是指在延长的时间段内保持所需的药理作用。
[0099]
据报告,纳布啡可注射制剂(即,iv或im或sc)的半衰期相对较短,仅约2
‑
3小时。在一些实施方案中,本发明方法可采用纳布啡的口服持续释放制剂,所述口服持续释放制剂包含有效量的纳布啡或其药学上可接受的盐、溶剂合物或酯。口服持续释放制剂可在比针对弹丸式注射或立即释放口服制剂所观察到的更长的时段(例如,至少约8
‑
12小时)内提供纳布啡的受控释放和较低的c
max
。降低给药频率提供了增强的患者便利性和对本发明方法的依从性的潜力。较低的给药频率还具有提供减少的副作用的潜力,因为随时间推移,患者可能暴露于剂的较低峰值浓度。
[0100]
不希望受特定理论束缚,止咳、抗呼吸急促和抗呼吸困难作用的持续时间长于预期是归因于纳布啡的肠肝再循环。纳布啡通过与酶系统(如udp
‑
葡糖醛酸基转移酶)的酶促反应在体内形成葡糖醛酸或其他类型的缀合代谢物。还有可能的是,肝肠再循环还在胆汁中的母体药物从胆囊释放到肠中并再吸收时发生。一旦形成,缀合的纳布啡产物被认为经由胆汁分泌转运到胃肠道中,由此药物缀合物被裂解,从而释放纳布啡,纳布啡可从肠中再吸收。持续释放制剂可通过将纳布啡更缓慢地释放到体内系统中并允许缀合更多的药物且因此可用于再循环和随后从肠再吸收而提高止咳、抗呼吸急促或抗呼吸困难作用的持续时
间。
[0101]
本发明方法可采用包含纳布啡或其药学上可接受的盐、溶剂合物或酯和持续释放递送系统的组合物。所述持续释放递送系统包含:(i)至少一种亲水性化合物、至少一种交联剂和至少一种药物稀释剂;(ii)至少一种亲水性化合物、至少一种交联剂、至少一种药物稀释剂和至少一种不同于第一交联剂的阳离子交联剂;或(iii)至少一种亲水性化合物、至少一种阳离子交联化合物和至少一种药物稀释剂。或者,在其他实施方案中,本发明方法可采用包含纳布啡或其药学上可接受的盐、溶剂合物或酯和持续释放递送系统的组合物,所述组合物可在持续释放系统中采用疏水性化合物。
[0102]
纳布啡可均匀地分散在所述持续释放递送系统中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约1mg至约240mg;约1mg至约150mg;约1mg至约125mg;或约1mg至约100mg的量存在于所述组合物中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约5mg至约80mg;约10mg至约70mg;约15mg至约60mg;约40mg至约80mg;约50mg至约70mg;或约45mg至约60mg的量存在于所述组合物中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约15mg、约20mg、约25mg、约30mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg或约240mg的量存在于所述组合物中。在一些实施方案中,纳布啡或其药学上可接受的盐以约15mg、约30mg、约45mg、约60mg、约90mg、约120mg或约180mg的量存在于所述组合物中。
[0103]
在一些实施方案中,纳布啡的药学上可接受的盐(例如盐酸纳布啡)以约15mg、约30mg、约60mg、约90mg、约120mg或约180mg的量存在于所述组合物中。对于包含纳布啡的药学上可接受的盐的组合物,所述组合物中纳布啡的量可表示为纳布啡游离碱的等效量,所述等效量是基于所述组合物中纳布啡的药学上可接受的盐的实际量的所述组合物中纳布啡游离碱的计算量。组合物中纳布啡游离碱的等效量的量将在制造过程中变化,并且本公开的组合物涵盖与本公开中所述的纳布啡含量的药学上可接受的偏差(即,fda可接受的)。
[0104]
下表示出对于含有15mg、30mg、60mg、90mg、120mg、180mg和240mg盐酸纳布啡的组合物,纳布啡游离碱的等效量:
[0105]
盐酸纳布啡的量纳布啡游离碱的等效量15mg13.630mg27.260mg54.490mg81.6120mg108.8180mg163.2240mg217.6
[0106]
纳布啡游离碱的等效量的量使用以下等式四舍五入至最接近的小数点后0.1位。
[0107]
在整个本公开中,组合物中纳布啡的量通常以组合物中存在的盐酸纳布啡的量表示。然而,本公开设想了其中纳布啡以另一种纳布啡形式(如不同的药学上可接受的盐和/或酯)存在的实施方案,并且提供了与本文明确描述的实施方案大约相同等效量的纳布啡
游离碱。例如,约251mg的柠檬酸纳布啡(fw=549.57g/mol)提供与约180mg的盐酸纳布啡大约相同等效量的纳布啡游离碱。所述组合物中纳布啡游离碱的等效量可通过下式计算:
[0108][0109]
可通过药学上可接受的量(例如,在fda安全标准允许的量之内,其在一些实施方案中是纳布啡游离碱的计算的等效量的1%或更少)来调整使用上述等式计算的剂型的纳布啡游离碱含量的等效量,以允许在参考剂量强度时使用整数来进行产品标记。例如,对于240mg盐酸纳布啡,纳布啡游离碱的计算的等效量是217.6mg。根据本公开,可针对216mg等效量的纳布啡游离碱的产品标记调整组合物的纳布啡含量。
[0110]
在一些实施方案中,纳布啡或其药学上可接受的盐(例如,hcl)以约15mg、约30mg、约60mg、约90mg、约120mg或约180mg的量存在于所述组合物中。
[0111]
在一些实施方案中,持续释放递送系统以约10mg至约420mg;约25mg至约225mg;约21mg至约198mg;或约80mg至约200mg;约80mg至约220mg;约90mg至约210mg;约100mg至约200mg;约110mg至约190mg;约120mg至约180mg;约130mg至约170mg;约140mg至约160mg;约30mg至约60mg;约60mg至约180mg;约30mg至约180mg、约75mg至约150mg、约80mg至约160mg、约90mg至约150mg、约100mg至约140mg、约110mg至约130mg、约100mg至约300mg、约200mg至约300mg或约200mg至约250mg的量存在于所述组合物中。在一些实施方案中,所述持续释放递送系统以约75mg至约150mg的量存在于所述组合物中。
[0112]
在一些实施方案中,所述持续释放递送系统以约30mg、约60mg、约75mg、约80mg、约90mg、约100mg、约110mg、约112mg、约115mg、约117mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约225mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约300mg、约320mg、约340mg、约360mg、约380mg、约400mg或约420mg的量存在于所述组合物中。在一些实施方案中,所述持续释放递送系统以约112mg的量存在于所述组合物中。
[0113]
所述组合物中的纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例通常是约4:1至约1:25。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例通常是约2.5:1至约1:4。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例通常是约5:1至约1:5、约4:1至约1:4、约3:1至约1:3、约2:1至约1:2、约1:1至约1:5、约1:1至约1:4、约1:1至约1:3、约1:1至约1.2和约1:2至约1:3。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例是约1:1、约1:2、约1:2.5、约1:3、约1:4或约1:5。
[0114]
在一些实施方案中,至少一种亲水性化合物以约5重量%至约80重量%的量存在于持续释放递送系统中;至少一种交联剂以约0.5重量%至约80重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约20重量%至约80重量%的量存在于持续释放递送系统中。在一些实施方案中,至少一种亲水性化合物以约8重量%至约31重量%的量存在于持续释放递送系统中;至少一种交联剂以约12重量%至约47重量%的量存在于持续释
放递送系统中;并且至少一种药物稀释剂以约20重量%至约78重量%的量存在于持续释放递送系统中。在一些实施方案中,至少一种亲水性化合物以约10重量%至约20重量%的量存在于持续释放递送系统中;至少一种交联剂以约15重量%至约25重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约50重量%至约85重量%的量存在于持续释放递送系统中。在一些实施方案中,至少一种亲水性化合物以约8重量重量%、约9重量重量%、约10重量%、约11重量%、约12重量%、约13重量%、约14重量%、约15重量%、约16重量%、约17重量%、约18重量%、约19重量%、约20重量%、约22重量%、约24重量%、约26重量%、约28重量%、约30重量%、约32重量%、约34重量%或约36重量%的量存在于持续释放递送系统中;至少一种交联剂以约10重量%、约11重量%、约12重量%、约13重量%、约14重量%、约15重量%、约16重量%、约17重量%、约18重量%、约19重量%、约20重量%、约22重量%、约24重量%、约26重量%、约28重量%、约30重量%、约32重量%、约33重量%、约34重量%或约35重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约40重量%、约45重量%、约50重量%、约55重量%、约60重量%、约65重量%、约70重量%、约80重量%或约85重量%的量存在于持续释放递送系统中。
[0115]
在一些实施方案中,至少一种亲水性化合物以约10重量%、约11重量%、约12重量%、约13重量%、约14重量%、约15重量%、约16重量%、约17重量%、约18重量%、约19重量%或约20重量%的量存在于持续释放递送系统中;至少一种交联剂以约15重量%、约16重量%、约17重量%、约18重量%、约19重量%、约20重量%或约22重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约55重量%、约60重量%、约65重量%、约70重量%、约80重量%或约85重量%的量存在于持续释放递送系统中。在一些实施方案中,至少一种亲水性化合物以约8重量%、约12重量%或约20重量%的量存在于持续释放递送系统中;至少一种交联剂以约12重量%、约18重量%或约30重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约40重量%、约60重量%或约70重量%的量存在于持续释放递送系统中。
[0116]
在一些实施方案中,纳布啡呈本领域已知的任何药学上可接受的盐的形式,其量提供如本文所述的纳布啡游离碱的等效量。示例性药学上可接受的盐包括但不限于盐酸、硫酸、硝酸、磷酸、氢溴酸、马来酸、苹果酸、抗坏血酸、柠檬酸、酒石酸、帕莫酸、月桂酸、硬脂酸、棕榈酸、油酸、肉豆蔻酸、月桂基硫酸、萘磺酸、亚油酸、亚麻酸等。在一些实施方案中,纳布啡呈盐酸盐的形式。
[0117]
持续释放递送系统包含至少一种亲水性化合物。亲水性化合物优选形成凝胶基质,所述凝胶基质在暴露于液体时以持续的速率释放纳布啡或其药学上可接受的盐、溶剂合物或酯。纳布啡或其药学上可接受的盐、溶剂合物或酯从凝胶基质中释放的速率取决于药物在所述凝胶基质的组分与胃肠道内的水相之间的分配系数。纳布啡与亲水性化合物的重量比通常在约10:1至约1:10、约9:1至约1:9、约8:1至约1:8、约7:1至约1:7、约6:1至约1:6、约5:1至约1:5、约4:1至约1:4、约3:1至约1:3以及约2:1至约1:2的范围内。在一些实施方案中,纳布啡与亲水性化合物的重量比在约10:1至约1:1、约10:1至约2:1、约9:1至约1:1、约8:1至约1:1、约7:1至约1:1、约6:1至约1:1、约5:1至约1:1、约4:1至约1:1、约3:1至约1:1以及约2:1至约1:1的范围内。在一些实施方案中,纳布啡与亲水性化合物的重量比在约6:1至约1:1、约5:1至约2:1、约4:1至约3:1、约4:1至约2:1以及约5:1至约2:1的范围内。在一些
实施方案中,纳布啡与亲水性化合物的重量比是约1:5、约1:4.5、约1:4.4、约1:4、约1:3.5、约1:3.3、约1:3、约1:2.5、约1:2、约1:1以及约1:1.5。
[0118]
持续释放递送系统通常包含约5重量%至约80重量%的量的亲水性化合物。在一些实施方案中,持续释放递送系统通常包含约5重量%至约30重量%、约8重量%至约31重量%、约10重量%至约20重量%、约20重量%至约60重量%或约40重量%至约60重量%的量的亲水性化合物。在一些实施方案中,持续释放递送系统包含约8重量%至约31重量%的量的亲水性化合物。在一些实施方案中,持续释放递送系统包含约10重量%至约20重量%的量的亲水性化合物。在一些实施方案中,持续释放递送系统包含约10重量%、约11重量%、约12重量%、约13重量%、约14重量%、约15重量%、约16重量%、约17重量%、约18重量%、约19重量%或约20重量%的量的亲水性化合物。在一些实施方案中,持续释放递送系统包含约12重量%的量的亲水性化合物。在一些实施方案中,持续释放递送系统包含约8重量%的量的亲水性化合物。在一些实施方案中,持续释放递送系统包含约20重量%的量的亲水性化合物。在一些实施方案中,持续释放递送系统包含约28重量%的量的亲水性化合物。
[0119]
亲水性化合物是本领域已知为亲水性的任何药学上可接受的化合物。示例性的亲水性化合物包括但不限于药学上可接受的树胶、纤维素醚、聚乙烯吡咯烷酮、蛋白质来源的化合物以及它们的混合物。示例性树胶包括但不限于杂多糖树胶和同多糖树胶,如黄原胶、黄芪胶、果胶、阿拉伯胶、刺梧桐胶、藻酸盐、琼脂、瓜尔胶、羟丙基瓜尔胶、角叉菜胶、刺槐豆胶和结冷胶。示例性纤维素醚包括但不限于羟烷基纤维素和羧烷基纤维素。在一些实施方案中,纤维素醚包括羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、羧甲基纤维素以及它们的混合物。在一些实施方案中,亲水性化合物是树胶。在其他实施方案中,亲水性化合物是杂多糖树胶。在其他实施方案中,亲水性化合物是黄原胶或其衍生物。黄原胶的衍生物包括但不限于,例如,脱酰基黄原胶、黄原胶的羧甲基酯和黄原胶的丙二醇酯。
[0120]
在另一方面,持续释放递送系统还包含至少一种交联剂。在一些实施方案中,交联剂是能够在液体存在下使亲水性化合物交联以形成凝胶基质的化合物。如本文所用,“液体”包括例如胃肠液和水溶液,诸如用于体外溶出试验的那些。持续释放递送系统通常包含约0.5重量%至约80重量%的量的交联剂。在一些实施方案中,持续释放递送系统通常包含约12重量%至约47重量%的量的交联剂。在一些实施方案中,持续释放递送系统通常包含约20重量%至约30重量%的量的交联剂。在一些实施方案中,持续释放递送系统通常包含约15重量%至约25重量%的量的交联剂。在一些实施方案中,至少一种交联剂以约15重量%、约16重量%、约17重量%、约18重量%、约19重量%、约20重量%、约21重量%、约22重量%、约23重量%、约24重量%或约25重量%的量存在于持续释放递送系统中。在一些实施方案中,持续释放递送系统包含约18重量%的量的交联剂。在一些实施方案中,持续释放递送系统包含约12重量%的量的交联剂。在一些实施方案中,持续释放递送系统包含约30重量%的量的交联剂。在一些实施方案中,持续释放递送系统包含约42重量%的量的交联剂。
[0121]
示例性交联剂包括同多糖。示例性同多糖包括但不限于半乳甘露聚糖树胶,如瓜尔豆胶、羟丙基瓜尔豆胶和刺槐豆胶。在一些实施方案中,交联剂是刺槐豆胶或瓜尔豆胶。在其他实施方案中,交联剂是海藻酸衍生物或水胶体。
[0122]
在一些实施方案中,当持续释放递送系统包含至少一种亲水性化合物和至少一种
交联剂时,亲水性化合物与交联剂的重量比是约1:9至约9:1、约1:8至约8:1、约1:7至约7:1、约1:6至约6:1、约1:5至约5:1、约1:4至约4:1、约1:3至约3:1或约1:2。在一些实施方案中,亲水性化合物与交联剂的重量比是约1:5、约1:4.5、约1:4、约1:3.5、约1:3、约1:2.5、约1:2、约1:1.5和约1:1。
[0123]
当持续释放递送系统包含至少一种亲水性化合物和至少一种交联剂时,纳布啡或其药学上可接受的盐、溶剂合物或酯与至少一种亲水性化合物和至少一种交联剂的总和的重量比是约10:1至约1:10、约9:1至约1:9、约8:1至约1:8、约7:1至约1:7、约6:1至约1:6、约5:1至约1:5、约4:1至约1:4、约3:1至约1:3或约2:1至约1:2。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯与至少一种亲水性化合物和至少一种交联剂的总和的重量比是约4:1至约1:1、约4:1至约1:1.5、约3:1至约1:1或约2:1至约1:1。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯与至少一种亲水性化合物和至少一种交联剂的总和的比例是约5:1、约4:1(即,1:0.25)、约3.5:1、约3:1、约2.5:1、约2:1(即,1:0.5)、约1.9:1、约1.8:1、约1.7:1、约1.6:1、约1.5:1、约1.4:1、约1.3:1、约1.2:1、约1.1:1、约1:1、约1:1.5、约1:2、约1:3、约1:4和约1:5。
[0124]
持续释放递送系统还包含一种或多种本领域已知的药物稀释剂。示例性药物稀释剂包括但不限于单糖、二糖、多元醇以及它们的混合物。在一些实施方案中,药物稀释剂包括例如淀粉、甘露醇、乳糖、右旋糖、蔗糖、微晶纤维素、山梨醇、木糖醇、果糖以及它们的混合物。在一些实施方案中,药物稀释剂是水溶性的。水溶性药物稀释剂的非限制性实例包括乳糖、右旋糖、蔗糖或它们的混合物。药物稀释剂与亲水性化合物的重量比通常是约1:9至约9:1、约1:8至约8:1、约1:7至约7:1、约1:6至约6:1、约1:5至约5:1、约1:4至约4:1、约1:3至约3:1或约1:2至约2:1。在一些实施方案中,药物稀释剂与亲水性化合物的重量比通常是约9:1至约1:1.5。在一些实施方案中,药物稀释剂与亲水性化合物的重量比是约9:1、约8.75:1、约8.5:1、约8.25:1、约8:1、约7.5:1、约7:1、约6.5:1、约6:1、约5.5:1、约5:1、约4.5:1、约4:1、约3.5:1、约3:1、约2.5:1、约2:1、约1.5:1或约1:1。
[0125]
持续释放递送系统通常包含约20%至约80%、约30%至约70%、约40%至约70%或约40%至约60%的量的一种或多种药物稀释剂。在一些实施方案中,持续释放递送系统包含约20重量%至约70重量%的量的一种或多种药物稀释剂。在一些实施方案中,持续释放递送系统包含约50重量%至约85重量%的一种或多种药物稀释剂。在一些实施方案中,持续释放递送系统包含约55重量%、约60重量%、约65重量%、约70重量%、约80重量%或约85重量%的量的一种或多种药物稀释剂。在一些实施方案中,持续释放递送系统包含约20重量%的量的一种或多种药物稀释剂。在一些实施方案中,持续释放递送系统包含约30重量%的量的一种或多种药物稀释剂。在一些实施方案中,持续释放递送系统包含约40重量%的量的一种或多种药物稀释剂。在一些实施方案中,持续释放递送系统包含约50重量%的量的一种或多种药物稀释剂。在一些实施方案中,持续释放递送系统包含约60重量%的量的一种或多种药物稀释剂。在一些实施方案中,持续释放递送系统包含约70重量%的量的一种或多种药物稀释剂。
[0126]
在另一方面,持续释放递送系统包含一种或多种阳离子交联化合物。在一些实施方案中,使用一种或多种阳离子交联化合物代替交联剂。在一些实施方案中,除交联剂外,还使用一种或多种阳离子交联化合物。在一些实施方案中,以足以使亲水性化合物交联以
在液体存在下形成凝胶基质的量使用一种或多种阳离子交联化合物。在一些实施方案中,一种或多种阳离子交联化合物以约0.5重量%至约30重量%、约0.5重量%至约25重量%、约0.5重量%至约20重量%、约0.5重量%至约15重量%、约0.5重量%至约10重量%或约0.5重量%至约5重量%的量存在于持续释放递送系统中。在一些实施方案中,一种或多种阳离子交联化合物以约5重量%至约20重量%、约5重量%至约15重量%、约6重量%至约14重量%、约7重量%至约13重量%、约8重量%至约12重量%或约9重量%至约11重量%的量存在于持续释放递送系统中。在一些实施方案中,一种或多种阳离子交联化合物以约5重量%、约6重量%、约7重量%、约8重量%、约9重量%、约10重量%、约11重量%、约12重量%、约13重量%、约14重量%或约15重量%的量存在于持续释放递送系统中。在一些实施方案中,阳离子交联化合物以约10重量%的量存在于持续释放递送系统中。
[0127]
示例性阳离子交联化合物包括但不限于单价金属阳离子、多价金属阳离子和无机盐,包括碱金属和/或碱土金属硫酸盐、氯化物、硼酸盐、溴化物、柠檬酸盐、乙酸盐、乳酸盐以及它们的混合物。例如,阳离子交联化合物包括但不限于以下中的一者或多者:硫酸钙、氯化钠、硫酸钾、碳酸钠、氯化锂、磷酸三钾、硼酸钠、溴化钾、氟化钾、碳酸氢钠、氯化钙、氯化镁、柠檬酸钠、乙酸钠、乳酸钙、硫酸镁、氟化钠或它们的混合物。
[0128]
当持续释放递送系统包含至少一种亲水性化合物和至少一种阳离子交联化合物时,亲水性化合物与阳离子交联化合物的重量比在约1:9至约9:1、约1:8至约8:1、约1:7至约7:1、约1:6至约6:1、约1:5至约5:1、约1:4至约4:1、约1:3至约3:1或约1:2至约2:1的范围内。在一些实施方案中,亲水性化合物与阳离子交联化合物的重量比在约1:3至约3:1的范围内。在一些实施方案中,亲水性化合物与阳离子交联化合物的重量比是约3:1、约2.75:1、约2.5:1、约2.25:1、约2:1、约1.8:1、约1.6:1、约1.4:1、约1.2:1、约1:1、约1:1.25、约1:1.5或约1:2。在一些实施方案中,亲水性化合物与阳离子交联化合物的重量比是约1:1.25。在一些实施方案中,亲水性化合物与阳离子交联化合物的重量比是约1.2:1。在一些实施方案中,亲水性化合物与阳离子交联化合物的重量比是约2:1。在一些实施方案中,亲水性化合物与阳离子交联化合物的重量比是约2.8:1。
[0129]
在一些实施方案中,至少一种亲水性化合物以约5重量%至约80重量%的量存在于持续释放递送系统中;至少一种阳离子交联剂以约0.5重量%至约30重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约20重量%至约80重量%的量存在于持续释放递送系统中。在一些实施方案中,至少一种亲水性化合物以约8重量%至约30重量%的量存在于持续释放递送系统中;至少一种阳离子交联剂以约10重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约20重量%至约70重量%的量存在于持续释放递送系统中。在一些实施方案中,至少一种亲水性化合物以约5重量%至约30重量%的量存在于持续释放递送系统中;至少一种阳离子交联剂以约5重量%至约20重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约20重量%至约85重量%的量存在于持续释放递送系统中。在一些实施方案中,至少一种亲水性化合物以约10重量%至约20重量%的量存在于持续释放递送系统中;至少一种阳离子交联剂以约5重量%至约15重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约50重量%至约85重量%的量存在于持续释放递送系统中。
[0130]
在一些实施方案中,至少一种亲水性化合物以约8重量%、约9重量%、约10重
量%、约11重量%、约12重量%、约13重量%、约14重量%、约15重量%、约16重量%、约17重量%、约18重量%、约19重量%、约20重量%、约22重量%、约24重量%、约26重量%、约28重量%或约30重量%的量存在于持续释放递送系统中;至少一种阳离子交联剂以约5重量%、约6重量%、约7重量%、约8重量%、约9重量%、约10重量%、约11重量%、约12重量%、约13重量%、约14重量%、约15重量%、约16重量%、约17重量%、约18重量%、约19重量%或约20重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约40重量%、约45重量%、约50重量%、约55重量%、约60重量%、约65重量%、约70重量%、约80重量%或约85重量%的量存在于持续释放递送系统中。在一些实施方案中,至少一种亲水性化合物以约10重量%、约11重量%、约12重量%、约13重量%、约14重量%、约15重量%、约16重量%、约17重量%、约18重量%、约19重量%或约20重量%的量存在于持续释放递送系统中;至少一种阳离子交联剂以约5重量%、约6重量%、约7重量%、约8重量%、约9重量%、约10重量%、约11重量%、约12重量%、约13重量%、约14重量%、约15重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约55重量%、约60重量%、约65重量%、约70重量%、约80重量%或约85重量%的量存在于持续释放递送系统中。在一些实施方案中,至少一种亲水性化合物以约8重量%、约12重量%或约20重量%的量存在于持续释放递送系统中;至少一种阳离子交联剂以约10重量%、约12重量%或约14重量%的量存在于持续释放递送系统中;并且至少一种药物稀释剂以约40重量%、约60重量%或约70重量%的量存在于持续释放递送系统中。
[0131]
在一些实施方案中,持续释放递送系统包含约0.5%至约80%的刺槐豆胶、约5%至约80%的黄原胶、约20%至约80%的甘露醇和约0.5%至80%的二水合硫酸钙。在一些实施方案中,持续释放递送系统包含约12%至约47%的刺槐豆胶、约8%至约31%的黄原胶、约20%至约78%的甘露醇和约0.5%至25%的二水合硫酸钙。在一些实施方案中,持续释放递送系统包含约15%至约25%的刺槐豆胶、约10%至约20%的黄原胶、约50%至约85%的甘露醇和约5%至15%的二水合硫酸钙。在一些实施方案中,持续释放递送系统包含约18%的刺槐豆胶、约12%的黄原胶、约60%的甘露醇和约10%的二水合硫酸钙。在一些实施方案中,持续释放递送系统包含约12%的刺槐豆胶、约8%的黄原胶、约70%的甘露醇和约10%的二水合硫酸钙。在一些实施方案中,持续释放递送系统包含约20%的刺槐豆胶、约30%的黄原胶、约40%的甘露醇和约10%的二水合硫酸钙。在一些实施方案中,持续释放递送系统包含约30%的刺槐豆胶、约20%的黄原胶、约40%的甘露醇和约10%的二水合硫酸钙。在一些实施方案中,持续释放递送系统包含约42%的刺槐豆胶、约28%的黄原胶、约20%的甘露醇和约10%的二水合硫酸钙。
[0132]
这种持续释放系统的组分(例如,至少一种亲水性化合物和至少一种交联剂;或至少一种亲水性化合物和至少一种阳离子交联化合物)的两种性质是它在暴露于液体后形成凝胶基质是所述化合物/剂的快速水合以及形成具有高凝胶强度的凝胶基质的能力。实现缓慢释放凝胶基质所需的这两种性质通过化合物的特定组合(例如,至少一种亲水性化合物和至少一种交联剂;或至少一种亲水性化合物和至少一种阳离子交联化合物)最大化。例如,亲水性化合物(例如,黄原胶)具有提供快速水合的优异水芯吸性质。亲水性化合物与能够使亲水性化合物的刚性螺旋有序结构交联的材料(例如,交联剂和/或阳离子交联化合物)的组合由此协同作用,以提供凝胶基质的高于预期的粘度(即高凝胶强度)。
[0133]
在一些实施方案中,持续释放组合物与一种或多种湿润剂(例如,聚乙氧基化蓖麻油、聚乙氧基化氢化蓖麻油、来自蓖麻油的聚乙氧基化脂肪酸、来自氢化蓖麻油的聚乙氧基化脂肪酸)、一种或多种润滑剂(例如,硬脂酸镁、硬脂酰富马酸钠等)、一种或多种缓冲剂、一种或多种着色剂和/或其他常规成分进一步掺混。
[0134]
在一些实施方案中,本发明方法中采用的组合物可含有另外的药物赋形剂。例如,在一些实施方案中,可将富马酸添加至本文所述的制剂中。
[0135]
在其他实施方案中,可将非功能性涂层(例如)添加至本文所述的组合物中。
[0136]
在一些实施方案中,本文所述的组合物还包含第二亲水性化合物。在一些实施方案中,第二亲水性化合物是纤维素醚。在一些实施方案中,第二亲水性化合物是羟烷基纤维素或羧烷基纤维素。在一些实施方案中,第二亲水性化合物是羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、羧甲基纤维素或它们的混合物。在一些实施方案中,第二亲水性化合物是乙基纤维素或蜡(例如,包括但不限于鲸蜡醇、硬脂醇、白蜡或巴西棕榈蜡)。第二亲水性化合物以约5重量%至约45重量%、约5重量%至约25重量%、约10重量%至约20重量%或12重量%至约18重量%范围内的量存在于所述制剂中。在一些实施方案中,第二亲水性化合物以约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约30%、约35%、约40%或约45%的量存在于所述制剂中。
[0137]
在一些实施方案中,第二亲水性化合物与纳布啡或药学上可接受的盐、溶剂合物或酯的重量比在约5:1至约1:5、约4:1至约1:4、约3:1至约1:3、约2:1至约1:2、约1:1至约1:3或约1:1至约1:2的范围内。在一些实施方案中,第二亲水性化合物与纳布啡或药学上可接受的盐、溶剂合物或酯的重量比是约5:1、约4:1、约3:1、约2:1、约1:1、约1:2、约1:3、约1:4或约1:5。
[0138]
在一些实施方案中,第二亲水性化合物与持续释放递送系统的重量比在约10:1至约1:10、约8:1至约1:8、约6:1至约1:6、约4:1至约1:4、约2:1至约1:3、约1:1至约1:10、约1:1至约1:6或约1:2至约1:6的范围内。在一些实施方案中,第二亲水性化合物与持续释放递送系统的重量比是约10:1、约8:1、约6:1、约4:1、约2:1、约1:1、约1:1.5、约1:2、约1:2.5、约1:3、约1:4、约1:5、约1:6、约1:7、约1:8、约1:9或约1:10。
[0139]
在一些实施方案中,口服持续释放固体剂型制剂包含约1mg至200mg的盐酸纳布啡和约10mg至约420mg的持续释放递送系统。在这些实施方案中,持续释放递送系统包含约12%至约42%的刺槐豆胶;约8.0%至约28%的黄原胶;约20%至约70%的甘露醇;和约5%至约20%的二水合硫酸钙。在一些实施方案中,本发明的方法可采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约5mg至约80mg的盐酸纳布啡和约80mg至约360mg的持续释放递送系统。在一些实施方案中,本发明的方法可采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约50mg至约150mg的盐酸纳布啡和约100mg至约300mg的持续释放递送系统。
[0140]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约15mg的盐酸纳布啡和约25mg至约225mg(例如约195mg)的持续释放递送系统。在这些实施方案中,持续释放递送系统包含约14%的刺槐豆胶;约9%的黄
原胶;约47%的甘露醇;和约8%的二水合硫酸钙。
[0141]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约30mg的盐酸纳布啡和约25mg至约225mg(例如约180mg)的持续释放递送系统。在这些实施方案中,持续释放递送系统包含约18%的刺槐豆胶;约12%的黄原胶;约60%的甘露醇;和约10%的二水合硫酸钙。
[0142]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约60mg的盐酸纳布啡和约25mg至约225mg(例如约120mg)的持续释放递送系统。在这些实施方案中,持续释放递送系统包含约10%的刺槐豆胶;约12%的黄原胶;约60%的甘露醇;和约10%的二水合硫酸钙。
[0143]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约5mg至约80mg的盐酸纳布啡和约80mg至约360mg的持续释放递送系统。
[0144]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约120mg的盐酸纳布啡和约25mg至约250mg(例如约240mg)的持续释放递送系统。在这些实施方案中,持续释放递送系统包含约18%的刺槐豆胶;约12%的黄原胶;约60%的甘露醇;和约10%的二水合硫酸钙。
[0145]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约30mg的盐酸纳布啡和约25mg至约350mg(例如约270mg或约360mg)的持续释放递送系统。在这些实施方案中,持续释放递送系统包含约18%的刺槐豆胶;约12%的黄原胶;约60%的甘露醇;和约10%的二水合硫酸钙。
[0146]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约45至约60mg的盐酸纳布啡和约100mg至约200mg的持续释放递送系统。在这些实施方案中,持续释放递送系统包含约15%至约25%的刺槐豆胶;约10%至约20%的黄原胶;约50%至约85%的甘露醇;和约5%至约15%的二水合硫酸钙。
[0147]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约30mg的盐酸纳布啡、约32.4mg的刺槐豆胶、约21.6mg的黄原胶、约108mg的甘露醇、约18mg的二水合硫酸钙、约35mg的羟丙基纤维素和约1.9mg的硬脂酸镁。
[0148]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约29.8mg的盐酸纳布啡、约32.2mg的刺槐豆胶、约21.4mg的黄原胶、约107mg的甘露醇、约18mg的二水合硫酸钙、约35mg的羟丙基纤维素和约1.9mg的硬脂酸镁。
[0149]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约60mg的盐酸纳布啡、约21.6mg的刺槐豆胶、约14.4mg的黄原胶、约72mg的甘露醇、约12mg的二水合硫酸钙、约30mg的羟丙基纤维素和约1.6mg的硬脂酸镁。
[0150]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约59.5mg的盐酸纳布啡、约21.4mg的刺槐豆胶、约14.3mg的黄原胶、约71mg的甘露醇、约12mg的二水合硫酸钙、约30mg的羟丙基纤维素和约1.6mg的硬脂酸镁。
[0151]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持
续释放固体剂型制剂包含约120mg的盐酸纳布啡、约43.2mg的刺槐豆胶、约28.8mg的黄原胶、约144mg的甘露醇、约24mg的二水合硫酸钙、约60mg的羟丙基纤维素和约3.2mg的硬脂酸镁。
[0152]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约119.0mg的盐酸纳布啡、约42.9mg的刺槐豆胶、约25.6mg的黄原胶、约143mg的甘露醇、约24mg的二水合硫酸钙、约60mg的羟丙基纤维素和约3mg的硬脂酸镁。
[0153]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约180mg的盐酸纳布啡、约64.8mg的刺槐豆胶、约43.2mg的黄原胶、约216mg的甘露醇、约36mg的二水合硫酸钙、约90mg的羟丙基纤维素、约5mg的硬脂酸镁和约25mg的富马酸。
[0154]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约180mg的盐酸纳布啡、约48.6mg的刺槐豆胶、约32.4mg的黄原胶、约162mg的甘露醇、约27mg的二水合硫酸钙、约60mg的羟丙基纤维素、约4mg的硬脂酸镁和约25mg的富马酸。
[0155]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约178.5mg的盐酸纳布啡、约48.2mg的刺槐豆胶、约32.2mg的黄原胶、约161mg的甘露醇、约27mg的二水合硫酸钙、约60mg的羟丙基纤维素、约4mg的硬脂酸镁和约25mg的富马酸。
[0156]
在一些实施方案中,本发明的方法采用口服持续释放固体剂型制剂,所述口服持续释放固体剂型制剂包含约30mg的盐酸纳布啡、约32.4mg的刺槐豆胶、约21.6mg的黄原胶、约108mg的甘露醇、约18mg的二水合硫酸钙、约35mg的羟丙基纤维素、约1.9mg的硬脂酸镁和约7.4mg的opadry ii白色。
[0157]
纳布啡的持续释放制剂是可经口施用的固体剂型制剂。口服固体剂型制剂的非限制性实例包括片剂、包含多个颗粒的胶囊、舌下片剂、粉末、颗粒、糖浆和经颊剂型或装置(例如,经颊贴剂、片剂等)。在一些实施方案中,片剂具有肠溶包衣或亲水性包衣。
[0158]
持续释放递送系统通过干法制粒或湿法制粒来制备,然后添加纳布啡或其药学上可接受的盐、溶剂合物或酯,尽管所述组分可通过附聚技术保持在一起以产生可接受的产品。在湿法制粒技术中,将组分(例如,亲水性化合物、交联剂、药物稀释剂、阳离子交联化合物、疏水性聚合物等)混合在一起,然后用一种或多种液体(例如,水、丙二醇、甘油、醇)润湿以产生湿润物质,随后干燥所述湿润物质。然后将干燥的物质用常规设备研磨成持续释放递送系统的颗粒。此后,将持续释放递送系统以所需量与纳布啡或其药学上可接受的盐、溶剂合物或酯以及任选的一种或多种湿润剂、一种或多种润滑剂、一种或多种缓冲剂、一种或多种着色剂、一种或多种第二亲水性化合物或其他常规成分混合以产生粒状组合物。持续释放递送系统和纳布啡可与例如高剪切混合器共混。纳布啡优选地精细且均匀地分散在持续释放递送系统中。将足以制成均匀批次的片剂的量的粒状组合物在常规生产规模的压片机中在典型的压缩压力,即约2,000
‑
16,000psi下进行压片。在一些实施方案中,不应将混合物压制至在暴露于液体后随后水合困难的程度。
[0159]
在一些实施方案中,通过干法制粒或湿法制粒制备纳布啡制剂。添加持续释放递
送系统的组分以及纳布啡或其药学上可接受的盐、溶剂合物或酯。或者,可通过附聚技术将所有组分保持在一起以产生可接受的产品。在湿法制粒技术中,将纳布啡或其药学上可接受的盐、溶剂合物或酯和组分(例如,亲水性化合物、交联剂、药物稀释剂、阳离子交联化合物、疏水性聚合物等)混合在一起,然后用一种或多种液体(例如,水、丙二醇、甘油、醇)润湿以产生湿润物质,随后干燥所述湿润物质。然后将干燥的物质用常规设备研磨成颗粒。任选地,还将一种或多种湿润剂、一种或多种润滑剂、一种或多种缓冲剂、一种或多种着色剂、一种或多种第二亲水性化合物或其他常规成分添加至制粒。将足以制成均匀批次的片剂的量的粒状组合物在常规生产规模的压片机中在典型的压缩压力,即约2,000
‑
16,000psi下进行压片。在一些实施方案中,不应将混合物压制至在暴露于液体后随后水合困难的程度。
[0160]
粒状组合物的平均粒度按重量计是约50μm至约400μm。在一些实施方案中,按重量计的平均粒度是约185μm至约265μm。粒状组合物的平均密度是约0.3g/ml至约0.8g/ml。在一些实施方案中,平均密度是约0.5g/ml至约0.7g/ml。由制粒形成的片剂通常具有约4kp至约22kp的硬度。制粒的平均流量是约25至约40g/sec。
[0161]
在一些实施方案中,本发明的方法可采用多层固体剂型,其中所述层被配制为以不同的速率释放盐酸纳布啡。例如,在一些实施方案中,第二层是包括纳布啡或其药学上可接受的盐、溶剂合物或酯的延长释放层和被设计为以受控的速率释放纳布啡或其药学上可接受的盐、溶剂合物或酯的持续释放递送系统,以使得在延长的时间段(例如,约8至约12小时)内维持治疗有效的血液水平。第一层是包括纳布啡或其药学上可接受的盐、溶剂合物或酯的制剂的立即释放层,所述立即释放层被设计为以比第二层的速率更快的速率释放纳布啡或其药学上可接受的盐、溶剂合物或酯,以在即刻时间段(例如,约1至约2小时)内达到治疗有效的血液水平。在一些实施方案中,第一层包括持续释放递送系统。在一些实施方案中,第一层不包括持续释放递送系统。
[0162]
在一些实施方案中,第二层与第一层的重量比是约10:1至约1:10、约9:1至约1:9、约8:1至约1:8、约7:1至约1:7、约6:1至约1:6、约5:1至约1:5、约4:1至约1:4、约3:1至约1:3、约2:1至约1:2。在一些实施方案中,第二层与第一层的重量比是约5:1至约1:5。在另一实施方案中,第二层与第一层的重量比是约1:1至约1:2。在一些实施方案中,第二层与第一层的重量比是约1:1、约1:1.2、约1:1.4、约1:1.6、约1:1.8或约1:2。在一些实施方案中,第二层与第一层的重量比是约1:2。在一些实施方案中,第二层与第一层的重量比是约1:1.4。在一些实施方案中,第二层与第一层的重量比是约3:1、约2.5:1、约2:1、约1.5:1。在一些实施方案中,第二层与第一层的重量比是约2.5:1。
[0163]
多层剂型的持续释放递送系统包含:(i)至少一种亲水性化合物、至少一种交联剂和至少一种药物稀释剂;(ii)至少一种亲水性化合物、至少一种交联剂、至少一种药物稀释剂和至少一种不同于第一交联剂的阳离子交联剂;或(iii)至少一种亲水性化合物、至少一种阳离子交联化合物和至少一种药物稀释剂。在一些实施方案中,当第一层包括持续释放递送系统时,所述第一层的持续释放递送系统包含与第二层的持续释放递送系统相同的组分(例如,第一层和第二层两者均是以上列出的实施方案(i)
‑
(iii)之一)。在其他实施方案中,第一层的持续释放递送系统包含与第二层的持续释放递送系统不同的组分(例如,第一层是以上列出的实施方案(i),而第二层是以上列出的实施方案(iii))。应认识到,任一层的持续释放递送系统可以是以上列出的实施方案(i)
‑
(iii)之一。此外,应认识到,在一些
实施方案中,第一层不包括持续释放递送系统。
[0164]
持续释放递送系统通常以约10mg至约420mg范围内的量存在于第二层(例如,延长释放层)中。在一些实施方案中,持续释放递送系统以约110mg至约200mg范围内的量存在于第二层中。在一些实施方案中,持续释放递送系统以约110mg至约150mg范围内的量存在于第二层中。在一些实施方案中,持续释放递送系统以约90mg至约150mg范围内的量存在于第二层中。在一些实施方案中,持续释放递送系统以约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg或约200mg的量存在于第二层中。在一些实施方案中,持续释放递送系统以约123mg的量存在于第二层中。在一些实施方案中,持续释放递送系统以约101mg的量存在于第二层中。在一些实施方案中,持续释放递送系统以约92mg的量存在于第二层中。在一些实施方案中,持续释放递送系统以约112.5mg的量存在于第二层中。在一些实施方案中,持续释放递送系统以约135mg的量存在于第二层中。在一些实施方案中,持续释放递送系统以约150mg的量存在于第二层中。
[0165]
纳布啡或其药学上可接受的盐、溶剂合物或酯通常以约15mg至约60mg范围内的量存在于第二层中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约30mg至约60mg范围内的量存在于第二层中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约45mg至约60mg范围内的量存在于第二层中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约15mg的量存在于第二层中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约30mg的量存在于第二层中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约45mg的量存在于第二层中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约15mg、约30mg、约60mg、约90mg、约120mg或约180mg的量存在于第二层中。
[0166]
在一些实施方案中,第二层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的重量比是约10:1至约1:10、约9:1至约1:9、约8:1至约1:8、约7:1至约1:7、约6:1至约1:6、约5:1至约1:5、约4:1至约1:4、约3:1至约1:3或约2:1至约1:2。在一些实施方案中,第二层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的重量比是约1:2至约1:4。在一些实施方案中,第二层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的重量比是约1:1至约1:5。在一些实施方案中,第二层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的重量比是约1:1、约1:1.2、约1:1.4、约1:1.6、约1:1.8、约1:2、约1:2.5、约1:3或约1:3.5。在一些实施方案中,第二层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的重量比是约1:2.5。在一些实施方案中,第二层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的重量比是约1:3.3。在另一实施方案中,第二层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的重量比是约1:3。在一些实施方案中,第二层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例是约1:2。
[0167]
当持续释放递送系统存在于第一层(例如,立即释放层)中时,其通常以约0mg至约50mg范围内的量存在。在一些实施方案中,持续释放递送系统以约5mg至约25mg或约5mg至约15mg范围内的量存在于第一层中。在一些实施方案中,持续释放递送系统以约3mg至约9mg的量存在于第一层中。在一些实施方案中,持续释放递送系统以约4mg至约6mg的量存在
于第一层中。在一些实施方案中,持续释放递送系统以约2mg、约4mg、约6mg、约8mg、约10mg、约12mg、约14mg、约15mg、约16mg、约18mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg或约50mg的量存在于第二层中。在一些实施方案中,持续释放递送系统以约6mg的量存在于第一层中。
[0168]
在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯通常以约5mg至约180mg范围内的量存在于第一层(例如,立即释放层)中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约5mg至约25mg或约10mg至约20mg范围内的量存在于第一层中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约5mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg或约50mg的量存在于第一层中。在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯以约15mg、约30mg、约60mg、约90mg、约120mg或约180mg的量存在于第一层中。
[0169]
在一些实施方案中,当第一层包括持续释放递送系统时,所述第一层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例是约10:1至约1:10、约9:1至约1:9、约8:1至约1:8、约7:1至约1:7、约6:1至约1:6、约5:1至约1:5、约4:1至约1:4、约3:1至约1:3、约2:1至约1:2。在一些实施方案中,第一层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例是约2:1至约4:1。在一些实施方案中,第一层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例是约5:1、约4.5:1、约4:1、约3.5:1、约3:1、约2.5:1、约2:1、约1.5:1或约1:1。在一些实施方案中,第一层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例是约2.5:1。在一些实施方案中,第一层中纳布啡或其药学上可接受的盐、溶剂合物或酯与持续释放递送系统的比例是约3:1。
[0170]
在一些实施方案中,所述多层剂型还包含药物崩解剂。崩解剂促进来自立即释放层的纳布啡或其可药学上可接受的盐、溶剂合物或酯的溶出和吸收。药物崩解剂的非限制性实例包括交联羧甲基纤维素钠、羟基乙酸淀粉、交联维酮和未改性淀粉。在一些实施方案中,崩解剂在所述剂型的第一层(即,立即释放层)中。崩解剂通常以约1.5mg至约4.5mg的量存在于所述层中。在一些实施方案中,崩解剂以约3mg的量存在。在一些实施方案中,崩解剂以约2重量%
‑
10重量%的量存在于所述层中。在一些实施方案中,崩解剂以约5重量%的量存在于所述层中。当所述层含有持续释放递送系统时,持续释放递送系统与崩解剂的重量比在约5:1至约1:5的范围内。在一些实施方案中,持续释放递送系统与崩解剂的比例在约1:1至约3:1的范围内。在其他实施方案中,持续释放递送系统与崩解剂的比例在约2:1的范围内。
[0171]
在一些实施方案中,通过首先分别制备立即释放层和延长释放层共混物来制备多层片剂。如上所述制备延长释放层。然后将延长释放层的湿法制粒干燥并研磨至适当的尺寸。添加硬脂酸镁并与研磨的制粒混合。通过首先将纳布啡或其可药学上可接受的盐、溶剂合物或酯与一种或多种稀释剂(例如,微晶纤维素)混合来制备立即释放层。然后将此混合物任选地与一种或多种崩解剂混合。将共混物与硬脂酸镁混合。最后,将立即释放层共混物和延长释放层共混物压制成多层(例如双层)片剂。
[0172]
在一些实施方案中,制剂的某些组分如亲水性化合物(例如,黄原胶)的化学性质
是使得所述组分被认为是对纳布啡的溶解度和沿胃肠道长度的ph值变化基本上不敏感的自缓冲剂。此外,据信所述组分的化学性质类似于某些已知的粘膜
‑
粘附物质,如聚卡波非。粘膜
‑
粘附性质对于经颊递送系统是期望的。因此,持续释放制剂可在胃肠道中与粘蛋白松散地相互作用,并且由此提供另一种方式,通过所述方式实现纳布啡的恒定递送速率。
[0173]
以上讨论的现象(粘膜
‑
粘附性质)是一种机制,通过所述机制,持续释放制剂可与粘蛋白和胃肠道流体相互作用,并且提供纳布啡的恒定递送速率。
[0174]
当通过usp程序药物释放通用章节<711>溶出(以引用的方式整体并入本文)测量时,用于本发明方法中的持续释放制剂通常表现出在1小时后约15重量%至约50重量%纳布啡、在4小时后约45重量%至约80重量%纳布啡或在10小时后至少约80重量%纳布啡的体外溶出。在一些实施方案中,使用一种或多种不同的水不溶性化合物和/或水溶性化合物的混合物、使用不同的增塑剂、改变持续释放膜的厚度,包括在包衣中提供释放调节化合物和/或通过提供穿过包衣的通路来改变持续释放制剂的体外和体内释放特征。在一些实施方案中,使用设备usp iii型/250ml在ph 6.8、37℃和15dpm下测定溶出速率。在一些实施方案中,使用在37℃和15dpm下在ph变化(0
‑
1小时ph 1.2,在1小时后ph 4.5,在2小时后ph 6.8)中进行的设备usp iii型/250ml测定溶出速率。
[0175]
在一些实施方案中,持续释放制剂在约6小时后具有约50重量%至约100重量%纳布啡的体外溶出。在一些实施方案中,持续释放制剂在约6小时后具有约75重量%至约100重量%纳布啡的体外溶出。在其他实施方案中,持续释放制剂从约6小时至约8小时具有约75重量%至约100重量%纳布啡的体外溶出。在其他实施方案中,持续释放制剂在约12小时后具有约80重量%至约100重量%纳布啡的体外溶出。在其他实施方案中,持续释放制剂从约12小时至约24小时具有约80重量%至约100重量%纳布啡的体外溶出。在一些实施方案中,持续释放制剂在约8小时至约12小时后具有约80%至约100%的体外溶出。在其他实施方案中,持续释放制剂在约1小时后具有约15重量%至约75重量%纳布啡的体外溶出。在其他实施方案中,持续释放制剂在约1小时后具有约50重量%纳布啡的体外溶出。在一些实施方案中,持续释放制剂在约1小时后具有约50重量%纳布啡的体外溶出,并且从约6小时至约8小时具有约75重量%至约100重量%纳布啡的体外溶出。在一些实施方案中,持续释放制剂在约1小时后具有约50重量%纳布啡的体外溶出,并且从约8小时至约12小时具有约75重量%至约100重量%纳布啡的体外溶出。在一些实施方案中,持续释放制剂在约1小时后具有约50重量%纳布啡的体外溶出,并且从约12小时至约24小时具有约75重量%至约100重量%纳布啡的体外溶出。在一些实施方案中,持续释放制剂在约1小时后具有约50重量%纳布啡的体外溶出,并且在约12小时后具有约80重量%至约100重量%纳布啡的体外溶出。
[0176]
当片剂是具有第一延长释放层和第二立即释放层的多层剂型时,持续释放制剂在约1小时后具有约25重量%至约75重量%纳布啡的体外溶出。在一些实施方案中,多层剂型在约1小时后具有约25重量%纳布啡的体外溶出。在一些实施方案中,多层剂型在约1小时后具有约50重量%纳布啡的体外溶出。在一些实施方案中,多层剂型在约6
‑
8小时后具有约75%至约100%纳布啡的体外溶出。在一些实施方案中,多层剂型在约8
‑
12小时后具有约75%至约100%纳布啡的体外溶出。在一些实施方案中,多层剂型在约12
‑
24小时后具有约75%至约100%纳布啡的体外溶出。在一些实施方案中,多层剂型在约12小时后具有约75%至约100%纳布啡的体外溶出。
[0177]
在一些实施方案中,当向具有正常或受损(例如,降低的)肾功能的患者经口施用时,本文所述的持续释放制剂表现出以下体内特征:(a)纳布啡的峰值血浆水平在约4小时至约6小时(例如对于施用后肾损害的患者)或约3小时至约5小时(例如对于施用后无肾损害的患者)内发生;(b)从给药约30分钟至给药约6小时内纳布啡止咳、抗呼吸急促或抗呼吸困难作用起效;(c)纳布啡止咳、抗呼吸急促或抗呼吸困难作用的持续时间是约2至约24小时;以及(d)相较于经口施用的纳布啡水溶液,相对纳布啡生物利用度是约0.5、约1、约1.5或介于约0.5至约1.5之间。止咳、抗呼吸急促或抗呼吸困难作用的起效时间可至少取决于给药和咳嗽、呼吸急促或呼吸困难症状的严重程度。在一些实施方案中,纳布啡止咳、抗呼吸急促或抗呼吸困难作用的持续时间是至少约8小时。在一些实施方案中,纳布啡止咳、抗呼吸急促或抗呼吸困难作用的持续时间是至少约9小时。在一些实施方案中,纳布啡止咳、抗呼吸急促或抗呼吸困难作用的持续时间是至少约10小时。在一些实施方案中,纳布啡止咳、抗呼吸急促或抗呼吸困难作用的持续时间是至少约11小时。在一些实施方案中,纳布啡止咳、抗呼吸急促或抗呼吸困难作用的持续时间是至少约12小时。在一些实施方案中,纳布啡止咳、抗呼吸急促或抗呼吸困难作用的持续时间是约6小时、8小时、10小时、12小时、15小时或18小时。在一些实施方案中,相较于经口施用的纳布啡水溶液,相对纳布啡生物利用度是约0.94。在一些实施方案中,相较于经口施用的纳布啡水溶液,相对纳布啡生物利用度是约1.35。
[0178]
在一些实施方案中,持续释放纳布啡制剂提供口服单位剂型,所述口服单位剂型包含纳布啡或其药学上可接受的盐、溶剂合物或酯。所述口服剂型在至少约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时、约13小时、约14小时、约15小时、约16小时、约17小时、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时或约24小时的时间段内提供止咳、抗呼吸急促或抗呼吸困难作用。在一些实施方案中,所述口服剂型在约6
‑
18小时、约8
‑
16小时、约8
‑
12小时、约8至约24小时、约12至约24小时、约18至约24小时或约8
‑
10小时的时间段内提供止咳、抗呼吸急促或抗呼吸困难作用。所述口服剂型在约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时、约13小时、约14小时、约15小时、约16小时、约17小时、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时或约24小时的时间段内提供止咳、抗呼吸急促或抗呼吸困难作用。
[0179]
在一些实施方案中,所述口服剂型提供特征在于一个或多个峰、然后平稳区域的纳布啡血浆水平。平稳区域被表征为具有相对一致的纳布啡血浆水平(例如,纳布啡的血浆水平从时间点至时间点并不始终增加或降低)。在一些实施方案中,平稳区域的特征在于具有一致的纳布啡平均血浆水平。平稳区域与平稳区域之后的区域形成对比,在平稳区域之后的区域中纳布啡的血浆水平通常从一个时间点至下一个时间点降低。在一些实施方案中,平稳区域具有至少约1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时或约12小时的持续时间。在一些实施方案中,平稳区域具有约1小时至约12小时、约2小时至约10小时、约2小时至约8小时、约2小时至约7小时或约4小时至约10小时、约4小时至约8小时或约4小时至约6小时的持续时间。在一些实施方案中,在平稳区域中的每个时间点纳布啡的血浆水平在平稳区域中的平均血浆水平的约75%至约125%的范围内。在一些实施方案中,在平稳区域中的每个时间点纳布啡的血浆水平在平稳区域中的平均血浆水平的约80%至约120%的范围内。在一些实施方案中,在平稳区域
中的每个时间点纳布啡的血浆水平在平稳区域中的平均血浆水平的约85%至约115%的范围内。在一些实施方案中,在平稳区域中的每个时间点纳布啡的血浆水平在平稳区域中的平均血浆水平的约90%至约110%的范围内。
[0180]
在一些实施方案中,在平稳区域中观察到的纳布啡的最低血浆水平低于平稳区域中的所有时间点的平均血浆水平不超过约25%。在一些实施方案中,在平稳区域中观察到的纳布啡的最低血浆水平低于平稳区域中的平均血浆水平不超过约20%。在一些实施方案中,在平稳区域中观察到的纳布啡的最低血浆水平低于平稳区域中的平均血浆水平不超过约15%。在一些实施方案中,在平稳区域期间观察到的纳布啡的最低血浆水平在平稳区域中的平均血浆水平的约75%至约100%的范围内。在一些实施方案中,在平稳区域期间观察到的纳布啡的最低血浆水平在平稳区域中的平均血浆水平的约80%至约100%的范围内。在一些实施方案中,在平稳区域期间观察到的纳布啡的最低血浆水平在平稳区域中的平均血浆水平的约85%至约100%的范围内。在一些实施方案中,在平稳区域期间观察到的纳布啡的最低血浆水平在平稳区域中的平均血浆水平的约80%至约95%的范围内。
[0181]
共同疗法
[0182]
尽管可将组合物作为唯一的活性药物成分施用,但是在其他实施方案中,所述组合物也可与已知针对咳嗽和/或呼吸困难在治疗上有效和/或补充纳布啡的作用的一种或多种成分组合使用。例如,在一些实施方案中,本发明的方法可将纳布啡或其药学上可接受的盐、溶剂合物或酯与一种或多种止咳剂、抗呼吸急促剂或抗呼吸困难剂结合使用。在一些实施方案中,与纳布啡或其药学上可接受的盐、溶剂合物或酯组合的止咳剂包括μ阿片样激动剂(如吗啡、可待因、羟考酮、右美沙芬、利多卡因、曲马多)、抗惊厥剂和抗神经性疼痛药物(如加巴喷丁、普瑞巴林)、抗抑郁剂(如阿米替林)、肺抗纤维化剂如吡非尼酮和尼达尼布类固醇如布地奈德和强的松、质子泵抑制剂(如艾美拉唑、异丙托溴铵、色甘酸盐、色甘酸钠和沙利度胺)、κ阿片样激动剂(如纳呋拉啡和地克法林)、μ阿片样拮抗剂(如纳洛酮和纳曲酮)。在一些实施方案中,与纳布啡或其药学上可接受的盐、溶剂合物或酯组合的抗呼吸困难剂包括抗焦虑药如苯并地西泮(benzodiazepam)和抗纤维化剂如吡非尼酮和尼达尼布
[0183]
在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯不与第二止咳剂、抗呼吸急促剂或抗呼吸困难剂组合施用,例如共同配制或分开施用。
[0184]
在一些实施方案中,纳布啡或其药学上可接受的盐、溶剂合物或酯与一种或多种用于治疗ipf咳嗽、呼吸急促或呼吸困难的剂结合施用。在一些实施方案中,用于治疗ipf咳嗽、呼吸急促或呼吸困难的剂选自由以下组成的组:吡非尼酮、尼达尼布、n
‑
乙酰半胱氨酸、色甘酸钠、沙利度胺、吉法匹生、司洛匹坦和奥维匹坦。
[0185]
给药
[0186]
本公开提供了通过向有需要的患者施用有效量的纳布啡或其药学上可接受的盐、溶剂合物或酯来治疗咳嗽、呼吸急促或呼吸困难的方法。有效量是足以消除或显著减轻咳嗽、呼吸急促或呼吸困难症状或缓解那些症状(例如,与治疗前存在的症状相比,减轻症状,如咳嗽频率或呼吸急促)的量。本发明的方法中采用的制剂可将纳布啡掺入持续释放制剂中,以使得所述制剂提供纳布啡的治疗有效血浆水平以用于治疗咳嗽、呼吸急促或呼吸困
难。
[0187]
根据本公开的一些实施方案,施用纳布啡或其药学上可接受的盐、溶剂合物或酯提供统计上显著的治疗作用。在一些实施方案中,统计上显著的治疗作用是基于由美国,例如fda或其他国家的一个或多个监管机构提供的一个或多个标准或准则来确定。在一些实施方案中,基于从监管机构批准的临床试验设置和/或程序获得的结果来确定统计上显著的治疗作用。
[0188]
在一些实施方案中,基于至少20、50、60、100、200、300、400、500、600、700、800、900、1000或2000的患者群体来确定统计上显著的治疗作用。在一些实施方案中,基于从随机化和双盲临床试验设置获得的数据来确定统计上显著的治疗作用。在一些实施方案中,基于p值小于或等于约0.05、0.04、0.03、0.02或0.01的数据来确定统计上显著的治疗作用。在一些实施方案中,基于置信区间大于或等于95%、96%、97%、98%或99%的数据来确定统计上显著的治疗作用。在一些实施方案中,在本公开所提供的方法的iii期临床试验例如由美国的fda批准下来确定统计上显著的治疗作用。
[0189]
在一些实施方案中,通过对用纳布啡或其可药学上可接受的盐、溶剂合物或酯以及任选地与标准护理组合治疗的患者进行的随机化双盲临床试验来确定统计上显著的治疗作用。在一些实施方案中,通过随机化临床试验并使用利用咳嗽计数监测装置测量的白天咳嗽频率作为主要功效参数以及任选地与任何其他普遍接受的用于咳嗽和/或呼吸困难评估的标准组合来确定统计上显著的治疗作用。
[0190]
通常,统计分析可包括监管机构(例如美国或欧洲或任何其他国家的fda)所允许的任何合适的方法。在一些实施方案中,统计分析包括非分层分析,例如来自kaplan
‑
meier、jacobson
‑
truax、gulliken
‑
lord
‑
novick、edwards
‑
nunnally、hageman
‑
arrindel和hierarchical linear modeling(hlm)的对数秩分析,以及cox回归分析。
[0191]
在本公开的一些实施方案中,按每天一次或两次施用纳布啡,以提供慢性咳嗽的咳嗽症状的有效缓解。在一些实施方案中,每日总剂量是约15mg、约10mg、约30mg、约60mg、约90mg、约120mg、约180mg、约240mg、约360mg或约480mg。在一些实施方案中,所述需要治疗慢性咳嗽的患者是患有肺病的患者。在一些实施方案中,所述肺病是间质性肺病。在一些实施方案中,所述间质性肺病选自由以下组成的组:特发性肺纤维化、超敏性肺炎、结节病、石棉沉着症、闭塞性细支气管炎、组织细胞增生症x、慢性嗜酸粒细胞性肺炎、胶原血管病、肉芽肿性血管炎、古德帕斯丘综合征和肺泡蛋白沉积症。在一些实施方案中,所述间质性肺病选自由以下组成的组:特发性肺纤维化、超敏性肺炎、结节病和石棉沉着症。在一些实施方案中,所述肺病是慢性阻塞性肺病(copd)。在一些实施方案中,所述copd与选自由以下组成的组的疾患相关:肺气肿、慢性支气管炎和α
‑1‑
抗胰蛋白酶(aat)缺乏症。在一些实施方案中,所述copd与选自由以下组成的组的刺激物相关:香烟烟雾、二手烟雾、管道烟雾、空气污染和工作场所暴露于粉尘、烟雾或烟气。
[0192]
在本公开的一些实施方案中,按每天一次或两次施用纳布啡,以提供与原因不明的慢性咳嗽相关的咳嗽症状的有效缓解。在一些实施方案中,每日总剂量是约30mg、约60mg、约90mg、约120mg、约180mg、约240mg、约360mg或约480mg。
[0193]
在本公开的一些实施方案中,按每天一次或两次施用纳布啡,以提供与难治性慢性咳嗽相关的咳嗽症状的有效缓解。在一些实施方案中,每日总剂量是约15mg、约20mg、
30mg、约60mg、约90mg、约120mg、约180mg、约240mg、约360mg或约480mg。
[0194]
在本公开的一些实施方案中,按每天一次或两次施用纳布啡,以提供与咳嗽超敏性综合征相关的咳嗽症状的有效缓解。在一些实施方案中,每日总剂量是约30mg、约60mg、约90mg、约120mg、约180mg、约240mg、约360mg或约480mg。
[0195]
在本公开的一些实施方案中,按每天一次或两次施用纳布啡,以提供与特发性肺纤维化相关的咳嗽、呼吸急促或呼吸困难的症状的有效缓解。在一些实施方案中,每日总剂量是约15mg、约10mg、约30mg、约60mg、约90mg、约120mg、约180mg、约240mg、约360mg或约480mg。
[0196]
在整个本公开中,其中所用的方法和剂量通常以用于“治疗咳嗽、呼吸急促或呼吸困难”的纳布啡(或其他止咳或抗呼吸急促或抗呼吸困难剂)的量表示,而不指定咳嗽、呼吸急促或呼吸困难与其相关的疾患。然而,本公开涵盖其中方法和剂量可有效治疗与特定疾患如ipf、难治性慢性咳嗽、原因不明的慢性咳嗽、超敏性肺炎、结节病、石棉沉着症、闭塞性细支气管炎、组织细胞增生症x、慢性嗜酸粒细胞性肺炎、胶原血管病、肉芽肿性血管炎、古德帕斯丘综合征和肺泡蛋白沉积症、copd(如与诸如肺气肿、慢性支气管炎和α
‑1‑
抗胰蛋白酶(aat)缺乏症的疾患相关的copd或与诸如香烟烟雾、二手烟雾、管道烟雾、空气污染和工作场所暴露于粉尘、烟雾或烟气的刺激物相关的copd)和本文所述的其他疾患相关的咳嗽、呼吸急促或呼吸困难。
[0197]
在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约15mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约20mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约30mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约40mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约60mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约90mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约120mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约180mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约240mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天至少约360mg。
[0198]
在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约15mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约20mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约30mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约40mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约60mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约90mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约120mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约180mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约
240mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约360mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡的每日总剂量可以是每天约480mg。
[0199]
在一些实施方案中,选择每天一次约15mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约20mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约10mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约30mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约15mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约40mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约20mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约60mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约30mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约90mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约45mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约120mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约60mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约180mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约90mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约240mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约120mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约360mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约180mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约480mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约240mg的纳布啡以提供咳嗽、呼吸急促或呼吸困难的显著减轻。
[0200]
在一些实施方案中,施用至有需要的患者的纳布啡的量呈药学上可接受的盐的形式,并且以提供给所述患者的纳布啡游离碱的等效量表示。
[0201]
在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天至少约14mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天至少约18mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天至少约27mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天至少约36mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天至少约54mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天至少约81mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天至少约108mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼
吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天至少约162mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天至少约216mg。
[0202]
在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天约14mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天约18mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天约27mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天约36mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天约54mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天约81mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天约108mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天约162mg。在一些实施方案中,对于治疗咳嗽、呼吸急促或呼吸困难,纳布啡游离碱的等效量的每日总剂量可以是每天约216mg。
[0203]
在一些实施方案中,选择每天一次约14mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约18mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约9mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约27mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约14mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约54mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约27mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约81mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约41mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约108mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约54mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约162mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约81mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约216mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约108mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约327mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约162mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天一次约436mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,选择每天两次约218mg等效量的纳布啡游离碱以提供咳嗽、呼吸急促或呼吸困难的显著减轻。
[0204]
患有慢性咳嗽的患者(包括ipf患者)的咳嗽减轻可通过多种方法确定。在一些实施方案中,可通过经由咳嗽严重程度数值评定量表(nrs)测试值、莱斯特咳嗽问卷得分、使用咳嗽计数监测装置测量的白天咳嗽频率、使用咳嗽计数监测装置测量的24小时咳嗽频率、使用咳嗽计数监测装置测量的夜间咳嗽频率、咳嗽生活质量问卷总值、临床整体变化印象(cgic)、promis项目库v1.0
‑
疲劳简式7a量表、ipf群体的圣乔治问卷(sgrq
‑
i)总得分、慢性肺病恶化工具1.1版电子日记工具总得分、评价呼吸道症状、(e
‑
rs
tm
)每日日记(e
‑
rs
tm
是工具的11种呼吸道症状项目衍生工具)咳嗽分量表得分、胸部症状分量表得分以及e
‑
rs
tm
总得分或它们的任何组合进行评价来确定剂量方案的有效性。在一些实施方案中,可通过经由使用咳嗽计数监测装置测量的白天咳嗽频率作为主要功效终点并结合诸如莱斯特咳嗽问卷得分的次要功效终点进行评价来确定剂量方案的有效性。
[0205]
呼吸急促或呼吸困难(包括ipf患者中)的减轻可通过多种方法确定。在一些实施方案中,可通过经由评价呼吸道症状(e
‑
rs
tm
)呼吸急促分量表得分(包括评估伴有活动性(呼吸困难)的呼吸急促)、borg呼吸困难量表值总得分、borg呼吸困难量表域(感觉
‑
感知、情感困扰或症状影响)、数值评定量表呼吸困难值、改良型医学研究委员会量表、promis库v1.0呼吸困难情绪反应量表、promis项目库v1.0呼吸困难严重程度
‑
简式10a量表、promis项目库v1.0呼吸困难特征量表或它们的任何组合进行评价来确定剂量方案的有效性。
[0206]
根据本公开的一些实施方案,选择纳布啡的每次施用的给药频率和剂量的量以提供用于治疗咳嗽、呼吸急促或呼吸困难的治疗作用。在一些实施方案中,选择纳布啡的每次施用的给药频率和剂量的量以提供用于治疗ipf咳嗽、呼吸急促或呼吸困难的治疗作用。
[0207]
根据本公开的一些实施方案,选择纳布啡的每次施用的给药频率和剂量的量以提供用于治疗与间质性肺病相关的疲劳的治疗作用。在一些实施方案中,间质性肺疾病是ipf。疲劳的减轻可通过各种方法来确定。在一些实施方案中,可通过经由promis项目库v1.0
‑
疲劳简式7a量表进行评价来确定剂量方案的有效性。
[0208]
根据本公开的一些实施方案,选择纳布啡的每次施用的给药频率和剂量以提供用于治疗慢性咳嗽的治疗作用。在一些实施方案中,选择纳布啡的每次施用的给药频率和剂量的量以提供用于治疗选自难治性慢性咳嗽和原因不明的慢性咳嗽的慢性咳嗽的治疗作用。
[0209]
根据本公开的一些实施方案,选择纳布啡的每次施用的给药频率和剂量的量以提供用于治疗咳嗽超敏性综合征的治疗作用。
[0210]
根据本公开的一些实施方案,选择纳布啡的每次施用的给药频率和剂量的量以提供用于治疗其他治疗难治的咳嗽、呼吸急促或呼吸困难的治疗作用。在一些实施方案中,选择每次施用纳布啡的给药频率和剂量的量以提供用于治疗与ipf相关的ipf咳嗽、呼吸急促或呼吸困难的治疗作用,所述ipf咳嗽、呼吸急促或呼吸困难是对于用选自吉法匹生、司洛匹坦和奥维匹坦的止咳剂治疗难治性的;对于用μ
‑
阿片样激动剂治疗难治性的;对于用吡非尼酮治疗难治性的;对于用尼达尼布治疗难治性的;对于用沙利度胺治疗难治性的;或对于用色甘酸钠治疗难治性的ipf咳嗽、呼吸急促或呼吸困难。
[0211]
在一些实施方案中,按每天一次或每天两次施用纳布啡或其药学上可接受的盐、
溶剂合物或酯持续至少一周,例如约1周、约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10周、约12周、约18周、约24周和约50周。
[0212]
在一些实施方案中,按每天一次或每天两次施用至少约30mg或约30mg的纳布啡或其药学上可接受的盐、溶剂合物或酯持续至少一周。在一些实施方案中,按每天一次或每天两次施用至少约60mg或约60mg的纳布啡或其药学上可接受的盐、溶剂合物或酯持续至少一周。在一些实施方案中,按每天一次或每天两次施用至少约90mg或约90mg的纳布啡或其药学上可接受的盐、溶剂合物或酯持续至少一周。在一些实施方案中,按每天一次或每天两次施用至少约120mg或约120mg的纳布啡或其药学上可接受的盐、溶剂合物或酯持续至少一周。在一些实施方案中,按每天一次或每天两次施用至少约180mg或约180mg的纳布啡或其药学上可接受的盐、溶剂合物或酯持续至少一周。在一些实施方案中,按每天一次或每天两次施用至少约240mg或约240mg的纳布啡或其药学上可接受的盐、溶剂合物或酯持续至少一周。在一些实施方案中,按每天一次或每天两次施用至少约360mg或约360mg的纳布啡或其药学上可接受的盐、溶剂合物或酯持续至少一周。
[0213]
根据一些实施方案,由本公开的方法提供的咳嗽、呼吸急促或呼吸困难的显著降低需要在患者经历咳嗽、呼吸急促或呼吸困难的显著减轻之前持续指定时间间隔(例如,至少一周)的治疗(即,在患者经历咳嗽、呼吸急促或呼吸困难的显著减轻之前存在诱导期)。在一些实施方案中,与治疗前相比,在治疗至少一周、至少两周、至少三周、至少四周、至少五周、至少六周、至少七周或至少八周后,患者经历咳嗽、呼吸急促或呼吸困难的显著减轻。在一些实施方案中,与治疗前相比,在治疗至少一周后,患者经历咳嗽、呼吸急促或呼吸困难的显著减轻。根据此实施方案,可使用本文所述的任何方法来表现出咳嗽、呼吸急促或呼吸困难的显著减轻(例如,与治疗之前相比,评价呼吸道症状(e
‑
rs
tm
)咳嗽分量表得分降低;与治疗前相比,使用咳嗽计数监测装置测量的白天咳嗽频率降低等)。
[0214]
在一些实施方案中,在治疗之后,患者经历ipf症状(如咳嗽、呼吸急促或呼吸困难)的显著减轻,其特征在于与治疗前相比,临床整体变化印象(cgic)提高至少一个点。在一些实施方案中,ipf症状减轻的特征在于与治疗前相比,cgic值在约1.0至约3.0个点范围内的提高,例如提高约1.0个点、约2.0个点、约3.0个点。
[0215]
在一些实施方案中,在治疗之后,患者经历与咳嗽频率降低有关的健康状况的显著改善,其特征在于与治疗前相比,关于患者的莱斯特咳嗽问卷得分的总得分提高至少约1.0个点。在一些实施方案中,与咳嗽频率降低有关的健康状况的改善的特征在于与治疗前相比,莱斯特咳嗽问卷得分在约0.5至约2.0个点范围内的提高,例如提高约0.5个点、约1.0个点、约1.5个点和约0.2个点。在一些实施方案中,与咳嗽频率降低有关的健康状况的改善的特征在于与治疗前相比,三个莱斯特咳嗽问卷域(身体、心理或社会)中的任一者得分在约0.5至约2.0个点范围内的提高,例如,提高约0.5个点、约1.0个点、约1.5个点和约2.0个点。
[0216]
在一些实施方案中,在治疗之后,患者经历咳嗽的显著减轻,其特征在于与治疗前相比,使用咳嗽计数监测装置测量的白天咳嗽频率降低至少约30%。在一些实施方案中,咳嗽减轻的特征在于与治疗前相比,白天咳嗽频率在10%至约100%范围内的下降,例如,下降约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%和约100%。
[0217]
在一些实施方案中,在治疗之后,患者经历咳嗽的显著减轻,其特征在于与治疗前
相比,咳嗽严重程度数值评定量表(nrs)值降低至少一个点。在一些实施方案中,咳嗽减轻的特征在于与治疗前相比,nrs咳嗽值在约1.0至约9.0个点范围内的下降,例如,下降约1.0个点、约2.0个点、约3.0个点、约4.0个点、约5.0个点、约6.0个点、约7.0个点、约8.0个点、约9.0个点和约10.0个点。
[0218]
在一些实施方案中,在治疗之后,由于咳嗽频率降低,患者经历健康相关生活质量的显著改善,其特征在于与治疗前相比,咳嗽生活质量问卷总值提高至少4个点。在一些实施方案中,健康相关生活质量的改善的特征在于与治疗前相比,总值在约3.0至约6.0个点范围内的提高,例如,提高约3.0个点、约3.5个点、约4.0个点、约4.5个点、约5.0个点、约5.5个点和约6.0个点。在某些实施方案中,在治疗之后,由于咳嗽频率降低,患者经历健康相关生活质量的显著改善,其特征在于与治疗前相比,六个分量表(身体不适、心理社会问题、功能能力、情绪健康、极端身体不适或人身安全担忧)中的任一者提高至少1个点。在一些实施方案中,健康相关生活质量的改善的特征在于与治疗前相比,分量表得分在约1.0至约4.0个点范围内的提高,例如,提高约4.0个点、约3.0个点、约2.0个点、约1.0个点。
[0219]
在一些实施方案中,在治疗之后,患者经历咳嗽的显著减轻,其特征在于与治疗前相比,患者的ipf群体的圣乔治问卷(sgrq
‑
i)总得分提高至少5个点。在一些实施方案中,咳嗽减轻的特征在于与治疗前相比,sgrq
‑
i总得分在约4.0至约7.0个点范围内的提高,例如,提高约4.0个点、约4.5个点、约5.0个点、约5.5个点、约6.0个点、约6.5个点和约7.0个点。在一些实施方案中,在治疗之后,患者经历咳嗽的显著减轻,其特征在于与治疗前相比,患者的sgrq
‑
i三个子域(症状、活动或影响)中的任一者提高至少1个点。
[0220]
在一些实施方案中,在所述治疗之后,患者经历咳嗽减轻,其特征在于与治疗前相比,评价呼吸道症状(e
‑
rs
tm
)咳嗽分量表得分降低至少1.0个点。在一些实施方案中,咳嗽减轻的特征在于与治疗前相比,评估呼吸道症状(e
‑
rs
tm
)咳嗽分量表得分在约1.0至约4.0个点范围内的下降,例如,下降约1.0个点、约2.0个点、约3.0个点和约4.0个点。
[0221]
在一些实施方案中,在所述治疗之后,患者经历咳嗽的减轻,其特征在于与治疗前相比,评价呼吸道症状(e
‑
rs
tm
)胸部症状分量表得分降低至少1.0个点。在一些实施方案中,咳嗽减轻的特征在于与治疗前相比,评价呼吸道症状(e
‑
rs
tm
)胸部症状分量表得分在约1.0至约12.0个点范围内的下降,例如,下降约1.0个点、约2.0个点、约3.0个点、约4.0个点、约5.0个点、约6.0个点、约7.0个点、约8.0个点、约9.0个点、约10个点、约11个点和约12.0个点。
[0222]
在一些实施方案中,在所述治疗之后,患者经历呼吸急促减轻,其特征在于与治疗前相比,评价呼吸道症状(e
‑
rs
tm
)呼吸急促分量表得分降低至少1.0个点。在一些实施方案中,呼吸急促减轻的特征在于与治疗前相比,评价呼吸道症状(e
‑
rs
tm
)呼吸急促分量表得分在约1.0至约23.0个点范围内的下降(bacci ed,o'quinn s,leidy nk,murray l,vernon m.evaluation of a respiratory symptom diary for clinical studies of idiopathic pulmonary fibrosis.respir med.2018年1月;134:130
‑
138),例如下降约1.0个点、约3.0个点、约5.0个点、约7.0个点、约9.0个点、约11.0个点、约13.0个点、约15.0个点、约17.0个点、约19个点、约21个点和约23.0个点。
[0223]
在一些实施方案中,在所述治疗之后,患者经历呼吸困难的减轻,其特征在于与治疗前相比,与活动有关的呼吸急促相关的评价呼吸道症状(e
‑
rs
tm
)呼吸急促分量表得分降低至少1.0个点。在一些实施方案中,呼吸困难减轻的特征在于与治疗前相比,与活动有关的评价呼吸道症状(e
‑
rs
tm
)呼吸急促分量表得分在约1.0至约17.0个点范围内的下降(bacci ed,o'quinn s,leidy nk,murray l,vernon m.evaluation of a respiratory symptom diary for clinical studies of idiopathic pulmonary fibrosis.online supplement(2018).https://doi.org/10.1016/j.rmed.2017.11.011),例如下降约1.0个点、约3.0个点、约5.0个点、约7.0个点、约9.0个点、约11.0个点、约13.0个点、约15.0个点、约17.0个点。
[0224]
在一些实施方案中,在所述治疗之后,患者经历呼吸困难的减轻,其特征在于与治疗前相比,borg呼吸困难量表值总得分改变至少一个点。在一些实施方案中,呼吸困难减轻的特征在于与治疗前相比,borg呼吸困难量表值总得分在约0.5至约2.0个点范围内的下降,例如,下降约0.5个点、约1.0个点、约1.5个点和约2.0个点。
[0225]
在一些实施方案中,在所述治疗之后,患者经历呼吸困难的减轻,其特征在于与治疗前相比,borg呼吸困难量表域(感觉
‑
感知、情感困扰或症状影响)中的任一者改变至少一个点。在一些实施方案中,呼吸困难减轻的特征在于与治疗前相比,borg呼吸困难量表域(感觉
‑
感知、情感困扰或症状影响)在约0.5至约2.0个点范围内的下降,例如下降约0.5个点、约1.0个点、约1.5个点和约2.0个点。
[0226]
在一些实施方案中,在所述治疗之后,患者经历呼吸困难的减轻,其特征在于与治疗前相比,数值评定量表呼吸困难值降低至少3个点。在一些实施方案中,呼吸困难减轻的特征在于与治疗前相比,borg呼吸困难量表域(感觉
‑
感知、情感困扰或症状影响)在约2.0至约5.0个点范围内的下降,例如下降约2.0个点、约2.5个点、约3.0个点、约3.5个点、约4.0个点、约4.5个点和约5.0个点
[0227]
在一些实施方案中,在所述治疗之后,患者经历呼吸困难的减轻,其特征在于与治疗前相比,改良型医学研究委员会量表中的至少一种类别变化。在一些实施方案中,呼吸困难减轻的特征在于与治疗前相比,改良型医学研究委员会量表在至少一种类别至约三种类别范围内的改善,例如约一种类别、约两种类别和约三种类别的改善。
[0228]
在一些实施方案中,在所述治疗之后,患者经历呼吸困难的减轻,其特征在于与治疗前相比,promis库v1.0呼吸困难情绪反应量表的7个问题中的至少一者中的至少一种类别变化。在一些实施方案中,呼吸困难减轻的特征在于与治疗前相比,promis库v1.0呼吸困难情绪反应量表的7个问题中的至少一者在至少一种类别至约三种类别范围内的改善,例如约一种类别、约两种类别和约三种类别的改善。
[0229]
在一些实施方案中,在所述治疗之后,患者经历呼吸困难的减轻,其特征在于与治疗前相比,promis项目库v1.0呼吸困难严重程度
‑
简式10a量表的10个问题中的至少一者中的至少一种类别变化。在一些实施方案中,呼吸困难减轻的特征在于与治疗前相比,promis项目库v1.0呼吸困难严重程度
‑
简式10a量表的10个问题中的至少一者在至少一种类别至约三种类别范围内的改善,例如约一种类别、约两种类别和约三种类别的改善。
[0230]
在一些实施方案中,在所述治疗之后,患者经历呼吸困难的减轻,其特征在于与治疗前相比,promis项目库v1.0呼吸困难特征量表的4个项目中的至少一者中的至少一种类
别变化或问题“我一直呼吸短促”中的一种类别变化。在一些实施方案中,呼吸困难减轻的特征在于与治疗前相比,promis项目库v1.0呼吸困难特征量表的4个项目中的至少一者或问题“我一直呼吸短促”中在约至少一种类别至约三种类别范围内的改善,例如约一种类别、约两种类别和约三种类别的改善。
[0231]
在一些实施方案中,在所述治疗之后,患者经历疲劳的减轻,其特征在于promis项目库v1.0疲劳简式7a量表的7个问题中的至少一者中的至少一种类别变化。在一些实施方案中,疲劳减轻的特征在于与治疗前相比,promis项目库v1.0疲劳简式7a量表的7个问题中的至少一者在至少一种类别至约三种类别范围内的改善,例如约一种类别、约两种类别、约三种类别、约四种类别、约五种类别、约六种类别和约七种类别的改善。
[0232]
在一些实施方案中,如通过客观量度(胸部x射线、肺功能测试等)所定量,与所述治疗之前相比,在所述治疗之后,患者经历肺纤维化进展率的显著降低。
[0233]
在一些实施方案中,在所述治疗之后,基于呼吸困难和咳嗽状态的改善,患者经历住院率的显著降低。
[0234]
在一些实施方案中,在所述治疗之后,由于与肺功能恶化有关的ipf急性加重(ae
‑
ipf)的发生率降低和/或继发于递增强度的呼吸困难的逐渐更频繁发作的“呼吸困难周期”正反馈回路中断的呼吸困难减轻,所述患者经历发病率和死亡率的显著降低。
[0235]
在一些实施方案中,纳布啡的每日剂量是每日一次或两次剂量,然后向上滴定,直到患者经历咳嗽、呼吸急促或呼吸困难的令人满意的缓解。每日剂量可以约5mg至约360mg范围内(例如,约15mg、约30mg或约60mg)的增量滴定。每日剂量可在一个或多个步骤中滴定。可通过增加单个每日剂量或每天两次给药方案的每个剂量来滴定每日剂量。在存在多个滴定步骤的情况下,剂量的量步进,可相同或可不同。
[0236]
在一些实施方案中,可每天一次或两次以约15mg、约30mg或约60mg的纳布啡起始滴定。在一些实施方案中,可每1至4天以30mg增量调节剂量。患者可自我滴定以在约7天至约30天(例如,约12天至约20天)内达到提供咳嗽、呼吸急促或呼吸困难的充分缓解并使不良反应最小化的剂量。在一些实施方案中,进行滴定持续至少约1周、2周、3周、4周或5周,直到在患者中达到稳定状态。
[0237]
在一些实施方案中,最初可每天一次或两次向患者提供15mg、30mg或60mg的片剂来自我滴定以实现高达约60mg、约90mg、约120mg、约180mg、约240mg、约360mg或约480mg。在一些实施方案中,例如对于患有ipf咳嗽、呼吸急促或呼吸困难的患者,滴定剂量以每天两次约15mg或约30mg开始,然后逐渐增加至约90mg或180mg。在一些实施方案中,例如对于患有ipf咳嗽、呼吸急促或呼吸困难的患者,滴定剂量以每天一次约15mg或约30mg开始,然后逐渐增加至约180mg或360mg。
[0238]
在一些实施方案中,根据下表中提供的剂量时间表进行纳布啡滴定持续十七天(以纳布啡游离碱的等效量表示):
[0239][0240][0241]
在一些实施方案中,根据下表中提供的剂量时间表进行纳布啡滴定持续两周(以纳布啡游离碱的等效量表示):
[0242]
天am剂量(mg)pm剂量(mg)第1天027第2天027第3天2727第4天2727第5天2754第6天5454第7天5454第8天5490第9天9090第10天9090第11天90108第12天108108第13天108108第14天108162
[0243]
在一些实施方案中,根据下表中提供的剂量时间表进行纳布啡滴定持续两周(以纳布啡游离碱的等效量表示):
0
‑
24小时
水平。
[0249]
在一些实施方案中,纳布啡和代谢物包括葡糖醛酸苷(最可能在苯酚和环己烷环上)、两种羟基化的纳布啡代谢物(在环丁烷环上)和三种酮(环丁烷环的羟基化,然后氧化为羰基或然后环丁烷环的开环)。在一些实施方案中,纳布啡代谢物包括纳布啡3
‑
葡糖醛酸或6
‑
葡糖醛酸。在一些其他实施方案中,纳布啡代谢物包括三羟基化纳布啡、单羟基化纳布啡或单葡糖醛酸化纳布啡或它们的组合。在一些实施方案中,纳布啡的一种或多种代谢物不具有可检测的止咳、抗呼吸急促或抗呼吸困难活性。在其他实施方案中,纳布啡的一种或多种代谢物表现出止咳、抗呼吸急促或抗呼吸困难活性。
[0250]
在其中纳布啡的一种或多种代谢物表现出止咳、抗呼吸急促或抗呼吸困难活性的实施方案中,可根据一种或多种表现出止咳、抗呼吸急促或抗呼吸困难活性的代谢物的清除率来如上文所述调整和/或滴定纳布啡的给药方案。可进行纳布啡的这种剂量调整和/或剂量滴定,以防止纳布啡和/或一种或多种代谢物的累积(所述一种或多种代谢物也可表现出止咳、抗呼吸急促或抗呼吸困难活性),以避免用纳布啡治疗的患者中的毒性作用。
[0251]
在一些实施方案中,纳布啡被完全代谢(例如,约100%被代谢)。在其他实施方案中,纳布啡未被完全代谢(例如,少于约100%被代谢)。例如,在一些实施方案中,纳布啡约100%代谢、约95%代谢、约90%代谢、约85%代谢、约80%代谢、约75%代谢、约70%代谢、约65%代谢、约60%代谢、约55%代谢、约50%代谢、约45%代谢、约40%代谢、约35%代谢、约25%代谢、约20%代谢、约15%代谢、约10%代谢、约5%代谢、约1%代谢或约0%代谢。在一些实施方案中,可通过累积水平,例如纳布啡或一种或多种其代谢物的血浆水平来测量或监测可透析剂的量。
[0252]
本文描述的实施方案应被理解为对本公开的说明,而不应被解释为限制性的。相反,本公开涵盖如所附权利要求所体现的替代方案及其等效方案。本文公开的每个参考文献以引用的方式整体并入本文。
[0253]
以下非限制性实施例说明本发明的各个方面:
[0254]
实施例
[0255]
实施例1
[0256]
如下制备30mg、60mg或180mg延长释放(er)纳布啡片剂:将盐酸纳布啡、甘露醇、黄原胶、刺槐豆胶和二水合硫酸钙添加至高剪切混合器中,并以低速干燥混合物。将制粒溶液(注射用水或纯化水)低速引入混合器中。湿法制粒以高速制粒并在流化床处理器中干燥。将干燥的颗粒使用常规碾磨机碾磨并分级。将碾磨的颗粒转移到扩散(滚筒式)混合器中。将羟丙基纤维素和(在适用的情况下)富马酸(仅180mg制剂)添加到扩散混合器中并共混。之后,将硬脂酸镁添加到扩散混合器中并共混。使用旋转式压片机压制最终的共混物。可用非功能性opadry白色包衣对片剂进行包衣。
[0257]
表1
[0258]
30mg、60mg、120mg和180mg延长释放纳布啡片剂
[0259]
成分mg/片剂盐酸纳布啡29.8甘露醇107.3羟丙基纤维素34.7
刺槐豆胶32.2黄原胶21.4脱水硫酸钙17.9硬脂酸镁1.9注射用水或纯化水适量总计:245.1
[0260]
成分mg/片剂盐酸纳布啡59.5甘露醇71.5羟丙基纤维素29.8刺槐豆胶21.4黄原胶14.3脱水硫酸钙11.9硬脂酸镁1.6注射用水或纯化水适量总计:210.0
[0261]
成分mg/片剂盐酸纳布啡119.0甘露醇143.0羟丙基纤维素59.6刺槐豆胶42.9黄原胶28.6脱水硫酸钙23.8硬脂酸镁3.2注射用水或纯化水适量总计:432.6
[0262]
成分mg/片剂盐酸纳布啡178.5甘露醇160.8羟丙基纤维素59.6刺槐豆胶48.2黄原胶32.2脱水硫酸钙26.8硬脂酸镁4.0富马酸24.8注射用水或纯化水适量总计:246.9
[0263]
将片剂用非功能性包衣(opadry ii白色)进行包衣。
[0264]
表2
[0265]
盐酸纳布啡er片剂,30mg、60mg或180mg组合物
[0266]
组分片剂(mg/片剂)盐酸纳布啡30.0甘露醇108.0羟丙基纤维素35.0刺槐豆胶32.4黄原胶21.6二水合硫酸钙18.0硬脂酸镁1.9opadry ii白色7.4无菌注射用水适量总计254.3
[0267][0268][0269]
组分片剂(mg/片剂)盐酸纳布啡180甘露醇160.8羟丙基纤维素59.6刺槐豆胶48.2富马酸24.8黄原胶32.2二水合硫酸钙26.8硬脂酸镁4.0无菌注射用水适量总计534.9
[0270]
实施例2
[0271]
将根据以下方案,针对咳嗽、呼吸急促和呼吸困难的治疗,用盐酸纳布啡er片剂在
特发性肺纤维化受试者中进行双盲、随机化、安慰剂对照的2周期交叉安全性和功效研究。
[0272]
所述研究包括相隔2周清除期的两个3周治疗期(图1)。在第一治疗期中,将患者以1:1的比例随机分配至每日两次(bid)162mg目标剂量的纳布啡er片剂(纳布啡游离碱的等效剂量)或安慰剂片剂bid。
[0273]
主要目标是评价盐酸纳布啡er片剂对(1)白天咳嗽频率的百分比变化和(2)以及安全性和耐受性的影响。白天定义为在施加数字咳嗽监测仪后的24小时内受试者醒来的时间段。使用客观的数字咳嗽监测进行评估。
[0274]
参加者
[0275]
为了符合条件,患者必须患有特发性肺纤维化,并且患者必须患有慢性咳嗽(>8周)。
[0276]
纳入标准
[0277]
要求患者满足所有以下标准才有资格纳入研究:
[0278]
·
基于ats/ers/jrs/alat标准对“明确的”或“可能的”ipf的诊断(参见raghu g,等人;美国胸科学会,欧洲呼吸学会,日本呼吸学会和拉丁美洲胸科学会.diagnosis of idiopathic pulmonary fibrosis.an official ats/ers/jrs/alat clinical practice guideline.am j respir crit care med.2018年9月1日;198(5).)。
[0279]
·
用力肺活量(fvc)>40%正常预测值。
[0280]
·
针对血红蛋白校正的肺对一氧化碳的弥散量[dlco]>25%正常预测值。
[0281]
·
慢性咳嗽>8周。
[0282]
·
如通过小口地喝3液量盎司(或89ml)水而不会引起咳嗽或窒息的能力所评估的适当吞咽反射。
[0283]
·
筛选时关于咳嗽严重程度数值评定量表的白天咳嗽严重程度得分≥4。
[0284]
·
同意时年龄为18岁及以上的男性或女性。
[0285]
·
有生育能力的女性必须使用可接受的节育方法(如果性活跃)。
[0286]
全部有生育能力的女性必须在筛选和基线访问时具有阴性妊娠试验。
[0287]
出于本研究的目的,除非绝经后(即距上一次月经至少1年且年龄>50岁)或通过手术不育(即,输卵管结扎、子宫切除术和/或双侧卵巢切除术),否则所有女性均被视为有生育能力。
[0288]
有生育能力的性活跃女性受试者除了1种其他方法(例如,宫内节育器放置至少1个月、稳定的激素避孕持续至少3个月、essure程序或杀精子剂)外,还必须使用1种屏障避孕法(例如,避孕套、宫颈帽或子宫帽)。对于使用屏障避孕法加杀精子剂的女性受试者,必须在筛选前至少14天使用所述方法。
[0289]
禁欲的女性受试者可参加研究;然而,如果她们变得性活跃,就必须建议要求她们使用适当的避孕。这种建议应在每次研究访问时进行,并且必须记录在原始记录中。
[0290]
·
愿意并且能够理解并提供书面知情同意。
[0291]
·
愿意并且能够遵守研究要求和限制。
[0292]
·
同意机密使用和存储所有数据以及使用所有匿名数据进行公布,包括科学出版物。
[0293]
排除标准
[0294]
如果患者符合以下任何标准,则他或她不符合资格:
[0295]
·
以下条件被排除:
[0296]
a)已知由家庭和职业环境暴露引起的间质性肺病(ild)
[0297]
b)已知由结缔组织病引起的间质性肺病(ild)。
[0298]
c)已知由药物相关毒性引起的间质性肺病(ild)。
[0299]
·
目前正在进行连续氧疗法。
[0300]
·
在研究者看来可能干扰研究期间抗咳嗽功效和/或安全性事件的评估或干扰受试者与研究要求配合的能力的主要精神障碍。
[0301]
·
筛选时血清胆红素>1.5
×
正常范围上限,除非有吉尔伯特综合征的临床诊断解释。
[0302]
·
筛选时血清肝丙氨酸氨基转移酶或天冬氨酸氨基转移酶>100u/l。
[0303]
·
筛选时估计的肾小球滤过率≤44ml/min/1.73m2。
[0304]
·
筛选4周内出现上呼吸道或下呼吸道感染。
[0305]
·
可能干扰受试者成功完成研究的能力的重大医学疾患或其他因素。
[0306]
·
由研究人员确定的可能干扰研究进行的药物滥用史。
[0307]
·
对纳布啡或媒介物组分的已知不耐受或超敏性/药物过敏。
[0308]
·
怀孕或哺乳期女性受试者。
[0309]
·
同时招募于正在进行的临床试验中或预期招募于同时进行的临床试验。
[0310]
·
睡眠呼吸暂停的临床诊断和/或使用持续气道正压通气(cpap)。
[0311]
·
在过去1个月内临床上显著的头部损伤史。
[0312]
·
吸入性肺炎的临床诊断。
[0313]
·
使用阿片剂后阿片戒断症状的临床史。
[0314]
·
记录的或临床疑似高碳酸血症(pco2>6.0kpa)。
[0315]
药物相关的排除:
[0316]
·
已知的不耐受性(胃肠、中枢神经系统症状)或对阿片剂的超敏性/药物过敏。
[0317]
·
在4周内暴露于任何研究药物,包括安慰剂。
[0318]
·
潜在受试者在筛选期之前的14天内不能接受阿片剂,包括含阿片剂的抗咳嗽剂。在研究的持续时间,禁止受试者使用阿片剂,包括纳曲酮。
[0319]
·
潜在受试者当前不能接受苯二氮卓类药物或其他cns抑制剂类药物,所述药物在与阿片剂同时使用时已知具有引起抑制cns活性的额外药理作用的潜力。
[0320]
·
潜在受试者目前不能接受影响血清素能神经传递并且当与阿片剂同时使用时可引起血清素综合征的药物。
[0321]
·
在研究治疗的持续时间禁止饮酒(由于当与阿片剂同时使用时可能导致cns抑制的额外药理学作用。
[0322]
·
筛选8周内ipf相关药物治疗方案的变化。
[0323]
心脏相关的排除
[0324]
·
如使用纽约心脏协会(nyha)分类所分级,具有2级或更高级别的充血性心力衰竭史的受试者。
[0325]
·
如使用加拿大心血管学会(ccs)分级量表所分级,具有2级或更高级别的心绞痛
史的受试者。
[0326]
·
室性心动过速、尖端扭转型室性心动过速史或猝死家族史。
[0327]
·
根据受试者的报告,在过去3个月内心肌梗塞或急性冠脉综合征。
[0328]
·
血清钾低于实验室正常下限。
[0329]
·
筛选ecg时qtcf间隔>450ms。
[0330]
·
任何筛选测量时的心率<45bpm。静息心率<45bpm的受试者在仰卧位5分钟后重复一次,如果在重复过程中保持<45bpm,则所述受试者将被视为筛选失败。
[0331]
·
使用具有尖端扭转型室性心动过速的“已知风险”的药物(分类为credible网站上的“kr”)在进入或研究过程中不允许。如果符合以下标准,则在研究进入时允许与可能的qt延长风险相关、但未明确与尖端扭转型室性心动过速相关的药物:
[0332]
在筛选之前,已向受试者给予稳定剂量的药物持续整整4周。
[0333]
筛选后或研究期间将不会增加药物剂量,并且预计受试者将在整个研究过程中接受所述药物。
[0334]
筛选时的qtcf≤450ms。
[0335]
结果
[0336]
主要终点是如在治疗第22天通过客观数字咳嗽监测所评估的白天咳嗽频率(每小时咳嗽次数)与基线相比的百分比变化。
[0337]
次要终点包括:
[0338]
·
治疗第9天(剂量:54mg bid)、第16天(剂量:108mg bid)和第22天(剂量:162mg bid)白天咳嗽频率(每小时咳嗽次数)与基线相比的相对变化。
[0339]
·
治疗第9天(剂量:54mg bid)、第16天(剂量:108mg bid)和第22天(剂量:162mg bid)24小时(白天和夜间组合)咳嗽频率(每小时咳嗽次数)与基线相比的相对变化。
[0340]
·
治疗第9天(剂量:54mg bid)、第16天(剂量:108mg bid)和第22天(剂量:162mg bid)夜间咳嗽频率(每小时咳嗽次数)与基线相比的相对变化。
[0341]
·
e
‑
rs日记咳嗽分量表(e
‑
rs日记问题编号2)应答者的百分比,其中应答被定义为在治疗的第9天、第16天和第22天,与基线相比的至少一种类别改善。
[0342]
·
治疗第8天、第15天和第21天,咳嗽严重程度数值评定量表的平均变化。
[0343]
·
治疗第9天、第16天、第22天的e
‑
rs日记呼吸急促分量表(e
‑
rs日记问题7、8、9、10和11)与基线相比的平均变化。
[0344]
·
治疗第9天、第16天和第22天14项exact v1.1电子日记工具总得分与基线相比的平均变化。
[0345]
·
治疗第8天、第15天和第21天,promis项目库v1.0疲劳简式7a量表与基线相比的平均变化。
[0346]
·
在治疗第8天、第15天和第21天测量的cgi
‑
c随时间推移的平均变化。
[0347]
统计方法
[0348]
样本量和效能
[0349]
大约44位受试者(每个序列22位)的计划的样本量得到在5%统计显著性水平(双侧)下检测白天咳嗽频率的40%变化的80%效能。
[0350]
主要功效分析是基于完成群体,所述群体由接受两项研究治疗并完成研究中的两
个治疗期的所有受试者组成。
[0351]
功效
[0352]
使用混合效应模型分析白天咳嗽频率(每小时咳嗽次数)的百分比变化,其中序列、治疗和时间(第9天、第16天和第22天)作为固定效应,基线值作为协变量,部位作为随机效应,并且受试者作为随机重复效应。对于在研究访问中未完成的评估,将不存在退出或缺失数据的推定。
[0353]
安全性
[0354]
不良事件的发生率根据监管活动医学词典(meddra)身体系统分类和优选条款通过比例的呈现来汇总。生命体征和实验室数据将使用描述性统计数据进行汇总。类似地,使用描述性统计数据汇总违禁药物或限制药物的使用程度和持续时间。未对安全结果进行正式的统计分析;如果存在,则推断通过临床审查和解释得出。
[0355]
将针对最相关的滥用相关meddra优选条款编码的特别感兴趣的不良事件(aesi)制成表格,并撰写描述性叙述。将被认为“可能与滥用可能性有关”的其他不良事件单独制成表格。
[0356]
心电图由经过专门培训的人员集中读取,并向临床站点实时反馈与安全性相关的任何发现。一旦数据库完成,就将ecg数据(例如,心率、pr、qtcf间隔)按受试者列出呈现,并按采集日期和时间进行汇总。完整的ecg评估记录在中心ecg实验室的单独报告中。
[0357]
药物动力学
[0358]
在适用的情况下,按收集时间列出研究产品血浆浓度数据(纳布啡和代谢产物)。
[0359]
在数据允许的情况下,进行另外两组分析并提供在单独的报告中:1)浓度结果的分析和报告;和2)药代动力学
‑
药效学(pk
‑
pd)分析以描述纳布啡血浆浓度与功效参数之间的暴露
‑
反应关系。
[0360]
在适当地情况下进行另外的pk
‑
pd分析,以包括安全性和/或耐受性参数。
[0361]
干预
[0362]
所述研究包括相隔2周清除期的两个22天治疗期(图1)。
[0363]
在治疗期1中,将符合条件的受试者随机分配(1:1)至以下治疗组之一:
[0364]
·
第1组:活性nal er片剂,然后在治疗期2中交叉安慰剂片剂
[0365]
·
第2组:安慰剂片剂,然后在治疗期2中交叉nal er片剂。
[0366]
在治疗第1
‑
6天时间段内,服用nal er的受试者从27mg qd至54mg bid进行滴定,然后在治疗第6
‑
8天保持在54mg bid。随后在治疗第9
‑
10天内将剂量递增至108mg bid,然后在治疗第10
‑
15天保持在108mg bid。随后在治疗第16
‑
17天内将剂量递增至162mg bid,然后在治疗第17
‑
21天保持在162mg bid。在治疗第22天,服用nal er的受试者将接受162mg am剂量。
[0367]
在2周清除期后,受试者按照相同的方案在3周时间段药物内接受第二次治疗(nal er或安慰剂)(图1)。受试者在第二次治疗结束时出院。研究的总持续时间长达11周。
[0368]
研究访问包括筛选以确定是否合格,以及对于每个治疗期:在第
‑
1天进行访问以进行基线评估,在治疗期间的第8天、第15天和第21天进行访问,一季在2周清除期结束时进行随访。在每个治疗期期间的研究访问中,抽取受试者的血液用于纳布啡血浆浓度的安全性分析和pk分析。受试者完成问卷以用于功效评价,并进行包括ecg的安全性评价。在基线
访问和每个治疗期期间间的访问中,现场工作人员在受试者身上放置电子咳嗽监测仪,并将其佩戴到第二天晚上,以便获得至少完整24小时记录时期的咳嗽频率。在每次记录结束时,受试者在就寝之前应在家中卸下监测器。受试者在就寝前完成每日电子日记。
[0369]
因除撤回同意外的其他原因而中断研究产品的受试者被视为已提前中断治疗,并被要求完成提前中断和2周治疗后安全性随访评价。
[0370]
结果
[0371]
如本文所述的临床终点所指示的,nal er治疗组中的ipf患者表现出一种或多种咳嗽、呼吸急促或呼吸困难症状的减轻。
[0372]
实施方案:
[0373]
1.一种治疗特发性肺纤维化(ipf)咳嗽、呼吸急促或呼吸困难的方法,所述方法包括向需要这种治疗的患者施用有效量的纳布啡或其药学上可接受的盐或酯。
[0374]
2.如实施方案1所述的方法,其中在所述治疗之前,根据咳嗽严重程度数值评定量表,所述患者的白天咳嗽严重程度是至少4。
[0375]
3.如实施方案1所述的方法,其中在所述治疗之前,所述患者的白天平均咳嗽计数是使用咳嗽计数监测装置测量的每小时至少15次。
[0376]
4.如实施方案1所述的方法,其中所述ipf咳嗽是慢性咳嗽。
[0377]
5.如实施方案1所述的方法,其中所述ipf咳嗽是难治性慢性咳嗽。
[0378]
6.如实施方案1所述的方法,其中所述ipf咳嗽对于用选自吉法匹生、司洛匹坦和奥维匹坦的止咳剂治疗是难治性的。
[0379]
7.如实施方案1所述的方法,其中所述ipf咳嗽、呼吸急促或呼吸困难对于用μ
‑
阿片样激动剂治疗是难治性的。
[0380]
8.如实施方案1所述的方法,其中所述ipf咳嗽、呼吸急促或呼吸困难对于用吡非尼酮治疗是难治性的。
[0381]
9.如实施方案1所述的方法,其中所述ipf咳嗽、呼吸急促或呼吸困难对于用尼达尼布治疗是难治性的。
[0382]
10.如实施方案1所述的方法,其中所述ipf咳嗽、呼吸急促或呼吸困难对于用沙利度胺治疗是难治性的。
[0383]
11.如实施方案1所述的方法,其中所述ipf咳嗽、呼吸急促或呼吸困难对于用色甘酸钠治疗是难治性的。
[0384]
12.如实施方案1所述的方法,其中所述患者还接受对于选自由以下组成的组的疾病的治疗:肺动脉高压、阻塞性睡眠呼吸暂停、肺癌、copd/肺气肿、缺血性心脏病和gerd。
[0385]
13.一种治疗慢性咳嗽的方法,所述方法包括向需要这种治疗的患者施用有效量的纳布啡或其药学上可接受的盐或酯。
[0386]
14.如实施方案13所述的方法,其中所述慢性咳嗽选自难治性慢性咳嗽、原因不明的慢性咳嗽、原因不明且难治性的慢性咳嗽。
[0387]
15.如实施方案14所述的方法,其中所述慢性咳嗽对于用曲马多治疗是难治性的。
[0388]
16.如实施方案13
‑
15中任一项所述的方法,其中所述需要治疗慢性咳嗽的患者是未患肺病的患者。
[0389]
17.如实施方案13
‑
15中任一项所述的方法,其中所述需要治疗慢性咳嗽的患者是
患有肺病的患者。
[0390]
18.如实施方案17所述的方法,其中所述肺病是间质性肺病。
[0391]
19.如实施方案18所述的方法,其中所述间质性肺病选自由以下组成的组:超敏性肺炎、结节病、石棉沉着症、闭塞性细支气管炎、组织细胞增生症x、慢性嗜酸粒细胞性肺炎、胶原血管病、肉芽肿性血管炎、古德帕斯丘综合征和肺泡蛋白沉积症。
[0392]
20.如实施方案17所述的方法,其中所述肺病是慢性阻塞性肺病(copd)。
[0393]
21.如实施方案20所述的方法,其中所述copd与选自由以下组成的组的疾患相关:肺气肿、慢性支气管炎和α
‑1‑
抗胰蛋白酶(aat)缺乏症。
[0394]
22.如实施方案20所述的方法,其中所述copd与选自由以下组成的组的刺激物相关:香烟烟雾、二手烟雾、管道烟雾、空气污染和工作场所暴露于粉尘、烟雾或烟气。
[0395]
23.一种治疗咳嗽超敏性病症的方法,所述方法包括向需要这种治疗的患者施用有效量的纳布啡或其药学上可接受的盐或酯。
[0396]
24.如实施方案1
‑
23中任一项所述的方法,其中每天一次施用约14mg等效量的纳布啡游离碱。
[0397]
25.如实施方案1
‑
23中任一项所述的方法,其中每天两次施用约14mg等效量的纳布啡游离碱。
[0398]
26.如实施方案1
‑
23中任一项所述的方法,其中每天一次施用约27mg等效量的纳布啡游离碱。
[0399]
27.如实施方案1
‑
23中任一项所述的方法,其中每天两次施用约27mg等效量的纳布啡游离碱。
[0400]
28.如实施方案1
‑
23中任一项所述的方法,其中每天一次施用约54mg等效量的纳布啡游离碱。
[0401]
29.如实施方案1
‑
23中任一项所述的方法,其中每天两次施用约54mg等效量的纳布啡游离碱。
[0402]
30.如实施方案1
‑
23中任一项所述的方法,其中每天一次施用约81mg等效量的纳布啡游离碱。
[0403]
31.如实施方案1
‑
23中任一项所述的方法,其中每天两次施用约81mg等效量的纳布啡游离碱。
[0404]
32.如实施方案1
‑
23中任一项所述的方法,其中每天一次施用约108mg等效量的纳布啡游离碱。
[0405]
33.如实施方案1
‑
23中任一项所述的方法,其中每天两次施用约108mg等效量的纳布啡游离碱。
[0406]
34.如实施方案1
‑
23中任一项所述的方法,其中每天一次施用约162mg等效量的纳布啡游离碱。
[0407]
35.如实施方案1
‑
23中任一项所述的方法,其中每天两次施用约162mg等效量的纳布啡游离碱。
[0408]
36.如实施方案1
‑
23中任一项所述的方法,其中每天一次施用约324mg等效量的纳布啡游离碱。
[0409]
37.如实施方案1
‑
36中任一项所述的方法,其中所述施用持续约8周、10周、12周、
24周或50周。
[0410]
38.如实施方案1
‑
36中任一项所述的方法,其中所述施用持续至少约1周。
[0411]
39.如实施方案1
‑
38中任一项所述的方法,所述方法还包括滴定纳布啡或其药学上可接受的盐或酯的剂量持续至少一周,直到在所述患者中达到稳定状态。
[0412]
40.如实施方案1
‑
38中任一项所述的方法,所述方法还包括滴定纳布啡或其药学上可接受的盐或酯的剂量持续约2周,直到在所述患者中达到稳定状态。
[0413]
41.如实施方案1
‑
38中任一项所述的方法,所述方法还包括滴定纳布啡或其药学上可接受的盐或酯的剂量持续约7至30天,直到在所述患者中达到稳定状态。
[0414]
42.如实施方案1
‑
38中任一项所述的方法,所述方法还包括滴定所述纳布啡或其药学上可接受的盐或酯的剂量持续约14至20天,直到在所述患者中达到稳定状态。
[0415]
43.如实施方案39所述的方法,其中所述滴定包括施用递增剂量的纳布啡或其药学上可接受的盐或酯,直到在所述患者中达到稳定状态。
[0416]
44.如实施方案39所述的方法,其中所述滴定包括施用递增剂量的纳布啡或其药学上可接受的盐或酯,直到在所述患者中达到27mg或324mg的有效量。
[0417]
45.如实施方案39所述的方法,其中所述滴定还包括每天一次或两次施用约27mg的初始剂量。
[0418]
46.如实施方案39所述的方法,其中所述滴定包括以约13mg至约54mg范围内的增量施用纳布啡或其药学上可接受的盐或酯。
[0419]
47.如实施方案39所述的方法,其中所述滴定包括根据下表中提供的剂量时间表施用纳布啡(以纳布啡游离碱的等效量表示):
[0420]
天am剂量(mg)pm剂量(mg)第1天027第2天027第3天2727第4天2727第5天2754第6天5454第7天5454第8天5454第9天54108第10天90108第11天90108第12天108108第13天108108第14天108108第15天108108第16天108162第17天162162
[0421]
48.如实施方案1
‑
47中任一项所述的方法,其中与所述治疗之前相比,在所述治疗
之后,所述患者经历咳嗽的显著减轻。
[0422]
49.如实施方案1
‑
48中任一项所述的方法,其中在所述治疗之后,所述患者经历咳嗽的减轻,其特征在于根据所述患者的莱斯特咳嗽问卷得分的总得分下降至少1.3个点。
[0423]
50.如实施方案1
‑
49中任一项所述的方法,其中在所述治疗之后,所述患者经历咳嗽的减轻,其特征在于使用咳嗽计数监测器装置测量的白天咳嗽频率降低至少30%。
[0424]
51.如实施方案1
‑
50中任一项所述的方法,其中在所述治疗之后,所述患者经历咳嗽严重程度的降低,其特征在于数值评定量表咳嗽(nrs)值降低至少三个点。
[0425]
52.如实施方案1
‑
51中任一项所述的方法,其中在所述治疗之后,所述患者经历咳嗽的减轻,其特征在于咳嗽生活质量问卷总值提高至少4个点。
[0426]
53.如实施方案1
‑
52中任一项所述的方法,其中在所述治疗之后,所述患者经历咳嗽的减轻,其特征在于所述患者的ipf群体的圣乔治问卷(sgrq
‑
i)总得分降低至少5个点。
[0427]
54.如实施方案1
‑
53中任一项所述的方法,其中在所述治疗之后,所述患者经历咳嗽的减轻,其特征在于所述患者的圣乔治问卷(sgrq
‑
i)得分的组成部分中的每一者降低至少一个点。
[0428]
55.如实施方案1
‑
54中任一项所述的方法,其中在所述治疗之后,所述患者经历咳嗽的减轻,其特征在于exact
‑
呼吸道症状(e
‑
rs
tm
)咳嗽分量表得分降低至少1.0个点。
[0429]
56.如实施方案1
‑
55中任一项所述的方法,其中在所述治疗之后,所述患者经历咳嗽的减轻,其特征在于exact
‑
呼吸道症状(e
‑
rs
tm
)胸部症状分量表得分降低至少1.0个点。
[0430]
57.如实施方案1
‑
56中任一项所述的方法,其中与所述治疗之前相比,在所述治疗之后,所述患者经历呼吸急促的显著减轻。
[0431]
58.如实施方案1
‑
57中任一项所述的方法,其中在所述治疗之后,所述患者经历呼吸急促的减轻,其特征在于exact
‑
呼吸道症状(e
‑
rs
tm
)呼吸急促分量表得分降低至少1.0个点。
[0432]
59.如实施方案1
‑
58中任一项所述的方法,其中与所述治疗之前相比,在所述治疗之后,所述患者经历呼吸困难的显著减轻。
[0433]
60.如实施方案1
‑
59中任一项所述的方法,其中在所述治疗之后,所述患者经历呼吸困难的减轻,其特征在于与活动有关的exact
‑
呼吸道症状(e
‑
rs
tm
)呼吸急促分量表得分降低至少1.0个点。
[0434]
61.如实施方案1
‑
60中任一项所述的方法,其中在所述治疗之后,所述患者经历呼吸困难的减轻,其特征在于borg呼吸困难量表值总得分改变至少一个点。
[0435]
62.如实施方案1
‑
61中任一项所述的方法,其中在所述治疗之后,所述患者经历呼吸困难的减轻,其特征在于borg呼吸困难量表域(感觉
‑
感知、情感困扰或症状影响)中的任一者改变至少一个点。
[0436]
63.如实施方案1
‑
62中任一项所述的方法,其中在所述治疗之后,所述患者经历呼吸困难的减轻,其特征在于数值评定量表呼吸困难值降低至少3个点。
[0437]
64.如实施方案1
‑
63中任一项所述的方法,其中在所述治疗之后,所述患者经历呼吸困难的减轻,其特征在于改良型医学研究委员会量表中的至少一种类别变化。
[0438]
65.如实施方案1
‑
64中任一项所述的方法,其中在所述治疗之后,所述患者经历呼吸困难的减轻,其特征在于promis库v1.0呼吸困难情绪反应量表的7个问题中的至少一者
中的至少一种类别变化。
[0439]
66.如实施方案1
‑
65中任一项所述的方法,其中在所述治疗之后,所述患者经历呼吸困难的减轻,其特征在于promis项目库v1.0呼吸困难严重程度
‑
简式10a量表的10个问题中的至少一者中的至少一种类别变化。
[0440]
67.如实施方案1
‑
66中任一项所述的方法,其中在所述治疗之后,所述患者经历呼吸困难的减轻,其特征在于与所述治疗之前相比,promis项目库v1.0呼吸困难特征量表的4个项目中的至少一者中的至少一种类别变化或问题“我一直呼吸短促”中的一种类别变化。
[0441]
68.如实施方案1
‑
67中任一项所述的方法,其中在所述治疗之后,所述患者经历疲劳的显著减轻。
[0442]
69.如实施方案1
‑
68中任一项所述的方法,其中在所述治疗之后,所述患者经历疲劳的减轻,其特征在于promis项目库v1.0疲劳简式7a量表的7个问题中的至少一者中的至少一种类别变化。
[0443]
70.如实施方案1
‑
69中任一项所述的方法,其中如通过客观量度(胸部x射线、肺功能测试等)所定量,与所述治疗之前相比,在所述治疗之后,所述患者经历肺纤维化率的显著降低。
[0444]
71.如实施方案1
‑
70中任一项所述的方法,其中在所述治疗之后,基于呼吸困难、呼吸急促或咳嗽状态的改善,所述患者经历住院率的显著降低。
[0445]
72.如实施方案1
‑
12和24
‑
71中任一项所述的方法,其中在所述治疗之后,由于与肺功能恶化有关的ipf急性加重(ae
‑
ipf)的发生率降低和/或继发于递增强度的呼吸困难的逐渐更频繁发作的“呼吸困难周期”正反馈回路中断的呼吸困难减轻,所述患者经历发病率和死亡率的显著降低。
[0446]
73.如实施方案1
‑
12和24
‑
72中任一项所述的方法,其中所述纳布啡或其药学上可接受的盐或酯与一种或多种治疗ipf咳嗽、呼吸急促或呼吸困难的药物结合施用。
[0447]
74.如实施方案73所述的方法,其中所述一种或多种治疗ipf咳嗽、呼吸急促或呼吸困难的药物选自由以下组成的组:吡非尼酮、尼达尼布、n
‑
乙酰半胱氨酸、色甘酸钠、沙利度胺、吉法匹生、司洛匹坦和奥维匹坦。
[0448]
75.如实施方案1
‑
74中任一项所述的方法,其中所述纳布啡或其药学上可接受的盐或酯是盐酸纳布啡。
[0449]
76.如实施方案1
‑
75中任一项所述的方法,其中所述纳布啡或其药学上可接受的盐或酯呈延长释放口服剂型的形式。
[0450]
77.如实施方案1
‑
76中任一项所述的方法,其中所述纳布啡或其药学上可接受的盐或酯以包含盐酸纳布啡、甘露醇、羟丙基纤维素、刺槐豆胶、黄原胶、二水合硫酸钙、富马酸和硬脂酸镁的制剂施用。
[0451]
78.如实施方案1至77中任一项所述的方法,其中所述纳布啡是经口施用的。
[0452]
79.如实施方案1
‑
77中任一项所述的方法,其中所述纳布啡是通过吸入施用的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1