具有内部力传递的用于药物递送的注射系统的制作方法
具有内部力传递的用于药物递送的注射系统
1.相关申请的交叉引用
2.本申请要求于2018年10月2日提交的美国临时专利申请号62/740,232的优先权,该专利申请的全部内容通过援引并入本文。
技术领域
3.本披露总体上涉及用于药物递送的注射系统,更具体地涉及管理在这样的系统内产生的内部力。
背景技术:
4.可注射药物通常通过使用附接至注射器的针头来施用。手动将针头插入到患者的组织中,然后手动使柱塞移位以将药物从贮存器中喷射到患者体内。对于某些患者,特别是对操作注射器经验很少或没有经验的患者,使用注射器自我施用药物可能是麻烦的和/或不舒服的。因此,患者经常使用自动注射系统来协助注射。这样的系统通常提供插入针或套管和/或从贮存器排出药物所需的致动能量。
5.储存和/或释放致动能量在注射系统的多个不同的部件中产生机械应力。特别是在涉及注射高粘度药物的应用中,应力可能会很大。此外,应力可能在发生注射之前、期间甚至之后出现。为了确保这种应力不会损害注射系统的完整性,可能有必要在某些设计参数内构造多个不同的部件,这些设计参数包括例如具有不小于一定的厚度和/或材料强度。通常,注射系统的外壳或壳体需要承受至少一些应力。这会对用于外壳的形状和/或材料施加限制,这样进而会影响患者/使用者的体验。
6.如以下更详细地阐述的,本披露阐述了体现了现有注射系统的有利替代方案的注射系统,并且可以解决本文中提到的挑战或需求中的一个或多个以及提供其他益处和优点。
技术实现要素:
7.本披露的一方面提供了一种用于注射药物的系统。该系统可以包括外壳体,该外壳体限定了内部空间并且在一些实施例中被配置为在注射期间由患者或使用者握持。该容器可以被设置或可设置在外壳体的内部空间中并且可以填充有或可填充有药物。该塞子可以可移动地设置在该容器中以用于将该药物从该容器排出。该系统可以包括驱动组件,该驱动组件包括作用于该塞子的柱塞、输出力或可操作用于输出力的能量源、以及机械联动装置,该机械联动装置可操作用于将由该能量源所输出的力传递给该柱塞,以致使该柱塞作用于该塞子以排出该药物。触发构件可以可选择性地与该机械联动装置接合以控制该机械联动装置的致动。在该预注射状态下,该触发构件可以禁止该机械联动装置的致动;而在该注射状态下,该触发构件可以允许该机械联动装置的致动。该系统还可以具有该柱塞静止地定位在给药结束位置的注射后状态。该外壳体可以被配置为其在该预注射状态、该注射状态和/或该注射后状态下基本上不承受或不承受由该能量源所输出的力引起的任何负
载。
8.本披露的另一方面提供了一种用于注射药物的系统。该系统可以包括:容器,该容器填充或可填充有该药物;以及塞子,该塞子可移动地设置在该容器中以用于将该药物从该容器排出。该系统可以包括驱动组件,该驱动组件包括作用于该塞子的柱塞、输出力或可操作用于输出力的能量源、以及机械联动装置,该机械联动装置可操作用于将由该能量源所输出的力传递给该柱塞,以致使该柱塞作用于该塞子以排出该药物。触发构件可以可选择性地与该机械联动装置接合以控制该机械联动装置的致动。在该预注射状态下,该触发构件可以禁止该机械联动装置的致动;而在该注射状态下,该触发构件可以允许该机械联动装置的致动。该系统还可以具有该柱塞静止地定位在给药结束位置的注射后状态。在该预注射状态下,至少该能量源、该柱塞、该机械联动装置和该触发构件可以可操作地串联连接以限定第一力传递环路,并且其中,该第一力传递环路直接或间接地接收由该能量源所输出的力。
附图说明
9.认为从结合附图的以下描述中将更充分地理解本公开。为了更清楚地显示其他元件,可以通过省略所选择的元件来简化一些附图。在某些附图中,这些元件的省略并不一定表示在任何示例性实施例中存在或不存在特定元件,除非可以在对应的书面描述中明确指出。而且,所有附图都不必按比例绘制。
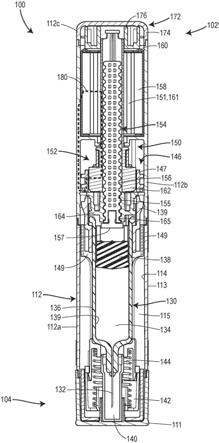
10.图1是根据本披露的实施例的处于预注射状态下的用于药物递送的注射系统的截面视图,并且展示了系统内的第一力传递环路。
11.图2a是处于注射状态下的图1的注射系统的实施例的截面视图,并且展示了系统内的第二力传递环路。
12.图2b是处于注射状态下的图1的注射系统的实施例的截面视图,并且展示了系统内的第三力传递环路。
13.图2c是处于注射状态下的图1的注射系统的实施例的截面视图,并且展示了系统内的第四力传递环路。
14.图3a是处于注射后状态下的图1的注射系统的实施例的截面视图,并且展示了系统内的第五力传递环路。
15.图3b是处于注射后状态下的图1的注射系统的实施例的截面视图,并且展示了系统内的第六力传递环路。
16.图4是根据本披露的替代性实施例的处于预注射状态下的用于药物递送的注射系统的截面视图,并且展示了系统内的第一力传递环路的替代版本。
17.图5是根据本披露的替代性实施例的处于注射状态下的用于药物递送的注射系统的截面视图,并且展示了系统内第三力传递环路的替代版本。
18.图6是根据本披露的替代性实施例的处于注射后状态下的用于药物递送的注射系统的截面视图,并且展示了系统内第五力传递环路的替代版本。
19.图7是根据本披露的替代性实施例的处于注射后状态下的用于药物递送的注射系统的截面视图,并且展示了系统内第六力传递环路的替代版本。
具体实施方式
20.本披露总体上涉及用于药物递送的注射系统的配置和操作。尽管大多数实施例是在比如自动注射器等手持注射器的背景下描述的,但是本披露的范围不限于这样的注射器。可应用本披露的其他注射系统包括但不限于:比如(例如经由粘合剂)粘附至患者皮肤的随身注射器(on
‑
body injector)等可穿戴注射器、穿戴在患者衣物上的携带式泵、混合式自动注射器/随身注射器。
21.通常,本披露的注射系统被设计为限制由于能量源所输出的力而承受机械应力或负载的零件或部件的数量。置于机械应力或负载下的一组或多组部件可以根据注射系统是处于预注射状态、注射状态还是注射后系统而变化。通过在一种或多种状态下从能量源所输出的力中排除或屏蔽某些部件,这样的部件可以受到较少限制性设计参数的约束,同样地,更多的选择可以用于它们的设计。例如,可以用更少的材料和/或更轻的材料来制造这样的部件,和/或它们的形状或配置可以不通过机械应力考虑来决定。这种自由还可以允许多种外部形状因素满足患者的需求或喜好,并且在某些情况下还可以节省成本。此外,排除某些部件在预注射状态下不必承受机械应力或负载可以在如何组装这样的部件方面提供灵活性。例如,在最终组装阶段之前,可以组装并加载某些部件以形成力传递环路。这简化了最终组装阶段,并且可能允许其在比执行较早制造步骤的设施成本更低或较不需要维护的设施上进行。其他益处和优点也是可能的,并且对于审阅本披露的本领域普通技术人员将是显而易见的。
22.现在参考图1
‑
3b,展示了用于注射药物的系统100的实施例的若干截面视图,该药物在本文中也可以称为药剂或药物产品。药物可以是但不限于各种生物制剂,比如肽、肽体或抗体。药物可以是流体或液体形式,但是本披露不限于特定状态。在某些液体制剂中,药物可以具有相对较高的粘度。
23.系统100的多种不同的实现方式和配置都是可能的。系统100可以被配置为单次使用的一次性注射器,或者可替代地为多次使用的可重复使用的注射器。系统100可以被配置为用于患者自我施用的自动注射器,但是系统100也可以由护理员或经过正式培训的医疗保健提供者(例如医生或护士)使用来施用注射。在系统100被配置为自动注射器或笔型注射器的实施例中,系统100可以在药物递送(在本文中也称为给药)的持续时间内被握持在患者或使用者的手中。在替代性实施例中,在药物递送可能被延迟或花费几分钟或几小时完成的情况下,系统100可以被配置为随身注射器,该随身注射器经由例如设置在或施加到系统100的外表面的粘合剂可释放地附接至患者的皮肤。
24.在系统100中包括的多个不同的部件的配置可以取决于系统100的操作状态。系统100可以具有预注射或存储状态、注射状态和注射后状态,但是更少或更多的状态也是可能的。预注射状态可以对应于系统100在组装之后并且由患者或使用者激活(例如,系统100的能量源的激活)之前的配置。预注射状态可以存在于系统100离开制造设施与患者或使用者激活系统100进行药物递送之间的时间。注射状态可以对应于在药物递送的过程中系统100的配置。在某些实施例中,注射状态也可以存在于激活与药物递送之间的时间中,在此期间将针头或其他递送构件插入患者体内。注射后状态可以对应于药物递送完成之后和/或当塞子在容器内被布置在给药结束位置时系统100的配置。
25.图1展示了处于预注射状态的系统100。系统100包括近端102和远端104,其中远端
104由处于预注射状态的盖111限定。盖111可以可移除地附接至外壳或壳体112。在使用之前,患者或使用者可以将盖111从外壳体112拆下以暴露开口,从而为皮下递送构件(比如针头或套管)提供通道。在所展示的实施例中,外壳体112由三个单独的(即分立的)且刚性连接的部件构成,这些部件从远端104到近端102如下布置:前壳体部分112a,后壳体部分112b和最后面的壳体部分112c。通过它们的刚性连接,可以防止壳体部分112a、112b和112c相对于彼此移动。在一些版本中,壳体部分112a、112b和112c可以根据它们在预注射状态、注射状态和/或注射后状态下所承受负载的量(如果有)而由不同的材料制成和/或具有不同的厚度。在替代性实施例中,壳体部分112a、112b和112c可以彼此一体地形成,使得壳体部分112a、112b和112c形成单个体结构。
26.外壳体112可以包括外表面113和内表面114,该外表面被配置为在注射过程中由患者或使用者握持,该内表面限定了中空内部空间115,在该中空内部空间中设置有多个不同的移动部件。外壳体112在总体上可以具有伸长形状(比如中空的圆柱体或管)或任何其他合适的形状。
27.系统100还可以包括容器130,该容器填充有(例如,预填充有)药物或可填充有(例如,在使用系统100时由患者或使用者填充)药物。容器130被设置或可被设置在外壳体112的内部空间115内、尤其是在前壳体部分112a内。容器130可以由制造商预先装载在内部空间115内,或者在使用时由患者或使用者装载在内部空间115内。在本实施例中,容器130被配置为预填充注射器,其具有从其远端突出的押针刚性中空针头132。针头132与容器130的内部孔或贮存器134流体连通地连接。在替代性实施例中,容器130可以被配置为药筒,其最初不与针头132或其他皮下递送构件处于流体连通。相反,皮下递送构件和/或流体路径连接组件可以在系统100激活时被致动,以便在贮存器134与皮下递送构件之间建立流体连通。除了针头132以外或作为针头的替代,在一些实施例中可以包括柔性套管。尽管针头132可以由比如金属等刚性材料构成,但是柔性套管可以由比如塑料等相对较软的材料构成造。
28.针头132可以包括在其近端与远端之间延伸的中空内部通道,以允许药物在注射期间流过针头132。可以在针头132的远端形成一个或多个开口,以允许将药物经皮下递送给患者。此外,针头132的远端可以包括锥形区域,在此皮下递送构件42的宽度逐渐减小至尖头。尖头可能足够锐利以至少刺穿患者的皮肤和皮下组织。在一些版本中,尖头可以足够锐利以同样穿透其他组织(包括例如肌肉、动脉壁和/或骨)。可移除护罩140(例如刚性的针头护罩)可以可移除地附接至容器130并且包围针头132的远端(包括其尖头),以在使用前将针头132的远端保持处于无菌状态下。可移除护罩140可以连接至盖111,使得盖111的移除导致从容器130上拆下可移除护罩140,从而露出针头132的远端。
29.仍参考图1,容器130可以包括限定内部孔或贮存器134的刚性壁136。壁136可以由玻璃或塑料制成。除了容纳药物之外,贮存器134还可以容纳塞子138。塞子138可以可移动地设置在容器130内,以使得该塞子可以沿着容器130的纵轴在远侧方向上从贮存器134的近端移动到贮存器134的远端。塞子138可以可滑动地且密封地与壁136的内表面139接触,从而在塞子138运动时防止或阻止药物泄漏通过塞子138。结果是,当在远侧方向上驱动塞子138时,塞子138能够将容纳在贮存器134中的药物通过针头132排出。容器130的近端可以是敞开的,以允许柱塞154延伸到容器30中并且在远侧方向上推动塞子138。塞子138可以继
续在远侧方向上移动,直到该塞子与壁136的内表面139的面向近侧的部分接触为止,如图3a和图3b所示。塞子138的此位置可以被称为给药结束位置,并且可以对应于完成向患者递送药物的时间。塞子138可以由橡胶或任何其他合适的材料构成。
30.如图1所示,容器130可以部分或全部接纳在托架或容器保持器139内。容器保持器139通常用作容器130的安装件并且可以刚性地连接至容器130,使得容器130和容器保持器139在系统100操作期间不会相对于彼此移动。另外,在某些实施例中,容器保持器139可以刚性地安装到前壳体部分112a,使得容器保持器139和前壳体部分112a在系统100操作期间也不会相对于彼此移动。在替代性实施例中,在系统100的操作期间,容器130和/或容器保持器139可以相对于前壳体部分112a移动。容器保持器139可以具有中空且大致圆柱形或管状的形状,并且可以在其周向壁中形成多个不同的开口或切口。
31.继续参考图1,系统100还可以包括防护机构140以用于防止使用者或患者在使用前意外地与针头132的尖头接触。防护机构140可以包括可移动地设置在外壳体112的远端处的防护构件142。防护构件142可以具有中空且大致圆柱形或管状的形状。防护机构140可以进一步包括防护偏置构件144(例如弹簧),当系统100不使用时,防护偏置构件朝着从外壳体112突出的伸出位置推动防护构件142(如图1所描绘的),并且当将系统100的远端104压靠患者的皮肤时,防护偏置构件允许防护构件142在近侧方向上缩回到外壳体112的内部空间115中(如图2a
‑
2c所示)。作为这种缩回的结果,针头132的远端可以露出并允许刺入患者的皮肤。
32.防护构件142的缩回还可以具有致动触发组件146的作用。如图1所描绘的,触发组件146包括触发环147和触发套筒149。触发套筒149和触发环147可以彼此刚性连接,使得它们彼此一起共同运动。尽管触发套筒149和触发环147在本实施例中是分立的结构,但是在替代性实施例中,触发套筒149和触发环147可以彼此一体地形成为单个整体结构。触发套筒149可以刚性地连接至防护构件142,使得当系统100的远端104压靠患者的皮肤时,这两个部件一起在近侧方向上共同运动。触发套筒149和/或防护构件142可以与患者的皮肤接触以引起缩回。触发套筒149的缩回又在近侧方向上推动触发环147,如图2a
‑
2c所见。
33.取决于其位置,触发环147可以选择性地与机械联动装置152接合。如以下更详细地描述的,当机械联动装置152自由移动或致动时,机械联动装置将由能量源所输出的力传递到柱塞154,以使柱塞154作用于塞子138以将药物从容器130中排出。在预注射状态下(图1),触发环147可以与机械联动装置152的部件(例如柱塞套筒162)接合(例如直接接触)以阻止或防止机械联动装置152运动。在注射状态下,当通过使触发套筒149缩回而使触发环147在近侧方向上移位时,触发环147可以与机械联动装置152分离,从而释放机械联动装置152而相对于外壳体112移动(如图2a
‑
2c所示)。通过如此配置,触发环147充当机械联动装置152的锁。在替代性实施例中,代替充当锁,触发环147可以充当钥匙,当通过使触发套筒149缩回来使触发环147移动时促进机械联动装置152的致动。在其他替代性实施例中,可以省略触发套筒149,并且例如可以通过可用手指/拇指按下的按钮来使触发环147移位,以便允许机械联动装置152的致动。
34.系统100还可以包括驱动组件150,该驱动组件存储致动能量并且在患者或使用者激活时释放致动能量以驱动塞子138穿过容器130以排出药物和/或驱动针头132进入患者的组织内。驱动组件150可以设置在外壳体112内,驱动组件150的至少一部分设置在后壳体
部分112b内。驱动组件150可以包括但不限于能量源151、机械联动装置152、柱塞154、能量源引导件158以及能量源壳体160。
35.在图1所展示的实施例中,柱塞154包括具有螺纹外表面156的杆155以及连接至杆155的远端的垫片157。垫片157可以刚性地连接至杆155并且与杆直接接触,使得杆155和垫片157在操作期间一起共同移动。在替代性实施例中,杆155和垫片157可以不是分立的部件,而是彼此一体地形成为单个整体结构。在预注射状态,垫片157可以与塞子138间隔开一定距离,如图1所描绘的。在注射状态下,垫片157可以碰撞并施加力或以其他方式作用于塞子138,以在远侧方向上驱动塞子138通过贮存器134,如图2a
‑
2c所见。
36.能量源151可以被配置为存储机械能、电能和/或化学能。在激活时,能量源151可以释放或以其他方式输出这种能量,以便产生对系统100的一个或多个部件进行致动所需的原动力。能量源151可以采用任何形式,包括但不限于一个或多个弹簧(例如,螺旋压缩弹簧、螺旋拉伸弹簧、螺旋扭转弹簧、螺旋形扭转弹簧等)、一个或多个电动马达和/或一种或多种产生气体或液体的化学物质或其任何组合。在图1
‑
3b所示的实施例中,能量源151由螺旋形扭转弹簧161限定,该螺旋形扭转弹簧有时也称为表簧。在预注射状态下,螺旋形扭转弹簧161可以保持处于缠绕状态或通电状态。系统100的激活可以释放螺旋形扭转弹簧161,使得它可以解开缠绕到断电状态或较少通电状态。
37.根据能量源151包括弹簧的实施例,能量源151可以在预注射状态下和在注射状态下以及可选地在注射后状态下输出偏置力。在其他实施例中,比如在能量源151包括电动马达的情况下,能量源151可以仅在注射状态下输出力。在本实施例中,螺旋形扭转弹簧161输出的力是旋转力(即转矩)。
38.在一些实施例中,由能量源151输出的力的大小可以在预注射状态下、在注射状态下和/或在注射后状态下的过程中变化。在能量源151包括弹簧的实施例中,能量源151输出的力在预注射状态下可以具有最大幅值,然后在注射状态的过程中逐渐减小幅值,而在注射后状态下具有最小幅值。而且,在弹簧实施例中,在预注射状态下和/或注射后状态下,能量源151输出的力的幅值可以恒定或不变。在替代性实施例中,在整个预注射状态下、在注射状态下和/或在注射后状态下,能量源151输出的力可以具有恒定的幅值。
39.能量源151输出的力可能没有对准塞子138的行进方向。因此包括机械联动装置152以接收由能量源151输出的力并且沿塞子138的行进方向传递该力,在本实施例中塞子对准容器130的纵轴。在本实施例中,机械联动装置152包括柱塞套筒或引导件162和螺母164。机械联动装置152的替代性实施例可以包括更少或更多的部件。柱塞套筒162可以具有中空且大致圆柱形或管状的形状,并且至少在预注射状态下接纳柱塞154的杆155的近端。在一些实施例中,柱塞套筒162的内径可以大于柱塞154的外径,以使得柱塞套筒162不与柱塞154彼此接触;然而,在其他实施例中,两个部件可以彼此接触或允许其彼此接触。螺母164可以是环形的,并且可以在预注射状态下接纳柱塞154的杆155的远端的至少一部分。螺母164可以具有螺纹内表面165,该螺纹内表面与柱塞154的杆155的螺纹外表面156处于螺纹接合。通过这种螺纹接合,螺母164相对于杆155的旋转可以在远侧方向上线性地驱动杆155。在本实施例中,柱塞套筒162和螺母164是刚性地连接在一起的分立部件;然而,在替代性实施例中,柱塞套筒162和螺母164可以彼此一体地形成为单个整体结构。
40.柱塞套筒162的近端可以直接连接至能量源151,使得柱塞套筒162直接接收能量
源151输出的力,并且可以由该力来致动。在本实施例中,由能量源151致动柱塞套筒162涉及在注射状态下柱塞套筒162绕柱塞154旋转。柱塞套筒162的远端可以刚性地连接至螺母164,使得柱塞套筒162和螺母164在注射状态下一起共同旋转。螺母164的旋转运动经由这两个部件之间的螺纹接合被转换成柱塞154的远侧线性运动。柱塞154的远侧线性运动被传递到塞子138,塞子又经由针头132将药物从容器130排出。
41.在预注射状态下,触发环147可以锁定地与柱塞套筒162的外表面接合,从而阻止或防止柱塞套筒162旋转(参见图1)。在注射状态下,触发环147可以移位到不再与柱塞162接合的位置,从而允许柱塞套筒162旋转并经由螺母164在远侧线性方向上驱动柱塞154(参见图2a
‑
2c)。柱塞154可以在远侧线性方向上推动塞子138,直到通过壁136的内表面139的面向近侧的部分而使其停止在给药结束位置,如图3a和图3b所描绘的。在此,即使针头132可能尚未从患者组织中移除,系统100仍被视为处于注射后状态下。
42.尽管本实施例涉及将旋转运动转换成线性运动的机械联动装置152,但是替代性实施例(比如采用压缩或拉伸弹簧作为能量源的替代性实施例)可以涉及机械联动装置接收线性运动并输出线性运动。
43.在一些实施例中,容器130、塞子138、触发环147、柱塞154、柱塞套筒162和/或螺母164可以分别对准容器130的纵轴和/或以该纵轴为中心。
44.能量源壳体160可以设置在外壳体112(特别是后壳体部分112b)内并且与其刚性连接并直接接触。在替代性实施例中,能量源壳体160可以定位在外壳体112的外部,但仍刚性地连接至外壳体。在这样的替代性实施例中,能量源壳体160可以对应于后壳体部分112b,并且因此形成系统100的外表面的一部分。能量源壳体160可以具有中空且大致圆柱形或管状的形状,并且可以全部或部分地接纳能量源引导件158,使得能量源壳体160包围或部分地包围能量源引导件158。能量源壳体160可以用作能量源引导件158的安装件;并且能量源壳体160和能量源引导件158可以彼此刚性连接并直接接触,使得它们不能相对于彼此移动。在所展示的实施例中,能量源壳体160和能量源引导件158是刚性地连接在一起的分立部件;然而,在替代性实施例中,能量源壳体160和能量源引导件158可以彼此一体地形成为单个整体结构。
45.能量源引导件158可以具有中空且大致圆柱形或管状的形状,并且可以全部或部分接纳能量源151,使得能量源引导件158包围或部分地包围能量源151。在注射状态期间,能量源151或其一部分可以相对于能量源引导件158旋转或以其他方式移动。在一些实施例中,能量源引导件158可以与能量源151直接接触,并且用作能量源151推出的安装件。
46.仍参考图1,在某些实施例中,系统100可以包括阻尼器组件172。阻尼器组件172通常用作减震器,该减震器可操作用于吸收或衰减由柱塞154撞击塞子138引起的冲击脉冲。如果不经减轻,则这种脉冲可能会使可能由玻璃制成的容器130破碎或破坏,并且还可能破坏系统100的其他部件。当最初释放时,与柱塞行程的后期相比,能量源151的输出力可以处于其最大幅值。结果是,在柱塞154作用于塞子138之前,能量源151可以将柱塞154加速到相对较高的速度。阻尼器组件172可以可操作用于在柱塞作用于塞子138之前减小柱塞154的速度。如图1所示,阻尼器组件172可以包括阻尼器壳体174和阻尼器构件176。阻尼器构件176可以固定地连接至柱塞套筒162,使得这两个部件在注射状态下一起共同旋转。在一些实施例中,阻尼流体可以被密封在阻尼器壳体174内并且与阻尼器构件176接触。阻尼流体
可以至少最初用以抵抗阻尼器构件176的旋转运动,从而提供预期的阻尼效果。在替代性实施例中,可以省略阻尼流体,而是可以经由阻尼器构件176的外表面与阻尼器壳体174的内表面之间的摩擦接触来实现阻尼效果。
47.阻尼器壳体174可以设置在外壳体112(特别是最后面的壳体部分112c)内并与其刚性连接并直接接触。在替代性实施例中,阻尼器壳体174可以定位在外壳体112的外部并且与其刚性连接。在这样的替代性实施例中,阻尼器壳体174可以对应于最后面的壳体部分112c,并因此形成系统100的外表面的一部分。阻尼器壳体174可以具有中空且大致圆柱形或管状的形状,并且可以全部或部分地接纳阻尼器构件176,使得阻尼器壳体174包围或部分地包围阻尼器构件176。尽管阻尼器构件176可以能够相对于阻尼器壳体174旋转,但是阻尼器构件176的其他自由度可能受到限制。
48.在一些实施例中,阻尼器构件176可以是环形的并且接纳柱塞套筒162的近端的一部分,如图1所展示的。阻尼器构件176的内表面可以直接且可滑动地与柱塞套筒162的外表面接触。在注射状态期间,这两个表面之间的摩擦可以提供所期望的阻尼效果。其他实施例可以另外地或可替代地依靠减震材料和/或液压流体来提供所期望的阻尼效果。
49.尽管本披露将系统100的某些部件被描述和/或展示为单独的分立元件,但是应当理解,在一些实施例中,这样的部件可以彼此一体地形成为单个的整体结构,包括被描述/或展示为彼此直接接触和/或刚性连接的部件,只要在系统100的使用或操作期间不需要这样的部件相对于彼此移动即可。
50.已经描述了系统100的配置和操作,现在将对系统100的有利的力学特性和受力特性进行描述。基础物理学教导所有力成对出现,使得如果一个物体在另一物体上施加力,则第二个物体在第一个物体上施加相等且相反的反作用力。如果第二个物体将力传递给第三个物体,则第三个物体在第二个物体上施加相等且相反的反作用力,依此类推其他进行力传递的物体。如果将物体可操作地串联连接(即一个接一个),并且将第一个物体和最后一个物体可操作地彼此连接,则可以形成力传递环路。施加的力和由施加的力引起的任何反作用力可以沿力传递环路起作用。如果只有可操作地串联连接的物体承受所施加的力和任何反作用力,则可以认为力传递环路是闭环的。相反,如果存在从力传递环路接收力的附加物体、但是此附加物体不能与其他物体可操作地串联连接,则可以认为力传递环路是开环的。在此,由于从力传递环路接收力,附加物体可以相对于其他物体运动。
51.在预注射状态、注射状态和/或注射后状态期间,在注射系统100内可以存在多种不同的力传递环路。与传统注射系统相比,系统100配置有更少的暴露于力传递环路的部件,这样可以在系统100的设计和/或制造中提供更大的自由度。换句话说,系统100中存在的力传递环路可以比传统注射系统中存在的等效力传递环路更短。
52.在某些实施例中,处于预注射状态、注射状态和注射后状态中的任何和所有状态下,可以将外壳体112的整体或至少前壳体部分112a从任何和所有力传递环路中排除。这样,外壳体112或至少前壳体部分112a可以基本上不需要或可能不需要承受由能量源151输出的力直接或间接引起的任何负载或机械应力。因此,在外壳体112或至少前壳体部分112a的设计和/或制造中可以具有更大的灵活性。
53.力传递环路可以直接或间接地接收由能量源151输出的力。如以下更详细地描述的,某些力传递环路可以包括与其他部件可操作地串联连接的能量源151。相反,其他力传
递环路可以不包括能量源151。然而,这样的力传递环路可以间接地接收能量源151输出的力。
54.参考图1,在预注射状态下,系统100可以具有第一力传递环路180(以虚线展示)。在某些实施例中,第一力传递环路180可以直接接收由能量源151输出的力。至少能量源151、柱塞套筒162、触发环147、螺母164、能量源壳体160和能量源引导件158可以可操作地串联连接(例如,直接连接或间接连接)以限定第一力传递环路180。至少可以将前壳体部分112a从第一力传递环路180中排除,但是在一些实施例中,可以将整个外壳体112从第一力传递环路180中排除。在一些实施例中,第一力传递环路180可以被限制为是(即独享)能量源151、柱塞套筒154、触发环147、螺母164、能量源壳体160和能量源引导件158之间的可操作连接。在这样的实施例中,可以通过在预注射状态下如下配置来实现第一传递环路180:能量源151与柱塞套筒162直接接触,柱塞套筒162与触发环147直接接触,触发环147与螺母164直接接触,螺母164与能量源壳体160直接接触,能量源壳体160与能量源引导件158直接接触,并且能量源引导件158与能量源151直接接触。
55.转向图2a
‑
2c,现在将对在注射状态下存在的多种不同的力传递环路进行描述。图2a展示了在注射状态下存在的第二力传递环路182(以虚线展示)。在某些实施例中,第二力传递环路182可以直接接收由能量源151输出的力。至少能量源151、柱塞套筒162、阻尼器构件176、阻尼器壳体174和能量源引导件158可以可操作地串联连接以限定第二力传递环路182。至少可以将前壳体部分112a从第二力传递环路182中排除,但是在一些实施例中可以将整个外壳体112从第二力传递环路182中排除。在一些实施例中,第二力传递环路182可以被限制为是能量源151、柱塞套筒162、阻尼器构件176、阻尼器壳体174和能量源引导件158之间的可操作连接。在这样的实施例中,可以通过在注射状态下如下配置来实现第二传递环路182:能量源151与柱塞套筒154直接连接,柱塞套筒154与阻尼器构件176直接接触,阻尼器构件176与阻尼器壳体174直接接触,阻尼器壳体174与能量源引导件158直接接触,并且能量源引导件158与能量源151直接接触。在一些实施例中,代替阻尼器构件176与阻尼器壳体174之间的直接接触,阻尼器构件176可以经由上述阻尼流体可操作地连接至阻尼器壳体174。
56.图2b展示了在注射状态下存在的第三力传递环路184(以虚线展示)。在某些实施例中,第三力传递环路184可以间接地接收由能量源151输出的力。至少螺母164、柱塞154、塞子138、容器130和容器保持器139可以可操作地串联连接以限定第三力传递环路184。至少可以将前壳体部分112a从第三传递环路184中排除,但是在一些实施例中可以将整个外壳体112从第二力第三环路184中排除。在一些实施例中,第三力传递环路184可被限制为是螺母164、柱塞154、塞子138、容器130和容器保持器139之间的可操作连接。在这样的实施例中,可以通过在注射状态下如此配置来实现第三传递环路184:螺母164与柱塞154直接接触,柱塞154与塞子138直接接触,塞子138与容器130直接接触,容器130与容器保持器139直接接触,并且容器保持器139与螺母164直接接触。
57.图2c展示了在注射状态下存在的第四力传递环路186(以虚线展示)。在某些实施例中,第四力传递环路186可以直接接收由能量源151输出的力。至少能量源151、柱塞套筒162、柱塞154、螺母164、能量源壳体160、能量源引导件158可以可操作地串联连接以限定第四力传递环路186。至少可以将前壳体部分112a从第四传递环路186中排除,但是在一些实
施例中可以将整个外壳体112从第四传递环路186中排除。在一些实施例中,第四传递环路186可以被限制为是能量源151、柱塞套筒162、柱塞154、螺母164、能量源壳体160和能量源引导件158之间的可操作连接。在这样的实施例中,可以通过在注射状态下如下配置来实现第四传递环路186:能量源151与柱塞套筒162直接接触,柱塞套筒162与柱塞154直接接触,柱塞154与螺母164直接接触,螺母164与能量源壳体160直接接触,能量源壳体160与能量源引导件158直接接触,并且能量源引导件158与能量源151直接接触。
58.现在参考图3a和图3b,将对在注射后状态下存在的多种不同的力传递环路进行描述。图3a展示了在注射后状态下存在的第五力传递环路188(以虚线展示)。在某些实施例中,第五力传递环路188可以间接地接收由能量源151输出的力。至少螺母164、柱塞154、塞子138、容器130和容器保持器139可以可操作地串联连接以限定第五力传递环路188。至少可以将前壳体部分112a从第五力传递环路188排除,但是在一些实施例中可以将整个外壳体112从第五传递环路188排除。在一些实施例中,第五力传递环路188可以被限制为是螺母164、柱塞154、塞子138、容器130和容器保持器139之间的可操作连接。在这样的实施例中,可以通过在注射后状态下如下配置来实现第五力传递环路188:螺母164与柱塞154直接接触,柱塞154与塞子138直接接触,塞子138与容器130直接接触,容器130与容器保持器139直接接触,并且容器保持器139与螺母164直接接触。
59.图3b展示了在注射后状态下存在的第六力传递环路190(以虚线展示)。在某些实施例中,第六力传递环路190可以直接接收由能量源151输出的力。至少能量源151、柱塞套筒162、柱塞154、螺母164、能量源壳体160和能量源引导件158可以可操作地串联连接以限定第六力传递环路190。至少可以将前壳体部分112a从第六力传递环路190中排除,但是在一些实施例中可以将整个外壳体112从第六力传递环路190中排除。在一些实施例中,第六力传递环路190可以被限制为是能量源151、柱塞套筒162、柱塞154、螺母164、能量源壳体160和能量源引导件158之间的可操作连接。在这样的实施例中,可以通过在注射后状态下如下配置来实现第六力传递环路190:能量源151与柱塞套筒162直接接触,柱塞套筒162与柱塞154直接接触,柱塞154与螺母164直接接触,螺母164与能量源壳体160直接接触,能量源壳体160与能量源引导件158直接接触,并且能量源引导件158与能量源151直接接触。
60.现在参考图4,展示了系统100的替代性实施例的预注射状态。在此,限定第一力传递环路的部件组与结合图1的实施例描述的限定第一力传递环路的部件组不同。与图1所示系统的元件相同或相似的图4所示系统的元件由相同的附图标记增加100表示。为了简洁起见,对这些元件中的许多元件的描述都被简化甚至省略。
61.系统200和系统100之间的结构差异在于,触发环247经由延伸构件297直接连接至能量源引导件258,该延伸构件可以与触发环247或能量源引导件258一体形成。结果是,力可以经由延伸构件297直接在触发环247和能量源引导件258之间传递。相反,在系统100中,触发环147经由能量源壳体160连接至能量源引导件158。在系统200中,可以将能量源壳体260从第一力传递环路280(在图4中以虚线展示)中排除。因此,在系统200中,能量源壳体260可以基本上不需要或可能不需要承受由能量源251输出的力引起的任何负载或机械应力。
62.更具体地,关于图4的实施例,至少能量源251、柱塞套筒262、触发环247、螺母264和能量源引导件258可以可操作地串联连接以限定预注射状态下的第一力传递环路280。在
一些实施例中,第一力传递环路280可以被限制为是能量源251、柱塞套筒254、触发环247、螺母264和能量源引导件258之间的可操作连接。在这样的实施例中,可以通过在预注射状态下如下配置来实现第一传递环路280:能量源251与柱塞套筒262直接接触,柱塞套筒262与触发环247直接接触,触发环247与螺母264直接接触,螺母264与能量源引导件258直接接触,并且能量源引导件258与能量源251直接接触。
63.转到图5,展示了系统100的替代性实施例的注射状态。在此,限定第三力传递环路的部件组与结合图2b的实施例描述的限定第三力传递环路的部件组不同。与图2b所示系统的元件相同或相似的图5所示系统的元件由相同的附图标记增加200表示。为了简洁起见,对这些元件中的许多元件的描述都被简化甚至省略。
64.系统300与系统100之间存在若干结构差异。系统300的柱塞354不包括与螺母的内表面处于螺纹接合的外表面。相反,柱塞354具有螺纹内表面395,该螺纹内表面与容器330的螺纹外表面396处于螺纹接合。柱塞354的螺纹内表面395和容器330的螺纹外表面396可以共同限定系统300的机械联动装置。另一差异在于,触发环347选择性地与柱塞354外部的一部分接合以控制致动柱塞354。在注射状态下,当触发环347与柱塞354分离时,柱塞354可以在能量源351输出的力的作用下旋转,这样进而经由表面395和396之间的螺纹接合而引起柱塞354的线性运动。
65.继续参考图5,至少柱塞354、塞子338和容器330可以可操作地串联连接以限定处于注射状态下的第三力传递环路384(图5中的虚线所示)。在一些实施例中,第三力传递环路384可以被限制为是柱塞354、塞子338和容器330之间的可操作连接。在这样的实施例中,可以通过在注射状态下如下配置来实现第三力传递环路384:柱塞354与塞子338直接接触,塞子338与容器330直接接触,并且容器330与柱塞354直接接触。
66.转到图6,展示了系统100的替代性实施例的注射后状态。在此,限定第五力传递环路的部件组与结合图3a的实施例描述的限定第五力传递环路的部件组不同。与图3a所示系统的元件相同或相似的图6所示系统的元件由相同的附图标记增加300表示。为了简洁起见,对这些元件中的许多元件的描述都被简化甚至省略。
67.系统400与系统100之间存在若干结构差异。在系统100中,容器保持器139能够直接将力传递到螺母164。相反,在系统400中,容器保持器439经由连接器构件495、前壳体部分412a、后壳体部分412b和连接器构件496将力传递至螺母164。容器保持器439和连接器构件495可以一体地形成为单个整体结构,或者形成为两个单独的但刚性连接的部分。螺母164和连接器构件496可以一体地形成为单个整体结构或两个单独的但刚性连接的部分。
68.继续参考图6,至少螺母464、柱塞454、塞子438、容器430、容器保持器439、前壳体部分412a和后壳体部分412b可以可操作地串联连接以限定注射后状态下的第五力传递环路488(以虚线展示)。在一些实施例中,第五力传递环路488可被限制为是螺母464、柱塞454、塞子438、容器430、容器保持器439、前壳体部分412a和后壳体部分412b之间的可操作连接。在这样的实施例中,可以通过在注射后状态下如下配置来实现第五力传递环路488:螺母464与柱塞454直接接触,柱塞454与塞子438直接接触,塞子438与容器430直接接触,容器430与容器保持器439直接接触,容器保持器439与前壳体部分412a直接接触,前壳体部分412a与后壳体部分412b直接接触,并且后壳体部分412b与螺母464直接接触。
69.转到图7,展示了系统100的另一替代性实施例的注射后状态。在此,限定第六力传
递环路的部件组与结合图3b的实施例描述的限定第六力传递环路的部件组不同。与图3b所示系统的元件相同或相似的图7所示系统的元件由相同的附图标记增加400表示。为了简洁起见,对这些元件中的许多元件的描述都被简化甚至省略。
70.继续参考图7,至少能量源551、柱塞套筒562、柱塞554、塞子538、容器530、容器保持器539、螺母564、能量源壳体560和能量源引导件558可以可操作地串联连接以限定注射后状态下的第六力传递环路590(以虚线展示)。
71.在一些实施例中,第六力传递环路590可被限制为是能量源551、柱塞套筒562、柱塞554、塞子538、容器530、容器保持器539、螺母564、能量源壳体560和能量源引导件558之间的可操作连接。
72.在这样的实施例中,可以通过在注射后状态下如下配置来实现第六力传递环路590:能量源551与柱塞套筒562直接接触,柱塞套筒562与柱塞554直接接触,柱塞554与塞子538直接接触,塞子538与容器530直接接触,容器530与容器保持器539直接接触,容器保持器539与螺母564直接接触,螺母564与能量源壳体560直接接触,能量源壳体560与能量源引导件558直接接触,并且能量源引导件558与能量源551直接接触。
73.将会认识到,根据本披露的系统、装置和方法相对于传统技术可以具有一个或多个优点,其中任何一个或多个优点可以存在于根据包含在该实施例中的本披露的特征的特定实施例中。还可以认识到本文未具体列出的其他优点。
74.药物信息
75.以上描述对用于药物输送装置的不同的组件、装置和方法进行了描述。应当清楚的是,这些组件、药物输送装置或方法可以进一步包括使用下文列出的药剂,但需要注意的是,以下列表既不应当被视为包括所有药物,也不应当被视为具有限制性。药剂将会包含在贮器中。在一些情况下,贮器是主容器,该主容器用药剂进行填充或预填充以用于治疗。该主容器可以是药筒或预填充针筒。
76.例如,药物输送装置或更具体地该装置的贮器可以填充有集落刺激因子,诸如粒细胞集落刺激因子(g
‑
csf)。此类g
‑
csf剂包括但不限于(非格司亭)和(培非格司亭)。在各种其他实施例中,药物输送装置可以与各种药学产品(诸如红细胞生成刺激剂(esa))一起使用,这些药学产品可以呈液体或冻干形式。esa是刺激红细胞生成的任何分子,比如(依伯汀α)、(达贝泊汀α)、(依伯汀δ)、(甲氧基聚乙二醇
‑
依伯汀β)、mrk
‑
2578、ins
‑
22、(依伯汀ζ)、(依伯汀β)、(依伯汀ζ)、(依伯汀α)、epoetin alfa hexal、(依伯汀α)、(依伯汀θ)、(依伯汀θ)、(依伯汀θ)、依伯汀α、依伯汀β、依伯汀ζ、依伯汀θ和依伯汀δ以及以下专利或专利申请中披露的分子或变体或其类似物:美国专利号4,703,008;5,441,868;5,547,933;5,618,698;5,621,080;5,756,349;5,767,078;5,773,569;5,955,422;5,986,047;6,583,272;7,084,245;和7,271,689;以及pct公开号wo 91/05867;wo 95/05465;wo 96/40772;wo 00/24893;wo 01/81405和wo 2007/136752,这些专利申请各自通过引用以其全部并入本文。
77.esa可以是红细胞生成刺激蛋白。如本文所用,“红细胞生成刺激蛋白”意指任何直接或间接引起促红细胞生成素受体激活(例如,通过结合并引起受体的二聚化)的蛋白。红细胞生成刺激蛋白包括结合并激活促红细胞生成素受体的促红细胞生成素及其变体、类似物或衍生物;与促红细胞生成素受体结合并激活该受体的抗体;或结合并激活促红细胞生成素受体的肽。红细胞生成刺激蛋白包括但不限于依伯汀α、依伯汀β、依伯汀δ、依伯汀ω、依伯汀ι、依伯汀ζ及其类似物,聚乙二醇化促红细胞生成素,氨甲酰化促红细胞生成素,模拟肽(包括emp1/hematide)以及模拟抗体。示例性红细胞生成刺激蛋白包括:促红细胞生成素,达贝泊汀,促红细胞生成素激动剂变体,以及结合并激活促红细胞生成素受体的肽或抗体(并且包括美国公开号2003/0215444和2006/0040858中报道的化合物,这些专利各自的公开内容通过引用以其全部并入本文),还有如以下专利或专利申请中公开的促红细胞生成素分子或其变体或类似物:美国专利号4,703,008;5,441,868;5,547,933;5,618,698;5,621,080;5,756,349;5,767,078;5,773,569;5,955,422;5,830,851;5,856,298;5,986,047;6,030,086;6,310,078;6,391,633;6,583,272;6,586,398;6,900,292;6,750,369;7,030,226;7,084,245;和7,217,689;美国公开号2002/0155998;2003/0077753;2003/0082749;2003/0143202;2004/0009902;2004/0071694;2004/0091961;2004/0143857;2004/0157293;2004/0175379;2004/0175824;2004/0229318;2004/0248815;2004/0266690;2005/0019914;2005/0026834;2005/0096461;2005/0107297;2005/0107591;2005/0124045;2005/0124564;2005/0137329;2005/0142642;2005/0143292;2005/0153879;2005/0158822;2005/0158832;2005/0170457;2005/0181359;2005/0181482;2005/0192211;2005/0202538;2005/0227289;2005/0244409;2006/0088906;和2006/0111279;以及pct公开号wo 91/05867;wo 95/05465;wo 99/66054;wo 00/24893;wo 01/81405;wo 00/61637;wo 01/36489;wo 02/014356;wo 02/19963;wo 02/20034;wo 02/49673;wo 02/085940;wo 03/029291;wo 2003/055526;wo 2003/084477;wo 2003/094858;wo 2004/002417;wo 2004/002424;wo 2004/009627;wo 2004/024761;wo 2004/033651;wo 2004/035603;wo 2004/043382;wo 2004/101600;wo 2004/101606;wo 2004/101611;wo 2004/106373;wo 2004/018667;wo 2005/001025;wo 2005/001136;wo 2005/021579;wo 2005/025606;wo 2005/032460;wo 2005/051327;wo 2005/063808;wo 2005/063809;wo 2005/070451;wo 2005/081687;wo 2005/084711;wo 2005/103076;wo 2005/100403;wo 2005/092369;wo 2006/50959;wo 2006/02646;和wo 2006/29094,这些专利各自通过引用以其全部并入本文。
78.用于与该装置一起使用的其他医药产品的示例可以包括但不限于抗体,例如(帕尼单抗)、xgeva
tm
(狄诺塞麦)和prolia
tm
(denosamab);其他生物制剂,例如(依那西普,tnf受体/fc融合蛋白,tnf阻断剂)、(培非格司亭、聚乙二醇化非格司亭、聚乙二醇化g
‑
csf、聚乙二醇化hu
‑
met
‑
g
‑
csf)、(非格司亭、g
‑
csf、hu
‑
metg
‑
csf)和(罗米司亭(romiplostim));小分子药物,例如(西那卡塞)。该装置还可以与治疗性抗体、多肽、蛋白质或其他化学物质(诸如铁,例如纳米氧化铁(ferumoxytol)、右旋糖酐铁、葡糖酸铁和蔗糖铁)一起使用。药学产品可以呈液体形式,或可以由冻干形式重构。
79.具体的说明性蛋白质是下文阐述的特定蛋白质,包括其融合物、片段、类似物、变体或衍生物:
80.opgl特异性抗体、肽体和相关蛋白等(也称为rankl特异性抗体、肽体等),包括完全人源化opgl特异性抗体和人opgl特异性抗体,特别是完全人源化单克隆抗体,包括但不限于在pct公开号wo 03/002713(将其以全文并入本文)中关于opgl特异性抗体和抗体相关蛋白所描述的抗体,特别是具有其中列出的序列的那些,特别是但不限于其中指明的那些:9h7;18b2;2d8;2e11;16e1;和22b3,包括具有如图2中所示的序列识别号2的轻链和/或如图4中所示的序列识别号4的重链的opgl特异性抗体,将它们各自如在上述公开物中所公开地通过引用以其全部整体单独地和具体地并入本文;
81.肌生成抑制蛋白结合蛋白、肽体和相关蛋白等,包括肌生成抑制蛋白特异性肽体,特别是在美国公开号2004/0181033和pct公开号wo 2004/058988(将其通过援引以其全文并入本文)中特别是在与肌生成抑制蛋白特异性肽体相关的部分中所描述的那些,包括但不限于mtn8
‑
19家族的肽体,包括具有序列识别号305
‑
351的那些,包括tn8
‑
19
‑
1至tn8
‑
19
‑
40、tn8
‑
19 con1和tn8
‑
19 con2;以下的肽体:序列标识号为357
‑
383的ml2家族;序列识别号384
‑
409的ml15家族;序列识别号为410
‑
438的ml17家族;序列识别号439
‑
446的ml20家族;序列识别号447
‑
452的ml21家族;序列识别号453
‑
454的ml24家族;以及序列识别号为615
‑
631的那些,将它们各自如在上述公开物中所披露地通过援引以其全部内容整体单独地和具体地并入本文;
82.il
‑
4受体特异性抗体、肽体和相关蛋白等,特别是抑制由il
‑
4和/或il
‑
13与受体的结合介导的活性的那些,包括在pct公开号wo 2005/047331或pct申请号pct/us 2004/37242和美国公开号2005/112694(将其通过引用以其全部并入本文)中特别是在与il
‑
4受体特异性抗体相关的部分中所描述的那些,特别是如其中所述的抗体,特别是但不限于其中指定的那些:l1h1;l1h2;l1h3;l1h4;l1h5;l1h6;l1h7;l1h8;l1h9;l1h10;l1h11;l2h1;l2h2;l2h3;l2h4;l2h5;l2h6;l2h7;l2h8;l2h9;l2h10;l2h11;l2h12;l2h13;l2h14;l3h1;l4h1;l5h1;l6h1,将它们各自如在上述公开物中所公开地通过引用以其全部整体单独地和具体地并入本文;
83.白介素1
‑
受体1(“il1
‑
r1”)特异性抗体、肽体和相关蛋白等,包括但不限于美国公开号2004/097712中所描述的那些(将该专利通过引用以其全文、以与il1
‑
r1特异性结合蛋白相关的部分并入本文),特别是单克隆抗体,尤其是但不限于其中指定的那些:15ca、26f5、27f2、24e12和10h7,将它们中的每一种完全如在前述公开物中所披露的那样通过引用以其全文单独地且具体地并入本文;
84.ang2特异性抗体、肽体和相关蛋白等,包括但不限于在pct公开号wo03/057134和美国公开号2003/0229023(将其各自通过引用以其全部并入本文)中特别是在与ang2特异性抗体和肽体等相关的部分中所描述的那些,尤其是具有其中描述的序列的那些并且包括但不限于:l1(n);l1(n)wt;l1(n)1k wt;2xl1(n);2xl1(n)wt;con4(n),con4(n)1k wt,2xcon4(n)1k;l1c;l1c 1k;2xl1c;con4c;con4c 1k;2xcon4c 1k;con4
‑
l1(n);con4
‑
l1c;tn
‑
12
‑
9(n);c17(n);tn8
‑
8(n);tn8
‑
14(n);con 1(n);还包括抗ang 2抗体和制剂,例如在pct公开号wo 2003/030833(将其通过引用以其全部按原样并入本文)中所描述的那些,特别是处于其中所述的各种排列形式(permutation)的ab526;ab528;ab531;ab533;ab535;
ab536;ab537;ab540;ab543;ab544;ab545;ab546;a551;ab553;ab555;ab558;ab559;ab565;abf1abfd;abfe;abfj;abfk;abg1d4;abgc1e8;abh1c12;abla1;ablf;ablk;ablp;和ablp;将它们各自如在上述公开物中所公开地通过引用以其全部整体单独地和具体地并入本文;
85.ngf特异性抗体、肽体和相关蛋白等,特别地包括但不限于美国公开号2005/0074821和美国专利号6,919,426中所描述的那些(将这些专利特别是关于ngf特异性抗体和相关蛋白的方面通过引用以其全文并入本文),就这一点而言特别地包括但不限于其中指定为4d4、4g6、6h9、7h2、14d10和14d11的ngf特异性抗体,将它们中的每一种完全如在前述公开物中所披露的那样通过引用以其全文单独地且具体地并入本文;
86.cd22特异性抗体、肽体和相关蛋白等,诸如美国专利号5,789,554中所描述的那些(将该专利关于cd22特异性抗体和相关蛋白的方面通过引用以其全文并入本文),特别是人cd22特异性抗体,诸如但不限于人源化和完全人抗体,包括但不限于人源化和完全人单克隆抗体,特别地包括但不限于人cd22特异性igg抗体,例如像人
‑
小鼠单克隆hll2γ
‑
链与人
‑
小鼠单克隆hll2κ链进行二硫化物连接的二聚体,包括但不限于例如依帕珠单抗(epratuzumab)中的人cd22特异性完全人源化抗体,cas登记号501423
‑
23
‑
0;
87.igf
‑
1受体特异性抗体、肽体和相关蛋白等,诸如pct公开号wo 06/069202中所描述的那些(将该专利关于igf
‑
1受体特异性抗体和相关蛋白的方面通过引用以其全文并入本文),包括但不限于其中指定为l1h1、l2h2、l3h3、l4h4、l5h5、l6h6、l7h7、l8h8、l9h9、l10h10、l11h11、l12h12、l13h13、l14h14、l15h15、l16h16、l17h17、l18h18、l19h19、l20h20、l21h21、l22h22、l23h23、l24h24、l25h25、l26h26、l27h27、l28h28、l29h29、l30h30、l31h31、l32h32、l33h33、l34h34、l35h35、l36h36、l37h37、l38h38、l39h39、l40h40、l41h41、l42h42、l43h43、l44h44、l45h45、l46h46、l47h47、l48h48、l49h49、l50h50、l51h51、l52h52的igf
‑
1特异性抗体,以及igf
‑
1r结合片段及其衍生物,将它们中的每一种完全如在前述公开物中所披露的那样通过引用以其全文单独地且具体地并入本文;
88.在用于本发明的方法和组合物中的抗igf
‑
1r抗体的非限制性示例中,还有以下所述的每一种和所有抗体:
89.(i)美国公开号2006/0040358(2006年2月23日公布)、2005/0008642(2005年1月13日公布)、2004/0228859(2004年11月18日公布),包括但不限于例如其中所述的抗体1a(dsmz保藏号dsm acc 2586)、抗体8(dsmz保藏号dsm acc 2589)、抗体23(dsmz保藏号dsm acc 2588)和抗体18;
90.(ii)pct公开号wo 06/138729(2006年12月28日公布)和wo 05/016970(2005年2月24日公布)、以及lu等人(2004),j.biol.chem.[生物化学杂志]279:2856
‑
2865,包括但不限于如其中所述的抗体2f8、a12和imc
‑
a12;
[0091]
(iii)pct公开号wo 07/012614(2007年2月1日公布)、wo 07/000328(2007年1月4日公布)、wo 06/013472(2006年2月9日公布)、wo 05/058967(2005年6月30日公布)和wo 03/059951(2003年7月24日公布);
[0092]
(iv)美国公开号2005/0084906(2005年4月21日公布),包括但不限于如其中所述的抗体7c10、嵌合抗体c7c10、抗体h7c10、抗体7h2m、嵌合抗体*7c10、抗体gm 607、人源化抗体7c10变体1、人源化抗体7c10变体2、人源化抗体7c10变体3和抗体7h2hm;
[0093]
(v)美国公开号2005/0249728(2005年11月10日公布)、2005/0186203(2005年8月
25日公布)、2004/0265307(2004年12月30日公布)和2003/0235582(2003年12月25日公布)以及maloney等人(2003),cancer res.[癌症研究]63:5073
‑
5083,包括但不限于如其中所述的抗体em164、表面重塑em164、人源化em164、huem164v1.0、huem164 v1.1、huem164 v1.2和huem164 v1.3;
[0094]
(vi)美国专利号7,037,498(2006年5月2日发布)、美国公开号2005/0244408(2005年11月30日公布)和2004/0086503(2004年5月6日公布)、以及cohen等人(2005),clinical cancer res.[临床癌症研究]11:2063
‑
2073,例如抗体cp
‑
751,871,包括但不限于如其中所述的由具有atcc登录号pta
‑
2792、pta
‑
2788、pta
‑
2790、pta
‑
2791、pta
‑
2789、pta
‑
2793的杂交瘤产生的每种抗体,以及抗体2.12.1、2.13.2、2.14.3、3.1.1、4.9.2和4.17.3;
[0095]
(vii)美国公开号2005/0136063(2005年6月23日公布)和2004/0018191(2004年1月29日公布),包括但不限于如其中所述的抗体19d12和以下抗体,该抗体包含由质粒15h12/19d12 hca(γ4)(以编号pta
‑
5214保藏在atcc)中的多核苷酸编码的重链以及由质粒15h12/19d12 lcf(κ)(以编号pta
‑
5220保藏在atcc)中的多核苷酸编码的轻链;以及
[0096]
(viii)美国公开号2004/0202655(2004年10月14日公布),包括但不限于如其中所述的抗体pint
‑
6a1、pint
‑
7a2、pint
‑
7a4、pint
‑
7a5、pint
‑
7a6、pint
‑
8a1、pint
‑
9a2、pint
‑
11a1、pint
‑
11a2、pint
‑
11a3、pint
‑
11a4、pint
‑
11a5、pint
‑
11a7、pint
‑
11a12、pint
‑
12a1、pint
‑
12a2、pint
‑
12a3、pint
‑
12a4、和pint
‑
12a5;将它们中的每一个和所有特别是关于靶向igf
‑
1受体的前述抗体、肽体和相关蛋白等的方面通过引用以其全文并入本文;
[0097]
b
‑
7相关蛋白1特异性抗体、肽体、相关蛋白等(“b7rp
‑
1”,在文献中也称为b7h2、icosl、b7h和cd275),特别是b7rp特异性完全人单克隆igg2抗体,特别是结合b7rp
‑
1的第一个免疫球蛋白样结构域中的表位的完全人igg2单克隆抗体,尤其是抑制b7rp
‑
1与活化的t细胞上的其天然受体icos的相互作用的那些,特别是在所有上述方面,在美国公开号2008/0166352和pct公开号wo 07/011941(将其通过引用以其全文并入本文)中关于此类抗体和相关蛋白所披露的那些,包括但不限于其中指定的如下抗体:16h(具有在此分别命名为序列识别号1和序列识别号7的轻链可变序列和重链可变序列);5d(具有在此分别命名为序列识别号2和序列识别号9的轻链可变序列和重链可变序列);2h(具有在此分别命名为序列识别号3和序列识别号10的轻链可变序列和重链可变序列);43h(具有在此分别命名为序列识别号6和序列识别号14的轻链可变序列和重链可变序列);41h(具有在此分别命名为序列识别号5和序列识别号13的轻链可变序列和重链可变序列);以及15h(具有在此分别命名为序列识别号4和序列识别号12的轻链可变序列和重链可变序列),将它们各自如在上述公开物中所披露的通过引用以其全部整体单独地和具体地并入本文;
[0098]
il
‑
15特异性抗体、肽体和相关蛋白等,例如特别是人源化单克隆抗体,特别是例如在美国公开号2003/0138421;2003/023586;和2004/0071702;以及美国专利号7,153,507(将其各自通过援引以其全文并入本文)中关于il
‑
15特异性抗体和相关蛋白所公开的那些抗体,包括肽体,特别地包括例如但不限于humax il
‑
15抗体和相关蛋白,例如146b7;
[0099]
ifnγ特异性抗体、肽体和相关蛋白等,尤其是人ifnγ特异性抗体,特别是完全人抗ifnγ抗体,例如在美国公开号2005/0004353(将其通过援引以其全文并入本文)中关于ifnγ特异性抗体所描述的那些,特别是例如其中称为1118;1118*;1119;1121;和1121*的抗体。将这些抗体中的每一种的重链和轻链的完整序列、以及它们的重链和轻链可变区和
2006/081171中所描述的那些(将该专利通过引用以其全文、特别是以与结合淀粉样蛋白
‑
β蛋白的蛋白质相关的部分并入本文)。预期的一种抗体是如在上述公开物中所披露的具有包含序列识别号8的重链可变区和包含序列识别号6的轻链可变区的抗体;
[0108]
c
‑
kit特异性抗体、肽体、相关蛋白等,包括但不限于美国公开号2007/0253951中所描述的那些(将该专利通过引用以其全文、特别是以与结合c
‑
kit和/或其他干细胞因子受体的蛋白质相关的部分并入本文);
[0109]
ox40l特异性抗体、肽体、相关蛋白等,包括但不限于美国公开号2006/0002929中所描述的那些(将该专利通过引用以其全文、特别是以与结合ox40l和/或ox40受体的其他配体的蛋白质相关的部分并入本文);以及
[0110]
其他示例性蛋白质,包括(阿替普酶,tpa);(达贝泊汀α);(依伯汀α,或促红细胞生成素);glp
‑
1,(干扰素β
‑
1a);(托西莫单抗,抗cd22单克隆抗体);(干扰素
‑
β);(阿仑单抗,抗cd52单克隆抗体);(依伯汀δ);(硼替佐米);mln0002(抗α4β7mab);mln1202(抗ccr2趋化因子受体mab);(依那西普,tnf受体/fc融合蛋白,tnf阻断剂);(依伯汀α);(西妥昔单抗,抗egfr/her1/c
‑
erbb
‑
1);(生长激素,人生长激素);(曲妥珠单抗,抗her2/neu(erbb2)受体mab);(生长激素,人生长激素);(阿达木单抗);溶液中的胰岛素;(干扰素alfacon
‑
1);(奈西立肽(nesiritide);重组人类b型利尿钠肽(hbnp);(阿那白滞素);(沙格司亭,rhugm
‑
csf);(依帕珠单抗,抗cd22mab);benlysta
tm
(lymphostat b,贝利单抗,抗blys mab);(替奈普酶,t
‑
pa类似物);(甲氧基聚乙二醇
‑
依伯汀β);(吉妥珠单抗奥佐米星);(依法利珠单抗);(塞妥珠单抗,cdp 870);soliris
tm
(依库丽单抗);培克珠单抗(抗c5补体);(medi
‑
524);(兰尼单抗);(17
‑
1a,依决洛单抗);(乐地单抗(lerdelimumab));theracim hr3(尼妥珠单抗);omnitarg(帕妥珠单抗,2c4);(idm
‑
1);(b43.13);(维西珠单抗);莫坎妥珠单抗(cantuzumab mertansine)(huc242
‑
dm1);(依伯汀β);(奥普瑞白介素,人白细胞介素
‑
11);(聚乙二醇化非格司亭,聚乙二醇化g
‑
csf,聚乙二醇化hu
‑
met
‑
g
‑
csf);(非格司亭,g
‑
csf,hu
‑
metg
‑
csf);orthoclone(莫罗单抗
‑
cd3,抗cd3单克隆抗体);(依伯汀α);(英夫利昔单抗,抗tnfα单克隆抗体);(阿昔单抗,抗gp lib/ilia受体单克隆抗体);(抗il6受体mab);(贝伐单抗),humax
‑
cd4(扎木单抗(zanolimumab));(利妥昔单抗,抗cd20 mab);(埃罗替尼);(干扰素α
‑
2a);(巴利昔单抗);(罗美昔布);
(帕利珠单抗);146b7
‑
cho(抗il15抗体,参见美国专利号7,153,507);(那他珠单抗,抗α4整合素mab);(mdx
‑
1303,抗炭疽杆菌保护性抗原mab);abthrax
tm
;(帕尼单抗);(奥马珠单抗);eti211(抗mrsa mab);il
‑
1trap(人igg1的fc部分和il
‑
1受体组分(i型受体和受体辅助蛋白)的胞外结构域);vegf trap(与igg1 fc融合的vegfr1的ig结构域);(达利珠单抗);(达利珠单抗,抗il
‑
2rαmab);(替伊莫单抗);(依泽替米贝);(阿塞西普,taci
‑
ig);抗cd80单克隆抗体(加利昔单抗(galiximab));抗cd23 mab(鲁昔单抗);br2
‑
fc(hubr3/hufc融合蛋白,可溶性baff拮抗剂);cnto 148(戈利木单抗,抗tnfαmab);hgs
‑
etr1(马帕木单抗(mapatumumab);人抗trail受体
‑
1mab);humax
‑
cd20(奥瑞珠单抗(ocrelizumab),抗cd20人mab);humax
‑
egfr(扎鲁木单抗(zalutumumab));m200(伏洛昔单抗(volociximab),抗α5β1整合素mab);mdx
‑
010(易普利姆玛,抗ctla
‑
4mab和vegfr
‑
1(imc
‑
18f1);抗br3 mab;抗艰难梭菌毒素a和毒素b c mab mdx
‑
066(cda
‑
1)和mdx
‑
1388);抗cd22 dsfv
‑
pe38缀合物(cat
‑
3888和cat
‑
8015);抗cd25 mab(humax
‑
tac);抗cd3 mab(ni
‑
0401);阿德木单抗(adecatumumab);抗cd30 mab(mdx
‑
060);mdx
‑
1333(抗ifnar);抗cd38 mab(humax cd38);抗cd40l mab;抗cripto mab;抗ctgf特发性肺纤维化i期纤维蛋白原(fg
‑
3019);抗ctla4 mab;抗嗜酸性粒细胞趋化因子1mab(cat
‑
213);抗fgf8 mab;抗神经节苷脂gd2 mab;抗神经节苷脂gm2 mab;抗gdf
‑
8人mab(myo
‑
029);抗gm
‑
csf受体mab(cam
‑
3001);抗hepc mab(humax hepc);抗ifnαmab(medi
‑
545,mdx
‑
1103);抗igf1r mab;抗igf
‑
1r mab(humax
‑
inflam);抗il12 mab(abt
‑
874);抗il12/il23mab(cnto 1275);抗il13 mab(cat
‑
354);抗il2ra mab(humax
‑
tac);抗il5受体mab;抗整合素受体mab(mdx
‑
018,cnto 95);抗ip10溃疡性结肠炎mab(mdx
‑
1100);抗lly抗体;bms
‑
66513;抗甘露糖受体/hcgβmab(mdx
‑
1307);抗间皮素dsfv
‑
pe38缀合物(cat
‑
5001);抗pd1mab(mdx
‑
1106(ono
‑
4538));抗pdgfrα抗体(imc
‑
3g3);抗tgfβmab(gc
‑
1008);抗trail受体
‑
2人mab(hgs
‑
etr2);抗tweak mab;抗vegfr/flt
‑
1mab;抗zp3 mab(humax
‑
zp3);nvs抗体#1;和nvs抗体#2。
[0111]
还可以包含硬化蛋白抗体,诸如但不限于洛莫索珠单抗(romosozumab)、布索珠单抗(blosozumab)或bps 804(诺华公司(novartis))。可以进一步包含治疗剂,诸如利妥木单抗(rilotumumab)、比沙洛姆(bixalomer)、曲班尼布(trebananib)、盖尼塔单抗(ganitumab)、可那木单抗(conatumumab)、二磷酸莫替沙尼(motesanib)、布罗达单抗(brodalumab)、维度匹仑(vidupiprant)、帕尼单抗、地诺单抗、nplate、prolia、vectibix或xgeva。另外,该装置中还可以包含结合人前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(pcsk9)的单克隆抗体(igg)。此类pcsk9特异性抗体包括但不限于(依洛尤单抗(evolocumab))和(阿利库单抗(alirocumab))以及如以下专利或专利申请中所披露的分子、其变体、类似物或衍生物,这些专利或专利申请中的每一个出于所有目的通过引用以其全文并入本文:美国专利号8,030,547、美国公开号2013/0064825、wo 2008/057457、wo 2008/057458、wo 2008/057459、wo 2008/063382、wo 2008/133647、wo 2009/100297、wo 2009/100318、wo 2011/037791、wo 2011/053759、wo 2011/053783、wo 2008/125623、wo 2011/072263、wo 2009/055783、wo 2012/0544438、wo 2010/029513、wo 2011/111007、wo 2010/077854、wo 2012/088313、wo 2012/101251、wo 2012/101252、wo 2012/
101253、wo 2012/109530、和wo 2001/031007。
[0112]
还可以包含用于治疗黑色素瘤或其他癌症的塔利莫金(talimogene laherparepvec)或另一种溶瘤hsv。溶瘤hsv的示例包括但不限于塔利莫金(美国专利号7,223,593和7,537,924);oncovexgalv/cd(美国专利号7,981,669);orienx010(lei等人(2013),world j.gastroenterol.[世界胃肠病学杂志]19:5138
‑
5143);g207、1716;nv1020;nv12023;nv1034和nv1042(vargehes等人(2002),cancer gene ther.[癌症基因治疗]9(12):967
‑
978)。
[0113]
还包含timp。timp是内源性组织金属蛋白酶抑制剂(timp),并且在许多自然过程中是重要的。timp
‑
3由各种细胞表达或和存在于细胞外基质中;它抑制所有主要软骨降解金属蛋白酶(cartilage
‑
degrading metalloprotease),并且可以在结缔组织的许多退化性疾病(包括类风湿性关节炎和骨关节炎)以及癌症和心血管病症中发挥作用。timp
‑
3的氨基酸序列和编码timp
‑
3的dna的核酸序列披露于2003年5月13日发布的美国专利号6,562,596中,将其披露内容通过引用并入本文。关于timp突变的描述可以在美国公开号2014/0274874和pct公开号wo 2014/152012中找到。
[0114]
还包含针对人降钙素基因相关肽(cgrp)受体的拮抗性抗体以及靶向cgrp受体和其他头痛靶标的双特异性抗体分子。关于这些分子的另外的信息可以在pct申请号wo 2010/075238中找到。
[0115]
此外,可以在该装置中使用双特异性t细胞接合剂抗体,例如(博纳吐单抗)。替代性地,该装置中可以包含apj大分子激动剂,例如爱帕琳肽(apelin)或其类似物。关于此类分子的信息可以在pct公开号wo 2014/099984中找到。
[0116]
在某些实施例中,该药剂包括治疗有效量的抗胸腺基质淋巴细胞生成素(tslp)或tslp受体抗体。可用于此类实施例中的抗tslp抗体的示例包括但不限于在美国专利号7,982,016和8,232,372以及美国公开号2009/0186022中所描述的那些。抗tslp受体抗体的示例包括但不限于在美国专利号8,101,182中所描述的那些。在特别优选的实施例中,该药剂包括治疗有效量的、在美国专利号7,982,016中指定为a5的抗tslp抗体。
[0117]
尽管已经根据示例性实施例描述了药物输送装置、方法及其部件,但是它们不限于此。详细描述仅被解释为是示例性的并且未描述本发明的每个可能的实施例,因为如果有可能的话,描述每个可能的实施例将是不实际的。可以使用当前技术或在本专利申请日之后开发的技术来实施许多替代性实施例,这些实施例仍然落入限定本发明的权利要求的范围内。例如,本文参考某些种类的药物输送装置(诸如随身注射器药物输送装置或其他种类的药物输送装置)描述的部件也可以用于其他种类的药物输送装置(诸如自动注射器药物输送装置)中。
[0118]
本领域普通技术人员将了解到,在不脱离本发明的范围的情况下,关于上文描述的实施例可以做出各种各样的修改、改变和组合,并且可以将此类修改、改变和组合视为在本发明构思的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1