核酸复合物的制作方法
本发明涉及核酸复合物及包含该核酸复合物的药物组合物等。
背景技术:
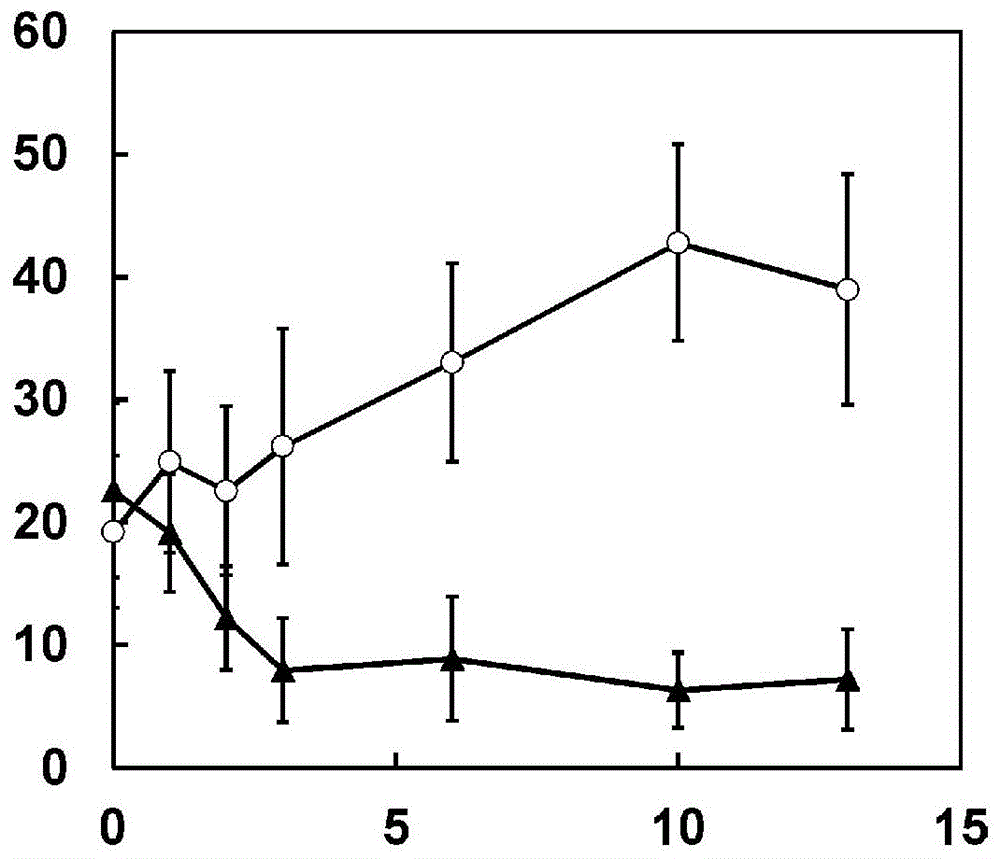
:作为核酸药物,已知有核酸适体(aptamer)、反义核酸、decoy核酸、核酶、sirna、mirna及antimirna等。核酸药物由于通用性高(能够控制细胞内的所有基因),因此期待在临床上应用于目前被认为难以治疗的各种疾病。另外,核酸药物由于在细胞内的靶向选择性和活性高,因此作为抗体、低分子药物之后的下一代药物而备受期待。然而,作为核酸药物的问题点,可举出难以递送至靶组织。作为核酸药物在体内的有效递送方法之一,报道了使用靶向化合物与核酸的核酸复合物(偶联物(conjugate))。作为靶向化合物,可举出能够与在细胞外表达的受体结合的配体。其中,特别地,作为能够与在肝细胞中极其高度地表达的去唾液酸糖蛋白受体(asgpr)结合的配体,已报道了多种利用了n-乙酰-d-半乳糖胺(galnac)等的核酸复合物。近年来,报道了将这些配体与sirna类结合而成的核酸复合物被有效地递送至肝细胞(非专利文献1)。作为靶向化合物与寡核苷酸的复合物,例如专利文献1及2中公开了以下所示的核酸复合物。[化学式1](式中,ac表示乙酰基。以下,在本说明书中。)另外,专利文献3中公开了具有以下所示的结构的核酸复合物,所述结构具有与专利文献1及2中公开的核酸复合物同样的糖配体-系链(tether)单元。[化学式2]另外,专利文献4中公开了具有以下所示的结构作为糖配体-系链单元的核酸复合物。[化学式3]apcs(血清淀粉样p成分,amyloidpcomponent,serum)(别名血清淀粉样p(serumamyloidp)、sap或者也称为正五聚蛋白2(pentraxin-2))具有由223个氨基酸构成的糖蛋白的五聚体结构。apcs是在肝脏中产生的糖蛋白,在血中以30~50μg/ml的较高浓度存在。另外,已知apcs具有钙依赖性地与全部种类的淀粉样蛋白纤维结合的生物化学特性,在具有淀粉样蛋白的患者的淀粉样蛋白中也包含多达20,000mg的apcs(非专利文献2)。由于apcs存在于全部淀粉样蛋白相关疾病的患者中的淀粉样蛋白中,因此被用作淀粉样蛋白相关疾病的患者的诊断标志物(非专利文献3)。淀粉样蛋白相关疾病是作为淀粉样蛋白纤维而已知的、异常的不溶性蛋白质纤维沉积于组织而引起器官障碍的疾病。已经阐明apcs通过与淀粉样蛋白结合来诱导耐受蛋白酶分解的特性、针对免疫细胞的吞噬的耐性,从而能够使apcs所结合的淀粉样蛋白稳定化,另外,使用了动物模型的研究以及临床研究强烈暗示了,通过阻碍apcs与淀粉样蛋白的结合,能够减轻淀粉样蛋白向器官的沉积及与其相伴的组织障碍(非专利文献4及5)。虽然可期待通过特异性地抑制apcs的表达能够预防或治疗淀粉样蛋白相关疾病,但迄今尚未报道特异性地抑制apcs的表达的医药品。现有技术文献专利文献专利文献1:国际公开第2009/073809号专利文献2:国际公开第2013/075035号专利文献3:国际公开第2015/105083号专利文献4:国际公开第2014/179620号非专利文献非专利文献1:美国化学学会杂志(journalofamericanchemicalsociety),2014年,第136卷,p16958-16961非专利文献2:淀粉样蛋白(amyloid),1997年,第4:4卷,p274-295非专利文献3:新英格兰医学杂志(n.engl.j.med.),1990年,第323卷,p508-13非专利文献4:自然(nature),2010年,第468卷,p93-97非专利文献5:新英格兰医学杂志(n.engl.j.med.),2015年,第373卷,p1106-1114技术实现要素:发明所要解决的课题本发明的目的在于提供能够抑制apcs的表达的核酸复合物。用于解决课题的手段本发明涉及以下内容。[1]核酸复合物,其由下述式1表示。式1:[化学式4](式1中,x为由有义链及反义链组成、包含至少11个碱基对的双链区域的双链核酸,该双链核酸在该反义链中的、17个~30个核苷酸的链长的寡核苷酸链中,与表1-1~表1-13中记载的靶标apcsmrna序列中的任一者互补,该有义链的3’末端或5’末端与s3结合,l1及l2各自独立地为糖配体,s1、s2及s3各自独立地为接头。)[2]如[1]所述的核酸复合物,具有下述式2表示的结构。式2:[化学式5](式2中,x、l1、l2及s3各自与上文中的含义相同,p1、p2、p3、p4、p5及p6、以及t1及t2各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,q1、q2、q3及q4各自独立,不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n-ch2ch2-,n为0~99的整数,b1及b2各自独立地为连接键、或下述式2-1表示的任一结构,各结构中的末端的黑圆点各自为与p2或p3、或者p5或p6的键合位点,m1、m2、m3及m4各自独立地为0~10的整数,式2-1:[化学式6]p1及p2各自独立地为1、2或3的整数,q1、q2、q3及q4各自独立地为0~10的整数,其中,p1及p2各自为2或3的整数时,各p3及p6、q2及q4、t1及t2以及l1及l2可以相同或不同,q1~q4为2~10时,各-[p2-q1]-、-[q2-p3]-、-[p5-q3]-、-[q4-p6]-的组合可以相同或不同。)[3]如[2]所述的核酸复合物,其中,p1及p4各自独立,为-co-nh-、-nh-co-或-o-。[4]如[2]或[3]所述的核酸复合物,其中,-[p2-q1]q1-及-[p5-q3]q3-各自独立,不存在或者为下述式3-1~式3-3表示的任一结构。式3-1:[化学式7]式3-2:[化学式8]式3-3:[化学式9](式3-1~式3-3中,m5及m6各自独立地为0~10的整数,式3-1~式3-3的结构中的末端的黑圆点各自为与b1或b2、或者p1或p4的键合位点。)[5]如[2]~[4]中任一项所述的核酸复合物,其具有下述式4-1~式4-9表示的任一结构。式4-1:[化学式10]式4-2:[化学式11]式4-3:[化学式12]式4-4:[化学式13]式4-5:[化学式14]式4-6:[化学式15]式4-7:[化学式16]式4-8:[化学式17]式4-9:[化学式18](式4-1~4-9中,x、l1、l2、s3、p3、p6、t1、t2、q2、q4、q2及q4各自与上文中的含义相同。)[6]如[1]所述的核酸复合物,其具有下述式5表示的结构。式5:[化学式19](式5中,x、s3、p1、p2、p3、q1、q2、b1、t1、l1、p1、q1及q2各自与上文中的含义相同。)[7]如[6]所述的核酸复合物,其中,p1为-co-nh-、-nh-co-或-o-。[8]如[6]或[7]所述的核酸复合物,其具有下述式6-1~式6-9表示的任一结构。式6-1:[化学式20]式6-2:[化学式21]式6-3:[化学式22]式6-4:[化学式23]式6-5:[化学式24]式6-6:[化学式25]式6-7:[化学式26]式6-8:[化学式27]式6-9:[化学式28](式6-1~6-9中,x、s3、p3、q2、t1、l1及q2各自与上文中的含义相同。)[9]如[2]~[5]中任一项所述的核酸复合物,其具有下述式7-1~式7-9表示的任一结构。式7-1:[化学式29]式7-2:[化学式30]式7-3:[化学式31]式7-4:[化学式32]式7-5:[化学式33]式7-6:[化学式34]式7-7:[化学式35]式7-8:[化学式36]式7-9:[化学式37](式7-1~7-9中,x、s3、l1及l2各自与上文中的含义相同。)[10]如[1]~[9]中任一项所述的核酸复合物,其中,所述糖配体为n-乙酰半乳糖胺。[11]如[1]~[10]中任一项所述的核酸复合物,其中,所述双链核酸包含修饰核苷酸。[12]如[1]~[11]中任一项所述的核酸复合物,其中,有义链的3’末端及反义链的5’末端形成平末端。[13]如[11]所述的核酸复合物,其中,所述双链核酸包含糖部修饰核苷酸。[14]如[1]~[13]中任一项所述的核酸复合物,其具有下述式7-8-1表示的结构。式7-8-1:[化学式38](式7-8-1中,x与上文中的含义相同。)[15]如[1]~[14]中任一项所述的核酸复合物,其中,x为选自由表1-1~表1-13中所记载的有义链/反义链组成的组中的1对有义链/反义链。[16]如[1]~[14]中任一项所述的核酸复合物,其中,x为选自由表m1-1~表m1-3及表r-1~表r-4中所记载的有义链/反义链组成的组中的1对有义链/反义链。[16-a1]如[1]~[14]中任一项所述的核酸复合物,其中,x为由3’末端与s3结合的有义链、和序列号2126、2144、2146中的任一条反义链组成的1对有义链/反义链。[16-a2]如[16-a1]所述的核酸复合物,其具有下述式6-1~式6-9表示的结构。式6-7:[化学式39](式6-7中,x、s3、p3、q2、t1、l1及q2各自与上文中的含义相同。)[16-a3]如[16-a1]所述的核酸复合物,其具有下述式7-8表示的结构。式7-8:[化学式40](式7-8中,x、s3、l1及l2各自与上文中的含义相同。)[16-a4]如[16-a1]所述的核酸复合物,其具有下述式7-8-1表示的结构。式7-8-1:[化学式41](式7-8-1中,x与上文中的含义相同。)[16-b1]如[1]~[14]中任一项所述的核酸复合物,其中,x为由序列号2083的有义链和序列号2126的反义链、序列号2101的有义链和序列号2144的反义链、或序列号2103的有义链和序列号2146的反义链组成的1对有义链/反义链。[16-b2]如[16-b1]所述的核酸复合物,其具有下述式6-1~式6-9表示的结构。式6-7:[化学式42](式6-7中,x、s3、p3、q2、t1、l1及q2各自与上文中的含义相同。)[16-b3]如[16-b1]所述的核酸复合物,其具有下述式7-8表示的结构。式7-8:[化学式43](式7-8中,x、s3、l1及l2各自与上文中的含义相同。)[16-b4]如[16-b1]所述的核酸复合物,其具有下述式7-8-1表示的结构。式7-8-1:[化学式44](式7-8-1中,x与上文中的含义相同。)[17]药物组合物,其含有[1]~[16]中任一项所述的核酸复合物。[18]如[17]所述的药物组合物,其用于导入至细胞内。[19]如[17]或[18]所述的药物组合物,其经静脉内施予或经皮下施予。[20]疾病的治疗或预防方法,所述方法包括下述步骤:将[1]~[16]中任一项所述的核酸复合物或[17]~[19]中任一项所述的药物组合物施予至需要其的患者。[21]抑制apcs基因的表达的方法,所述方法包括下述步骤:使用[1]~[16]中任一项所述的核酸复合物或[17]~[19]中任一项所述的药物组合物将双链核酸导入至细胞内。[22]淀粉样蛋白相关疾病的治疗方法,所述方法包括下述步骤:将[1]~[16]中任一项所述的核酸复合物或[17]~[19]中任一项所述的药物组合物施予至哺乳动物。[23]用于淀粉样蛋白相关疾病的治疗的药物,其包含[1]~[16]中任一项所述的核酸复合物或[17]~[19]中任一项所述的药物组合物。[24]淀粉样蛋白相关疾病的治疗剂,其包含[1]~[16]中任一项所述的核酸复合物或[17]~[19]中任一项所述的药物组合物。[25]如[22]所述的治疗方法,其中,淀粉样蛋白相关疾病为由包含apcs的淀粉样蛋白纤维介导的障碍所引起的疾病。[26]如[23]所述的药物,其中,淀粉样蛋白相关疾病为由包含apcs的淀粉样蛋白纤维介导的障碍所引起的疾病、。[27]如[24]所述的治疗剂,其中,淀粉样蛋白相关疾病为由包含apcs的淀粉样蛋白纤维介导的障碍所引起的疾病。发明效果通过例如将含有本发明的核酸复合物的药物组合物施予至哺乳动物,能够在生物体内治疗各种相关疾病。附图说明[图1]为示出试验例2中的各小鼠组的血中人apcs浓度的推移的图。图中第0天(day0)的apcs浓度示出施予6天前的值,将初次施予日作为第0天。横轴表示将初次施予日设为第0天得到的经过天数,纵轴表示血中人apcs浓度(μg/ml)。〇表示对照组,▲表示化合物5-2的10mg/kg施予组。图的误差棒表示标准偏差(sd)。具体实施方式本发明的核酸复合物为下述式1表示的核酸复合物。式1:[化学式45]式1中,x为由有义链及反义链组成、包含至少11个碱基对的双链区域的双链核酸,该双链核酸在该反义链中的、17个~30个核苷酸的链长的寡核苷酸链中,与表1-1~表1-13中记载的靶标apcsmrna序列中的任一者互补,该有义链的3’末端或5’末端与s3结合,l1及l2各自独立地为糖配体,s1、s2及s3各自独立地为接头。本发明中,s1及s2可相对于s3在苯环上的取代位置而言分别在邻位、间位、对位与苯环键合,优选为下述式1-1表示的核酸复合物。意味着式1中的s1及s2与苯环的连接键可以在苯环上的除s3的取代位置以外的任意位置。式1-1:[化学式46]式1-1中,x、l1、l2、s1、s2及s3各自与上文中的含义相同。本说明书中,所谓与上文中的含义相同,以式1-1中为例进行说明时,是指:关于式1-1中的各x、l1、l2、s1及s2,可以为与式1中上述的各x、l1、l2、s1及s2的定义相同的基团。本发明中,x为由有义链及反义链组成、包含至少11个碱基对的双链区域的双链核酸。另外,该双链核酸在该反义链中的、17个~30个核苷酸的链长的寡核苷酸链中,与后述的表1-1~表1-13中记载的靶标apcsmrna序列中的任一者互补。另外,该有义链的3’末端或5’末端与s3结合。l1及l2各自独立,为糖配体。本发明中,糖配体是指能够与在靶细胞中表达的受体结合的来自糖类(单糖、二糖、三糖及多糖等)的基团。另外,本发明中,糖配体通过o-键与作为s1及s2的接头相键合时,糖配体是指除了参与构成糖配体的糖类的键合的羟基以外的部分来自糖类的基团。本发明中,选择成为寡核苷酸的靶标的糖配体即可。作为单糖,可举出例如阿洛糖、醛糖、阿拉伯糖、克拉定糖(cladinose)、赤藓糖(erythrose)、赤藓酮糖(erythrulose)、果糖、d-岩藻糖醇、l-岩藻糖醇、岩藻糖胺(fucosamine)、岩藻糖、墨角藻糖(fuculose)、半乳糖胺、d-半乳糖氨醇(d-galactosaminitol)、n-乙酰半乳糖胺、半乳糖、氨基葡萄糖、n-乙酰氨基葡萄糖、葡糖胺醇、葡萄糖、葡萄糖-6-磷酸、古洛糖、甘油醛、l-甘油-d-甘露庚糖、甘油、甘油酮、古洛糖、艾杜糖、来苏糖、甘露糖胺、甘露糖、甘露糖-6-磷酸、阿洛酮糖、异鼠李糖、异鼠李糖胺、鼠李糖醇、鼠李糖胺、鼠李糖、核糖、核酮糖、景天庚糖(sedoheptulose)、山梨糖、塔格糖、塔罗糖(talose)、酒石酸、苏糖、木糖、及木酮糖等。作为二糖、三糖、多糖,可举出例如阿比可糖、阿卡波糖(acarbose)、amicetose、支链淀粉、直链淀粉、芹菜糖、arcanose、蛔糖(ascarylose)、抗坏血酸、2-脱氧-6-鼠李糖、纤维二糖、纤维三糖、纤维素、马铃薯三糖、查尔糖(chalcose)、甲壳素、可立糖(colitose)、环糊精、磁麻糖、糊精、2-脱氧核糖、2-脱氧葡萄糖、2-脱氧毛地黄糖(diginose)、毛地黄糖(digitalose)、毛地黄毒糖(digitoxose)、evalose、evemitrose、低聚果糖(fructo-oligosaccharide)、半乳寡糖(galto-oligosaccharide)、龙胆三糖、龙胆二糖、葡聚糖、糖原、金缕梅糖、肝素、菊糖、异左旋葡萄糖酮、异麦芽糖、异麦芽三糖、异葡糖基麦芽糖(isopanose)、曲二糖、乳糖、乳糖胺、乳糖二胺、昆布二糖、左旋葡聚糖、左旋葡萄糖酮、β-麦芽糖、麦芽三糖、低聚甘露糖、甘露三糖、松三糖、松二糖、胞壁酸、碳霉糖、6-脱氧-d-阿洛糖、神经氨糖酸、含有唾液酸的糖链、黑曲霉糖、野艽霉素、诺维糖、夹竹桃糖、潘糖、泊雷糖、车前糖、樱草糖、棉子糖、玫瑰糖(rhodinose)、芦丁糖、箭毒羊角拗糖(sarmentose)、景天庚糖、景天庚醛聚糖(sedoheptulosan)、茄三糖、槐糖、水苏糖、链霉糖、蔗糖、α,α-海藻糖、海藻糖胺、松二糖、泰威糖、木二糖、伞形糖等。糖类中的各单糖可以为d体或l体,也可以为d体与l体以任意比例形成的混合物。糖类也可包含:脱氧糖(将醇羟基替换为氢原子而得到的物质)、氨基糖(将醇羟基替换为氨基而得到的物质)、硫代糖(将醇羟基替换为巯基而得到的物质、或将c=o替换为c=s而得到的物质、或将环内的氧替换为硫而得到的物质)、硒代糖、碲代糖、氮杂糖(将环内的碳替换为氮而得到的物质)、亚氨基糖(将环内的氧替换为氮而得到的物质)、亚磷糖(将环内的氧替换为磷而得到的物质)、磷杂糖(将环内的碳替换为磷而得到的物质)、c-取代单糖(用碳原子替换非末端碳原子中的氢原子而得到的物质)、不饱和单糖、醛醇(用choh基替换羰基而得到的物质)、醛糖酸(将醛基替换为羧基而得到的物质)、酮基醛糖酸、糖醛酸、醛糖二酸等。关于作为单糖的氨基糖,可举出半乳糖胺、葡糖胺、甘露糖胺、岩藻糖胺、异鼠李糖胺、神经氨糖酸、胞壁酸、乳糖二胺、acosamine、bacillosamine、柔红糖胺、脱氧糖胺、福乐糖胺、加洛糖胺、卡糖胺(kanosamine)、kansosamine、碳霉糖胺、海藻糖胺、过骨胺(perosamine)、6-脱氧-l-塔罗糖胺、绛红糖胺(purpurosamine)、紫红糖胺(rhodosamine)等。另外,氨基糖的氨基可被乙酰基等替换。作为含有唾液酸的糖链,可举出在糖链非还原末端含有neuac的糖链,具体而言,可举出含有neuac-gal-glcnac的糖链、neu5acα(2-6)galβ(1-3)glcnac等。糖类中的各单糖可被取代基取代,只要能够与在靶细胞中表达的受体结合即可,例如,羟基可被取代,各单糖中的一个~多个氢原子可被叠氮化物及/或芳基(所述芳基可被取代)取代。作为糖配体,与作为靶标的各器官相对应地选择与在靶细胞的表面表达的受体结合的糖配体是优选的。例如,靶细胞为肝细胞的情况下,针对在肝细胞表面的表达的受体的糖配体是优选的,针对去唾液酸糖蛋白受体(asgpr)的糖配体是更优选的。作为针对asgpr的糖配体,优选甘露糖或n-乙酰半乳糖胺,更优选n-乙酰半乳糖胺。作为与asgpr的亲和性更高的糖配体,例如bioorganicmedicinalchemistry,17,7254(2009)及journalofamericanchemicalsociety,134,1978(2012)等中记载的糖衍生物是已知的,可使用这些糖衍生物。本发明中,s1、s2及s3为接头。s1和s2只要为将作为糖配体的l1和l2、与苯环连结的结构则没有特别限定,可采用核酸复合物中使用的已知结构。s1与s2可以相同,也可以不同。作为糖配体的l1和l2优选通过糖苷键与s1及s2连结。s1及s2可通过例如-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-键而分别与苯环连结。s3只要为将作为双链核酸的x与苯环连结的结构则没有特别限定,可采用核酸复合物中使用的已知结构。作为寡核苷酸的x优选通过磷酸二酯键与s3连结。s3可通过例如-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-键而与苯环连结。关于作为s1、s2及s3的接头,例如可采用国际公开第2009/073809号、国际公开第2013/075035号、国际公开第2015/105083号、国际公开第2014/179620号、国际公开第2015/006740号中公开的结构。本发明中,核酸复合物优选为具有下述式2表示的结构的核酸复合物。式2:[化学式47]式2中,x、l1、l2及s3各自与上文中的含义相同,p1、p2、p3、p4、p5及p6、以及t1及t2各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,q1、q2、q3及q4各自独立,不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n-ch2ch2-,n为0~99的整数。p1及p4各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,优选为-o-、-o-co-、-nh-co-或-co-nh-,更优选为-o-、-nh-co-或-co-nh-,进一步优选为-nh-co-。p1或p4为例如-nh-co-时,具有-nh-co-苯环这样的部分结构。q1、q2、q3及q4各自独立,不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n-ch2ch2-,n为0~99的整数,优选为取代或未取代的碳原子数1~12的亚烷基,更优选为未取代的碳原子数1~12的亚烷基,进一步优选为未取代的碳原子数1~6的亚烷基,更进一步优选为未取代的碳原子数1~4的亚烷基。p2及p5各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,优选不存在或者为-co-o-或-co-nh-,更优选不存在或者为-co-nh-。p2及p5为例如-co-nh-时,具有b1-co-nh-q1及b2-co-nh-q3这样的部分结构。优选地,-(p2-q1)q1-及-(p5-q3)q3-各自独立,不存在或者为下述式3-1~式3-3表示的任一结构。式3-1:[化学式48]式3-2:[化学式49]式3-3:[化学式50]式3-1~3-3中,m5及m6各自独立地为0~10的整数,式3-1~式3-3的结构中的末端的黑圆点各自为与b1或b2、或者p1或p4的键合位点。b1及b2各自独立地为连接键、或下述式表示的任一结构,各结构中的末端的黑圆点各自为与p2或p3、或者p5或p6的键合位点,m1、m2、m3及m4各自独立地为0~10的整数。[化学式51]b1及b2优选为来自包含谷氨酸、天冬氨酸、赖氨酸、亚氨基二乙酸等非天然氨基酸的氨基酸、或2-氨基-1,3-丙二醇等氨基醇的基团,b1及b2为来自谷氨酸及天冬氨酸的基团时,优选谷氨酸及天冬氨酸的氨基分别键合且p2及p5为-nh-co-键,b1及b2为来自赖氨酸的基团时,优选赖氨酸的羧基分别键合且p2及p5为-co-nh-键,b1及b2为来自亚氨基二乙酸的基团时,优选亚氨基二乙酸的氨基分别键合且p2及p5为-co-键。b1及b2具体而言优选具有以下的结构。[化学式52]p1及p2各自为2或3的整数时,各p3及p6、q2及q4、t1及t2以及l1及l2可以相同或不同。q1~q4为2~10时,各-[p2-q1]-、-[q2-p3]-、-[p5-q3]-、-[q4-p6]-的组合可以相同或不同。各-[p2-q1]-,-[q2-p3]-、-[p5-q3]-,及-[q4-p6]-的组合相同或不同,是指-[p2-q1]-、-[q2-p3]-、-[p5-q3]-、及-[q4-p6]-表示的各2~10个单元存在相同的情况和不同的情况。本发明中,核酸复合物优选为具有下述式4-1~4-9表示的结构的核酸复合物。式4-1:[化学式53]式4-2:[化学式54]式4-3:[化学式55]式4-4:[化学式56]式4-5:[化学式57]式4-6:[化学式58]式4-7:[化学式59]式4-8:[化学式60]式4-9:[化学式61]式4-1~4-9中,x、l1、l2、s3、p3、p6、t1、t2、q2、q4、q2及q4各自与上文中的含义相同。p3及p6各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,优选为-o-co-或-nh-co-,更优选为-nh-co-。p3及p6为例如-nh-co-时,各自具有b1-nh-co-q2及b2-nh-co-q4这样的部分结构。t1及t2各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,优选为-o-或-s-,更优选为-o-。本发明中,核酸复合物优选为具有下述式5表示的结构的核酸复合物。式5中,式2中的p1与p4、p2与p5、p3与p6、q1与q3、q2与q4、b1与b2、t1与t2、l1与l2、p1与p2、q1与q3以及q2与q4各自相同。式5:[化学式62]式5中,x、s3、p1、p2、p3、q1、q2、b1、t1、l1、p1、q1及q2各自与上文中的含义相同。另外,式5中的x、s3、p1、p2、p3、q1、q2、b1、t1、l1、p1、q1及q2各自可以为上述中的优选基团,p1优选为-co-nh-、-nh-co-或-o-。式5中的-(p2-q1)q1-优选不存在或者为上述式3-1~式3-3表示的任一结构。本发明中,核酸复合物优选为具有下述式6-1~6-9表示的结构的核酸复合物。式6-1:[化学式63]式6-2:[化学式64]式6-3:[化学式65]式6-4:[化学式66]式6-5:[化学式67]式6-6:[化学式68]式6-7:[化学式69]式6-8:[化学式70]式6-9:[化学式71]式6-1~式6-9中,x、s3、p3、q2、t1、l1及q2各自与上文中的含义相同。本发明中,核酸复合物优选为具有下述式7-1~式7-9中任一者表示的结构的核酸复合物。式7-1:[化学式72]式7-2:[化学式73]式7-3:[化学式74]式7-4:[化学式75]式7-5:[化学式76]式7-6:[化学式77]式7-7:[化学式78]式7-8:[化学式79]式7-9:[化学式80]式7-1~式7-9中,x、l1、l2及s3各自与上文中的含义相同。l1与l2可以相同也可以不同,优选相同。式7-1~式7-9中,也可以通过向各亚烷基部分导入链长不同的亚烷基链、或者将酰胺键等替换为其他键,从而制造具有式7-1~式7-9表示的结构的核酸复合物以外的核酸衍生物。本发明中,核酸复合物优选为具有下述式11表示的结构的核酸复合物。式11:[化学式81]式11中,l1、l2、s1s2及x各自与上文中的含义相同,p7及p8各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,q5、q6及q7各自独立,不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n8-ch2ch2-,n8为0~99的整数,b3在本说明书中也被称为分支单元,为下述式11-1表示的任一结构,曲折线各自是指与q5及q6的连接键。式11-1:[化学式82]式11-1中,具有三唑环的基团中的取代为该三唑环的1位及3位的氮原子中的任一者。q5及q6各自独立,为0~10的整数。p7不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,优选为-o-、-nh-co-或-co-nh-,更优选为-o-或-nh-co-。p7为例如-o-时,具有苯环-o-这样的部分结构。p8不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,当p8存在时,优选为-co-o-或-co-nh-,更优选为-co-nh-。p8为例如-co-nh-时,具有q6-co-nh-这样的部分结构。q5、q6及q7各自独立,不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n8-ch2ch2-,n8为0~99的整数,优选为取代或未取代的碳原子数1~12的亚烷基,更优选为未取代的碳原子数1~12的亚烷基,进一步优选为未取代的碳原子数1~6的亚烷基,更进一步优选为未取代的碳原子数1~4的亚烷基。-(p7-q5)q5-为-o-(ch2)m15-nh-及-nh-co-(ch2)m16-nh-,m15及m16优选各自独立地为1~10的整数。本发明中,核酸复合物优选为具有下述式12-1~式12-12中的任一者表示的结构的核酸复合物。式12-1:[化学式83]式12-2:[化学式84]式12-3:[化学式85]式12-4:[化学式86]式12-5:[化学式87]式12-6:[化学式88]式12-7:[化学式89]式12-8:[化学式90]式12-9:[化学式91]式12-10:[化学式92]式12-11:[化学式93]式12-12:[化学式94]式12-1~12-12中,x、l1、l2、s1及s2各自与上文中的含义相同,n1’~n12’各自独立地为1~10的整数。对于本发明的核酸复合物而言,在式1表示的核酸复合物中,优选为将与s1及s2对应的式2中记载的结构、及与s3对应的式11中记载的结构组合而得的核酸复合物。式2可以是式4-1~式4-9,可以是式6-1~式6-9,可以是式7-1~式7-9,式2为式4-1~式4-9、式6-1~式6-9、或式7-1~式7-9时,式11可以是式12-1~式12-12。对于本发明的核酸复合物而言,在式1表示的核酸复合物中,更优选为下述核酸复合物:将与s1及s2对应的式4-1~式4-9中记载的任一结构、及与s3对应的式12-1~式12-12中记载的任一结构组合而得的核酸复合物;将与s1及s2对应的式6-1~式6-9中记载的任一结构、及与s3对应的式12-1~式12-12中记载的任一结构组合而得的核酸复合物;将与s1及s2对应的式7-1~式7-9中记载的任一结构、及与s3对应的式12-1~式12-12中记载的任一结构组合而得的核酸复合物。本发明的核酸复合物优选由下述式7-8-1表示。式7-8-1:[化学式95](式7-8-1中,x与上文中的含义相同。)式1中的x为由有义链及反义链组成、包含至少11个碱基对的双链区域的双链核酸,该双链核酸在该反义链中的、17个~30个核苷酸的链长的寡核苷酸链中,与表1-1~表1-13中记载的靶标apcsmrna序列中的任一者互补。有义链的3’末端或5’末端与s3结合,因此,式1中,与s3结合的x为构成双链核酸的有义链,并且是由后述的表1-1~表1-13或表m1-1~表m1-3及表r-1~表r-2中的有义链序列表示的有义链。本发明中,包含与apcsmrna互补的碱基序列的核酸被称为反义链核酸,包含与反义链核酸的碱基序列互补的碱基序列的核酸也被称为有义链核酸。构成本发明的核酸复合物的双链核酸是在被导入至哺乳动物细胞的情况下,具有降低或终止apcs基因的表达的能力的双链核酸,并且是具有有义链及反义链的双链核酸。另外,该有义链和该反义链具有至少11个碱基对,该反义链中的、至少17个核苷酸且至多30个、即、17个~30个核苷酸的链长的寡核苷酸链与选自由表1-1~表1-13中记载的组中的靶标apcsmrna序列互补。构成本发明的核酸复合物的双链核酸只要是核苷酸或具有与该核苷酸同等的功能的分子聚合而得的聚合物,则可以是任何的双链核酸。作为这样的聚合物,可举出例如作为核糖核苷酸聚合物的rna、作为脱氧核糖核苷酸聚合物的dna、由rna和dna组成的嵌合核酸、以及这些核酸中的至少一个核苷酸被具有与该核苷酸等同的功能的分子取代而得到的核苷酸聚合物。另外,在这些核酸中含有至少一个具有与核苷酸等同的功能的分子的衍生物也包括在作为本发明中使用的药物的双链核酸内。另外,尿嘧啶(u)能够同义地读作胸腺嘧啶(t)。作为与核苷酸具有同等功能的分子,可以举出例如核苷酸衍生物等。作为核苷酸衍生物,只要是对核苷酸施以修饰而得到的分子即可,可以是任意的分子,例如,优选使用为了较之rna或dna而言提高核酸酶抗性或使其稳定化、增强与互补链核酸的亲和力、增强细胞透过性、或使之可视化而对核糖核苷酸或脱氧核糖核苷酸施以修饰而得到的分子等。作为对核苷酸施以修饰而得到的分子,可举出例如糖部修饰核苷酸、磷酸二酯键修饰核苷酸、碱基修饰核苷酸、以及对糖部、磷酸二酯键和碱基中的至少一者进行修饰而得到的核苷酸等。作为糖部修饰核苷酸,只要是对核苷酸的糖的化学结构的一部分或全部用任意取代基进行修饰或取代而成的核苷酸、或者用任意原子进行取代而成的核苷酸即可,可以为任意的核苷酸,但优选使用2’-修饰核苷酸。作为2’-修饰核苷酸,可举出例如核糖的2’-oh基被选自由h、or、r、r’or、sh、sr、nh2、nhr、nr2、n3、cn、f、cl、br及i组成的组(r为烷基或芳基,优选碳原子数为1~6的烷基,r’为亚烷基,优选碳原子为1~6的亚烷基)中的取代基取代而成的核苷酸,更优选为2’-oh基被h、f或甲氧基取代而成的核苷酸,进一步优选为2’-oh基被f或甲氧基取代而成的核苷酸。另外,还可举出2’-oh基被选自由2-(甲氧基)乙氧基、3-氨基丙氧基、2-[(n,n-二甲基氨基)氧基]乙氧基、3-(n,n-二甲基氨基)丙氧基、2-[2-(n,n-二甲基氨基)乙氧基]乙氧基、2-(甲基氨基)-2-氧代乙氧基、2-(n-甲基氨基甲酰基)乙氧基及2-氰基乙氧基组成的组中的取代基取代而成的核苷酸等。就2’-修饰核苷酸而言,优选相对于双链核酸区域内的核苷酸含有50~100%,更优选含有70~100%,进一步优选含有90~100%。另外,就2’-修饰核苷酸而言,优选相对于有义链的核苷酸含有20~100%,更优选含有40~100%,进一步优选含有60%~100%。另外,就2’-修饰核苷酸而言,优选相对于反义链的核苷酸含有20~100%,更优选含有40~100%,进一步优选含有60%~100%。作为磷酸二酯键修饰核苷酸,只要是对核苷酸的磷酸二酯键的化学结构的一部分或全部用任意的取代基进行了修饰或取代的核苷酸、或者用任意的原子进行了取代的核苷酸,则可以为任意的核苷酸,可以举出例如磷酸二酯键被硫代磷酸酯键取代的核苷酸、磷酸二酯键被二硫代磷酸酯键取代的核苷酸、磷酸二酯键被膦酸烷基酯键取代的核苷酸、磷酸二酯键被氨基磷酸酯键取代的核苷酸等。作为碱基修饰核苷酸,只要是针对核苷酸的碱基的化学结构的一部分或全部以任意取代基进行修饰或取代而成的核苷酸、或者以任意原子进行取代而成的核苷酸即可,可以是任意的碱基修饰核苷酸,可举出例如碱基中的氧原子被硫原子取代而成的核苷酸、氢原子被碳原子数为1~6的烷基、卤素等取代而成的核苷酸、甲基被氢、羟甲基、碳原子数为2~6的烷基等取代而成的核苷酸、氨基被碳原子数为1~6的烷基、碳原子数为1~6的烷酰基、氧代基、羟基等取代而成的核苷酸。作为核苷酸衍生物,还可举出在核苷酸或者糖部、磷酸二酯键或碱基中的至少一者被修饰的核苷酸衍生物上直接或介由接头附加了下述其他化学物质而成的产物,所述其他化学物质为肽、蛋白质、糖、脂质、磷脂、酚嗪、叶酸、菲啶、蒽醌、吖啶、荧光素、罗丹明、香豆素、色素等,具体而言,可举出附加有5’-多胺的核苷酸衍生物、附加有胆固醇的核苷酸衍生物、附加有类固醇的核苷酸衍生物、附加有胆酸的核苷酸衍生物、附加有维生素的核苷酸衍生物、附加有cy5的核苷酸衍生物、附加有cy3的核苷酸衍生物、附加有6-fam的核苷酸衍生物、以及附加有生物素的核苷酸衍生物等。核苷酸衍生物可以与核酸内的其他核苷酸或核苷酸衍生物形成桥联结构,如亚烷基结构、肽结构、核苷酸结构、醚结构、酯结构、及组合了这些结构中的至少一者的结构等。本说明书中,所谓“互补”,是指可在两个碱基之间进行碱基配对的关系,例如像腺嘌呤与胸腺嘧啶或尿嘧啶的关系、以及鸟嘌呤与胞嘧啶的关系这样,介由松弛的氢键在整个双键区域形成双螺旋结构。在本说明书中,所谓“互补的”,是指:不仅包括两个核苷酸序列完全互补的情况,还可在该核苷酸序列之间具有0~30%、0~20%或0~10%的错配碱基,例如,与apcsmrna互补的反义链可在与该mrna的部分碱基序列完全互补的碱基序列中含有一个或多个碱基的替换。具体而言,反义链可相对于靶基因的靶序列而言具有1~8个、优选1~6个、1~4个、1~3个,特别是2个或1个错配碱基。例如,当反义链为21个碱基长时,其可以相对于靶标基因的靶序列而言具有6个、5个、4个、3个、2个或1个错配碱基,该错配的位置可以是各序列的5’末端或3’末端。另外,所谓“互补的”是指包括下述情况:一条核苷酸序列为在与另一条核苷酸序列完全互补的碱基序列中添加及/或缺失了一个或多个碱基而得到的序列。例如,apcsmrna与本发明的反义链核酸可由于反义链中的碱基的添加及/或缺失而在反义链及/或靶标apcsmrna区域中具有1个或2个凸出碱基。作为本发明中使用的药物的双链核酸为包含与apcsmrna的一部分碱基序列互补的碱基序列的核酸、及/或包含与该核酸的碱基序列互补的碱基序列的核酸即可,其可由任意的核苷酸或其衍生物构成。对于本发明的双链核酸而言,只要包含与靶标apcsmrna序列互补的碱基序列的核酸、和包含与该核酸的碱基序列互补的碱基序列的核酸能够形成至少11个碱基对的双链即可,可以是任意长度,能形成双链的序列长度通常为11~27个碱基,优选为15~25个碱基,更优选为17~23个碱基,进一步优选为19~23个碱基。作为本发明的核酸复合物的反义链,可以使用包含与靶标apcsmrna序列互补的碱基序列的核酸,也可使用该核酸中的1~3个碱基(优选1~2个碱基,更优选1个碱基)缺失、取代或者添加而成的核酸。作为抑制apcs表达的核酸,优选使用:包含与靶标apcsmrna序列互补的碱基序列、且抑制apcs表达的单链核酸;或由包含与靶标apcsmrna序列互补的碱基序列的核酸、和包含与该核酸的碱基序列互补的碱基序列的核酸组成、且抑制apcs表达的双链核酸。构成双链核酸的单链的反义链核酸及有义链核酸各自相同或不同,通常由11~30个碱基组成,各自相同或不同,优选由17~27个碱基组成,更优选由17~25个碱基组成,进一步优选由19~25个碱基组成,进一步更优选由21或23个碱基组成。作为本发明中使用的药物的双链核酸中,于紧邻双链区的3’侧或5’侧具有不形成双链的额外的核苷酸或核苷酸衍生物时,将其称为突出部(overhang)。当具有突出部时,构成突出部的核苷酸可以是核糖核苷酸、脱氧核糖核苷酸或它们的衍生物。作为具有突出部的双链核酸,可以使用在至少一条链的3’末端或5’末端具有由1~6个碱基(通常为1~3个碱基)构成的突出部的双链核酸,优选使用具有由2个碱基构成的突出部的双链核酸,可举出例如具有由dtdt(dt表示脱氧胸苷)或uu(u表示尿苷)构成的突出部的双链核酸。突出部可以仅存在于反义链中、仅存在于有义链中、以及存在于反义链和有义链这两者中,在本发明中,优选使用在反义链中具有突出部的双链核酸。需要说明的是,对于反义链而言,在包含双链区和紧邻其的突出部的、由17个~30个核苷酸组成的寡核苷酸链中,与选自表1-1~表1-13中所记载的组中的靶标apcsmrna序列中的任一者充分互补。此外,作为本发明的双链核酸,也可使用例如基于dicer等核糖核酸酶的作用而生成双链核酸的核酸分子(wo2005/089287)、不具有3’末端、5’末端的突出部而是形成平末端的双链核酸、仅有义链突出的双链核酸(us2012/0040459)等。作为构成本发明的核酸复合物的双链核酸,可使用由与靶标基因的碱基序列或其互补链的碱基序列相同的序列组成的核酸,也可使用由该核酸的至少一条链的5’末端或3’末端被删除1~4个碱基而得到的核酸、和包含与该核酸的碱基序列互补的碱基序列的核酸组成的双链核酸。构成本发明的核酸复合物的双链核酸可以是rna彼此形成了双链的双链rna(dsrna)、dna彼此形成了双链的双链dna(dsdna)、或者rna与dna形成了双链的杂合核酸。或者,双链中的一条链或两条链可以是dna和rna的嵌合核酸。优选为双链rna(dsrna)。优选的是,本发明的核酸复合物的反义链的5’末端起第2位核苷酸与靶标apcsmrna序列的3’末端起第2位脱氧核糖核苷酸互补,更优选的是,反义链的5’末端起第2位~第7位核苷酸与靶标apcsmrna序列的3’末端起第2位~第7位脱氧核糖核苷酸完全互补,进一步优选的是,反义链的5’末端起第2位~第11位核苷酸与靶标apcsmrna序列的3’末端起第2位~第11位脱氧核糖核苷酸完全互补。另外,优选的是,本发明的核酸中的反义链的5’末端起第11位核苷酸与靶标apcsmrna序列的3’末端起第11位脱氧核糖核苷酸互补,更优选的是反义链的5’末端起第9位~第13位核苷酸与靶标apcsmrna序列的3’末端起第9位~第13位脱氧核糖核苷酸完全互补,进一步优选的是,反义链的5’末端起第7位~第15位核苷酸与靶标apcsmrna序列的3’末端起第7位~第15位脱氧核糖核苷酸完全互补。本发明的核酸复合物的反义链及有义链可基于例如以genbank登记号nm_001639.3登记的人apcs全长mrna的cdna(有义链)的碱基序列(序列号1)来进行设计。双链核酸可以以与apcs基因序列内的靶序列进行相互作用的方式进行设计。双链核酸中的1条链的序列与上述的靶部位序列互补。双链核酸可使用本说明书中记述的方法,以化学方式进行合成。rna可通过酶合成或部分/全部有机合成而生成,另外,经修饰的核糖核苷酸可通过在体外进行酶合成或有机合成而导入。在一个实施方式中,各链以化学方式制备。以化学方式合成rna分子的方法在该
技术领域:
中是已知的[参见nucleicacidsresearch,1998年,、第32卷,p.936-948]。通常,双链核酸可通过使用固相寡核苷酸合成法来进行合成(例如,参见usman等,美国专利第5,804,683号说明书;美国专利第5,831,071号说明书;美国专利第5,998,203号说明书;美国专利第6,117,657号说明书;美国专利第6,353,098号说明书;美国专利第6,362,323号说明书;美国专利第6,437,117号说明书;美国专利第6,469,158号说明书;scaringe等,美国专利第6,111,086号说明书;美国专利第6,008,400号说明书;美国专利第6,111,086号说明书)。对于单链核酸而言,使用固相亚磷酰胺法(参见nucleicacidsresearch,1993年,第30卷,p.2435-2443)来合成,进行脱保护,并在nap-5柱(amershampharmaciabiotech,piscataway,nj)上进行脱盐。寡聚物使用离子交换高效液相色谱法(ie-hplc)进行纯化,所述离子交换高效液相色谱法中采用了使用15分钟工序的线性梯度的amershamsource15q柱-1.0cm(高度25cm)(amershampharmaciabiotech,piscataway,nj)。就梯度而言,从90:10的缓冲液a:b变化至52:48的缓冲液a:b,缓冲液a是ph为8.5的100mmol/l的tris,并且缓冲液b是ph为8.5的100mmol/l的tris(1mol/l的nacl)。在260nm下对试样进行监测,收集对应于全长寡核苷酸种类的峰并汇总,利用nap-5柱进行脱盐,并进行冷冻干燥。各单链核酸的纯度通过利用beckmanpace5000(beckmancoulterinc.,fullerton,calif)的毛细管电泳(ce)来确定。ce毛细管具有100μm的内径,含有ssdna100rgel(beckman-coulter)。典型地,将约0.6nmole的寡核苷酸注射至毛细管,在444v/cm的电场中施行,通过260nm处的uv吸光度来进行检测。改性tris-硼酸-7mol/l-尿素电泳缓冲液从beckman-coulter购入。可获得用于下述实验的、至少为90%纯度(利用ce评价)的单链核酸。化合物同一性是按照制造商推荐的方案、通过利用voyagerde.tm.biospectometry工作站(appliedbiosystems,fostercity,calif.)的基质辅助激光解吸电离飞行时间型(maldi-tof)质谱法进行验证的。单链核酸的相对分子质量可在预想的分子质量的0.2%以内得到。使单链核酸以100μmol/l的浓度再次悬浮于包含100mmol/l乙酸钾、30mmol/lhepes的ph为7.5的缓冲液中。将互补的有义链及反义链以同等的摩尔量进行混合,得到50μmol/l双链核酸的最终溶液。对试样加热5分钟直至95℃,在使用前冷却至室温。双链核酸于-20℃进行保存。使单链核酸冷冻干燥、或于-80℃储存于无核酸酶的水中。作为本发明中的由有义链及反义链组成、包含至少11个碱基对的双链区域、在该反义链中的、11个~30个核苷酸的链长的寡核苷酸链中与选自后述的表1-1~表1-13中记载的组中的靶标apcsmrna序列互补的双链核酸,可使用下述双链核酸:包含选自由表m1-1~表m1-3及表r-3~表r-4、以及表1-1~表1-13中记载的反义链组成的组中的序列的双链核酸;或者,包含选自由后述的表m1-1~表m1-3及表r-1~表r-2、以及表1-1~表1-13中记载的有义链组成的组中的序列的双链核酸;或者,包含选自由表m1-1~表m1-3及表r-1~表r-4、以及表1-1~表1-13中所记载的有义链/反义链组成的组中的1对有义链/反义链的序列的双链核酸。即,构成本发明中使用的核酸复合物的双链核酸的具体例为由表m1-1~表m1-3及表r-1~表r-4、以及表1-1~表1-13中的有义链及反义链组成的双链核酸。需要说明的是,表m1-1~表m1-3及表r-1~表r-4中,n(m)表示2’-o-甲基修饰rna,n(f)表示2’-氟修饰rna,及^表示硫代磷酸酯。另外,表1-1~表1-13、及表m1-1~表m1-3及表r-3~表r-4中记载的反义链序列的5’末端核苷酸在5’末端可进行磷酸化,也可不进行磷酸化,优选进行磷酸化。对于包含表1-1~表1-13中所记载的有义链/反义链的序列的双链核酸而言,在添加1nm时的敲低活性的测定中,相对于未添加双链核酸的条件,添加了双链核酸时的、apcs的相对表达量优选为0.50以下,更优选为0.30以下,进一步优选为0.20以下,最优选为0.10以下。本发明中的寡核苷酸可以是包含2’-修饰核苷酸的双链核酸,优选表m1~表m3中记载的双链核酸,更优选为添加1nm时的敲低活性的测定中,相对于未添加双链核酸的条件,添加了双链核酸时的、apcs的相对表达量为0.10以下的双链核酸。将上述的优选的双链核酸与已知的配体接头组合而得的核酸复合物也被包括在本发明内。作为已知的配体接头,例如,可举出国际公开第2009/073809号及国际公开第2013/075035号中公开的配体接头。本发明的核酸复合物优选为表s1中记载的核酸复合物(化合物1-2~化合物43-2),更优选为下述核酸复合物:将核酸复合物以3nm作为最终浓度添加时的敲低活性的测定中,相对于未添加核酸复合物的阴性对照,添加了核酸复合物时的apcs的相对表达量为0.50以下的核酸复合物。作为核酸复合物的具体例,可举出化合物1-2、5-2、9-2、10-2、15-2、20-2、33-2、35-2。对本发明的核酸复合物的制造方法进行说明。需要说明的是,在以下所示的制造方法中,当定义的基团在该制造方法的条件下发生变化或不适于实施该制造方法时,可通过使用有机合成化学中常用的保护基的导入及除去方法[例如,有机合成中的保护基,第3版(protectivegroupsinorganicsynthesis,thirdedition),格林(t.w.greene)著,johnwiley&sonsinc.(1999年)等中记载的方法]等来制造目标化合物。另外,还可根据需要改变取代基导入等反应工序的顺序。式1表示的核酸复合物也可通过固相合成来进行合成。式1表示的核酸复合物可参考作为核酸复合物而已知的连接结构的合成方法来进行合成。式1表示的核酸复合物中的、以s1作为接头的l1-苯环单元、以s2作为接头的l2-苯环单元的合成例如以式2表示的核酸复合物为例进行说明。式2表示的核酸复合物中的l1-苯环单元、l2-苯环单元通过p1、p2、p3、p4、p5、及p6以及t1及t2进行连结。p1、p2、p3、p4、p5、及p6以及t1及t2的-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-键可参考例如第4版实验化学讲座19“有机化合物的合成i”丸善(1992年)、第4版实验化学讲座20“有机化合物的合成ii”丸善(1992年)等中记载的键合反应的方法、并选择适于形成式2表示的结构的原料从而适当进行合成。另外,从苯环起依次键合具有q1作为部分结构的化合物、具有b1作为部分结构的化合物,由此能够制造l1-苯环单元的部分结构。另行合成具有l1和q2作为部分结构的化合物,并使具有l1和q2作为部分结构的化合物与具有l1-苯环单元的部分结构(所述l1-苯环单元的部分结构具有苯环、q1及b1作为部分结构)的化合物键合,由此能够制造l1-苯环单元结构。关于l2-苯环单元也是同样的,从苯环起依次键合具有q3作为部分结构的化合物、具有b2作为部分结构的化合物,由此能够制造l2-苯环单元的部分结构。另行合成具有l2和q4作为部分结构的化合物,并使具有l2和q4作为部分结构的化合物与具有l2-苯环单元的部分结构(所述l2-苯环单元的部分结构具有苯环、q3及b2作为部分结构)的化合物键合,由此能够制造l2-苯环单元结构。关于具有q1作为部分结构的化合物、具有q3作为部分结构的化合物,可举出在碳原子数1~10的亚烷基或-(ch2ch2o)n-ch2ch2-的两末端具有羟基、羧基、氨基、巯基的化合物。关于具有b1作为部分结构的化合物、具有b2作为部分结构的化合物,可举出具有下述式2-1表示的任一结构且在各结构中的末端的黑圆点处各自具有羟基、羧基、氨基或巯基的化合物。式2-1:[化学式96]关于具有b1作为部分结构的化合物、具有b2作为部分结构的化合物的具体例,可举出乙二醇、谷氨酸、天冬氨酸、赖氨酸、tris、亚氨基二乙酸、2-氨基-1,3-丙二醇等,优选为谷氨酸、天冬氨酸、赖氨酸、亚氨基二乙酸。具体而言,b1及b2优选为以下的结构。[化学式97]在合成具有l1、q2及b1作为部分结构的化合物之后,与具有q1和苯环的化合物键合,由此可制造l1-苯环单元结构。在合成具有l2、q4及b2作为部分结构的化合物之后,与具有q3和苯环的化合物键合,由此可制造l2-苯环单元结构。本发明中,作为[l1-t1-(q2-p3)q2-]p1-b1-(p2-q1)q1-p1-的部分结构、与作为[l2-t2-(q3-p6)q4-]p2-b2-(p5-q3)q3-p2-的部分结构可以相同或不同,优选相同。作为与糖配体的l1-t1-q2相当的单元,可举出例如l3-t1-q2-cooh、l3-t1-(q2-p3)q2-1-q2-nh2等。具体而言,可举出l3-o-碳原子数1~12的亚烷基-cooh、l3-碳原子数1~12的亚烷基-co-nh-碳原子数2~12的亚烷基-nh2等。l3只要为通过脱保护而成为l1的糖配体衍生物则没有特别限定。作为糖配体的取代基,只要为糖类化学领域中常用的取代基则没有特别限定,优选为ac基。关于以s1作为接头的l1-苯环单元、以s2作为接头的l2-苯环单元的合成,具体而言,可参考实施例中记载的方法,适当增减亚烷基链的碳原子数,或者使用将末端氨基、末端羧基转化为可形成-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-键的基团的化合物而进行合成。另外,关于l1的糖配体,在实施例中示例有甘露糖或n-乙酰半乳糖胺,但也可以变更为其他糖配体来实施。关于式1表示的核酸复合物中的、以s3作为接头的x-苯环单元的合成,例如以式12表示的核酸复合物为例进行说明。式12表示的核酸复合物中的x-苯环单元除了寡核苷酸的键以外还具有由p7及p8表示的键。p7及p8的-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-键可参考例如第4版实验化学讲座19“有机化合物的合成i”丸善(1992年)、第4版实验化学讲座20“有机化合物的合成ii”丸善(1992年)中记载的键合反应的方法、并选择适于形成式12表示的结构的原料从而适当进行合成。另外,从苯环起依次键合具有q5作为部分结构的化合物、具有b3作为部分结构的化合物,由此能够制造x-苯环单元的部分结构。另行合成具有x和q7作为部分结构的化合物、具有x和q6作为部分结构的化合物,并使具有x和q7作为部分结构的化合物、具有x和q6作为部分结构的化合物与具有x-苯环单元的部分结构(所述具有x-苯环单元的部分结构具有苯环及q5作为部分结构)的化合物键合而构建b3部分,由此能够制造x-苯环单元结构具体而言,若以在具有x-苯环单元的部分结构(所述x-苯环单元的部分结构具有苯环及q5作为部分结构)的化合物的末端具有叠氮基的情况为例,则可通过下述方式来制造x-苯环单元结构:使实施例中公开那样的经末端键合性官能团化的寡核苷酸反应,从而使其环化加成而形成三唑环,构建b3部分。关于具有q5作为部分结构的化合物、具有q6作为部分结构的化合物、具有q7作为部分结构的化合物,可举出在碳原子数1~10的亚烷基或-(ch2ch2o)n8-ch2ch2-的两末端具有羟基、羧基、氨基、巯基的化合物。可以分别依次制造l1-苯环单元结构、l2-苯环单元结构、和x-苯环单元结构,优选在合成l1-苯环单元结构及l2-苯环单元结构之后键合x-苯环单元结构。尤其是关于具有寡核苷酸部分的x,优选在接近糖配体复合物合成的最终工序时导入至化合物内。本发明中,可以以合成中间体的形式得到下述式8~式10表示的化合物。式8:[化学式98](式8中,r1及r2各自独立地为氢原子、叔丁氧羰基(boc基)、苄氧羰基(z基)、9-芴甲氧羰基(fmoc基)、-co-r4、或-co-b4-[(p9-q8)q7-t3-l3]p3,p9及t3各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,q8不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n1-ch2ch2-,n1为0~99的整数,b4各自独立地为连接键或下述式8-1表示的任一结构,各结构中的末端的黑圆点各自为与羰基或p9的键合位点,m7、m8、m9及m10各自独立地为0~10的整数,式8-1:[化学式99]p3为1、2或3的整数,q7为0~10的整数,l3为糖配体,y为-o-(ch2)m11-nh-及-nh-co-(ch2)m12-nh,m11及m12各自独立地为1~10的整数,r3为氢原子、叔丁氧羰基、苄氧羰基、9-芴甲氧羰基、-co-r4、-co-(ch2ch2o)n2-ch2ch2-n3、或-co-q9-b5-(q10-p10)q8-x1,n2为0~99的整数,p10不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,q9及q10各自独立,不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n3-ch2ch2-,n3为0~99的整数,b5为下述式8-2表示的任一结构,曲折线处各自是指与q9及q10的连接键,式8-2:[化学式100]式8-2中,具有三唑环的基团中的取代为该三唑环的1位及3位的氮原子中的任一者。q8为0~10的整数,x1为氢原子或固相载体,r4为经选自下述组中的1个或2个取代基取代的碳原子数2~10的烷基,所述组由经叔丁氧羰基、苄氧羰基、9-芴甲氧羰基取代或未经取代的氨基、羧基、马来酰亚胺基、及芳烷基氧基羰基组成。)式9:[化学式101](式9中,r5及r6各自独立地为氢原子、叔丁氧羰基、苄氧羰基、9-芴甲氧羰基、-co-r4’、或-co-q11-(p11-q11’)q9-t4-l4,p11及t4各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,q11及q11’不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n4-ch2ch2-,n4为0~99的整数,q9为0~10的整数,l4为糖配体,y’为-o-(ch2)m11’-nh-及-nh-co-(ch2)m12’-nh,m11’及m12’各自独立地为1~10的整数,r3’为氢原子、叔丁氧羰基、苄氧羰基、9-芴甲氧羰基、-co-r4’、-co-(ch2ch2o)n2’-ch2ch2-n3、或-co-q9’-b5’-(q10’-p10’)q8’-x1’,n2’为0~99的整数,p10’不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,q9’及q10’各自独立,不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n3’-ch2ch2-,n3’为0~99的整数,b5’为下述式9-1表示的任一结构,曲折线处各自是指与q9’及q10’的连接键,式9-1:[化学式102]式9-1中,具有三唑环的基团中的取代为该三唑环的1位及3位的氮原子中的任一者。q8’为0~10的整数,x1’为氢原子或固相载体,r4’为经选自下述组中的1个或2个取代基取代的碳原子数2~10的烷基,所述组由经叔丁氧羰基、苄氧羰基、9-芴甲氧羰基取代或未经取代的氨基、羧基、马来酰亚胺基、及芳烷基氧基羰基组成。)式10:[化学式103]式10中,r7及r8各自独立地为羟基、叔丁氧基、苄氧基、-nh-r10、或-nh-q12-(p12-q12’)q10-t4-l4,p12及t4各自独立,不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,q12及q12’不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n2-ch2ch2-,n2为0~99的整数,l4为糖配体,y2为-o-(ch2)m9-nh-及-nh-co-(ch2)m10-nh,m9、m10各自独立地为1~10的整数,q10为0~10的整数,r9为氢原子、叔丁氧羰基、苄氧羰基、9-芴甲氧羰基、-co-r10、-co-(ch2ch2o)n6-ch2ch2-n3、或-co-q13-b6-(q14-p13)q11-x2,n6为0~99的整数,p13不存在或者为-co-、-nh-、-o-、-s-、-o-co-、-s-co-、-nh-co-、-co-o-、-co-s-或-co-nh-,q13及q14各自独立,不存在或者为取代或未取代的碳原子数1~12的亚烷基或-(ch2ch2o)n7-ch2ch2-,n7为0~99的整数,b6为下述式10-1表示的任一结构,曲折线处各自是指与q13及q14的连接键,式10-1:[化学式104]式10-1中,具有三唑环的基团中的取代为该三唑环的1位及3位的氮原子中的任一者。q11为0~10的整数,x2为氢原子或固相载体,r10为经选自下述组中的1个或2个取代基取代的碳原子数2~10的烷基,所述组由经叔丁氧羰基、苄氧羰基、9-芴甲氧羰基取代或未经取代的氨基、羧基、马来酰亚胺基、及芳烷基氧基羰基组成。)以下,示出与本发明相关的制造方法作为一例。需要说明的是,在与以下的制造方法1~制造方法17相关的记载中,存在使用与本发明的核酸衍生物等中的式1~式12表示的化合物中相同的符号来作为表示基团的符号的情况,但两者应分开理解,并非通过针对制造方法1~制造方法12所记载的基团的说明来限定性地解释本发明。另外,关于本发明中的核酸衍生物,在制造方法1~制造方法17中,将表示寡核苷酸的x记载为-o-x。制造方法1对于本发明中的核酸衍生物而言,可以以具有式(i’)表示的部分结构的化合物的制造方法的形式来示例其制造方法。[化学式105](式中,p1为fmoc等可利用碱进行脱保护的保护基,dmtr表示p,p’-二甲氧基三苯甲基,r表示糖配体-系链单元,r’表示r中的糖配体的各羟基经乙酰基等可利用碱进行脱保护的保护基保护的基团,polymer表示固相载体,q’为-co-。)工序1化合物(i-b)可通过下述方式制造:在吡啶等溶剂中,在根据需要而添加的共溶剂的存在下,于0℃与100℃之间的温度,使化合物(i-a)与p,p’-二甲氧基三苯甲基氯反应5分钟~100小时。作为共溶剂,可举出例如甲醇、乙醇、二氯甲烷、氯仿、1,2-二氯乙烷、甲苯、乙酸乙酯、乙腈、乙醚、四氢呋喃、1,2-甲氧基乙烷、二氧杂环己烷、n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、吡啶、水等,它们可以单独使用或混合而使用。工序2化合物(i-c)可通过下述方式制造:以无溶剂的条件下或在溶剂中,在1~1000当量的仲胺存在下,于室温与200℃之间的温度,使化合物(i-b)反应5分钟~100小时。作为溶剂,可举出例如甲醇、乙醇、二氯甲烷、氯仿、1,2-二氯乙烷、甲苯、乙酸乙酯、乙腈、乙醚、四氢呋喃、1,2-甲氧基乙烷、二氧杂环己烷、n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、吡啶、水等,它们可以单独使用或混合而使用。作为仲胺,可举出例如二乙胺、哌啶等。工序3化合物(1-e)可通过下述方式制造:在无溶剂的条件下或在溶剂中,在1~30当量的碱、缩合剂及根据需要添加的0.01~30当量的添加剂的存在下,于室温与200℃之间的温度,使化合物(i-c)与化合物(i-d)反应5分钟~100小时。作为溶剂,可举出工序2中示例的溶剂。作为碱,可举出例如碳酸铯、碳酸钾、氢氧化钾、氢氧化钠、甲醇钠、叔丁醇钾、三乙胺、二异丙基乙基胺、n-甲基吗啉、吡啶、1,8-二氮杂双环[5.4.0]-十一碳-7-烯(dbu)、n,n-二甲基-4-氨基吡啶(dmap)等。作为缩合剂,可举出例如1,3-二环己基碳二亚胺(dcc)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺·盐酸盐(edc)、羰基二咪唑、苯并三唑-1-基氧基三(二甲基氨基)磷鎓六氟磷酸盐、(苯并三唑-1-基氧基)三吡咯烷基磷鎓六氟磷酸盐、o-(7-氮杂苯并三唑-1-基)-n,n,n’,n’-四甲基脲六氟磷酸盐(hatu)、o-(苯并三唑-1-基)-n,n,n’,n’-四甲基脲六氟磷酸盐(hbtu)、2-氯-1-甲基吡啶鎓碘化物等。作为添加剂,可举出例如1-羟基苯并三唑(hobt)、4-二甲基氨基吡啶(dmap)等。化合物(i-d)可通过已知的方法(例如参见journalofamericanchemicalsociety,136,16958,(2014))或以其为基准的方法而得到。工序4化合物(i-f)可通过下述方式制造:在溶剂中,在1~30当量的碱存在下,于室温与200℃之间的温度,使化合物(i-e)与丁二酸酐反应5分钟~100小时。作为溶剂,可举出工序2中示例的溶剂。作为碱,可举出工序3中示例的碱。工序5化合物(i-g)可通过下述方式制造:在无溶剂的条件下或在溶剂中,在1~30当量的碱、缩合剂及根据需要添加的0.01~30当量的添加剂的存在下,于室温与200℃之间的温度,使化合物(i-f)与末端经氨基化的固相载体反应5分钟~100小时,然后,于室温与200℃之间的温度与乙酸酐/吡啶溶液反应5分钟~100小时。作为溶剂,可举出工序2中示例的溶剂。作为碱、缩合剂及添加剂,分别可举出工序3中示例的物质。作为经氨基化的固相载体,可举出例如长链烷基胺细孔性玻璃(lcaa-cpg)等,它们可以以市售品的形式得到。工序6具有式(i’)表示的糖配体-系链-分支单元的核酸复合物可通过下述方式制造:使用化合物(i-g),利用已知的寡核苷酸化学合成法将对应的核苷酸链伸长,然后,进行从固相的脱离、保护基的脱保护及纯化。作为已知的寡核苷酸化学合成法,可举出亚磷酰胺法、硫代磷酸酯法、磷酸三酯法、cem法(参见nucleicacidsresearch,35,3287(2007))等,例如,可通过abi3900高通量核酸合成仪(appliedbiosystems公司制)来合成。对于从固相的脱离、脱保护而言,可通过在化学合成寡核苷酸后,在溶剂中或在无溶剂的条件下,于-80℃至200℃之间的温度,用碱处理10秒至72小时,从而进行制造。作为碱,可举出例如氨、甲胺、二甲胺、乙胺、二乙胺、异丙胺、二异丙胺、哌啶、三乙胺、乙二胺、1,8-二氮杂双环[5.4.0]-十一碳-7-烯(dbu)、碳酸钾等。作为溶剂,可举出水、甲醇、乙醇、thf等。寡核苷酸的纯化可利用c18反相柱或阴离子交换柱、优选前述两种方法的组合来进行。理想的是,纯化后的核酸复合物纯度为90%以上,优选为95%以上。另外,上述工序3中,也可以根据需要将化合物(i-d)分割为两个单元,分两个阶段与化合物(i-c)缩合来进行。具体而言,例如r-q’为r-nh-co-q4’-co-的情况下(q4’为取代或未取代的碳原子数1~12的亚烷基),在工序3中,利用与工序3同样的方法使化合物(i-c)与ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)缩合,将得到的化合物的乙酯在乙醇、水等溶剂中用氢氧化锂等碱进行水解,然后进一步与r’-nh2(r’与上文中的含义相同)缩合,由此可得到目标化合物。需要说明的是,ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)及r’-nh2(r’与上文中的含义相同)可利用已知的方法(例如参见journalofamericanchemicalsociety,136,16958(2014))或以其为基准的方法得到。此处,q4’中,取代或未取代的碳原子数1~12的亚烷基中的取代基及亚烷基部分与上述相同。作为示例示出了q为-co-的情况,但对于q并非-co-时的化合物而言,也可通过适当变更q的结构,利用与上述同样的方法、已知的方法或它们的组合,并适当变更反应条件而制备。制造方法2对于本发明中的核酸衍生物而言,可以以具有式(ii’)表示的部分结构的化合物的制造方法的形式来示例其制造方法。[化学式106](式中,dmtr、r、r’、x、q’、及polymer与上文中的含义相同。tbdms表示叔丁基二甲基甲硅烷基,fmoc表示9-芴甲氧羰基)工序7化合物(ii-a)可通过下述方式制造:在n,n-二甲基甲酰胺(dmf)等溶剂中,优选在2当量的碱的存在下,于0℃~100℃之间的温度,使化合物(i-a)、叔丁基二甲基氯硅烷及二甲基氨基吡啶反应5分钟~100小时。作为碱,可举出制造方法1的工序3中示例的碱。工序8化合物(ii-b)可使用化合物(ii-a)、在与制造方法1的工序1同样的条件下制造。工序9化合物(ii-c)可通过下述方式制造:在溶剂中,于室温与200℃之间的温度,使化合物(ii-b)与四正丁基氟化铵(tbaf)反应5分钟~100小时。作为溶剂,可举出工序2中示例的溶剂。工序10化合物(ii-d)可使用化合物(ii-c)、在与制造方法1的工序2同样的条件下制造。工序11化合物(ii-e)可使用化合物(ii-d)及化合物(i-d)、在与制造方法1的工序3同样的条件下制造。工序12~14化合物(ii’)可使用化合物(ii-e)、在与制造方法1的工序4~工序6同样的条件下制造。另外,在上述工序11中,也可根据需要将化合物(i-d)分割为两个单元,分两个阶段与化合物(ii-c)缩合来进行。具体而言,例如r-q’为-nh-co-q4’-co-的情况下(q4’为取代或未取代的碳原子数1~12的亚烷基),在工序11中,利用与工序11同样的方法,使化合物(ii-c)与ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)缩合,将得到的化合物的乙酯在乙醇、水等溶剂中用氢氧化锂等碱进行水解,然后进一步与r’-nh2(r’与上文中的含义相同)缩合,由此可得到目标化合物。需要说明的是,ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)及r’-nh2(r’与上文中的含义相同)可利用已知的方法(例如参见journalofamericanchemicalsociety,136,16958(2014))或以其为基准的方法而得到。作为示例示出了q为-co-的情况,但对于q并非-co-时的化合物而言,也可通过适当变更q的结构,利用与上述同样的方法、已知的方法或它们的组合,并适当变更反应条件而制备。制造方法3对于本发明中的核酸衍生物而言,可以以具有式(iii’)表示的部分结构的化合物的制造方法的形式来示例其制造方法。[化学式107](式中,dmtr、fmoc、r、r’、q’、x及polymer与上文中的含义相同。)化合物(iii’)可使用化合物(iii-a)、在与制造方法1的工序1至工序6同样的条件下制造。需要说明的是,化合物(iii-a)可以以市售品的形式得到。工序15化合物(iii-b)可使用化合物(iii-a)、在与制造方法1的工序1同样的条件下制造。化合物(iii-a)可以以市售品的形式购入。工序16化合物(iii-c)可使用化合物(iii-b)、在与制造方法1的工序2同样的条件下制造。工序17化合物(iii-e)可使用化合物(iii-c)、在与制造方法1的工序3同样的条件下制造。工序18~20化合物(iii’)可使用化合物(iii-e)、在与制造方法1的工序4~工序6同样的条件下制造。另外,在上述工序17中,也可根据需要将化合物(i-d)分割为两个单元,分两个阶段与化合物(iii-c)缩合来进行。具体而言,例如r-q’为-nh-co-q4’-co-的情况下(q4’为取代或未取代的碳原子数1~12的亚烷基),在工序17中,利用与工序17同样的方法,使化合物(iii-c)与ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)缩合,将得到的化合物的乙酯在乙醇、水等溶剂中用氢氧化锂等碱进行水解,然后进一步与r’-nh2(r’与上文中的含义相同)缩合,由此可得到目标化合物。需要说明的是,ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)及r’-nh2(r’与上文中的含义相同)可利用已知的方法(例如参见journalofamericanchemicalsociety,136,16958(2014))或以其为基准的方法而得到。作为示例示出了q为-co-的情况,但对于q并非-co-时的化合物而言,也可通过适当变更q的结构,利用与上述同样的方法、已知的方法或它们的组合,并适当变更反应条件而制备。制造方法4对于本发明中的核酸衍生物而言,可以以具有式(iv’)表示的部分结构的化合物的制造方法的形式来示例其制造方法。[化学式108](式中,dmtr、fmoc、r、r’、q’、x及polymer与上文中的含义相同。)化合物(iv’)可使用化合物(iv-a)、在与制造方法1的工序1至工序6同样的条件下制造。需要说明的是,化合物(iv-a)可以以市售品的形式得到。另外,在上述工序23中,也可根据需要将化合物(i-d)分割为两个单元,分两个阶段与化合物(iv-c)缩合来进行。具体而言,例如r’-q’为-nh-co-q4’-co-的情况下(q4’为取代或未取代的碳原子数1~12的亚烷基),在工序23中,利用与工序23同样的方法使化合物(iv-c)与ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)缩合,将得到的化合物的乙酯在乙醇、水等溶剂中用氢氧化锂等碱进行水解,然后进一步与r’-nh2(r’与上文中的含义相同)缩合,由此可得到目标化合物。需要说明的是,ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)及r’-nh2(r’与上文中的含义相同)可利用已知的方法(例如参见journalofamericanchemicalsociety,136,16958(2014))或以其为基准的方法而得到。作为示例示出了q为-co-的情况,但对于q并非-co-时的化合物而言,也可通过适当变更q的结构,利用与上述同样的方法、已知的方法或它们的组合,并适当变更反应条件而制备。制造方法5对于本发明中的核酸衍生物而言,可以以具有式(v’)表示的部分结构的化合物的制造方法的形式来示例其制造方法。[化学式109](式中,dmtr、r、r’、x、q’、tbdms、fmoc及polymer与上文中的含义相同。)化合物(v’)可使用化合物(iv-a)、在与制造方法2的工序1至工序7同样的条件下制造。需要说明的是,化合物(iv-a)可以以市售品的形式得到。另外,在上述工序31中,也可根据需要将化合物(i-d)分割为两个单元,分两个阶段与化合物(v-d)缩合来进行。具体而言,例如r’-q’为-nh-co-q4’-co-的情况下(q4’为取代或未取代的碳原子数1~12的亚烷基),在工序31中,利用与工序31同样的方法使化合物(v-d)与ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)缩合,将得到的化合物的乙酯在乙醇、水等溶剂中用氢氧化锂等碱进行水解,然后进一步与r’-nh2(r’与上文中的含义相同)缩合,由此可得到目标化合物。需要说明的是,ch3ch2-o-co-q4’-co-oh(q4’与上文中的含义相同)及r’-nh2(r’与上文中的含义相同)可利用已知的方法(例如参见journalofamericanchemicalsociety,136,16958(2014))或以其为基准的方法而得到。作为示例示出了q为-co-的情况,但对于q并非-co-时的化合物,也可通过适当变更q-oh的结构,利用与上述同样的方法、已知的方法或它们的组合,并适当变更反应条件而制备。制造方法6以下示例在寡核苷酸的5’末端键合有糖配体-系链-分支单元的本发明的核酸复合物的制造方法。[化学式110](式中,r、r’、q’、dmtr及x与上文中的含义相同)工序35化合物(i-h)可通过下述方式制造:在无溶剂的条件下或在溶剂中,在碱及反应促进剂共存下,于室温与200℃之间的温度,使化合物(ii-e)与2-氰乙基-n,n,n’,n’-四异丙基亚磷酰二胺反应5分钟~100小时。作为溶剂,可举出制造方法1的工序2中示例的溶剂。作为碱,可举出制造方法1的工序3中示例的碱。作为反应促进剂,可举出例如1h-四唑、4,5-二氰基咪唑、5-乙硫基四唑、5-苄硫基四唑等,可以以市售品的形式购入。工序36将寡核苷酸链伸长,最后使用化合物(i-h),用糖配体-系链-分支单元对寡核苷酸的5’末端进行修饰,然后进行从固相的脱离、保护基的脱保护及纯化,由此能够制造化合物(i”)。此处,从固相的脱离、保护基的脱保护及纯化中,可分别以与制造方法1的工序7同样的方式进行制造。制造方法7以下示例在寡核苷酸的5’末端键合有糖配体-系链-分支单元的本发明的核酸复合物的制造方法。可在与制造方法6的工序35及36同样的条件下进行制造。[化学式111](式中,r、r’、q’、dmtr及x与上文中的含义相同)制造方法8以下示例在寡核苷酸的5’末端键合有糖配体-系链-分支单元的本发明的核酸复合物的制造方法。可在与制造方法6的工序35及36同样的条件下进行制造。[化学式112](式中,r、r’、q’、dmtr及x与上文中的含义相同)制造方法9以下示例在寡核苷酸的5’末端键合有糖配体-系链-分支单元的本发明的核酸复合物的制造方法。可在与制造方法6的工序35及36同样的条件下进行制造。[化学式113](式中,r、r’、q’、dmtr及x与上文中的含义相同)制造方法10以下示例在寡核苷酸的5’末端键合有糖配体-系链-分支单元的本发明的核酸复合物的制造方法。可在与制造方法6的工序35及36同样的条件下进行制造。[化学式114](式中,r、r’、q’、dmtr及x与上文中的含义相同)制造方法11将构成双链核酸的在有义链的3’末端或5’末端具有糖配体-系链-分支单元的有义链、和构成双链核酸的反义链各自溶解于水或合适的缓冲液中,并进行混合,由此可得到具有双链核酸的核酸复合物。作为缓冲液,可举出例如乙酸缓冲液、tris缓冲液、柠檬酸缓冲液、磷酸缓冲液、水等,可以将它们单独或混合而使用。作为有义链与反义链的混合比,相对于1当量有义链而言,反义链优选为0.5~2当量,更优选为0.9~1.1当量,进一步优选为0.95当量~1.05当量。另外,可在将该有义链与该反义链混合后适当进行退火处理。退火处理可通过下述方式进行:将有义链与反义链的混合物加热至优选50~100℃、更优选60~100℃、进一步优选80~100℃后,缓慢冷却至室温。反义链可按照上述的已知寡核苷酸合成法而得到。制造方法12对于本发明中的核酸衍生物而言,可以以具有式(vi’)表示的部分结构的化合物的制造方法的形式来示例其制造方法。[化学式115](式中,dmtr、r、r’、x、q’、polymer、及fmoc与上文中的含义相同,tbs表示叔丁基二甲基硅烷基,r0及rx相同或不同,表示氢原子、c1~c10的亚烷基或c3-c8的亚环烷基,w为c1~c10的亚烷基、c3-c8的亚环烷基,或者可与r0一起形成c4-c8的含氮杂环。)工序45化合物(vi-b)可使用化合物(vi-a)、在与制造方法1的工序1同样的条件下制造。化合物(vi-a)可以以市售品的形式得到、或者利用已知的方法(例如bioorganic&medicinalchemistryletters,第11卷,383-386页)或以其为基准的方法而得到。工序46化合物(vi-c)可使用化合物(vi-b)、在与制造方法1的工序2同样的条件下进行制造。工序47化合物(vi-d)可使用化合物(vi-c)、在与制造方法1的工序3同样的条件下进行制造。工序48化合物(vi-e)可使用化合物(vi-d)、在与制造方法1的工序2同样的条件下制造。工序49化合物(vi-g)可使用化合物(vi-e)和化合物(vi-f)、在与制造方法1的工序3同样的条件下制造。工序50化合物(vi-h)可使用化合物(vi-g)、在与制造方法2的工序9同样的条件下制造。工序51~53化合物(vi’)可使用化合物(vi-h)、化合物(vi-i)及化合物(vi-j)、在与制造方法1的工序4~6同样的条件下制造。工序45~53可利用已知的方法(例如国际公开第2015/105083号记载的方法)或以其为基准的方法来实施。化合物(vi-f)可利用已知的方法(例如,美国化学学会杂志(journalofamericanchemicalsociety),136卷,16958页,2014年记载的方法)或以其为基准的方法而得到。制造方法13式2中p1及p4为-nh-co-、-o-co-或-s-co-的糖配体-系链单元可利用以下的方法制造。[化学式116](式中,q1、q2、q3、q4、q5、p2、p3、p5、p6、p7、t1、t2、l1、l2、q1、q2、q3及q4各自与上文中的含义相同,q2’表示比q2小1的整数,q4’表示比q4小1的整数,p1’及p4’各自独立地表示-nh-co-、-o-co-或-s-co-,z表示h、oh、nh2、sh、氯原子、溴原子、碘原子、甲磺酰氧基、对甲苯磺酰氧基或羧酸,b1’及b2’表示下述式的结构体中的任一者,pg1、pg2、pg3、pg4、pg5、pg6及pg7各自表示合适的保护基。)式:[化学式117]m1、m2、m3或m4各自独立地表示0~10的整数。工序54化合物(vii-c)可通过下述方式制造:在四氢呋喃等溶剂中,添加负载于聚合物上的三苯基膦,在冰冷却下,使化合物(vii-a)和化合物(vii-b)与偶氮二羧酸二异丙酯的甲苯溶液反应。作为溶剂,可举出制造工序1的工序2中示例的溶剂。化合物(vii-a)可以以市售品的形式得到。工序55化合物(vii-d)可使用化合物(vii-c)、在甲醇等溶剂中、在冰冷却下、在碱的存在下进行反应而制造。作为溶剂,可举出制造工序1的工序2中示例的溶剂。作为碱,可举出制造工序1的工序3中示例的碱。工序56化合物(vii-f)可使用化合物(vii-d)及化合物(vii-e)、在与制造工序1的工序3同样的条件下制造。工序57化合物(vii-h)可使用化合物(vii-f)及化合物(vii-g)、在与制造工序1的工序3同样的条件制造。工序58化合物(vii-j)可使用化合物(vii-h)及化合物(vii-i)、在与制造工序1的工序3同样的条件下制造。另外,通过将下述工序dp1和工序58重复进行,能够制造具有所期望的q1的值的化合物(vii-j)。工序59化合物(vii-l)可使用化合物(vii-j)及化合物(vii-k)、在与制造工序1的工序3同样的条件下制造。工序60化合物(vii-n)可使用化合物(vii-l)及化合物(vii-m)、在与制造工序1的工序3同样的条件下制造。工序61~63化合物(vii’)可使用化合物(vii-o)、化合物(vii-p)及化合物(vii-q)、在与制造工序1的工序3同样的条件制造。另外,通过将下述工序dp1和工序61重复进行,能够制造具有所期望的q3的值的化合物(vii’)。工序dp1可通过适当使用有机合成化学中常用的方法[例如,有机合成中的保护基第3版(protectivegroupsinorganicsynthesis,thirdedition)、格林(t.w.greene)著,johnwiley&sonsinc.(1999年)等中记载的方法等]来制造所期望的化合物。化合物(vii-b)、化合物(vii-e)、化合物(vii-g)、化合物(vii-i)、化合物(vii-k)、化合物(vii-m)、化合物(vii-o)、化合物(vii-p)及化合物(vii-q)可以以市售品的形式得到、或者通过将“实验化学讲座第4版有机合成,p.258,丸善(1992年)”、“march’sadvancedorganicchemistry:reactions,mechanisms,andstructure,7thedition”中记载的方法进行组合或以其为基准的方法而得到。制造方法14式4中p7为-o-的单元可利用以下的方法制造。[化学式118](式中,q5、p7、q5各自与上文中的含义相同,q5”表示比q5小2的整数,q5’表示比q5小1的整数,z2表示h、oh、nh2或sh,pg8及pg9各自表示合适的保护基,lc表示糖配体-系链单元,e表示羧酸或马来酰亚胺。)工序64化合物(viii-c)可使用化合物(viii-a)及化合物(viii-b)、在与制造工序1的工序3同样的条件下制造。另外,通过将下述工序dp2和工序64重复进行,能够制造具有所期望的q5”的值的化合物(viii-c)。化合物(viii-b)可以以市售品的形式得到、或者通过将“实验化学讲座第4版有机合成,p.258,丸善(1992年)”、“march’sadvancedorganicchemistry:reactions,mechanisms,andstructure,7thedition”中记载的方法进行组合或以其为基准的方法而得到。工序65化合物(viii’)可使用化合物(viii-c)及化合物(viii-d)、在与制造工序1的工序3同样的条件下制造。化合物(viii-d)可以以市售品的形式得到、或者通过将“实验化学讲座第4版有机合成,p.258,丸善(1992年)”、“march’sadvancedorganicchemistry:reactions,mechanisms,andstructure,7thedition”中记载的方法进行组合或以其为基准的方法而得到。工序dp2可通过适当使用有机合成化学中常用的方法[例如,有机合成中的保护基第3版(protectivegroupsinorganicsynthesis,thirdedition)、格林(t.w.greene)著,johnwiley&sonsinc.(1999年)等中记载的方法等]来制造所期望的化合物。制造方法15式2中p1及p4为-o-的糖配体-系链单元可利用以下的方法制造。[化学式119](式中,q1、q2、q3、q4、p2、p3、p5、p6、t1、t2、l1、l2、q1、q2、q3、q4、q2’、q4’、z、b1’、b2’各自与上文中的含义相同,pg10、pg11、pg12、pg13、pg14及pg15各自表示合适的保护基)式:[化学式120]m1、m2、m3及m4与上文中的含义相同。工序66化合物(ix-c)可通过下述方式制造:将化合物(ix-a)与化合物(ix-b)溶解于n,n’-二甲基甲酰胺等溶剂中,加入碳酸氢钾等碱,于室温~200℃反应5分钟~100小时。作为溶剂,可举出制造工序1的工序2中示例的溶剂。作为碱,可举出制造工序1的工序3中示例的碱。工序67化合物(ix-e)可通过下述方式制造:将化合物(ix-c)和化合物(ix-d)溶解于n,n’-二甲基甲酰胺等溶剂中,加入碳酸氢钾等碱,于室温~200℃反应5分钟~100小时。作为溶剂,可举出制造工序1的工序2中示例的溶剂。作为碱,可举出制造工序1的工序3中示例的碱。化合物(ix-a)可以以市售品的形式得到。工序68化合物(ix-g)可使用化合物(ix-e)及化合物(ix-f)、在与制造工序1的工序3同样的条件下制造。工序69化合物(ix-i)可使用化合物(ix-g)及化合物(ix-h)、在与制造工序1的工序3同样的条件下制造。另外,通过将工序dp和工序69重复进行,能够制造具有所期望的q1的值的化合物(vii-j)。工序70化合物(ix-k)可使用化合物(ix-i)及化合物(ix-j)、在与制造工序1的工序3同样的条件下制造。工序71化合物(ix-m)可使用化合物(ix-k)及化合物(ix-l)、在与制造工序1的工序3同样的条件下制造。工序72-74化合物(ix’)可使用化合物(ix-m)、化合物(ix-n)、化合物(ix-o)及化合物(ix-p)、在与制造工序1的工序3同样的条件下制造。另外,通过将下述工序dp3和工序72重复进行,能够制造具有所期望的q3的值的化合物(ix’)。工序dp3可通过适当使用有机合成化学中常用的方法[例如,有机合成中的保护基第3版(protectivegroupsinorganicsynthesis,thirdedition)、格林(t.w.greene)著,johnwiley&sonsinc.(1999年)等中记载的方法等]来制造所期望的化合物。化合物(ix’-b)、化合物(ix’-d)、化合物(ix’-f)、化合物(ix’-h)、化合物(ix’-j)、化合物(ix’-l)、化合物(ix’-n)、化合物(ix’-o)及化合物(ix’-p)可以以市售品的形式得到、或者通过将“实验化学讲座第4版有机合成,p.258,丸善(1992年)”、“march’sadvancedorganicchemistry:reactions,mechanisms,andstructure,7thedition”中记载的方法进行组合或以其为基准的方法而得到。制造方法16作为式1~式8的核酸复合物的制造方法,也可使用以下的方法。[化学式121](式中,lc、q5、q6、q7、p7、p8、q5’、q6及x与上文中的含义相同。)工序75化合物(x-b)可通过下述方式制造:在溶剂中,于0℃~100℃,使化合物(xiii”)与化合物(x-a)反应10秒~100小时。作为溶剂,可举出水、磷酸缓冲液、乙酸钠缓冲液、二甲基亚砜等,它们可以单独使用或混合而使用。化合物(viii’)可通过使用制造方法14而得到。化合物(x-a)也可通过已知的方法(例如生物偶联物化学(bioconjugatechemistry),第21卷,187-202页,2010年;或currentprotocolsinnucleicacidchemistry,2010年,9月,chapter:unit4.41)或以其为基准的方法而得到。工序76化合物(x’)可通过下述方式制造:使用化合物(x-b),在碳酸钠水溶液或氨水中等ph为8以上的条件下,于室温与200℃之间的温度,使其反应5分钟~100小时。制造方法17作为式1~式8的核酸复合物的制造方法,也可使用以下的方法。[化学式122](式中,lc、q5、q6、q7、p7、p8、q5’、q6及x与上文中的含义相同。)工序77化合物(xi-a)可使用化合物(viii”)、通过已知的方法(例如生物偶联物化学(bioconjugatechemistry),第26卷,1451-1455页,2015年中记载的方法)或以其为基准的方法而得到。化合物(viii”’)可通过使用制造方法14而得到。工序78化合物(xi’)可使用化合物(xi-a)和化合物(xi-b)、通过已知的方法(例如生物偶联物化学(bioconjugatechemistry),第26卷,1451-1455页,2015年中记载的方法)或以其为基准的方法而得到。化合物(xi-b)可通过生物偶联物化学(bioconjugatechemistry),第26卷,1451-1455页,2015年中记载的方法或以其为基准的方法而得到。工序79另外,作为其他方法,化合物(xi’)可通过已知的方法(例如参见生物偶联物化学(bioconjugatechemistry),第22卷,1723-1728页,2011年)或以其为基准的方法、直接从化合物(xi-a)得到。本说明书中的核酸复合物也可以以例如酸加成盐、金属盐、铵盐、有机胺加成盐、氨基酸加成盐等盐的形式得到。作为酸加成盐,可举出例如盐酸盐、硫酸盐、磷酸盐等无机酸盐、乙酸盐、马来酸盐、富马酸盐、柠檬酸盐、甲磺酸盐等有机酸盐,作为金属盐,可举出例如钠盐、钾盐等碱金属盐、镁盐、钙盐等碱土金属盐、铝盐、锌盐等,作为铵盐,可举出例如铵、四甲基铵等的盐,作为有机胺加成盐,可举出例如吗啉、哌啶等的加成盐,作为氨基酸加成盐,可举出例如赖氨酸、甘氨酸、苯丙氨酸等的加成盐。在想要制备本说明书的核酸复合物的盐的情况下,该复合物以期望的盐的形式得到时直接进行纯化即可,另外,以游离形式得到时,可以将该复合物溶解或悬浮于适当的溶剂中,加入相应的酸或碱,进行分离·纯化。另外,在将形成该复合物盐的抗衡离子转化为不同的抗衡离子时,可以将该复合物盐溶解或悬浮于适当的溶剂中,然后加入数当量~大幅过量的酸、碱及/或盐(氯化钠、氯化铵等无机盐等),并进行分离、纯化。本说明书的核酸复合物中有时也可存在几何异构体、光学异构体等立体异构体、互变异构体等,所有可能的异构体及它们的混合物均被包括在本发明内。另外,本说明书的核酸复合物有时也以与水或各种溶剂的加成物的形式存在,这些加成物也被涵盖在本发明的核酸复合物内。此外,本发明的核酸复合物还涵盖分子中的部分或全部原子被质量数不同的原子(同位素)(例如氘原子等)取代而成的物质。本发明的药物组合物含有式1表示的核酸复合物。本发明的核酸复合物通过具有l1及l2的糖配体而被靶细胞识别,并被导入至细胞内。对于本发明的核酸复合物而言,可以将其施予至哺乳动物,在生物体内使靶基因的表达降低或停止,由此抑制靶基因的表达,从而用于与靶基因相关的疾病的治疗。将本发明的核酸复合物作为治疗剂或预防剂使用时,作为施予途径,优选使用治疗时最有效的施予途径,但并没有特别限定,可举出例如静脉内施予、皮下施予、肌肉内施予等,优选为皮下施予。施予量根据施予对象的病状、年龄、施予途径等的不同而不同,例如可以以换算为双链寡核苷酸的1天施予量为0.1μg~1000mg的方式施予,更优选以1天施予量为1~100mg的方式施予。作为适合于静脉内施予或肌肉内施予的制剂,可举出例如注射剂,也可以将制备的液剂直接作为例如注射剂等形态使用,也可通过例如过滤、离心分离等将溶剂从该液剂中除去而使用,还可将该液剂进行冷冻干燥而使用及/或对加入有例如甘露醇、乳糖、海藻糖、麦芽糖或甘氨酸等赋形剂的液剂进行冷冻干燥而使用。为注射剂的情况下,优选在液剂或者除去了溶剂或进行了冷冻干燥的组合物中混合例如水、酸、碱、各种缓冲液、生理盐水或氨基酸输液等而制备注射剂。另外,还可以添加例如柠檬酸、抗坏血酸、半胱氨酸或edta等抗氧化剂、或者甘油、葡萄糖或氯化钠等等渗剂等而制备注射剂。另外,还可加入例如甘油等冷冻保存剂而进行冷冻保存。通过将本发明的组合物施予至哺乳动物的细胞,能够将本发明的组合物中的双链核酸导入细胞内。在体内将本发明的核酸复合物向哺乳动物的细胞导入的方法可以按照能够在体内进行的已知的转染的工序实施。通过将本发明的组合物静脉内施予至包括人在内的哺乳动物,能够送达至肝脏,将本发明的组合物中的双链核酸导入至肝脏或肝细胞内。向肝脏或肝细胞内导入本发明的组合物中的双链核酸后,能够使该肝细胞内的apcs基因的表达降低,治疗或预防淀粉样蛋白相关疾病。作为淀粉样蛋白相关疾病,可举出由包含apcs的淀粉样蛋白纤维介导的障碍所引起的疾病,具体而言,为作为淀粉样蛋白纤维而已知的异常的不溶性蛋白质纤维沉积于组织中而引起器官障碍的疾病。作为淀粉样蛋白相关疾病,更具体而言,可举出作为全身性淀粉样变性的al淀粉样变性、aa淀粉样变性、attr淀粉样变性、透析淀粉样变性、伴随淀粉样蛋白沉积的心力衰竭、伴随淀粉样蛋白沉积的肾病、老年性淀粉样变性、腕管综合征等、作为局限性淀粉样变性的阿尔茨海默型痴呆、脑淀粉样血管病、ii型糖尿病等。本发明的核酸复合物的施予对象为哺乳动物,优选为人。将本发明的核酸复合物作为淀粉样蛋白相关疾病的治疗剂或预防剂使用时,作为施予途径,优选使用治疗时最有效的施予途径,可优选举出静脉内施予、皮下施予、或肌肉内施予,可更优选举出皮下施予。施予量根据施予对象的病状、年龄、施予途径等的不同而不同,例如可以以换算为双链核酸的1天施予量为0.1μg~1000mg的方式施予,更优选以1天施予量为1~100mg的方式施予。另外,本发明提供:用于疾病的治疗的核酸复合物;用于疾病的治疗的药物组合物;用于治疗疾病的核酸复合物的用途;核酸复合物在疾病的治疗用药物的制造中的用途;用于疾病的治疗用药物的制造的核酸复合物;包括将有效量的核酸复合物施予至需要其的对象的、疾病的治疗或预防方法。实施例以下,利用参考例、实施例及试验例对本发明具体地进行说明。但是,本发明并不限定于这些实施例及试验例。需要说明的是,实施例及参考例中示出的质子核磁共振光谱(1hnmr)是在270mhz、300mhz或400mhz下测定的,根据化合物及测定条件的不同,有时无法清楚地观测到交换性质子。另外,作为信号的多重度的表述,使用了通常所使用的表述,br是指broad,表示表观上为宽幅的信号。uplc分析中使用了以下的条件。流动相a:含有0.1%甲酸的水溶液,b:乙腈溶液梯度:流动相b为10%-90%的线性梯度(3分钟)柱:waters公司制acquityuplcbehc18(1.7μm,内径2.1×50mm)流速:0.8ml/minpda检测波长:254nm(检测范围为190-800nm)表x-1~表x-4中示出参考例化合物。[表1]表x-1:化合物a1~a7[表2]接表x-1[表3]表x-2:化合物b1~b3[表4]表x-3:化合物c1~c17[表5]接表x-3[表6]接表x-3[表7]接表x-3[表8]接表x-3[表9]表x-4:化合物d1~d11[表10]接表x-4参考例1[化学式123]化合物re1-2的合成参考例1工序1将通过美国化学学会杂志(journalofamericanchemicalsociety),第136卷,16958-16961页,2014年中记载的方法合成的化合物re1-1(0.8755g,1.9567mmol)溶解于四氢呋喃(10ml)中,加入1,3-二环己基碳二亚胺(dcc,0.4247g,2.0584mmol)和n-羟基琥珀酰亚胺(0.2412g,2.0958mmol)于室温搅拌一夜。将从反应混合物中析出的固体除去,在减压下蒸馏除去溶剂。将得到的混合物溶解于n,n’-二甲基甲酰胺(dmf)中,加入2-氨基乙基马来酰亚胺溴酸盐(0.6479g,2.5491mmol)和二异丙基乙基胺(1.7ml,9.7835mmol),然后于室温搅拌一夜。在减压下,将反应液中的溶剂蒸馏除去,利用反相柱色谱法(水/甲醇=80/20)使其洗脱,由此得到化合物re1-2(0.8502g,收率76%)。esi-msm/z:570(m+h)+;1h-nmr(dmso-d6)δ:1.45-1.56(4h,m),1.78(3h,s),1.90(3h,s),1.97(2h,t,j=7.0hz),2.00(3h,s),2.11(3h,s),3.18-3.19(2h,m),3.38-3.45(3h,m),3.64-3.71(1h,m),3.85-3.89(1h,m),4.01-4.04(3h,m),4.48(1h,d,j=8.6hz),4.95-4.98(1h,m),5.21(1h,d,j=3.5hz),6.99(2h,s),7.81-7.87(2h,m).化合物re1-4的合成参考例1工序2将化合物re1-1(0.9602g,2.1460mmol)溶解于n,n’-二甲基甲酰胺(10ml)中,加入n-boc-乙二胺(sigma-aldrich公司制,0.6877g,4.292mmol)、二异丙基乙基胺(1.90ml,10.87mmol)、及2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(和光纯药工业公司制,1.6437g,4.3229mmol),于室温搅拌一整夜。向反应液中加入水,用氯仿萃取2次,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,得到化合物re1-3的粗纯化物。esi-msm/z:590(m+h)+参考例1工序3将化合物re1-4的合成工序1中合成的化合物re1-3(1.2654g,2.1460mmol)溶解于二氯甲烷(15ml)中,加入三氟乙酸(4ml),于室温搅拌一夜。向反应液中加入水,用乙酸乙酯进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,利用反相柱色谱法(水/甲醇=80/20)使其洗脱,由此得到化合物re1-4(0.3879g,收率37%)。esi-msm/z:490(m+h)+;1h-nmr(dmso-d6)δ:1.46-1.52(4h,m),1.78(3h,s),1.90(3h,s),2.00(3h,s),2.08(2h,t,j=7.4hz),2.11(3h,s),2.85(2h,t,j=6.3hz),3.27(2h,dd,j=12.3,6.2hz),3.67-3.69(1h,m),3.68-3.73(1h,m),3.86-3.90(1h,m),4.01-4.04(3h,m),4.49(1h,d,j=8.4hz),4.97(1h,dd,j=11.3,3.4hz),5.22(1h,d,j=3.5hz),7.86(1h,d,j=9.1hz),7.95-8.02(1h,m).参考例2[化学式124]参考例2工序1将((2r,3r)-1,3-二羟基丁烷-2-基)氨基甲酸(9h-芴-9-基)甲酯(化合物re2-1,chem-impexinternational,inc公司制,1.50g,4.58mmol)溶解于吡啶(20ml)中,在冰冷却下,加入4,4’-二甲氧基三苯甲基氯(东京化成工业公司制,1.71g,5.04mmol),然后于室温搅拌2小时。将反应液用冰冷却,加入10%柠檬酸水溶液,用乙酸乙酯进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(己烷/乙酸乙酯=90/10)对残余物进行纯化,由此得到化合物re2-2(1.07g,收率37%)。esi-msm/z:630(m+h)+参考例2工序2将参考例2工序1中合成的化合物re2-2(1.07g,1.699mmol)溶解于n,n-二甲基甲酰胺(10ml)中,于室温加入哌啶(0.336ml,3.40mmol)并搅拌3小时。向反应液中加入水,用乙酸乙酯进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,用氨基硅胶柱色谱法(氯仿/甲醇=90/10)对残余物进行纯化,由此得到化合物re2-3(0.59g,收率85%)。esi-msm/z:408(m+h)+参考例3[化学式125]参考例3工序1将5-羟基间苯二甲酸二甲酯(化合物re3-1,和光纯药工业公司制,5.0443g,24mmol)溶解于四氢呋喃(和光纯药工业公司制25ml)中,加入2-(叔丁氧羰基氨基)-1-乙醇(东京化成工业公司制,4.0343g,25.03mmol)、及负载于聚合物上的三苯基膦(sigma-aldrich公司制,6.61g,25.2mmol),然后在冰冷却下,加入40%偶氮二甲酸二异丙酯(diad)甲苯溶液(东京化成工业公司制,13.26ml,25.2mmol),于室温搅拌一夜。将反应液过滤,在减压下将滤液蒸馏除去,然后用氨基硅胶柱色谱法(己烷/乙酸乙酯=95/5~80/20)对残余物进行纯化,由此得到化合物re3-2(5.3071g,收率63%)。esi-msm/z:254(m+h)+,以脱boc体的形式检测参考例3工序2将参考例3工序1中合成的化合物re3-2(5.3071g,15.02mmol)溶解于甲醇(25ml)中,在冰冷却下,加入2mol/l氢氧化钠水溶液(和光纯药工业公司制,13ml),于室温搅拌4小时。将反应液用冰冷却,加入10%柠檬酸水溶液,用乙酸乙酯进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,由此定量地得到化合物re3-3。esi-msm/z:324(m-h)-参考例3工序3将参考例3工序2中合成的化合物re3-3(1.9296g,5.93mmol)溶解于n,n’-二甲基甲酰胺(70ml)中,加入n-1-(9h-芴-9-基甲氧基羰基)-乙二胺盐酸盐(3.3493g,11.86mmol)、二异丙基乙基胺(5.18ml,29.7mmol)、及2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(4.5168g,11.88mmol),于室温搅拌4小时。将反应液用冰冷却,加入10%柠檬酸水溶液,用氯仿进行萃取,然后用饱和碳酸氢钠水溶液及饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇)对残余物进行纯化,由此得到化合物re3-4(3.4407g,收率68%)。esi-msm/z:898(m+hcoo)-参考例3工序4将参考例3工序3中合成的化合物re3-4(1.6087g,1.884mmol)溶解于二氯甲烷(20ml)中,在冰冷却下,加入三氟乙酸(5ml,64.9mmol),于室温搅拌4小时。在减压下,将反应液中的溶剂蒸馏除去,由此定量地得到化合物re3-5(2.4079g)。esi-msm/z:798(m+hcoo)-参考例3工序5将参考例3工序4中合成的化合物re3-5(386mg,0.512mmol)溶解于四氢呋喃(10ml)中,在冰冷却下,加入苯甲酰氯(175mg,1.024mmol),于室温搅拌1小时。在减压下将反应液中的溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇)对残余物进行纯化,由此得到化合物re3-6(373mg,收率82%)。esi-msm/z:888(m+h)+参考例3工序6将参考例3工序5中合成的化合物re3-6(108mg,0.122mmol)溶解于二氯甲烷(5ml)中,于室温加入二乙胺(0.5ml,4.8mmol),并搅拌1小时。在减压下将溶剂蒸馏除去,由此定量地得到化合物re3-7(54.9mg)。esi-msm/z:444(m+h)+参考例3工序7将参考例3工序6中合成的化合物re3-7(180mg,0.406mmol)、nα,nε-双(叔丁氧羰基)-l-赖氨酸(novabiochem公司制,295mg,0.852mmol)、二异丙基乙基胺(0.354ml,2.029mmol)、及2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(324mg,0.852mmol),于室温搅拌一整夜。将反应液用冰冷却,加入10%柠檬酸水溶液,用氯仿进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,用氨基硅胶柱色谱法(氯仿/甲醇)对残余物进行纯化,由此定量地得到化合物re3-8(450mg)。esi-msm/z:1101(m+h)+参考例3工序8将参考例3工序7中合成的化合物re3-8(2.1558g,1.9593mmol)溶解于二氯甲烷(20ml)中,在冰冷却下,加入三氟乙酸(5ml),于室温搅拌4小时。在减压下,将反应液中的溶剂蒸馏除去,由此定量地得到化合物re3-9。esi-msm/z:700(m+h)+参考例4[化学式126](图中,bn表示苄基。)参考例4工序1将利用参考例3中记载的方法合成的化合物re4-1(参考例3中的化合物re3-5,0.5716g,0.7582mmol)、利用生物偶联物化学(bioconjugatechemistry),第22卷,690-699页,2011年中记载的方法合成的十二烷酸单苄酯(0.4859g,1.5164mmol)、二异丙基乙基胺(0.662ml,3.79mmol)、及2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(0.5766g,1.516mmol)溶解于n,n二甲基甲酰胺(12ml)中,于室温搅拌1小时。将反应液用冰冷却,加入饱和柠檬酸水溶液,用氯仿进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇)对残余物进行纯化,由此得到化合物re4-2(0.88g,收率84%)。esi-msm/z:1057(m+h)+参考例4工序2将参考例4工序1中合成的化合物re4-2(0.7545g,0.714mmol)溶解于二氯甲烷和四氢呋喃的混合溶剂(20ml)中,于室温加入二乙胺(5ml,47.9mmol)并搅拌一整夜。在减压下将溶剂蒸馏除去,由此定量地得到化合物re4-3。esi-msm/z:612(m+h)+参考例4工序3加入参考例4工序2中合成的化合物re4-3(0.437g,0.7143mmol)、nα,nε-双(叔丁氧羰基)-l-赖氨酸(novabiochem公司制,0.5483g,1.583mmol)、二异丙基乙基胺(0.624ml,3.57mmol)、2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(0.5703g,1.5mmol),于室温搅拌2小时。向反应液中加入10%柠檬酸水溶液,用乙酸乙酯进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,由此得到化合物re4-4的粗产物。esi-msm/z:1269(m+h)+参考例4工序4将参考例4工序3中合成的化合物re4-4(0.906g,0.7143mmol)溶解于二氯甲烷(12ml)中,在冰冷却下,加入三氟乙酸(3ml,38.9mmol),于室温搅拌4小时。在减压下,将反应液中的溶剂蒸馏除去,由此得到化合物re4-5的粗产物。esi-msm/z:869(m+h)+参考例5[化学式127]参考例5工序1将利用参考例3中记载的方法合成的化合物re5-1(参考例3中的re3-8,100mg,0.091mmol)溶解于甲醇(3ml)中,添加乙酸(2μl)后,进行基于钯/碳的催化加氢还原。在减压下,将得到的溶液馏分中的溶剂蒸馏除去,由此定量地得到化合物re5-2。esi-msm/z:967(m+h)+参考例5工序2将化合物re5-2(50mg,0.052mmol)及n-(6-马来酰亚胺己酰氧基)琥珀酰亚胺(48mg,0.155mmol)溶解于四氢呋喃(2ml)中,加入二异丙基乙基胺(0.045ml,0.259mmol),于室温搅拌一整夜。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇)对残余物进行纯化,由此得到化合物re5-3(18mg,收率30%)。esi-msm/z:1160(m+h)+参考例5工序3将参考例5工序2中合成的化合物re5-3(18mg,0.016mmol)溶解于二氯甲烷(2ml)中,在冰冷却下,加入三氟乙酸(0.2ml,2.6mmol),于室温搅拌一整夜。在减压下将反应液中的溶剂蒸馏除去,利用乙醚进行晶析后,以白色固体的形式得到化合物re5-4(7.5mg,收率64%)。esi-msm/z:759(m+h)+参考例6[化学式128]参考例6工序1使用利用参考例3中记载的方法合成的化合物re6-1(参考例3中的化合物re3-2,0.9372g,2.8809mmol)、β-丙氨酸甲酯盐酸盐(东京化成工业株式会社制,0.8082g,5.7902mmol),利用与参考例3工序3同样的方法,定量地得到化合物re6-2。esi-msm/z:495(m+h)+参考例6工序2使用参考例6工序1中合成的化合物re6-2(0.9622g,1.952mmol),利用与参考例3工序4同样的方法,定量地得到化合物re6-3。esi-msm/z:396(m+h)+参考例6工序3使用参考例6工序2中合成的化合物re6-3(0.1146g,0.290mmol)及15-叠氮基-4,7,10,13-四氧杂十五烷酸n-琥珀酰亚胺基酯(n3-peg4-nhs,东京化成工业株式会社制,0.0750g,0.1931mmol),利用与参考例5工序2同样的方法,定量地得到化合物re6-4。esi-msm/z:669(m+h)+参考例6工序4使用参考例6工序3中合成的化合物re6-4(0.1291g,0.193mmol),利用与参考例3工序2同样的方法,定量地得到化合物re6-5。esi-msm/z:641(m+h)+参考例6工序5使用参考例6工序4中合成的化合物re6-5(0.1252g,0.193mmol)及l-谷氨酸二叔丁基酯(渡边化学株式会社制,0.1180g,0.399mmol),利用与参考例3工序3同样的方法,得到化合物re6-6(0.0521g,收率24%)。esi-msm/z:1124(m+h)+参考例6工序6使用参考例6工序5中合成的化合物re6-6(0.0521g,0.0464mmol),利用与参考例3工序4同样的方法,得到化合物re6-7(36mg,收率86%)。esi-msm/z:899(m+h)+参考例7[化学式129]参考例7工序1使用通过参考例3中记载的方法合成的化合物re7-1(参考例3中的re3-9,0.2586g,0.3695mmol)和通过美国化学学会杂志(journalofamericanchemicalsociety),第136卷,16958-16961页,2014年中记载的方法合成的参考例1中记载的化合物re-1(0.8559g,1.7927mmol),利用与参考例3工序3同样的方法,得到化合物re7-2(0.5272g,收率61%)。esi-msm/z:2418(m+h)+参考例7工序2使用参考例7工序1中合成的化合物re7-2(0.2653g,0.1097mmol),利用与参考例5工序1同样的方法,得到化合物re7-3(0.1524g,收率61%)。esi-msm/z:2284(m+h)+参考例8:化合物a1及b1的合成[化学式130]化合物a1的合成使用利用参考例7中记载的方法合成的化合物re8-1(参考例7中的化合物re7-3,0.0152g,0.006657mmol),利用与参考例5工序2同样的方法,得到化合物a1(0.0077g,收率47%)。esi-msm/z:1239(m+2h)2+1h-nmr(dmso-d6)δ:1.11-1.66(34h,m),1.77(12h,d,j=1.5hz),1.89(12h,s),2.01-2.14(10h,m),2.01(12h,s),2.10(12h,s),2.92-2.99(4h,m),3.16-3.54(14h,m),3.65-3.74(4h,m),3.81-3.91(4h,m),3.98-4.08(14h,m),4.11-4.24(4h,m),4.48(4h,dd,j=8.4,1.8hz),4.93-5.00(4h,m),5.21(4h,d,j=3.5hz),6.99(2h,s),7.52(2h,s),7.66-7.75(2h,m),7.78-7.87(6h,m),7.91(1h,brs),8.01-8.08(3h,brm),8.54-8.60(2h,brm).化合物b1的合成使用化合物re8-1(参考例7中的化合物re7-3,0.0150g,0.00657mmol),利用与参考例3工序3同样的方法,得到化合物b1(0.0062g,收率37%)。esi-msm/z:1279(m+2h)2+1h-nmr(dmso-d6)δ:1.11-1.66(30h,m),1.77(12h,s),1.89(12h,s),2.01-2.14(8h,m),2.01(12h,s),2.10(12h,s),2.33-2.38(2h,m),2.92-2.99(4h,m),3.16-3.54(14h,m),3.58-3.63(16h,m),3.65-3.74(4h,m),3.81-3.91(4h,m),3.98-4.08(12h,m),4.11-4.24(4h,m),4.48(4h,dd,j=8.4,1.8hz),4.93-5.00(4h,m),5.21(4h,d,j=3.5hz),7.52(2h,s),7.66-7.75(2h,m),7.78-7.87(6h,m),7.91(1h,brs),8.01-8.08(3h,brm),8.54-8.60(2h,brm).参考例9:化合物b2及b3的合成[化学式131]化合物b2的合成使用利用参考例6中记载的方法合成的化合物re9-1(参考例6中的化合物re6-5,0.00436g,0.00681mmol)及参考例1的化合物re1-4(0.010g,0.020mmol),利用与参考例3工序3同样的方法,得到化合物b2的粗产物。esi-msm/z:1584(m+h)+化合物b3的合成使用利用参考例6中记载的方法合成的化合物re9-2(参考例6中的化合物re6-7,0.0100g,0.01112mmol),利用与参考例3工序3同样的方法,得到化合物b3(0.0223g,收率72%)。esi-msm/z:1393(m+2h)2+参考例10:化合物c1及d1的合成[化学式132]参考例10工序1使用利用参考例4中记载的方法合成的化合物re10-1(参考例4中的化合物re4-5,0.1952g,0.225mmol)和通过美国化学学会杂志(journalofamericanchemicalsociety),第136卷,16958-16961页、2014年中记载的方法合成的参考例1的化合物re1-1(0.4162g,0.93mmol),利用与参考例3工序3同样的方法,得到化合物re10-2(334.8mg,收率58%)。esi-msm/z:1294(m+2h)2+参考例10工序2使用参考例10工序1中合成的化合物re10-2(0.1459g,0.056mmol),利用与参考例5工序1同样的方法,得到化合物d1(112mg,收率80%)。esi-msm/z:1249(m+2h)2+1h-nmr(dmso-d6)δ:1.11-1.66(44h,m),1.77(12h,d,j=1.5hz),1.89(12h,s),2.01-2.20(12h,m),2.01(12h,s),2.10(12h,s),2.92-2.99(4h,m),3.16-3.54(10h,m),3.58-3.64(4h,m),3.65-3.74(4h,m),3.81-3.91(4h,m),3.98-4.08(12h,m),4.11-4.24(4h,m),4.48(4h,dd,j=8.4,1.8hz),4.93-5.00(4h,m),5.21(4h,d,j=3.5hz),6.99(2h,s),7.52(2h,s),7.66-7.75(2h,m),7.78-7.87(6h,m),7.91(1h,brs),8.01-8.08(3h,brm),8.54-8.60(2h,brm).参考例10工序3使用参考例10工序2中合成的化合物d1(0.1091g,0.044mmol)及参考例2的化合物re2-3(0.0748g,0.184mmol),利用与参考例3工序3同样的方法,以粗产物形式得到化合物re10-3。esi-msm/z:1292(m+2h)2+,以脱dmtr体形式检测参考例10工序4将参考例10工序3中合成的化合物re10-3(0.161g,0.05586mmol)溶解于二氯甲烷(5ml)中,加入丁二酸酐(东京化成工业公司制,0.1182g,1.181mmol)、n,n-二甲基氨基吡啶(0.0224g,0.183mmol)、及三乙胺(0.55ml,3.95mmol),于室温搅拌一夜。将反应液用冰冷却,加入水,用乙酸乙酯萃取2次,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,由此得到化合物re10-4的粗产物。esi-msm/z:1342(m+2h)2+,以脱dmtr体形式检测参考例10工序5将参考例10工序4中合成的化合物re10-4(0.0816g,0.02734mmol)、o-(苯并三唑-1-基)-n,n,n’,n’-四甲基脲六氟磷酸盐(0.0221g,0.05827mmol)、及二异丙基乙基胺(0.02ml,0.1094mmol)溶解于n,n-二甲基甲酰胺(4ml)中,加入lcaa-cpg(chemgene公司制,0.4882g),于室温搅拌一整夜。将混合物过滤,依次用二氯甲烷、10%甲醇二氯甲烷溶液、及乙醚进行洗涤,然后使其与乙酸酐/吡啶溶液作用,由此得到化合物c1(49.5μmol/g,收率89%)。需要说明的是,收率由向固相载体中的导入率算出,所述向固相载体中的导入率可通过将1%三氟乙酸/二氯甲烷溶液添加于固相载体中、根据来自dmtr基的吸收而计算得到。参考例11[化学式133]利用药物化学杂志(journalofmedicinalchemistry),第59卷,2718-2733页,2016年中记载的方法,由化合物re11-1(1.200g,3.640mmol)来合成化合物re11-2(1.050g,收率50%)。esi-msm/z:582(m+h)+参考例12[化学式134]将化合物re12-1(4.000g,10.27mmol)溶解于二氯甲烷(60ml)中,加入2-(2-羟基乙氧基)乙基氨基甲酸苄酯(2.700g,11.30mmol)、及三氟甲磺酸(0.1360ml,1.541mmol),在回流条件下搅拌一整夜。向反应液中加入10wt%碳酸钾水溶液,与二氯甲烷进行分液后,用水洗涤有机相,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,置换为2-甲基四氢呋喃并进行浓缩。将残余物滴加于庚烷中,对得到的晶体进行过滤,由此得到化合物re12-2(5.130g,收率88%)。esi-msm/z:570(m+h)+参考例13[化学式135]将化合物re13-1(参考例1中的化合物re1-1,898.0mg,2.007mmol)溶解于二氯甲烷(15ml)中,加入1-羟基苯并三唑一水合物(338.0mg,2.208mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(343mg,2.208mmol)、及n-1-z-1,3-二氨基丙烷盐酸盐(0.4910ml,2.208mmol),于室温搅拌3小时。向反应液中加入水,用二氯甲烷进行分液后,用饱和碳酸氢钠水溶液洗涤有机层,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇=90/10)对残余物进行纯化,由此得到化合物re13-2(873.0mg,收率68%)。esi-msm/z:639(m+h)+参考例14[化学式136]参考例14工序1将化合物re14-1(参考例1中的化合物re1-1,3.00g,6.70mmol)溶解于二氯甲烷(60ml)中,于室温加入l-赖氨酸苄酯二对甲苯磺酸盐(1.75g,3.02mmol)、三乙胺(0.935ml,6.70mmol),1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(1.29g,6.70mmol)、1-羟基苯并三唑一水合物(103mg,0.670mmol),并搅拌2.5小时。用水和饱和碳酸氢钠水溶液对反应液进行洗涤,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇=90/10)对残余物进行纯化,由此定量地得到化合物re14-2。esi-msm/z:1096(m+h)+参考例14工序2将化合物re14-2(2.30g,2.10mmol)溶解于四氢呋喃(46ml)中,于室温加入10%钯碳粉末(含水品,54.29%;424mg),在氢气氛下搅拌一整夜。将反应液过滤,在减压下将溶剂蒸馏除去,由此定量地得到化合物re14-3。esi-msm/z:1006(m+h)+参考例15[化学式137]参考例15工序1将亚氨基二乙酸(东京化成工业公司制,1.5g,6.43mmol)溶解于二氯甲烷(30ml)中,加入五氟三氟乙酸(东京化成工业公司制,2.75ml,16.08mmol)、三乙胺(4.48ml,32.2mmol),搅拌4小时。向反应液中加入10%柠檬酸水溶液,用氯仿进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在其中,将利用参考例11中记载的方法合成的化合物re15-1(参考例11中的化合物re11-2,2g,3.45mmol)溶解于乙酸乙酯(10ml)和乙腈(10ml)的混合液中,进行基于钯/碳的催化加氢还原。在减压下将得到的溶液部分中的溶剂蒸馏除去,由此得到化合物re15-2的粗产物。esi-msm/z:1091(m+h)+参考例15工序2使用化合物re15-2(1.5g,1.37mmol),利用与参考例1工序3同样的方法,定量地得到化合物re15-3。esi-msm/z:990(m+h)+参考例16[化学式138]参考例16工序1使用n-(叔丁氧羰基)-l-谷氨酸(东京化成工业公司制),并使用利用参考例11中记载的方法合成的化合物re16-1(1.855g,3.19mmol),利用与参考例15工序1同样的方法,得到化合物re16-2的粗纯化物。esi-msm/z:1105(m+h)+参考例16工序2使用化合物re16-2(1.421g,1.2866mmol),利用与参考例1工序3同样的方法,定量地得到化合物re16-3。esi-msm/z:1004(m+h)+参考例17[化学式139]将利用有机化学杂志(journaloforganicchemistry),第74卷,6837-6842页,2009年中记载的方法合成的化合物re17-1(90mg,0.173mmol)溶解于四氢呋喃(1ml)中,加入负载于聚合物上的三苯基膦(sigma-aldrich公司制,63mg,0.189mmol),在加热回流下搅拌3小时。将反应液过滤,在减压下将溶剂蒸馏除去,由此得到化合物re17-2(70mg,收率82%)。esi-msm/z:516(m+na)+1h-nmr(400mhz,cdcl3):δ0.89(3h,s),1.42-1.48(2h,m),1.52-1.61(2h,m),1.85(1h,brs),2.68(2h,t,j=7.2hz),3.06-3.07(2h,m),3.39-3.44(3h,m),3.51-3.55(3h,m),3.78(6h,s),6.80-6.85(4h,m),7.17-7.23(1h,m),7.27-7.33(6h,m),7.41-7.43(2h,m).参考例18[化学式140]参考例18工序1使用化合物re18-1(东京化成工业公司制,0.500g,3.73mmol),利用与参考例2工序1同样的方法,得到化合物re18-2的粗产物(1.5g)。esi-msm/z:435(m-h)-参考例18工序2使用化合物re18-2的粗产物(1.5g)和1,4-二氨基丁烷(东京化成工业公司制,3.29g,37.3mmol),利用与参考例3工序3同样的方法,得到化合物re18-3(0.18g,两步收率10%)。esi-msm/z:551(m+hcoo)-1h-nmr(400mhz,meod):δ1.09(3h,s),1.45-1.52(4h,m),2.80(2h,t,j=7.2hz),2.91(2h,s),3.05(1h,d,j=8.8hz),3.12-3.16(4h,m),3.24(1h,s),3.43(1h,d,j=10.8hz),3.62-3.66(7h,m),6.71-6.76(4h,m),7.05-7.11(1h,m),7.12-7.20(6h,m),7.28-7.32(2h,m).参考例19[化学式141]将利用有机化学杂志(journaloforganicchemistry),第74卷,6837-6842页,2009年中记载的方法合成的化合物re19-1(110mg,0.212mmol)溶解于四氢呋喃(2ml)中,加入n-(1r,8s,9s)-双环[6.1.0]壬-4-炔-9-基甲氧羰基-1,8-二氨基-3,6-二氧杂辛烷(东京化成工业公司制,72mg,0.222mmol),于室温搅拌1小时。向反应液中加入水,用氯仿进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,用氨基硅胶柱色谱法(氯仿/甲醇=90/10)对残余物进行纯化,由此得到化合物re19-2(160mg,收率90%)。esi-msm/z:845(m+h)+1h-nmr(400mhz,cdcl3):δ0.88(3h,s),0.91-1.09(3h,m),1.20-1.25(1h,m),1.52-1.59(4h,m),1.80-1.85(2h,m),2.19-2.25(4h,m),2.59-2.68(1h,m),2.84-2.90(4h,m),3.02-3.11(3h,m),3.35-3.44(5h,m),3.49-3.53(5h,m),3.54-3.58(2h,m),3.62(5h,s),3.78(6h,s),4.13(2h,d,j=6.4hz),4.21(2h,t,j=7.2hz),6.79-6.84(4h,m),7.18-7.21(1h,m),7.24-7.27(2h,m),7.28-7.32(4h,m),7.39-7.44(2h,m).参考例20[化学式142]参考例20工序1使用化合物re20-1(astatech公司制,100mg,1.148mmol)及fmoc-ser(tbume2si)-oh(渡边化学工业公司制,532mg,1.205mmol),利用与参考例3工序3同样的方法,得到化合物re20-2(410mg,收率70%)。esi-msm/z:511(m+h)+1h-nmr(400mhz,cdcl3):δ0.06(6h,s),0.90(9h,s),2.76-2.85(1h,m),3.65-3.86(5h,m),4.02-4.23(3h,m),4.32-4.40(4h,m),5.55(1h,d,j=8.0hz),7.31(2h,t,j=7.6hz),7.40(2h,t,j=7.6hz),7.59(2h,d,j=7.6hz),7.76(2h,d,j=7.6hz).参考例20工序2使用化合物re20-2(410mg,0.803mmol),利用与参考例2工序1同样的方法,得到化合物re20-3的粗产物(680mg)。esi-msm/z:814(m+h)+参考例20工序3使用化合物re20-3的粗产物(680mg),利用与参考例2工序5同样的方法,得到化合物re20-4(330mg,两步收率70%)。esi-msm/z:519(m+h)+1h-nmr(400mhz,cdcl3):δ0.02-0.09(6h,m),0.89(9h,d,j=28.8hz),2.84-2.94(1h,m),3.24-3.30(2h,m),3.46(1h,t,j=7.2hz),3.52-3.68(2h,m),3.75-3.80(1h,m),3.82(6h,d,j=2.4hz),3.89-3.96(1h,m),4.05-4.17(1h,m),4.27-4.37(1h,m),6.82-6.89(4h,m),7.22-7.27(1h,m),7.29-7.34(6h,m),7.41-7.45(2h,m)参考例21[化学式143]参考例21工序1将n-(叔丁氧羰基)-1,3-二氨基丙烷(东京化成工业公司制,1.788g,10.26mmol)溶解于二氯甲烷(22.8ml)中,加入三乙胺(1.907ml,13.68mmol),于室温搅拌15分钟。向反应液中滴加利用有机化学通讯(organicletter),第16卷,6318-6321页,2014年中记载的方法合成的化合物re21-1(1.126g,6.84mmol)的二氯甲烷溶液(5ml),于室温搅拌2小时。向反应液中加入水,用氯仿进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸镁进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=35/65)对残余物进行纯化,由此得到化合物re21-2(1.65g,收率80%)。esi-msm/z:303(m+h)+参考例21工序2使用化合物re21-2(1.65g,5.46mmol),利用与参考例1工序2同样的方法,得到化合物re21-3(1.10g,收率100%)。esi-msm/z:203(m+h)+1h-nmr(400mhz,cdcl3):δ1.74(2h,dt,j=12.0,6.0hz),2.95(2h,t,j=6.0hz),3.18(1h,s),3.60(2h,td,j=6.0,5.2hz),7.54(2h,dt,j=8.4,1.8hz),7.76(2h,dt,j=8.4,1.8hz),7.97(1h,brs).参考例22[化学式144]参考例22工序1使用化合物re22-1(东京化成公司制,1.2g,4.24mmol),利用与参考例2工序1同样的方法,得到化合物re22-2的粗产物。esi-msm/z:608(m+na)+参考例22工序2使用化合物re22-2的粗产物,利用与参考例2工序5同样的方法,得到化合物r22-3(1.34g,两步收率52%)。esi-msm/z:386(m+na)+1h-nmr(400mhz,cdcl3):δ3.34(2h,t,j=6.4hz),3.47(2h,t,j=6.4hz),3.79(6h,s),6.78-6.84(4h,m),7.17-7.21(1h,m),7.27-7.35(6h,m),7.42-7.46(2h,m).参考例22工序3使用化合物re22-3(1.15g,3.16mmol)及fmoc-ser(tbume2si)-oh(渡边化学工业公司制,1.677g,3.8mmol),利用与参考例3工序3同样的方法,得到化合物re22-4(560mg,收率31%)。1h-nmr(400mhz,cdcl3)δ:0.00-0.07(6h,m),0.83-0.89(9h,m),3.18-3.26(2h,m),3.39-3.46(2h,m),3.61-3.68(1h,m),3.76(6h,s),3.89(1h,dd,j=10.0,4.0hz),4.03(1h,dd,j=10.0,4.0hz),4.15-4.20(1h,m),4.22-4.28(1h,m),4.32-4.40(2h,m),5.65-5.88(1h,m),6.76-6.85(4h,m),7.16-7.23(1h,m),7.25-7.34(8h,m),7.36-7.44(4h,m),7.50-7.64(2h,m),7.72-7.79(2h,m).参考例23使用表y-1中记载的化合物re23-1~re23-5及fmoc-ser(tbume2si)-oh,利用与参考例22同样的方法,得到表y-2中记载的化合物re23-6~re23-10。使用参考例22的化合物re22-3和fmoc-thr(tbume2si)-oh,利用与参考例22同样的方法,得到表y-2中记载的化合物re23-11。使用表y-1中记载的化合物re23-1和fmoc-thr(tbume2si)-oh,利用与参考例22同样的方法,得到表y-2中记载的化合物re23-12。通过本实施例合成的化合物的nmr分析数据示于表y-3。[表11]表y-1[表12]表y-2[表13]表y-3参考例24[化学式145]使用利用参考例22中记载的方法合成的化合物re24-1(参考例22中的化合物re22-4,2.487g,3.16mmol),利用与参考例2工序2同样的方法,得到化合物re24-2(1.2g,收率67%)。esi-msm/z:587(m+na)+1h-nmr(400mhz,cdcl3):δ-0.01-0.07(6h,m),0.86-0.90(9h,m),3.15-3.21(2h,m),3.41-3.48(3h,m),3.72(1h,dd,j=10.0,6.4hz),3.79(6h,s),3.84(1h,dd,j=10.0,4.8hz),6.79-6.84(4h,m),7.18-7.23(1h,m),7.27-7.33(6h,m),7.40-7.44(2h,m),7.72-7.75(1h,brm).参考例25使用表y-2中记载的化合物re23-6~re23-12,利用与参考例24同样的方法,得到表z-1中记载的化合物re25-1~re25-7。通过本实施例合成的化合物的质谱分析结果示于表z-2。[表14]表z-1[表15]表z-2参考例25化合物esi-msm/zre25-1605(m+h)+re25-2619(m+h)+re25-3303(m+h)+,以脱dmtr体形式检测re25-4649(m+hcoo)-re25-5577(m-h)-re25-6623(m+hcoo)-re25-7317(m+h)+,以脱dmtr体形式检测参考例26[化学式146]参考例26工序1将化合物re26-1(2.00g,9.47mmol)溶解于n,n’-二甲基甲酰胺(40ml)中,于室温加入亚氨基二乙酸二叔丁基酯(5.11g,20.84mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(4.00g,20.84mmol)、1-羟基苯并三唑一水合物(145mg,0.947mmol),搅拌2小时。向反应液中加入水,用乙酸乙酯进行萃取后,用饱和碳酸氢钠水溶液和饱和食盐水洗涤有机层,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=50/50)对残余物进行纯化。进而用甲醇进行浆料纯化,得到化合物re26-2(4.07g,收率65%)。esi-msm/z:664(m-h)-参考例26工序2将化合物re26-2(2.66g,4.00mmol)溶解于四氢呋喃(53ml)中,于室温加入10%钯碳粉末(含水品,54.29%;490mg),在氢气氛下搅拌3小时。将反应液过滤,在减压下将溶剂蒸馏除去,由此得到化合物re26-3(2.86g,收率113%)。esi-msm/z:634(m-h)-参考例26工序3将化合物re26-3(871.0mg,1.370mmol)溶解于n,n’-二甲基甲酰胺(17ml)中,加入o-(7-氮杂苯并三唑-1-基)-n,n,n’,n’-四甲基脲六氟磷酸盐(625.0mg,1.644mmol)、二异丙基乙基胺(0.5730ml,3.290mmol)、及十二烷二酸单苄酯(527.0mg,1.644mmol),于室温搅拌一整夜。向反应液中加入水,用乙酸乙酯进行萃取后,用饱和碳酸氢钠水溶液及饱和食盐水对有机层进行洗涤,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=60/40)对残余物进行纯化,由此得到化合物re26-4(1.030g,收率80%)。esi-msm/z:939(m+h)+参考例26工序4将化合物re26-4(1.030g,1.098mmol)溶解于二氯甲烷(10ml)中,加入三氟乙酸(10.00ml,130.0mmol),于室温搅拌1小时。在减压下将溶剂蒸馏除去,得到化合物re26-5的粗产物。esi-msm/z:713(m-h)-参考例27[化学式147]参考例27工序1将化合物re27-1(2.000g,12.98mmol)溶解于n,n’-二甲基甲酰胺(30ml)中,加入碳酸氢钾(1.559g,15.57mmol)及苄基氯(2.328ml,19.47mmol),于室温搅拌4小时。向反应液中加入饱和氯化铵水溶液,用二氯甲烷进行萃取,然后用水洗涤有机层,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=50/50)对残余物进行纯化,由此得到化合物re27-2(2.850g,收率90%)。esi-msm/z:243(m-h)-参考例27工序2将化合物re27-2(2.500g,10.24mmol)溶解于n,n’-二甲基甲酰胺(30ml)中,加入碳酸钾(5.660g,40.90mmol)及溴乙酸叔丁酯(3.300ml,22.52mmol),于90℃搅拌4小时。向反应液中加入饱和氯化铵水溶液,用二氯甲烷萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=75/25)对残余物进行纯化,由此得到化合物re27-3(4.300g,收率89%)。esi-msm/z:472(m-h)-参考例27工序3将化合物re27-3(1.000g,2.116mmol)溶解于二氯甲烷(10ml)中,加入三氟乙酸(10.00ml,130.0mmol),于室温搅拌6小时。在减压下将溶剂蒸馏除去,得到化合物re27-4的粗产物。esi-msm/z:359(m-h)-参考例27工序4将化合物re27-4(350.0mg,0.9710mmol)溶解于n,n’-二甲基甲酰胺(7ml)中,加入1-羟基苯并三唑一水合物(327.0mg,2.137mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(410.0mg,2.137mmol)、及亚氨基二乙酸二叔丁酯(524.0mg,2.137mmol),于室温搅拌5小时。向反应液中加入水,用乙酸乙酯进行萃取后,用饱和碳酸氢钠水溶液及饱和食盐水对有机层进行洗涤,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=60/40)对残余物进行纯化,得到化合物re27-5(617.0mg,收率78%)。esi-msm/z:814(m-h)-参考例27工序5将化合物re27-5(610.0mg,0.7490mmol)溶解于二氯甲烷(6ml)中,加入三氟乙酸(6ml,78.00mmol),于室温搅拌1小时。在减压下将溶剂蒸馏除去,得到化合物re27-6的粗产物。esi-msm/z:590(m+h)+参考例28[化学式148]参考例28工序1将利用参考例26中记载的方法合成的化合物re28-1(参考例26中的化合物re26-3,474mg,0.744mmol)溶解于n,n’-二甲基甲酰胺(10ml)中,于室温加入利用药物化学杂志(journalofmedicinalchemistry),第54卷,2433-2446页,2011年中记载的方法合成的反式环己烷-1,4-二甲酸单苄酯(0.234mg,0.893mmol)、二异丙基乙基胺(0.312ml,1.79mmol)、o-(7-氮杂苯并三唑-1-基)-n,n,n’,n’-四甲基脲六氟磷酸盐(339mg,0.893mmol),并搅拌6小时。向反应液中加入水,用乙酸乙酯进行萃取后,用饱和碳酸氢钠水溶液和饱和食盐水洗涤有机层,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=50/50)对残余物进行纯化,由此得到化合物re28-2(448mg,收率68%)。esi-msm/z:879(m-h)-参考例28工序2将化合物re28-2(341mg,0.387mmol)溶解于二氯甲烷(3.4ml)中,于室温加入三氟乙酸(3.4ml),搅拌一整夜。将反应液减压浓缩,用乙酸乙酯进行共沸,用庚烷进行浆料纯化,由此得到化合物re28-3(254mg,收率100%)。esi-msm/z:656(m+h)+参考例29[化学式149]参考例29工序1将化合物re29-1(500mg,2.75mmol)溶解于n,n’-二甲基甲酰胺(10ml)中,于室温加入亚氨基二乙酸二叔丁酯(1.48g,6.04mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(1.16g,6.04mmol)、1-羟基苯并三唑一水合物(42.0mg,0.275mmol),并搅拌4小时。向反应液中加入水,用乙酸乙酯进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=50/50)对残余物进行纯化,由此得到化合物re29-2(329mg,收率19%)。esi-msm/z:635(m-h)-参考例29工序2将化合物re29-2(323mg,0.507mmol)溶解于n,n’-二甲基甲酰胺(6.5ml)中,于室温加入碳酸钾(84.0mg,0.609mmol)、溴乙酸苄酯(139mg,0.609mmol),并搅拌3小时。向反应液中加入水,用乙酸乙酯进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=50/50)对残余物纯化,由此得到化合物re29-3(313mg,收率79%)。esi-msm/z:783(m-h)-参考例29工序3将化合物re29-3(312mg,0.398mmol)溶解于二氯甲烷(3.1ml)中,于室温加入三氟乙酸(3.1ml)并搅拌一整夜。将反应液减压浓缩,用乙酸乙酯进行共沸,由此得到化合物re29-4(252mg,定量)。esi-msm/z:561(m+h)+参考例30[化学式150]参考例30工序1将化合物re30-1(2.00g,9.47mmol)溶解于n,n’-二甲基甲酰胺(40ml)中,于室温加入2-氨基-1,3-丙二醇(1.90g,20.84mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(4.00g,20.84mmol)、1-羟基苯并三唑一水合物(145mg,0.947mmol),并搅拌2小时。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(乙酸乙酯/甲醇=70/30)对残余物进行纯化。进而用乙酸乙酯进行浆料纯化,由此得到化合物re30-2(2.68g,收率79%)。esi-msm/z:356(m-h)-参考例30工序2将化合物re30-2(500mg,1.40mmol)悬浮于乙腈(10ml)中,于室温加入丙烯酸叔丁酯(3.59g,28.0mmol)、苄基三甲基氢氧化铵(40%水溶液;1.76ml,702mmol),并搅拌一整夜。在减压下将溶剂蒸馏除去,加入水,并用乙酸乙酯进行萃取,然后用饱和食盐水对有机层进行洗涤,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=50/50)对残余物进行纯化,由此得到化合物re30-3(300mg,收率24%)。esi-msm/z:871(m+h)+参考例30工序3将化合物re30-3(340mg,0391mmol)溶解于四氢呋喃(6.8ml)中,于室温加入10%钯碳粉末(含水品,54.29%;31.3mg),在氢气氛下搅拌6小时。将反应液过滤,在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=30/70)对残余物进行纯化,由此得到化合物re30-4(235mg,收率72%)。esi-msm/z:841(m+h)+参考例30工序4将化合物re30-4(232mg,0.276mmol)溶解于n,n’-二甲基甲酰胺(4.6ml)中,于室温加入十二烷酸单苄酯(0.133mg,0.414mmol)、二异丙基乙基胺(0.145ml,0.829mmol)、o-(7-氮杂苯并三唑-1-基)-n,n,n’,n’-四甲基脲六氟磷酸盐(158mg,0.414mmol),并搅拌一整夜。向反应液中加入水,用乙酸乙酯进行萃取后,用饱和碳酸氢钠水溶液和饱和食盐水洗涤有机层,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(庚烷/乙酸乙酯=30/70)对残余物进行纯化,由此得到化合物re30-5(274mg,收率87%)。esi-msm/z:1141(m-h)-参考例30工序5将化合物re30-5(273mg,0.239mmol)溶解于二氯甲烷(2.7ml)中,于室温加入三氟乙酸(2.7ml),并搅拌一整夜。将反应液减压浓缩,用乙酸乙酯进行共沸,由此得到化合物re30-6(231mg,定量)。esi-msm/z:919(m+h)+参考例31[化学式151]参考例31工序1将4-硝基间苯二甲酸re31-1(500mg,2.37mmol)及n-boc-乙二胺(808mg,5.21mmol)溶解于n,n’-二甲基甲酰胺(10ml)中,于室温加入三乙胺(0.90ml,7.11mmol)、1-羟基苯并三唑一水合物(703mg,5.21mmol)及1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(1.36g,7.11mmol),并搅拌16小时。对反应液进行后处理,用硅胶柱色谱法对粗品进行纯化,由此得到化合物re31-2(650mg,收率55%)。参考例31工序2将化合物re31-2(500mg,1.01mmol)及锌粉末(330mg,5.05mmol)悬浮于甲醇(3.5ml)及四氢呋喃(3.5ml)中,于0℃滴加氯化铵(378mg,7.07mmol)的水溶液,于室温搅拌24小时。对反应液进行后处理,用硅胶柱色谱法对粗品进行纯化,由此得到化合物re31-3(160mg,收率34%)。参考例31工序3将化合物re31-3(200mg,0.430mmol)及n-苄氧基羰基-甘氨酸(苄氧基羰基也记为cbz。)溶解于n,n’-二甲基甲酰胺(2.0ml)中,于室温加入二异丙基乙基胺(0.220ml,1.29mmol)、o-(7-氮杂苯并三唑-1-基)-n,n,n’,n’-四甲基脲六氟磷酸盐(245mg,0.645mmol),并搅拌16小时。对反应液进行后处理,用硅胶柱色谱法对粗品进行纯化,由此得到化合物re31-4(180mg,收率64%)。esi-msm/z:657(m+h)+参考例32[化学式152]参考例32工序1将3,5-二硝基苯甲酸re32-1(500mg,2.36mmol)及n-cbz-乙二胺(588mg,2.83mmol)溶解于n,n’-二甲基甲酰胺(5.0ml)中,于室温加入三乙胺(0.65ml,4.72mmol)、1-羟基苯并三唑一水合物(380mg,2.83mmol)及1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(675mg,3.54mmol),并搅拌16小时。对反应液进行后处理,用硅胶柱色谱法对粗品进行纯化,由此得到化合物re32-2(445mg,收率48%)。参考例32工序2将化合物re32-2(200mg,0.515mmol)溶解于乙醇(5.0ml)中,于室温加入氯化锡(ii)(584mg,3.09mmol)及浓盐酸(0.2ml),于80℃搅拌16小时。对反应液进行后处理,得到化合物re32-3(180mg,定量)。esi-msm/z:329(m+h)+参考例33[化学式153]参考例33工序1使用利用参考例3中记载的方法合成的化合物re33-1(参考例3中的化合物re3-2,8.17g,23.12mmol),利用与参考例3的工序4同样的方法,得到化合物re33-2(3.7g,收率63%)。esi-msm/z:254(m+h)+参考例33工序2使用化合物re33-2(3.7g,14.63mmol),利用与参考例3的工序5同样的方法,得到化合物re33-3(3.82g,收率67%)。esi-msm/z:432(m+hcoo)-参考例33工序3使用化合物re33-3(3.82g,9.86mmol),利用与参考例1的工序2同样的方法,得到化合物re33-4(3.08g,收率87%)。esi-msm/z:360(m+h)+参考例34[化学式154]参考例34工序1使用化合物re34-1(2g,9.53mmol)和(叔丁氧羰基氨基)-1-戊醇(东京化成公司制,2g,10mmol),利用与参考例3的工序1同样的方法,得到化合物re34-2(2.40g,收率63%)。esi-msm/z:296(m+h)+,以脱boc体形式检测参考例34工序2使用化合物re34-2,利用与参考例3的工序2~4及参考例4的工序1~4同样的方法,得到化合物re34-3(1.579g,收率21%)。esi-msm/z:910(m+h)+参考例35:化合物d2的合成[化学式155]参考例35工序1将利用参考例11中记载的方法合成的化合物re35-1(参考例11中的化合物re11-2,1.015g,1.748mmol)溶解于n,n’-二甲基甲酰胺(12ml)中,于室温加入10%钯碳粉末(含水品,54.29%;187mg),在氢气氛下搅拌6小时。将反应液过滤。向滤液中加入参考例26中合成的化合物re26-5(250.0mg,0.350mmol)、1-羟基苯并三唑一水合物(26.80mg,0.1750mmol)、及1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(402.0mg,2.099mmol),于室温搅拌一整夜。向反应液中加入水,用乙酸乙酯进行萃取后,用饱和碳酸氢钠水溶液及饱和食盐水对有机层进行洗涤,用无水硫酸钠进行干燥。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇=87/13)对残余物进行纯化,由此得到化合物re35-2(617.0mg,收率88%)。esi-msm/z:1215(m+2h)2+参考例35工序2将化合物re35-2(0.7380g,0.3040mmol)溶解于四氢呋喃(7ml)中,于室温加入10%钯碳粉末(含水品,54.29%;135.90mg),在氢气氛下搅拌一整夜。将反应液过滤,在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇=87/13)对残余物进行纯化,由此得到化合物d2(581mg,收率82%)。esi-msm/z:1170(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):1.12-2.36(106h,m),2.91-3.19(8h,m),3.23-3.55(14h,m),3.60-3.76(4h,m),3.78-3.94(8h,m),3.95-4.10(16h,m),4.47(4h,d,j=8.8hz),4.92-5.01(4h,m),5.17-5.24(4h,m),6.98(1h,s),7.64(2h,s),7.81-7.95(4h,m),8.28-8.38(2h,m),8.44-8.56(2h,m),10.13(1h,s)参考例36:化合物d3的合成[化学式156]参考例36工序1将利用参考例12中记载的方法合成的化合物re36-1(参考例12中的化合物re12-2,500mg,0.879mmol)溶解于n,n’-二甲基甲酰胺(6.5ml)中,于室温加入10%钯碳粉末(含水品,54.29%;94mg),在氢气氛下搅拌4小时。将反应液过滤。向滤液中加入参考例26中的化合物re26-5(126.0mg,0.176mmol)、1-羟基苯并三唑一水合物(13.47mg,0.088mmol)、及1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(202.0mg,1.055mmol),于室温搅拌一整夜。在减压下将反应液中的溶剂蒸馏除去,用反相柱色谱法(水/乙腈)对残余物进行纯化,由此得到化合物re36-2(249.7mg,收率60%)。esi-msm/z:1191(m+2h)2+参考例36工序2将化合物re36-2(0.242g,0.102mmol)溶解于四氢呋喃(3.6ml)及水(1.2ml)中,于室温加入10%钯碳粉末(含水品,54.29%;45mg),在氢气氛下搅拌4小时。将反应液过滤,在减压下将溶剂蒸馏除去,得到化合物d3(216mg,收率93%)。esi-msm/z:1146(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):1.15-1.65(20h,m),1.68-2.15(52h,m),3.13-3.29(6h,m),3.40-3.67(16h,m),3.71-3.96(11h,m),3.98-4.14(16h,m),4.55(4h,t,j=8.8hz),4.93-5.06(4h,m),5.12-5.28(4h,m),6.56(1h,s),6.98(1h.s),7.64(2h,s),7.77-7.93(4h,m),8.26-8.49(3h,m),10.10(1h,s)参考例37:化合物d4的合成[化学式157]参考例37工序1将利用参考例13中记载的方法合成的化合物re37-1(参考例13中的化合物re13-2,430mg,0.674mmol)溶解于n,n’-二甲基甲酰胺(6ml)中,于室温加入10%钯碳粉末(含水品,54.29%;79mg),在氢气氛下搅拌4小时。将反应液过滤。向滤液中加入参考例26中的化合物re26-5(105.0mg,0.148mmol)、1-羟基苯并三唑一水合物(11.31mg,0.074mmol)、及1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(170.0.0mg,0.887mmol),于室温搅拌一整夜。在减压下将反应液中的溶剂蒸馏除去,用反相柱色谱法(水/乙腈)对残余物进行纯化,由此得到化合物re37-2(218.1mg,收率56%)。esi-msm/z:1329(m+2h)2+参考例37工序2将化合物re37-2(0.210g,0.079mmol)溶解于四氢呋喃(3.1ml)及水(1.0ml)中,于室温加入10%钯碳粉末(含水品,54.29%;39mg),在氢气氛下搅拌4小时。将反应液过滤,在减压下将溶剂蒸馏除去,得到化合物d4(192.7mg,收率95%)。esi-msm/z:1284(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):1.17-1.65(42h,m),1.69-2.13(61h,m),2.95-3.17(16h,m),3.65-3.77(3h,m),3.79-3.94(6h,m),3.96-4.10(16h,m),4.48(4h,d,j=8.4hz),4.96(4h,dd,j=2.4,11.2hz),5.21(4h,d,j=3.2hz),7.01(1h,s),7.64-7.92(11h,m),8.26-8.48(4h,m),10.14(1h,s)参考例38:化合物d5的合成[化学式158]参考例38工序1将利用参考例12中记载的方法合成的化合物re38-1(参考例12中的化合物re12-2,450mg,0.791mmol)溶解于n,n’-二甲基甲酰胺(6ml)中,于室温加入10%钯碳粉末(含水品,54.29%;85mg),在氢气氛下搅拌5小时。将反应液过滤。向滤液中加入参考例27中的化合物re27-6(94mg,0.158mmol)、1-羟基苯并三唑一水合物(133.0mg,0.871mmol)、及1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(182.0mg,0.950mmol),于室温搅拌一整夜。在减压下将反应液中的溶剂蒸馏除去,用反相柱色谱法(水/乙腈)对残余物进行纯化,由此得到化合物re38-2(99mg,收率28%)。esi-msm/z:1129(m+2h)2+参考例38工序2将化合物re38-2(80mg,0.035mmol)溶解于四氢呋喃(1.7ml)及水(0.85ml)中,于室温加入10%钯碳粉末(含水品,54.29%;26mg),在氢气氛下搅拌2小时。将反应液过滤,在减压下将溶剂蒸馏除去,得到化合物d5(57.5mg,收率75%)。esi-msm/z:1084(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):1.69-2.21(46h,m),3.14-3.65(28h,m),3.67-4.22(27h,m),4.43-4.66(4h,m),4.69-4.88(4h,m),4.89-5.08(4h,m),5.12-5.32(4h,m),6.54-6.68(1h,br),7.01(2h,s),7.78-8.09(3h,m),8.13-8.31(2h,m),8.58-8.75(2h,m)参考例39:化合物d6的合成[化学式159]参考例39工序1将利用参考例13中记载的方法合成的化合物re39-1(参考例13中的化合物re13-2,418mg,0.655mmol)溶解于n,n’-二甲基甲酰胺(6ml)中,于室温加入10%钯碳粉末(含水品,54.29%;77mg),在氢气氛下搅拌5小时。将反应液过滤。向滤液中加入参考例27中合成的化合物re27-6(85mg,0.144mmol)、1-羟基苯并三唑一水合物(121.0mg,0.791mmol)、及1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(165.0mg,0.863mmol),于室温搅拌一整夜。在减压下将反应液中的溶剂蒸馏除去,用反相柱色谱法(水/乙腈)对残余物进行纯化,由此得到化合物re39-2(99mg,收率28%)。esi-msm/z:1268(m+2h)2+参考例39工序2化合物re39-2(186mg,0.073mmol)溶解于四氢呋喃2.8ml)及水(0.93ml)中,于室温加入10%钯碳粉末(含水品,54.29%;40mg),在氢气氛下搅拌2小时。将反应液过滤,在减压下将溶剂蒸馏除去,得到化合物d6(156.7mg,收率87%)。esi-msm/z:1222(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):1.36-1.62(27h,m),1.67-2.17(64h,m),2.92-3.21(15h,m),3.58-3.77(2h,m),3.80-3.95(7h,m),3.97-4.13(15h,m),4.47(4h,d,j=8.8hz),4.88-5.02(7h,m),5.10-5.24(3h,m),6.95-7.00(1h,m),7.26-7.31(2h,m),7.72-7.88(8h,m),8.10-8.20(2h,m),8.51-8.60(2h,m)参考例40[化学式160]参考例40工序1将利用参考例38中记载的方法合成的化合物d5(171mg,0.079mmol)溶解于n,n’-二甲基甲酰胺(3.4ml)中,加入甘氨酸苄酯对甲苯磺酸盐(32.0mg,0.095mmol)、1-羟基苯并三唑一水合物(12.09mg,0.079mmol)、及1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(18.16mg,0.095mmol),于室温搅拌一整夜。在减压下将反应液中的溶剂蒸馏除去,用反相柱色谱法(水/乙腈)对残余物进行纯化,由此得到化合物re40-2(55.7mg,收率31%)。esi-msm/z:1158(m+2h)2+参考例40工序2将化合物re40-2(54mg,0.023mmol)溶解于四氢呋喃(0.83ml)及水(0.28ml)中,于室温加入10%钯碳粉末(含水品,54.29%;18mg),在氢气氛下搅拌2小时。将反应液过滤,在减压下将溶剂蒸馏除去,得到化合物re40-3(50.1mg,收率97%)。esi-msm/z:1112(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):0.96-1.06(3h,m),1.71-2.20(54h,m),3.41-3.64(15h,m),3.68-4.20(32h),4.55(4h,d,j=8.4hz),4.81(4h,s),4.94-5.02(4h,m),5.17-5.25(4h,m),6.63-6.76(2h,m),6.93-7.02(2h,m),7.84-8.00(3h,m),8.17-8.30(2h,m),8.58-8.70(2h,m)参考例41:化合物d7的合成[化学式161]参考例41工序1将化合物re41-1(500mg,0.861mmol)溶解于n,n’-二甲基甲酰胺(10ml)中,于室温加入10%钯碳粉末(含水品,54.29%;92.1mg),在氢气氛下搅拌2小时。在氩气氛下,于室温加入参考例27中合成的化合物re27-3(113mg,0.172mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(198mg,1.03mmol)、1-羟基苯并三唑一水合物(13.2mg,0.086mmol),并搅拌一整夜。用硅藻土将反应液过滤,在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇=90/10)对残余物进行纯化,进而用反相制备hplc(乙腈/水)进行纯化,由此得到化合物re41-2(195mg,收率48%)。esi-msm/z:1186(m+2h)2+参考例41工序2将化合物re41-2(194mg,0.082mmol)溶解于四氢呋喃(2.9mg)及水(1.0ml)中,于室温加入10%钯碳粉末(含水品,54.29%;35.7mg),在氢气氛下搅拌8小时。将反应液过滤,在减压下将溶剂蒸馏除去,得到化合物d7(183mg,收率98%)。esi-msm/z:1141(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):1.21-1.45(m,40h),1.76-2.18(m,50h),3.00-3.09(m,8h),3.40-4.20(m,32h),4.47(d,j=8.5hz,4h),4.96(dd,j=3.1,11.2hz,4h),5.21(d,j=3.1hz,4h),6.98(s,1h),7.65(s,2h),7.84(d,j=9.0hz,4h),8.31(brs,1h),8.44(brs,1h),10.11(s,1h).参考例42:化合物d8的合成[化学式162]参考例42工序1将利用参考例11中记载的方法合成的化合物re42-1(参考例11中的化合物re11-2,500mg,0.861mmol)溶解于n,n’-二甲基甲酰胺(10ml)中,于室温加入10%钯碳粉末(含水品,54.29%;92.1mg),在氢气氛下搅拌2小时。在氩气氛下,于室温加入参考例29中合成的化合物re29-4(97.0mg,0.172mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(198mg,1.03mmol)、1-羟基苯并三唑一水合物(13.2mg,0.086mmol),并搅拌一整夜。用硅藻土将反应液过滤,在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇=85/15)对残余物进行纯化,进而用反相制备hplc(乙腈/水)进行纯化,由此得到化合物re42-2(179mg,收率46%)。esi-msm/z:1138(m+2h)2+参考例42工序2将化合物re42-2(175mg,0.077mmol)溶解于四氢呋喃(2.6mg)及水(0.9ml)中,于室温加入10%钯碳粉末(含水品,54.29%;32.4mg),在氢气氛下搅拌1小时。将反应液过滤,在减压下将溶剂蒸馏除去,得到化合物d8(160mg,收率95%)。esi-msm/z:1093(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):1.23-1.45(m,32h),1.77(s,12h),1.89(s,12h),1.99(s,12h),2.10(s,12h),3.01-3.11(m,8h),3.69-4.02(m,34h),4.47-4.50(m,4h),4.94-4.98(m,4h),5.21(d,j=3.1hz,4h),6.92(s,1h),6.94(s,2h),7.87(d,j=9.4hz,2h),7.92(d,j=8.5hz,2h),8.33(brs,2h),8.50(brs,2h).参考例43:化合物d9的合成[化学式163]参考例43工序1将利用参考例13中记载的方法合成的化合物re43-1(参考例13中的化合物re13-2,500mg,0.784mmol)溶解于n,n’-二甲基甲酰胺(10ml)中,于室温加入10%钯碳粉末(含水品,54.29%;92.1mg),在氢气氛下搅拌2小时。在氩气氛下,于室温加入参考例30中合成的化合物re30-6(144mg,0.157mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(180mg,0.941mmol)、1-羟基苯并三唑一水合物(12.0mg,0.078mmol),并搅拌一整夜。用硅藻土将反应液过滤,在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇=80/20)对残余物进行纯化,进而用反相制备hplc(乙腈/水)进行纯化,由此得到化合物re43-2(191mg,收率43%)。esi-msm/z:1431(m+2h)2+参考例43工序2将化合物re43-2(186mg,0.065mmol)溶解于四氢呋喃(2.8mg)及水(0.9ml)中,于室温加入10%钯碳粉末(含水品,54.29%;34.3mg),在氢气氛下搅拌1小时。将反应液过滤,在减压下将溶剂蒸馏除去,得到化合物d9(174mg,收率97%)。esi-msm/z:1386(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):1.25-4.02(m,164h),4.18-4.26(m,2h),4.47(d,j=8.1hz,4h),4.96(dd,j=3.1,11.2hz,4h),5.21(d,j=3.6hz,4h),7.74-7.91(m,13h),8.18(s,2h),8.36(d,j=7.2hz,2h),10.27(brs,1h).参考例44:化合物a2的合成[化学式164]参考例44工序1将利用参考例31中记载的方法合成的化合物re44-1(参考例31中的化合物re31-4,150mg,0.228mmol)溶解于二氯甲烷(1.5ml)中,于室温加入三氟乙酸(1.5ml)并搅拌4小时。将反应液减压浓缩,用乙酸乙酯进行共沸。将残余物溶解于n,n’-二甲基甲酰胺(3ml)中,于室温加入参考例14的化合物re14-3(574mg,0.571mmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(109mg,0.571mmol)、三乙胺(0.159ml,1.14mmol)、1-羟基苯并三唑一水合物(3.50mg,0.023mmol),并搅拌一整夜。将反应液减压浓缩,用硅胶柱色谱法(氯仿/甲醇=90/10)对残余物进行纯化,进而用反相制备hplc(乙腈/水)进行纯化,由此得到化合物re44-2(242mg,收率44%)。esi-msm/z:1216(m+2h)2+参考例44工序2将化合物re44-2(242mg,0.100mmol)溶解于四氢呋喃/水(4/1;12ml)中,于室温加入10%钯碳粉末(含水品,54.29%;44.6mg,在氢气氛下搅拌2小时。在氩气氛下,于室温加入6-马来酰亚胺己酸(23.2mg,0.110mmol)、氯化4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉(55.2mg,0.199mmol),并搅拌一整夜。用硅藻土将反应液过滤,在减压下将溶剂蒸馏除去,用hp20树脂(丙酮/水)对残余物进行纯化,由此得到化合物a2(97.4mg,收率39%)。esi-msm/z:1245(m+2h)2+1h-nmr(400mhz,dmso-d6,δ):1.14-2.16(100h,m),2.96-2.98(4h,m),3.24-3.41(18h,m),3.69-3.73(4h,m),3.83-3.91(6h,m),4.14-4.16(2h,m),4.47(4h,d,j=8.6hz),4.96(4h,dd,j=3.6,11.3hz),5.21(4h,d,j=3.2hz),7.01(2h,s),7.73-7.75(2h,m),7.83-7.94(7h,m),8.05-8.08(2h,m),8.14-8.20(3h,m),8.55-8.56(2h,m),10.24(1h,brs).参考例45:化合物a3的合成[化学式165]参考例45工序1将利用参考例32中记载的方法合成的化合物re45-1(参考例32中的化合物re32-3,75.0mg,0.228mmol)溶解于n,n’-二甲基甲酰胺(3.0ml)中,于室温加入参考例14的化合物re14-3(574mg,0.571mmol)、二异丙基乙基胺(0.199ml,1.14mmol)、o-(7-氮杂苯并三唑-1-基)-n,n,n’,n’-四甲基脲六氟磷酸盐(217mg,0.571mmol),并搅拌一整夜。在减压下将溶剂蒸馏除去,用硅胶柱色谱法(氯仿/甲醇=90/10)对残余物进行纯化,进而用反相制备hplc(乙腈/水)进行纯化,由此得到化合物re45-2(202mg,收率38%)。esi-msm/z:1152(m+2h)2+参考例45工序2将化合物re45-2(196mg,0.085mmol)溶解于四氢呋喃/水(4/1;10ml)中,于室温加入10%钯碳粉末(含水品,54.29%;36.1mg),在氢气氛下搅拌2小时。在氩气氛下,于室温加入6-马来酰亚胺己酸(19.8mg,0.094mmol)、氯化4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉(47.0mg,0.170mmol),并搅拌一整夜。用硅藻土将反应液过滤,在减压下将溶剂蒸馏除去,用hp20树脂(丙酮/水)对残余物进行纯化,由此得到化合物a3(42.4mg,收率21%)。esi-msm/z:1182(m+2h)2+参考例46:化合物d10[化学式166]使用利用参考例34中记载的方法合成的化合物re46-1(参考例34中的化合物re34-3),利用与参考例10工序1及2同样的方法,得到化合物d10(2.2g,收率58%)。esi-msm/z:2437(m+h)+参考例47:化合物a4的合成[化学式167]参考例47工序1使用利用参考例33中记载的方法合成的化合物re47-1(参考例33中的化合物re33-4,0.101g,0.282mmol),并使用参考例15的化合物re15-2(0.607g,0.613mmol),利用与参考例3工序3同样的方法得到化合物re47-2(0.25g,收率39%)。esi-msm/z:2304(m+h)+参考例47工序2使用化合物re47-2(0.255g,0.111mmol),利用与参考例3工序2同样的方法得到化合物re47-3(0.15g,收率63%)。esi-msm/z:2170(m+h)+参考例47工序3使用化合物re47-3(20.8mg,9.59μmol),利用与参考例5工序2同样的方法得到化合物a4(5.5mg,收率24%)。esi-msm/z:1182(m+2h)2+参考例48:化合物a5的合成[化学式168]参考例48工序1使用利用参考例33中记载的方法合成的化合物re48-1(参考例33中的化合物re33-4,0.099g,0.277mmol),并使用参考例16工序2中合成的化合物re16-3(0.618g,0.615mmol),利用与参考例3工序3同样的方法得到化合物re48-2(0.343g,收率53%)。esi-msm/z:2333(m+h)+参考例48工序2使用化合物re48-2,利用与参考例10工序1及2同样的方法,得到化合物a5(6.9mg,收率28%)。esi-msm/z:2392(m+h)+参考例49:化合物a6的合成[化学式169]使用化合物re49-1(0.048g,0.021mmol)和3-马来酰亚胺丙酸n-琥珀酰亚胺基酯(东京化成公司制,0.017g,0.064mmol),利用与参考例8的化合物a1的合成同样的方法,得到化合物a6(0.040g,收率78%)。esi-msm/z:2480(m+hcoo)-参考例50:化合物a7的合成[化学式170]工序131使用利用参考例10中记载的方法合成的化合物d1(23.6mg,9.46μmol)和n-(2-氨基乙基)马来酰亚胺三氟乙酸盐(sigma-aldrich公司制,7.21mg,0.028μmol),利用与参考例3工序3同样的方法,得到化合物a7(9.1mg,收率36%)。esi-msm/z:1310(m+2h)2+参考例51[化学式171]参考例51工序1使用利用参考例7中记载的方法合成的化合物re51-1(0.122g,0.054mmol)、和利用与生物偶联物化学(bioconjugatechemistry),第22卷,690-699页,2011年中记载的方法同样的方法合成的己酸单苄酯,利用与参考例4工序1同样的方法,得到化合物re51-2(0.076g,收率56%)。esi-msm/z:2503(m+h)+参考例51工序2使用化合物re51-2(0.076g,0.03mmol),利用与参考例3工序1同样的方法,得到化合物re51-3(0.030g,收率40%)。esi-msm/z:2412(m+h)+参考例52[化学式172]使用利用参考例6中记载的方法合成的化合物re52-1(参考例6中的化合物re6-5,4.36mg,0.006mmol)和参考例1的化合物re1-4(10mg,0.02mmol),利用与参考例3工序7同样的方法,得到化合物re52-2(7mg,收率65%)。esi-msm/z:1581(m-h)-参考例53:化合物c2的合成[化学式173]参考例53工序1使用利用参考例46中记载的方法合成的化合物d10(0.2011g,0.079mmol),利用与参考例10工序3同样的方法,得到化合物re53-1(0.129g,收率55%)。esi-msm/z:2972(m+hcoo)-参考例53工序2使用化合物re53-1(0.129g,0.044mmol),利用与参考例10工序4同样的方法,得到化合物re53-2的粗产物。esi-msm/z:1535(m+hcooh-2h)2-参考例53工序3使用化合物re53-2(0.0467g,0.013mmol),利用与参考例10工序5同样的方法,得到化合物c2(19.4μmol/g,收率35%)。参考例54:化合物c3的合成[化学式174]参考例54工序1使用利用参考例10中记载的方法合成的化合物d1(100mg,0.040mmol)及参考例17的化合物re17-2,利用与参考例10工序3同样的方法,得到化合物re54-1(90mg,收率76%)。esi-msm/z:1335(m-dmtr+2h)2+参考例54工序2使用化合物re54-1(90mg,0.030mmol),利用与参考例10工序4同样的方法,得到化合物re54-2的粗产物。esi-msm/z:1558(m+hcooh-2h)2-参考例54工序3使用化合物re54-2的粗产物,利用与参考例10工序5同样的方法,得到化合物c3(21.5μmol/g,两步收率32%)。参考例55:化合物c4的合成[化学式175]参考例55工序1使用利用参考例46中记载的方法合成的化合物d10(100mg,0.039mmol)及参考例17中合成的化合物re17-2,利用与参考例10工序3同样的方法,得到化合物re55-1(90mg,收率76%)。esi-msm/z:1356(m+2h)2+以脱dmtr体形式检测参考例55工序2使用化合物re55-1(90mg,0.030mmol),利用与参考例10工序4同样的方法,得到化合物re55-2的粗产物。esi-msm/z:1579(m+hcooh-2h)2-参考例55工序3使用化合物re55-2的粗产物,利用与参考例10工序5同样的方法,得到化合物c4(17.0μmol/g,两步收率26%)。参考例56:化合物c5的合成[化学式176]参考例56工序1使用利用参考例46中记载的方法合成的化合物d10(100mg,0.039mmol)及参考例18的工序2中合成的化合物re18-3,利用与参考例10工序3同样的方法,得到化合物re56-1(50mg,收率42%)。esi-msm/z:1363(m+2h)2+以脱dmtr体形式检测参考例56工序2使用化合物re56-1(50mg,0.017mmol),利用与参考例10工序4同样的方法,得到化合物re56-2的粗产物。esi-msm/z:1587(m+hcooh-2h)2-参考例56工序3使用化合物re56-2的粗产物,利用与参考例10工序5同样的方法,得到化合物c5(0.5μmol/g,两步收率1%)。参考例57:化合物c6的合成[化学式177]参考例57工序1使用利用参考例46中记载的方法合成的化合物d10(100mg,0.039mmol)及参考例19的化合物re19-2,利用与参考例10工序3同样的方法,得到化合物re57-1(40mg,收率30%)。esi-msm/z:1532(m+2h)2+以脱dmtr体形式检测参考例57工序2使用化合物re57-1(40mg,0.012mmol),利用与参考例10工序4同样的方法,得到化合物re57-2的粗产物。esi-msm/z:1582(m+2h)2+以脱dmtr体形式检测参考例57工序3使用化合物re57-2的粗产物,利用与参考例10工序5同样的方法,得到化合物c6(0.2μmol/g,两步收率1%)。参考例58:化合物c7的合成[化学式178]参考例58工序1使用利用参考例10中记载的方法合成的化合物d1(70mg,0.028mmol)及参考例21的化合物re21-3,利用与参考例10工序3同样的方法,得到化合物re58-1(58mg,收率77%)。esi-msm/z:1341(m+2h)2+参考例58工序2将化合物re58-1(58mg,0.022mmol)溶解于甲醇(0.15ml)中,加入利用有机化学杂志(journaloforganicchemistry),第74卷,6837-6842页,2009年中记载的方法合成的参考例17的化合物re17-1(16.9mg,0.032mmol)、1mol/ll-抗坏血酸钠水溶液(0.022ml,0.022mmol)、20mmol/l硫酸铜(ii)水溶液(0.011ml,0.22μmol)、及10mmol/l三(2-苯并咪唑基甲基)胺/dmso溶液(0.022ml,0.22μmol),于室温搅拌3小时。用硅胶柱色谱法(氯仿/甲醇=80/20)对反应液进行纯化,得到化合物re58-2(7mg,收率10%)。esi-msm/z:1450(m+2h)2+以脱dmtr体形式检测参考例58工序3使用化合物re58-2(10mg,3.13μmol),利用与参考例10工序4同样的方法,得到化合物re58-3的粗产物。esi-msm/z:1500(m+2h)2+以脱dmtr体形式检测参考例58工序4使用化合物re58-3的粗产物,利用与参考例10工序5同样的方法,得到化合物c7(8.4μmol/g,收率27%)。参考例59[化学式179]参考例59工序1使用利用参考例46中记载的方法合成的化合物d10(74.1mg,0.029mmol)和参考例22的化合物re22-2(15mg,0.027mmol),利用与参考例3工序3同样的方法、或生物偶联物化学(bioconjugatechemistry),第26卷,1451-1455页,2015年中记载的方法,得到化合物re59-1的粗产物。esi-msm/z:1392(m+h)+,以脱dmtr体形式检测参考例59工序2使用化合物re59-1(0.083g,0.027mmol),利用国际公开公报2015105083号中记载的方法,得到化合物re59-2的粗产物。esi-msm/z:2669(m+h)+,以脱dmtr体形式检测参考例59工序3使用化合物re59-2(0.08g,0.027mmol),利用与参考例10工序4同样的方法,得到化合物re59-3的粗产物。esi-msm/z:1556(m+hooh-2h)2-1h-nmr(400mhz,meod):δ1.45-1.86(48h,m),1.93(12h,s),1.94(12h,s),2.02(12h,s),2.13(12h,s),2.16-2.28(17h,m),2.48(4h,s),3.10-3.16(6h,m),3.36-3.56(19h,m),3.77(6h,s),3.80-3.89(6h,m),3.98-4.35(30h,m),4.53-4.59(4h,m),4.66-4.72(1h,m),5.04-5.10(4h,m),5.31-5.36(4h,m),6.81-6.88(4h,m),7.17-7.23(1h,m),7.26-7.32(6h,m),7.38-7.44(2h,m),7.54(2h,brs),7.90(1h,brs).参考例60使用化合物d1、及表z-1中记载的结构或参考例20的化合物re20-4,利用与参考例59工序1及工序2同样的方法,得到表p-1及表p-2中记载的化合物。通过本实施例合成的化合物的质谱分析结果示于表p-3。[表16]表p-1[表17]接表p-1[表18]表p-2[表19]表p-3参考例60化合物esi-msm/zre60-11537(m+hcooh-2h)2-re60-21584(m+hcooh-2h)2-re60-31577(m+hcooh-2h)2re60-41577(m+hcooh-2h)2-re60-51564(m+hcooh-2h)2-re60-61578(m+hcooh-2h)2-re60-71564(m+hcooh-2h)2-re60-81584(m+hcooh-2h)2-re60-91570(m+hcooh-2h)2参考例61:化合物c8的合成[化学式180]使用参考例59中记载的化合物re59-3,利用与参考例10工序5同样的方法,得到化合物c8(10.0μmol/g)。参考例62:c9~c17的合成使用表p-1及表p-2中记载的化合物,利用与参考例61同样的方法,得到表q-1及表q-2中记载的化合物。利用本实施例合成的化合物的负载量示于表q-3。[表20]表q-1[表21]接表q-1[表22]表q-2[表23]表q-3化合物负载量(μmo1/g)c92.6c1023.1c1122.2c1232.7c1330.5c1418.1c1520.4c1612.7c172.2实施例1:化合物1-1及1-2的合成[化学式181]工序1加入参考例化合物a1、和利用大分子(molecules)、第17卷、13825-13843页、2012年中记载的方法合成的末端经硫醇化的寡核苷酸,于室温静置4小时。向反应混合物中加入碳酸钠,于4℃静置一夜。利用阴离子交换色谱法(gehealthcare,monoq5/50gl,10μm,5.0mmx50mm,基于a液:10mmol/ltris缓冲液/30%乙腈、b液:10mmol/ltris缓冲液/30%乙腈/1mol/lnabr的梯度)或反相液相色谱法(waters,xbridgec18,5μm,4.6mmx250mm,基于0.1mol/l三乙基乙酸铵缓冲液、b液:乙腈的梯度)中的任一方法进行纯化,得到化合物1-1。有义链序列如表r-1~表r-2中记载的那样。工序2将工序1中合成的化合物1-1(3’-apcs-ssrna)利用混合缓冲液(100mmol/l乙酸钾、30mmol/l2-[4-(2-羟基乙基)哌嗪-1-基]乙磺酸、hepes)-koh(ph7.4)、2mmol/l乙酸镁)进行浓度调节(50μmol/l)。将前述有义链与反义链(50μmol/l)各自以相同的量进行混合,于80℃静置10分钟。反义链序列如表r-3~表r-4中记载的那样。缓缓降低温度,于37℃静置1小时,得到双链的化合物1-2。实施例2~10:化合物2-1~10-1及化合物2-2~10-2的合成使用与实施例1的碱基序列不同的寡核苷酸,与实施例1同样地操作,合成化合物2-1~10-1及化合物2-2~10-2。实施例11:化合物11-1及化合物11-2的合成[化学式182]工序1使用参考例化合物d5,加入利用大分子(molecules)、第17卷、13825-13843页、2012年中记载的方法合成的末端经氨基修饰的寡核苷酸,利用生物偶联物化学(bioconjugatechemistry),第22卷,1723-1728页,2011年或生物偶联物化学(bioconjugatechemistry),第26卷,1451-1455页,2015年中记载的方法使其反应。利用实施例1中记载的方法进行纯化,由此得到化合物11-1。工序2利用与实施例1的工序2同样的方法,得到化合物11-2。实施例12~43:化合物12-1~43-1及化合物12-2~43-2的合成使用与实施例11的碱基序列不同的寡核苷酸,与实施例11同样地操作,合成化合物12-1~43-1及化合物12-2~43-2。利用本实施例合成的化合物的配体-接头结构如下所示。[化学式183]利用本实施例合成的核酸复合物的序列(有义链)及质谱分析结果示于表r-1~表r-2。需要说明的是,表r-1~表r-2中,n(m)表示2’-o-甲基修饰rna,n(f)表示2’-氟修饰rna,p表示5’末端处的磷酸化,^表示硫代磷酸酯,x表示参考例化合物a1的残基,y表示参考例化合物d5的残基。通过由序列号2069~2111所示的核糖核苷酸组成的有义链、和由序列号2112~2154所示的核糖核苷酸组成的反义链的双链核酸构成(序列号n(n=2069~2111)所示的有义链与序列号[n+43]所示的反义链配对)。[表24]表r-1[表25]表r-2利用本实施例合成的核酸复合物的序列示于表r-3~表r-4。需要说明的是,表r-3~表r-4中,n(m)表示2’-o-甲基修饰rna,n(f)表示2’-氟修饰rna,p表示5’末端处的磷酸化,^表示硫代磷酸酯。[表26]表r-3[表27]表r-4参考试验例1:sirna的人细胞中的apcsmrna的敲低活性的测定关于双链核酸,由sigma-aldrich公司合成表1-1~表1~13中记载的双链核酸并进行利用。具体而言,由使由序列号2~644所示的核糖核苷酸组成的有义链、由序列号645~1287所示的核糖核苷酸组成的反义链退火而得到的双链核酸构成(序列号n(n=2~644)所示的有义链与序列号[n+643]所示的反义链配对)。向384孔的培养板中添加将双链核酸和rnaimax转染试剂(thermofisherscientific公司制,目录编号13778150)使用opti-memireducedserummedium培养基(thermofisherscientific公司制,目录编号31985070)稀释而得的sirna/rnaimax混合液20μl。将作为来源于人卵巢癌的细胞株的rmg-i细胞(jcrb细胞库,jcrb0172)以成为10,000细胞/40μl/孔的方式接种于各384孔的培养板,在37℃、5%co2条件下培养24小时。培养基使用了含有10%胎牛血清(thermofisherscientific公司制,目录编号10091-148)的ham’sf-12nutrientmix培养基(thermofisherscientific公司制,目录编号11765-047)。使双链核酸的最终浓度成为1nm。然后,将细胞用dpbs,nocalcium,nomagnesium(thermofisherscientific公司制,目录编号14190-144)洗涤,从各板使用taqman(注册商标)fastcells-to-ct(商标)试剂盒(thermofisherscientific公司制,目录编号4399003)利用以下的方法合成cdna。将裂解液(试剂盒内容物)与dnasei(试剂盒内容物)以100:1混合而成的溶液各添加10μl,混合5分钟。各添加1μl终止液(试剂盒内容物),混合2分钟,制成rna提取液。将5μl的2×rtbuffer(试剂盒内容物)、0.5μl的20×rtenzymemix(试剂盒内容物)、2.5μl无核酸酶水、2μl的rna提取液混合,使其在37℃、60分钟、95℃、5分钟的条件下反应,合成cdna。将该cdna2μl加入microamp(注册商标)enduraplate(商标)optical384-wellclearreactionplateswithbarcode(thermofisherscientific公司制,目录编号4483285)中,然后添加5μl的taqman(注册商标)fastuniversalpcrmastermix(thermofisherscientific公司制,目录编号4352042)、2.5μl的蒸馏水(ultrapure)(thermofisherscientific公司制,目录编号10977015)、0.25μl的人apcs探针、0.25μl的人actb探针。使用quantstudio(商标)7flex,实施人apcs基因及人actb(actinbeta)基因的实时pcr。actb是组成型表达的基因,作为内部对照进行测定,对apcs基因表达量进行校正。将不添加sirna而只用转染试剂处理rmg-i细胞时的apcsmrna量作为1.0,计算导入了各sirna时的apcsmrna相对表达量值。实施2次本实验,将apcsmrna相对表达量值的最小值示于表1-1~表1-13。[表28]表1-1[表29]表1-2[表30]表1-3[表31]表1-4[表32]表1-5[表33]表1-6[表34]表1-7[表35]表1-8[表36]表1-9[表37]表1-10[表38]表1-11[表39]表1-12[表40]表1-13需要说明的是,apcs第二链cdna的全长的碱基序列示于表2。[表41]表2参考试验例2:修饰sirna的人细胞中的apcsmrna的敲低活性的测定1委托genedesign公司,合成由序列号1931~1974所示的核糖核苷酸组成的有义链核酸、由序列号1975~2018所示的核糖核苷酸组成的反义链核酸、及使它们退火而得到的双链核酸(序列号n(n=1931~1974)所示的有义链与序列号[n+44]所示的反义链配对)。以合成的双链核酸的最终浓度成为1nm、或0.1nm的方式,将该双链核酸导入rmg-1细胞,培养24小时,除此以外,实施与参考试验例1同样的操作,算出apcsmrna相对表达量。实施4次本实验,将apcsmrna相对表达量值的中值示于表m1-1~表m1-2。表m1-1~表m1-2中,n(m)表示2’-o-甲基-rna,n(f)表示2’-f-rna。[表42]表m1-1[表43]表m1-2参考试验例3修饰sirna的人细胞中的apcsmrna的敲低活性的测定2关于双链核酸,由genedesign,inc.合成表m1-3中所记载的双链核酸并进行利用。具体而言,由使由序列号2019~2043所示的核糖核苷酸组成的有义链、由序列号2044~2068所示的核糖核苷酸组成的反义链退火而得到的双链核酸构成(序列号n(n=2019~2043)所示的有义链与序列号[n+25]所示的反义链配对)。向96孔的培养板中添加将各双链核酸和rnaimax转染试剂(thermofisherscientific公司制,目录编号13778150)使用opti-memireducedserummedium培养基(thermofisherscientific公司制,目录编号31985070)稀释而得的sirna/rnaimax混合液20μl。将来源于人卵巢癌的细胞株即rmg-i细胞(jcrb细胞库,jcrb0172)以成为10,000细胞/60μl/孔的方式接种于各96孔的培养板,在37℃、5%co2条件下培养24小时。培养基使用了含有10%胎牛血清(thermofisherscientific公司制,目录编号10091-148)的ham’sf-12nutrientmix培养基(thermofisherscientific公司制,目录编号11765-047)。使双链核酸的最终浓度成为1或0.1nm。然后,将细胞用dpbs,nocalcium,nomagnesium(thermofisherscientific公司制,目录编号14190-144)洗涤,从各板使用superprepcelllysis&rtkitforqpcr(东洋纺公司制,目录编号scq-101),按照制品中附带的说明书所记载的方法,回收总rna,并通过以得到的总rna为模板的逆转录反应进行cdna的制作。将该cdna3μl添加至microampoptical384孔板(appliedbiosystems公司制,目录编号:4309849),然后添加10μl的taqmangeneexpressionmastermix(appliedbiosystems公司制,目录编号4369016)、6μl的ultrapuredistilledwater(thermofisherscientific公司制,目录编号:10977-015)、1μl的人apcs探针或者1μl的人gapdh(d-甘油醛-3-磷酸脱氢酶,d-glyceraldehyde-3-phosphatedehydrogenase)探针,使用quantstudio12kflex实时pcr系统(thermofisherscientific公司制),实施人apcs基因及人gapdh基因的实时pcr。gapdh是组成型表达的基因,作为内部对照进行测定,对apcs基因表达量进行校正。将不添加sirna而只用转染试剂处理rmg-i细胞时的apcsmrna量作为1.0,计算导入了各sirna时的apcsmrna相对表达量值。实施2次本实验,将apcsmrna相对表达量值的平均值示于表m1-3。需要说明的是,表m1-3中,n(m)表示2’-o-甲基修饰rna,n(f)表示2’-氟修饰rna。[表44]表m1-3试验例1核酸复合物的针对人原代肝细胞的apcsmrna的敲低试验针对实施例1~43中得到的各核酸复合物,测定人原代肝细胞中的体外敲低活性。以该核酸复合物的最终浓度成为300、30、3或0.3nmol/l的方式,将使用opti-mem(thermofisherscientific公司制,目录编号31985)稀释而得的各核酸复合物以各20μl分注至96孔的i型胶原蛋白包被培养板(康宁公司制,目录编号:356407)后,将悬浮于涂板培养基(platingmedium)(biopredicinternationalcompany制,目录编号:lv0304-2)中的人原代肝细胞(biopredicinternationalcompany制,目录编号hep187)以成为10,000细胞/80μl/孔的方式接种,在37℃、5%co2条件下培养6小时,然后谨慎地除去培养上清液,添加孵育培养基(incubationmedium)(biopredicinternationalcompany制,目录编号lv0304-2),将各核酸复合物供于人原代肝细胞。另外,作为阴性对照的组,使用了供给了20μl的opti-mem的人原代肝细胞。将添加了各核酸复合物的细胞在37℃的5%co2温箱内培养18小时,使用经冰冷却的磷酸缓冲生理盐水(dpbs)(nacalaitesque公司制,目录编号14249-95)进行洗涤,从各板使用superprepcelllysis&rtkitforqpcr(东洋纺公司制,目录编号scq-101),按照制品中附带的说明书所记载的方法,回收总rna,并通过以得到的总rna为模板的逆转录反应进行cdna的制作。将该cdna3μl添加至microampoptical384孔板(appliedbiosystems公司制,目录编号:4309849),然后添加10μl的taqmangeneexpressionmastermix(appliedbiosystems公司制,目录编号4369016)、6μl的ultrapuredistilledwater(thermofisherscientific公司制,目录编号:10977-015)、1μl的人apcs探针(appliedbiosystems公司制)或者1μl的人gapdh探针(appliedbiosystems公司制),使用quantstudio12kflex实时pcr系统(thermofisherscientific公司制),按照附带的使用说明书所记载的方法,实施人apcs基因及人gapdh基因的实时pcr。gapdh是组成型表达的基因,作为内部对照进行测定,对apcs表达量进行校正。将同样地测得的阴性对照中的apcs的mrna的准定量值作为1.0,计算导入了各核酸复合物时的apcsmrna相对表达量。实施2次本实验,将apcsmrna相对表达量值的平均值示于表s1。[表45]表s1:apcsmrna表达率化合物300nm30nm3nm0.3nm1-20.1270.2230.4510.8522-20.3090.4590.5960.9773-20.3660.5160.7660.9194-20.2540.3860.5960.8745-20.0750.0960.1410.4516-20.3770.4990.6690.8417-20.1870.3140.6520.9508-20.1800.2730.5090.8939-20.1450.2720.4560.88510-20.0870.1250.2580.68211-20.1300.2440.6760.98712-2ntntntnt13-2ntntntnt14-2ntntntnt15-20.0510.0560.2040.73116-2ntntntnt17-20.1220.2200.9200.96518-20.1840.3740.9930.98819-20.1440.2860.9891.21820-20.0640.1200.03950.92521-2ntntntnt22-2ntntntnt23-2ntntntnt24-2ntntntnt25-20.1770.3370.8741.02126-2ntntntnt27-2ntntntnt28-2ntntntnt29-2ntntntnt30-2ntntntnt31-2ntntntnt32-2ntntntnt33-20.0460.0820.3840.88034-2ntntntnt35-20.0510.0760.4420.98436-2ntntntnt37-2ntntntnt38-2ntntntnt39-2ntntntnt40-2ntntntnt41-2ntntntnt42-2ntntntnt43-2ntntntnt由表s1可见,各核酸复合物添加至人原代肝细胞后,抑制了apcs基因的mrna的表达。试验例2核酸复合物的小鼠中的体内敲低试验针对实施例1~43中得到的核酸复合物,利用以下的方法实施了体内敲低试验。需要说明的是,各核酸复合物根据试验利用磷酸缓冲生理盐水(dpbs)(nacalaitesque公司制)进行稀释而使用。小鼠使用移植了人肝细胞的pxb小鼠(pxb/humanhepatocyterepopulatedcdna-upa/scidtg,自phoenixbioco.,ltd.获得),对核酸复合物针对人apcs的效果进行了评价。将pxb小鼠驯化饲育后,将各核酸复合物皮下施予至小鼠。施予用量为10mg/kg,施予用量设为5ml/kg。作为对照组,仅将dpbs皮下施予至小鼠。在施予6天前及施予后1、2、3、6、10、13天进行采血,以1500×g离心分离,由此得到血清。将这些血清使用人sapelisa(sap,human,elisa试剂盒,hycultbiotech公司制,#hk331-02)来评价血中人apcs量。elisa按照附带的手册实施。各小鼠组的血中人apcs浓度的推移示于图1。相对于dpbs施予组而言的、核酸复合物施予组中的apcs表达比率(%)示于表s2。[表46]表s2:施予用量10mg/kg、施予后第13天的apcs蛋白表达率(相对于dpbs施予组)化合物表达率1-2nt2-2nt3-2nt4-2nt5-218.526-2nt7-2nt8-2nt9-2nt10-2nt11-2nt12-2nt13-2nt14-2nt15-2nt16-2nt17-2nt18-2nt19-2nt20-2nt21-2nt22-2nt23-2nt24-2nt25-2nt26-2nt27-2nt28-2nt29-2nt30-2nt31-2nt32-2nt33-231.3534-2nt35-231.3136-2nt37-2nt38-2nt39-2nt40-2nt41-2nt42-2nt43-2nt由表s2可见,将本发明的核酸复合物施予至表达人apcs的小鼠,使小鼠末梢血中的apcs蛋白表达降低。产业上的可利用性本发明的核酸复合物可用于施予至哺乳动物、并在生物体内治疗淀粉样蛋白相关疾病。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1