包含15-HEPE和/或15-HETrE的组合物以及治疗或预防心血管代谢疾病、代谢综合征和/或相关疾病的方法与流程
包含15
‑
hepe和/或15
‑
hetre的组合物以及治疗或预防心血管代谢疾病、代谢综合征和/或相关疾病的方法
1.优先权要求
2.本申请要求于2019年5月15日提交的美国临时申请号62/848,222的优先权,其全部内容在此引入作为参考。
技术领域
3.本申请大体上涉及包含15
‑
hepe和/或15
‑
hetre的组合物,并且涉及使用其的方法。
背景技术:
4.心血管代谢疾病,也称为代谢综合征,是一组病症,包括升高的血压,高血糖,受损的葡萄糖耐量,过量的体脂和异常的脂质水平,它们一起发生并增加心脏病、中风和糖尿病的风险。这些病症会导致心脏病的风险增大。
技术实现要素:
5.本申请涉及包含15
‑
hepe和/或15
‑
hetre的组合物以及使用此类组合物来治疗多种疾病和病症的方法。
6.在一些方面,本公开提供了对有需要的受试者治疗和/或预防代谢综合征的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或hetre的组合物。
7.在其它方面,本公开提供了对有需要的受试者治疗和/或预防心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
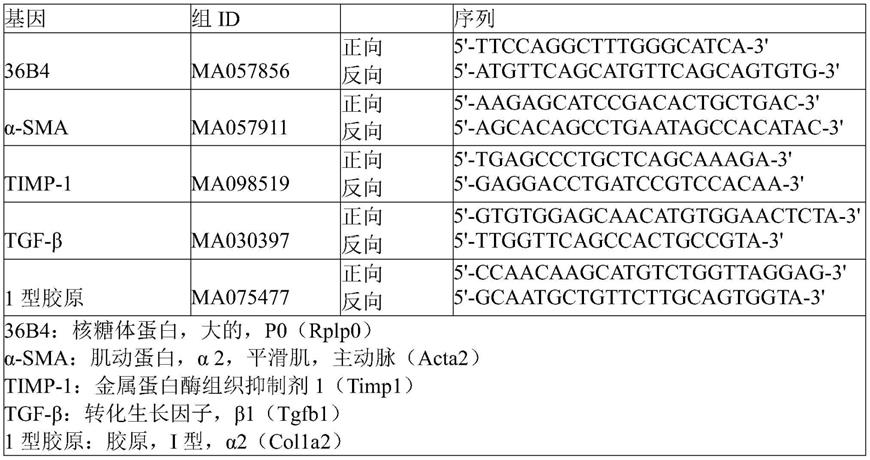
‑
hetre或包含15
‑
hepe和/或hetre的组合物。
8.在另一方面,本公开提供了对有需要的受试者治疗和/或预防代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述15
‑
hepe和/或15
‑
hetre占所述组合物中的所有脂肪酸的至少约90重量%。
9.在又一个方面,本公开提供了对有需要的受试者治疗和/或预防代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中的所有脂肪酸的至少约90重量%,并且其中所述受试者表现出以下各项中的一种或多种:甘油二酯、甘油磷脂、肝脂肪、血压、腰围,和/或游离脂肪酸水平的降低;和/或甘油磷脂水平的提高。
10.在一个方面,本公开提供了对受试者预防非酒精性脂肪肝炎(nash)的第一阶段进展至nash的第二阶段的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物。在一些实施例中,第一阶段是代谢过载、增加的肝脂肪含量和脂毒性、细胞应激凋亡、炎症和/或纤维发生性重塑。在另一个实施例中,第二阶段是增加的肝脂肪含量和脂毒性、细胞应激凋亡、炎症和/或纤维发生性重塑。
11.在另一方面,本公开提供在有需要的受试者中对患有非酒精性脂肪肝病症(nafld)、代谢综合征和/或心血管代谢疾病的受试者治疗和/或预防心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或hetre的组合物。
12.在又一方面,本公开提供在有需要的受试者中对患有非酒精性脂肪肝障碍(nafld)、代谢综合征或心血管代谢疾病的受试者治疗和/或预防心血管疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中的所有脂肪酸的至少约90重量%。
13.在一些实施例中,受试者表现出以下一项或多项的减少:α
‑
平滑肌作用(α
‑
sma)、金属肽酶抑制剂
‑
1(timp
‑
1)、转化生长因子β
‑
β(tgf
‑
β)和/或1型胶原水平。在另一个实施例中,受试者表现出甘油二酯、肝脂肪、血压、腰围和/或游离脂肪酸水平的降低和/或甘油磷脂水平的提高。在各种实施例中,受试者表现出碱性磷酸酶(alp)水平的降低。在另一个实施例中,受试者表现出血清丙氨酸转氨酶(alt),天冬氨酸转氨酶(ast)和/或胆红素(bun)水平的降低。在一个实施例中,受试者表现出纤维化面积的减少。在另一个实施例中,受试者表现出血红蛋白a1c(hba1c),胰岛素抗性的稳态模型评估(homa
‑
ir)和/或脂肪组织胰岛素抗性(脂肪组织
‑
ir)水平的降低。在另一个实施例中,受试者表现出极低密度脂蛋白胆固醇(vldl
‑
c)、非高密度脂蛋白胆固醇(非hdl
‑
c)和/或残粒样颗粒胆固醇(rlp
‑
c)和/或高密度脂蛋白胆固醇(hdl
‑
c)水平的降低。在另一个实施例中,受试者表现出肝硬度、纤维化
‑
4(fib
‑
4)、增强的肝纤维化(elf)分数和/或nafld分数的降低。在各种实施例中,受试者表现出选自由以下组成的组的发炎性和促纤维化蛋白质的减少:纤溶酶原激活剂抑制剂
‑
1(pai
‑
1)、金属肽酶抑制剂
‑
1(timp
‑
1)、二肽基肽酶4(dpp4)、trem样转录物2(tlt2)、趋化因子(c
‑
c基序)配体16(ccl16)、单核细胞趋化蛋白
‑
1(mcp
‑
1)、血清淀粉样蛋白a4(saa4)、磷酸肌醇3(pi3)、硫氧还蛋白还原酶(tr)、白细胞免疫球蛋白样受体b1(lilbr1)、胺氧化酶、含铜3(aoc3)、丝氨酸蛋白酶2(prss2)和肿瘤坏死因子配体超家族成员11a(tnrsf11a)。
14.在各种实施例中,nafld是非酒精性脂肪性肝炎(nash)。在一些实施例中,所述心血管代谢疾病或心血管疾病是以下各项中的一种或多种:血脂异常、高脂血症、高胆固醇血症、高甘油三酯血症、原发性高胆固醇血症、原发性高脂血症、常见原发性高脂血症、常见高胆固醇血症、家族性高脂血症、家族性原发性高脂血症、家族性高胆固醇血症、家族性高甘油三酯血症、家族性混合型高脂血症、家族性载脂蛋白b
‑
100缺陷、继发性高脂血症、混合型高脂血症、心血管疾病、残余心血管风险、预防动脉粥样硬化斑块形成/进展、微血管疾病、大血管疾病、动脉粥样硬化、冠状动脉粥样硬化、舒张功能障碍、降低心血管风险、主要冠状动脉事件的预防、主要不良心血管事件的预防、缺血性事件的预防、心血管事件的二级/一级预防、心血管死亡的预防、心肌梗塞、中风、心绞痛、正常内皮功能的恢复、糖尿病(diabetes)、糖尿病(diabetes mellitus)、胰岛素抗性、高胰岛素血症、高血糖症、血糖代谢障碍、血糖控制的诱导、葡萄糖耐量受损和空腹血糖受损。在一个实施例中,微血管疾病是视网膜病、肾病、神经病或其组合。在另一个实施例中,大血管疾病是中风、外周血管疾病、肢体缺血、心脏病或其组合。
15.在一些方面,本公开提供了一种治疗或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
16.在一些实施例中,胆汁淤积性肝病是原发性胆汁性胆管炎(pbc)、原发性硬化性胆
管炎(psc)、进行性家族性肝内胆汁淤积或其组合。在另一个实施例中,胆汁淤积性肝病由药物诱导的肝损伤、全胃肠外营养(tpn)、病毒性和酒精性肝炎、继发于全身性疾病的胆汁淤积、移植物功能障碍、肝移植后胆汁淤积、胰腺炎、胆总管结石、mirizzi综合征、遗传疾病、恶性肿瘤或其组合引起。在一些实施例中,恶性肿瘤是肝细胞癌、胆管肿瘤、胰腺癌或其组合。
17.在另一个实施例中,其中所述受试者表现出选自由以下组成的组的细胞因子和/或趋化因子的降低:α
‑
sma、timp
‑
1、tgf
‑
β和1型胶原水平。
18.在一个方面,本公开提供了一种治疗或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe和/或15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者具有肾病的至少一种风险因素。
19.在一个实施例中,肾病选自由以下组成的组:肾纤维化、肾小管间质纤维化、慢性肾病、严重间质纤维化、肾间质纤维化和终末期肾病。在另一个实施例中,肾病导致纤维化。在一些实施例中,肾病的至少一种风险因素选自由以下组成的组:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。
20.在另一个实施例中,受试者表现出肾羟脯氨酸水平的降低。在各种实施例中,受试者不表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平的提高或降低。在另一个实施例中,受试者表现出肝脏中促纤维化细胞因子的减少。在一些实施例中,α
‑
sma、timp
‑
1、tgf
‑
β、1型胶原、白介素1β(il
‑
1β)、白介素6(il
‑
6)、白介素6(il
‑
8)、白介素13(il
‑
13)、肿瘤坏死因子(tnf
‑
α)、tnf样配体1a(tl1a)、芳香烃受体(ahr)、白介素17(il
‑
17)、白介素23(il
‑
23)、白介素11(il
‑
11)和/或白介素33(il
‑
33)。
21.在一些实施例中,受试者表现出血管粘附分子和/或趋化因子和/或肿瘤坏死因子受体超家族成员的减少。
22.在一些实施例中,口服15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在各种实施例中,每天1至8个胶囊,服用组合物。
23.在另一个实施例中,15
‑
hepe和/或15
‑
hetre呈游离酸形式、酯化形式或盐形式。在又一个实施例中,酯化形式是烷基酯形式或甘油三酯形式。在一些实施例中,15
‑
hepe包含15(s)
‑
hepe、15(r)
‑
hepe或其组合和/或15
‑
hetre包含15(s)
‑
hetre、15(r)
‑
hetre或其组合。
24.在另一个实施例中,组合物包含约1g至约2g的15
‑
hepe和/或15
‑
hetre。在一个实施例中,组合物包含约2g或更多的15
‑
hepe和/或15
‑
hetre。在一些实施例中,组合物包含约10mg至约10,000mg的15
‑
hepe和/或15
‑
hetre。在又一个实施例中,组合物包含约5mg/kg、约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe和/或15
‑
hetre。在各种实施例中,15
‑
hepe和/或15
‑
hetre占组合物中存在的所有脂肪酸的至少约90重量%。
附图说明
25.图1是实例1中描述的研究及其持续时间的示意图。
26.图2示出根据实例1所述研究的动物体重变化。
27.图3示出了根据实例1所述研究处死动物当天的体重。
28.图4a至4d示出了根据实例1中描述的研究在处死当天动物的肾重和肾重/体重比。
29.图5示出了根据实例1所述研究的动物的肾羟脯氨酸含量。
30.图6a至6g示出了根据实例1所述研究的动物的天狼星红染色。
31.图7示出了描绘根据实例1所述研究的动物的天狼星红阳性面积(%)的图。
32.图8a至8d分别示出了根据实例1中描述的研究对动物的α
‑
sma、timp
‑
1、tgf
‑
β和1型胶原的基因表达分析。
33.图9是实例2中描述的研究及其持续时间的示意图。
34.图10示出根据实例2所述研究的动物体重变化。
35.图11示出了根据实例2所述研究处死动物当天的体重。
36.图12a和12b分别示出了根据实例2中描述的研究在处死当天动物的肝量和肝重/体重比。
37.图13示出了根据实例2所述研究的动物血清alt水平的变化。
38.图14示出了根据实例2所述研究的动物血清总胆红素水平的变化。
39.图15a至15e示出了根据实例2所述研究的动物的天狼星红染色和纤维化区域。
40.图16示出了描绘根据实例2所述研究的动物的天狼星红阳性面积(%)的图。
41.图17a
‑
17d分别示出了根据实例2中所述研究的动物的α
‑
sma、timp
‑
1、tgf
‑
β和1型胶原的基因表达分析。
42.图18a和18b示出了根据实例3中描述的研究,ds102(15
‑
hepe)诱导的tgf
‑
β的抑制。
43.图18c至18g分别示出了根据实例3中描述的研究,ds102对i型tgf
‑
β受体、ii型tgf
‑
β受体、iii型tgf
‑
β受体、egfr和窖蛋白
‑
1的膜易位和降解的影响。
44.图19是实例4中描述的研究及其持续时间的示意图。
45.图20示出了根据实例4所述研究的患者的基线脂质组分布。
46.图21a至21c是描绘分别服用依匹鲁通(epeleuton,15
‑
hepe)和安慰剂的患者的胰岛素、血糖和游离脂肪酸水平变化的图。
47.图22a和22b是分别描绘服用依匹鲁通和安慰剂的患者的homa
‑
ir和apido
‑
ir水平变化的图。
48.图23a和23b是分别描绘在第16周服用依匹鲁通和安慰剂的患者的平均hba1c水平变化和hba1c水平≥6.5%的患者比例的图。
49.图24a和24b是分别描绘服用依匹鲁通和安慰剂的患者的脂质分布的平均变化和中值(%)变化的图。
50.图25a至25c是分别描绘服用依匹鲁通和安慰剂的患者的胆固醇、甘油三酯和vldl
‑
c水平变化的图。
51.图26是描绘服用ds102的患者的肝毒性脂质分布的变化的图。
52.图27是使用owl肝脏护理试验证实服用ds102解决nash的图。
53.图28是描绘服用ds102和安慰剂的患者的cap引起的肝脂肪含量变化的图。
54.图29a至29c是描绘服用ds102和安慰剂的患者的炎性和促纤维化蛋白水平变化的图表。
55.图30是描绘服用ds102和安慰剂的患者的包括nash发展目标在内的蛋白质表达变化的图。
56.图31是描绘服用ds102和安慰剂的患者的炎性和促纤维化蛋白减少的火山图。
57.图32是描绘服用ds102和安慰剂的患者的血管粘附分子变化的图。
58.图33是描绘服用ds102和安慰剂的患者的心血管危险蛋白变化的图。
59.图34是描绘服用ds102和安慰剂的患者的趋化因子变化的图。
60.图35是描绘服用ds102和安慰剂的患者的肿瘤坏死因子受体超家族成员的变化的图。
61.图36a和36b是描绘服用ds102和安慰剂的患者的alp水平降低的图。
62.图37是15
‑
hepe乙酯通过血浆相对浓度的箱形图。
具体实施方式
63.虽然本发明能够以各种形式实施,但是以下对几个实施例的描述是在理解将本公开认为是本发明的示例的前提下进行的,并非旨在将本发明限制于说明的特定实施例。提供标题仅仅是为了方便起见,而不应解释为以任何方式限制本发明。在任何标题下示出的实施例均可与在任何其他标题下示出的实施例组合。
64.除非另外明确指出,否则本申请中指定的各种定量值中对数值的使用表示为近似值,好像在规定范围内的最小值和最大值前面均有单词“约”一样。这样,与规定值的细微偏差可用于获得与规定值基本上相同的结果。同样,范围的公开旨在作为连续范围,包括所列举的最小值和最大值之间的每个值,以及可以由这些值形成的任何范围。本文还公开了可以通过将列举的数值划分为任何其他列举的数值而形成的任何和所有比率(以及任何此类比率的范围)。因此,本领域技术人员将认识到,许多此类比率、范围和比率的范围可以由本文呈现的数值明确地推导出来;并且,在所有情况下,此类比率、范围和比率的范围代表本发明的各个实施例。
65.除非另外定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同含义。尽管在本公开的实践中可使用与本文所述的那些类似或等同的方法和材料,但下文描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其它参考文献以全文引用的方式明确地并入。在冲突的情况下,以本说明书(包括定义)为准。此外,本文所述的材料、方法和实施例仅是说明性的,而不是限制性的。
66.定义
67.如本文所用,“15
‑
hepe”是15
‑
羟基
‑
二十碳
‑
5z,8z,11z,13e,17z
‑
五烯酸。15
‑
hepe,有时也称为15
‑
ohepa,可以根据本领域已知的方法由二十碳五烯酸(“epa”,二十碳
‑
5,8,11,14,17
‑
五烯酸或20:5n
‑
3)、ω
‑
3脂肪酸合成。如本文所用,“15
‑
hetre”是15
‑
羟基
‑
二十碳
‑
8z,11z,13e
‑
三烯酸。15
‑
hetre可根据本领域已知的方法由二高
‑
γ
‑
亚麻酸(“dgla”,顺式,顺式,顺式
‑
8,11,14
‑
二十碳三烯酸或20:3n
‑
6,一种ω
‑
3脂肪酸)合成。例如,15
‑
hepe或15
‑
hetre可通过将epa或dgla暴露于酶15
‑
脂氧合酶来合成。如本文所用,术语“15
‑
hepe”或“15
‑
hetre”是指呈其游离酸形式(例如,15
‑
羟基
‑
二十碳
‑
5z,8z,11z,13e,17z
‑
五烯酸或15
‑
羟基
‑
二十碳
‑
8z,11z,13e
‑
三烯酸)的15
‑
hepe或15
‑
hetre和/或其药学上可接受的酯、缀合物或盐,或任何前述物质的混合物。可以替代地使用15
‑
hepe或15
‑
hetre的衍生物,尽管这不包括缺少15
‑
hepe或15
‑
hetre的羟基的任何衍生化合物。在一些实施例中,15
‑
hepe或15
‑
hetre以游离酸形式使用。或者,15
‑
hepe或15
‑
hetre的药学上可接受的酯
或盐用于本公开中。在一些实施例中,15
‑
hepe或15
‑
hetre呈c1‑4烷基酯形式,如甲酯或乙酯形式。在又另一个实施例中,15
‑
hepe或hetre呈甘油酯(例如,甘油二酯或甘油三酯)的形式。
68.15
‑
hepe和15
‑
hetre是手性分子并且可以(s)
‑
或(r)
‑
对映异构体形式或作为外消旋混合物使用。如本文所用,“15
‑
hepe”或“15
‑
hetre”包括所有这类形式,而不限于立体特异性。在另一个实施例中,15
‑
hepe包含(s)形式:15(s)
‑
羟基
‑
(5z,8z,11z,13e,17z)
‑
二十碳五烯酸或(r)形式:15(r)
‑
羟基
‑
(5z,8z,11z,13e,17z)
‑
二十碳五烯酸。在一些实施例中,15
‑
hetre包含(s)形式:15(s)
‑
羟基
‑
二十碳
‑
8z,11z,13e
‑
三烯酸或15(r)
‑
羟基
‑
二十碳
‑
8z,11z,13e
‑
三烯酸。
69.如本文所用,“ds102”是指15
‑
hepe或包含15
‑
hepe的组合物。
70.如本文所用,“依匹鲁通”是指15
‑
hepe或包含15
‑
hepe的组合物。
71.如本文所用,“ds109”是指15
‑
hetre或包含15
‑
hetre的组合物。
72.如本文所用,对疾病、病症或病状的“治疗”至少部分地包括:(1)抑制疾病、病症或病状,即阻止或减少疾病、病症或病状或其临床症状的发展;或(2)缓解疾病、病症或病状,即引起疾病、病症或病状或其临床症状的消退。与给定疾病或病症有关的术语“预防”意指:如果没有发生疾病,则预防疾病的发作;预防疾病或病症在可能易患该病症或疾病但尚未诊断为患有该病症或疾病的受试者中发生,和/或如果已经存在,则预防进一步的疾病/疾病发展。
73.如本文所用,“有效量”是指对受试者产生治疗效果所需的活性组合物的量。如本文所用,“治疗有效量”是指将在一定程度上缓解所治疗的疾病、病症或病状的一种或多种症状的所施用的药剂或化合物的足够量。在一些实施例中,结果是疾病的体征、症状或病因的减少和/或减轻,或生物系统的任何其他期望的改变。例如,在一些实施例中,用于治疗用途的“有效量”是提供疾病症状的临床显著降低而没有过度不良副作用所需的包括本文公开的化合物的组合物的量。在一些实施例中,使用诸如剂量递增研究等技术确定任何个别情况下的适当“有效量”。术语“治疗有效量”包括例如预防有效量。在其它实施例中,本文公开的化合物例如式(a)或式(i)的化合物的“有效量”是有效实现期望的药理作用或治疗改善而没有过度不良副作用的量。在其它实施例中,应理解,“有效量”或“治疗有效量”因受试者的代谢、年龄、体重、一般状况,所治疗的病状,所治疗的病状的严重性和处方医师的判断的不同而在受试者与受试者之间有所不同。本文中的术语“药学上可接受的”是指所述物质对受试者不产生不可接受的毒性或不与组合物的其它组分相互作用。
74.根据以下详细描述,本公开的其他特征和优点将变得显而易见。
75.组合物
76.在一个实施例中,本公开的组合物包含15
‑
hepe或15
‑
hetre作为活性成分。本文中的术语“药学上可接受的”是指所述物质对受试者不产生不可接受的毒性或不与组合物的其它组分相互作用。
77.在一个实施例中,15
‑
hepe或15
‑
hetre呈酯形式(在本文中也称为e
‑
15
‑
hepe、乙基
‑
15
‑
hepe或15
‑
hepe ee和e
‑
15
‑
hetre、乙基
‑
15
‑
hetre或15
‑
hetreee)。在另一个实施例中,15
‑
hepe或15
‑
hetre包含15
‑
hepe或15
‑
hetre的c1‑
c5烷基酯。在另一个实施例中,15
‑
hepe或15
‑
hetre包含15
‑
hepe或15
‑
hetre甲酯、15
‑
hepe或15
‑
hetre丙酯,或15
‑
hepe或15
‑
hetre丁酯。在又一个实施例中,15
‑
hepe或15
‑
hetre包含光学活性15(s)
‑
羟基
‑
(5z,8z,11z,13e,17z)
‑
二十碳五烯酸或15(s)
‑
羟基
‑
二十碳
‑
8(z),11(z),13(e)
‑
三烯酸。该异构体可以以上述任何形式使用。
78.在另一个实施例中,15
‑
hepe或15
‑
hetre包含锂15
‑
hepe或15
‑
hetre、单、二或三甘油酯15
‑
hepe或15
‑
hetre或15
‑
hepe或15
‑
hetre的任何其它酯或盐,或15
‑
hepe或15
‑
hetre的游离酸形式。
79.在各种实施例中,本公开提供包含15
‑
hepe或15
‑
hetre的医药组合物,例如可口服组合物。在一个实施例中,组合物包含治疗有效量的15
‑
hepe或15
‑
hetre。在一个实施例中,医药组合物包含按重量计约0.1%至约99%、约1%至约95%、约5%至约90%的15
‑
hepe或15
‑
hetre。本文提供的“组合物”和短语“医药组合物”可互换使用。
80.在一个实施例中,医药组合物包含按重量计约至少约70%、至少约80%或至少约90%的15
‑
hepe或15
‑
hetre。在一个实施例中,医药组合物包含按重量计至少约50%、至少约60%、至少约70%、至少约80%或至少约90%的15
‑
hepe或15
‑
hetre。
81.在另一个实施例中,15
‑
hepe或15
‑
hetre以约1mg至约10,000mg、约25mg至约7500mg、约25mg至约5000mg、约50mg至约5000mg、约50mg至约3000mg、约75mg至约2500mg或约100mg至约1000mg,例如约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约24mg、约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg、约350mg、约375mg、约400mg、约425mg、约450mg、约475mg、约500mg、约525mg、约550mg、约575mg、约600mg、约625mg、约650mg、约675mg、约700mg、约725mg、约750mg、约775mg、约800mg、约825mg、约850mg、约875mg、约900mg、约925mg、约950mg、约975mg、约1000mg、约1025mg、约1050mg、约1075mg、约1100mg、约1025mg、约1050mg、约1075mg、约1200mg、约1225mg、约1250mg、约1275mg、约1300mg、约1325mg、约1350mg、约1375mg、约1400mg、约1425mg、约1450mg、约1475mg、约1500mg、约1525mg、约1550mg、约1575mg、约1600mg、约1625mg、约1650mg、约1675mg、约1700mg、约1725mg、约1750mg、约1775mg、约1800mg、约1825mg、约1850mg、约1875mg、约1900mg、约1925mg、约1950mg、约1975mg、约2000mg、约2025mg、约2050mg、约2075mg、约2100mg、约2125mg、约2150mg、约2175mg、约2200mg、约2225mg、约2250mg、约2275mg、约2300mg、约2325mg、约2350mg、约2375mg、约2400mg、约2425mg、约2450mg、约2475mg、约2500mg、约2525mg、约2550mg、约2575mg、约2600mg、约2625mg、约2650mg、约2675mg、约2700mg、约2725mg、约2750mg、约2775mg、约2800mg、约2825mg、约2850mg、约2875mg、约2900mg、约2925mg、约2950mg、约2975mg、约3000mg、约3025mg、约3050mg、约3075mg、约3100mg、约3125mg、约3150mg、约3175mg、约3200mg、约3225mg、约3250mg、约3275mg、约3300mg、约3325mg、约3350mg、约3375mg、约3400mg、约3425mg、约3450mg、约3475mg、约3500mg、约3525mg、约3550mg、约3575mg、约3600mg、约3625mg、约3650mg、约3675mg、约3700mg、约3725mg、约3750mg、约3775mg、约3800mg、约3825mg、约3850mg、约3875mg、约3900mg、约3925mg、约3950mg、约3975mg、约4000mg、约4025mg、约4050mg、约4075mg、约4100mg、约4125mg、约4150mg、约4175mg、约4200mg、约4225mg、约4250mg、约4275mg、约4300mg、约4325mg、约4350mg、约4375mg、约4400mg、约4425mg、约4450mg、约
4475mg、约4500mg、约4525mg、约4550mg、约4575mg、约4600mg、约4625mg、约4650mg、约4675mg、约4700mg、约4725mg、约4750mg、约4775mg、约4800mg、约4825mg、约4850mg、约4875mg、约4900mg、约4925mg、约4950mg、约4975mg、约5000mg、约5025mg、约5050mg、约5075mg、约5100mg、约5125mg、约5150mg、约5175mg、约5200mg、约5225mg、约5250mg、约5275mg、约5300mg、约5325mg、约5350mg、约5375mg、约5400mg、约5425mg、约5450mg、约5475mg、约5500mg、约5525mg、约5550mg、约5575mg、约5600mg、约5625mg、约5650mg、约5675mg、约5700mg、约5725mg、约5750mg、约5775mg、约5800mg、约5825mg、约5850mg、约5875mg、约5900mg、约5925mg、约5950mg、约5975mg、约6000mg、约6025mg、约6050mg、约6075mg、约6100mg、约6125mg、约6150mg、约6175mg、约6200mg、约6225mg、约6250mg、约6275mg、约6300mg、约6325mg、约6350mg、约6375mg、约6400mg、约6425mg、约6450mg、约6475mg、约6500mg、约6525mg、约6550mg、约6575mg、约6600mg、约6625mg、约6650mg、约6675mg、约6700mg、约6725mg、约6750mg、约6775mg、约6800mg、约6825mg、约6850mg、约6875mg、约6900mg、约6925mg、约6950mg、约6975mg、约7000mg、约7025mg、约7050mg、约7075mg、约7100mg、约7125mg、约7150mg、约7175mg、约7200mg、约7225mg、约7250mg、约7275mg、约7300mg、约7325mg、约7350mg、约7375mg、约7400mg、约7425mg、约7450mg、约7475mg、约7500mg、约7525mg、约7550mg、约7575mg、约7600mg、约7625mg、约7650mg、约7675mg、约7700mg、约7725mg、约7750mg、约7775mg、约7800mg、约7825mg、约7850mg、约7875mg、约7900mg、约7925mg、约7950mg、约7975mg、约8000mg、约8025mg、约8050mg、约8075mg、约8100mg、约8125mg、约8150mg、约8175mg、约8200mg、约8225mg、约8250mg、约8275mg、约8300mg、约8325mg、约8350mg、约8375mg、约8400mg、约8425mg、约8450mg、约8475mg、约8500mg、约8525mg、约8550mg、约8575mg、约8600mg、约8625mg、约8650mg、约8675mg、约8700mg、约8725mg、约8750mg、约8775mg、约8800mg、约8825mg、约8850mg、约8875mg、约8900mg、约8925mg、约8950mg、约8975mg、约9000mg、约9025mg、约9050mg、约9075mg、约9100mg、约9125mg、约9150mg、约9175mg、约9200mg、约9225mg、约9250mg、约9275mg、约9300mg、约9325mg、约9350mg、约9375mg、约9400mg、约9425mg、约9450mg、约9475mg、约9500mg、约9525mg、约9550mg、约9575mg、约9600mg、约9625mg、约9650mg、约9675mg、约9700mg、约9725mg、约9750mg、约9775mg、约9800mg、约9825mg、约9850mg、约9875mg、约9900mg、约9925mg、约9950mg、约9975mg或约10,000mg的量存在于本公开的组合物中。
82.在一个实施例中,本公开的组合物中存在的15
‑
hepe或15
‑
hetre包含至少约90重量%的15
‑
hepe或15
‑
hetre(如本文定义和例示术语“15
‑
hepe”和“15
‑
hetre”)。15
‑
hepe或15
‑
hetre组合物可包含甚至更高纯度的15
‑
hepe或15
‑
hetre,例如至少约95重量%的15
‑
hepe或15
‑
hetre或至少约97重量%的15
‑
hepe或15
‑
hetre,其中15
‑
hepe或15
‑
hetre为如本文所述的15
‑
hepe或15
‑
hetre的任何形式。15
‑
hepe或15
‑
hetre的纯度可进一步通过本文提供的15
‑
hepe或15
‑
hetre的任何描述来定义(例如,杂质分布)。
83.上文讨论了医药组合物中15
‑
hepe或15
‑
hetre的量及其纯度。必需脂肪酸的性质及其合成使得15
‑
hepe或15
‑
hetre组合物可包括来自必需脂肪酸代谢级联中的其它必需脂肪酸的部分。
84.在一个实施例中,本公开的组合物含有其它ω
‑
3脂肪酸,包括α亚麻酸、十八碳四
烯酸、二十二碳六烯酸(dha)或其衍生物的按重量计不超过约10%、不超过约9%、不超过约8%、不超过约7%、不超过约6%、不超过约5%、不超过约4%、不超过约3%、不超过约2%、不超过约1%或不超过约0.5%。在其它实施例中,这种其它ω
‑
3脂肪酸基本上不存在或不存在。
85.在另一个实施例中,15
‑
hepe或15
‑
hetre占存在于本公开的组合物中的所有脂肪酸的按重量计至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%、至少约98%、至少约99%或100%。
86.在一个实施例中,存在于本发明组合物中的15
‑
hepe或15
‑
hetre的盐形式包含15
‑
hepe或15
‑
hetre的盐形式的至少90重量%。含有15
‑
hepe或15
‑
hetre的盐形式的组合物可包含甚至更高的纯度,例如15
‑
hepe或15
‑
hetre的盐形式的至少91重量%、至少92重量%、至少重量93%、至少94重量%、至少95重量%、至少96重量%或至少97重量%。
87.可能存在由于15
‑
hepe合成产生的一些残余二十碳五烯酸或由于15
‑
hetre合成产生的一些残余二高
‑
γ
‑
亚麻酸。按重量计,epa或dgla可以不多于约10%、不多于约9%、不多于约8%、不多于约7%、不多于约6%、不多于约5%、不多于约4%、不多于约3%、不多于约2%、不多于约1%、或不多于约0.5%。或者,基本上没有或没有未改性成羟基形式的epa或dgla。
88.在一个实施例中,本公开提供了包含包封在胶囊壳中的15
‑
hepe和/或15
‑
hetre或其衍生物的医药组合物。在一个实施例中,组合物以足以提供每天至多约1g、约2g、约3g、约4g、约5g、约6g、约7g、约8g、约9g或约10g 15
‑
hepe和/或15
‑
hetre或其衍生物的量给药至受试者。在一个实施例中,组合物以足以提供每天约4g至约8g、约1g至约2g、约2g至约4g、约3g至约8g、约4g至约6g的15
‑
hepe和/或15
‑
hetre或其衍生物的量给药至受试者。在一个实施例中,将约500mg至约1g的15
‑
hepe和/或15
‑
hetre或其衍生物包封在胶囊壳中。
89.在一个实施例中,胶囊壳包含明胶(例如,具有较低分子量的明胶rxl或石灰骨明胶)。在另一个实施例中,胶囊壳包含已通过蛋白水解酶处理以切割明胶图案并有效降低其分子量的明胶rxl。在另一个实施例中,医药组合物包含d
‑
山梨糖醇和1,4
‑
山梨聚糖的15
‑
hepe和/或15
‑
hetre酯。在一个实施例中,胶囊壳包含(a)明胶和(b)选自d
‑
山梨糖醇和1,4
‑
山梨聚糖中的一种或多种的增塑剂。在一个实施例中,明胶如u.s.7,485,323中所述,其全部内容通过引用并入本文。
90.在一个实施例中,增塑剂包含约20%至约30%,例如约24%至约28%、24%或28%(基于干重)的量的1,4
‑
山梨聚糖,和约30%至约50%,例如约35%至约45%(基于干重)的d
‑
山梨糖醇含量。
91.在一些实施例中,胶囊是硬明胶胶囊。在另一个实施例中,胶囊是软明胶胶囊。
92.在一些实施例中,胶囊壳包含改性淀粉,角叉菜胶(例如,红海藻提取物),磷酸氢二钠,甘油和/或山梨聚糖。在一些实施例中,胶囊壳还包含水。在一些实施例中,胶囊壳在高达约65℃的温度和/或约12的ph值下是稳定的。
93.在一些实施例中,胶囊外壳无气味并且具有中性颜色(例如无色、白色或透明)。
94.在一些实施例中,胶囊壳还包含甘油、纯净水、二氧化钛、中链甘油三酯和卵磷脂。
95.其它活性剂
96.在一个实施例中,医药组合物还包含一种或多种另外的活性剂。在一个实施例中,
医药组合物包含的另外的活性剂的量小于该活性剂通常公认的治疗有效量。在一个实施例中,医药组合物包含的另外的活性剂的量等于或大于该活性剂的通常公认的治疗有效量。如果使用另外的活性剂,则15
‑
hepe和/或15
‑
hetre可以共同配制为单一剂量单位或可以配制为用于协调、组合或伴随给药的两个至多个剂量单位。
97.epa本身对于治疗脂肪肝疾病和/或心血管疾病具有有益的特性,并且在替代实施例中可以将15
‑
hepe与epa组合。dgla本身对于治疗心血管疾病具有有益的特性,并且在替代实施例中可以将15
‑
hetre与dgla组合。
98.在一个实施例中,15
‑
hepe或15
‑
hetre和一种或多种活性剂以约1:1000至约1000:1、约1:500至约500:1、约1:100至约100:1、约1:50至约50:1、约1:25至约25:1、约1:10至约10:1、约1:5至约5:1、约1:4至约4:1、约1:3至约3:1、约1:2至约2:1或约1:1的15
‑
hepe或15
‑
hetre:其它活性剂的重量比存在于本公开的组合物中,或共同给药。
99.剂型
100.根据本公开使用的组合物可以配制为一种或多种剂量单位。本文中的术语“剂量单位”是指组合物的一部分,其含有适于单次给药以提供治疗效果的治疗剂的量。这样的剂量单位可以每天给药一次至多次(例如,1至约10、1至8、1至6、1至4或1至2次),或根据需要给药多次以引起治疗反应。
101.在一些实施例中,本公开的组合物为口服剂型或单位的形式。合适的剂型的非限制性实例包括片剂(例如,混悬片剂、咬混悬剂片剂、快速分散片剂、咀嚼片剂等)、囊片、胶囊(例如,软或硬明胶胶囊或hpmc胶囊)、锭剂、小药囊、扁囊剂、含片、丸剂、悬浮液、酏剂、糖浆剂或合理地适于口服给药的任何其它固体剂型。本文中的术语“口服”和“口服给药”包括其中将药剂或组合物置于接受治疗的受试者的口中的任何递送形式,无论是否吞咽。因此,这包括口腔和舌下给药,以及食道给药。
102.或者,本公开的组合物还可以配制用于直肠、局部或肠胃外(例如皮下、肌内、静脉内和皮内或输注)递送。
103.在讨论本公开的组合物中15
‑
hepe或15
‑
hetre的量时,这可分成若干剂型。对于口服给药的尺寸存在限制。如果每天向受试者给药约1至约4g 15
‑
hepe或15
‑
hetre,那么这可以多达4个胶囊,每个胶囊提供约1g 15
‑
hepe或15
‑
hetre。
104.本公开的组合物可以是待直接吸入的液体剂型或剂量单位的形式,或者它们可以在摄入之前与食物或饮料混合。合适的液体剂型的非限制性实例包括溶液、悬浮液、酏剂、糖浆、液体气溶胶制剂等。
105.在另一个实施例中,本公开的组合物包含一种或多种药学上可接受的赋形剂。本文中的术语“药学上可接受的赋形剂”意指本身不是治疗剂的任何物质,其用作将治疗药递送至受试者的载体或媒剂或添加至组合物中以改善其处理或储存特性或允许或促进单位剂量的组合物的形成,并且其不产生不可接受的毒性或与组合物中的其它组分相互作用。仅举例来说,根据本公开的医药组合物可以包含以下各项中的一种或多种:抗氧化剂、表面活性剂、防腐剂、调味剂、共溶剂、粘度助剂、悬浮助剂和亲脂相。
106.在一个实施例中,医药组合物包含一种或多种抗氧化剂,例如抗坏血酸、棕榈酸、棕榈酸抗坏血酸酯、α
‑
生育酚、艾地苯醌、泛醌、阿魏酸、辅酶q10、番茄红素、绿茶、儿茶素、表没食子儿茶素3
‑
没食子酸酯(egcg)、绿茶多酚(gtp)、水飞蓟素、越桔、白藜芦醇、葡萄籽、
石榴提取物、染料木、碧萝芷、烟酰胺等。在一个实施例中,医药组合物包含约0.01wt.%至约2wt.%的抗氧化剂,例如约0.01wt.%、约0.02wt.%、约0.03wt.%、约0.04wt.%、约0.05wt.%、约0.06wt.%、约0.07wt.%、约0.08wt.%、约0.09wt.%、约0.1wt.%、约0.11wt.%、约0.12wt.%、约0.13wt.%、约0.14wt.%。约0.15wt.%、约0.16wt.%、约0.17wt.%、约0.18wt.%、约0.19wt.%、约0.2wt.%、约0.21wt.%、约0.22wt.%、约0.23wt.%、约0.24wt.%、约0.25wt.%、约0.26wt.%、约0.27wt.%、约0.28wt.%、约0.29wt.%、约0.3wt.%、约0.31wt.%、约0.32wt.%、约0.33wt.%、约0.34wt.%、约0.35wt.%、约0.36wt.%、约0.37wt.%、约0.38wt.%、约0.39wt.%、约0.4wt.%、约0.41wt.%、约0.42wt.%、约0.43wt.%、约0.44wt.%、约0.45wt.%、约0.46wt.%、约0.47wt.%、约0.48wt.%、约0.49wt.%、约0.5wt.%、约0.51wt.%、约0.52wt.%、约0.53wt.%、约0.54wt.%、约0.55wt.%、约0.56wt.%、约0.57wt.%、约0.58wt.%、约0.59wt.%、约0.6wt.%、约0.61wt.%、约0.62wt.%、约0.63wt.%、约0.64wt.%、约0.65wt.%、约0.66wt.%、约0.67wt.%、约0.68wt.%、约0.69wt.%、约0.7wt.%、约0.71wt.%、约0.72wt.%、约0.73wt.%、约0.74wt.%、约0.75wt.%、约0.76wt.%、约0.77wt.%、约0.78wt.%、约0.79wt.%、约0.8wt.%、约0.81wt.%、约0.82wt.%、约0.83wt.%、约0.84wt.%、约0.85wt.%、约0.86wt.%、约0.87wt.%、约0.88wt.%、约0.89wt.%、约0.9wt.%、约0.91wt.%、约0.92wt.%、约0.93wt.%、约0.94wt.%、约0.95wt.%、约0.96wt.%、约0.97wt.%、约0.98wt.%、约0.99wt.%、约1wt.%、约1.1wt.%、约1.2wt.%、约1.3wt.%、约1.4wt.%、约1.5wt.%、约1.6wt.%、约1.7wt.%、约1.8wt.%、约1.9wt.%、或约2wt.%的一种或多种抗氧化剂。
107.治疗方法
108.本文公开的组合物和制剂可用于治疗和/或预防代谢综合征和/或心血管代谢疾病。代谢综合征是指增大心血管疾病风险的一组心血管代谢病症。虽然心血管代谢疾病和代谢综合征是类似的,但是心血管代谢疾病定义了可能引起代谢综合征的更广泛的病症组。代谢综合征和/或心血管代谢疾病的风险因素的非限制性实例包括腰围大、甘油三酯水平升高、高密度脂蛋白胆固醇(hdl
‑
c)水平降低、血压升高、空腹血糖水平升高和/或胰岛素抗性。代谢综合征和/或心血管代谢疾病也可称为综合征x、肥胖综合征、心血管代谢综合征、代谢障碍综合征、高甘油三酯血症腰围、胰岛素抗性综合征、代谢紊乱、代谢过载和代谢底物过载。
109.在一些实施例中,受试者具有至少约35英寸、至少约40英寸、至少约45英寸、至少约50英寸、至少约55英寸、至少约60英寸或至少约65英寸的大基线腰围。
110.在一些实施例中,受试者具有约135mg/dl至约500mg/dl,例如约135mg/dl至约500mg/dl、约150mg/dl至约500mg/dl、约200mg/dl至约499mg/dl或约200mg/dl至<500mg/dl的升高的基线甘油三酯水平。在一些实施例中,受试者具有约50mg/dl至约1500mg/dl,例如约50mg/dl至约1500mg/dl、约80mg/dl至约1500mg/dl、约50mg/dl至约190mg/dl、约80mg/dl至约190mg/dl、约190mg/dl至约250mg/dl、约250mg/dl至约1400mg/dl的空腹基线甘油三酯水平。在一个实施例中,受试者具有约80mg/dl至约1400mg/dl的空腹基线甘油三酯水平。在一些实施例中,受试者或受试者组具有约50mg/dl、约55mg/dl、约60mg/dl、约65mg/dl、约70mg/dl、约75mg/dl、约80mg/dl、约85mg/dl、约90mg/dl、约95mg/dl、约100mg/dl、约105mg/
dl、约110mg/dl、约115mg/dl、约120mg/dl、约125mg/dl、约130mg/dl、约135mg/dl、约140mg/dl、约145mg/dl、约150mg/dl、约155mg/dl、约160mg/dl、约165mg/dl、约170mg/dl、约175mg/dl、约180mg/dl、约185mg/dl、约190mg/dl、约195mg/dl、约200mg/dl、约205mg/dl、约210mg/dl、约215mg/dl、约220mg/dl、约225mg/dl、约230mg/dl、约235mg/dl、约240mg/dl、约245mg/dl、约250mg/dl、约255mg/dl、约260mg/dl、约265mg/dl、约270mg/dl、约275mg/dl、约280mg/dl、约285mg/dl、约290mg/dl、约295mg/dl、约300mg/dl、约305mg/dl、约310mg/dl、约315mg/dl、约320mg/dl、约325mg/dl、约330mg/dl、约335mg/dl、约340mg/dl、约345mg/dl、约350mg/dl、约355mg/dl、约360mg/dl、约365mg/dl、约370mg/dl、约375mg/dl、约380mg/dl、约385mg/dl、约390mg/dl、约395mg/dl、约400mg/dl、约405mg/dl、约410mg/dl、约415mg/dl、约420mg/dl、约425mg/dl、约430mg/dl、约435mg/dl、约440mg/dl、约445mg/dl、约450mg/dl、约455mg/dl、约460mg/dl、约465mg/dl、约470mg/dl、约475mg/dl、约480mg/dl、约485mg/dl、约490mg/dl、约495mg/dl、约500mg/dl、约1000mg/dl、约1100mg/dl、约1200mg/dl、约1300mg/dl、约1400mg/dl、约1500mg/dl、约2000mg/dl、约2500mg/dl、约3000mg/dl、约3500mg/dl、约4000mg/dl、约4500mg/dl、约5000mg/dl或大于约5000mg/dl的进食或空腹的基线甘油三酯水平(或在受试者组的情况下,中值基线甘油三酯水平)。在一些实施例中,受试者或受试者组具有大于或等于80mg/dl、大于或等于约100mg/dl、大于或等于约120mg/dl、大于或等于约150mg/dl、大于或等于约175mg/dl、大于或等于约250mg/dl,或大于等于约500mg/dl,例如约190mg/dl至约250mg/dl、约80mg/dl至约190mg/dl、约250mg/dl至约1400mg/dl、约200mg/dl至约500mg/dl、约300mg/dl至约1800mg/dl、约500mg/dl至约1500mg/dl、或约80mg/dl至约1500mg/dl的进食或空腹的基线甘油三酯水平(或在受试者组的情况下,中值基线甘油三酯水平)。
111.在另一实施例中,受试者的基线血压升高为至少约100mmhg、至少约115mmhg、至少约120mmhg、至少约125mmhg、至少约130mmhg、至少约135mmhg、至少约140mmhg、至少约145mmhg、至少约150mmhg、至少约155mmhg、至少约160mmhg、至少约165mmhg或至少约170mmhg。
112.在一些实施例中,受试者的基线空腹血糖水平升高为至少约100mg/dl、至少约115mg/dl、至少约120mg/dl、至少约125mg/dl、至少约130mg/dl、至少约135mg/dl、至少约140mg/dl、至少约145mg/dl、至少约150mg/dl、至少约155mg/dl、至少约160mg/dl、至少约165mg/dl或至少约170mg/dl。
113.在一些实施例中,受试者的基线hdl
‑
c水平降低为小于约60mg/dl、小于约55mg/dl、小于约50mg/dl、小于约45mg/dl、小于约40mg/dl、小于约35mg/dl、小于约30mg/dl、小于约25mg/dl、小于约20mg/dl、小于约15mg/dl、小于约10mg/dl或小于约5mg/dl。
114.在一些实施例中,本公开提供了一种治疗和/或预防受试者的代谢综合征的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
115.在一些实施例中,本公开提供了一种治疗和/或预防受试者的代谢综合征的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,所
述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
116.在一些实施例中,本公开提供了一种治疗和/或预防受试者的心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
117.在一些实施例中,本公开提供了一种治疗和/或预防受试者的心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
118.在一些实施例中,本公开提供了一种治疗和/或预防受试者的内皮功能障碍的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
119.在一些实施例中,本公开提供了一种治疗和/或预防受试者的内皮功能障碍的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
120.在一个实施例中,本公开提供了一种治疗和/或预防受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,受试者患有nafld。在一些实施例中,所述nafld是非酒精性脂肪性肝炎(nash)。在一些实施例中,所述方法还包含在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者具有至少一种代谢综合征和/或心血管代谢疾病的风险因素。在一些实施例中,至少一种风险因素是腰围大、甘油三酯水平升高、hdl
‑
c水平降低、血压升高、空腹血糖水平升高和/或胰岛素抗性。在一些实施例中,受试者表现出腰围、甘油三酯水平、血压、空腹血糖水平的降低和/或胰岛素抗性和/或hdl
‑
c水平的提高中的一种或多种。
121.在一个实施例中,本公开提供了一种治疗和/或预防受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,受试者患有nafld。在一些实施例中,所述nafld为nash。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者具有至少一种代谢综合征和/或心血管代谢疾病的风险因素。在一些实施例中,所述至少一种风险因素是腰围大、甘油三酯水平升高、hdl
‑
c水平降低、血压升高、空腹血糖水平升高和/或胰岛素抗性。在一些实施例中,受试者表现出腰围、甘油三酯水平、血压、空腹血糖水平的降低和/或胰岛素抗性和/或hdl
‑
c水平的提高中的一种或多种。
122.在一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或
包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出总胆固醇、甘油三酯、甘油二酯和/或极低密度脂蛋白胆固醇(vldl
‑
c)水平中的一种或多种的降低和/或甘油磷脂水平的提高。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线总胆固醇、甘油三酯、甘油二酯、vldl
‑
c和/或甘油磷脂水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
123.在一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出总胆固醇、甘油三酯、甘油二酯和/或vldl
‑
c水平中的一种或多种的降低和甘油磷脂水平的提高。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线总胆固醇、甘油三酯、甘油二酯,vldl
‑
c和/或甘油磷脂水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
124.在一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出空腹血糖,胰岛素和/或游离脂肪酸水平中的一种或多种的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线空腹血糖,胰岛素和/或游离脂肪酸水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
125.在一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出空腹血糖,胰岛素和/或游离脂肪酸水平中的一种或多种的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线空腹血糖、胰岛素和/或游离脂肪酸水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
126.在一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出血红蛋白a1c(hba1c)、胰岛素抗性的稳态模型评估(homa
‑
ir)和/或脂肪组织胰岛素抗性(脂肪组织
‑
ir)水平中的一种或多种的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe
和/或15
‑
hetre的组合物之前测定受试者的hba1c、homa
‑
ir和/或脂肪组织
‑
ir水平的基线。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
127.在另一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。在一个实施例中,受试者表现出hba1c、homa
‑
ir和/或脂肪组织
‑
ir水平中的一种或多种的降低。在一些实施例中,所述方法还包括在施用包含15
‑
hepe的组合物之前测定受试者的基线hba1c、homa
‑
ir和/或脂肪组织
‑
ir水平。
128.在一个实施例中,本公开提供了一种治疗和/或预防患有肝纤维化和/或nafld的受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出肝脂肪含量,肝硬度,纤维化
‑
4(fib
‑
4),增强的肝纤维化(elf)分数和/或nafld分数(nfs)的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的肝脂肪含量、肝硬度、fib
‑
4、elf分数和/或nfs。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
129.在一个实施例中,本公开提供了一种治疗和/或预防患有肝纤维化和/或nafld的受试者的代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出肝脂肪含量、肝硬度、纤维化
‑
4(fib
‑
4)、增强的肝纤维化(elf)分数和/或nafld分数(nfs)的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的肝脂肪含量、肝硬度、fib
‑
4、elf分数和/或nfs。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
130.在一些实施例中,本公开提供了通过靶向nash的一个或多个进展阶段来治疗和/或预防患有nash的受试者的代谢综合征和/或心血管代谢疾病的方法。nash的进展阶段包括以下五个阶段:代谢过载;肝脂肪含量和脂毒性增加;细胞应激凋亡;炎症;以及纤维发生的重塑。代谢过载阶段的特征在于胰岛素抗性、游离脂肪酸、空腹血糖、胰岛素和/或hba1c水平升高。肝脂肪含量和脂毒性阶段的特征在于总胆固醇、游离脂肪酸、甘油三酯、甘油二酯、vldl
‑
c、非高密度脂蛋白胆固醇(非hdl
‑
c)和/或残余颗粒样胆固醇(rlp
‑
c)水平升高和/或甘油磷脂水平降低。细胞应激凋亡阶段的特征在于细胞凋亡标记物升高。细胞凋亡标记物的非限制性实例包括来自磷酸化b细胞淋巴瘤2(bcl
‑
2)家族的蛋白质、半胱天冬酶的活化片段和/或裂解的聚(adp
‑
核糖)聚合酶
‑
1(parp
‑
1)。炎症阶段的特征在于t细胞活化、b
细胞活化和/或趋化性水平升高。最后,也称为组织建模的纤维发生性重塑发生在诸如nash之类的疾病中,并且可能会导致器官衰竭和/或死亡。纤维发生性重塑的特征在于促纤维化蛋白的水平升高。在一些实施例中,所述方法包含向受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者不表现出nash的一个或多个进展阶段。在一些实施例中,所述方法包含向受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出nash的一个或多个进展阶段的减少。
131.在另一个实施例中,所述方法包含向受试者施用15
‑
hetre或包含15
‑
hetre的组合物,其中所述受试者不表现出nash的一个或多个进展阶段。在一些实施例中,所述方法包含向受试者施用15
‑
hetre或包含15
‑
hetre的组合物,其中所述受试者表现出nash的一个或多个进展期的减少。
132.在另一个实施例中,本公开提供了一种治疗、预防和/或减少代谢过载的方法,所述方法包含向受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,受试者表现出胰岛素抗性、游离脂肪酸、空腹血糖、胰岛素和/或hba1c水平的降低。在一些实施例中,所述受试者患有nash。
133.在另一个实施例中,本公开提供了一种治疗、预防和/或减少代谢过载的方法,所述方法包含向受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,受试者表现出胰岛素抗性、游离脂肪酸、空腹血糖、胰岛素和/或hba1c水平的降低。在一些实施例中,所述受试者患有nash。
134.在一些实施例中,本公开提供了一种治疗、预防和/或降低肝脂肪含量和脂毒性的方法,所述方法包含向受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,受试者表现出总胆固醇、游离脂肪酸、甘油三酯、甘油二酯、vldl
‑
c、非hdl
‑
c和/或rlp
‑
c降低,和/或甘油磷脂水平提高。在一些实施例中,受试者表现出肝脂肪含量的降低。在一些实施例中,所述受试者患有nash。
135.在一些实施例中,本公开提供一种治疗、预防和/或降低肝脂肪含量和脂毒性的方法,所述方法包含向受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,受试者表现出总胆固醇、游离脂肪酸、甘油三酯、甘油二酯、vldl
‑
c、非hdl
‑
c和/或rlp
‑
c降低,和/或甘油磷脂水平提高。在一些实施例中,受试者表现出肝脂肪含量的降低。在一些实施例中,所述受试者患有nash。
136.在一些实施例中,本公开提供了一种治疗、预防或减少细胞应激凋亡的方法,所述方法包含向受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,受试者表现出与细胞凋亡相关联的标记物如来自bcl
‑
2家族的蛋白质、半胱天冬酶的活化片段和/或裂解的parp
‑
1的减少。在一些实施例中,所述受试者患有nash。
137.在一些实施例中,本公开提供了一种治疗、预防或减少细胞应激凋亡的方法,所述方法包含向受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,受试者表现出与细胞凋亡相关联的标记物例如来自bcl
‑
2家族的蛋白质、半胱天冬酶的活化片段和/或裂解的parp
‑
1的减少。在一些实施例中,所述受试者患有nash。
138.在一些实施例中,本公开提供了一种治疗、预防和/或减轻炎症的方法,所述方法包含向受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,受试者表现出t细胞活化、b细胞活化和/或趋化性降低。在一些实施例中,所述受试者患有nash。
139.在一些实施例中,本公开提供了一种治疗、预防和/或减轻炎症的方法,所述方法包含向受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,受试者表现出t细胞活化、b细胞活化和/或趋化性降低。在一些实施例中,所述受试者患有nash。
140.在一些实施例中,本公开提供了一种治疗、预防和/或减少受试者的纤维发生性重塑的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,受试者表现出转化生长因子(tgf
‑
β)信号传导和纤维化蛋白的减少。纤维化蛋白的非限制性实例包括炎性和/或促纤维化蛋白,例如纤溶酶原激活剂抑制剂
‑
1(pai
‑
1)、金属肽酶抑制剂
‑
1(timp
‑
1)、二肽基肽酶4(dpp4)、trem样转录物2(tlt2)、趋化因子(c
‑
c基序)配体16(ccl16)、单核细胞趋化蛋白
‑
1(mcp
‑
1)、血清淀粉样蛋白a4(saa4)、磷酸肌醇3(pi3)、硫氧还蛋白还原酶(tr)、白细胞免疫球蛋白样受体b1(lilbr1)、胺氧化酶、含铜3(aoc3)、丝氨酸蛋白酶2(prss2)和/或肿瘤坏死因子配体超家族成员11a(tnrsf11a)。在一些实施例中,所述受试者患有nash。
141.在一些实施例中,本公开提供了一种治疗、预防和/或减少受试者的纤维发生性重塑的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,受试者表现出转化生长因子(tgf
‑
β)信号传导和纤维化蛋白的减少。纤维化蛋白的非限制性实例包括炎性和/或促纤维化蛋白,例如纤溶酶原激活剂抑制剂
‑
1(pai
‑
1)、金属肽酶抑制剂
‑
1(timp
‑
1)、二肽基肽酶4(dpp4)、trem样转录物2(tlt2)、趋化因子(c
‑
c基序)配体16(ccl16)、单核细胞趋化蛋白
‑
1(mcp
‑
1)、血清淀粉样蛋白a4(saa4)、磷酸肌醇3(pi3)、硫氧还蛋白还原酶(tr)、白细胞免疫球蛋白样受体b1(lilbr1)、胺氧化酶、含铜3(aoc3)、丝氨酸蛋白酶2(prss2)和/或肿瘤坏死因子配体超家族成员11a(tnrsf11a)。在一些实施例中,所述受试者患有nash。
142.在一些实施例中,本公开提供了对受试者治疗、预防nash,和/或减少nash的一个阶段向随后阶段进展的方法。nash的随后的阶段可以包括nash的第一、第二、第三、第四或第五阶段。在一些实施例中,向处于代谢过载阶段的受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者未进展至增加的肝脂肪和脂毒性阶段、细胞应激凋亡阶段、炎症阶段和/或纤维发生性重塑阶段。在另一个实施例中,向处于增加的肝脂肪和脂毒性阶段的受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者未进展至细胞应激凋亡阶段,炎症阶段和/或纤维发生性重塑阶段。在又一个实施例中,向处于细胞应激凋亡阶段的受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者未进展至炎症阶段和/或纤维发生性重塑阶段。在另一个实施例中,向处于炎症阶段的受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者未进展至纤维发生性重塑阶段。
143.在一些实施例中,本公开提供了对受试者治疗、预防nash,和/或减少nash的一个阶段向随后阶段进展的方法。nash的随后的阶段可以包括nash的第一、第二、第三、第四或第五阶段。在一些实施例中,向处于代谢过载阶段的受试者施用15
‑
hetre或包含15
‑
hetre的组合物,其中所述受试者未进展至增加的肝脂肪和脂毒性阶段、细胞应激凋亡阶段、炎症阶段和/或纤维发生性重塑阶段。在另一个实施例中,向处于增加的肝脂肪和脂毒性阶段的受试者施用15
‑
hetre或包含15
‑
hetre的组合物,其中所述受试者未进展至细胞应激凋亡阶段、炎症阶段和/或纤维发生性重塑阶段。在又一个实施例中,向处于细胞应激凋亡阶段的受试者施用15
‑
hetre或包含15
‑
hetre的组合物,其中所述受试者未进展至炎症阶段和/或
纤维发生性重塑阶段。在另一个实施例中,向处于炎症阶段的受试者施用15
‑
hetre或包含15
‑
hetre的组合物,其中所述受试者未进展至纤维发生性重塑阶段。
144.本文公开的组合物和制剂可用于治疗或预防心血管疾病或病症。在一个实施例中,所述心血管疾病或病症选自:血脂异常、高脂血症、高胆固醇血症、高甘油三酯血症、原发性高胆固醇血症、原发性高脂血症、常见原发性高脂血症、常见高胆固醇血症、家族性高脂血症、家族性原发性高脂血症、家族性高胆固醇血症、家族性高甘油三酯血症、家族性混合型高脂血症、家族性载脂蛋白b
‑
100缺陷、继发性高脂血症、混合型高脂血症、心血管疾病、残余心血管风险、预防动脉粥样硬化斑块形成/进展、微血管疾病、大血管疾病、动脉粥样硬化、冠状动脉粥样硬化、舒张功能障碍、降低心血管风险、主要冠状动脉事件的预防、主要不良心血管事件的预防、缺血性事件的预防、心血管事件的二级/一级预防、心血管死亡的预防、心肌梗塞、中风、心绞痛、正常内皮功能的恢复、糖尿病(diabetes)、糖尿病(diabetes mellitus)、胰岛素抗性、高胰岛素血症、高血糖症、血糖代谢障碍、血糖控制的诱导、葡萄糖耐量受损和空腹血糖受损。微血管疾病的非限制性实例包括视网膜病、肾病和神经病。大血管疾病的非限制性实例包括中风、外周血管疾病、肢体缺血和心脏病。在一些实施例中,受试者患有非酒精性肝病,胆汁淤积性肝病,肾病或代谢综合征。心血管疾病的任何上述实例还可以指心血管代谢疾病的非限制性实例。
145.在一个实施例中,本公开提供了一种治疗和/或预防受试者的心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,受试者患有肝纤维化、nafld、胆汁淤积性肝病、肾病、心血管代谢疾病和/或代谢综合征。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前确定受试者患有胆汁淤积性肝病、肾病、心血管代谢疾病和/或代谢综合征。
146.在一个实施例中,本公开提供了一种治疗和/或预防受试者的心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,受试者患有肝纤维化、nafld、胆汁淤积性肝病、肾病、心血管代谢疾病和/或代谢综合征。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前确定受试者患有胆汁淤积性肝病、肾病、心血管代谢疾病和/或代谢综合征。
147.在一个实施例中,本公开提供了对患有肝纤维化、nafld、胆汁淤积性肝病、肾病、心血管代谢疾病和/或代谢综合征的受试者治疗和/或预防心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出总胆固醇、甘油三酯、甘油二酯和/或vldl
‑
c水平中的一种或多种的降低和/或甘油磷脂水平的提高。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线总胆固醇、甘油三酯、甘油二酯,vldl
‑
c和/或甘油磷脂水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
148.在另一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的心血
管疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。在一个实施例中,受试者表现出总胆固醇、甘油三酯、甘油二酯和/或vldl
‑
c水平中的一种或多种的降低和/或甘油磷脂水平的提高。在一些实施例中,所述方法还包括在施用包含15
‑
hepe的组合物之前测定受试者的基线总胆固醇、甘油三酯、甘油二酯,vldl
‑
c和/或甘油磷脂基线水平。
149.在一个实施例中,本公开提供了对患有肝纤维化、nafld、胆汁淤积性肝病、肾病、心血管代谢疾病和/或代谢综合征的受试者治疗和/或预防心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
150.在另一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的心血管疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。在一个实施例中,受试者表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平的降低。在一些实施例中,所述方法还包括在施用包含15
‑
hepe的组合物之前测定受试者的基线α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平。
151.在一个实施例中,本公开提供了对患有肝纤维化、nafld、胆汁淤积性肝病、肾病、心血管代谢疾病或代谢综合征的受试者治疗和/或预防心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出空腹血糖,胰岛素和/或游离脂肪酸水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线空腹血糖,胰岛素和/或游离脂肪酸水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
152.在另一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的心血管疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。在一个实施例中,受试者表现出空腹血糖、胰岛素和/或游离脂肪酸水平的降低。在一些实施例中,所述方法还包括在施用包含15
‑
hepe的组合物之前测定受试者的基线空腹血糖、胰岛素和/或游离脂肪酸水平。
153.在一个实施例中,本公开提供了一种治疗和/或预防患有肝纤维化、nafld、胆汁淤积性肝病、肾病、心血管代谢疾病或代谢综合征的受试者的心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出hba1c、homa
‑
ir和/或脂肪组织
‑
ir水平的降低。在一些实施例中,所述方法还
包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的hba1c、homa
‑
ir和/或脂肪组织
‑
ir水平的基线。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
154.在另一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的心血管疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。在一个实施例中,受试者表现出hba1c、homa
‑
ir和/或脂肪组织
‑
ir水平的降低。在一些实施例中,所述方法还包括在施用包含15
‑
hepe的组合物之前测定受试者的基线hba1c、homa
‑
ir和/或脂肪组织
‑
ir水平。
155.在一个实施例中,本公开提供了一种治疗和/或预防患有肝纤维化、nafld、胆汁淤积性肝病、肾病、心血管代谢疾病或代谢综合征的受试者的心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出肝脂肪含量、肝硬度、纤维化
‑
4(fib
‑
4)、增强的肝纤维化(elf)分数和/或nafld分数(nfs)的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的肝脂肪含量、肝硬度、fib
‑
4、elf分数和/或nfs。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
156.在另一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的心血管疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。在一个实施例中,受试者表现出肝脂肪含量、肝硬度、fib
‑
4、elf分数和/或nfs的降低。在一些实施例中,所述方法还包括在施用包含15
‑
hepe的组合物之前测定受试者的肝脂肪含量、肝硬度、fib
‑
4、elf分数和/或nfs。
157.在一个实施例中,本公开提供了一种治疗和/或预防患有肝纤维化、nafld、胆汁淤积性肝病、肾病、心血管代谢疾病或代谢综合征的受试者的心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出一种或多种炎性和/或促纤维化蛋白水平的降低。在一些实施例中,所述一种或多种炎性和/或促纤维化蛋白选自由以下组成的组:pai
‑
1、timp
‑
1、dpp4、tlt2、ccl16、mcp
‑
1、saa4、pi3、tr、lilbr1、胺氧化酶、aoc3、prss2和tnrsf11a。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的一种或多种炎性和/或促纤维化蛋白的基线水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
158.在另一个实施例中,本公开提供了一种治疗和/或预防患有nafld的受试者的心血管疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。在一个实施例中,受试者表现出一种或多种炎性和/或促纤维化蛋白水平的降低。在一些实施例中,所述一种或多种炎性和/或促纤维化蛋白选自由以下组成的组:pai
‑
1、timp
‑
1、dpp4、tlt2、ccl16、mcp
‑
1、saa4、pi3、tr、lilbr1、胺氧化酶、aoc3、prss2和tnrsf11a。在一些实施例中,所述方法还包括在施用包含15
‑
hepe的组合物之前测定受试者的一种或多种炎性和/或促纤维化蛋白的基线水平。
159.在另一个实施例中,本公开提供了改善受试者的与心血管疾病相关联的生物标记物的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。例如,在一些实施例中,受试者表现出总胆固醇、甘油三酯、甘油二酯和/或vldl
‑
c水平的降低和/或甘油磷脂水平的提高。在一些实施例中,受试者还表现出心血管疾病风险的降低。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
160.本文公开的组合物和制剂还可用于治疗或预防胆汁淤积性肝病。胆汁淤积性肝病是肝脏的发炎和肝内和/或肝外胆管的结果,其引起肝脏中毒性胆汁积聚并且最终会导致肝硬化。胆汁淤积性肝病的风险因素的非限制性实例包括免疫系统中的遗传缺陷、机械畸变、毒素和/或调节异常。在一个实施例中,胆汁淤积性肝病选自原发性胆汁性胆管炎(pbc)、原发性硬化性胆管炎(psc)、肝内胆汁淤积、进行性家族性肝内胆汁淤积和妊娠肝内胆汁淤积。在一个实施例中,胆汁淤积性肝病由药物诱导的肝损伤、全胃肠外营养(tpn)、病毒性和酒精性肝炎、继发于全身性疾病的胆汁淤积、移植物功能障碍、肝移植后胆汁淤积、胰腺炎、胆总管结石、mirizzi综合征、遗传疾病和/或恶性肿瘤引起。恶性肿瘤的非限制性实例包括肝细胞癌,胆管肿瘤或胰腺癌。
161.在一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,胆汁淤积性肝病是pbc、psc和/或进行性家族性肝内胆汁淤积。
162.在一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,胆汁淤积性肝病是pbc、psc和/或进行性家族性肝内胆汁淤积。
163.在一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出碱性磷酸酯(alp)水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试
者的基线alp水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,所述方法包含向受试者施用约50mg/受试者体重(mg/kg),约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
164.在一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出alp水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线alp水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,所述方法包含向受试者施用约50mg/受试者体重(mg/kg),约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。
165.在另一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出alp水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线alp水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
166.在另一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出alp水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线alp水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。
167.在一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,所述方法包含向受试者施用约50mg/受试者体重(mg/kg),约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
168.在一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,所述方法包含向受试者施用约50mg/受试者体重(mg/kg),约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。
169.在一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre
的组合物,其中所述受试者表现出血清丙氨酸转氨酶(alt),天冬氨酸转氨酶(ast),和/或胆红素(bun)水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线血清alt、ast和/或bun水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,所述方法包含向受试者施用约50mg/受试者体重(mg/kg),约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
170.在另一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出血清alt、ast和/或bun水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线血清alt、ast和/或bun水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。
171.在另一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出血清alt、ast和/或bun水平的降低。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线血清alt、ast和/或bun水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。
172.在一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出纤维化面积的减小。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线纤维化面积。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,所述方法包含向受试者施用约50mg/受试者体重(mg/kg),约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
173.在另一个实施例中,本公开提供了一种治疗和/或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出纤维化面积的减小。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线纤维化面积。在一些实施例中,所述方法包含向受试者施用约1至约4g的15
‑
hepe或包含15
‑
hepe的组合物。
174.本文公开的组合物和制剂还可用于治疗或预防肾脏疾病或病症。在一个实施例中,所述肾病或病症选自肾纤维化、肾小管间质纤维化、慢性肾病、严重间质纤维化、肾间质和终末期肾病。在一些实施例中,受试者具有肾病的至少一种风险因素。肾病的至少一种危险因素的非限制性实例包括糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。
175.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例
中,所述方法包含向受试者施用约2g或更多的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在另一个实施例中,胆汁淤积性肝病是肾纤维化、肾小管间质纤维化、慢性肾病、严重间质纤维化、肾间质和终末期肾病。
176.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hepe或包含15
‑
hepe的组合物。在另一个实施例中,胆汁淤积性肝病是肾纤维化、肾小管间质纤维化、慢性肾病、严重间质纤维化、肾间质和终末期肾病。
177.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hetre或包含15
‑
hetre的组合物。在另一个实施例中,所述方法包含向受试者施用约2g或更多的15
‑
hetre或包含15
‑
hetre的组合物。在另一个实施例中,胆汁淤积性肝病是肾纤维化、肾小管间质纤维化、慢性肾病、严重间质纤维化、肾间质和终末期肾病。
178.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平的降低。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
179.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平的降低。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。
180.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物,其中所述受试者表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平的降低。在一些实施例中,受试者具有选自由以下组
成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法还包括在施用15
‑
hetre或包含15
‑
hetre的组合物之前测定受试者的基线α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hetre或包含15
‑
hepe的组合物。在又一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hetre或包含15
‑
hetre的组合物。
181.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出血清alt、ast和/或bun水平的降低。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者的基线血清alt、ast和/或bun水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
182.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出血清alt、ast和/或bun水平的降低。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线血清alt、ast和/或bun水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。
183.在一个实施例中,本公开提供一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物,其中所述受试者表现出血清alt、ast和/或bun水平的降低。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法进一步包含在施用15
‑
hetre或包含15
‑
hetre的组合物之前测定受试者的基线血清alt、ast和/或bun水平。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hetre或包含15
‑
hetre的组合物。在又一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hetre或包含15
‑
hetre的组合物。
184.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者表现出纤维化面积的减小。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合
物之前测定受试者的基线纤维化面积。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
185.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物,其中所述受试者表现出纤维化面积的减小。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者的基线纤维化面积。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。
186.在一个实施例中,本公开提供了一种治疗和/或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物,其中所述受试者表现出纤维化面积的减小。在一些实施例中,受试者具有选自由以下组成的组的肾病的至少一种风险因素:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。在一些实施例中,所述方法还包括在施用15
‑
hetre或包含15
‑
hetre的组合物之前测定受试者的基线纤维化面积。在一些实施例中,所述方法包含向受试者施用约1g至约4g的15
‑
hetre或包含15
‑
hetre的组合物。在又一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hetre或包含15
‑
hetre的组合物。
187.在另一个实施例中,本公开提供了一种对患有糖尿病(例如,i型或ii型)的受试者预防肾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前确定受试者患有糖尿病。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
188.在另一个实施例中,本公开提供了一种预防患有糖尿病(例如,i型或ii型)的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前确定受试者患有糖尿病。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
189.在另一个实施例中,本公开提供预防患有糖尿病(例如i型或ii型)的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hetre或包含15
‑
hetre的组合物之前确定受试者患有糖尿病。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hetre或包含15
‑
hetre的组合物。在又一个实施例中,15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
190.在另一个实施例中,本公开提供了一种治疗和/或预防患有心血管疾病的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前确定受试者患有心血管疾病。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
191.在另一个实施例中,本公开提供了一种治疗和/或预防患有心血管疾病的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前确定受试者患有心血管疾病。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
192.在另一个实施例中,本公开提供了一种治疗和/或预防患有心血管疾病的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hetre或包含15
‑
hetre的组合物之前确定受试者患有心血管疾病。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hetre或包含15
‑
hetre的组合物。在又一个实施例中,15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
193.在另一个实施例中,本公开提供了一种治疗和/或预防患有肾小球肾炎的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前确定受试者患有肾小球肾炎。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
194.在另一个实施例中,本公开提供了一种治疗和/或预防患有肾小球肾炎的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前确定受试者患有肾小球肾炎。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
195.在另一个实施例中,本公开提供了一种治疗和/或预防患有肾小球肾炎的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hetre或包含15
‑
hetre的组合物之前确定受试者患有肾小球肾炎。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hetre或包含15
‑
hetre的组合物。在又一个实施例中,15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
196.在另一个实施例中,本公开提供了一种治疗和/或预防患有多囊性肾病的受试者
的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前确定受试者患有多囊性肾病。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
197.在另一个实施例中,本公开提供了一种治疗和/或预防患有多囊性肾病的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前确定受试者患有多囊肾病。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
198.在另一个实施例中,本公开提供了一种治疗和/或预防患有多囊性肾病的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hetre或包含15
‑
hetre的组合物之前确定受试者患有多囊肾病。在另一个实施例中,所述方法包含向受试者施用约10mg/受试者体重(mg/kg),约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hetre或包含15
‑
hetre的组合物。在又一个实施例中,15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
199.在另一个实施例中,本公开提供了一种治疗和/或预防患有高血压的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物之前测定受试者患有高血压。在一些实施例中,受试者具有至少约130mmhg、至少约135mmhg、至少约140mmhg、至少约145mmhg、至少约150mmhg、至少约155mmhg、至少约160mmhg、至少约165mmhg或至少约170mmhg的高血压。在另一个实施例中,所述方法包含向受试者施用约10mg/kg、约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。在又一个实施例中,15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
200.在另一个实施例中,本公开提供了一种治疗和/或预防患有高血压的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,所述方法还包括在施用15
‑
hepe或包含15
‑
hepe的组合物之前测定受试者患有高血压。在一些实施例中,受试者具有至少约130mmhg、至少约135mmhg、至少约140mmhg、至少约145mmhg、至少约150mmhg、至少约155mmhg、至少约160mmhg、至少约165mmhg或至少约170mmhg的高血压。在另一个实施例中,所述方法包含向受试者施用约10mg/kg、约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe或包含15
‑
hepe的组合物。在又一个实施例中,15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
201.在另一个实施例中,本公开提供了一种治疗和/或预防患有高血压的受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,所述方法还包括在施用15
‑
hetre或包含15
‑
hetre的组合物之前测定受试者患有高血压。在一些实施例中,受试者具有至少约130mmhg、至少约135mmhg、至少约140mmhg、至少
约145mmhg、至少约150mmhg、至少约155mmhg、至少约160mmhg、至少约165mmhg或至少约170mmhg的高血压。在另一个实施例中,所述方法包含向受试者施用约10mg/kg、约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hetre或包含15
‑
hetre的组合物。在又一个实施例中,15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
202.本文公开的组合物和制剂还可用于减少患有心血管疾病、胆汁淤积性肝病、肾病、代谢综合征和/或心血管代谢疾病的受试者的细胞因子和/或趋化因子。非限制性细胞因子和/或趋化因子包括α
‑
平滑肌作用(α
‑
sma)、金属肽酶抑制剂
‑
1(timp
‑
1)、转化生长因子β
‑
β(tgf
‑
β)和1型胶原。
203.在另一个实施例中,本公开提供了一种治疗和/或预防受试者的肝纤维化的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre,或包含15
‑
hepe和/或15
‑
hetre的组合物。在一些实施例中,通过肝功能试验(lft)评估治疗和/或预防。在一些实施例中,受试者表现出肝脏硬度、elf分数、nfs、fib
‑
4、ast与血小板比率指数(apri)、肝脏炎症和纤维化分数(lif)、lok分数、纤维化指数、king分数、bonacini分数和/或瞬时弹性成像(te)分数的降低。在一些实施例中,通过成像技术如磁共振成像(mri)来测量lft。
204.在另一个实施例中,本公开提供了一种治疗和/或预防受试者的肝纤维化的方法,所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。在一些实施例中,通过lft来评估治疗和/或预防。在一些实施例中,受试者表现出肝脏硬度、elf分数、nfs、fib
‑
4、apri、lif、lok分数、纤维化指数、king分数、bonacini分数和/或te分数的降低。在一些实施例中,通过成像技术如mri来测量lft。
205.在另一个实施例中,本公开提供了一种治疗和/或预防受试者的肝纤维化的方法,所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物。在一些实施例中,通过lft来评估治疗和/或预防。在一些实施例中,受试者表现出肝脏硬度、elf分数、nfs、fib
‑
4、apri、lif、lok分数、纤维化指数、king分数、bonacini分数和/或te分数的降低。在一些实施例中,通过成像技术如mri来测量lft。
206.在另一个实施例中,在用本发明的组合物治疗时,所述受试者或受试者组表现出以下的一个或多个结果:
207.(a)相对于基线、安慰剂对照和/或未经治疗的患者,血清转氨酶(alt)和/或天冬氨酸转氨酶(ast)水平没有提高或降低;
208.(b)相对于基线、安慰剂对照和/或未经治疗的患者,胆红素(bun)水平没有提高或降低;
209.(c)相对于基线、安慰剂对照和/或未经治疗的患者,纤维化面积没有提高或降低;
210.(d)相对于基线、安慰剂对照和/或未经治疗的患者,空腹血糖水平没有提高或降低;
211.(e)相对于基线、安慰剂对照和/或未经治疗的患者,胰岛素水平没有提高或降低;
212.(f)相对于基线、安慰剂对照和/或未经治疗的患者,碱性磷酸盐(alp)水平没有提高或降低;
213.(g)相对于基线、安慰剂对照和/或未经治疗的患者,血红蛋白a1c(hba1c)水平没有提高或降低;
214.(h)相对于基线、安慰剂对照和/或未经治疗的患者,胰岛素抗性(homa
‑
ir)水平的
稳态模型评估没有提高或降低;
215.(i)相对于基线、安慰剂对照和/或未经治疗的患者,脂肪组织胰岛素抗性(脂肪组织
‑
ir)水平没有提高或降低;
216.(j)相对于基线、安慰剂对照和/或未经治疗的患者,总胆固醇水平没有提高或降低;
217.(k)相对于基线、安慰剂对照和/或未经治疗的患者,甘油三酯水平没有提高或降低;
218.(l)相对于基线、安慰剂对照和/或未经治疗的患者,甘油二酯水平没有提高或降低;
219.(m)相对于基线、安慰剂对照和/或未经治疗的患者,极低密度脂蛋白胆固醇(vldl
‑
c)水平没有提高或降低;
220.(n)相对于基线、安慰剂对照和/或未经治疗的患者,残粒样颗粒胆固醇(rlp
‑
c)水平没有提高或降低;
221.(o)相对于基线、安慰剂对照和/或未经治疗的患者,非高密度脂蛋白胆固醇(非hdl
‑
c)水平没有提高或降低;
222.(p)相对于基线、安慰剂对照和/或未经治疗的患者,高密度脂蛋白胆固醇(hdl
‑
c)水平没有降低或增加;
223.(q)相对于基线、安慰剂对照和/或未经治疗的患者,低密度脂蛋白胆固醇(ldl
‑
c)水平没有提高或降低;
224.(r)相对于基线、安慰剂对照和/或未经治疗的患者,肾羟脯氨酸水平没有提高或降低;
225.(s)相对于基线、安慰剂对照和/或未经治疗的患者,白介素
‑
33(il
‑
33)水平没有提高或降低;
226.(t)相对于基线、安慰剂对照和/或未经治疗的患者,白介素
‑
17(il
‑
17)水平没有提高或降低;
227.(u)相对于基线、安慰剂对照和/或未经治疗的患者,芳香烃受体(ahr)水平没有提高或降低;
228.(v)相对于基线、安慰剂对照和/或未经治疗的患者,tnf
‑
样配体1a(tl1a)水平没有提高或降低;
229.(w)相对于基线、安慰剂对照和/或未经治疗的患者,肿瘤坏死因子(tnf
‑
α)水平没有提高或降低;
230.(x)相对于基线、安慰剂对照和/或未经治疗的患者,白介素
‑
13(il
‑
13)水平没有提高或降低;
231.(y)相对于基线、安慰剂对照和/或未经治疗的患者,白介素
‑
6(il
‑
6)水平没有提高或降低;
232.(z)相对于基线、安慰剂对照和/或未经治疗的患者,白介素1β
‑
β(il
‑
1β)水平没有提高或降低;
233.(aa)相对于基线、安慰剂对照和/或未经治疗的患者,1型胶原水平没有提高或降低;
234.(bb)相对于基线、安慰剂对照和/或未经治疗的患者,转化生长因子
‑
β(tgf
‑
β)水平没有提高或降低;
235.(cc)相对于基线、安慰剂对照和/或未经治疗的患者,α
‑
平滑肌作用(α
‑
sma)水平没有提高或降低;
236.(dd)相对于基线、安慰剂对照和/或未经治疗的患者,肿瘤坏死因子配体超家族成员11a(tnrsf11a)水平没有提高或降低;
237.(ee)相对于基线、安慰剂对照和/或未经治疗的患者,丝氨酸蛋白酶2(prss2)水平没有提高或降低;
238.(ff)相对于基线、安慰剂对照和/或未经治疗的患者,胺氧化酶,含铜3(aoc3)水平没有提高或降低;
239.(gg)相对于基线、安慰剂对照和/或未经治疗的患者,白细胞免疫球蛋白样受体b1(lilbr1)水平没有提高或降低;
240.(hh)相对于基线、安慰剂对照和/或未经治疗的患者,转铁蛋白受体蛋白1(tr)水平没有提高或降低;
241.(ii)相对于基线、安慰剂对照和/或未经治疗的患者,弹性蛋白酶抑制剂(pi3)水平没有提高或降低;
242.(jj)相对于基线、安慰剂对照和/或未经治疗的患者,血清淀粉样蛋白a4(saa4)水平没有提高或降低;
243.(kk)相对于基线、安慰剂对照和/或未经治疗的患者,单核细胞趋化蛋白
‑
1(mcp
‑
1)水平没有提高或降低;
244.(ll)相对于基线、安慰剂对照和/或未经治疗的患者,趋化因子(c
‑
c基序)配体16(ccl16)水平没有提高或降低;
245.(mm)相对于基线、安慰剂对照和/或未经治疗的患者,trem样转录物2(tlt2)水平没有提高或降低;
246.(nn)相对于基线、安慰剂对照和/或未经治疗的患者,二肽基肽酶4(dpp4)水平没有提高或降低;以及
247.(oo)相对于基线、安慰剂对照和/或未经治疗的患者,金属蛋白酶抑制剂
‑
1(timp
‑
1)水平没有提高或降低;
248.(pp)相对于基线、安慰剂对照和/或未经治疗的患者,纤溶酶原激活剂抑制剂
‑
1(pai
‑
1)水平没有提高或降低;
249.(qq)相对于基线、安慰剂对照和/或未经治疗的患者,nafld分数(nfs)没有提高或降低;以及
250.(rr)相对于基线、安慰剂对照和/或未经治疗的患者,纤维化
‑
4(fib
‑
4)水平没有提高或降低;
251.(ss)相对于基线、安慰剂对照和/或未经治疗的患者,肝脏硬度水平没有提高或降低;
252.(tt)相对于基线、安慰剂对照和/或未经治疗的患者,肝脂肪含量没有提高或降低;
253.(uu)相对于基线、安慰剂对照和/或未经治疗的患者,甘油磷脂水平没有降低或增
加;
254.(vv)相对于基线、安慰剂对照和/或未经治疗的患者,血压没有提高或降低;
255.(ww)相对于基线、安慰剂对照和/或未经治疗的患者,增强的肝纤维化(elf)分数没有提高或降低;
256.(xx)相对于基线、安慰剂对照和/或未经治疗的患者,肺和/或皮肤成纤维细胞中的胶原产生没有提高或降低;
257.(yy)相对于基线、安慰剂对照和/或未经治疗的患者,葡萄糖摄取没有减少或增加;
258.(zz)相对于基线、安慰剂对照和/或未经治疗的患者,肺和/或皮肤成纤维细胞活力提高;
259.(ab)相对于基线、安慰剂对照和/或未经治疗的患者,白介素
‑
8(il
‑
8)水平没有变化或降低;
260.(ac)相对于基线、安慰剂对照和/或未经治疗的患者,白介素
‑
23(il
‑
23)水平没有变化或降低;
261.(ad)相对于基线、安慰剂对照和/或未经治疗的患者,白介素
‑
11(il
‑
11)水平没有变化或降低;和/或
262.(ae)相对于基线、安慰剂对照和/或未经治疗的患者,干扰素γ(ifnγ)水平没有变化或降低;
263.(af)相对于基线、安慰剂对照和/或未经治疗的患者,t和/或b细胞活化没有变化或减少;
264.(ag)相对于基线、安慰剂对照和/或未经治疗的患者,趋化性没有变化或降低;
265.(ah)相对于基线、安慰剂对照和/或未经治疗的患者,磷酸化b细胞淋巴瘤2(bcl
‑
2)家族成员没有变化或减少;
266.(ai)相对于基线、安慰剂对照和/或未经治疗的患者,半胱天冬酶的活化片段水平没有变化或降低;
267.(aj)相对于基线、安慰剂对照和/或未经治疗的患者,裂解的聚(adp
‑
核糖)聚合酶
‑
1(parp
‑
1)水平没有变化或降低;
268.(ak)相对于基线、安慰剂对照和/或未经治疗的患者,腰围没有变化或缩小;
269.(al)相对于基线、安慰剂对照和/或未经治疗的患者,ast与血小板比率指数(arpi)没有变化或降低;
270.(am)相对于基线、安慰剂对照和/或未经治疗的患者,肝脏炎症和纤维化(lif)分数没有变化或降低;
271.(an)相对于基线、安慰剂对照和/或未经治疗的患者,lok分数没有变化或降低;
272.(ao)相对于基线、安慰剂对照和/或未经治疗的患者,纤维化分数没有变化或降低;
273.(ap)相对于基线、安慰剂对照和/或未经治疗患者,king分数没有变化或降低;
274.(aq)相对于基线、安慰剂对照和/或未经治疗的患者,bonacini分数没有变化或降低;
275.(ar)相对于基线、安慰剂对照和/或未经治疗的患者,瞬时弹性成像(te)分数没有
变化或降低;
276.(as)相对于基线、安慰剂对照和/或未经治疗的患者,血管粘附分子没有提高或降低;
277.(at)相对于基线、安慰剂对照和/或未经治疗的患者,心血管风险蛋白没有提高或降低;
278.(au)相对于基线、安慰剂对照和/或未经治疗的患者,趋化因子没有提高或降低;和/或
279.(av)相对于基线、安慰剂对照和/或未经治疗的患者,肿瘤坏死因子受体超家族成员没有提高或降低。
280.在一个实施例中,本发明的方法包含在向受试者或受试者组给药之前测量上文(a)
‑
(av)中所述的一种或多种标记物或参数的基线水平。在另一个实施例中,所述方法包含在测定(a)
‑
(av)中所述的一种或多种标记物或参数的基线水平后向受试者施用本文公开的组合物,随后对所述一种或多种标记物进行另外的测量。
281.在另一个实施例中,在用本发明的组合物治疗后,例如在约1至约12周、约1至约8周或约1至约4周的时间段内,受试者或受试者组表现出以上刚刚描述的结果(a)
‑
(av)中的任何2项或更多项、任何3项或更多项、任何4项或更多项、任何5项或更多项、任何6项或更多项、任何7项或更多项、任何8项或更多项、任何9项或更多项、任何10项或更多项、任何11项或更多项、任何12项或更多项、任何13项或更多项、任何14项或更多项、任何15个或更多项、任何16个或更多项、任何17项或更多项、任何18项或更多项、任何19项或更多项、任何20项或更多项、任何21项或更多项,或所有22项。
282.在另一个实施例中,在用本发明的组合物治疗时,所述受试者或受试者组表现出以下的一个或多个结果:
283.(a)相对于基线、安慰剂对照,和/或未经治疗的患者,血清alt和/或ast水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
284.(b)相对于基线、安慰剂对照,和/或未经治疗的患者,bun水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
285.(c)相对于基线、安慰剂对照,和/或未经治疗的患者,纤维化面积没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
286.(d)相对于基线、安慰剂对照,和/或未经治疗的患者,空腹血糖水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
287.(e)相对于基线、安慰剂对照,和/或未经治疗的患者,胰岛素没有提高或降低至少
约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
288.(f)相对于基线、安慰剂对照,和/或未经治疗的患者,alp水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
289.(g)相对于基线、安慰剂对照,和/或未经治疗的患者,hb1ac水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
290.(h)相对于基线、安慰剂对照,和/或未经治疗的患者,homa
‑
ir水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
291.(i)相对于基线、安慰剂对照,和/或未经治疗的患者,脂肪组织
‑
ir没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
292.(j)相对于基线、安慰剂对照,和/或未经治疗的患者,总胆固醇水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
293.(k)相对于基线、安慰剂对照,和/或未经治疗的患者,甘油三酯水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
294.(l)相对于基线、安慰剂对照,和/或未经治疗的患者,甘油二酯水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
295.(m)相对于基线、安慰剂对照,和/或未经治疗的患者,vldl
‑
c水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
296.(n)相对于基线、安慰剂对照,和/或未经治疗的患者,rlp
‑
c水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
297.(o)相对于基线、安慰剂对照,和/或未经治疗的患者,非hdl
‑
c水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
298.(p)相对于基线、安慰剂对照,和/或未经治疗的患者,hdl
‑
c水平没有降低或提高至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
299.(q)相对于基线、安慰剂对照,和/或未经治疗的患者,ldl
‑
c水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
300.(r)相对于基线、安慰剂对照,和/或未经治疗的患者,肾羟脯氨酸水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
301.(s)相对于基线、安慰剂对照,和/或未经治疗的患者,il
‑
33水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
302.(t)相对于基线、安慰剂对照,和/或未经治疗的患者,il
‑
17水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
303.(u)相对于基线、安慰剂对照,和/或未经治疗的患者,ahr水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
304.(v)相对于基线、安慰剂对照,和/或未经治疗的患者,tl1a水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
305.(w)相对于基线、安慰剂对照,和/或未经治疗的患者,tnf
‑
α水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
306.(x)相对于基线、安慰剂对照,和/或未经治疗的患者,il
‑
13水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、
至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
307.(y)相对于基线、安慰剂对照,和/或未经治疗的患者,il
‑
6水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
308.(z)相对于基线、安慰剂对照,和/或未经治疗的患者,il
‑
1β水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
309.(aa)相对于基线、安慰剂对照,和/或未经治疗的患者,1型胶原水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
310.(bb)相对于基线、安慰剂对照,和/或未经治疗的患者,tgf
‑
β水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
311.(cc)相对于基线、安慰剂对照,和/或未经治疗的患者,α
‑
sma没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
312.(dd)相对于基线、安慰剂对照,和/或未经治疗的患者,tnrsf11a没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
313.(ee)相对于基线、安慰剂对照,和/或未经治疗的患者,prss2水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%。
314.(ff)相对于基线、安慰剂对照,和/或未经治疗的患者,aoc3水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
315.(gg)相对于基线、安慰剂对照,和/或未经治疗的患者,lilbr1水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
316.(hh)相对于基线、安慰剂对照,和/或未经治疗的患者,tr水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至
少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
317.(ii)相对于基线、安慰剂对照,和/或未经治疗的患者,pi3没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
318.(jj)相对于基线、安慰剂对照,和/或未经治疗的患者,saa4水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
319.(kk)相对于基线、安慰剂对照,和/或未经治疗的患者,mcp
‑
1水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
320.(ll)相对于基线、安慰剂对照,和/或未经治疗的患者,ccl16水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
321.(mm)相对于基线、安慰剂对照,和/或未经治疗的患者,tlt2水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
322.(nn)相对于基线、安慰剂对照,和/或未经治疗的患者,dpp4水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
323.(oo)相对于基线、安慰剂对照,和/或未经治疗的患者,timp
‑
1水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
324.(pp)相对于基线、安慰剂对照,和/或未经治疗的患者,pai
‑
1水平没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
325.(qq)相对于基线、安慰剂对照,和/或未经治疗的患者,nfs没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
326.(rr)相对于基线、安慰剂对照,和/或未经治疗的患者,fib
‑
4水平没有提高或降低
至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
327.(ss)相对于基线、安慰剂对照,和/或未经治疗的患者,至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
328.(tt)相对于基线、安慰剂对照,和/或未经治疗的患者,肝脂肪含量没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
329.(uu)相对于基线、安慰剂对照,和/或未经治疗的患者,甘油磷脂水平没有降低或提高至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
330.(vv)相对于基线、安慰剂对照,和/或未经治疗的患者,血压没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
331.(ww)相对于基线、安慰剂对照,和/或未经治疗的患者,elf分数没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
332.(zz)相对于基线、安慰剂对照,和/或未经治疗的患者,肺和/或皮肤成纤维细胞分数中胶原产生没有提高或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
333.(yy)相对于基线、安慰剂对照,和/或未经治疗的患者,葡萄糖摄取没有减少或增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
334.(zz)相对于基线、安慰剂对照,和/或未经治疗的患者,肺和/或皮肤成纤维细胞活力提高至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
335.(ab)相对于基线、安慰剂对照,和/或未经治疗的患者,il
‑
8水平分数没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约
70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
336.(ac)相对于基线、安慰剂对照和/或未经治疗的患者,il
‑
23水平没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、的至少约75%、至少约80%、至少约85%、至少约90%或至少约95%水平;和/或
337.(ad)相对于基线、安慰剂对照,和/或未经治疗的患者,il
‑
11水平分数没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
338.(ae)相对于基线、安慰剂对照,和/或未经治疗的患者,ifnγ水平没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
339.(af)相对于基线、安慰剂对照,和/或未经治疗的患者,t和/或b细胞活化没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
340.(ag)相对于基线、安慰剂对照,和/或未经治疗的患者,趋化性没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
341.(ah)相对于基线、安慰剂对照,和/或未经治疗的患者,bcl
‑
2家族成员没有变化或减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
342.(ai)相对于基线、安慰剂对照,和/或未经治疗的患者,半胱天冬酶的活化片段水平没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
343.(aj)相对于基线、安慰剂对照,和/或未经治疗的患者,裂解的parp
‑
1水平没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
344.(ak)相对于基线、安慰剂对照,和/或未经治疗的患者,腰围没有变化或减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
345.(al)相对于基线、安慰剂对照,和/或未经治疗的患者,arpi没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少
约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
346.(am)相对于基线、安慰剂对照,和/或未经治疗的患者,lif分数没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
347.(an)相对于基线、安慰剂对照,和/或未经治疗的患者,lok分数没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
348.(ao)相对于基线、安慰剂对照,和/或未经治疗的患者,纤维化分数没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
349.(ap)相对于基线、安慰剂对照,和/或未经治疗的患者,king分数没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
350.(aq)相对于基线、安慰剂对照,和/或未经治疗的患者,bonacini分数没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;和/或
351.(ar)相对于基线、安慰剂对照,和/或未经治疗的患者,te分数没有变化或降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%。
352.(as)相对于基线、安慰剂对照,和/或未经治疗的患者,血管粘附分子增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
353.(at)相对于基线、安慰剂对照,和/或未经治疗的患者,心血管风险蛋白增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;
354.(au)相对于基线、安慰剂对照,和/或未经治疗的患者,趋化因子增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;以及
355.(av)相对于基线、安慰剂对照,和/或未经治疗的患者,肿瘤坏死因子受体超家族
chemical industries,japan))混合并在室温下孵育25分钟。然后将样本与ehrlich溶液(例如400μl)混合并在65℃下加热20分钟以显色。将样本在冰上冷却并离心除去沉淀后,在560纳米(nm)处测量各上清液的光密度。根据羟脯氨酸标准曲线来计算羟脯氨酸的浓度。使用二辛可宁(bca)蛋白质测定试剂盒(美国的赛默飞世尔科技公司(thermo fisher scientific,usa)测定肾样本的蛋白质浓度,并用于归一化计算的羟脯氨酸值。肾羟脯氨酸含量表示为微克(μg)/mg蛋白质。
368.组织病理学分析:为了显现胶原沉积,使用picro
‑
sirius红溶液(德国的瓦尔德克公司(waldeck,germany))将肾切片染色。为了量化间质纤维化区域,使用数码相机(例如,dfc295;德国的徕卡显微系统公司(leica microsystems,germany)),200倍放大率,捕获皮质髓质区的亮视场图像,使用imagej软件(美国国立卫生研究院(national institute of health,usa))测量5个视野/切片中的阳性面积。
369.定量rt
‑
pcr:根据制造商的说明书,使用rnaiso(日本的宝生物工程株式会社(takara bio,japan))从肾样本中提取总核糖核酸(rna)。使用含有4.4微摩尔(mm)氯化镁(mgcl2)(瑞士的豪夫迈
·
罗氏有限公司(f.hoffmann
‑
la roche,switzerland)),40u rna酶抑制剂(日本的东洋纺公司(toyobo,japan)),0.5mm dntp(美国的普洛麦格公司(promega,usa)),6.28μm随机六聚体(普洛麦格公司),5x第一链缓冲液(普洛麦格公司),10mm二硫苏糖醇(美国的英杰公司(invitrogen,usa))和200u mlv
‑
rt(英杰公司),终体积为20μl。反应在37℃下进行1小时,然后在99℃下进行5分钟。使用实时pcr dice和tb green
tm premix ex taq
tm ii(宝生物工程株式会社)进行实时pcr。为了计算相对microrna(mrna)表达水平,将每种基因(例如α
‑
sma、timp
‑
1、tgf
‑
β和1型胶原)的表达相对于参照基因36b4(基因符号:rplp0)的表达归一化。关于pcr引物组和板布局的信息描述于表1和2中。
370.表1.用于定量rt
‑
pcr测定的pcr引物
[0371][0372]
表2.关于定量rt
‑
pcr测定的pcr板的细节
[0373][0374]
样本采集:对于血清样本,通过直接心脏穿刺在不含抗凝剂的血清分离管中采集非空腹血液,并在4℃下以3,500x g离心4分钟。采集上清液并储存在
‑
80℃下用于运输。对于肾脏样本,采集左肾并水平切成2片。将左肾上部固定在bouin氏液中,然后包埋在石蜡中。石蜡块在室温下储存,用于组织学分析。将左肾下部冠状切成2片。将左肾的前部在液氮中快速冷冻并储存在
‑
80℃用于基因表达测定。将左肾的后部在液氮中快速冷冻并储存在
‑
80℃用于肾生物化学。
[0375]
统计学检验:在graphpad prism 6(美国的graphpad software公司(graphpad software inc.,usa))上使用bonferroni多重比较检验进行统计学分析。p值<0.05被认为具有统计学显著性。当单尾t检验返回p值<0.1时,认为有趋势。结果表示为平均值
±
sd。
[0376]
1.2实验设计和治疗
[0377]
研究设计包括以下研究组:
[0378]
·
第1组(假手术对照):八只被做假手术小鼠保持无任何处理直到处死。
[0379]
·
第2组(媒剂):从第0天至第13天每天一次让八只uuo小鼠口服体积为10ml/kg的媒剂[0.5%hpmc]。
[0380]
·
第3组(ds109低):从第0天至第13天每天一次让八只uuo小鼠口服补充有5mg/kg剂量的ds109的媒剂。
[0381]
·
第4组(ds109中):从第0天至第13天每天一次让八只uuo小鼠口服补充有50mg/kg剂量的ds109的媒剂。
[0382]
·
第5组(ds109高):从第0天至第13天每天一次让八只uuo小鼠口服补充有250mg/kg剂量的ds109的媒剂。
[0383]
·
第6组(ds102低):从第0天至第13天每天一次让八只uuo小鼠口服补充有50mg/kg剂量的ds102的媒剂。
[0384]
·
第7组(ds102高):从第0天至第13天每天一次让八只uuo小鼠口服补充有500mg/kg剂量的ds102的媒剂。
[0385]
表3总结了研究期间组1至7中每一组的治疗时间表。
[0386]
表3.治疗时间表总结
[0387][0388]
动物监测和处死:每天监测小鼠的活力、临床体征和行为。在治疗期间治疗前每天测量个体的体重。每次给药后约60分钟观察小鼠的毒性、濒死和死亡的显著临床体征。在第14天,在异氟烷(isoflurane)麻醉(辉瑞制药公司(pfizer inc))下通过直接心脏穿刺放血处死动物。
[0389]
1.3结果
[0390]
体重变化和一般考虑:图2示出了所有动物的体重变化。所有动物术后体重均下降,治疗期间逐渐恢复。从第2天到第5天和从第10天到第11天,媒剂组的平均体重显著低于假手术对照组。媒剂组和治疗组之间在治疗期间的任何一天平均体重没有显著变化。治疗期间所有组均无死亡动物。在本研究中,没有动物表现出一般状况的恶化。
[0391]
处死当天的体重和肾脏重量:图3和表4示出了处死当天动物的体重。在处死当天,假手术对照组和媒剂组之间的平均体重没有显著差异。在处死当天,媒剂组和治疗组之间的平均体重没有显著差异。
[0392]
表4.处死当天的体重
[0393][0394]
图4a至4d和表4示出了处死当天动物的肾重和肾重/体重比。与假手术对照组相比,媒剂组示出了平均右肾重的显著增加。然而,媒剂组与治疗组之间在平均右肾重上不存在显著差异。与假手术对照组相比,媒剂组的平均右肾/体重比也显著增加。媒剂组和治疗
组之间的平均右肾/体重比没有显著差异。与假手术对照组相比,媒剂组的平均左肾重也显著增加。媒剂组与治疗组之间在平均左肾重上不存在显著差异。最后,与假手术对照组相比,媒剂组示出了平均左肾/体重比的显著增加,但是媒剂组与治疗组之间的平均左肾/体重比没有显著差异。
[0395]
肾化学:图5和表5示出了动物的肾羟脯氨酸含量。与假手术对照组相比,媒剂组示出肾羟脯氨酸含量显著增加。与媒剂组相比,“ds109低”、“ds109高”、“ds102低”和“ds102高”组示出肾羟脯氨酸含量显著降低。媒剂组与“ds109中”组之间的肾羟脯氨酸含量无显著差异。
[0396]
表5.肾羟脯氨酸含量
[0397]
组肾羟脯氨酸(μg/mg总蛋白)假手术对照,(n=8)3.02
±
1.89媒剂,(n=8)16.67
±
7.83ds109低,(n=8)9.94
±
2.02ds109中,(n=8)13.94
±
6.44ds109高,(n=8)8.30
±
1.04ds102低,(n=8)8.47
±
2.08ds102高,(n=8)8.59
±
1.99
[0398]
组织学分析:图6a至6g和表6示出了天狼星红染色,而图7示出了动物的纤维化区域。图6a显示了天狼星红染色的肾切片的代表性显微照片。与假手术对照组相比,媒剂组示出了纤维化面积百分比(天狼星红阳性面积)显著增加。bonferroni多重比较显示,与媒剂组相比,“ds109中”组中的纤维化面积倾向于减小。媒剂组与其他治疗组之间的纤维化面积没有显著差异。由于存在显著离群值,进行了mann
‑
whitney u检验,结果显示“ds109低”、“ds109中”、“ds109高”、“ds102低”和“ds102高”组的纤维化面积与媒剂组相比倾向于减小(p<0.1)。
[0399]
表6.动物的纤维化面积
[0400]
组天狼星红阳性面积(%)天狼星红阳性面积(%)_中位数假手术对照,(n=8)0.63
±
0.220.51
±
0.15媒剂,(n=8)5.00
±
1.374.55
±
0.94ds109低,(n=8)4.23
±
1.903.22
±
1.47ds109中,(n=8)3.58
±
1.043.28
±
1.41ds109高,(n=8)4.71
±
0.963.76
±
0.81ds102低,(n=8)5.01
±
3.114.19
±
3.33ds102高,(n=8)4.01
±
1.923.08
±
1.16
[0401]
基因表达分析:α
‑
sma、timp
‑
1、tgf
‑
β、1型胶原的基因表达分析示于图8a至8d和表7中。
[0402]
表7.基因表达分析
[0403]
组α
‑
smatimp
‑
1tgf
‑
β1型胶原假手术对照,(n=8)1.00
±
0.181.00
±
0.141.00
±
0.091.00
±
0.13
媒剂,(n=8)3.82
±
0.58133.20
±
26.863.88
±
0.3011.52
±
2.15ds109低,(n=8)3.87
±
0.82153.60
±
37.124.29
±
0.9310.76
±
1.45ds109中,(n=8)4.61
±
3.15167.70
±
122.606.01
±
4.7715.23
±
11.52ds109高,(n=8)4.85
±
1.22180.90
±
23.125.48
±
0.3613.88
±
1.91ds102低,(n=8)3.74
±
0.81138.30
±
30.394.31
±
0.6911.80
±
1.78ds102高,(n=8)5.54
±
1.54124.80
±
28.605.37
±
0.7614.09
±
2.88
[0404]
α
‑
sma:与假手术对照组相比,媒剂组示出α
‑
sma mrna表达水平的显著增加。媒剂组与治疗组之间的α
‑
sma mrna表达水平没有显著差异。
[0405]
timp
‑
1:与假手术对照组相比,媒剂组示出timp
‑
1 mrna表达水平显著增加。媒剂组和治疗组之间的timp
‑
1 mrna表达水平没有显著差异。
[0406]
tgf
‑
β:与假手术对照组相比,媒剂组示出tgf
‑
βmrna表达水平显著增加。媒剂组和治疗组之间的tgf
‑
βmrna表达水平没有显著差异。
[0407]
1型胶原:与假手术对照组相比,媒剂组示出了1型胶原mrna表达水平的显著增加。媒剂组与治疗组之间在1型胶原mrna表达水平上不存在显著差异。
[0408]
1.4总结
[0409]
如天狼星红染色和肾羟脯氨酸含量所示,在本研究中在媒剂组中出现肾纤维化。
[0410]
ds109:与媒剂组相比,用低剂量的ds109治疗示出肾羟脯氨酸含量的显著降低(p<0.05)和纤维化面积的减小趋势(p<0.1)。与媒剂组相比,用中等剂量的ds109治疗示出纤维化面积的减小趋势(p<0.1)。最后,与媒剂组相比,用高剂量的ds109治疗示出肾羟脯氨酸含量的显著降低(p<0.05)和纤维化面积的减小趋势(p<0.1)。
[0411]
ds102:与媒剂组相比,用低剂量ds102治疗示出肾羟脯氨酸含量的显著降低(p<0.05)和纤维化面积的减小趋势(p<0.1)。与媒剂组相比,用高剂量的ds102治疗示出肾羟脯氨酸含量的显著降低(p<0.05)和纤维化面积的减小趋势(p<0.1)。
[0412]
总之,本研究的结果表明ds109和ds102对肾纤维形成具有抑制作用,并且具有作为发展成纤维化的慢性肾病的治疗剂的潜力。
[0413]
实例2:胆汁淤积性肝病和/或肝纤维化胆道结扎(bdl)研究
[0414]
本研究的目的是检测ds012对bdl引起的胆汁淤积的作用。
[0415]
图9描绘了从手术和治疗到研究第14天的研究设计。
[0416]
1.1材料和方法
[0417]
待测物质:本研究的待测物质为ds102。为了制备每种物质的给药溶液,将ds102在0.5%羟丙基甲基纤维素(hpmc)的媒剂中稀释。
[0418]
bdl手术:在研究的第0天,在戊巴比妥(pentobarbital)(日本的共立制药公司(kyoritsu seiyaku,japan))麻醉下进行bdl手术。首先剃除小鼠毛发,切开腹腔,用7
‑
0手术丝结扎胆总管两次。用缝合线缝合小鼠的腹膜和皮肤,并将小鼠转移到干净的笼子(例如,休息笼子)中直至从麻醉中恢复。被做了假手术的小鼠的胆总管暴露但未结扎。
[0419]
药物施用:ds102以10毫升(ml)/千克(kg)的量口服。
[0420]
治疗剂量:ds102以50、250和500毫克(mg)/kg的3个剂量水平从研究的第0天至第13天每天施用一次。
[0421]
动物:无病原体的6周龄雄性c57bl/6j小鼠获自japan slc公司.(日本)。将动物在
温度(例如,23
±
2℃),湿度(例如,45
±
10%),光照(例如,12小时人工光照和黑暗循环;光照从8:00到20:00)并且有空气交换的受控条件下维持在无特定病原体(spf)设施中。在实验室中保持高压以防止设施被污染。将动物圈养在tpx笼(clea japan公司)中,每笼最多4只小鼠。将无菌paper
‑
clean(japan slc公司)用于铺垫,并每周更换一次。随意提供无菌固体正常饮食,置于笼子顶部的金属盖中。还从配备有橡胶塞和吸管的水瓶中随意提供纯水。水瓶每周更换一次,清洁,在高压灭菌器中灭菌并重复使用。通过耳打孔器识别小鼠,并用特定的识别码标记每个笼子。
[0422]
血清生物化学的测量:为了显现胶原沉积,使用picro
‑
sirius红溶液(德国的瓦尔德克公司)将bouin固定的肝切片染色。对于纤维化区域的定量分析,使用数码相机(dfc295;德国的徕卡公司(leica,germany)),100倍放大率,捕获皮质髓质区的亮视场图像,使用imagej软件(美国国立卫生研究院)测量5个视野/切片中的阳性面积。
[0423]
组织学分析:为了显现胶原沉积,使用picro
‑
sirius红溶液(德国的瓦尔德克公司)将肾切片染色。为了量化间质纤维化区域,使用数码相机(例如,dfc295;德国的徕卡显微系统公司),200倍放大率,捕获皮质髓质区的亮视场图像,使用imagej软件(美国国立卫生研究院)测量5个视野/切片中的阳性面积。
[0424]
定量rt
‑
pcr:根据制造商的说明书,使用rnaiso(日本的宝生物工程株式会社)从肝脏样本中提取总核糖核酸(rna)。使用含有4.4mm氯化镁(mgcl2)(瑞士的豪夫迈
·
罗氏有限公司),40u rna酶抑制剂(日本的东洋纺公司),0.5mm dntp(美国的普洛麦格公司),6.28μm随机六聚体(普洛麦格公司),5x第一链缓冲液(普洛麦格公司),10mm二硫苏糖醇(美国的英杰公司)和200u mlv
‑
rt(英杰公司),终体积为20μl。反应在37℃下进行1小时,然后在99℃下进行5分钟。使用实时pcr dice和tb green
tm premix ex taq
tm ii(宝生物工程株式会社)进行实时pcr。为了计算相对mrna表达水平,将每个基因(α
‑
sma、timp
‑
1、tgf
‑
β和1型胶原)的表达相对于参照基因36b4(基因符号:rplp0)的表达归一化。关于pcr引物组和板布局的信息描述于表8和9中。
[0425]
表8.用于定量rt
‑
pcr测定的pcr引物
[0426][0427]
表9.关于定量rt
‑
pcr测定的pcr板的细节
[0428][0429]
样本采集:对于血清样本,通过直接心脏穿刺在不含抗凝剂的血清分离管中采集非空腹血液,并在4℃下以3,500x g离心4分钟。采集上清液并在储存用于生物化学(30μl)和运输(所有剩余的)。对于肝样本,采集左侧叶并切成6片。将两片左侧叶固定在bouin氏液中,然后包埋在石蜡中。将样本储存在室温下用于组织学分析。将另外2片左外侧叶包埋在o.c.t.化合物中,并在液氮中速冻。将样本储存在下。将左侧叶的剩余切片在液氮中快速冷冻并在
‑
80℃下储存用于基因表达分析。将右中叶、左中叶、右叶和尾叶在液氮中快速冷冻并在
‑
80℃下储存用于运输。
[0430]
统计学检验:在graphpad prism 6(美国的graphpad software公司)上使用bonferroni多重比较检验进行统计学分析。p值<0.05被认为具有统计学显著性。当单尾t检验返回p值<0.1时,认为有趋势。结果表示为平均值
±
sd。
[0431]
1.2实验设计和治疗
[0432]
研究设计包括以下研究组:
[0433]
·
第1组(假手术对照):八只被做假手术小鼠保持无任何处理直到处死。
[0434]
·
第2组(媒剂):从第0天至第13天每天一次让十五只经过bdl手术的小鼠口服体
积为10ml/kg的媒剂[0.5%hpmc]。
[0435]
·
第3组(ds102低):从第0天至第13天每天一次让十五只经过bdl手术的小鼠口服补充有50mg/kg剂量的ds102的媒剂。
[0436]
·
第4组(ds102中):从第0天至第13天每天一次让十五只经过bdl手术的小鼠口服补充有250mg/kg剂量的ds102的媒剂。
[0437]
·
第5组(ds102高):从第0天至第13天每天一次让十五只经过bdl手术的小鼠口服补充有500mg/kg剂量的ds102的媒剂。
[0438]
表10总结了研究期间组1至5中每一组的治疗时间表。
[0439]
表10.治疗时间表总结
[0440][0441]
动物监测和处死:每天监测小鼠的活力、临床体征和行为。在治疗期间治疗前每天测量个体的体重。每次给药后约60分钟观察小鼠的毒性、濒死和死亡的显著临床体征。在bdl手术后第14天,在异氟烷(isoflurane)麻醉(辉瑞制药公司)下通过直接心脏穿刺放血处死动物。
[0442]
1.3结果
[0443]
体重变化和一般考虑:图10示出了所有动物的体重变化。除假手术对照组外,所有组的平均体重在研究期间逐渐降低。从第2天到第14天,媒剂组的平均体重显著低于假手术对照组。在研究期间,媒剂组和ds102治疗组之间在任何一天的平均体重没有显著变化。
[0444]
在治疗期间,在达到第14天之前发现死亡的小鼠如下:在媒剂组中发现15只小鼠中有3只死亡;在“ds102低”、“ds102中”和“ds102高”组中发现15只小鼠中有7只死亡。在该模型中,预期死亡百分比仅由于疾病诱导,并且观察到的死亡率与历史数据一致。
[0445]
处死当天的体重和肝量:图11和表11示出了处死当天动物的体重。与假手术对照组相比,媒剂组在处死当天示出平均体重的显著降低。在处死当天,媒剂组和ds102治疗组之间的平均体重没有显著差异。
[0446]
表11.处死当天的体重
[0447]
组体重(g)肝量(mg)肝重/体重比(%)假手术对照,(n=8)23.1
±
0.71132
±
904.9
±
0.4媒剂,(n=12)16.8
±
1.81438
±
1808.7
±
1.4ds102低,(n=8)17.4
±
2.91392
±
3288.3
±
2.3ds102中,(n=8)17.0
±
2.41513
±
1829.0
±
1.2ds102高,(n=8)16.4
±
1.61231
±
2557.6
±
1.5
[0448]
图12a和12b和表11示出了处死当天动物的肝量和肝重/体重比。与假手术对照组相比,媒剂组的平均肝量显著增加。与媒剂组相比,“ds102高”组的平均肝量倾向于降低。媒剂组与其他治疗组之间在平均肝量上不存在显著差异。与假手术对照组相比,媒剂组的平
均肝重/体重比显著增加。与媒剂组相比,“ds102高”组的平均肝重/体重比倾向于降低。媒剂组与其他治疗组之间在平均肝重/体重比方面不存在显著差异。
[0449]
生物化学:图13和表12示出了动物的血清转氨酶(alt)。与假手术对照组相比,媒剂组示出血清alt水平显著增加。媒剂组和ds102治疗组之间的血清alt水平没有显著差异。然而,根据该模型的历史数据,已知alt水平在没有治疗的第14天降低。这样,这可能影响检测各组间差异的能力。
[0450]
表12.生物化学
[0451]
组血清alt(u/l)血清总胆红素(mg/dl)假手术对照,(n=8)22
±
20.4
±
0.1媒剂,(n=12)335
±
18524.9
±
9.6ds102低,(n=8)402
±
11226.8
±
6.9ds102中,(n=8)351
±
15523.5
±
9.8ds102高,(n=8)383
±
14726.2
±
6.1
[0452]
图14和表12示出了动物的血清总胆红素。与假手术对照组相比,媒剂组示出了血清总胆红素水平显著增加。媒剂组和ds102治疗组之间的血清总胆红素水平没有显著差异。
[0453]
组织学分析:图15a至14e和表13示出了天狼星红染色,图16示出了动物的纤维化区域。图14a显示天狼星红染色的肝脏切片的代表性显微照片。与假手术对照组相比,媒剂组的肝切片示出肝小叶的门静脉区域中的胶原沉积和pv
‑
cv或pv
‑
pv桥接纤维化增加。与假手术对照组相比,媒剂组示出了纤维化面积(天狼星红阳性面积)显著增加。与媒剂组相比,“ds102中”组示出了纤维化面积显著缩小。与媒剂组相比,“ds102高”组的纤维化面积趋于缩小。媒剂组与“ds102低”组之间的纤维化面积没有显著差异。
[0454]
表13.组织学分析
[0455]
组天狼星红阳性面积(%)假手术对照,(n=8)0.46
±
0.25媒剂,(n=12)1.93
±
0.67ds102低,(n=8)1.70
±
0.63ds102中,(n=8)1.06
±
0.48ds102高,(n=8)1.42
±
0.60
[0456]
基因表达分析:α
‑
sma、timp
‑
1、tgf
‑
β和1型胶原的基因表达分析示于图17a至17d和表14中。
[0457]
表14.基因表达分析
[0458]
组α
‑
smatimp
‑
1tgf
‑
β1型胶原假手术对照,(n=8)1.00
±
0.241.00
±
0.821.00
±
0.081.00
±
0.24媒剂,(n=12)2.98
±
2.1633.09
±
13.751.65
±
0.444.77
±
2.53ds102低,(n=8)3.21
±
1.6743.82
±
26.191.48
±
0.484.94
±
2.76ds102中,(n=8)2.66
±
1.3330.65
±
16.801.50
±
0.444.21
±
1.90ds102高,(n=8)1.42
±
0.7516.09
±
10.161.00
±
0.232.51
±
1.39
[0459]
α
‑
sma:与假手术对照组相比,媒剂组示出α
‑
sma mrna表达水平的显著增加。与媒
剂组相比,“ds102高”组中的α
‑
sma mrna表达水平倾向于降低。媒剂组和ds102治疗组之间的α
‑
sma mrna表达水平没有显著差异。
[0460]
timp
‑
1:与假手术对照组相比,媒剂组示出了timp
‑
1 mrna表达水平显著增加。与媒剂组相比,“ds102高”组中的timp
‑
1 mrna表达水平倾向于降低。媒剂组和ds102治疗组之间timp
‑
1 mrna表达水平没有显著差异。
[0461]
tgf
‑
β:与假手术对照组相比,媒剂组示出了tgf
‑
βmrna表达水平的显著增加。与媒剂组相比,“ds102高”组示出了tgf
‑
βmrna表达水平的显著降低。媒剂组和ds102治疗组之间的tgf
‑
βmrna表达水平没有显著差异。
[0462]
1型胶原:与假手术对照组相比,媒剂组示出了1型胶原mrna表达水平显著增加。与媒剂组相比,“ds102高”组中的1型胶原mrna表达水平倾向于降低。媒剂组和ds102治疗组之间在1型胶原mrna表达水平上没有显著差异。
[0463]
1.4总结
[0464]
在本研究中,与假手术对照组相比,媒剂组中的生物化学参数(例如alt和总胆红素),组织学胶原沉积(例如纤维化面积)和基因表达水平(例如α
‑
sma、timp
‑
1、tgf
‑
β、1型胶原)显著增加。这些结果表明在媒剂组中建立了胆汁淤积和肝纤维化。
[0465]
与媒剂组相比,用中等剂量的ds102治疗示出了纤维化面积显著缩小(p<0.05)。与媒剂组相比,用高剂量的ds102治疗示出了tgf
‑
βmrna表达水平显著降低(p<0.05),并且纤维化面积、肝量、肝重/体重比、α
‑
sma、timp
‑
1和1型胶原mrna表达水平的降低趋势接近显著性(p<0.01)。这些结果表明,ds102抑制肝中多种促纤维化细胞因子的产生,对肝纤维化具有抑制作用,并且具有作为胆汁淤积性肝病的治疗剂的潜力。
[0466]
实例3:ds102对tgf
‑
β受体、信号传导和诱导的纤维化蛋白的作用
[0467]
本研究的目的是研究15
‑
hepe和15
‑
hepe ee对tgf
‑
β受体表达、tgf
‑
β诱导的细胞内信号传导和促纤维化上皮间质转化蛋白的影响。
[0468]
1.1材料和方法
[0469]
细胞毒性试验:在不同的肝(肝癌)细胞系中试验15
‑
hepe游离酸和乙酯的细胞毒性以了解试验系统中的浓度范围。
[0470]
转录活性:进行启动子(荧光素酶)测定以测量施用15
‑
hepe后tgfβ诱导的转录激活。
[0471]
用蔗糖梯度超速离心和共聚焦显微镜鉴定蔗糖引起的15
‑
hepe诱导的tgf
‑
β受体的微区易位。在37℃下用100μm的15
‑
hepe和等体积的dmso(二甲亚砜)处理0、1、4和24小时的mv1lu细胞(貂肺上皮细胞)的质膜中进行tgf
‑
β受体的蔗糖密度梯度分析,并且使来自这些经处理细胞的细胞裂解物经受蔗糖密度梯度超速离心。然后使用抗tβr
‑
i(i型tgf
‑
β受体)、抗tβr
‑
ii(ii型tgf
‑
β受体)、抗tβr
‑
iii(iii型tgf
‑
β受体、β聚糖)、抗egfr(表皮生长因子受体)和抗小窝蛋白
‑
1抗体通过western印迹分析来分析蔗糖梯度级分。评估未处理细胞或用15
‑
hepe处理的细胞的质膜中的tβr
‑
i、tβr
‑
ii、tβr
‑
iii、egfr和小窝蛋白
‑
1的脂质筏/小窝和非脂质筏微区定位,以确定15
‑
hepe对tgf
‑
β受体的膜微区定位的作用。
[0472]
1.2结果
[0473]
测定15
‑
hepe对tgf
‑
β诱导的信号传导和细胞应答的作用。为了试验15
‑
hepe对tgf
‑
β诱导的信号传导的作用,试验了15
‑
hepe调节tgf
‑
β刺激的smad2磷酸化和核转位的活
性,这两者都是导致tgf
‑
β诱导的细胞应答的关键信号传导事件。tgf
‑
β的一种重要生物活性是负责上皮
‑
间质转化(emt)的基因的转录激活,emt是伤口愈合、组织纤维化和癌症进展中的关键事件。评价15
‑
hepe对hepg2和lxr细胞中tgfβ诱导的上皮间质转化相关蛋白(如纤连蛋白、pai
‑
1和n
‑
钙粘着蛋白等)表达的影响。将hepg2细胞(人肝癌细胞系)用递增剂量的15
‑
hepe阶段ii在含有0.1%fbs的dmem中处理1小时,并且用或不用200皮摩尔(pm)的tgf
‑
β连续刺激48小时。
[0474]
15
‑
hepe直接抑制tgf
‑
β信号传导,如图18a和18b中所示。具体地,图18a示出15
‑
hepe诱导ii型tgf
‑
β受体的降解并阻断tgf
‑
β诱导的上皮间质转化(emt)(即,促纤维化)蛋白产生。将hepg2细胞(人肝癌细胞系)用递增剂量的15
‑
hepe阶段ii在含有0.1%fbs的dmem中处理1小时,并且用或不用200皮摩尔(pm)的tgf
‑
β连续刺激48小时。图18a所示的两个面板是在相同实验条件下运行的两个单独的实验。来自这些单独实验的结果表明15
‑
hepe阻断tgf
‑
β诱导的emt蛋白产生和ii型tgf
‑
β受体的诱导的降解。图18a还示出了15
‑
hepe对纤溶酶原激活剂抑制剂
‑
1(pa
‑
1)(一种由tgf
‑
β诱导的并且与增加的心血管风险相关的蛋白质)的作用。图18b示出了15
‑
hepe抑制肝星状细胞中tgf
‑
β刺激的细胞内信号传导(例如,smad2/3磷酸化)。图18b中进行的实验包括用至100μm的递增浓度的ds102预处理lx2细胞(人肝星状细胞)24小时,然后用tgf
‑
β刺激30分钟。实验结果表明15
‑
hepe抑制tgf
‑
β刺激。
[0475]
在37℃下用100μm的15
‑
hepe和等体积的二甲亚砜(dmso)处理0、1、4和24小时的貂肺上皮细胞(mv1lu)的质膜中进行tgf
‑
β受体的15
‑
hepe蔗糖密度梯度分析,并且使来自这些经处理的细胞的细胞裂解物经受蔗糖密度梯度超速离心。然后使用抗tβr
‑
i(i型tgf
‑
β受体
‑
图18c)、抗tβr
‑
ii(ii型tgf
‑
β受体
‑
图18d)、抗tβr
‑
iii(iii型tgf
‑
β受体、β聚糖
‑
图18e)、抗egfr(表皮生长因子受体
‑
图18f)和抗小窝蛋白
‑
1抗体(图18g)通过western印迹分析来分析蔗糖梯度级分。级分4至5含有脂筏/小窝,而级分7至10是非脂筏级分。用15
‑
hepe处理不影响tβr
‑
i蛋白的丰度,但在24小时处理时诱导tβr
‑
i易位至脂筏(图18c)。星号(
★
)表明与对照和较短的处理持续时间相比,15
‑
hepe增加了级分中tβr
‑
i的丰度(24小时)(图18c)。15
‑
hepe从1至4小时诱导tβr
‑
ii易位并且在24小时处理时进一步诱导降解(图18d)。三角形(
▼
)表明与对照细胞相比,级分中的tβr
‑
ii易位和丰度降低(图18d)。在图18e、18f和18g中,15
‑
hepe不改变tβr
‑
iii、egfr和小窝蛋白
‑
1的定位和丰度。
[0476]
1.3总结
[0477]
因此,总之,这些结果表明游离酸或乙酯形式的15
‑
hepe,诱导ii型tgf
‑
β受体的易位和降解,阻断tgf
‑
β诱导促纤维化蛋白产生,并且抑制肝星状细胞中tgf
‑
β诱导的细胞内信号传导(smad2/3)。因此,15
‑
hepe和15
‑
hepe ee可直接抑制tgf
‑
β信号传导,结果支持15
‑
hepe和15
‑
hepe ee在治疗包括非酒精性脂肪性肝炎(nash)的多种纤维化疾病,其它纤维化疾病,心血管代谢疾病以及癌症的多种适应症中的治疗潜力。
[0478]
实例4:口服ds102对于nafld患者的功效
[0479]
本研究的目的是评估口服ds102胶囊与安慰剂相比对于治疗患有非酒精性脂肪肝疾病(nafld)的成年患者的安全性和功效。
[0480]
1.1研究终点
[0481]
主要终点:本研究的主要终点包括服用ds102的功效和安全性。基于血清丙氨酸转
氨酶(alt)从基线到第16周的变化和通过瞬时弹性成像测量的肝脏硬度从基线到第16周的变化来评估功效。根据每个治疗组中导致治疗中止的治疗突发不良事件(teae)的数量来评估安全性。
[0482]
次要终点:本研究的次要终点包括以下任一指标的变化:血清alt从基线到第2、4、8和12周;天冬氨酸转氨酶(ast)从基线到第2、4、8、12和16周;ast:alt比率从基线到第2、4、8、12和16周;纤维化
‑
4(fib
‑
4)指数从基线到第16周;nafld纤维化分数(nfs)从基线到第16周;通过按受控衰减参数(cap)度量的肝脂肪从基线到第16周的变化;增强的肝纤维化(elf)分数从基线到第16周;以及稳态模型评估胰岛素抗性(homa
‑
ir)和脂肪组织胰岛素抗性(脂肪组织
‑
ir)从基线到第2、4、8、12和16周。
[0483]
探索性分析:探索性分析包括对脂质和代谢参数的分析,包括总胆固醇、甘油三酯、极低密度脂蛋白胆固醇(vldl
‑
c)、低密度脂蛋白胆固醇(ldl
‑
c)、高密度脂蛋白胆固醇(hdl
‑
c)、非高密度脂蛋白胆固醇(非hdl
‑
c)、残粒样颗粒胆固醇(rlp
‑
c)、空腹血糖、胰岛素、游离脂肪酸和血红蛋白a1c(hba1c)。另外的探索性分析包括高通量脂质组学和蛋白质组学。
[0484]
1.2研究设计
[0485]
这是一项随机,安慰剂对照,双盲,平行组,多中心探索性iia期研究,旨在研究18
‑
75岁nafld患者口服ds102胶囊的安全性和功效以及两剂ds102和安慰剂之间的剂量
‑
反应关系。在本研究中研究了确认患有nafld患者的三个平行组,以在16周的治疗期内比较ds102的两种不同剂量与安慰剂。本研究计划包括96名可评价患者,给每个治疗组随机分配32名患者。
[0486]
研究包括28天的筛选期,16周的治疗期和4周的随访期。在筛选访视时,使用筛选检查评估患者。符合入选标准和不符合排除标准的患者入选。
[0487]
在图19中提供了本研究的总体时间范围的示意图。一旦患者入选参与研究,他们被限制使用任何其他针对nafld的治疗。被认为对患者是必要的,并且研究者认为不会干扰安全性和功效评估的任何药物(如处方药和非处方药(otc))或治疗干预,除非它们被包括在下面提供的“伴随药物”列表中,否则将继续使用。
[0488]
在比较治疗期开始之前,患者返回研究中心进行其疾病的基线评估,合格患者以1:1:1随机化随机分配到三个平行组治疗方案之一:
[0489]
·
治疗组a:2x安慰剂500mg胶囊,每天口服两次(每天4粒胶囊),持续16周。
[0490]
·
治疗组b:1x ds102 500mg胶囊和1x安慰剂500mg胶囊,每天口服两次(每天4粒胶囊),持续16周。
[0491]
·
治疗组c:2x ds102 500mg胶囊,每天口服两次(每天4粒胶囊),持续16周。
[0492]
为了维持双盲条件,ds102胶囊和安慰剂胶囊外观相同。
[0493]
1.3患者和筛选
[0494]
为了参与本研究,要求患者符合以下所有入选标准,并且必须不符合以下任何排除标准。在筛选访视(第1次访视)和治疗/基线访视(第2次访视)开始时验证入选和排除标准。
[0495]
本研究的入选标准如下:
[0496]
·
因影像学或组织学上存在肝脂肪变性而诊断为nafld但无任何继发性原因的患
者。
[0497]
·
筛选期间间隔7天或更多天两次alt≥1.5uln且<5uln的患者。
[0498]
·
筛选3个月内历史肝活检示出nash和/或≥f1纤维化或nfs≥
‑
1.455或fib
‑
4≥1.3或fibroscan≥8kpa的患者。
[0499]
·
体重指数(bmi)为25.0至40.0kg/m2的患者。研究中允许有受控肥胖或受控糖尿病病史的患者。
[0500]
·
研究者认为其研究前临床实验室结果不干扰其参与研究的患者。
[0501]
·
18至75岁的患者。
[0502]
·
女性患者和有具备生育能力的女性伴侣的男性患者在研究期间需要使用适当的避孕或具有灭菌伴侣。适当的避孕定义为:全身激素避孕药;结合杀精子剂的子宫内装置或屏障避孕方法;或同意禁欲,禁欲被定义为患者在与研究治疗相关的整个风险期中避免与异性性交并符合其首选和通常的生活方式。要求激素避孕药在基线之前稳定剂量至少一个月。
[0503]
·
能够与研究者沟通良好,理解并遵守研究要求,理解并签署书面知情同意书的患者。
[0504]
本研究的排除标准如下:
[0505]
·
入选前3个月内代谢状况不稳定(如体重变化>5%)的患者。
[0506]
·
有胃旁路手术、原位肝移植(olt)内科/外科病史或已被记录准备进行olt的患者。
[0507]
·
不受控制的2型糖尿病患者,即筛选时hba1c≥9%(75mmol/mol)。
[0508]
·
具有失代偿或严重肝病的患者,如以下一种或多种所证明:经证实的肝硬化或疑似肝硬化,食管静脉曲张,腹水,疑似门静脉高压,在筛选60天内住院治疗肝病,胆红素≥2x uln,或alt或ast≥5x uln。如果结合胆红素≤1.5x uln,则gilbert综合征患者符合条件。
[0509]
·
活动性或需要药物治疗的炎性肠病患者。
[0510]
·
患有诊断或怀疑的自身免疫疾病如全身性红斑狼疮(sle)和/或类风湿性关节炎(ra)的患者。
[0511]
·
除了被治疗的皮肤癌(基底细胞或鳞状细胞癌)之外,有活动性非肝恶性肿瘤史的患者。
[0512]
·
患有肝脏疾病以外的严重全身性或重大疾病的患者,包括冠状动脉疾病、脑血管疾病、肺部疾病、肾功能不全、严重精神疾病、呼吸或高血压疾病以及糖尿病和关节炎,研究者认为这些疾病妨碍了患者参与和完成研究。
[0513]
·
排除需要抗糖尿病治疗(包括胰岛素增敏剂)和/或降脂治疗且在筛选前至少3个月未服用稳定剂量的患者。如果患者依赖于胰岛素,该治疗应该在筛选前至少3个月开始,但是允许改变剂量。
[0514]
·
已知对研究治疗的任何成分过敏的患者。
[0515]
·
筛选时人免疫缺陷病毒(hiv)抗体,乙型肝炎表面抗原或丙型肝炎抗体检测呈阳性的患者。
[0516]
·
其他病因的肝病患者,如药物诱导的自身免疫性肝炎、原发性胆汁性胆管炎
(pbc)、原发性硬化性胆管炎(psc)、血色素沉着病、α
‑
1抗胰蛋白酶(a1at)缺乏或威尔逊氏病。
[0517]
·
研究者认为患者有明显的药物/溶剂滥用史。
[0518]
·
研究者认为有酗酒史或每周饮酒超过21个单位(男性)或每周饮酒超过14个单位(女性)的患者,其中一个单位由10ml或8mg纯酒精组成。
[0519]
·
在基线前4周内使用富含ω
‑
3或ω
‑
6脂肪酸的膳食补充剂的患者。
[0520]
·
在研究治疗的第一天给药之前的3个月内已经用试验药参与任何其他临床研究的患者。
[0521]
·
在试验期间怀孕、计划怀孕、哺乳和/或不愿意使用适当避孕的患者。
[0522]
·
研究者认为不适合参与本研究的患者。
[0523]
1.4研究执行
[0524]
在研究期间,在筛选访视后安排10次诊所访视:1次在比较治疗期/基线(第0天/第2次访视)开始、8次在比较治疗期(第2周/第3次访视、第4周/第4次访视、第6周/第5次访视、第8周/第6次访视、第10周/第7次访视、第12周/第8次访视、第14周/第9次访视、第16周/第10次访视)。如果患者未完成研究,则在第10次访视后4周或最后一次访视后2周进行最终安全性随访访视(第11次访视)。表17描述了针对研究的临床访视。
[0525]
表17.本研究临床访视的研究流程图
[0526]
[0527]
[0528][0529]
筛选访视(第1次访视):在筛选时访视以下内容
[0530]
筛选访视(第1次访视):获得知情同意书后,为患者分配患者筛选号。理想情况下,患者禁食。进行了以下筛选评估/样本采集:入选/排除标准的验证;人口统计数据;病史;体格检查;12
‑
导联心电图(ecg);生命体征(血压、心率和体温);用于临床实验室安全性试验(血液学、血清生物化学和凝血试验)的样本;病毒学;妊娠试验(有生育能力的女性患者);alt、ast试验(在筛选期间在两个场合测量的alt);以及伴随用药评估。当患者因不良事件(ae),难以遵守研究方案要求或疾病状态显著改变而需要在计划访视日期之间进行访视时,发生非计划访视。遵循医学上必要的所有程序。如果合格,在离开诊所前,指导患者在下次访视前不进食任何早餐,保证最短禁食8小时。
[0531]
治疗期:完成成功筛选访视后,患者开始比较治疗期(16周)。在比较治疗期开始时,在确认持续合格性之后,将患者随机分配到三种治疗方案之一。在整个比较治疗期间,患者每天两次服用ds102胶囊或安慰剂胶囊的分配的研究药物产品(imp)。在患者日志卡中记录imp的每一次自我服用。指导患者在早晨和晚上与食物一起或在食物之后服用ds102(例外是,在诊所第3次访视、4、6、8和10的早晨,指导患者在访视之前放弃服用ds102,而在诊所就诊之后尽快服用ds102)。在基线(第2次访视)、第2周(第3次访视)、第4周(第4次访视)、第8周(第6次访视)、第12周(第8次访视)、第16周(第10次访视)和第20周(第11次访视)开始时,询问患者在访视前是否禁食至少8小时。如果不是这种情况,则记录禁食的持续时间,并且关于禁食的持续时间,重新指导患者。然后给患者提供清淡早餐(例如茶或橙汁和吐司)。在基线(第2次访视),第8周(第8次访视)和第16周(第10次访视),在患者接受清早餐之前进行血液采样评估。当患者因不良事件(ae),难以遵守研究方案要求或疾病状态显著改变而需要在计划访视日期之间进行访视时,发生非计划访视。遵循医学上必要的所有程序。提前终止研究的患者在患者退出后尽快进行第10次访视的研究程序,以便记录所有与研究相关的信息。根据研究者的判断,在试验进行期间的任何时间进行尿doa和酒精呼吸试验。
[0532]
基线(第2次访视):患者在第2次访视时前往研究中心。进行首次采血评估。采血后进行以下评估:入选/排除标准验证;病史;体格检查;12导联ecg;药代动力学取样;生命体征(血压、心率和体温);用于临床实验室安全性试验(血液学、血清生物化学和凝血试验)的样本;脂质分布;尿分析;妊娠试验(有生育能力的女性患者);alt、ast试验;homa
‑
ir/脂肪组织
‑
ir;elf;肝脏硬度和cap;fib
‑
4;nfs(包括bmi);生物标记物血液样本;探索性血液样本;患者随机化;研究药物/安慰剂给药;ae评估;以及伴随用药评估。如果满足所有研究进入标准,研究者将患者随机分组,并向患者提供来自一个患者治疗包的指定imp或安慰剂。一旦完成所有基线评估,在该研究中心给予第一剂imp或安慰剂。患者在第0天晚上服用第二剂imp或安慰剂。然后每天施用两次胶囊。患者在返回研究中心访视(第3次访视)的早晨服用imp或安慰剂。在离开诊所前,指导患者在下次访视前不进食任何早餐,保证最短禁食8小时。
[0533]
第2周(第3次访视):患者在第3次访视返回研究中心。患者在第3次访视的早晨不服用imp或安慰剂。进行了以下评估:体格检查;药代动力学取样;生命体征(如血压、心率和体温);alt、ast试验;homa
‑
ir/脂肪组织
‑
ir;ae评估;以及伴随用药评估。返回imp或安慰剂,并向患者提供另外的imp或安慰剂。完成所有访视评估后,患者立即服用下一剂量的imp或安慰剂。胶囊继续每天给药两次。完成此次访视时,通知患者在两周后第4次访视时返回研究中心。患者在返回研究中心访视(第4次访视)的早晨不服用imp或安慰剂。在离开诊所前,指导患者在下次访视前不进食任何早餐,保证最短禁食8小时。
[0534]
第4周(第4次访视):患者在第4次访视返回研究中心。患者在第4次访视的早晨不服用imp或安慰剂。进行了以下评估:体格检查;药代动力学取样;生命体征(血压、心率和体温);用于临床实验室安全性试验(血液学、血清生化和凝血试验)的样本;妊娠试验(有生育能力的女性患者);alt、ast试验;homa
‑
ir/脂肪组织
‑
ir;ae评估;以及伴随用药评估。返回imp或安慰剂,并向患者提供另外的imp或安慰剂。完成所有访视评估后,患者立即服用下一剂量的imp或安慰剂。胶囊继续每天给药两次。完成此次访视时,通知患者在两周后第5次访视时返回研究中心。患者在返回研究中心访视(第5次访视)的早晨不服用imp或安慰剂。
[0535]
第6周(第5次访视):患者在第5次访视返回研究中心。进行了以下评估:ae评估和伴随用药评估。返回imp或安慰剂并向患者提供另外的imp或安慰剂。完成所有访视评估后,患者立即服用下一剂量的imp或安慰剂。胶囊继续每天给药两次。完成此次访视时,通知患者在两周后第6次访视时返回研究中心。患者在返回研究中心访视(第6次访视)的早晨不服用imp或安慰剂。在离开诊所前,指导患者在下次访视前不进食任何早餐,保证最短禁食8小时。
[0536]
第8周(第6次访视):患者在第6次访视返回研究中心。患者在第6次访视的早晨不服用imp或安慰剂。进行首次采血评估。采血后进行以下评估:体格检查;药代动力学取样;生命体征(血压、心率和体温);用于临床实验室安全性试验(血液学、血清生化和凝血试验)的样本;脂质分布;妊娠试验(有生育能力的女性患者);alt、ast试验;homa
‑
ir/脂肪组织
‑
ir;生物标记物血液样本;ae评估;以及伴随用药评估。返回imp或安慰剂并向患者提供另外的imp或安慰剂。完成所有访视评估后,患者立即服用下一剂量的imp或安慰剂。胶囊继续每天给药两次。完成此次访视时,通知患者在两周后第7次访视时返回研究中心。患者在返回研究中心访视(第7次访视)的早晨服用imp或安慰剂。
[0537]
第10周(第7次访视):患者在第7次访视返回研究中心。进行了以下评估:ae评估和伴随用药评估。返回imp或安慰剂,并向患者提供另外的imp或安慰剂。完成所有访视评估后,患者立即服用下一剂量的imp或安慰剂。胶囊继续每天给药两次。完成此次访视时,通知患者在两周后第8次访视时返回研究中心。患者在返回研究中心访视(第8次访视)的早晨不服用imp或安慰剂。在离开诊所前,指导患者在下次访视前不进食任何早餐,保证最短禁食8小时。
[0538]
第12周(第8次访视):患者在第8次访视返回研究中心。患者在第8次访视的早晨不服用imp或安慰剂。进行了以下评估:体格检查;药代动力学取样;生命体征(血压、心率和体温);用于临床实验室安全性试验(血液学、血清生物化学和凝血试验)的样本;妊娠试验(有生育能力的女性患者);alt、ast试验;homa
‑
ir/脂肪组织
‑
ir;ae评估;以及伴随用药评估。返回imp或安慰剂,并向患者提供另外的imp或安慰剂。完成所有访视评估后,患者立即服用下一剂量的imp或安慰剂。胶囊继续每天给药两次。完成此次访视时,通知患者在两周后第9次访视时返回研究中心。患者在返回研究中心访视(第9次访视)的早晨不服用imp或安慰剂。
[0539]
第14周(第9次访视):患者在第9次访视返回研究中心。进行了以下评估:ae评估和伴随用药评估。返回imp或安慰剂,并向患者提供另外的imp或安慰剂。完成所有访视评估后,患者立即服用下一剂量的imp或安慰剂。胶囊继续每天给药两次。完成此次访视时,通知患者需要在两周后在第10次访视时返回研究中心。患者不能在返回研究中心访视(第10次访视)的早晨服用imp或安慰剂。在离开诊所前,指导患者在下次访视前不进食任何早餐,保证最短禁食8小时。
[0540]
第16周(第10次访视)或提前退出:患者在第10次访视返回研究中心。患者在第10次访视的早晨不服用imp或安慰剂。进行首次采血评估。采血后进行以下评估:体格检查;12导联ecg;药代动力学取样;生命体征(血压、心率和体温);用于临床实验室安全性试验(血液学、血清生物化学和凝血试验)的样本;尿分析;脂质分布;妊娠试验(有生育能力的女性患者);alt、ast试验;homa
‑
ir/脂肪组织
‑
ir;elf;肝脏硬度和cap;fib
‑
4;nfs[包括bmi];生物标记物血液样本;探索性血液样本;ae评估;以及伴随用药评估。返回imp或安慰剂。没有发放另外的imp或安慰剂泡罩包装或患者日记卡。在本次访视完成研究评估后,继续进行研究限制。完成本次访视时,通知患者在4周后第11次访视时返回研究中心,以评估本次访视以来的任何ae(不良事件),并进行安全性和功效评估。在离开诊所前,指导患者在下次访视前不进食任何早餐,保证最短禁食8小时。
[0541]
随访访视(第20周/第11次访视):第10次访视后4周(或提前退出访视后2周),患者返回研究中心。进行以下评估:体格检查;药代动力学取样;生命体征(血压、心率和体温);用于临床实验室安全性试验(血液学、血清生化和凝血试验)的样本;妊娠试验(有生育能力的女性患者);alt、ast试验;homa
‑
ir/脂肪组织
‑
ir;生物标记物;ae评估;以及伴随用药评估。
[0542]
1.5评估
[0543]
功效评估包括:alt、ast、alt:ast比;homa
‑
ir/脂肪组织
‑
ir;elf;肝脏硬度和cap;fib
‑
4指数;和nfs。下面提供每个的详细描述。
[0544]
alt、ast、alt:ast比率:增加的肝酶(alt和ast)是肝损伤的标志,并且在第1次访
视/筛选(在筛选期间间隔7天或更多天的两个时机),第2次访视/基线,第3次访视/第2周,第4次访视/第4周,第6次访视/第8周,第8次访视/第12周,第10次访视/第16周和随访第11次访视/第20周评估。
[0545]
homa
‑
ir/脂肪组织
‑
ir:homa
‑
ir/脂肪组织
‑
ir水平是度量胰岛素抗性的方法。homa
‑
ir通过将空腹血浆胰岛素(fpi)乘以空腹血浆血糖(fpg),然后除以常数405来计算。通过将空腹非酯化脂肪酸(nefa)乘以空腹胰岛素来计算脂肪组织
‑
ir。取血样以评估第2次访视/基线、第3次访视/第2周、第4次访视/第4周、第6次访视/第8周、第8次访视/第12周、第10次访视/第16周和随访第11次访视/第20周的homa
‑
ir和脂肪组织
‑
ir。要求所有受试者在采血前至少禁食8小时。如果受试者至少8小时未禁食,则记录禁食的持续时间,并鼓励受试者对于下一次临床访视适当地禁食。
[0546]
elf:elf分数是由金属蛋白酶1的组织抑制剂(timp
‑
1),iii型前胶原的氨基末端前肽(piiinp)和透明质酸(ha)组成的细胞外基质标记物组。在基线(第2次访视)和第16周(第10次访视)取血样进行该评估。
[0547]
肝硬度和cap:使用瞬时弹性成像(例如,502 touch型号或等同产品)来评估肝硬度和cap。如果可能,对于基线(第0周)和第10次访视(第16周),患者禁食,并在当天的同一时间扫描。对于本次评估,符合以下条件:患者采取仰卧位,右臂在头部后方最大外展,位置与肝活检(lb)相似;将探头尖端置于肝脏右叶肋骨之间的皮肤上(医生将探头置于肋间隙进行测量);在检查期间,m+或xl+探头的选择由自动探头选择工具(aps)确定(如果aps工具建议在“m+和xl+探头”之间连续使用“xl+探头”或“开关”,则仅使用xl+探头);在超声时间运动图像辅助下,操作者定位了没有大血管结构的肝脏部分(xl+探头的测量深度在35
‑
75mm之间,m+探头的测量深度在25
‑
65mm之间,所探查的体积为3cm3)。对于每位患者,操作者在同一点使用xl+或m+探头进行至少10次有效测量或最多20次尝试的检查。整个检查持续不超过10至15分钟。最终硬度和cap值记录为有效测量的中值。
[0548]
fib
‑
4指数:fib
‑
4指数基于年龄、血小板计数、alt水平和ast水平,并在基线(第2次访视)和第16周(第10次访视)评估。fib
‑
4分数如下式所示确定。
[0549]
fib
‑
4=年龄(岁)x ast(u/l)
[0550]
血小板计数(109/l)x√alt(u/l)
[0551]
nfs:nfs基于年龄、高血糖、bmi、血小板计数、白蛋白水平和ast/alt比率。nafld纤维化分数=
‑
1.675+0.037
×
年龄(岁)+0.094
×
bmi(kg/m2)+1.13
×
ifg/糖尿病(是=1,否=0)+0.99
×
ast/alt比值
‑
0.013
×
血小板(
×
109/l)
‑
0.66
×
白蛋白(g/dl)。在基线(第2次访视)和第16周(第10次访视)评估nfs。
[0552]
安全性评估包括:病史;体格检查;ecg;生命体征;临床实验室安全性试验(例如血液学、血清生物化学、凝血、脂质分布和尿分析);病毒学;妊娠试验;采血;药代动力学取样;探索性血液采集;生物标记物血液采集;尿doa和酒精呼吸试验;不良事件评估;伴随用药;生物分析;样本、储存、处理;和装运;和限制。下面提供每个的详细描述。
[0553]
病史:研究者或指定人员在筛选访视(第1次访视)和基线访视(第2次访视)时对患者病史进行了全面审查,以确保不符合排除标准。报告了任何伴随疾病,无论研究者认为是否与研究相关。尽可能记录诊断日期或病情持续时间。
[0554]
体格检查:根据当地实践,研究者按照表19中的研究流程图在第1次访视/筛选、第2次访视/基线、第3次访视/第2周、第4次访视/第4周、第6次访视/第8周、第8次访视/第12周、第10次访视/第16周和随访第11次访视/第20周进行体格检查(包括身高和体重)。该检查在基线和之后针对症状完全完成(即,除非患者指示,否则不评估身体系统的标准面板)。例如,如果患者向研究者报告存在“皮疹”,则评价皮肤。除非临床上有保证,否则无需对其他身体系统进行评估。记录任何异常结果。体格检查结果与基线检查相比的变化记录为ae。
[0555]
ecg:在每个时间点记录具有10秒导联ii节律条的12导联ecg 10mm/lmv,25mm/s。使用ge mac 1200或等效模型来记录ecg。在获取ecg之前,患者以完全仰卧姿势安静休息5分钟。在表19的研究流程图中所示的第1次访视/筛选,第2次访视/基线和第10次访视/第16周进行记录。
[0556]
生命体征:根据表19中的研究流程图,在第1次访视/筛选、第2次访视/基线、第3次访视/第2周、第4次访视/第4周、第6次访视/第8周、第8次访视/第12周、第10次访视/第16周和随访第11次访视/第20周进行生命体征测量。在采集任何血样之前进行生命体征测量。被认为具有临床意义的所有新发现或先前的发现的变化均被记录为ae,如果发现是在患者签名后作出的。生命体征测量包括:仰卧血压(例如,休息至少5分钟后),收缩压和舒张压(mmhg);静息心率,每分钟心跳次数(bpm);根据临床实践获取的温度。
[0557]
临床实验室安全性试验:对血液学、血清生物化学、凝血、脂质分布和尿分析进行安全性试验:按照表19中的研究流程图,采集血液和尿样本,用于进行常规血液学、血清生物化学、凝血和尿分析试验以及脂质分布。在中心实验室分析所有样本。所有受试者在采血前至少禁食8小时。如果受试者至少8小时未禁食,则记录禁食的持续时间,并鼓励受试者对于下一次临床访视适当地禁食。
[0558]
·
血液学:全血计数包括红细胞计数、血红蛋白、血细胞比容、白细胞计数、白细胞分类计数、血小板计数和网织红细胞计数。
[0559]
·
血清生化学:尿素(血尿素氮;bun)、肌酐、尿酸、总胆红素、间接和直接胆红素、钠、碳酸氢钾、磷、氯化钙、碱性磷酸酶(alp)、天冬氨酸转氨酶(ast)、丙氨酸转氨酶(alt)、alt/ast比、乳酸脱氢酶(ldh)、肌酸磷酸激酶(cpk)、白蛋白、总蛋白、胆固醇、甘油三酯、葡萄糖、c
‑
反应蛋白(crp)。
[0560]
·
凝血:凝血酶原时间(pt)、国际标准化比值(inr)和活化部分凝血酶原时间(aptt)。
[0561]
·
脂质分布:ldl、hdl和vldl
‑
c。
[0562]
·
尿分析:ph、蛋白质、葡萄糖、血液、酮、白细胞、白细胞酯酶、胆红素、比重、尿胆素原和硝酸盐。如果存在血液、蛋白质、白细胞酯酶或硝酸盐/亚硝酸盐,则进行反射显微镜检查。
[0563]
病毒学:采集血样进行病毒学试验,包括hiv、hep c和hep b,详见表19的研究流程图。
[0564]
妊娠试验:对于有生育能力的女性患者,根据表19的研究流程图,在第1次访视/筛选、第2次访视/基线、第4次访视/第4周、第6次访视/第8周、第8次访视/第12周、第10次访视/第16周和第11次访视/第20周进行妊娠试验。
[0565]
采血:采集血样,并在样本分析和验证后由每位研究者审查实验室结果的临床显
著值。重复安全性实验室试验可能需要额外的血液。
[0566]
药代动力学(pk)取样:按照表19中的研究流程图,在第2次访视/基线、第3次访视/第2周、第4次访视/第4周、第6次访视/第8周、第8次访视/第12周、第10次访视/第16周和随访第11次访视/第20周通过直接静脉穿刺采集用于pk分析的血样。在每个时间点取1ml血样。离心后,将血浆样本分成两份,备用样本保存在中心实验室,直至完成生物分析测定。
[0567]
探索性血液采集:根据表19中的研究流程图,在基线(第0周)和第10次访视/16周时采集血液,并储存用于潜在基因阵列分析或以后的其他探索性试验。
[0568]
生物标记物血液采集:根据表19中的研究流程图,在基线(第0周)、第6次访视/第8周、第10次访视/第16周和随访第11次访视/第20周收集血液,并储存用于潜在的生物标记物分析。
[0569]
尿doa和酒精呼吸试验:根据研究者的判断,在临床上是适当的,进行酒精呼吸试验,并且在进行试验期间的任何时间从患者采集尿样以检测以下物质:安非他明(amphetamine)、巴比妥酸盐(barbiturate)、苯二氮(benzodiazepine)、可卡因、大麻素和阿片类(opiates)。
[0570]
伴随用药:筛选前,患者接受稳定剂量的任何伴随用药至少3个月,该剂量应在整个研究期间保持稳定。如果患者依赖于胰岛素,该治疗应该在筛选前至少3个月开始,但是允许改变剂量。
[0571]
限制:研究包括饮食、酒精、咖啡因和身体活动限制。对于饮食,患者在研究期间和基线前4周避免摄取富含ω
‑
3或ω
‑
6脂肪酸的食物补充剂(例如鳕鱼肝油胶囊)。对于酒精,患者避免饮酒超过21个单位/周(男性)或14个单位/周(女性),其中一个单位由10ml或8mg纯酒精组成。在研究之前或研究期间没有咖啡因限制。对于体力活动,患者在安全性实验室试验(例如生物化学)前至少3至4小时避免运动和剧烈体力活动。
[0572]
1.6试验药
[0573]
ds102胶囊是白色,不透明的硬壳胶囊(0),其含有500mg 15
‑
hepe乙酯(ee)以及5%w/w胶体二氧化硅作为粘度调节剂。
[0574]
ds102安慰剂(石蜡油)是白色,不透明的硬壳胶囊(尺寸0号),含有等量填充重量的液体石蜡和1%w/w胶体二氧化硅作为粘度调节剂。
[0575]
ds102和安慰剂胶囊在2
‑
8℃下储存在安全区域(例如上锁的柜或储药室),防止意外使用。标签中不写出剂量内容并包含随机化编号。
[0576]
剂量和给药:该研究涉及ds102与安慰剂的比较,每天两次口服给药,总持续时间为16周。最后一次研究药物给药发生在第16周访视/提前终止(et)访视前一天。患者需要在进食时同时服用或进食后服用胶囊。本研究允许的针对其他病症的药物照常服用。泡罩包装由7天用量的4个胶囊组成,最后,患者连续16周服用指定的药物。
[0577]
1.7不良事件和严重不良事件
[0578]
本研究的不良事件(ae)和严重不良事件(sae)定义如下。
[0579]
不良事件(ae):服用第一剂研究药物的患者出现的任何不希望有的体验,无论是否认为与试验用imp相关。ae记录在病例报告表中,定义了与imp的关系和严重度。
[0580]
严重不良事件(sae):如果患者在研究药物首次给药后出现严重不良事件,则将该事件记录为sae。sae的特征在于在任何剂量下的不良医学事件,包括以下任何一种:导致死
亡,危及生命,需要患者住院治疗或延长现有住院治疗,或导致持续或显著的残疾/能力丧失。术语“危及生命”是指其中患者在事件发生时处于死亡风险中的事件。它并不指假设可能导致死亡的事件,如果它更严重的话。重要但不危及生命的事件的实例包括急诊室的强化治疗,过敏性支气管痉挛,未导致住院的血液恶质病或惊厥,或药物依赖或药物滥用的发展。
[0581]
非预期不良事件(uae):之前未在研究者手册或类似产品信息表(如产品特性总结(spc))中报告的经验。
[0582]
ae的强度是研究者根据其临床经验对事件相对严重程度的估计。以下定义用于评定ae的严重度:
[0583]
·
轻度:不良事件为一过性事件,容易耐受。
[0584]
·
中度:不良事件引起患者不适,中断患者日常活动。
[0585]
·
严重:不良事件对患者的日常活动造成了相当大的干扰,可能导致丧失能力或危及生命。
[0586]
还考虑到患者病史,最近的体格检查结果和伴随用药,确定了ae与实验治疗的因果关系。以下定义用于确定ae的因果关系:
[0587]
·
不相关:ae发作相对于实验治疗的时间关系不合理或其他原因可以解释ae的发生。
[0588]
·
相关:ae发作相对于实验治疗的时间关系是合理的,遵循已知的治疗反应模式,并且不可能有其他原因。
[0589]
报告了整个研究期间(包括随访期)的所有ae。
[0590]
1.8药物诱导的肝损伤
[0591]
严重药物诱导性肝损伤(dili):不考虑所感知的因果关系,如果发生严重dili,则停止试验药给药,直至认为症状缓解。如果试验药被认为是肝损伤的原因,则患者不再接受药物再激发。严重dili规定肝损伤证据,如总胆红素>2
×
uln或inr>1.5所示。
[0592]
具有异常基线肝生化的患者:在测定异常基线肝生化时,计算相对于基线水平的倍数增加,而不是使用uln。因此,在获得3
×
基线alt或ast(或>200iu/l)的数字后,在72小时内进行重复试验,以确认/确定生化变化是否改善或恶化。在全面体检的同时收集ae信息。进行了肝脏病因筛选和/或其他适当试验。如果发生肝功能不全,则患者应接受严重dili治疗。如果发生符合严重dili的任何标准的情况,则考虑暂停药物治疗。
[0593]
1.9严重不良反应和非预期不良反应
[0594]
不良反应:与任何剂量相关的对药品的所有有害和非预期反应均被视为药物不良反应。短语“对药品的反应”是指药品和ae之间的因果关系至少具有合理的可能性(即,不能排除该关系)。对于市售的医药产品,不良反应是对药物的有害和非预期的反应,并且其在人中通常用于预防、诊断或治疗疾病或用于改变生理功能的剂量下发生。
[0595]
非预期不良反应:不良反应的性质或严重程度与适用产品信息不一致。
[0596]
疑似非预期严重不良反应(susar):根据上述定义,任何可能与imp相关且非预期的严重不良反应。
[0597]
1.10统计方法和数据管理
[0598]
该临床试验采用随机、双盲、安慰剂对照的平行组设计。使用随机化来最小化分配
偏倚并增加已知和未知患者属性(例如人口统计学特征)在治疗组之间均匀平衡的可能性。在数据收集和安全性和功效评价期间使用设盲以减少潜在偏倚。基于研究持续时间的简短性和不存在任何可能的长期不可逆损害(可能具有安慰剂治疗的结果),使用安慰剂作为比较物被证明是评估对于患者的安全性和功效的合理设计。
[0599]
样本量的估计:假设活性药物组和安慰剂组之间的百分比反应有20%的增量,标准偏差为25%,中途退出率为20%,这导致为取得5%的显著性水平和80%的把握度(power),需要每组32名患者进行统计学检验。根据揭盲建议,在中期分析中重新估计样本量。样本量最多总共可增加到150名患者,以为主要终点达到80%的条件把握度。
[0600]
设盲和破码说明:所有研究中心人员以及参与监查或开展研究的人员对单个患者治疗分配设盲。随机化细节严格保密,只有在紧急情况下经授权人员才能接触了解,直到正式揭盲。只有在记录和验证所有患者数据并锁定数据库后,试验的设盲代码才被破坏。
[0601]
中期分析和数据监测:当至少50%的患者完成第16周访视时,进行中期安全性分析以估计条件把握度。中期分析基于针对主要和共同主要功效终点以及次要终点收集的数据,并用于估计实现主要研究目的的条件把握度,从而可能重新估计样本量,并可能丢弃有效性较低的治疗组。
[0602]
临床上有意义的反应:与安慰剂相比,alt或肝硬度降低至少20%的较高平均值或中值,以及与安慰剂相比,alt和肝硬度降低至少10%的较高平均值或中值
[0603]
分析组包括入选组,全分析组(fas),符合方案组(pps),安全性分析组(sas)和药代动力学(pk)组。每个分析组的详细描述如下。
[0604]
入选组:签署知情同意书的患者。筛选失败是来自入组人群的不符合资格要求并在随机化前退出研究的患者。
[0605]
fas:接受至少一次研究治疗给药并具有至少一次基线后测量的随机化患者。根据随机分配的治疗对患者进行分析,无论他们实际接受何种治疗。
[0606]
pps:fas的子集,由无重大方案违背的fas患者组成。在数据库锁定之前,逐例评估并记录所有方案偏离,被认为严重影响疗效结果的重大偏离导致相关患者从pps中排除。
[0607]
sas:接受至少一次研究治疗给药的患者。根据实际采取的治疗,对患者进行分析。
[0608]
pk组:sas中具有至少一个ds102 pk浓度的患者。根据实际接受的治疗,对患者进行分析。
[0609]
安全性分析:列出了每名患者的人口统计学、病史和体格检查数据,并进行描述性总结。使用当前版本的监管活动医学词典(medical dictionary for regulatory activities,meddra)将研究期间记录的所有ae编码为系统器官类别和首选术语。按照治疗,与治疗的关系,严重性和严重度对ae进行列表和总结。按治疗和天数列出每个患者的临床实验室值(例如,血液学、生物化学和尿分析)。实验室正常范围之外的值分开列出,并加上关于其临床意义的相关评论,按治疗,潜在临床显著异常突出显示并总结。将给药前获得的临床实验室值定义为基线值。列出了每例患者的酒精呼吸试验和doa试验结果。列出并描述性总结每个治疗和一天的生命体征的单个值。列出了每名患者的12导联ecg评估以及所有相关评论,并按治疗和天数总结。根据世界卫生组织药物词典最新版本,按药物组和亚组分类的伴随用药(如有)按治疗列出和总结。通常,根据变量的性质,应用适当的描述性统计。分类变量采用计数和百分比表示,而连续变量采用平均值、标准差、中值、最小值、最大
值、变异系数和患者人数表示。
[0610]
药代动力学分析:将15(s)
‑
hepe的血浆浓度制成表格并描述性总结。图示了15(s)
‑
hepe的单个和平均血浆浓度
‑
时间分布。
[0611]
主要变量:主要功效变量是第16周(第10次访视)血清alt相对于基线的变化。通过协方差分析(ancova)模型,将相应基线值作为协变量包括进来,将动态治疗组与安慰剂组进行比较。根据dunnett's多重检验方法,进行与安慰剂组的比较。对于缺失的第16周数值,最后一个可用值被结转(locf)。类似的方法用于肝脏硬度。对于alt,另外考虑纵向建模。
[0612]
次要变量:次要功效变量及其从基线到第16周(第10次访视)的变化按照每个治疗组和访视,利用描述性统计进行总结。这适用于ast、ast:alt比率,按cap度量的肝脂肪,通过瞬时弹性成像测量的肝硬度,fib
‑
4、nfs、elf和homa
‑
ir/脂肪组织
‑
ir。通过anova模型,包括中心效应项,将动态治疗组的相对于基线的变化与安慰剂组进行比较。5%的显著性水平用于所有治疗比较。
[0613]
探索性分析:探索性分析包括对脂质和代谢参数的分析,包括总胆固醇、甘油三酯、极低密度脂蛋白胆固醇(vldl
‑
c)、低密度脂蛋白胆固醇(ldl
‑
c)、高密度脂蛋白胆固醇(hdl
‑
c)、非高密度脂蛋白胆固醇(非hdl
‑
c)、残粒样颗粒胆固醇(rlp
‑
c)、空腹血糖、胰岛素、游离脂肪酸和血红蛋白a1c(hba1c)。另外的探索性分析包括高通量脂质组学和蛋白质组学。
[0614]
1.11结果
[0615]
该研究表明,被诊断患有nafld并以1g或2g/天的剂量服用ds102的患者表现出代谢过载标记物的统计学显著降低以及胰岛素敏感性和血糖控制的改善。
[0616]
图20示出了三个治疗组在基线时良好平衡且具有相似的脂质组学和代谢组学分布。患者的基线特征如表18所示,其中10至13%的患者在基线时接受他汀(statin)治疗。
[0617]
表18.受试者的基线特征
[0618][0619]
图21a至21c描绘了与安慰剂组相比,每天服用1g或2g ds102的患者从基线到第16周胰岛素、血糖和游离脂肪酸水平的变化。服用ds102后胰岛素、血糖和游离脂肪酸水平的降低在临床上是显著的,因为代谢底物包括葡萄糖、碳水化合物和游离脂肪酸驱动nash的发病机制。
[0620]
图22a和22b示出了与安慰剂组相比,每天服用ds102 1g或2g的患者从基线到第16周homa
‑
ir和脂肪组织ir水平的变化。患者在第16周表现出两种胰岛素抗性指数的改善(例如,homa
‑
ir和脂肪组织
‑
ir水平的降低),对于服用2g ds102的那些患者,在符合方案组(pps)观察到显著改善。
[0621]
图23a和23b描绘了与安慰剂组相比,每天服用ds012 1g或2g的患者的糖基化血红蛋白(例如hba1c)水平从基线到第16周的变化。具体而言,图23a示出hba1c水平的变化,图23b示出在基线时hba1c水平高但在第16周达到正常水平的患者比例中hba1c水平的变化。由于hb1ac是附着于身体红细胞的葡萄糖的量的量度并且是长期血糖控制的替代值,这些结果表明服用ds102提供临床上显著的改善并且以剂量依赖性方式使血糖控制正常化。
[0622]
图24a和24b示出了安全性分析组(sas)中第16周患者脂质分布的平均变化和中值(%)变化。这些结果进一步描绘于图25a至25c中,并且说明服用ds102通过维持或降低患者的总胆固醇、vldl
‑
c、非hdl
‑
c、残粒样颗粒(rlp)胆固醇和甘油三酯水平来显著改善患者的脂质分布。显著地,降低在第16周没有平稳,表明服用ds102可能在更长持续时间的研究中产生更大的变化。
[0623]
如图26所示,服用ds102还逆转了nash的肝毒性脂质特征,并改善了在诊断为在nash的患者中改变的多种脂质类别。具体地,服用2g的ds102显著降低多种肝毒性甘油二酯的水平并显著提高多种甘油磷脂基团的水平。该发现是重要的,因为nash患者具有低水平的肝和血浆甘油磷脂。
[0624]
图27示出了服用ds102也解决了基于验证的诊断试验(如owl肝脏护理非侵入性nash诊断试验)的nash。owl肝脏护理是基于活组织检查证实的nash患者的血浆脂质组学开发的试验,并且提供高预测值。owl肝脏护理区分nafld和正常肝脏患者的曲线(auc)下面积为0.88,区分无脂肪性肝炎的nafld和nash患者的auc为0.79。在第16周,与安慰剂组相比,ds102的服用以剂量依赖性方式显著改善和正常化owl肝脏护理诊断的nash。表19示出了每个治疗组在基线时的试验诊断,并证明大多数患者在基线时被分类为nash或nafld,在2g ds102组中患者的百分比较低。
[0625]
表19.基线时的owl试验诊断
[0626][0627]
服用ds102还降低了诊断为nafld的患者的如按照cap评估的肝脂肪含量,如图28所示。还预期,ds102预期在更长持续时间的研究中和当通过更灵敏的方法评估时诱导肝含量的更大变化。
[0628]
ds102的服用也降低了患者的甘油三酯水平,如表20所示,因此预期ds102也将有效降低心血管风险。
[0629]
表20.服用ds102的患者在第16周时的甘油三酯水平变化
[0630][0631]
图29a至29c示出了服用ds102减少炎性和促纤维化蛋白。对于该评估,分析用ds102治疗之前和之后的血液样本的大于350种不同蛋白质生物标记物的组。用2g的ds102治疗显著下调与炎症、纤维化、脂质代谢、细胞凋亡和趋化性相关的超过150个标记物的表达。用ds102治疗后观察到代谢过载和脂毒性的消退,其防止随后的细胞应激、炎症和纤维化。炎性和促纤维化蛋白的减少表明ds102提供nash的消退和预防纤维化的潜力。
[0632]
如图30所示,服用ds102还降低了多种nash发展靶标的表达。特别地,服用2g ds102降低nash药物开发靶标,包括ccr2/5信号传导(艾尔建公司的cenicriviroc(cenicriviroc
‑
allergan)),半乳糖凝集素3(gr
‑
md
‑
02
‑
半乳糖凝集素)和aoc3(勃林格殷格翰公司(boehringer ingelheim))。
[0633]
图31中的火山图(bonferroni和benjamini
‑
hochberg试验的数据)示出服用2g ds102降低了基于蛋白质表达变化的炎性和促纤维化蛋白质。表21示出了基于bonferroni试验的最显著的炎性和促纤维化蛋白减少。
[0634]
表21.基于bonferroni试验的重要蛋白
[0635][0636]
服用1g ds102也示出了tr的显著降低。表22示出了基于线性模型分析的最显著的炎性和促纤维化蛋白减少。
[0637]
表22.基于线性模型的重要蛋白
[0638]
蛋白质描述tlt2增强t细胞活化,清除凋亡细胞aoc3损害葡萄糖稳态。nash、动脉粥样硬化增加。prss2在胰腺中表达,参与细胞粘附
[0639]
该分析还表明,基于benjamini
‑
hochberg检验,1g ds107组中的1种蛋白质和安慰剂组中的0种蛋白质超过第一阈值。
[0640]
服用ds102还降低了多种血管粘附分子的表达,如图32所示。血管粘附分子与动脉粥样硬化有关,它们的循环水平与心血管危险有关。
[0641]
服用ds102还降低了与心血管风险增加相关的多种蛋白质的表达,如图33所示。
[0642]
服用ds102还降低了多种循环趋化因子的表达,如图34所示。趋化因子是动脉粥样硬化慢性炎症的重要驱动因素。
[0643]
服用ds102还降低了多种肿瘤坏死因子受体超家族成员的表达,如图35所示。肿瘤坏死因子受体超家族成员涉及炎症和动脉粥样硬化。
[0644]
ds102也被证明是安全,且耐受良好的,与安慰剂相比,没有观察到安全性和耐受性差异。无药物相关严重不良事件(sae),不良事件(ae)发生率低,所有治疗组都一致。大多数ae为轻度至中度以及短暂性,无患者发生导致治疗中断的ae。每个治疗组的安全性情况
如表23所示。
[0645]
表23.研究组的安全性特征
[0646]
患者数,n(%)2g ds102(n=30)1g ds102(n=32)安慰剂(n=31)≥1ae15(50.0)19(59.4)17(54.8)与研究药物相关的ae≥13(10.0)2(6.3)4(12.9)≥1sae1(3.3)01(3.2)导致治疗中断的ae001(3.2)与药物研究相关的sae000死亡000
[0647]
还评价了ds102改善相关适应症,原发性胆汁性肝硬化(pbc)和原发性硬化性胆管炎(psc)的潜在功效,如图36a和36b所示。重要的是,服用2g ds102降低了碱性磷酸盐(alp)以及肝纤维化的多种标记物,表明ds102对于治疗pbc和psc也是有效的。
[0648]
图37是15
‑
hepe乙酯(ee)谷血浆相对浓度的箱形图,其表明ds102治疗组在第8周和第16周如预期具有较高的系统性暴露。
[0649]
1.12总结
[0650]
总之,这些结果表明ds102通过显著降低代谢负荷和改善胰岛素敏感性来靶向nash病理的多个阶段。服用ds102还通过逆转与nash相关的脂质累积水平来改善患者的脂质分布。具体地,服用ds102的那些患者表现出肝毒性脂质水平(包括总胆固醇、非hdl胆固醇、rlp胆固醇、甘油三酯、甘油二酯和vldl
‑
c)的累积减少,以及甘油磷脂水平的提高。这些作用是显著的,因为诊断为nash的患者的特征在于高的总胆固醇、甘油三酯、甘油二酯和vldl
‑
c水平以及低的甘油磷脂和ω
‑
3pufa水平。此外,预期多种脂质的变化可降低心血管风险并改善代谢综合征的多个方面。
[0651]
结果还表明存在有利于施用2g或更高的ds102的剂量依赖性作用,与安慰剂相比具有较大且统计学显著的改善。
[0652]
总之,ds102非常适合作为单一疗法或联合疗法的一部分用于治疗nash,并且预期降低心血管风险,包括对于诊断患有nash或心血管代谢疾病(包括代谢综合征)的患者。
[0653]
下文阐述本公开的各种实施例:
[0654]
段落a.一种对有需要的受试者治疗和/或预防代谢综合征的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或hetre的组合物。
[0655]
段落b.一种对有需要的受试者治疗和/或预防心血管代谢疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或hetre的组合物。
[0656]
段落c.一种对有需要的受试者治疗和/或预防代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述15
‑
hepe和/或15
‑
hetre占所述组合物中所有脂肪酸的至少约90重量%。
[0657]
段落d.一种对有需要的受试者治疗和/或预防代谢综合征和/或心血管代谢疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%,并且其中所述受试者表现出以下各项中的一种或多种:甘油二酯、甘油磷脂、肝脂肪、血压、腰围和/或游离脂肪酸水平的降低;和/或甘油磷脂水平的提高。
[0658]
段落e.一种对受试者预防非酒精性脂肪肝炎(nash)的第一阶段进展至nash的第二阶段的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物。
[0659]
段落f.根据段落e所述的方法,其中所述第一阶段是代谢过载、增加的肝脂肪含量和脂毒性、细胞应激凋亡、炎症和/或纤维发生性重塑。
[0660]
段落g.根据段落e或段落f所述的方法,其中所述第二阶段是增加的肝脂肪含量和脂毒性、细胞应激凋亡、炎症和/或纤维发生性重塑。
[0661]
段落h.一种在有需要的受试者中对患有非酒精性脂肪肝病症(nafld)、代谢综合征和/或心血管代谢疾病的受试者治疗和/或预防心血管疾病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或hetre的组合物。
[0662]
段落i.一种在有需要的受试者中对患有非酒精性脂肪肝障碍(nafld)、代谢综合征或心血管代谢疾病的受试者治疗和/或预防心血管疾病的方法,所述方法包含向所述受试者施用约1g至约4g的包含15
‑
hepe的组合物,其中所述15
‑
hepe占所述组合物中所有脂肪酸的至少约90重量%。
[0663]
段落j.根据段落a至i中任一段所述的方法,其中所述受试者表现出以下一项或多项的减少:α
‑
平滑肌作用(α
‑
sma)、金属肽酶抑制剂
‑
1(timp
‑
1)、转化生长因子β
‑
β(tgf
‑
β)和/或1型胶原水平。
[0664]
段落k.根据段落a至c或e至j中任一段所述的方法,其中所述受试者表现出甘油二酯、肝脂肪、血压、腰围和/或游离脂肪酸水平的降低和/或甘油磷脂水平的提高。
[0665]
段落l.根据段落a至k中任一段所述的方法,其中所述受试者表现出碱性磷酸盐(alp)水平的降低。
[0666]
段落m.根据段落a至l中任一段所述的方法,其中所述受试者表现出血清丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)和/或胆红素(bun)水平的降低。
[0667]
段落n.根据段落a至m中任一段所述的方法,其中所述受试者表现出纤维化面积的减少。
[0668]
段落o.根据段落a至n中任一段所述的方法,其中所述受试者表现出血红蛋白a1c(hba1c)、胰岛素抗性的稳态模型评估(homa
‑
ir)和/或脂肪组织胰岛素抗性(脂肪组织
‑
ir)水平的降低。
[0669]
段落p.根据段落h至o中任一段所述的方法,其中所述nafld是非酒精性脂肪肝炎(nash)。
[0670]
段落q.根据段落b至d或f至p中任一段所述的方法,其中所述心血管代谢疾病或心血管疾病是以下各项中的一种或多种:血脂异常、高脂血症、高胆固醇血症、高甘油三酯血症、原发性高胆固醇血症、原发性高脂血症、常见原发性高脂血症、常见高胆固醇血症、家族性高脂血症、家族性原发性高脂血症、家族性高胆固醇血症、家族性高甘油三酯血症、家族性混合型高脂血症、家族性载脂蛋白b
‑
100缺陷、继发性高脂血症、混合型高脂血症、心血管疾病、残余心血管风险、预防动脉粥样硬化斑块形成/进展、微血管疾病、大血管疾病、动脉粥样硬化、冠状动脉粥样硬化、舒张功能障碍、降低心血管风险、主要冠状动脉事件的预防、主要不良心血管事件的预防、缺血性事件的预防、心血管事件的二级/一级预防、心血管死亡的预防、心肌梗塞、中风、心绞痛、正常内皮功能的恢复、糖尿病(diabetes)、糖尿病(diabetes mellitus)、胰岛素抗性、高胰岛素血症、高血糖症、血糖代谢障碍、血糖控制的
诱导、葡萄糖耐量受损和空腹血糖受损。
[0671]
段落r.根据段落q所述的方法,其中所述微血管疾病是视网膜病、肾病、神经病或其组合。
[0672]
段落s.根据段落q所述的方法,其中所述大血管疾病是中风、外周血管疾病、肢体缺血、心脏病或其组合。
[0673]
段落t.根据段落a至s中任一段所述的方法,其中所述受试者表现出极低密度脂蛋白胆固醇(vldl
‑
c)、非高密度脂蛋白胆固醇(非hdl
‑
c)和/或残粒样颗粒胆固醇(rlp
‑
c)和/或高密度脂蛋白胆固醇(hdl
‑
c)水平的降低。
[0674]
段落u.根据段落a至t中任一段所述的方法,其中所述受试者表现出肝硬度、纤维化
‑
4(fib
‑
4)、增强的肝纤维化(elf)分数和/或nafld分数(nfs)的降低。
[0675]
段落v.根据段落a至u中任一段所述的方法,其中所述受试者表现出选自由以下组成的组的发炎性和促纤维化蛋白质的减少:纤溶酶原激活剂抑制剂
‑
1(pai
‑
1)、金属肽酶抑制剂
‑
1(timp
‑
1)、二肽基肽酶4(dpp4)、trem样转录物2(tlt2)、趋化因子(c
‑
c基序)配体16(ccl16)、单核细胞趋化蛋白
‑
1(mcp
‑
1)、血清淀粉样蛋白a4(saa4)、磷酸肌醇3(pi3)、硫氧还蛋白还原酶(tr)、白细胞免疫球蛋白样受体b1(lilbr1)、胺氧化酶、含铜3(aoc3)、丝氨酸蛋白酶2(prss2)和肿瘤坏死因子配体超家族成员11a(tnrsf11a)。
[0676]
段落w.一种治疗或预防受试者的胆汁淤积性肝病的方法,所述方法包含向所述受试者施用15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物。
[0677]
段落x.根据段落w所述的方法,其中所述胆汁淤积性肝病是原发性胆汁性胆管炎(pbc)、原发性硬化性胆管炎(psc)、进行性家族性肝内胆汁淤积或其组合。
[0678]
段落y.根据段落w或段落x所述的方法,其中所述胆汁淤积性肝病由药物诱导的肝损伤、全胃肠外营养(tpn)、病毒性和酒精性肝炎、继发于全身性疾病的胆汁淤积、移植物功能障碍、肝移植后胆汁淤积、胰腺炎、胆总管结石、mirizzi综合征、遗传疾病、恶性肿瘤或其组合引起。
[0679]
段落z.根据段落y所述的方法,其中所述恶性肿瘤是肝细胞癌、胆管肿瘤、胰腺癌或其组合。
[0680]
段落aa.根据段落w至z中任一段所述的方法,其中所述受试者表现出选自由以下组成的组的细胞因子和/或趋化因子的降低:α
‑
平滑肌作用(α
‑
sma)、金属肽酶抑制剂
‑
1(timp
‑
1)、转化生长因子β
‑
β(tgf
‑
β)和1型胶原水平。
[0681]
段落bb.一种治疗或预防受试者的肾病的方法,所述方法包含向所述受试者施用15
‑
hepe和/或15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物,其中所述受试者具有肾病的至少一种风险因素。
[0682]
段落cc.根据段落bb所述的方法,其中所述肾病选自由以下组成的组:肾纤维化、肾小管间质纤维化、慢性肾病、严重间质纤维化、肾间质纤维化和终末期肾病。
[0683]
段落dd.根据段落cc所述的方法,其中所述肾脏疾病导致纤维化。
[0684]
段落ee.根据段落bb至dd中任一段所述的方法,其中肾病的所述至少一种风险因素选自由以下组成的组:糖尿病、高血压、心血管疾病、肾小球肾炎和多囊肾病。
[0685]
段落ff.根据段落bb至ee中任一段所述的方法,其中所述受试者表现出肾羟脯氨酸水平的降低。
[0686]
段落gg.根据段落bb至ff中任一段所述的方法,其中所述受试者表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平没有提高。
[0687]
段落hh.根据段落bb至gg中任一段所述的方法,其中所述受试者表现出α
‑
sma、timp
‑
1、tgf
‑
β和/或1型胶原水平的降低。
[0688]
段落ii.根据段落aa至hh中任一段所述的方法,其中所述受试者表现出所述肝脏中促纤维化细胞因子的减少。
[0689]
段落jj.根据段落ii所述的方法,其中所述促纤维化细胞因子是α
‑
sma、timp
‑
1、tgf
‑
β、1型胶原、白介素1β(il
‑
1β)、白介素
‑
6(il
‑
6)、白介素
‑
6(il
‑
8)、白介素
‑
13(il
‑
13)、肿瘤坏死因子(tnf
‑
α)、tnf样配体1a(tl1a)、芳烃受体(ahr)、白介素
‑
17(il
‑
17)、白介素
‑
23(il
‑
23)、白介素
‑
11(il
‑
11)和/或白介素
‑
33(il
‑
33)中的一种或多种。
[0690]
段落kk.根据段落a至jj中任一段所述的方法,其中所述受试者表现出血管粘附分子和/或趋化因子和/或肿瘤坏死因子受体超家族成员的减少。
[0691]
段落ll.根据段落a至kk中任一段所述的方法,其中所述15
‑
hepe、15
‑
hetre或包含15
‑
hepe和/或15
‑
hetre的组合物经口施用。
[0692]
段落mm.根据段落a至ll中任一段所述的方法,其中所述15
‑
hepe和/或15
‑
hetre呈游离酸形式、酯化形式或盐形式。
[0693]
段落nn.根据段落mm所述的方法,其中所述酯化形式是烷基酯形式或甘油三酯形式。
[0694]
段落oo.根据段落a至nn中任一段所述的方法,其中所述15
‑
hepe包含15(s)
‑
hepe、15(r)
‑
hepe或其组合和/或所述15
‑
hetre包含15(s)
‑
hetre、15(r)
‑
hetre或其组合。
[0695]
段落pp.根据段落a至oo中任一段所述的方法,其中所述组合物包含约1g至约2g的15
‑
hepe和/或15
‑
hetre。
[0696]
段落qq.根据段落a至pp中任一段所述的方法,其中所述组合物包含约2g或更多的15
‑
hepe和/或15
‑
hetre。
[0697]
段落rr.根据段落a至qq中任一段所述的方法,其中所述组合物包含约1g或约2g的15
‑
hepe和/或15
‑
hetre。
[0698]
段落ss.根据段落a至rr中任一段所述的方法,其中所述组合物包含约10mg至约10,000mg的15
‑
hepe和/或15
‑
hetre。
[0699]
段落tt.根据段落a至ss中任一段所述的方法,其中所述组合物包含约5mg/kg、约50mg/kg、约250mg/kg或约500mg/kg的15
‑
hepe和/或15
‑
hetre。
[0700]
段落uu.根据段落a至tt中任一段所述的方法,其中所述15
‑
hepe和/或15
‑
hetre占所述组合物中存在的所有脂肪酸的至少约90重量%。
[0701]
段落vv.根据段落a至uu中任一段所述的方法,其中所述组合物以每天1至8个胶囊施用。
[0702]
段落ww.根据段落a至c或h至vv中任一段所述的方法,其中所述方法包含向所述受试者施用15
‑
hepe或包含15
‑
hepe的组合物。
[0703]
段落xx.根据段落a至c或h至vv中任一段所述的方法,其中所述方法包含向所述受试者施用15
‑
hetre或包含15
‑
hetre的组合物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1