用于治疗对PD-1/PD-L1信号传导抑制剂无应答的癌症的方法和药物与流程
用于治疗对pd-1/pd-l1信号传导抑制剂无应答的癌症的方法和药物
技术领域
1.本发明涉及用于治疗个体中的癌症的药物、治疗方法、试剂盒和用途以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合,其特征在于vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂联合施用。更具体地,本发明涉及用于治疗个体中对pd-1/pd-l1信号传导抑制剂无应答的癌症的药物、治疗方法、试剂盒和用途以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合,其特征在于vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂联合施用。
背景技术:
2.程序性细胞死亡1(pd-1)受体和pd-1配体1和2(分别称为pd-l1和pd-l2)在免疫调节中发挥重要作用。在活化的t细胞上表达的pd-1由pd-l1(也称为b7-h1)和pd-l2活化,所述pd-l1和pd-l2由基质细胞、肿瘤细胞或两者表达,并且pd-1信号传导的扩增造成t细胞丧失复制能力和攻击癌细胞的能力,最终导致细胞死亡。施用这些蛋白质的信号传导抑制剂,例如抗pd-1抗体或抗pd-l1抗体,重新活化t细胞并且恢复细胞毒性免疫功能。
3.人血管内皮生长因子(vegf/vegf-a)参与与肿瘤和眼内病症相关联的正常和异常血管生成和新血管形成的限制。vegf是一种从多种来源中分离出的同源二聚体糖蛋白。对于内皮细胞,vegf具有促进其分裂的活性。vegf在胎儿血管发生过程中的新血管形成和成年后血管生成中具有重要的调节功能。截至2018年10月,三种称为血管生成抑制剂(vegf抑制剂)的产品已获批在日本生产和销售。这三种产品是贝伐珠单抗(商品名:安维汀)、雷莫芦单抗(商品名:cyramza)和阿柏西普(商品名:zaltrap)。
4.纳武单抗(商品名:欧狄沃)和帕博利珠单抗(商品名:可瑞达)为可商购获得的抗pd-1抗体,并且阿替利珠单抗(商品名:泰圣奇)和阿维单抗(商品名:bavencio)和德瓦鲁单抗(商品名:英飞凡)为可商购获得的抗pd-l1抗体。
5.截至2018年10月,伊匹木单抗(商品名:yervoy)作为抗ctla4抗体,是唯一获批与这些pd-1/pd-l1信号传导抑制剂联合使用的药剂。pd-1/pd-l1信号传导抑制剂另外地作为单药施用。
6.但是,人们仍然在寻求更有效的疗法,即联合使用抗癌剂和免疫疗法的协同效应(非专利参考文献1)。pd-1/pd-l1信号传导抑制剂与vegf信号传导抑制剂的组合也正在开发中(专利参考文献1-5)。
7.[专利文献]
[0008]
专利文献1 jp 2012-511329 a
[0009]
专利文献2 jp 2017-506227 a
[0010]
专利文献3 jp 2018-522887 a
[0011]
专利文献4 jp 2018-529375 a
[0012]
专利文献5 jp 2018-522850 a
[0013]
[非专利文献]
[0014]
非专利文献1 cancer j.2018 jul/aug;24(4):193-204。
技术实现要素:
[0015]
本发明提供了用于治疗癌症的药物、治疗方法、试剂盒和用途以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合。更具体地,本发明提供了用于治疗个体中对pd-1/pd-l1信号传导抑制剂无应答的癌症的药物、治疗方法、试剂盒和用途以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合。
[0016]
本发明人通过勤勉的研究发现,与vegf信号传导抑制剂或pd-1/pd-l1信号传导抑制剂各自单独使用相比,vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂的组合在癌症治疗中更有效,即提供了协同效应。特别地,本发明人发现,vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂的组合在对pd-1/pd-l1信号传导抑制剂无应答的癌症的治疗中有效,由此完成了本发明。
[0017]
根据本发明所述的药物是一种用于治疗个体中的癌症的药物,该药物包含pd-1/pd-l1信号传导抑制剂,用于与vegf信号传导抑制剂联合使用。
[0018]
根据本发明所述的药物是一种用于治疗个体中的癌症的药物,该药物包含vegf信号传导抑制剂,用于与pd-1/pd-l1信号传导抑制剂联合使用。
[0019]
根据本发明所述的药物是一种用于治疗个体中的癌症的药物,该药物包含vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂。
[0020]
根据本发明所述的药物是一种用于治疗个体中的癌症的药物,其中pd-1/pd-l1信号传导抑制剂与vegf信号传导抑制剂联合施用。
[0021]
根据本发明所述的上述药物中的任一者是一种药物,其中pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂同时、分别或依次施用。
[0022]
根据本发明所述的上述药物中的任一者是一种药物,其中vegf信号传导抑制剂为vegf拮抗剂或vegfr拮抗剂。
[0023]
根据本发明所述的上述药物中的任一者是一种药物,其中vegf信号传导抑制剂为抗vegf抗体或抗vegfr抗体。
[0024]
根据本发明所述的上述药物中的任一者是一种药物,其中抗vegf抗体或抗vegfr抗体为贝伐珠单抗、雷莫芦单抗或阿柏西普β。
[0025]
根据本发明所述的上述药物中的任一者是一种药物,其中pd-1/pd-l1信号传导抑制剂为pd-1拮抗剂或pd-l1拮抗剂。
[0026]
根据本发明所述的上述药物中的任一者是一种药物,其中pd-1/pd-l1信号传导抑制剂为amp-224、bms-936559、medi4736、msb0010718c、mpdl3280a、纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011)。
[0027]
根据本发明所述的上述药物中的任一者是一种药物,其中pd-1/pd-l1信号传导抑制剂为抗pd-l1抗体。
[0028]
根据本发明所述的上述药物中的任一者可以是一种药物,其中癌症选自由以下项组成的组:乳腺癌、肝癌、包括小细胞肺癌在内的肺癌、卵巢癌、胃癌、膀胱癌、胰腺癌、胆道癌、宫颈癌、子宫内膜癌、结肠癌、直肠癌、结直肠癌、肾癌、食道癌、前列腺癌、恶性黑素瘤、
头颈部癌、恶性胸膜间皮瘤、胶质母细胞瘤、尿路上皮癌、软组织肉瘤、恶性淋巴瘤、多发性骨髓瘤、病毒阳性实体癌、病毒阴性实体癌、白血病、鳞状细胞癌、merkel细胞癌、小儿恶性实体瘤、神经胶质瘤、甲状腺癌、非小细胞肺癌、霍奇金淋巴瘤和子宫癌。
[0029]
根据本发明所述的药物是一种用于治疗癌症的药物,该药物包含pd-1/pd-l1信号传导抑制剂,用于与vegf信号传导抑制剂联合使用,其中与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用相比,该药物改善了包含需要治疗癌症并且与pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂同时、分别或依次施用的个体的组中的应答率。
[0030]
根据本发明所述的药物是一种用于治疗癌症的药物,该药物包含vegf信号传导抑制剂,用于与pd-1/pd-l1信号传导抑制剂联合使用,其中与vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该药物改善了包含需要治疗癌症并且与pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂同时、分别或依次施用的个体的组中的应答率。
[0031]
根据本发明所述的药物是一种用于治疗癌症的药物,该药物包含pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂,其中与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用或vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该药物改善了包含需要治疗癌症并且与pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂同时、分别或依次施用的个体的组中的应答率。
[0032]
根据本发明所述的试剂盒是一种用于治疗个体中的癌症的试剂盒,该试剂盒包含pd-1/pd-l1信号传导抑制剂,用于与vegf信号传导抑制剂联合使用。
[0033]
根据本发明所述的试剂盒是一种用于治疗个体中的癌症的试剂盒,该试剂盒包含vegf信号传导抑制剂,用于与pd-1/pd-l1信号传导抑制剂联合使用。
[0034]
根据本发明所述的试剂盒是一种用于治疗个体中的癌症的试剂盒,该试剂盒包含vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂。
[0035]
根据本发明所述的试剂盒是一种用于治疗癌症的试剂盒,其中pd-1/pd-l1信号传导抑制剂与vegf信号传导抑制剂联合施用。
[0036]
根据本发明所述的上述试剂盒中的任一者是一种试剂盒,其中pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂同时、分别或依次施用。
[0037]
根据本发明所述的上述试剂盒中的任一者是一种试剂盒,其中vegf信号传导抑制剂为vegf拮抗剂或vegfr拮抗剂。
[0038]
根据本发明所述的上述试剂盒中的任一者是一种试剂盒,其中vegf信号传导抑制剂为抗vegf抗体或抗vegfr抗体。
[0039]
根据本发明所述的上述试剂盒中的任一者是一种试剂盒,其中抗vegf抗体或抗vegfr抗体为贝伐珠单抗、雷莫芦单抗或阿柏西普β。
[0040]
根据本发明所述的上述试剂盒中的任一者是一种试剂盒,其中pd-1/pd-l1信号传导抑制剂为pd-1拮抗剂或pd-l1拮抗剂。
[0041]
根据本发明所述的上述试剂盒中的任一者是一种试剂盒,其中pd-1/pd-l1信号传导抑制剂为amp-224、bms-936559、medi4736、msb0010718c、mpdl3280a、纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011)。
[0042]
根据本发明所述的上述试剂盒中的任一者是一种试剂盒,其中pd-1/pd-l1信号传导抑制剂为抗pd-l1抗体。
[0043]
根据本发明所述的上述试剂盒中的任一者可以是一种试剂盒,其中癌症选自由以下项组成的组:乳腺癌、肝癌、包括小细胞肺癌在内的肺癌、卵巢癌、胃癌、膀胱癌、胰腺癌、胆道癌、宫颈癌、子宫内膜癌、结肠癌、直肠癌、结直肠癌、肾癌、食道癌、前列腺癌、恶性黑素瘤、头颈部癌、恶性胸膜间皮瘤、胶质母细胞瘤、尿路上皮癌、软组织肉瘤、恶性淋巴瘤、多发性骨髓瘤、病毒阳性实体癌、病毒阴性实体癌、白血病、鳞状细胞癌、merkel细胞癌、小儿恶性实体瘤、神经胶质瘤、甲状腺癌、非小细胞肺癌、霍奇金淋巴瘤和子宫癌。
[0044]
根据本发明所述的试剂盒是一种用于治疗癌症的试剂盒,该试剂盒包含pd-1/pd-l1信号传导抑制剂,用于与vegf信号传导抑制剂联合使用,其中与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用相比,该试剂盒改善了包含需要治疗癌症并且与pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂同时、分别或依次施用的个体的组中的应答率。
[0045]
根据本发明所述的试剂盒是一种用于治疗癌症的试剂盒,该试剂盒包含vegf信号传导抑制剂,用于与pd-1/pd-l1信号传导抑制剂联合使用,其中与vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该试剂盒改善了包含需要治疗癌症并且与pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂同时、分别或依次施用的个体的组中的应答率。
[0046]
根据本发明所述的药物是一种用于治疗癌症的试剂盒,该试剂盒包含pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂,其中与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用或vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该试剂盒改善了包含需要治疗癌症并且与pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂同时、分别或依次施用的个体的组中的应答率。
[0047]
根据本发明所述的治疗方法是一种用于治疗癌症的方法,该方法包括以下步骤:向个体施用根据本文所述的相应实施例中的本发明的药物和试剂盒以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合中的一种或多种。
[0048]
根据本发明所述的用途是pd-1/pd-l1信号传导抑制剂和/或vegf信号传导抑制剂用于制备本发明的药物或试剂盒的用途。
[0049]
根据本发明所述的vegf信号传导抑制剂是一种用于治疗癌症的vegf信号传导抑制剂,并且与pd-1/pd-l1信号传导抑制剂联合施用于有此需要的个体。
[0050]
根据本发明所述的pd-1/pd-l1信号传导抑制剂是一种用于治疗癌症的pd-1/pd-l1信号传导抑制剂,并且与vegf信号传导抑制剂联合施用于有此需要的个体。
[0051]
根据本发明所述的组合是一种vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂的组合,其用于治疗癌症。
[0052]
本发明的有利效果
[0053]
根据本发明所述的药物、治疗方法、试剂盒和用途以及以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合与vegf信号传导抑制剂或pd-1/pd-l1信号传导抑制剂各自单独使用相比,可更有效地治疗个体中的癌症。更具体地,与vegf信号传导抑制剂或pd-1/pd-l1信号传导抑制剂各自单独使用相比,本发明可更有效地治疗个体中的对pd-1/pd-l1信号传导抑制剂无应答的癌症。
附图说明
[0054]
图1显示了pd-l1蛋白(a)和cd8蛋白(b)在荷ov2944-hm-1癌小鼠肿瘤组织(hm-1)和在荷colon 38癌小鼠肿瘤组织(colon 38)中的基线(未给药)肿瘤内表达。在荷ov2944-hm-1癌小鼠组中,对六只小鼠进行治疗。在荷colon 38癌小鼠组中,对一只小鼠(初步试验针对多个个体)进行治疗。
[0055]
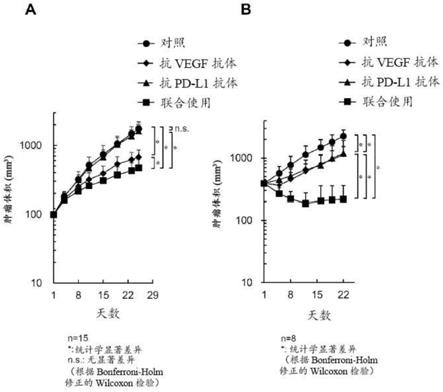
图2显示了在分别接受单一疗法施用(5mg/kg抗pd-l1抗体(克隆6e11),每周两次;或10mg/kg抗vegf抗体(克隆b20-4.1.1),每周一次)或联合使用抗pd-l1抗体和抗vegf抗体或相同剂量的对照抗体(对照)的小鼠中,小鼠卵巢癌细胞系ov2944-hm-1(a)或小鼠结直肠癌细胞系colon 38(b)的肿瘤体积的变化。在每组中,对15只(a)小鼠或8只(b)小鼠进行治疗。绘制每组中肿瘤体积的平均值和sd数据条。
[0056]
图3显示了显示了在设置类似于图2a的每个施用组中,开始施用后第8天荷ov2944-hm-1癌小鼠的肿瘤中的所有活细胞中cd8呈阳性的t细胞的比例(a)和颗粒酶b呈阳性、cd8呈阳性的t细胞的比例(b)。在每组中,对14-15只(a)小鼠或15只(b)小鼠进行治疗。绘制每组中细胞比例的平均值和sd数据条。另外,该图显示了组织切片(c),其中在设置类似于图2a的每个施用组中,开始施用后第8天在荷ov2944-hm-1癌小鼠中通过免疫组织化学法检测到的肿瘤内cd8蛋白,并且显示了该蛋白的表达水平的定量结果(d)。在每组中,对14-15只小鼠(c,d)进行治疗。绘制每组中肿瘤体积的平均值和sd数据条。
[0057]
图4a显示了在相应的对照组、抗vegf抗体单独施用组以及抗pd-l1抗体和抗vegf抗体联合使用组(联合使用)中,在联合使用抗cd8α抗体(白色(+抗cd8α抗体))的情况下和不联合使用抗体(黑色)的情况下,荷ov2944-hm-1癌小鼠的肿瘤体积随时间的变化。在每组中,对14只小鼠进行治疗。绘制每组中肿瘤体积的平均值和sd数据条。图4b显示了在施用抗pd-l1抗体、抗vegf抗体、抗cd8α抗体(+)或相应的对照抗体(-)的各组中,开始施用后第22天时荷ov2944-hm-1癌小鼠的肿瘤体积。在每组中,对14只小鼠进行治疗。绘制每组中肿瘤体积的平均值和sd数据条。
[0058]
图5a显示了在设置类似于图2a的每个施用组中,开始施用后第8天时荷ov2944-hm-1癌小鼠的肿瘤组织中每1mg蛋白中cxcl9蛋白的表达水平。在每组中,对14-15只小鼠进行治疗。绘制每组中细胞比例的平均值和sd数据条。图5b显示了在施用抗pd-l1抗体、抗vegf抗体、抗cxcr3抗体(+)或相应的对照抗体(-)的各组中,开始施用后第8天时荷ov2944-hm-1癌小鼠的肿瘤中所有活细胞中cd8呈阳性的t细胞的比例。在每组中,对16只小鼠进行治疗。绘制每组中细胞比例的平均值和sd数据条。
[0059]
图6显示了在设置类似于图2a的每个施用组中,开始施用后第8天时荷ov2944-hm-1癌小鼠的肿瘤组织中mhc i类分子的蛋白质表达水平,用平均荧光强度(mfi)来表示。在每组中,对15只小鼠进行治疗。绘制每组中细胞比例的平均值和sd数据条。
[0060]
图7显示了组织切片(a),其中在设置类似于图2a的每个施用组中,开始施用后第8天,在荷ov2944-hm-1癌小鼠的肿瘤组织中通过免疫组织化学法检测到的肿瘤内微血管密度(mvd),并且显示了mvd的定量结果(b)。在每组中,对7只小鼠进行治疗。绘制每组中细胞比例的平均值和sd数据条。
具体实施方式
[0061]
将通过以下实例对本发明的实施例进行详细说明。在实施例和实例中未特别说明的情况下,使用标准方案中所述的方法,诸如以下文献中所使用的那些方法或其经修饰的和修改的方法:j.sambrook,e.f.fritsch和t.maniatis(编著),molecular cloning,a laboratory manual(第3版),cold spring harbor press,cold spring harbor,new york(2001);和f.m.ausubel,r.brent,r.e.kingston,d.d.moore,j.g.seidman,j.a.smith,k.struhl(编著),current protocols in molecular biology,john wiley&sons ltd.。此外,在使用商购获得的试剂盒或测量设备的情况下,除非有特别说明,否则均使用试剂盒或测量设备随附的方案。
[0062]
此外,根据本说明书中的描述,本领域的技术人员清楚本发明的目的、特征、优点和思路,并且基于本说明书中的描述,本领域的技术人员将能够轻松再现本发明。下文描述的本发明的实施例和具体实例显示了本发明的优选实施例。提供它们是出于说明或解释的目的,并不限制本发明。对于本领域技术人员而言清楚的是,在本文所公开的本发明的目的和范围内,可基于本说明书中的描述进行各种改变或修改。
[0063]
==根据本发明所述的药物==
[0064]
根据本发明所述的药物是一种用于治疗个体中的癌症的药物,其中pd-1/pd-l1信号传导抑制剂与vegf信号传导抑制剂联合施用。在该药物中,癌症优选地是对pd-1/pd-l1信号传导抑制剂有抗性的癌症。
[0065]
根据本发明所述的药物是一种用于治疗个体中的对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物。在一个实施例中,该药物包含pd-1/pd-l1信号传导抑制剂。该药物优选地是用于与vegf信号传导抑制剂联合使用的药物。
[0066]
根据本发明所述的药物是一种用于治疗个体中的对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物。在一个实施例中,该药物包含vegf信号传导抑制剂。该药物优选地是用于与pd-1/pd-l1信号传导抑制剂联合使用的药物。
[0067]
根据本发明所述的药物是一种用于治疗癌症的药物,其中在个体中已形成对pd-1/pd-l1信号传导抑制剂的抗性。在一个实施例中,该药物包含vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂。
[0068]
根据本发明所述的上述药物中的任一者可以是一种药物,其中pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂同时、分别或依次施用。此外,在根据本发明所述的上述药物中的任一者中,癌症可以是具有内在抗性或者已经获得抗性或复发的癌症。
[0069]
根据本发明所述的药物是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物。在一个实施例中,该药物包含pd-1/pd-l1信号传导抑制剂。该药物优选地是用于与vegf信号传导抑制剂联合使用的药物。在该药物中,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用相比,该药物改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0070]
根据本发明所述的药物是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物。在一个实施例中,该药物包含vegf信号传导抑制剂。该药物优选地是用于与pd-1/pd-l1信号传导抑制剂联合使用的药物。在该药物中,pd-1/pd-l1信号传导抑制剂和
vegf信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该药物改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0071]
根据本发明所述的药物是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物。在一个实施例中,该药物包含pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂。在该药物中,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用或vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该药物改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0072]
关于根据本发明所述的上述药物,其特征在于改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率;在一个实施例中,包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组可包括在施用pd-1/pd-l1信号传导抑制剂之前未通过诊断检查抗性存在或缺乏的个体。替代性地,在该药物的另一个实施例中,包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组可包括在施用pd-1/pd-l1信号传导抑制剂之前已经通过诊断检查抗性存在或缺乏并且确定其具有抗性的个体。在另一个实施例中,抗性可以是由常规治疗引起的抗性,该常规治疗包括pd-1/pd-l1信号传导抑制剂。
[0073]
关于根据本发明所述的上述药物中的任一者,vegf信号传导抑制剂可以是vegf拮抗剂或vegfr拮抗剂。
[0074]
关于根据本发明所述的上述药物中的任一者,vegf信号传导抑制剂可以是抗vegf抗体或抗vegfr抗体。在药物中,抗vegf抗体或抗vegfr抗体优选地为贝伐珠单抗、雷莫芦单抗或阿柏西普β。
[0075]
关于根据本发明所述的上述药物中的任一者,pd-1/pd-l1信号传导抑制剂可以是pd-1拮抗剂或pd-l1拮抗剂。在药物中,pd-1拮抗剂可以是amp-224、bms-936559、medi4736、msb0010718c、mpdl3280a、纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011)。在药物中,pd-1拮抗剂优选地为抗pd-1抗体,进一步优选地为纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011),并且更优选地为纳武单抗或帕博利珠单抗。此外,在药物中,pd-l1拮抗剂可以是抗pd-l1抗体。在药物中,pd-l1拮抗剂可以是德瓦鲁单抗、阿替利珠单抗、阿维单抗(msb0010718c)、bms-936559、mpdl3280a或medi4736,并且优选地为德瓦鲁单抗、阿替利珠单抗或阿维单抗。
[0076]
根据本发明所述的上述药物中的任一者可以是一种药物,其中癌症选自由以下项组成的组:乳腺癌、肝癌、包括小细胞肺癌在内的肺癌、卵巢癌、胃癌、膀胱癌、胰腺癌、胆道癌、宫颈癌、子宫内膜癌、结肠癌、直肠癌、结直肠癌、肾癌、食道癌、前列腺癌、恶性黑素瘤、头颈部癌、恶性胸膜间皮瘤、胶质母细胞瘤、尿路上皮癌、软组织肉瘤、恶性淋巴瘤、多发性骨髓瘤、病毒阳性实体癌、病毒阴性实体癌、白血病、鳞状细胞癌、merkel细胞癌、小儿恶性实体瘤、神经胶质瘤、甲状腺癌、非小细胞肺癌、霍奇金淋巴瘤和子宫癌。
[0077]
==根据本发明所述的试剂盒==
[0078]
根据本发明所述的试剂盒是一种包含vegf信号传导抑制剂和/或pd-1/pd-l1信号
l1信号传导抑制剂。
[0087]
关于根据本发明所述的上述试剂盒中的任一者,vegf信号传导抑制剂可以是vegf拮抗剂或vegfr拮抗剂。
[0088]
关于根据本发明所述的上述试剂盒中的任一者,vegf信号传导抑制剂可以是抗vegf抗体或抗vegfr抗体。在该试剂盒中,抗vegf抗体或抗vegfr抗体优选地为贝伐珠单抗、雷莫芦单抗或阿柏西普β。
[0089]
关于根据本发明所述的上述试剂盒中的任一者,pd-1/pd-l1信号传导抑制剂可以是pd-1拮抗剂或pd-l1拮抗剂。在该试剂盒中,pd-1拮抗剂可以是amp-224、bms-936559、medi4736、msb0010718c、mpdl3280a、纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011)。在该试剂盒中,pd-1拮抗剂优选地为抗pd-1抗体,进一步优选地为纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011),并且更优选地为纳武单抗或帕博利珠单抗。此外,在该试剂盒中,pd-l1拮抗剂可以是抗pd-l1抗体。在该试剂盒中,pd-l1拮抗剂可以是德瓦鲁单抗、阿替利珠单抗、阿维单抗、bms-936559、msb0010718c、mpdl3280a或medi4736,并且优选地为德瓦鲁单抗、阿替利珠单抗或阿维单抗。
[0090]
根据本发明所述的上述试剂盒中的任一者可以是一种试剂盒,其中癌症选自由以下项组成的组:乳腺癌、肝癌、包括小细胞肺癌在内的肺癌、卵巢癌、胃癌、膀胱癌、胰腺癌、胆道癌、宫颈癌、子宫内膜癌、结肠癌、直肠癌、结直肠癌、肾癌、食道癌、前列腺癌、恶性黑素瘤、头颈部癌、恶性胸膜间皮瘤、胶质母细胞瘤、尿路上皮癌、软组织肉瘤、恶性淋巴瘤、多发性骨髓瘤、病毒阳性实体癌、病毒阴性实体癌、白血病、鳞状细胞癌、merkel细胞癌、小儿恶性实体瘤、神经胶质瘤、甲状腺癌、非小细胞肺癌、霍奇金淋巴瘤和子宫癌。
[0091]
==根据本发明所述的治疗方法==
[0092]
根据本发明所述的治疗方法是一种用于治疗个体中的癌症的方法。
[0093]
在一个实施例中,根据本发明所述的治疗方法包括向个体施用pd-1/pd-l1信号传导抑制剂的步骤。在该治疗方法中,pd-1/pd-l1信号传导抑制剂优选地与vegf信号传导抑制剂联合施用。
[0094]
在一个实施例中,根据本发明所述的治疗方法包括向个体施用vegf信号传导抑制剂。在该治疗方法中,vegf信号传导抑制剂优选地与pd-1/pd-l1信号传导抑制剂联合施用。
[0095]
在一个实施例中,根据本发明所述的治疗方法包括向个体施用pd-1/pd-l1信号传导抑制剂的步骤和施用vegf信号传导抑制剂的步骤。
[0096]
在根据本发明所述的上述治疗方法中的任一者中,癌症优选地为对pd-1/pd-l1信号传导抑制剂有抗性的癌症。
[0097]
在根据本发明所述的上述治疗方法中的任一者中,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或依次施用。此外,在根据本发明所述的上述治疗方法中的任一者中,癌症可以是具有内在抗性或者已经获得抗性或复发的癌症。
[0098]
根据本发明所述的治疗方法是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的治疗方法。在一个实施例中,该治疗方法包括施用pd-1/pd-l1信号传导抑制剂的步骤。在该治疗方法中,pd-1/pd-l1信号传导抑制剂优选地与vegf信号传导抑制剂联合施用。在该治疗方法中,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或
依次施用。在一个实施例中,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用相比,该治疗方法改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0099]
根据本发明所述的治疗方法是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的治疗方法。在一个实施例中,该治疗方法包括施用vegf信号传导抑制剂的步骤。在该治疗方法中,pd-1/pd-l1信号传导抑制剂优选地与vegf信号传导抑制剂联合施用。在该治疗方法中,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用相比,该治疗方法改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0100]
根据本发明所述的治疗方法是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的治疗方法。在一个实施例中,该治疗方法包括施用pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂的步骤。在该治疗方法中,vegf信号传导抑制剂优选地与pd-1/pd-l1信号传导抑制剂联合施用。在该治疗方法中,vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用或vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该治疗方法改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0101]
关于根据本发明所述的上述治疗方法,其改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率;在一个实施例中,包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组可包括在施用pd-1/pd-l1信号传导抑制剂之前未通过诊断检查抗性存在或缺乏的个体。替代性地,在治疗方法的另一个实施例中,包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组可包括在施用pd-1/pd-l1信号传导抑制剂之前已经通过诊断检查抗性存在或缺乏并且确定其具有抗性的个体。在另一个实施例中,抗性可以是由常规治疗引起的抗性,该常规治疗包含pd-1/pd-l1信号传导抑制剂。
[0102]
在根据本发明所述的上述治疗方法中的任一者中,vegf信号传导抑制剂可以是vegf拮抗剂或vegfr拮抗剂。
[0103]
在根据本发明所述的上述治疗方法中的任一者中,vegf信号传导抑制剂可以是抗vegf抗体或抗vegfr抗体。在该治疗方法中,抗vegf抗体或抗vegfr抗体优选地为贝伐珠单抗、雷莫芦单抗或阿柏西普β。
[0104]
在根据本发明所述的上述治疗方法中的任一者中,pd-1/pd-l1信号传导抑制剂可以是pd-1拮抗剂或pd-l1拮抗剂。在该治疗方法中,pd-1拮抗剂可以是amp-224、bms-936559、medi4736、msb0010718c、mpdl3280a、纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011)。在该治疗中,pd-1拮抗剂优选为抗pd-1抗体,进一步优选为纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011),并且更优选为纳武单抗或帕博利珠单抗。此外,在该治疗方法中,pd-l1拮抗剂可以是抗pd-l1抗体。在该治疗中,pd-l1拮抗剂可以是德瓦鲁单抗、阿替利珠单抗、阿维单抗、bms-936559、msb0010718c、mpdl3280a或medi4736,并且优选地为德瓦鲁
单抗、阿替利珠单抗或阿维单抗。
[0105]
在根据本发明所述的上述治疗方法中的任一者中,癌症可选自由以下项组成的组:乳腺癌、肝癌、包括小细胞肺癌在内的肺癌、卵巢癌、胃癌、膀胱癌、胰腺癌、胆道癌、宫颈癌、子宫内膜癌、结肠癌、直肠癌、结直肠癌、肾癌、食道癌、前列腺癌、恶性黑素瘤、头颈部癌、恶性胸膜间皮瘤、胶质母细胞瘤、尿路上皮癌、软组织肉瘤、恶性淋巴瘤、多发性骨髓瘤、病毒阳性实体癌、病毒阴性实体癌、白血病、鳞状细胞癌、merkel细胞癌、小儿恶性实体瘤、神经胶质瘤、甲状腺癌、非小细胞肺癌、霍奇金淋巴瘤和子宫癌。
[0106]
==根据本发明所述的用途==
[0107]
根据本发明所述的用途是pd-1/pd-l1信号传导抑制剂和/或vegf信号传导抑制剂用于制备本发明的药物或试剂盒的用途。
[0108]
根据本发明所述的用途,药物或试剂盒是一种用于治疗个体中的癌症的药物或试剂盒。在该用途中,癌症优选地是对pd-1/pd-l1信号传导抑制剂有抗性的癌症。
[0109]
在根据本发明所述的用途中,药物或试剂盒是一种用于治疗个体中的对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物或试剂盒。在用途的一个实施例中,药物或试剂盒在一个实施例中包含pd-1/pd-l1信号传导抑制剂。该药物或试剂盒优选地是用于与vegf信号传导抑制剂联合使用的药物或试剂盒。
[0110]
在根据本发明所述的用途中,药物或试剂盒是一种用于治疗个体中的对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物或试剂盒。在一个实施例中,该药物或试剂盒包含vegf信号传导抑制剂。该药物或试剂盒优选地是用于与pd-1/pd-l1信号传导抑制剂联合使用的药物或试剂盒。
[0111]
根据本发明所述的用途,药物或试剂盒是一种用于治疗个体中的对pd-1/pd-l1信号传导抑制剂获得抗性的癌症的药物或试剂盒。在一个实施例中,药物或试剂盒包含vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂。
[0112]
在根据本发明所述的上述用途中的任一者中,药物或试剂盒可以是一种药物或试剂盒,其中pd-1/pd-l1信号传导抑制剂和所述vegf信号传导抑制剂同时、分别或依次施用。此外,在根据本发明所述的上述用途中的任一者中,癌症可以是具有内在抗性或者已经获得抗性或复发的癌症。
[0113]
在根据本发明所述的用途中,药物或试剂盒是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物或试剂盒。在一个实施例中,药物或试剂盒包含pd-1/pd-l1信号传导抑制剂。该药物或试剂盒优选地是用于与vegf信号传导抑制剂联合使用的药物或试剂盒。在该药物或试剂盒中,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用相比,该药物或试剂盒改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0114]
在根据本发明所述的用途中,药物或试剂盒是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物或试剂盒。在一个实施例中,该药物或试剂盒包含vegf信号传导抑制剂。该药物或试剂盒优选地是用于与pd-1/pd-l1信号传导抑制剂联合使用的药物或试剂盒。在该药物或试剂盒中,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑
制剂联合施用相比,该药物或试剂盒改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0115]
在根据本发明所述的用途中,药物或试剂盒是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的药物或试剂盒。在一个实施例中,药物或试剂盒包含vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂。在该药物或试剂盒中,vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用或vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该药物或试剂盒改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0116]
关于根据本发明所述的上述用途,其特征在于改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率;在一个实施例中,包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组可包括在施用pd-1/pd-l1信号传导抑制剂之前未通过诊断检查抗性存在或缺乏的个体。替代性地,在药物或试剂盒的另一个实施例中,包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组可包括在施用pd-1/pd-l1信号传导抑制剂之前已经通过诊断检查抗性存在或缺乏并且确定其具有抗性的个体。在另一个实施例中,抗性可以是由常规治疗引起的抗性,该常规治疗包含pd-1/pd-l1信号传导抑制剂。
[0117]
在根据本发明所述的上述用途中的任一者中,vegf信号传导抑制剂可以是vegf拮抗剂或vegfr拮抗剂。
[0118]
在根据本发明所述的上述用途中的任一者中,vegf信号传导抑制剂可以是抗vegf抗体或抗vegfr抗体。在该用途中,抗vegf抗体或抗vegfr抗体优选地为贝伐珠单抗、雷莫芦单抗或阿柏西普β。
[0119]
在根据本发明所述的上述用途中的任一者中,pd-1/pd-l1信号传导抑制剂可以是pd-1拮抗剂或pd-l1拮抗剂。在该用途中,pd-1拮抗剂可以是amp-224、bms-936559、medi4736、msb0010718c、mpdl3280a、纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011)。在该用途中,pd-1拮抗剂优选地为抗pd-1抗体,进一步优选地为纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011),并且更优选地为纳武单抗或帕博利珠单抗。此外,在该用途中,pd-l1拮抗剂可以是抗pd-l1抗体。在该用途中,pd-l1拮抗剂可以是德瓦鲁单抗、阿替利珠单抗、阿维单抗、bms-936559、msb0010718c、mpdl3280a或medi4736,并且优选地为德瓦鲁单抗、阿替利珠单抗或阿维单抗。
[0120]
根据本发明所述的上述药物中的任一者可以是一种药物,其中癌症选自由以下项组成的组:乳腺癌、肝癌、包括小细胞肺癌在内的肺癌、卵巢癌、胃癌、膀胱癌、胰腺癌、胆道癌、宫颈癌、子宫内膜癌、结肠癌、直肠癌、结直肠癌、肾癌、食道癌、前列腺癌、恶性黑素瘤、头颈部癌、恶性胸膜间皮瘤、胶质母细胞瘤、尿路上皮癌、软组织肉瘤、恶性淋巴瘤、多发性骨髓瘤、病毒阳性实体癌、病毒阴性实体癌、白血病、鳞状细胞癌、merkel细胞癌、小儿恶性实体瘤、神经胶质瘤、甲状腺癌、非小细胞肺癌、霍奇金淋巴瘤和子宫癌。
[0121]
==根据本发明所述的用于治疗癌症的vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或其组合==
[0122]
根据本发明所述的vegf信号传导抑制剂是一种用于治疗癌症的vegf信号传导抑制剂。vegf信号传导抑制剂优选地与pd-1/pd-l1信号传导抑制剂联合施用于有此需要的个体。vegf信号传导抑制剂优选地是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的vegf信号传导抑制剂。
[0123]
根据本发明所述的pd-1/pd-l1信号传导抑制剂是一种用于治疗癌症的pd-1/pd-l1信号传导抑制剂。pd-1/pd-l1信号传导抑制剂优选地与vegf信号传导抑制剂联合施用于有此需要的个体。pd-1/pd-l1信号传导抑制剂优选地是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的pd-1/pd-l1信号传导抑制剂。
[0124]
根据本发明所述的vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂的组合是一种用于治疗癌症的组合。该组合优选地是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的组合。
[0125]
关于根据本发明所述的上述vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或其组合中的任一者,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或依次施用。此外,在根据本发明所述的上述vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或其组合中的任一者中,癌症可以是具有内在抗性或者已经获得抗性或复发的癌症。
[0126]
根据本发明所述的vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或其组合是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或其组合。在一个实施例中,vegf信号传导抑制剂优选地与pd-1/pd-l1信号传导抑制剂联合使用。在一个实施例中,pd-1/pd-l1信号传导抑制剂优选地与vegf信号传导抑制剂联合使用。在本发明中,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用相比,pd-1/pd-l1信号传导抑制剂或组合改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0127]
根据本发明所述的vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或其组合是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或其组合。在一个实施例中,vegf信号传导抑制剂优选地与pd-1/pd-l1信号传导抑制剂联合使用。在一个实施例中,pd-1/pd-l1信号传导抑制剂优选地与vegf信号传导抑制剂联合使用。在本发明中,pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,vegf信号传导抑制剂或组合改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0128]
根据本发明所述的组合是一种用于治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂的组合。在一个实施例中,该组合包含vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂。在该组合中,vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂可同时、分别或依次施用。在一个实施例中,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用或vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该组合改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率。
[0129]
关于根据本发明所述的上述vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或
组合,本发明的特征在于改善了包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组中的应答率;在一个实施例中,包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组可包括在施用pd-1/pd-l1信号传导抑制剂之前未通过诊断检查抗性存在或缺乏的个体。替代性地,在本发明的另一个实施例中,包含需要治疗对pd-1/pd-l1信号传导抑制剂有抗性的癌症的个体的组可包括在施用pd-1/pd-l1信号传导抑制剂之前已经通过诊断检查抗性存在或缺乏并且确定其具有抗性的个体。在另一个实施例中,抗性可以是由常规治疗引起的抗性,该常规治疗包含pd-1/pd-l1信号传导抑制剂。
[0130]
关于根据本发明所述的上述vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或组合中的任一者,vegf信号传导抑制剂可以是vegf拮抗剂或vegfr拮抗剂。
[0131]
关于根据本发明所述的上述vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或组合中的任一者,vegf信号传导抑制剂可以是抗vegf抗体或抗vegfr抗体。在药物中,抗vegf抗体或抗vegfr抗体优选地为贝伐珠单抗、雷莫芦单抗或阿柏西普β。
[0132]
关于根据本发明所述的上述vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或组合中的任一者,pd-1/pd-l1信号传导抑制剂可以是pd-1拮抗剂或pd-l1拮抗剂。在本发明中,pd-1拮抗剂可以是amp-224、bms-936559、medi4736、msb0010718c、mpdl3280a、纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011)。在本发明中,pd-1拮抗剂优选地为抗pd-1抗体,进一步优选地为纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011),并且更优选地为纳武单抗或帕博利珠单抗。此外,在本发明中,pd-l1拮抗剂可以是抗pd-l1抗体。在本发明中,pd-l1拮抗剂可以是德瓦鲁单抗、阿替利珠单抗、阿维单抗、bms-936559、msb0010718c、mpdl3280a或medi4736,并且优选地为德瓦鲁单抗、阿替利珠单抗或阿维单抗。
[0133]
关于根据本发明所述的上述vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂或组合中的任一者,癌症可选自由以下项组成的组:乳腺癌、肝癌、包括小细胞肺癌在内的肺癌、卵巢癌、胃癌、膀胱癌、胰腺癌、胆道癌、宫颈癌、子宫内膜癌、结肠癌、直肠癌、结直肠癌、肾癌、食道癌、前列腺癌、恶性黑素瘤、头颈部癌、恶性胸膜间皮瘤、胶质母细胞瘤、尿路上皮癌、软组织肉瘤、恶性淋巴瘤、多发性骨髓瘤、病毒阳性实体癌、病毒阴性实体癌、白血病、鳞状细胞癌、merkel细胞癌、小儿恶性实体瘤、神经胶质瘤、甲状腺癌、非小细胞肺癌、霍奇金淋巴瘤和子宫癌。
[0134]
本发明的一个实施例是一种用于治疗个体中的癌症的药物。在本实施例的药物中,pd-1/pd-l1信号传导抑制剂与vegf信号传导抑制剂联合施用。
[0135]
本发明的一个实施例是一种包含pd-1/pd-l1信号传导抑制剂的药物。本实施例的药物与vegf信号传导抑制剂联合施用于有此需要的个体以用于治疗癌症。
[0136]
本发明的一个实施例是一种包含vegf信号传导抑制剂的药物。本实施例的药物与pd-1/pd-l1信号传导抑制剂联合施用于有此需要的个体以用于治疗癌症。
[0137]
本发明的一个实施例是一种包含vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂的药物,并且施用于有此需要的个体以用于治疗癌症。
[0138]
本发明的一个实施例是一种包含pd-1/pd-l1信号传导抑制剂或vegf信号传导抑制剂的药物,并且与对照组相比,改善了包括需要治疗癌症的个体的组中的应答率。在本实
施例中,药物是一种包含pd-1/pd-l1信号传导抑制剂的药物并且可用于与vegf信号传导抑制剂联合使用。在这种情况下,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用相比,该药物改善了组中的应答率。在另一个实施例中,药物是一种包含vegf信号传导抑制剂的药物并且可用于与pd-1/pd-l1信号传导抑制剂联合使用。在这种情况下,与vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,该药物改善了组中的应答率。
[0139]
本发明的一个实施例是一种用于治疗癌症的试剂盒,该试剂盒包含vegf信号传导抑制剂和/或pd-1/pd-l1信号传导抑制剂。
[0140]
本发明的药物和试剂盒除vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂之外,可与另一种用于治疗癌症的附加药物等联合使用,或与已知疗法诸如放射疗法或手术联合使用。
[0141]
本发明的药物和试剂盒包括其中将是活性成分的pd-1/pd-l1信号传导抑制剂和/或vegf信号传导抑制剂配制为单一制剂(复方药物)的药物或试剂盒的实施例,或者包含两种或更多种单独配制的制剂的药物或试剂盒的实施例。
[0142]
根据本发明所述的治疗方法是一种用于治疗有此需要的个体中的癌症的治疗方法。该治疗方法包括以下步骤:向个体施用根据本文所述的相应实施例中的本发明的药物和试剂盒以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合中的一种或多种。
[0143]
本发明的治疗方法可包括使用除本文具体所述的本发明的药物和试剂盒以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合之外的另一种用于治疗癌症的药物、药剂或试剂盒等进行治疗的步骤,或实施已知疗法诸如放射疗法或手术的步骤。该其他药物可包括一种或多种化疗剂。
[0144]
本发明所述的用途是一种pd-1/pd-l1信号传导抑制剂和/或vegf信号传导抑制剂用于制备本发明的药物或试剂盒的用途。本发明的用途除pd-1/pd-l1信号传导抑制剂和/或vegf信号传导抑制剂之外,可包括使用另一种用于治疗癌症的药剂或已知疗法诸如放射疗法或手术。所述其他药剂可包括一种或多种化疗剂。
[0145]
本发明的vegf信号传导抑制剂是一种用于治疗癌症的vegf信号传导抑制剂。vegf信号传导抑制剂优选地与pd-1/pd-l1信号传导抑制剂联合施用于有此需要的个体。本发明的vegf信号传导抑制剂除pd-1/pd-l1信号传导抑制剂之外,可与另一种用于治疗癌症的附加药物、药剂或试剂盒等联合使用,或与已知疗法诸如放射疗法或手术联合使用。
[0146]
本发明的pd-1/pd-l1信号传导抑制剂是一种用于治疗癌症的pd-1/pd-l1信号传导抑制剂。pd-1/pd-l1信号传导抑制剂优选地与vegf信号传导抑制剂联合施用于有此需要的个体。本发明的pd-1/pd-l1信号传导抑制剂除vegf信号传导抑制剂之外,可与另一种用于治疗癌症的附加药物、药剂或试剂盒等联合使用,或与已知疗法诸如放射疗法或手术联合使用。
[0147]
本发明的组合是一种vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂的组合,其用于治疗癌症。本发明的组合除vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂之外,可与另一种用于治疗癌症的附加药物、药剂或试剂盒等联合使用,或与已知疗法诸如放射疗法或手术联合使用。
[0148]
与单独或分别使用vegf信号传导抑制剂或pd-1/pd-l1信号传导抑制剂相比,向患有癌症的个体联合施用pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂提供了更高的效应,即协同效应。因此,在根据本发明所述的药物、治疗方法、试剂盒和用途以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合(在下文中也称作“本发明的药物等”或“根据本发明所述的药物等”)中,优选其中vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂联合施用的实施例。
[0149]
在此,在本发明的药物、治疗方法、试剂盒和用途以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合中,可以与vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂联合施用的化疗剂对于所治疗的癌症是公开已知物质的或新型抗癌物质。更具体地,它们可以是例如但不限于:厄洛替尼、卡培他滨、左旋亚叶酸钙、亚叶酸钙、卡铂、环磷酰胺、顺铂、多西他赛、奈达铂、紫杉醇、吡柔比星、氟尿嘧啶(5-fu)、博来霉素、丝裂霉素c、替加氟-尿嘧啶制剂、替加氟-尿嘧啶-氧嗪酸钾制剂、替加氟、阿克拉比星、安布比星、异环磷酰胺、盐酸伊立替康水合物、拓扑替康、依托泊苷、克唑替尼、盐酸吉西他滨、阿糖胞苷、阿霉素、尼莫司汀、替莫唑胺、盐酸拓扑替康、培美曲塞钠水合物、依维莫司、表柔比星、依西美坦、戈舍瑞林、他莫昔芬、地塞米松、多西氟啶、托瑞米芬、长春瑞滨、吡柔比星、泼尼松龙、甲氨蝶呤、拉帕替尼、美雄烷、米托蒽醌、甲羟孕酮、亮丙瑞林、来曲唑、奥曲肽、长春地辛和替西白介素。
[0150]
本领域的技术人员可根据待治疗的癌症的类型、治疗效果、患者病情、耐受性以及vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂的类型,选择适当的可与vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂联合施用的化疗剂的类型。但是,在使用贝伐珠单抗作为vegf信号传导抑制剂并且使用阿替利珠单抗作为pd-1/pd-l1信号传导抑制剂的情况下,化疗剂优选地为卡铂、多西他赛、紫杉醇、依托泊苷、卡培他滨、奥沙利铂、氟尿嘧啶、左旋亚叶酸钙、亚叶酸钙、盐酸伊立替康水合物、盐酸吉西他滨、顺铂、替莫唑胺或盐酸拓扑替康或它们的组合,并且更优选地为卡铂和/或紫杉醇。
[0151]
在pd-1/pd-l1信号传导抑制剂或vegf信号传导抑制剂单独并且分别施用于癌症的情况下,当癌症对这些药剂中的每一种均有应答时,获得有效的抗癌作用。此外,如实例中所示,与施用pd-1/pd-l1信号传导抑制剂或vegf信号传导抑制剂所获得的抗癌作用中的每一种相比,认为将pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂联合施用于对这些药剂中的每一种均有应答的癌症时具有明显更高的抗癌作用,即具有协同效应。因此,利用本发明的药物等,联合使用pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂的癌症治疗比单独并且分别使用pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂更有效。因此,在本法的药物和试剂盒以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合中,优选地使用pd-1/pd-l1信号传导抑制剂与vegf信号传导抑制剂的组合治疗癌症。
[0152]
此外,在其中癌症对pd-1/pd-l1信号传导抑制剂无应答的情况下,与对pd-1/pd-l1信号传导抑制剂有应答的癌症相比,使用pd-1/pd-l1信号传导抑制剂进行治疗时具有明显较低或者完全观察不到或几乎观察不到的抗癌作用。但是,与vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合使用相比,认为联合使用pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂治疗对pd-1/pd-l1信号传导抑制剂无应答的癌症时具有明显更高的抗癌作用。通过联合施用所获得的效果自然明显高于pd-1/pd-l1信号传导抑制剂不与vegf
信号传导抑制剂联合使用的情况下。因此,本发明的药物等特别在对pd-1/pd-l1信号传导抑制剂无应答的癌症并且难以治疗的癌症中表现出其功效。
[0153]
如上所述,无论癌症对pd-1/pd-l1信号传导抑制剂有应答还是无应答,通过联合使用pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂,本发明的药物等与单独并且分别使用pd-1/pd-l1信号传导抑制剂或vegf信号传导抑制剂相比,具有明显更高的抗癌作用,即具有协同效应。
[0154]
因此,在包括需要癌症治疗的个体的组中,利用本发明的药物等(将pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂联合使用)治疗癌症时,该组中的每个个体均获得了高于不经此类治疗的对照组的抗癌作用。在此,对照组为包括需要治疗癌症的个体的组,并且可以是既不施用pd-1/pd-l1信号传导抑制剂也不施用vegf信号传导抑制剂的组、施用pd-1/pd-l1信号传导抑制剂(不与vegf信号传导抑制剂联合)的组或施用vegf信号传导抑制剂(不与pd-1/pd-l1信号传导抑制剂联合)的组。
[0155]
例如,在本发明的药物为包含用于与vegf信号传导抑制剂联合使用的pd-1/pd-l1信号传导抑制剂的药物的情况下,与pd-1/pd-l1信号传导抑制剂不与vegf信号传导抑制剂联合施用相比,在作为包含需要治疗癌症的个体的集合的组中的每个个体中具有更高的抗癌作用。例如,在本发明的药物为包含用于与pd-1/pd-l1信号传导抑制剂的vegf信号传导抑制剂的药物的情况下,与vegf信号传导抑制剂不与pd-1/pd-l1信号传导抑制剂联合施用相比,在作为包含需要治疗癌症的集合的组中的每个个体中具有更高的抗癌作用。
[0156]
如已经说明的,通过使用pd-1/pd-l1信号传导抑制剂与vegf信号传导抑制剂的组合进行治疗,本发明的药物等对于对pd-1/pd-l1信号传导抑制剂无应答的癌症也有效。因此,在上述“组”(包括需要癌症治疗的个体的集合)是对pd-1/pd-l1信号传导抑制剂无应答的癌症的个体的集合的情况下,特别表现出本发明的药物等的功效。当本发明的药物等用于包含对pd-1/pd-l1信号传导抑制剂无应答的癌症的个体的组中时,与分别使用pd-1/pd-l1信号传导抑制剂或vegf信号传导抑制剂相比,可增加识别出抗癌作用的个体的比例,即改善了应答率。另外,无应答性不受特别限制,只要是对pd-1/pd-l1信号传导抑制剂的无应答性或抗性即可,并且可以是癌症已获得抗性或复发的内在抗性或无应答性。在一个实施例中,包括需要治疗癌症的个体的组包括尚未确定为有抗性的个体。在另一个实施例中,包括需要治疗癌症的个体的组包括已确定通过常规治疗获得抗性的个体。在本实施例中,例如,药物可以是包含pd-1/pd-l1信号传导抑制剂的药物,用于与vegf信号传导抑制剂联合使用,或者是包含vegf信号传导抑制剂的药物,用于与pd-1/pd-l1信号传导抑制剂联合使用。
[0157]
在一个实施例中,包括需要治疗癌症的个体的组可以是这样的组,其中包括在接受pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂联合治疗之前尚未确定是否存在对pd-1/pd-l1信号传导抑制剂无应答性的癌症的个体。在一个实施例中,对于包括需要治疗癌症的个体的组中的至少一部分个体,可以在使用pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂的组合进行治疗之前确定是否存在对pd-1/pd-l1信号传导抑制剂无应答性的癌症。无应答性不受特别限制,只要是对pd-1/pd-l1信号传导抑制剂的无应答性或抗性即可,并且可以是内在抗性。如上所述,在癌症对pd-1/pd-l1信号传导抑制剂无应答的情况下,特别表现出本发明的药物等的功效,并由此可以改善包括需要治疗癌症的个体的组中
的应答率。
[0158]
在能够确定的前提下,用于确定是否存在对pd-1/pd-l1信号传导抑制剂抗性的癌症的方法不受限制。但是,例如,可基于是否存在标志物来确定,其通过检测在治疗之前采集的癌症组织中是否存在在具有此类抗性的癌症中特异性表现出的标志物(诸如基因、抗体或组织学特征)来实现。本领域的技术人员可从已知方法中任意选择遗传或组织学方法进行确定。
[0159]
在此,在本发明的药物等有效的前提下,利用本发明的药物等治疗的癌症不受限制。但是,例如,它可以选自由以下项组成的组:乳腺癌、肝癌、包括小细胞肺癌在内的肺癌、卵巢癌、胃癌、膀胱癌、胰腺癌、胆道癌、宫颈癌、子宫内膜癌、结肠癌、直肠癌、结直肠癌、肾癌、食道癌、前列腺癌、恶性黑素瘤、头颈部癌、恶性胸膜间皮瘤、胶质母细胞瘤、尿路上皮癌、软组织肉瘤、恶性淋巴瘤、多发性骨髓瘤、病毒阳性实体癌、病毒阴性实体癌、白血病、鳞状细胞癌、merkel细胞癌、小儿恶性实体瘤、神经胶质瘤、甲状腺癌、非小细胞肺癌、霍奇金淋巴瘤和子宫癌。
[0160]
无论癌症对pd-1/pd-l1信号传导抑制剂有应答还是无应答,通过联合使用pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂,本发明的药物等与单独并且分别使用pd-1/pd-l1信号传导抑制剂或vegf信号传导抑制剂相比,具有明显更高的抗癌作用。但是,由于本发明特别可在治疗对pd-1/pd-l1信号传导抑制剂无应答或难以治疗的癌症中表现出功效,因此它在以下个体的治疗中特别有效:在对常规治疗有抗性或无应答、癌症不合适继续接受常规治疗或癌症对常规治疗未表现出期望的应答性水平(例如,由于无应答性和/或毒性),即癌症难以治疗,诸如对pd-1/pd-l1信号传导抑制剂具有内在抗性、癌症在经过pd-1/pd-l1信号传导抑制剂等的常规治疗后获得抗性或者癌症在经过pd-1/pd-l1信号传导抑制剂等的常规治疗后复发。特别地,本发明的药物等对以下癌症特别有效,即由于对pd-1/pd-l1信号传导抑制剂的无应答性而难以治疗的癌症。即使对于对pd-1/pd-l1信号传导抑制剂无应答的癌症,即对pd-1/pd-l1信号传导抑制剂具有内在抗性的癌症、由于经过常规治疗而获得抗性的癌症或复发的癌症,vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂的组合相比于pd-1/pd-l1信号传导抑制剂和vegf信号传导抑制剂单独并且分别施用也提供了出色的效果,即具有协同效应,并且显著改善了癌症治疗效果。此外,本发明的药物等可例如用于治疗不可手术切除、进行性和/或复发的癌症。本发明的药物等优选地可用于治疗不要求治愈性切除的进行性或复发性癌症、不可切除的进行性或复发性癌症或不能手术或复发的癌症。
[0161]
在本文中,术语“抗性”、“无应答性”和“耐受性”作为同义词使用,并且不受限制,只要它们是指细胞或个体缺乏应答性(也称为敏感性)和/或产生明显应答(例如,部分应答和/或完全应答)的能力的状态即可。例如,对pd-1/pd-l1信号传导抑制剂有抗性的癌症是对使用pd-1/pd-l1信号传导抑制剂的治疗无任何应答性的癌症或未表现出明显应答(例如,部分应答和/或完全应答)的癌症。如果将药剂施用于对其具有“抗性”或“无应答性”的癌症,不仅无法获得预期的效果,有时该癌症甚至可能进一步发展或转化为恶性程度更高的癌症。“抗性”或“无应答性”可以是“内在抗性”或“获得性抗性”。
[0162]
在本文中,术语“内在抗性”是指细胞或个体对药剂的内在无应答性。当细胞或个体对某种药剂具有内在抗性时,与缺乏抗性(即,具有敏感性或应答性)相比,该药剂不起作
用或效果不佳。不论采用哪种药物治疗,均无法实现100%的应答率,并且始终存在无应答者(即药物不起作用的个体)。一般而言,哮喘、癌症、抑郁症、糖尿病、消化性溃疡、高脂血症等药物的应答率为百分之几十。
[0163]
在本文中,术语“获得性抗性”是指尽管细胞或个体对药剂具有内在应答性(或敏感性),但是在暴露于某种药剂后获得的无应答性。由于产生获得性抗性,与缺乏抗性(即当具有应答性时)相比,最初起作用的药剂在施用过程中不起作用或效果不佳。特别地,本发明的药物等的获得性抗性可以是经过常规治疗后产生的抗性。例如,抗血管生成治疗剂通常用于许多癌症(包括肝癌)治疗中。但是,即使这些药剂在治疗的初始阶段有效,但在持续重复治疗时,有时仍然产生抗性。例如,对pd-1/pd-l1信号传导抑制剂有抗性的癌症是指在存在pd-1/pd-l1信号传导抑制剂的情况下不再消退或甚至有所发展的癌症。
[0164]
在本文中,术语“复发”是指在癌症通过治疗得到治愈或缩小后再次出现或再生长的现象。即使治疗看起来进展顺利,当通过手术未完全切除并且小到不可见的癌症再次出现时,或者当曾经通过药物疗法(抗癌疗法)或放射疗法缩小的癌症再次出现时,也发生“复发”。“复发”是指同一癌症可能出现在与经过治疗的癌症接近或相同的部位,尽管同一癌症也可能出现在与经过治疗的癌症不同的器官或成员中。特别地,同一癌症出现在与经过治疗的癌症不同的器官或成员中称为“转移”。癌细胞进入血管和淋巴,然后通过血液或淋巴流的携带,转移到另一个器官或成员,并且在其中增殖。癌症通常转移到血流充足的部位,例如淋巴结、肺、肝、脑和骨骼。在癌症由于复发而出现的情况下,患有癌症的个体已接受过常规治疗,诸如药物疗法或放射疗法。因此,由于复发而出现的癌症可能是对常规治疗具有获得性抗性的癌症。
[0165]
可使用本领域中已知的方法评估对治疗的无应答性和/或应答性,并且这些方法在能够实现期望的评估的情况下不受限制。例如,可通过疾病衍生的细胞对治疗(例如,用药剂治疗)的增殖进行的体内或体外测定法来评估无应答性和/或应答性。可通过对疾病衍生的细胞的增殖进行的体内或体外测定法等来评估无应答性的获得、应答性的维持和/或无应答者的增加。在一个实施例中,无应答性可以用ic
50
或ec
50
的变化或疾病衍生的细胞的增殖的减少来表示。在一个实施例中,该变化大于约50%、100%和/或200%中的任一者。此外,例如可在体内通过评估对治疗的应答、应答的持续时间和/或无进展生存期(例如部分应答和完全应答),来评估无应答性和/或应答性的变化。无应答性和/或应答性的变化可基于个体群体中对治疗的应答、应答的持续时间和/或无进展生存期(例如部分应答和完全应答的数量)的变化。
[0166]
在本发明的一个实施例中,通过本发明的药物等治疗的癌症可以是接受常规治疗时、治疗期间或治疗后已发生进展的癌症。例如,癌症可以是在接受常规治疗后已发生进展的癌症。例如,癌症在常规治疗开始后约1、2、3、4、5、6、7、8、9、10、11或12个月中的任一时间发生进展。例如,在另一个实施例中,癌症在常规治疗开始后约3、6、9或12个月中的任一时间发生进展。在本发明的一个实施例中,癌症对常规治疗有抗性或无应答。在另一个实施例中,癌症复发。即,癌症最初对常规治疗有应答,但是在停止常规治疗后约6、7、8、9、10、11、12、24或36个月中的任一时间,在原发病灶处复发,或者发生转移性癌症。
[0167]
在本发明中,常规治疗包括施用pd-1/pd-l1信号传导抑制剂。在另一个实施例中,常规治疗为pd-1拮抗剂或pd-l1拮抗剂的单一疗法。在另一个实施例中,常规治疗为pd-1拮
抗剂或pd-l1拮抗剂的单一疗法。在另一个实施例中,常规治疗包括施用pd-1/pd-l1信号传导抑制剂和化疗剂。在另一个实施例中,常规治疗包括施用pd-1拮抗剂和化疗剂。在另一个实施例中,常规治疗包括施用pd-l1拮抗剂和化疗剂。在另一个实施例中,常规治疗包括施用pd-1拮抗剂和紫杉烷。在另一个实施例中,包括施用pd-l1拮抗剂和紫杉烷。在另一个实施例中,常规治疗包括施用pd-l1拮抗剂和nab-紫杉醇。在另一个实施例中,常规治疗包括施用pd-l1拮抗剂和5-fu。在另一个实施例中,常规治疗包括施用pd-l1拮抗剂和拓扑异构酶抑制剂。常规治疗包括施用pd-l1拮抗剂和拓扑异构酶抑制剂。在另一个实施例中,常规治疗包括施用pd-l1拮抗剂和盐酸伊立替康水合物或拓扑替康。在另一个实施例中,常规治疗包括施用pd-l1拮抗剂、厄洛替尼、卡培他滨和/或5-fu。在另一个实施例中,常规治疗包括施用pd-1拮抗剂和抗ctla4抗体。在另一个实施例中,常规治疗包括施用pd-l1拮抗剂和抗ctla4抗体。在另一个实施例中,常规治疗包括施用抗ctla4抗体。在另一个实施例中,常规治疗为pd-l1拮抗剂的新辅助疗法。
[0168]
在本发明的一个实施例中,紫杉烷为紫杉醇。在另一个实施例中,白蛋白是人血清白蛋白。在另一个实施例中,纳米颗粒包含涂覆有白蛋白的紫杉醇。在另一个实施例中,纳米颗粒组合物中纳米颗粒的平均粒径为约200nm或更小(小于约200nm)。在另一个实施例中,组合物包含以白蛋白稳定的紫杉醇的纳米颗粒制剂(nab-紫杉醇(其与术语“abraxane(注册商标)”可互换使用)。在另一个实施例中,组合物为nab-紫杉醇(abraxane(注册商标))。
[0169]
在本文中,vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂“联合使用”或“组合使用”包括使用单独的制剂或单一药物制剂同时施用,以及优选在两种(或全部)活性剂同时具有生物活性的时段内以任何顺序分别或依次施用。vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂的施用顺序、施用频率、施用时间等可任选地由本领域的技术人员确定。vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂中的一种可先于另一种或晚于另一种施用,或者它们可以同时施用。在另一个实施例中,除vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂之外的另一种药剂或另一种药物可与vegf信号传导抑制剂和pd-/pd-l1信号传导抑制剂同时使用,或者在各种抑制剂之前或之后使用。在另一个实施例中,放射疗法或手术可与vegf信号传导抑制剂和pd-/pd-l1信号传导抑制剂同时进行,或者在各种抑制剂之前或之后进行。
[0170]
在本文中,“治疗”、“施加治疗”或“施加治疗中”(也称为“疗法”、“施加疗法”或“施加疗法中”)是指某种疾病或症状的减小、减轻或缓和,并且包括防止(预防)未来疾病或症状的发展以及对疾病进展的抑制。所需的治疗效果包括症状缓解、减少疾病的任何直接或间接病理结果、降低症状进展的速度、恢复或减轻疾病状态以及改善预后。“治疗”或“疗法”不限于必然实现完全康复或治愈疾病或症状的“治疗”或“疗法”,也不限于获得所需的治疗效果,即有效“治疗”或“疗法”。例如,癌症治疗(或治疗癌症)是指对患有癌症或诊断出癌症的受试者给药或实施手术、放射疗法等,目的在于实现至少一种所需的治疗效果(诸如减少癌细胞数量、缩小肿瘤大小、降低癌细胞浸润周围器官的速率或降低肿瘤转移或肿瘤生长速率)。在本发明的一个实施例中,癌症治疗是指用本发明的药物、试剂盒或治疗方法进行治疗。
[0171]
治疗癌症的疗效(即功效)可通过本文所示的方法或标准或通过一种或多种已知
的方法或标准进行评估(参见w.a.weber,j.nucl.med.50:1s-10s(2009))。例如,关于肿瘤生长的抑制率,按照美国国家癌症研究所(nci)标准,t/c为42%或更低是抗肿瘤活性的最低水平。t/c《10%被视为抗肿瘤活性水平高,其中t/c(%)=接受治疗的患者的中位肿瘤体积/对照组中位肿瘤体积
×
100。
[0172]
在一个实施例中,治疗的疗效(即抗癌功效)可通过患者状态、受累器官或受累细胞等的一种或多种已知的标准进行评估,这些标准包括部分应答(pr)、完全应答(cr)、总应答率(orr)、疾病控制率(dcr)、无进展生存期(pfs)、无疾病生存期(dfs)、总生存期(os)、病理完全应答(pcr)和临床完全应答(ccr)等。
[0173]
orr是指在最短时间内表现出癌症大小缩小或体积减小的人群比例。而且,orr可表示为完全应答率与部分应答率之和。dcr是指无疾病进展的患者比例,并且可以用完全应答率、部分应答率与疾病稳定率(sd)的总和来表示。pfs也称为“肿瘤进展时间”,是指患者在治疗期间和治疗后无癌症进展的持续时间,并且包括患者发生cr或pr的时期以及患者发生sd的时期。dfs是指患者在治疗期间或治疗后无复发或其他疾病的持续时间。os是指患者自治疗开始之日起生存的时期。通过治疗延长os是指(例如)与未经治疗的患者组相比,接受治疗的患者组自试验开始之日起中位生存期点估计值延长。
[0174]
在一个实施例中,对使用本发明的药物、试剂盒或治疗方法的治疗的应答是指使用实体瘤应答评价标准(recist)1.1中的应答标准来评估pr、cr、pfs、dfs、orr、dcr或os中的任意一种。
[0175]
在一个实施例中,可使用特异性作用评价指标来评估癌症治疗的功效。施用包含pd-1/pd-l1信号传导抑制剂和白蛋白的纳米颗粒的组合物的个体中的血清ca19-9(碳水化合物抗原19-9)水平相比于治疗之前的血清ca19-9水平降低了至少约50%(诸如至少约60%、70%、80%、90%、95%等之一)。
[0176]
并非本发明的所有实施例都能在所有受试者中有效地获得所需的治疗效果。然而,本发明的实施例中的任一者均应在具有统计学意义的数量的受试者中实现所需的治疗效果,所述统计学意义通过本技术领域中已知的任意统计检验(诸如学生t检验、卡方检验、根据mann-whitney的u检验、kruskal-wallis检验(h检验)、jonckheere-terpstra检验和wilcoxon检验)确定。
[0177]
在本文所示的标准或用于评估癌症治疗效果的已知标准中,如果功效符合至少一项标准,则可以该治疗有效或具有抗癌作用。优选地,功效与患者生存期的延长或与全身症状的改善(诸如疼痛的改善)相关联。但是,当存在诸如癌症缩小或暂时消失的治疗效果时,也可以确定该治疗有效。此外,与用于比较的受试者相比,“更有效”、“高效”、“高治疗效果”或“更高的治疗效果”等意指相对于本文所示的至少一项标准或已知的标准具有更高的有效性。
[0178]
pd-1/pd-l1信号传导抑制剂可以是能够通过直接或间接作用抑制pd-1或pd-l1的功能或活性的任何药剂,并且可以是pd-1拮抗剂或pd-l1拮抗剂。pd-1/pd-l1信号传导抑制剂可以是抑制pd-1的功能或活性的抑制剂或抑制pd-l1的功能或活性的pd-l1抑制剂。
[0179]
pd-1拮抗剂可以是任何能够中和、阻断、抑制、停止、降低或干扰pd-1或pd-l1的功能或活性的分子。例如,它可以是抗pd-1抗体或其抗原结合片段或pd-l1分子或其衍生物,其通过与pd-1的结合而抑制pd-1与pd-l1的结合。其实例可包括抗体、抗体片段、结合多肽、
肽和非肽分子。更具体地,pd-1拮抗剂的实例可包括amp-224、bms-936559、medi4736、msb0010718c、mpdl3280a、纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317和匹利珠单抗(ct-011)。pd-1拮抗剂优选为抗pd-1抗体或其抗原结合片段,并且进一步优选为pd-1中和抗体或其抗原结合片段。
[0180]
抗pd-1抗体是与pd-1结合的抗体,优选为pd-1结合并且抑制其功能的抗体,进一步优选为抑制pd-1或b7.1与pd-l1的结合从而抑制其功能的抗体,并且更优选为抑制pd-1或b7.1与pd-l1的结合所诱导的信号传导的抗体,例如中和抗体。
[0181]
抑制pd-1的功能是指释放由于pd-1或b7.1与pd-l1的结合而诱导的t细胞活化的抑制作用,并且与对照组的活性相比,pd-1的活性下降至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。pd-1的活性通过本领域中的任何标准方法(包括本文所述的那些方法)来确定。
[0182]
例如,可使用纳武单抗、amp-514、帕博利珠单抗(mk-3475)、regn2810、pdr001、bgb-a317或匹利珠单抗(ct-011)作为pd-1拮抗剂,但是优选使用纳武单抗或帕博利珠单抗。
[0183]
考虑到所需的功能,抗pd-1抗体可以是任何与纳武单抗、amp-514、帕博利珠单抗、regn2810、pdr001、bgb-a317或匹利珠单抗具有相同的抗原结合特性的抗体。例如,它可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含高变区(cdr),每个高变区具有与纳武单抗、amp-514、帕博利珠单抗、regn2810、pdr001、bgb-a317或匹利珠单抗的相应的重链和轻链中每个cdr的氨基酸序列相同的氨基酸序列。替代性地,考虑到所需的功能,抗pd-1抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含重链可变(hv)区或轻链可变(lv)区,该重链可变区或轻链可变区具有与纳武单抗、amp-514、帕博利珠单抗、regn2810、pdr001、bgb-a317或匹利珠单抗的相应的hv区或lv区的氨基酸序列相同的氨基酸序列。
[0184]
在一个实施例中,抗pd-1抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含与纳武单抗、amp-514、帕博利珠单抗、regn2810、pdr001、bgb-a317或匹利珠单抗的相应的氨基酸序列具有至少80%、85%、90%、95%、98%或99%的序列同一性的氨基酸序列。在一个实施例中,抗pd-1抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含cdr,这些cdr各自包含与纳武单抗、amp-514、帕博利珠单抗、regn2810、pdr001、bgb-a317或匹利珠单抗的相应的重链和轻链中每个cdr的氨基酸序列具有至少80%、85%、90%、95%、98%或99%的序列同一性的氨基酸序列。在一个实施例中,抗pd-1抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含hv区和lv区,该hv区和lv区包含与纳武单抗、amp-514、帕博利珠单抗、regn2810、pdr001、bgb-a317或匹利珠单抗的hv区和lv区的相应的氨基酸序列具有至少80%、85%、90%、95%、98%或99%的序列同一性的氨基酸序列。
[0185]
pd-l1拮抗剂可以是任何能够中和、阻断、抑制、停止、降低或干扰pd-l1或pd-1的功能或活性的分子。例如,它可以是抗pd-l1抗体或其抗原结合片段或pd-1分子或其衍生物,其通过与pd-l1的结合而抑制pd-1与pd-l1的结合。其实例可包括抗体、抗体片段、结合多肽、肽和非肽分子。pd-l1拮抗剂优选为抗pd-l1抗体或其抗原结合片段,并且进一步优选为pd-l1中和抗体或其抗原结合片段。
[0186]
抗pd-l1抗体是与pd-l1结合的抗体,优选为pd-l1结合并且抑制其功能的抗体,进一步优选为抑制pd-1或b7.1与pd-l1的结合从而抑制其功能的抗体,并且更优选为抑制pd-1或b7.1与pd-l1的结合所诱导的信号传导的抗体,例如中和抗体。
[0187]
抑制pd-l1的功能是指释放由于pd-1或b7.1与pd-l1的结合而诱导的t细胞活化的抑制作用,并且与对照组的活性相比,pd-l1的活性下降至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。pd-l1的活性通过本领域中的任何标准方法(包括本文所述的那些方法)来确定。
[0188]
例如,可使用阿替利珠单抗、阿维单抗(msb0010718c)、德瓦鲁单抗、bms-936559、mpdl3280a、medi4736、kn035、cx-072、ly3300054和faz053中的任何一种或多种抗体作为抗pd-l1抗体。但是,优选使用阿替利珠单抗、阿维单抗、德瓦鲁单抗、bms-936559、mpdl3280a或medi4736,并且进一步优选使用阿替利珠单抗、阿维单抗或德瓦鲁单抗。
[0189]
考虑到所需的功能,抗pd-l1抗体可以是任何与阿替利珠单抗、阿维单抗、德瓦鲁单抗、bms-936559、mpdl3280a、medi4736、kn035、cx-072、ly3300054或faz053具有相同的抗原结合特性的抗体。例如,它可以是:包含以下cdr序列的抗体,这些cdr序列各自具有与阿替利珠单抗的重链(seq id no:1)和轻链(seq id no:2)中的每个高变区(hcdr1-3,lcdr1-3)的氨基酸序列(seq id no:5-10)相同的氨基酸序列;包含以下cdr序列的抗体,这些cdr序列各自具有与阿维单抗的重链(seq id no:11)和轻链(seq id no:12)中的每个高变区(hcdr1-3,lcdr1-3)的氨基酸序列(seq id no:15-20)相同的氨基酸序列;包含以下cdr序列的抗体,这些cdr序列各自具有与德瓦鲁单抗的重链(seq id no:21)和轻链(seq id no:22)中的每个高变区(hcdr1-3,lcdr1-3)的氨基酸序列相同的氨基酸序列;包含以下cdr序列的抗体,这些cdr序列各自具有与kn035的重链(seq id no:25)中的每个高变区(hcdr1-3)的氨基酸序列(seq id no:27-29)相同的氨基酸序列;包含以下cdr序列的抗体,这些cdr序列各自具有与cx-072的重链(seq id no:30)和轻链(seq id no:31)中的每个高变区(hcdr1-3,lcdr1-3)的氨基酸序列相同的氨基酸序列;或包含以下cdr序列的抗体,这些cdr序列各自具有与ly3300054的重链(seq id no:34)和轻链(seq id no:35)中的每个高变区(hcdr1-3,lcdr1-3)的氨基酸序列(seq id no:38-43)相同的氨基酸序列;或其抗原结合片段。替代性地,它可以是抗体或抗原结合片段,该抗体或抗原结合片段包含高变区(cdr),每个高变区具有与bms-936559、mpdl3280a、medi4736或faz053的相应的重链和轻链中每个cdr的氨基酸序列相同的氨基酸序列。
[0190]
替代性地,考虑到所需的功能,抗pd-l1抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含重链可变(vh)区和/或轻链可变(vl)区,该重链可变区和/或轻链可变区具有与阿替利珠单抗的vh区(seq id no:3)和/或vl区(seq id no:4)、阿维单抗的vh区(seq id no:13)和/或vl区(seq id no:14)、德瓦鲁单抗的vh区(seq id no:23)和/或vl区(seq id no:24)、kn035的vh区(seq id no:26)、cx-072的vh区(seq id no:32)和/或vl区(seq id no:33)或ly3300054的vh区(seq id no:36)和/或vl区(seq id no:37)的氨基酸序列相同的氨基酸序列。替代性地,它可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含重链可变(vh)区和/或轻链可变(vl)区,该重链可变区和/或轻链可变区具有与bms-936559、mpdl3280a、medi4736或faz053的相应的vh区和/或vl区的氨基酸序列相同的氨基酸序列。
[0191]
在一个实施例中,抗pd-l1抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含与阿替利珠单抗、阿维单抗、德瓦鲁单抗、bms-936559、mpdl3280a、medi4736、kn035、cx-072、ly3300054或faz053的相应的氨基酸序列具有至少80%、85%、90%、95%、98%或99%的序列同一性的氨基酸。在一个实施例中,抗pd-l1抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含cdr,这些cdr各自包含与阿替利珠单抗、阿维单抗、德瓦鲁单抗、bms-936559、mpdl3280a、medi4736、kn035、cx-072、ly3300054或faz053的相应的重链和轻链中每个cdr的氨基酸序列具有至少80%、85%、90%、95%、98%或99%的序列同一性的氨基酸序列。在一个实施例中,抗pd-l1抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含vh区和vl区,该vh区和vl区包含与阿替利珠单抗、阿维单抗、德瓦鲁单抗、bms-936559、mpdl3280a、medi4736、kn035、cx-072、ly3300054或faz053中相应的vh区和vl区的相应的氨基酸序列具有至少80%、85%、90%、95%、98%或99%的序列同一性的氨基酸序列。
[0192]
vegf信号传导抑制剂可以是能够通过直接或间接作用抑制vegf信号传导的功能或活性的任何药剂,并且可以是vegf拮抗剂或vegfr拮抗剂。vegf信号传导抑制剂可以是抑制vegf的功能或活性的vegf抑制剂或抑制vegfr的功能的vegf受体(vegfr)抑制剂。
[0193]
vegf拮抗剂可以是任何能够中和、阻断、抑制、停止、降低或干扰vegf或vegf受体(vegfr)的功能或活性的分子,并且可以是抗vegf抗体或抗vegf受体(vegfr)抗体或其抗原结合片段。另外,例如,它可以是vegf分子或其衍生物,其通过与vegfr的结合来抑制vegf与vegfr的结合。vegf拮抗剂的实例可包括抗体、抗体片段、结合多肽、肽和非肽分子。vegf拮抗剂优选为抗vegf抗体或抗vegfr抗体或其抗原结合片段,并且进一步优选为vegf中和抗体或vegfr中和抗体或其抗原结合片段。
[0194]
vegf中和抗体和vegfr中和抗体是分别降低或消除vegf和vegfr的功能或活性的抗体,中和其功能或活性。但是,vegf和vegfr具有配体-受体关系,因此vegf中和抗体和vegfr中和抗体均可能是与vegf或vegfr结合并且抑制vegf与vegfr的结合的抗vegf抗体或抗vegfr抗体。
[0195]
通过抑制vegf或vegfr的功能,vegf或vegfr的活性与对照组的活性相比降低至少5%、10%、20%、30%,40%、50%、60%、70%、80%、90%或100%。vegf或vegfr的活性通过本领域中的任何标准方法(包括本文所述的那些方法)来确定。
[0196]
可优选地使用贝伐珠单抗、雷莫芦单抗或阿柏西普β作为抗vegf抗体或抗vegfr抗体。
[0197]
考虑到所需的功能,抗vegf抗体或抗vegfr抗体可以是任何与贝伐珠单抗、雷莫芦单抗或阿柏西普β具有相同的抗原结合特异性的抗体。例如,它可以是:包含以下cdr序列的抗体,这些cdr序列各自具有与贝伐珠单抗的重链(seq id no:44)和轻链(seq id no:45)中的每个高变区(hcdr1-3,lcdr1-3)的氨基酸序列(seq id no:48-53)相同的氨基酸序列;或包含以下cdr序列的抗体,这些cdr序列各自具有与雷莫芦单抗的重链(seq id no:54)和轻链(seq id no:55)中的每个高变区(hcdr1-3,lcdr1-3)的氨基酸序列(seq id no:58-63)相同的氨基酸序列;或其抗原结合片段。替代性地,它可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含cdr,这些cdr各自具有与阿柏西普β的重链和轻链的每个高变区(cdr)的氨基酸序列相同的氨基酸序列。
[0198]
替代性地,考虑到所需的功能,抗vegf抗体或抗vegfr抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含重链可变(vh)区和/或轻链可变(vl)区,该重链可变区和轻链可变区具有与贝伐珠单抗的vh区(seq id no:46)和/或vl区(seq id no:47)或雷莫芦单抗的vh区(seq id no:56)和/或vl区(seq id no:57)的氨基酸序列相同的氨基酸序列。替代性地,它可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含重链可变(vh)区和/或轻链可变(vl)区,该重链可变区和/或轻链可变区具有与阿柏西普β的vh区和/或vl区的氨基酸序列相同的氨基酸序列。
[0199]
在一个实施例中,抗vegf抗体或抗vegfr抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含与贝伐珠单抗、雷莫芦单抗或阿柏西普β的相应的氨基酸序列具有80%、85%、90%、95%、98%或99%的序列同一性的氨基酸。在一个实施例中,抗vegf抗体或抗vegfr抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含cdr,这些cdr各自包含与贝伐珠单抗、雷莫芦单抗或阿柏西普β的相应的重链和轻链中每个cdr的氨基酸序列具有至少80%、85%、90%、95%、98%或99%的序列同一性的氨基酸序列。在一个实施例中,抗vegf抗体或抗vegfr抗体可以是抗体或其抗原结合片段,该抗体或其抗原结合片段包含重链可变(vh)区和/或轻链可变(vl)区,该重链可变区和/或轻链可变区包含与贝伐珠单抗、雷莫芦单抗或阿柏西普β的相应的vh区和vl区的相应的氨基酸序列具有至少80%、85%、90%、95%、98%或99%的序列同一性的氨基酸序列。
[0200]
在本发明的药物、治疗方法、试剂盒和用途以及vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂及其组合中,vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂的组合的实施例包括例如但不限于以下组合:
[0201]
贝伐珠单抗与amp-224组合、贝伐珠单抗与bms-936559组合、贝伐珠单抗与medi4736组合、贝伐珠单抗与msb0010718c组合、贝伐珠单抗与mpdl3280a组合、贝伐珠单抗与纳武单抗组合、贝伐珠单抗与amp-514组合、贝伐珠单抗与帕博利珠单抗(mk-3475)组合、贝伐珠单抗与regn2810组合、贝伐珠单抗与pdr001组合、贝伐珠单抗与bgb-a317组合或贝伐珠单抗与匹利珠单抗(ct-011)组合。
[0202]
雷莫芦单抗与amp-224组合、雷莫芦单抗与bms-936559组合、雷莫芦单抗与medi4736组合、雷莫芦单抗与msb0010718c组合、雷莫芦单抗与mpdl3280a组合、雷莫芦单抗与纳武单抗组合、雷莫芦单抗与amp-514组合、雷莫芦单抗与帕博利珠单抗(mk-3475)组合、雷莫芦单抗与regn2810组合、雷莫芦单抗与pdr001组合、雷莫芦单抗与bgb-a317组合或雷莫芦单抗与匹利珠单抗(ct-011)组合。
[0203]
阿柏西普β与amp-224组合、阿柏西普β与bms-936559组合、阿柏西普β与medi4736组合、阿柏西普β与msb0010718c组合、阿柏西普β与mpdl3280a组合、阿柏西普β与纳武单抗组合、阿柏西普β与amp-514组合、阿柏西普β与帕博利珠单抗(mk-3475)组合、阿柏西普β与regn2810组合、阿柏西普β与pdr001组合、阿柏西普β与bgb-a317组合或阿柏西普β与匹利珠单抗(ct-011)组合。
[0204]
贝伐珠单抗与阿替利珠单抗组合、贝伐珠单抗与阿维单抗(msb0010718c)组合、贝伐珠单抗与德瓦鲁单抗组合、贝伐珠单抗与bms-936559组合、贝伐珠单抗与mpdl3280a组合、贝伐珠单抗与medi4736组合、贝伐珠单抗与kn035组合、贝伐珠单抗与cx-072组合、贝伐珠单抗与ly3300054组合或贝伐珠单抗与faz053组合。
[0205]
雷莫芦单抗与阿替利珠单抗组合、雷莫芦单抗与阿维单抗(msb0010718c)组合、雷莫芦单抗与德瓦鲁单抗组合、雷莫芦单抗与bms-936559组合、雷莫芦单抗与mpdl3280a组合、雷莫芦单抗与medi4736组合、雷莫芦单抗与kn035组合、雷莫芦单抗与cx-072组合、雷莫芦单抗与ly3300054组合或雷莫芦单抗与faz053组合。
[0206]
阿柏西普β与阿替利珠单抗组合、阿柏西普β与阿维单抗(msb0010718c)组合、阿柏西普β与德瓦鲁单抗组合、阿柏西普β与bms-936559组合、阿柏西普β与mpdl3280a组合、阿柏西普β与medi4736组合、阿柏西普β与kn035组合、阿柏西普β与cx-072组合、阿柏西普β与ly3300054组合或阿柏西普β与faz053组合。
[0207]
可使用已知方法获得作为多克隆抗体或单克隆抗体的抗体。虽然抗体来源不受限制,但抗体优选为哺乳动物来源的抗体,更优选为人源的抗体。哺乳动物来源的单克隆抗体包括由杂交瘤细胞产生的抗体和由宿主细胞产生的那些抗体,这些宿主细胞通过基因工程技术用包含抗体基因的表达载体进行转化。抗体可以是嵌合抗体、人源化抗体或人抗体或衍生自文库的抗体或其抗体片段。
[0208]
抗体可以是与各种分子诸如聚乙二醇(peg)、放射性物质或毒素等连接的缀合抗体。此类缀合抗体可通过对获得的抗体进行化学修饰来获得。另外,在本领域中已经建立了用于修饰抗体的方法。本文中的“抗体”也包括这些缀合抗体。
[0209]
抗体不仅包括以igg为代表的二价抗体,而且包括以igm为代表的单价抗体或多价抗体。本发明的多价抗体包括具有完全相同的抗原结合位点的多价抗体或具有部分或完全不同的抗原结合位点的多价抗体。
[0210]
此外,抗体可以是双特异性抗体。双特异性抗体是指在同一抗体分子中具有识别不同表位的可变区的抗体,但这些表位可以存在于不同分子中或同一分子内。
[0211]
用于生产双特异性抗体的方法是已知的。例如,可通过连接识别不同抗原的两种类型的抗体来制备双特异性抗体。待连接的抗体可各自为具有h链和l链的抗体的半分子,也可以是仅由h链组成的抗体的四分之一分子。替代性地,可通过融合产生不同单克隆抗体的杂交瘤来制备产生双特异性抗体的融合细胞。此外,可使用基因工程技术制备双特异性抗体。
[0212]
抗体可以是低分子量抗体。低分子量抗体包含缺少全长抗体的一部分的抗体片段。允许抗体分子部分缺失,只要抗体分子与arid5a结合即可。本发明的抗体片段优选地包含重链可变区(vh)和轻链可变区(vl)中的一者或两者。vh或vl的氨基酸序列可包含添加、缺失和/或置换。此外,分子可缺少vh和vl中的一者或两者的一部分,只要它们与pd-l1结合即可。另外,抗体片段可以嵌合或人源化。抗体片段的具体实例可包括例如fab、fab'、f(ab')2和fv。此外,低分子量抗体的具体实例可包括例如fab、fab'、f(ab')2、fv、scfv、双体抗体和sc(fv)2。
[0213]
可根据常规方法将制剂制成片剂、颗粒、粉末、胶囊剂、乳剂、混悬剂或糖浆剂或注射液诸如无菌溶液或液体混悬剂。当这些活性成分分别配制为两种或更多种制剂时,单个制剂可同时施用或以一定的时间间隔分别或依次施用。两种或更多种制剂也可以在一天中以不同的频率分别施用。根据本发明所述的药物可全身或局部经口或经肠胃外施用。当这些活性成分分别配制为两种或更多种制剂时,单个制剂也可通过不同的途径施用。
[0214]
例如,在根据本发明所述的药物制备为可能同时施用或以特定间隔施用的多种不
同制剂的情况下,诸如市售药物的包装说明书或销售手册等文件可指示其相应的组合用途。另外,可制备包含分别包含前述物质的制剂的试剂盒。
[0215]
制剂可通过将所需的活性成分与任选的药用载体、赋形剂或稳定剂混合制成冻干制剂或水溶液形式进行储存。
[0216]
药用材料的实例可包括无菌水、生理盐水、稳定剂、赋形剂、缓冲剂、防腐剂、表面活性剂、螯合剂(诸如edta)、粘结剂等。
[0217]
表面活性剂可以是非离子表面活性剂。其典型实例可包括具有hlb6-18的那些,诸如失水山梨醇脂肪酸酯,诸如失水山梨醇单辛酸酯、失水山梨醇单月桂酸酯和失水山梨醇单棕榈酸酯;脂肪酸甘油酯,诸如单辛酸甘油酯、单肉豆蔻酸甘油酯和单硬脂酸甘油酯等。
[0218]
表面活性剂也可以是阴离子表面活性剂。其典型实例可包括具有c
10-18
烷基基团的烷基硫酸盐,诸如乙酰硫酸钠、月桂基硫酸钠和油基硫酸钠;具有c
10-18
烷基基团并且氧乙烯的平均加成摩尔数为2-4的聚氧乙烯烷基醚硫酸盐,诸如聚氧乙烯月桂基硫酸钠;具有c
8-18
烷基基团的烷基磺基琥珀酸盐,诸如月桂基磺基琥珀酸钠;天然表面活性剂,例如卵磷脂和甘油磷脂;鞘氨醇磷脂,诸如鞘磷脂;以及与c
12-18
脂肪酸的蔗糖脂肪酸酯。
[0219]
缓冲剂的实例可包括磷酸、柠檬酸缓冲剂、乙酸、苹果酸、酒石酸、琥珀酸、乳酸、磷酸钾、葡萄糖酸、辛酸、脱氧胆酸、水杨酸、三乙醇胺、富马酸、其他有机酸等或碳酸缓冲剂、tris缓冲剂、组氨酸缓冲剂、咪唑缓冲剂等。
[0220]
另外,溶液制剂可通过溶于溶液制剂领域中已知的水性缓冲剂中来制备。缓冲剂浓度通常为1-500mm,优选为5-100mm,并且进一步优选为10-20mm。
[0221]
碳水化合物或糖诸如多糖和单糖的实例可包括葡聚糖、葡萄糖、果糖、乳糖、木糖、甘露糖、麦芽糖、蔗糖、海藻糖、棉子糖等。
[0222]
糖醇的实例可包括甘露醇、山梨糖醇、肌醇等。
[0223]
当制剂为水溶液时,其实例包括生理盐水和包含葡萄糖或其他佐剂(诸如d-山梨糖醇、d-甘露糖、d-甘露糖醇和氯化钠)的等渗溶液,并且可以与适当的增溶剂(诸如醇(乙醇等)、多元醇(丙二醇、peg等)、非离子表面活性剂(聚山梨酯80、hco-50)等结合使用。
[0224]
如果需要,可进一步包括稀释剂、增溶剂、ph调节剂、镇痛剂、含硫还原剂、抗氧化剂等。
[0225]
作为一个实施例,除了通过常规途径施用vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂以外,还可以包括通过基因疗法进行施用。例如,抗vegf抗体、抗pd-1抗体或抗pd-l1抗体在基因疗法中的使用可以通过已知的方法进行。
[0226]
本发明药物的剂量和给药计划因接受药物施用的受试者、受试者的年龄和体重、病情、施用方法以及待使用的vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂的类型等而不同,并且它们可由本领域的技术人员根据制造商的说明凭经验确定。
[0227]
在本发明的药物等中,vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂优选地联合施用,并且可同时、分别或依次施用。vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂可作为单独的制剂同时施用,也可以间隔一定的时间间隔分别或依次施用。两种或更多种制剂可分别在一天中以不同的频率施用,并且它们可以间隔一定天数的不同频率分别施用。每种制剂可按照如下所示的单独给药时间表施用于一例受试者。
[0228]
例如,vegf信号传导抑制剂可通过静脉内输注以每次施用约1mg/kg至约50mg/kg
或每次施用约4mg/kg至约15mg/kg的剂量施用于人受试者。更具体地,可以每次施用约4mg/kg(体重)、约5mg/kg(体重)、约8mg/kg(体重)、约7.5mg/kg(体重)、约10mg/kg(体重)或约15mg/kg(体重)的剂量施用。另外,这些剂量可例如以约一周或约一周以上的给药间隔、约两周或约两周以上的给药间隔或约三周或约三周以上的给药间隔给予。此外,虽然每次施用的持续时间优选为约30分钟至约90分钟,但不限于该范围,只要可以安全地进行施用即可。
[0229]
如上所述,vegf信号传导抑制剂的具体实例包括抗vegf抗体贝伐珠单抗、雷莫芦单抗或阿柏西普β。如上所述,vegf信号传导抑制剂的剂量和给药方案可由本领域的技术人员根据其实施例来确定。但是,例如,在贝伐珠单抗的情况下,可以约两周或约两周以上的给药间隔以每次施用约5mg/kg(体重)或约10mg/kg(体重)的剂量、以约三周或约三周以上的给药间隔以每次施用约7.5mg/kg(体重)的剂量或以约三周或约三周以上的给药间隔以每次施用约15mg/kg(体重)的剂量施用于人受试者。在雷莫芦单抗的情况下,可以约两周的给药间隔以每次施用约8mg/kg(体重)的剂量或以约三周的给药间隔以每次施用约10mg/kg(体重)的剂量施用于人受试者。在阿柏西普β的情况下,可以约两周的给药间隔以每次施用约4mg/kg(体重)的剂量施用。
[0230]
此外,例如,pd-1/pd-l1信号传导抑制剂可通过静脉内输注以每次施用约0.1mg至约30,000mg的剂量施用于人受试者。进一步具体地,可以每次施用约1mg或更多和约10mg或更少、约80mg或更少、约240mg或更少、约840mg或更少、约1,000mg或更少或约1,200mg或更少的剂量进行施用。更具体地,可以每次施用约10mg、约80mg、约240mg、约840mg或约1,200mg的剂量进行施用。替代性地,可以每次施用约1.0mg/kg(体重)或更多、约2.0mg/kg(体重)或更多、约2.5mg/kg(体重)或更多、约10mg/kg(体重)或更多或约20mg/kg(体重)或更多和约100mg/kg(体重)或更少的剂量进行施用。更具体地,可以每次施用约2mg/kg(体重)、约10mg/kg(体重)、约15mg/kg(体重)或约20mg/kg(体重)的剂量进行施用。另外,这些剂量可例如以约两周或约两周以上的给药间隔或约三周或约三周以上的给药间隔给予。此外,虽然每次施用的持续时间优选为约30分钟至约90分钟,但不限于该范围,只要可以安全地进行施用即可。
[0231]
如上所述,pd-1/pd-l1信号传导抑制剂的剂量和给药方案可由本领域的技术人员根据其实施例来确定。但是,例如,在阿替利珠单抗的情况下,可以约一周或一周以上的给药间隔、优选以约二至四周的给药间隔并且更优选以以约三周的给药间隔以每次施用约1200mg的剂量施用于人受试者。替代性地,在阿替利珠单抗的情况下,可以约一周或一周以上的给药间隔、优选以约两周的给药间隔以每次施用约840mg的剂量进行施用。在阿维单抗的情况下,可以约三周的给药间隔以每次施用约10mg/kg(体重)的剂量施用。在德瓦鲁单抗的情况下,可以约两周的给药间隔以每次施用的剂量可约10mg/kg(体重)的剂量施用。在纳武单抗的情况下,可以约两周的给药间隔以每次施用约240mg的剂量或以约三周的给药间隔以每次施用约80mg的剂量进行施用。在帕博利珠单抗的情况下,可以约三周的给药间隔以每次施用约2mg/kg(体重)的剂量或以约三周的给药间隔以每次施用约200mg的剂量进行施用。
[0232]
在本发明的药物等中,vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂联合施用。但是,例如,在使用贝伐珠单抗作为vegf信号传导抑制剂并且使用阿替利珠单抗作为
pd-1/pd-l1信号传导抑制剂的情况下,可使用如下所示的给药计划。静脉内施用阿替利珠单抗,然后至少约五分钟后,静脉内施用贝伐珠单抗。替代性地,在静脉内使用阿替利珠单抗后受试者身体状况不佳的情况下,在施用后约60分钟
±
15分钟,静脉内施用贝伐珠单抗。
[0233]
关于vegf信号传导抑制剂和pd-1/pd-l1信号传导抑制剂的施用,本领域的技术人员可根据治疗效果、患者病情、耐受性等适当地调整施用时间、给药间隔、给药次数和给药期。
[0234]
在本发明的药物等中,vegf信号传导抑制剂与pd-1/pd-l1信号传导抑制剂联合施用,并且可进一步与一种或更多种化疗剂联合施用。例如,当使用贝伐珠单抗作为vegf信号传导抑制剂并且使用阿替利珠单抗作为pd-1/pd-l1信号传导抑制剂时,化疗剂优选地为卡铂、多西他赛、紫杉醇、依托泊苷、卡培他滨、奥沙利铂、氟尿嘧啶、左旋亚叶酸钙、亚叶酸钙、盐酸伊立替康水合物、盐酸吉西他滨、顺铂、替莫唑胺或盐酸拓扑替康或它们的组合,并且更优选地为卡铂和/或紫杉醇。在该情况下,本领域的技术人员可根据治疗效果、患者病情、耐受性等适当地调整vegf信号传导抑制剂、pd-1/pd-l1信号传导抑制剂以及一种或多种化疗剂的施用时间、给药间隔、给药次数和给药期。
[0235]
例如,对于人受试者,在贝伐珠单抗的情况下,可以每次施用约5mg/kg(体重)、约10mg/kg(体重)、约7.5mg/kg(体重)或约15mg/kg(体重)的剂量进行施用,并且在阿替利珠单抗的情况下,可以每次施用约1200mg或840mg的剂量进行施用。此外,例如对于贝伐珠单抗与阿替利珠单抗的组合,卡铂可以每次施用约auc6的剂量施用,多西他赛可以每次施用约75mg/m2的剂量施用,紫杉醇可以每次施用约200mg/m2(i.v.)的剂量施用,nab-紫杉醇可以每次施用约100mg/m2(i.v.)的剂量施用,并且/或者依托泊苷可以每次施用约100mg/m2的剂量施用,并且可以每次施用约auc6的卡铂和每次施用约200mg/m2(i.v.)的紫杉醇的方式施用。药剂可分别以约一至四周的给药间隔同时、分别或依次施用。例如,贝伐珠单抗可以约两周的给药间隔以每次施用约5mg/kg(体重)的剂量施用,以约两周的给药间隔以每次施用约10mg/kg(体重)的剂量施用,以约三周的给药间隔以每次施用约7.5mg/kg(体重)的剂量施用,或以约三周的给药间隔以每次施用约15mg/kg(体重)的剂量施用。
[0236]
例如,阿替利珠单抗可以以约三周的给药间隔以每次施用约1200mg的剂量施用,或以约两周的给药间隔以每次施用约840mg的剂量施用。
[0237]
另外,“约”在用于修饰由数字定义的参数时(例如,本文所述的联合疗法中所用的药剂剂量或治疗持续时间),意指该参数在针对该该参数给出的数值的10%左右的范围内变化。例如,“约5mg”意指“4.5mg至5.5mg”。
[0238]
通过引用并入
[0239]
本文中提到的所有出版物、专利和专利申请均通过引用以其全文并入本文,都以引用方式并入本文,就好像每个单独的出版物、专利和专利申请都被具体且单独地指出通过引用并入一样。如有冲突,以本专利申请(包括本文中的定义)为准。
[0240]
实例
[0241]
下面使用实例更具体地说明本发明,但本发明不受这些实例的限制。
[0242]
==小鼠模型的制备==
[0243]
在培养箱中(设置为37℃和5%co2),使用细胞培养瓶培养ov2944-hm-1细胞和colon 38细胞。在ov2944-hm-1细胞的情况下,收集细胞,以1
×
107细胞/ml的密度重悬,然
后皮下接种(1
×
106细胞/小鼠)到b6c3f1小鼠(clea japan,inc.)右侧的腹股沟区域。在colon 38细胞的情况下,收集细胞,以2
×
107细胞/ml的密度重悬,然后皮下接种(1
×
106细胞/小鼠)到c57bl/6小鼠(charles river laboratories japan)右侧的腹股沟区域。在形成可触及的肿瘤后,将动物随机分入试验组中,使得各组在试验开始时具有相似的平均肿瘤体积。
[0244]
==免疫组织化学==
[0245]
对于免疫组织化学,使用抗小鼠cd8α单克隆抗体(克隆kt15,genetex)检测cd8蛋白,使用抗小鼠b7-h1/pd-l1多克隆抗体(r&d systems)检测pd-l1蛋白,并且使用抗小鼠颗粒酶b抗体(克隆gb11)检测颗粒酶b。
[0246]
[实例1]
[0247]
使用小鼠卵巢癌细胞系ov2944-hm-1和小鼠结直肠癌细胞系colon38对同系小鼠模型的表征以及联合使用抗pd-l1抗体和抗vegf抗体的抗肿瘤活性
[0248]
==治疗方法==
[0249]
在随机分组当天开始施用药剂,每周两次经腹膜内施用5mg/kg的抗小鼠pd-l1抗体(克隆6e11,wo 2015/095418),并且每周一次经腹膜内施用10mg/kg的抗小鼠vegf抗体(克隆b20-4.1.1)。施用相同剂量的小鼠igg以作为每种抗体的对照。
[0250]
==肿瘤内pd-l1蛋白和cd8蛋白表达==
[0251]
对于荷ov2944-hm-1癌小鼠和荷colon 38癌小鼠,利用随机分组当天(未给药)提取的肿瘤制作石蜡切片,并且使用免疫组织化学方法检测肿瘤组织中的pd-l1蛋白和cd8蛋白表达。
[0252]
与荷colon 38癌小鼠的肿瘤组织(colon 38)相比,荷ov2944-hm-1癌小鼠的肿瘤组织(hm-1)具有较低的pd-l1蛋白和cd8蛋白表达水平,并且表现出免疫荒漠样(immune desert-like)表型(图1)。
[0253]
==肿瘤体积==
[0254]
在开始施用后第1、4、8、11、15、19、23和25天,使用卡尺测量肿瘤体积,并且使用试验最后一天的肿瘤体积进行统计学分析。当使用ov2944-hm-1细胞时,与对照组相比,在抗pd-l1抗体单一施用组中未观察到明显差异,而抗vegf抗体单一施用组中则明显减小。与每个单一施用组相比,两种抗体联合使用组(组合使用)的肿瘤体积显著减小(图2a)。当使用colon 38细胞时,与对照组的肿瘤体积相比,抗pd-l1抗体单一施用组和抗vegf抗体单一施用组均表现出显著减小。与每个单一施用组相比,两种抗体联合使用组(组合使用)的肿瘤体积显著减小(图2b)。
[0255]
换言之,荷ov2944-hm-1癌小鼠中的肿瘤对抗pd-l1抗体(一种pd-1/pd-l1信号传导抑制剂)无应答,但是联合使用抗pd-l1抗体与抗vegf抗体(一种vegf信号传导抑制剂)时,与对照组(小鼠igg)、抗vegf抗体单一施用组和抗pd-l1抗体单一施用组相比,均显著抑制了肿瘤生长。上述结果表明,联合使用抗pd-l1抗体与抗vegf抗体所产生的抗肿瘤作用强于单独使用每种抗体,无论对单独的抗pd-l1抗体有抗性还是敏感均如此。
[0256]
[实例2]
[0257]
在荷ov2944-hm-1癌小鼠中,联合使用抗pd-l1抗体与抗vegf抗体对肿瘤内cd8呈阳性的t细胞的影响以及对抗肿瘤作用的贡献。
[0258]
==治疗方法==
[0259]
在随机分组当天开始施用药剂,每周两次经腹膜内向荷ov2944-hm-1癌小鼠施用5mg/kg的6e11抗体,并且每周一次经腹膜内施用10mg/kg的b20-4.1.1。此外,自随机分组日之前11天开始,每周两次以100μg/小鼠的剂量经腹膜内向荷ov2944-hm-1癌小鼠施用抗小鼠cd8抗体(克隆116-13.1)。施用相同剂量的小鼠igg以作为每种抗体的对照。
[0260]
==cd8呈阳性的t细胞以及颗粒酶b呈阳性、cd8呈阳性的t细胞==
[0261]
在开始施用后第8天,从小鼠中提取肿瘤,并且用gentlemacs(注册商标)octo dissociator分散细胞,使用抗小鼠颗粒酶b抗体(克隆gb11)-alexa647(bd biosciences)和抗小鼠cd8α抗体(克隆53-6.3)-bv650(bd biosciences),通过流式细胞术对肿瘤组织中的颗粒酶b呈阳性的t细胞和cd8呈阳性的t细胞进行定量分析。
[0262]
此外,制备在开始施用后第8天提取的肿瘤石蜡切片,用于对cd8蛋白进行ihc评分测量,并且使用抗小鼠cd8α抗体(克隆kt15)(genetex)检测每个治疗组的肿瘤组织中cd8呈阳性的t细胞。
[0263]
==肿瘤体积==
[0264]
在开始施用后第1、3、8、11、15、18和22天,使用卡尺测量肿瘤体积。
[0265]
在抗pd-l1抗体单一施用组和抗vegf抗体单一施用组中,cd8呈阳性的t细胞相对于所有活细胞的比例与对照组相比无显著差异,但是在联合使用两种抗体的组中(组合使用),所述比例则明显更高(图3a)。在抗pd-l1抗体单一施用组和抗vegf抗体单一施用组中,颗粒酶b呈阳性、cd8呈阳性的t细胞相对于所有活细胞的比例与对照组相比也不存在显著差异,但是在联合使用两种抗体的组中(组合使用),所述比例则明显更高(图3b)。
[0266]
在开始施用后第8天,cd8蛋白的ihc得分(通过如下设置得到的图:无发现(-)、极轻微(
±
)、轻微(+)、中度(++)、明显(+++),然后转换为得分(
“‑”
=0,
“±”
=1,“+”=2,“++”=3,“+++”=4))在接受6e11和b20-4.1.1联合使用的小鼠中,与对照组和抗vegf抗体单一施用组相比明显更高(图3c和图3d)。
[0267]
上述结果表明,单一施用抗pd-l1抗体6e11不影响肿瘤内cd8呈阳性的t细胞的数量。另外,颗粒酶b呈阳性、cd8呈阳性的t细胞代表活化的cd8呈阳性的t细胞。
[0268]
因此,表明即使对于单一施用抗pd-l1抗体(一种pd-1/pd-l1信号传导抑制剂)对肿瘤内活化的cd8呈阳性的t细胞无影响的癌症,与对照组和抗vegf抗体单一施用组相比,联合使用抗pd-l1抗体与抗vegf抗体具有显著增加浸润到肿瘤中的活化的cd8呈阳性的t细胞的作用。
[0269]
关于肿瘤体积,在对照组和抗vegf抗体单一施用组中,无论是否施用抗cd8α抗体,在肿瘤体积方面未见显著差异。同时,在联合使用组(组合使用)(组合使用+抗cd8α抗体)中,抗cd8α抗体的施用使肿瘤体积显著增加至与抗vegf抗体单一施用组相同的水平(图4a)。
[0270]
图4b显示了各组开始施用后第22天的肿瘤体积的比较。与对照组(均为
“‑”
)或抗vegf抗体单一施用组(仅抗vegf抗体为“+”)相比,抗pd-l1抗体与抗vegf抗体联合使用组(抗pd-l1抗体和抗vegf抗体均为“+”)中的肿瘤体积明显减小,即获得了明显更高的抗肿瘤作用。在除联合使用抗pd-l1抗体与抗vegf抗体以外联合使用抗cd8α抗体的组中(均为“+”),肿瘤体积增加至与抗vegf抗体单一施用组相同的水平。即,抵消了由于联合使用而诱
导的抗肿瘤作用的增强。
[0271]
上述结果表明,肿瘤内cd8呈阳性的t细胞介导了抗pd-l1抗体and抗vegf抗体联合使用所诱导的抗肿瘤作用的增强。
[0272]
[实例3]
[0273]
在荷ov2944-hm-1癌小鼠中,联合使用抗pd-l1抗体与抗vegf抗体对肿瘤内cxcl9蛋白表达的影响以及对肿瘤内cd8呈阳性的t细胞增加的贡献
[0274]
==治疗方法==
[0275]
在随机分组当天开始施用药剂,每周两次经腹膜内向荷ov2944-hm-1癌小鼠施用5mg/kg的6e11抗体,并且每周一次经腹膜内向荷ov2944-hm-1癌小鼠施用10mg/kg的b20-4.1.1。每周两次以100μg/小鼠的剂量经腹膜内向荷ov2944-hm-1癌小鼠施用抗小鼠cxcr3抗体(克隆cxcr3-173)。施用相同剂量的小鼠igg以作为每种抗体的对照。
[0276]
==cxcl9蛋白表达==
[0277]
开始施用后第8天,从小鼠中提取肿瘤,并且使用quantikine elisa(小鼠cscl9/mig)(r&d systems)通过elisa对肿瘤组织中cxcl9蛋白的表达水平进行定量分析。
[0278]
关于cxcl9蛋白表达水平而言,抗pd-l1抗体单一施用组和抗vegf抗体单一施用组与对照组相比未见显著差异。在联合使用抗pd-l1抗体与抗vegf抗体的组中(组合使用),cxcl9蛋白表达水平相比于对照组或抗vegf抗体单一施用组明显更高(图5a)。
[0279]
此外,在除抗pd-l1抗体和抗vegf抗体以外施用抗cxcr3抗体的组中(均为“+”),所有活细胞中cd8呈阳性的t细胞的比例与联合使用抗pd-l1抗体与抗vegf抗体的组相比显著降低,并且与对照组处于相同的水平(图5b)。这表明抗cxcr3抗体诱导的cd8呈阳性的t细胞中cxcr3轴的阻滞抵消了联合使用抗pd-l1抗体与抗vegf抗体时观察到的抗肿瘤作用的增强。
[0280]
实例2表明,在抗pd-l1抗体与抗vegf抗体联合使用组中观察到肿瘤内cd8呈阳性的t细胞的增加有助于抗肿瘤作用的增强。
[0281]
cxcl9是一种t细胞趋化因子,其通过与t细胞上表达的受体cxcr3结合而起作用,并且本实例(图5)表明,在联合使用抗pd-l1抗体与抗vegf抗体的组中观察到更高的肿瘤内cxcl9蛋白浓度,其通过cd8呈阳性的t细胞中的cxcr3轴促进了对肿瘤的浸润的增强。结合实例2和实例3,据信抗pd-l1抗体与抗vegf抗体联合使用的抗肿瘤作用的显著增强(如图2和图4所示)由肿瘤内cxcl9蛋白浓度升高所诱导的肿瘤内cd8呈阳性的t细胞的增加引起。
[0282]
[实例4]
[0283]
在荷ov2944-hm-1癌小鼠中,联合使用抗pd-l1抗体与抗vegf抗体对肿瘤细胞上mhc i类分子的影响
[0284]
==治疗方法==
[0285]
在随机分组当天开始施用药剂,每周两次经腹膜内向荷ov2944-hm-1癌小鼠施用5mg/kg的6e11抗体,并且每周一次经腹膜内向荷ov2944-hm-1癌小鼠施用10mg/kg的b20-4.1.1。施用相同剂量的小鼠igg以作为每种抗体的对照。
[0286]
==mhc i类分子==
[0287]
在开始施用后第8天,从小鼠中提取肿瘤,并且用gentlemacs(注册商标)octo dissociator分散细胞,使用抗小鼠h-2kk(c3h)抗体-fitc(biolegend),通过流式细胞术对
肿瘤细胞上mhc i类分子的蛋白表达水平进行定量分析。
[0288]
与其他施用组相比,联合使用抗pd-l1抗体与抗vegf抗体的组中mhc i类分子蛋白表达水平显著增加(图6)。
[0289]
mhc i类分子将抗原呈递给cd8呈阳性的t细胞,并且在癌细胞消除等方面起重要作用。根据目前的结果,据信联合使用抗pd-l1抗体与抗vegf抗体增强了肿瘤特异性抗原呈递给cd8呈阳性的t细胞。
[0290]
[实例5]
[0291]
在荷ov2944-hm-1癌小鼠中,联合使用抗pd-l1抗体与抗vegf抗体对肿瘤内微血管密度的影响
[0292]
==治疗方法==
[0293]
在随机分组当天开始施用药剂,每周两次经腹膜内向荷ov2944-hm-1癌小鼠施用5mg/kg的6e11抗体,并且每周一次经腹膜内向荷ov2944-hm-1癌小鼠施用10mg/kg的b20-4.1.1。施用相同剂量的小鼠igg以作为每种抗体的对照。
[0294]
==肿瘤内微血管密度==
[0295]
在开始施用后第8天,测量从小鼠中提取的肿瘤的肿瘤内微血管密度(mvd)。使用大鼠抗小鼠cd31单克隆抗体(克隆mec 13.3)(becton dickinson and company)和大鼠hrp-polymer,1-step(小鼠吸附)(biocare medical),通过免疫组织化学方法检测肿瘤组织中的cd31蛋白,并且根据cd31呈阳性的面积相对于总观察面积(每个切片包含3-6个活组织区域)的比率计算mvd。关于mvd,抗pd-l1抗体单一施用组中的微血管密度与对照组相比无显著差异。同时,联合使用抗pd-l1抗体与抗vegf抗体的组中(组合使用)和抗vegf抗体单一施用组中的微血管密度明显低于对照组或抗pd-l1抗体单一施用组(图7)。
[0296]
肿瘤内微血管密度与癌症进展有关。根据目前的结果,即使对抗pd-l1抗体(一种pd-1/pd-l1信号传导抑制剂)具有抗性的癌症,联合使用抗pd-l1抗体与抗vegf抗体以及施用抗vegf抗体具有显著降低肿瘤内微血管密度的作用,即抗肿瘤作用。
[0297]
基于本实例和实例1-4,表明在具有pd-l1
低
肿瘤和免疫荒漠样表型的对pd-l1信号传导抑制剂无应答的小鼠模型中,联合使用抗pd-l1抗体(一种pd-1/pd-l1信号传导抑制剂)与抗vegf抗体(一种vegf信号传导抑制剂)提供了强的抗肿瘤作用,其通过增加肿瘤内cxcl9并且随后增强cd8呈阳性的t细胞浸润到肿瘤中来实现。
[0298]
产业适用性
[0299]
本发明可用于癌症治疗。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1