用于基因递送的重组腺相关病毒载体的制作方法
用于基因递送的重组腺相关病毒载体
1.相关申请的交叉引用
2.本技术要求2018年12月5日提交的美国临时申请62/775,871;2019年2月5日提交的62/801,195;2019年6月18日提交的62/863,126和2019年10月14日提交的62/914,856的优先权,这些申请各自出于所有目的以引用方式整体并入本文中。
3.通过引用并入序列表
4.据此以电子文档提交的文本文件的内容全文以引用方式并入本文:序列表的计算机可读格式副本(文件名:abeo_002_04wo_seqlist_st25,创建日期:2019年12月3日;文件大小:556kb)。
背景技术:
5.腺相关病毒载体是基因疗法的有前途的递送载体。然而,它们的治疗功效因载体的递送效率或有限的组织趋性而受到影响。因此,迫切需要具有更佳治疗潜力的新aav载体。
技术实现要素:
6.本公开整体涉及基因疗法领域,并且具体地涉及具有新衣壳蛋白的重组腺相关病毒(aav)载体颗粒(也称为aav病毒载体)、它们的制备、以及它们递送转基因以治疗或预防疾病或病症的用途。
附图说明
7.图1用于aim衣壳文库构建的策略。
8.图2a:组织培养中转导效率的比较。将hek 293细胞以50,000个细胞/孔接种于96孔板中。用含有aav9
‑
gfp或aav214
‑
gfp病毒的衣壳以5e+5的moi转导细胞。在转导后45小时拍摄图像。
9.图2b给予aav9或aav214病毒的2e+11病毒基因组(vg)的小鼠的不同组织中的转导效率的比较。
10.图2c给予aav9或aav214病毒2e+11vg的小鼠的脑中的转导效率和表达水平的比较。
11.图3a aav施用后小鼠视网膜的扫描激光检眼镜成像。通过视网膜下(右眼)和玻璃体内(左眼)注射,给野生型c57bl/6j小鼠施用经标记的aav血清型。对于两种施用方法,注射1μl 5e+12vg/ml(5e+9vg/眼)的aav载体,10天后用hra2 spectralis扫描激光检眼镜(heidelberg engineering,carlsbad,ca)对动物成像。从图中省略了白内障妨碍充分观察的图像。
12.图3b对玻璃体内给予aav204
‑
gfp的小鼠眼的ihc分析。
13.图4比较了通过rt
‑
qpcr得到的灵长类动物中由aav204或aav9转导所介导的gfp表达。虚线对应于计算为
‑
rt平均值的背景加上2或4个标准偏差。
14.图5a
‑
5f示出aav204介导的眼表达。图5a示出由玻璃体内注射的aav204介导的转导扩散,主要是外周和一些中央凹。图5b示出(通过gfp表达)在灵长类动物玻璃体内注射aav204病毒后,包括感光细胞和rpe细胞在内的多种视网膜细胞的转导。图5c示出黄斑中大量的感光细胞和rpe转导,其中大多数视锥(负责色觉的感光细胞)是集中的。图5d
‑
5f示出由vmd2(卵黄状黄斑变性
‑
2启动子)驱动的aav204的gfp的表达,vmd2是rpe的细胞特异性启动子。在玻璃体内注射2.5
×
10
12
个病毒基因组(vg)载体后的第14天(图5d)和第28天(图5e)进行slo成像。图5f示出第28天时外周的gfp表达和核(dapi)。
15.图6示出对离体进行的nhp眼外植体转导的ihc分析。
16.图7中和抗体定量策略。发光不存在指示靶aav被中和抗体结合。
17.图8展示aav204和aav9的不同免疫原性。使用内部开发的方法获得中和抗体滴度。将aav9
‑
luc或pa
‑
aav204
‑
luc与各种血清稀释液在25,000的moi下温育。温育后,将病毒/血清混合物转移到含有20,000个lec2细胞的孔中,并与细胞一起温育24小时,之后测量发光并与来自仅用相同moi的病毒转导的细胞的对照值进行比较。
18.图9示出使用aav204或aav6(aav肺转导的基准)通过气管内递送的肺转导的比较。
19.图10a
‑
10c示出通过flipr测定得到的cftrδr和全长表达盒的功能性(图10a)和对aav204包装的cftrδr表达盒处理的剂量反应(图10b)。图10c示出就通过flipr测定的膜电位而言,cftrδr与全长密码子优化的cftr表达的比较。用表达这些蛋白的aav204转导293细胞,监测荧光变化。读取基线1分钟,然后向细胞中加入50m毛喉素。
20.图11a
‑
11c示出aav204转导培养的cf患者细胞的能力(图11a),细胞膜中cftrδr表达和正确定位(图11b),并且cftrδr表达使人cf患者细胞中的cftr电流恢复(图11c)。
21.图12a示出将包含cftr转基因的aav204颗粒经鼻施用给纤维化小鼠模型的体内效应。图12b示出aav204/cftrδr治疗(通过增加鼻膜电位)在不同cf患者细胞中的效应。
22.图13示出在静脉内施用病毒颗粒30天后,aav9
‑
cln3和aav214
‑
cln3载体在cln3δex7/8小鼠模型中的生物分布。
23.图14示出通过rt
‑
qpcr测量的aav9
‑
cln3和aav214
‑
cln3载体在cln3δex7/8小鼠脑组织中的表达。
24.图15示出gla在转导的hek293细胞中表达的免疫印迹。
25.图16示出aav施用后c57bl/6小鼠的血浆、脑、肝、脊髓、心、肾和眼中gla的酶活性(超生理)。
26.图17示出通过静脉注射进行aav施用后c57bl/6小鼠的脑、二头肌、膈膜和肝中gaa的酶活性。
27.图18a
‑
18b示出通过转染在hek293细胞中表达的重组hgaa的免疫印迹(图18a)和酶促分析(图18b)。
28.图19a
‑
19e示出aav施用后c57bl/6小鼠的血浆(图19a)、脑(图19b)、二头肌(图19c)、膈膜(图19d)或肝(图19e)中gaa的酶活性。图19f示出用aav衣壳经iv治疗的gaa
‑
/
‑
小鼠中的糖原水平。数据表示为gaa
‑
/
‑
小鼠中发现的糖原的百分比%。糖原减少表明通过aav9和aav214介导的密码子优化的gaa酶的表达使gaa功能恢复。
29.图20示出来自aav204(seq id no:2)和aav6(seq id no:63)的vp1氨基酸序列的比对。
30.图21示出来自下列的vp1蛋白氨基酸序列的比对:aav214(seq id no:3);aav214a(seq id no:30)、aav214ab(seq id no:84)、aav214e(seq id no:31)、aav214e8(seq id no:32)、aav214e9(seq id no:33)、aav214e10(seq id no:34)、itb204_45(seq id no:49)、aav9(seq id no:71)和aav8(seq id no:67)。
31.图22示出来自下列的vp2蛋白氨基酸序列的比对:aav214(seq id no:35);aav214a(seq id no:36)、aav214ab(seq id no:85)、aav214e(seq id no:37)、aav214e8(seq id no:38)、aav214e9(seq id no:39)、aav214e10(seq id no:40)、itb204_45(seq id no:50)、aav9(seq id no:72)和aav8(seq id no:68)。
32.图23示出来自下列的vp3蛋白氨基酸序列的比对:aav214(seq id no:41);aav214a(seq id no:42)、aav214ab(seq id no:86)、aav214e(seq id no:43)、aav214e8(seq id no:44)、aav214e9(seq id no:45)、aav214e10(seq id no:46)、itb204_45(seq id no:51)、aav9(seq id no:73)和aav8(seq id no:69)。
33.图24a示出肌内施用后由aav110载体颗粒和aav9载体颗粒递送的gfp转基因的表达。上图以白光示出左腿和右腿,示出了整体组织结构。下图示出gfp荧光。
34.图24b提供了与aav9相比,图24a中获得的aav110颗粒(itcord1.10)的荧光的定量分析。
35.图25a
‑
25c示出肌内施用后,由aav110颗粒(itcord1.10)递送的转基因相对于aav9的表达。数据显示肌肉中的aav110表达特别高。
36.图26a示出肌内施用表达gfp的aav110和aav9颗粒后,用于检测gfp表达的肌肉组织的免疫组织化学。图示出由aav9载体颗粒表达的gfp(左下图)、由aav110颗粒表达的gfp(右下图)和对照肌肉(上图)。用抗gfp抗体对组织进行染色。
37.图26b.im递送的aav214比aav9转导更大的肌肉区域。通过im注射后10天的免疫组织化学来分析大鼠全肌(股二头肌)的gfp或mcherry表达。用gfp和mcherry pab探测固定和冷冻切片。与aav9相比,aav214展示出显著更大的转导区域,其主要局限于与注射位点一致的肌肉的上部。
38.图27示出荧光素酶的生物发光图像,所述荧光素酶以转基因表达并暴露于荧光素。在aav214施用后28天获得数据。
39.图28比较了在aav214和aav9中静脉内递送的smn
‑
1蛋白的肌肉表达。
40.图29示出由aav214和aav9的变体介导的心脏和二头肌中作为转基因的gfp的表达。y轴示出每微克基因组dna的病毒拷贝数的log10值。
41.图30示出vp1、vp2和vp3衣壳蛋白的示意图。vp1和vp2特异性部分与vp3部分一起标出,该vp3部分与产生的vp3蛋白相同。示出aav214 vp3的氨基酸序列(seq id no:41)并指示可变区i
‑
ix。aav214的完整vp1蛋白氨基酸序列以seq id no:3提供。
42.图31a
‑
31c说明aav214治疗的动物证实aav9中和抗体的产生减少。图31a示出测定经im给予aav9或aav214的动物的针对aav9的中和抗体。通过测定动物血清抑制aav9转导的能力进行分析。萤光素酶载体导入允许的细胞类型,lec2。转导后三天,测定细胞的萤光素酶活性。每组由2或3只大鼠组成,用于对照,aav9或aav214。图31b和31c示出与aav9和aav204的交叉反应性。图31b示出aav9测试后各种aav中和抗体的产生。图31c示出aav204测试后各种aav中和抗体的产生。
具体实施方式
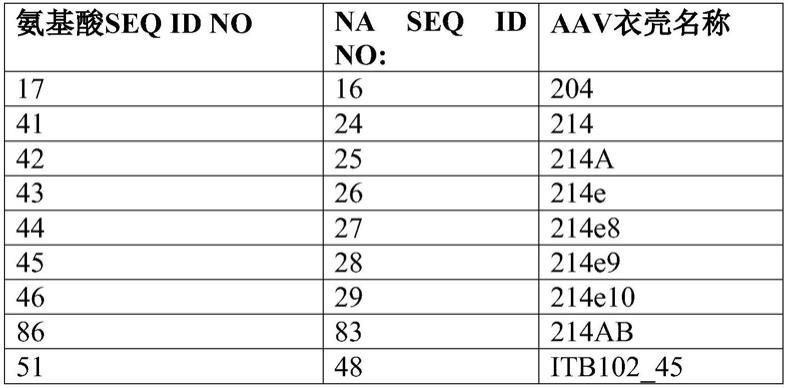
43.下文将更全面地描述根据本公开的一些实施方案。然而,本公开的各方面可以以不同的形式来体现,并且不应被解释为限于本文所阐述的实施方案。相反,提供这些实施方案是为了使本公开透彻和完整,并且将向本领域技术人员充分传达本发明的范围。在本文的描述中使用的术语仅是为了描述特定实施方案的目的,而不是旨在限制。
44.除非另有定义,否则本文所用的所有术语(包括技术和科学术语)具有与本发明所属领域的普通技术人员通常理解的相同含义。还应当理解,诸如在常用词典中定义的那些术语应当被解释为具有与它们在本技术和相关领域的上下文中的含义一致的含义,并且不应当以理想化或过于正式的意义来解释,除非在此明确地如此定义。
45.除非上下文另外指出,否则特别旨在本文所述的本发明的各种特征可以以任何组合使用。此外,本公开还预期在实施方案中,可以排除或省略本文阐述的任何特征或特征的组合。为了说明,如果说明书陈述复合物包含组分a、b和c,明确意欲可单独地或组合地忽略和不要求保护a、b或c中任一种,或它们的组合。
46.除非明确地另外指出,否则所有指定的一些实施方案、特征和术语旨在包括所叙述的实施方案、特征或术语以及它们的生物学等同物。
47.通过引用并入
48.本文引用的所有参考文献、文章、出版物、专利公布和专利申请出于所有目的以引用方式整体并入。然而,本文引用的任何参考文献、文章、出版物、专利公布和专利申请的提及不得且不应被视为承认或以任何形式表明它们构成有效的现有技术或形成世界上任何国家公知常识的一部分。
49.定义
50.除非另有说明,本技术的实施将采用有机化学、药理学、免疫学、分子生物学、微生物学、细胞生物学和重组dna的常规技术,这些技术在本领域的技术范围内。参见,例如,sambrook,fritsch和maniatis,molecular cloning:a laboratory manual,第2版(1989);current protocols in molecular biology(f.m.ausubel等编辑,(1987));the series methods in enzymology(academic press,inc.):pcr 2:a practical approach(m.j.macpherson,b.d.hames和g.r.taylor编辑(1995)),harlow和lane编辑,(1988)antibodies,a laboratory manual,and animal cell culture(ri.freshney,编(1987))。
51.如在本发明的说明书和所附权利要求中所使用的,单数形式“一/一个”、和“该/所述”也旨在包括复数形式,除非上下文另有明确指示。
52.如本文所用,术语“包括”旨在表示组合物和方法包括所述的要素,但不排除其他要素。如本文所用,过渡短语“基本上由......组成”(和语法上的变体)应被解释为包括所述的材料或步骤以及那些本质上不影响所述实施方案的基本和新颖特征的材料或步骤。因此,本文所用的术语“基本上由......组成”不应解释为等同于“包含......”“由......组成”应意指排除多于微量的其它成分要素以及用于施用本发明所公开的组合物的实质性方法步骤。由这些过渡术语中的每一个定义的方面在本公开的范围内。
53.所有的数字名称,例如ph、温度、时间、浓度和分子量,包括范围,都是近似值,其以1.0或0.1的增量适当地,或以+/
‑
15%、10%、5%、2%的变化可选地改变(+)或(
‑
)。应当理解,尽管不总是明确地说明,所有的数字名称前面都有术语“约”。还应理解,尽管不总是明
确地说明,但本文所述的试剂仅是示例性的,并且其等同物是本领域已知的。当涉及可测量值如量或浓度等时,本文所用的术语“约”是指包括指定量的20%、10%、5%、1%、0.5%或甚至0.1%的变化。
54.本文所公开的术语“可接受的”、“有效的”或“足够的”当用于描述任何组分、范围、剂型等的选择时意指所述组分、范围、剂型等适用于所公开的目的。
55.此外,如本文所用,“和/或”是指并且包括相关联的所列项目中的一个或多个项目的任意和所有可能组合,以及当以二者择一(“或”)解释时,组合的缺乏。
56.除非特别说明,术语“宿主细胞”包括真核宿主细胞,包括例如真菌细胞、酵母细胞、高等植物细胞、昆虫细胞和哺乳动物细胞。真核宿主细胞的非限制性实例包括猿、牛、猪、鼠、大鼠、鸟、爬行动物和人,例如hek293细胞和293t细胞。
57.如本文所用,术语“分离的”是指基本上不含其它物质的分子或生物制品或细胞物质。
58.如本文所用,术语“核酸序列”和“多核苷酸”可互换使用,指任何长度的核苷酸(核糖核苷酸或脱氧核糖核苷酸)的聚合形式。因此,该术语包括但不限于单链、双链或双链dna或rna、基因组dna、cdna、dna
‑
rna杂交体或包含、由或基本上由嘌呤和嘧啶碱基或其他天然的、化学或生物化学修饰的、非天然的或衍生的核苷酸碱基组成的聚合物。
[0059]“基因”指含有至少一个能够编码特定多肽或蛋白质的开放阅读框(orf)的多核苷酸。“基因产物”或可选地“基因表达产物”指当基因转录和翻译时产生的氨基酸序列(例如肽或多肽)。
[0060]
如本文所用,“表达”是指多核苷酸被转录成mrna的两步过程和/或转录的mrna随后被翻译成肽、多肽或蛋白质的过程。如果多核苷酸来自基因组dna,则表达可包括在真核细胞中剪接mrna。
[0061]“在转录控制下”是本领域熟知的术语,表示多核苷酸序列(通常是dna序列)的转录依赖于其与有助于转录起始或促进转录的元件的可操作地连接。“可操作地连接”是指多核苷酸以允许它们在细胞中发挥功能的方式排列。一方面,本发明提供了与下游序列可操作地连接的启动子。
[0062]
当术语“编码”应用于多核苷酸时,是指如果在其天然状态下或当通过本领域技术人员熟知的方法操作时,其可以被转录以产生多肽和/或其片段的mrna,则称其“编码”多肽的多核苷酸。反义链是这种核酸的互补物,并且可以从其推导出编码序列。
[0063]
本文所用的术语“启动子”是指控制序列,其是多核苷酸序列的区,在该区编码序列如基因或转基因的转录的起始和速率受到控制。启动子可以是例如组成型的、诱导型的、阻遏型的或组织特异性的。启动子可以含有调节蛋白和分子如rna聚合酶和转录因子可以结合的遗传元件。非限制性示例性启动子包括劳斯肉瘤病毒(rsv)ltr启动子(任选地与rsv增强子一起)、巨细胞病毒(cmv)启动子、sv40启动子、二氢叶酸还原酶启动子、β
‑
肌动蛋白启动子、磷酸甘油激酶(pgk)启动子、u6启动子、h1启动子、遍在鸡β
‑
肌动蛋白杂合(cbh)启动子、小核rna(u1a或u1b)启动子、mecp2启动子、mep418启动子、mep426启动子、最小mecp2启动子、vmd2启动子、mrho启动子或efi启动子。
[0064]
本文提供的其它非限制性示例性启动子包括但不限于efla、ubc、人β
‑
肌动蛋白、cag、tre、ac5、多角体蛋白、camkiia、gal1、tef1、gds、adh1、ubi和α
‑1‑
抗胰蛋白酶(haat)。
本领域已知,可以修饰这些启动子的核苷酸序列以提高或降低mrna转录的效率。参见,例如gao等(2018)mol.ther.:nucleic acids 12:135
‑
145(修饰7sk、u6和h1启动子的tata盒以消除rna聚合酶iii转录并刺激rna聚合酶ii依赖性mrna转录)。合成来源的启动子可用于普遍存在的或组织特异性表达。此外,病毒来源的启动子,其中一些如上所述,可用于本文公开的方法中,例如cmv、hiv、腺病毒和aav启动子。在实施方案中,启动子与增强子一起使用以增加转录效率。增强子的非限制性实例包括间隙类视黄醇结合蛋白(irbp)增强子、rsv增强子或cmv增强子。
[0065]
增强子是增加靶序列表达的调节元件。“启动子/增强子”是含有能够提供启动子和增强子功能的序列的多核苷酸。例如,逆转录病毒的长末端重复同时含有启动子和增强子功能。增强子/启动子可以是“内源的”或“外源的”或“异源的”“内源”增强子/启动子是与基因组中的给定基因天然连接的增强子/启动子。“外源”或“异源”增强子/启动子是通过遗传操作(即分子生物学技术)与基因并置的增强子/启动子,使得该基因的转录由连接的增强子/启动子指导。用于本文提供的方法、组合物和构建体的连接的增强子/启动子的非限制性实例包括pde启动子加irbp增强子或cmv增强子加u1a启动子。本领域理解增强子可以远距离操作,而与它们相对于内源或异源启动子位置的方向无关。因此,进一步理解的是,在距启动子一定距离处操作的增强子因此“可操作地连接”到该启动子,而不管其在载体中的位置或其相对于启动子位置的取向。
[0066]
术语“蛋白质”、“肽”和“多肽”可互换使用,并且在其最广泛的意义上是指两个或更多个氨基酸亚基、氨基酸类似物或肽模拟物的化合物。亚基可以通过肽键连接。在另一个方面,亚基可以通过其它键例如酯、醚等连接。蛋白质或肽必须含有至少两个氨基酸,并且对可以包含、由或基本上由蛋白质或肽序列组成的氨基酸的最大数目没有限制。本文所用术语“氨基酸”是指天然和/或非天然或合成的氨基酸,包括甘氨酸和d和l光学异构体、氨基酸类似物和肽模拟物。
[0067]
如本文所用,术语“信号肽”或“信号多肽”意指通常存在于新合成的分泌或膜多肽或蛋白质的n末端的氨基酸序列。它用于将多肽导向特定的细胞位置,例如穿过细胞膜、进入细胞膜或进入细胞核。在实施方案中,信号肽在定位后被去除。信号肽的实例是本领域公知的。非限制性实例是描述于美国专利8,853,381、5,958,736和8,795,965中的那些。在实施方案中,信号肽可以是idua信号肽。
[0068]
当涉及特定分子、生物材料或细胞物质时,术语“等同物”或“生物等同物”可互换使用,并且是指具有最小同源性同时仍保持所需结构或功能的那些。等同多肽的非限制性实例包括与参照多肽(例如野生型多肽)具有至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%同一性或至少约99%同一性的多肽;或由与参考多核苷酸(例如野生型多核苷酸)具有至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%的同一性、至少约97%的序列同一性或至少约99%的序列同一性的多核苷酸编码的多肽。
[0069]“同源性”或“同一性”或“相似性”是指两个肽之间或两个核酸分子之间的序列相似性。同一性百分比可以通过比较每个序列中的位置来确定,所述序列可以为了比较的目的而比对。当被比较序列中的位置被相同的碱基或氨基酸占据时,则分子在该位置是相同的。序列之间的同一性程度取决于共享的匹配位置数目。“无关”或“非同源”序列与本公开
的序列之一共享小于40%的同一性、小于25%的同一性。通过将所述核酸或氨基酸序列导入clustalw(可从https://genome.jp/tools
‑
bin/clustalw/获得)并使用该clustalw,可以确定本文提供的核酸或氨基酸序列的比对和序列同一性百分比。例如,使用gonnet(对于蛋白质)权重矩阵产生用于进行本文发现的蛋白质序列比对(例如,图20
‑
23)的clustalw参数。在实施方案中,使用clustalw(用于dna)权重矩阵产生用于使用本文发现的核酸序列进行核酸序列比对的clustalw参数。
[0070]
如本文所用,氨基酸修饰可以是氨基酸取代、氨基酸缺失或氨基酸插入。氨基酸取代可以是保守氨基酸取代或非保守氨基酸取代。保守置换(也称为保守突变、保守置换或保守变异)是蛋白质中的氨基酸置换,其将给定氨基酸改变为具有相似生化性质(例如电荷、疏水性或大小)的不同氨基酸。如本文所用,“保守变异”是指氨基酸残基被另一个生物学上相似的残基置换。保守变异的实例包括一个疏水残基如异亮氨酸、缬氨酸、亮氨酸或甲硫氨酸取代另一个;或一个带电荷或极性残基取代另一个,如精氨酸取代赖氨酸,谷氨酸取代天冬氨酸,谷氨酰胺取代天冬酰胺等。保守取代的其它示例性实例包括以下变化:丙氨酸变为丝氨酸;天冬酰胺变为谷氨酰胺或组氨酸;天冬氨酸变为谷氨酸;半胱氨酸变为丝氨酸;甘氨酸变为脯氨酸;组氨酸变为天冬酰胺或谷氨酰胺;赖氨酸变为精氨酸、谷氨酰胺或谷氨酸;苯丙氨酸变为酪氨酸,丝氨酸变为苏氨酸;苏氨酸变为丝氨酸;色氨酸变为酪氨酸;酪氨酸变为色氨酸或苯丙氨酸;等等。
[0071]
如本文所用,术语“载体”指包含完整复制子、基本上由完整复制子组成或由完整复制子组成的核酸,使得当例如通过转染、感染或转化过程将载体置于细胞内时,载体可以被复制。本领域理解,一旦进入细胞,载体可以作为染色体外(附加型)元件复制或者可以整合到宿主细胞染色体中。载体可以包括来源于逆转录病毒、腺病毒、疱疹病毒、杆状病毒、修饰的杆状病毒、乳多空病毒或其它修饰的天然存在的病毒的核酸。用于递送核酸的示例性非病毒载体包括裸dna;与阳离子脂质(单独或与阳离子聚合物结合)复合的dna;阴离子和阳离子脂质体;dna
‑
蛋白质复合物和颗粒,其包含与阳离子聚合物(如异质聚赖氨酸、限定长度的寡肽和聚乙烯亚胺)凝聚的,在一些情况下包含在脂质体中的dna、基本上由其组成或由其组成,所述阳离子聚合物例如异源聚赖氨酸、限定长度的寡肽和聚乙烯亚胺;以及包含、基本上由或由病毒和聚赖氨酸
‑
dna病毒和聚赖氨酸
‑
dna组成的三元复合物的使用。
[0072]
关于一般重组技术,含有启动子和克隆位点的载体是本领域公知的,其中多核苷酸可以可操作地连接到所述克隆位点中。这些载体能够在体外或体内转录rna,并且可以从诸如agilent technologies(santa clara,calif)和promega biotech(madison,wis.)的来源商购获得。为了优化表达和/或体外转录,可能需要去除、添加或改变克隆的转基因的5'和/或3'非翻译部分,以消除额外的、潜在的不适当的可选翻译起始密码子或或可能在转录或翻译层面干扰或降低表达的其它序列。或者,可将共有核糖体结合位点插入紧靠起始密码子的5'以增强表达。
[0073]“病毒载体”定义为重组产生的病毒或病毒颗粒,其含有将在体内、离体或体外递送至宿主细胞中的多核苷酸。病毒载体的实例包括逆转录病毒载体、aav载体、慢病毒载体、腺病毒载体、甲病毒载体等。甲病毒载体,例如基于塞姆利基森林(semliki forest)病毒的载体和基于辛德毕斯(sindbis)病毒的载体,也已经被开发用于基因疗法和免疫疗法。参见,例如schlesinger和dubensky(1999)curr.opin.biotechnol.5:434
‑
439和ying等。
(1999)nat.med.5(7):823
‑
827。
[0074]
如本文所用,术语“重组表达系统”或“重组载体”是指用于表达通过重组形成的某些遗传物质的遗传构建体。
[0075]“基因递送载体”定义为任何可以携带插入的多核苷酸进入宿主细胞的分子。基因递送载体的实例是脂质体、胶束、生物相容的聚合物,包括天然聚合物和合成聚合物;脂蛋白;多肽;多糖;脂多糖;人工病毒包膜;金属颗粒;细菌;病毒,如杆状病毒、腺病毒和逆转录病毒;噬菌体、粘粒、质粒和真菌载体;和本领域通常使用的其它重组载体,其已经被描述用于在多种真核和原核宿主中表达,并且可以用于基因疗法以及用于简单蛋白质表达。也包含、基本上由或由靶向抗体或其片段组成的脂质体可用于本文公开的方法中。除了将多核苷酸递送至细胞或细胞群之外,可以通过非限制性蛋白转染技术将本文所述的蛋白直接引入细胞或细胞群,或者,可以增强本文公开的蛋白的表达和/或促进其活性的培养条件是其他非限制性技术。
[0076]
本文公开的多核苷酸可以使用基因递送载体递送至细胞或组织。本文所用的“基因递送”、“基因转移”、“转导”等是指将外源多核苷酸(有时称为“转基因”)导入宿主细胞,而与导入所用的方法无关。这些方法包括多种众所周知的技术,例如载体介导的基因转移(通过例如病毒感染/转染,或多种其它基于蛋白质或基于脂质的基因递送复合物)以及促进“裸”多核苷酸递送的技术(例如电穿孔、“基因枪”递送和用于多核苷酸引入的多种其它技术)。导入的多核苷酸可以稳定或瞬时维持在宿主细胞中。稳定维持通常需要引入的多核苷酸含有与宿主细胞相容的复制起点,或整合到宿主细胞的复制子中,例如染色体外复制子(例如质粒)或核或线粒体染色体。已知许多载体能够介导基因转移到哺乳动物细胞中,如本领域已知和本文所述。
[0077]“质粒”是通常与染色体dna分离并能够独立于染色体dna复制的dna分子。在许多情况下,它是环状的和双链的。质粒提供了在微生物群体内水平基因转移的机制,并且通常在给定的环境状态下提供选择性优势。质粒可以携带在竞争性环境小生境中提供对天然存在的抗生素的抗性的基因,或可选地,产生的蛋白质可以在类似的环境下充当毒素。本领域已知,尽管质粒载体通常以染色体外环状dna分子存在,但也可以设计质粒载体以随机或靶向方式稳定整合到宿主染色体中,并且可以使用环状质粒或在引入宿主细胞之前已经线性化的质粒完成这种整合。
[0078]
基因工程中使用的“质粒”被称为“质粒载体”。许多质粒可商购获得用于这样的用途。将待复制的基因插入到质粒的拷贝中,所述质粒含有使细胞对特定抗生素具有抗性的基因和多克隆位点(mcs或多接头),所述多克隆位点是含有若干个常用限制性位点(允许在该位置容易地插入dna片段)的短区。质粒的另一个主要用途是产生大量的蛋白质。在这种情况下,研究人员培养含有携带目标基因的质粒的细菌或真核细胞,所述目标基因可被诱导以从插入的基因产生大量蛋白质。
[0079]
在由dna病毒载体如腺病毒(ad)或腺相关病毒(aav)介导基因转移的方面,载体构建体是指包含、基本上由或由病毒基因组或其部分以及转基因组成的多核苷酸。
[0080]
本文所用的术语“腺相关病毒”或“aav”是指与该名称相关的病毒类别的成员,并且属于依赖性细小病毒(dependoparvovirus)属,细小病毒(parvoviridae)科。腺相关病毒是一种单链dna病毒,它只在细胞中生长,其中某些功能是由共同感染的辅助病毒提供的。
aav的一般信息和综述可参见例如carter,1989,handbook of parvoviruses,第1卷,第169
‑
228页,以及berns,1990,virology,第1743
‑
1764页,raven press(纽约)。完全期望这些综述中描述的相同原理将适用于在综述的出版日期之后表征的其它aav血清型,因为众所周知,各种血清型在结构上和功能上非常密切相关,甚至在遗传水平上也是如此。(参见,例如,blacklowe,1988年,parvoviruses and human disease第165
‑
174页,j.r.pattison编;和rose,comprehensive virology 3:1
‑
61(1974))。例如,所有aav血清型显然都表现出非常相似的由同源rep基因介导的复制特性;并且都携带三种相关的衣壳蛋白,例如在aav2中表达的那些。相关性程度进一步由异源双链分析提示,其显示了血清型之间沿基因组长度的广泛交叉杂交;以及在对应于“反向末端重复”(itr)的末端存在类似的自退火区段。相似的感染性模式也表明每种血清型的复制功能处于相似的调控下。已知该病毒的多种血清型适于基因递送;所有已知的血清型可以感染来自各种组织类型的细胞。至少11种顺序编号的aav血清型是本领域已知的。可用于本文所公开方法的非限制性示例性血清型包括11种血清型中的任一种,例如aav2、aav8、aav9或变体血清型,例如aav
‑
dj和aav php.b。aav颗粒包含下列三种主要病毒蛋白,基本上由下列三种主要病毒蛋白组成,或由下列三种主要病毒蛋白组成:vp1、vp2和vp3。在实施方案中,aav指血清型aav1、aav2、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav13、aavphp.b或aavrh74。
[0081]
本文所用的“aav载体”指包含一个或多个异源核酸(hna)序列和一个或多个aav反向末端重复(itr)、基本上由其组成或由其组成的载体。当存在于提供rep和cap基因产物功能性的宿主细胞中时,这种aav载体可被复制并包装到感染性病毒颗粒中;例如通过转染宿主细胞。在实施方案中,aav载体含有启动子、编码至少一种蛋白质或rna的至少一种核酸、和/或包装到感染性aav颗粒的侧翼itr内的增强子和/或终止子。包壳的核酸部分可称为aav载体基因组。含有aav载体的质粒也可含有用于制备用途的元件,例如抗生素抗性基因等,但这些不被包壳,因此不形成aav颗粒的一部分。
[0082]
如本文所用,术语“病毒衣壳”或“衣壳”是指病毒颗粒的蛋白质外壳或衣壳。衣壳的功能是包壳、保护、转运病毒基因组,并将其释放到宿主细胞中。衣壳通常由蛋白质的寡聚结构亚基(“衣壳蛋白”)组成。如本文所用,术语“包壳”是指被包含在病毒衣壳内。aav的病毒衣壳由三种病毒衣壳蛋白的混合物组成:vp1、vp2和vp3。vp1、vp2和vp3的混合物含有60个单体,它们以t=1二十面体对称排列,比例为1:1:10(vp1:vp2:vp3)或1:1:20(vp1:vp2:vp3),如sonntag f等(june 2010)所述。"a viral assembly factor promotes aav2 capsid formation in the nucleolus".proceedings of the national academy of sciences of the united states of america.107(22):10220
–
5和rabinowitz je,samulski rj(december 2000)."building a better vector:the manipulation of aav virions".virology.278(2):301
–
8,其中每一篇以引用方式整体并入本文中。
[0083]“aav病毒粒子”或“aav病毒颗粒”或“aav病毒载体”或“aav载体颗粒”或“aav颗粒”指由至少一种aav衣壳蛋白和包壳的多核苷酸aav载体组成的病毒颗粒。因此,aav载体颗粒的生产必然包括aav载体的生产,因为这样的载体包含在aav载体颗粒中。
[0084]
如本文所用,关于病毒或质粒的术语“辅助者”是指用于提供本文公开的任一种aav载体复制和包装所必需的额外组分的病毒或质粒。辅助病毒编码的组分可以包括病毒粒子组装、包壳、基因组复制和/或包装所需的任何基因。例如,辅助病毒或质粒可编码病毒
基因组复制所必需的酶。适合与aav构建体一起使用的辅助病毒和质粒的非限制性实例包括phelp(质粒)、腺病毒(病毒)或疱疹病毒(病毒)。在实施方案中,phelp质粒可以是phelpk质粒,其中氨苄青霉素表达盒与卡那霉素表达盒交换;phelpk具有seq id no:92所示的序列。
[0085]
如本文所用,包装细胞(或辅助细胞)是用于产生病毒载体的细胞。生产重组aav病毒载体需要反式提供的rep和cap蛋白以及来自腺病毒的帮助aav复制的基因序列。在一些方面,包装/辅助细胞含有稳定整合到细胞基因组中的质粒。在其它方面,包装细胞可以被瞬时转染。通常,包装细胞是真核细胞,例如哺乳动物细胞或昆虫细胞。
[0086]
如本文所用,报告蛋白是一种可检测的蛋白,其与启动子可操作地连接以测定启动子的表达(例如,组织特异性和/或强度)。在一些方面,报告蛋白可以可操作地连接至多肽。在一些方面,报告蛋白可用于监测dna递送方法、启动子和增强子元件的功能鉴定和表征、翻译和转录调节、mrna加工和蛋白质:蛋白质相互作用。报告蛋白的非限制性实例是β
‑
半乳糖苷酶;荧光蛋白,例如绿色荧光蛋白(gfp)或红色荧光蛋白(rfp);荧光素酶;谷胱甘肽s
‑
转移酶;和麦芽糖结合蛋白。
[0087]“组合物”旨在意指活性多肽、多核苷酸或抗体与另一种惰性(例如可检测标记)或活性(例如基因递送载体)化合物或组合物的组合。
[0088]“药物组合物”意在包括活性多肽、多核苷酸或抗体与惰性或活性载体如固体支持物的组合,使得组合物适于体外、体内或离体诊断或治疗用途。
[0089]
如本文所用,术语“药学上可接受的载体”涵盖任何标准药物载体,如磷酸盐缓冲盐水溶液、水和乳液,如油/水或水/油乳液,及各种类型的润湿剂。组合物还可以包括稳定剂和防腐剂。载体、稳定剂和佐剂的实例,参见martin (1975)remington's pharm.sci.第15版(mack publ.co.,easton)。
[0090]
诊断或治疗的“受试者”是细胞或动物,例如哺乳动物或人。受试者不限于特定物种,包括接受诊断或治疗的非人动物和接受感染或动物模型的那些动物,包括但不限于猿、鼠、大鼠、犬或兔类物种,以及其它家畜、运动类动物或宠物。在实施方案中,所述受试者是人。
[0091]
本文所用术语“组织”是指活的或死亡的生物体的组织或任何来源于或设计成模仿活的或死亡的生物体的组织。所述组织可以是健康的、患病的和/或具有基因突变。生物组织可以包括任何单个组织(例如,可以相互连接的细胞的集合),或构成器官或生物体的身体的部分或区域的一组组织。该组织可以包含、基本上由或由均质的细胞材料组成,或者它可以是复合结构,例如在包括胸腔的身体区域中发现的结构,例如可以包括肺组织、骨骼组织和/或肌肉组织。示例性组织包括但不限于源自肝脏、肺、甲状腺、皮肤、胰腺、血管、膀胱、肾脏、脑、胆道、十二指肠、腹主动脉、髂静脉、心脏和肠的那些,包括其任何组合。
[0092]
如本文所用,受试者中疾病的“治疗”是指(1)预防受试者中发生的症状或疾病,所述受试者易患或尚未表现出疾病的症状;(2)抑制疾病或阻止其发展;或(3)改善或引起疾病或疾病症状的消退。如本领域所理解的,“治疗”是用于获得有益或期望结果的方法,包括临床结果。出于本技术的目的,有益或期望的结果可以包括一种或多种,但不限于,减轻或改善无论可检测的还是不可检测的一种或多种症状、减轻病状(包括疾病)的程度、病状(包括疾病)的稳定(即,不恶化)状态、延缓或减缓病状(包括疾病)、进展、改善或减轻病状(包
括疾病)、状态和缓解(无论部分或全部)。
[0093]
本文所用术语“有效量”旨在意指足以达到所需效果的量。在治疗或预防应用的情况下,有效量将取决于所讨论的病症的类型和严重性以及个体受试者的特征,例如一般健康、年龄、性别、体重和对药物组合物的耐受性。在基因疗法的背景下,在实施方案中,有效量是足以导致在受试者中缺陷的基因恢复部分或全部功能的量。在其它一些实施方案中,aav病毒颗粒的有效量是足以导致基因在受试者中表达的量。在实施方案中,所述有效量是在有需要的受试者中增加半乳糖代谢所需的量。熟练的技术人员将能够根据这些和其它因素确定合适的量。
[0094]
在实施方案中,有效量将取决于所讨论的应用的大小和性质。它还取决于目标受试者的性质和敏感性以及使用的方法。本领域技术人员将能够基于这些和其它考虑来确定有效量。根据实施方案,有效量可以包括组合物的一次或多次施用、基本上由组合物的一次或多次施用组成或由组合物的一次或多次施用组成。
[0095]
如本文所用,术语“施用”旨在表示将物质递送至受试者,诸如动物或人。施用可以在整个治疗过程中以一个剂量、连续或间歇地进行。确定最有效的施用方式和剂量的方法是本领域技术人员已知的,并且将随用于治疗的组合物、治疗目的以及被治疗的受试者的年龄、健康或性别而变化。可以进行单次或多次施用,剂量水平和模式由治疗医师选择,或者在宠物和其它动物的情况下,由治疗兽医选择。
[0096]
aav的结构和功能
[0097]
aav是复制缺陷型细小病毒,其单链dna基因组的长度为约4.7kb,包括两个145个核苷酸的反向末端重复(itr)。aav有多种血清型。aav血清型的基因组的核苷酸序列是已知的。例如,aav
‑
1的完整基因组提供于genbank登记号nc_002077;aav
‑
2的完整基因组提供于genbank登记号nc_001401和srivastava等,j.virol.,45:555
‑
564(1983);aav
‑
3的完整基因组提供于genbank登录号nc_l829;aav
‑
4的完整基因组提供于genbank登录号nc_001829;aav
‑
5基因组提供于genbank登录号af085716;aav
‑
6的完整基因组提供于genbank登记号nc_001862;aav
‑
7和aav
‑
8基因组的至少部分分别提供于genbank登录号ax753246和ax753249;aav
‑
9基因组提供于gao等,j.virol.,78:6381
‑
6388(2004);aav
‑
10基因组提供于mol.ther.,13(1):67
‑
76(2006);并且aav
‑
11基因组提供于virology,330(2):375
‑
383(2004)。aav rh.74基因组的序列在美国专利9,434,928中提供,其以引用方式整体并入本文中。美国专利9,434,928也提供了衣壳蛋白和自身互补基因组的序列。在一个方面,基因组是自身互补的基因组。aav itr中含有指导病毒dna复制(rep)、包壳/包装和宿主细胞染色体整合的顺式作用序列。三个aav启动子(相对图谱位置命名为p5、p19和p40)驱动编码rep和cap基因的两个aav内部开放阅读框的表达。两个rep启动子(p5和p19)与单个aav内含子(在核苷酸2107和2227)的差异剪接结合,导致从rep基因产生四种rep蛋白(rep 78、rep 68、rep 52和rep 40)。rep蛋白具有多种酶特性,这些特性最终负责复制病毒基因组。
[0098]
cap基因从p40启动子表达,并编码三种衣壳蛋白vp1、vp2和vp3。选择性剪接和非共有翻译起始位点负责产生三种相关的衣壳蛋白。更具体地,在转录翻译vp1、vp2和vp3各自的单个mrna后,可以以两种不同的方式剪接:可以切除更长或更短的内含子,导致形成两个mrna库:2.3kb和2.6kb长的mrna库。通常优选较长的内含子,因此2.3kb长的mrna可被称为主要剪接变体。该形式缺少vp1蛋白合成从其开始的第一aug密码子,导致vp1蛋白合成的
总体水平降低。保留在主要剪接变体中的第一个aug密码子是vp3蛋白的起始密码子。然而,在同一开放读码框中该密码子的上游是acg序列(编码苏氨酸),其被最佳的kozak(翻译起始)背景包围。这导致低水平合成vp2蛋白,其实际上是具有额外n末端残基的vp3蛋白,如vp1,如becerra sp等(1985年12月)中所述。"direct mapping of adeno
‑
associated virus capsid proteins b and c:a possible acg initiation codon".proceedings of the national academy of sciences of the united states of america.82(23):7919
‑
23,cassinotti p等,(1988年11月)。"organization of the adeno
‑
associated virus(aav)capsid gene:mapping of aminor spliced mrna coding for virus capsid protein 1".virology.167(1):176
–
84,muralidhar s等,(1994年1月)."site
‑
directed mutagenesis of adeno
‑
associated virus type 2structural protein initiation codons:effects on regulation of synthesis and biological activity".journal of virology.68(1):170
‑
6,以及trempe jp,carter bj(1988年9月)。"alternate mrna splicing is required for synthesis of adeno
‑
associated virus vp1 capsid protein".journal of virology.62(9):3356
‑
63,其中每一篇以引用方式并入本文中。单个共有poly
‑
a位点位于aav基因组的图谱位置95。aav的生命周期和遗传学综述于muzyczka,current topics in microbiology and immunology,158:97
‑
129(1992)。
[0099]
每个vp1蛋白含有vp1部分、vp2部分和vp3部分。vp1部分是vp1蛋白的n
‑
末端部分,其是vp1蛋白所特有的。vp2部分是vp1蛋白中存在的氨基酸序列,也在vp2蛋白的n
‑
末端部分发现。vp3部分和vp3蛋白具有相同的序列。vp3部分是vp1蛋白的c端部分,其与vp1和vp2蛋白共有。参见图30。
[0100]
vp3蛋白可进一步分成离散可变表面区i
‑
ix(vr
‑
i
‑
ix)。每种可变表面区(vr)可包含或含有特定氨基酸序列,所述特定氨基酸序列单独或与其它vr中每一种的特定氨基酸序列组合可赋予特定血清型独特感染表型(例如,相对于其它aav血清型,抗原性降低、转导改善和/或组织特异性向性),如dimatta等“structural insight into the unique properties of adeno
‑
associated virus serotype 9”j.virol.,vol.86(12):6947
‑
6958,2012年6月,其内容以引用方式并入。
[0101]
aav具有独特的特征,使其作为载体在例如基因疗法中向细胞递送外源dna具有吸引力。培养物中细胞的aav感染是非致细胞病变的,而人类和其它动物的天然感染是沉默的和无症状的。此外,aav感染许多哺乳动物细胞,使得有可能在体内靶向许多不同组织。此外,aav转导缓慢分裂和非分裂细胞,并且可作为转录活性核附加体(染色体外元件)基本上持续这些细胞的寿命。aav前病毒基因组作为克隆的dna插入质粒中,这使得重组基因组的构建可行。此外,由于指导aav复制和基因组包壳的信号包含在aav基因组的itr内,一些或所有内部约4.3kb的基因组(编码复制和结构衣壳蛋白,rep
‑
cap)可被外源dna取代以产生aav载体。rep和cap蛋白可以以反式提供。aav的另一个显著特征是它是一种极其稳定和旺盛的病毒。它容易经受住灭活腺病毒所用的条件(56
‑
65℃数小时),使得aav的冷藏不太关键。aav甚至可被冻干。最后,aav感染的细胞对双重感染没有抗性。
[0102]
多项研究已证明肌肉中长期(>1.5年)重组aav介导的蛋白质表达。参见clark等,hum gene ther,8:659
‑
669(1997);kessler等,proc nat.acad sc.usa,93:14082
‑
14087(1996);和xiao等,j virol,70:8098
‑
8108(1996)。还参见chao等,mol ther,2:619
‑
623
(2000)和chao等,mol ther,4:217
‑
222(2001)。此外,由于肌肉高度血管化,重组aav转导导致肌肉注射后体循环中转基因产物的出现,如herzog等,proc natl acad sci usa,94:5804
‑
5809(1997)以及murphy等,proc natl acad sci usa,94:13921
‑
13926(1997)。此外,lewis等j virol,76:8769
‑
8775(2002)证实骨骼肌纤维具有正确抗体糖基化、折叠和分泌的必要细胞因子,表明肌肉能够稳定表达分泌的蛋白质治疗剂。本发明的重组aav(raav)基因组包含编码治疗性蛋白质(例如cftr)的核酸分子和侧接该核酸分子的一个或多个aav itr,基本上由其组成,或由其组成。raav基因组中的aav dna可来自重组病毒可源自的任何aav血清型,包括但不限于aav血清型aav
‑
1、aav
‑
2、aav
‑
3、aav
‑
4、aav
‑
5、aav
‑
6、aav
‑
7、aav
‑
8、aav
‑
9、aav
‑
10、aav
‑
11、aav
‑
12、aav
‑
13、aav php.b和aav rh74。假型raav的制备公开于例如wo2001083692中。也考虑了其它类型的raav变体,例如具有衣壳突变的raav。参见,例如marsic等,molecular therapy,22(11):1900
‑
1909(2014)。各种aav血清型的基因组的核苷酸序列是本领域已知的。
[0103]
aav载体颗粒、衣壳蛋白和aav载体
[0104]
本文提供了aav载体颗粒、aav载体和衣壳蛋白,其具有期望的组织特异性并且可用于递送多种治疗有效载荷,包括可用于治疗疾病的核酸和蛋白质。
[0105]
aav衣壳蛋白
[0106]
本公开提供了具有高基因转移效率和增加的组织向性的aav颗粒。aav载体递送目前依赖于使用血清型选择用于基于病毒的天然向性的组织靶向或通过直接注射到靶组织中。如果需要全身递送以实现最大治疗益处,则血清型选择是与组织特异性启动子组合的组织靶向的唯一可用选项。因此,许多目前可用的aav载体对于基因疗法是次优的。
[0107]
本发明提供了aav衣壳蛋白序列,其赋予包含它们的aav衣壳高基因转移效率和增加的组织特异性。在实施方案中,本文提供的aav衣壳序列使用图1所示的aav衣壳生成平台生成。
[0108]
在实施方案中,vp1衣壳蛋白包含表1中列出的氨基酸序列中的任一个,或与表1中列出的氨基酸序列中的任一个相比突变、缺失或添加至多1、2、3、4、5、6、7、8、9或10个氨基酸的序列。在多个方面,与这些序列相比,可突变、缺失或添加至多20个氨基酸、至多30个氨基酸或至多40个氨基酸,在实施方案中,vp1衣壳蛋白由表1中列出的核酸序列中的任一个,或与由表1中列出的核酸序列中的任一个相比具有至多5个、至多10个、至多30个或至多60个核苷酸变化的序列编码。
[0109]
表1:vp1衣壳蛋白
[0110]
氨基酸seq id nona seq id no:aav衣壳名称198aav 110215aav 204318aav 2143019aav 214a3120aav 214e3221aav 214e83322aav 214e93423aav 214e10
4947aav itb102_458482aav 214ab
[0111]
在实施方案中,aav vp1蛋白包含、由或基本上由seq id no:1
‑
3、30
‑
34、49或84的氨基酸序列,或具有至多1、2、3、4、5、6、7、8、9或10个不同于seq id no:1
‑
3、30
‑
34、49或84的氨基酸的序列组成。还提供了编码这些vp1蛋白的多核苷酸。在实施方案中,编码vp1蛋白的多核苷酸包含、由或基本上由seq id no:15、18
‑
23、47、82和98的序列,或与seq id no:15、18
‑
23、47、82和98的序列相比具有至多5个、至多10个、至多30个核苷酸变化的序列组成。
[0112]
在实施方案中,aav衣壳序列是aav
‑
110衣壳蛋白(seq id no:1)、aav 204衣壳蛋白(seq id no:2)、aav 214衣壳蛋白(seq id no:3)或aav itb102_45衣壳蛋白(seq id no:49)。在实施方案中,aav衣壳蛋白是aav 214衣壳蛋白的变体。在实施方案中,aav衣壳蛋白是aav214a(seq id no:30)、aav
‑
214
‑
ab(seq id no:84)、aav214e(seq id no:31)、aav214e8(seq id no:32)、aav214e9(seq id no:33)或aav214e10(seq id no:34)。
[0113]
示例性vp2和vp3蛋白的序列提供于表2和表3中。给定vp2和vp3序列,可通过与完整的vp1蛋白序列比对来测定vp1部分。
[0114]
表2:vp2衣壳蛋白
[0115]
氨基酸seq id no名称3521436214a37214e38214e839214e940214e1085214ab50itb102_45
[0116]
itb102_45的示例性核酸是seq id no:47。其它衣壳vp2部分的示例性核酸可衍生自vp1衣壳蛋白核酸的相应部分。
[0117]
表3:vp3衣壳蛋白
[0118]
[0119]
aav214、aav214e、aav214e8、aav214e9、aav214e10的vp3蛋白具有相同的氨基酸(seq id no:41)和核酸(seq id no:24)序列。
[0120]
在实施方案中,aav vp2蛋白包含、由或基本上由seq id no:35
‑
40、50或85的氨基酸序列,或具有至多1、2、3、4、5、6、7、8、9或10个不同于seq id no:35
‑
40、50或85的氨基酸的序列组成。还提供了编码这些vp2蛋白的多核苷酸。在实施方案中,编码vp2蛋白的多核苷酸包含、由或基本上由seq id no:47的序列,或与seq id no:47的序列相比具有至多5个、至多10个、至多30个核苷酸变化的序列组成。
[0121]
在实施方案中,aav vp3蛋白包含、由或基本上由seq id no:17、41
‑
46、51或86的氨基酸序列,或具有至多1、2、3、4、5、6、7、8、9或10个不同于seq id no:17、41
‑
46、51或86的氨基酸的序列组成。还提供了编码这些vp3蛋白的多核苷酸。在实施方案中,编码蛋白质的多核苷酸包含、由或基本上由seq id no:16、24
‑
29、48和83的序列,或与seq id no:16、24
‑
29、48和83的序列相比具有至多5个、至多10个、至多30个核苷酸变化的序列组成。
[0122]
在实施方案中,aav衣壳蛋白是嵌合蛋白。在实施方案中,本文公开的aav衣壳蛋白的vp1、vp2或vp3部分可被来自本文公开的不同aav衣壳蛋白的vp1、vp2或vp3部分替代。
[0123]
在实施方案中,本文提供了一种aav衣壳蛋白,其包含在氨基酸129处的亮氨酸残基、在氨基酸586处的天冬酰胺残基和在氨基酸723处的谷氨酸残基,其中aav衣壳蛋白中的氨基酸位置相对于seq id no:2的氨基酸序列中的氨基酸位置进行编号。在一些情况下,蛋白质包含seq id no:2的氨基酸序列。在其它情况下,这些氨基酸可以被引入到其它衣壳蛋白中。
[0124]
在实施方案中,本文提供了aav vp1衣壳蛋白,其包含vp1部分、vp2部分和vp3部分,其中所述vp1部分包含在氨基酸129处的亮氨酸(l)残基,其中所述vp2部分包含在氨基酸157处的苏氨酸(t)或天冬酰胺(n)残基和在氨基酸162处的赖氨酸(k)或丝氨酸(s)残基,并且其中所述vp3部分包含在氨基酸223处的天冬酰胺(n)残基、在氨基酸224处的丙氨酸(a)残基、在氨基酸272处的组氨酸(h)残基、在氨基酸410处的苏氨酸(t)残基、在氨基酸724处的组氨酸(h)残基和在氨基酸734处的脯氨酸(p)残基,其中所述aav衣壳蛋白衣壳中的氨基酸位置相对于seq id no:3的氨基酸序列中的氨基酸位置进行编号(即vp1衣壳亚基编号)。
[0125]
在实施方案中,vp1部分还包含在氨基酸24处的天冬氨酸(d)或丙氨酸(a)残基,其中aav衣壳蛋白中的氨基酸位置相对于seq id no:3的氨基酸序列中的氨基酸位置进行编号。在实施方案中,vp2部分还包含下列中的一者或多者:(i)在氨基酸148处的脯氨酸(p)残基;(ii)在氨基酸152处插入的精氨酸(r)残基;(iii)在氨基酸168处的精氨酸(r)残基;(iv)在氨基酸189处的异亮氨酸(i)残基;和(v)在氨基酸200处的丝氨酸(s)残基,其中aav衣壳蛋白中的氨基酸位置相对于seq id no:3的氨基酸序列中的氨基酸位置进行编号。
[0126]
在实施方案中,在公开的vp3部分衣壳蛋白中的一个或多个可变区i
‑
ix(参见图30)可被去除并用可变区替换。下表中确定了合适的替代方案。这些序列的位置以及其它选择的同一性可通过与seq id no:41比对来鉴定,如图30所示。在实施方案中,一个或多个vr可以具有1、2或3个氨基酸的插入。在实施方案中,一个或多个vr可以具有1、2或3个氨基酸的缺失。
[0127][0128]
本公开提供了编码本文公开的aav衣壳蛋白中的任一种的核酸。本公开还提供了包含本文公开的核酸中的任一种的载体。
[0129]
在实施方案中,aav是aav9血清型。可以使用替代血清型或经修饰的衣壳病毒来优化神经元向性。可选的载体包括:用于比标准aav9更高的神经元向性的修饰的aav9血清型载体,例如php.b,其使用cre
‑
lox重组系统来鉴定神经元靶向载体。或者,aav9 php.b具有vp1的经修饰的氨基酸498(从天冬酰胺变为赖氨酸)以降低肝向性。具有突变的几个氨基酸的aavrh74的其它变体可用于非常广泛的组织向性,包括脑。
[0130]
aav载体
[0131]
aav载体提供被包壳到aav载体颗粒中的核酸,所述aav载体颗粒包括参与控制核酸在受试者中表达的元件以及促进包壳的itr。在实施方案中,本文公开的aav载体包含至少一种异源核酸(hna)序列,该序列在受试者的细胞中表达时可有效治疗疾病或病症。在实施方案中,hna序列包含转基因。在实施方案中,aav载体包含至少一个itr序列和至少一个转基因。在实施方案中,转基因编码治疗性蛋白质或治疗性rna。
[0132]
在实施方案中,宿主细胞中转基因表达的控制可由aav载体内包含的调节元件调节,包括启动子序列和poly
‑
a位点。在实施方案中,aav载体也可编码信号肽。在实施方案中,aav载体具有5’和3’反向末端重复(itr)。5’itr位于启动子的上游,启动子又位于转基因的上游。在实施方案中,5’和3’itr具有相同的序列。在实施方案中,它们具有不同的序列。在实施方案中,本公开的aav载体可在5’至3’取向上包含第一(5’)itr、启动子、转基因、poly
‑
a位点和第二(3’)itr。
[0133]
在实施方案中,aav载体具有seq id no:88(pa_cf1)、seq id no:89(pa_cf3)、seq id no:90(pa_cf5)或seq id no:91(pa_cf7)所示的核苷酸序列。这些载体含有下列组分:
[0134][0135]
在实施方案中,hna(例如包含转基因的hna)与组成型启动子可操作地连接。组成型启动子可以是本领域已知和/或本文提供的任何组成型启动子。在实施方案中,组成型启动子包含、基本上由或由劳斯肉瘤病毒(rsv)ltr启动子(任选地与rsv增强子一起)、巨细胞病毒(cmv)启动子、sv40启动子、二氢叶酸还原酶启动子、β
‑
肌动蛋白启动子、磷酸甘油激酶(pgk)启动子、u6启动子、h1启动子、杂合鸡β肌动蛋白启动子、mecp2启动子、h1启动子、u1a启动子、mmep418启动子、mmep426启动子、最小mecp2启动子、cag启动子或ef1启动子组成。本领域已知,可以修饰这些启动子的核苷酸序列以提高或降低mrna转录的效率。参见,例如gao等(2018)mol.ther.:nucleic acids 12:135
‑
145(修饰7sk、u6和h1启动子的tata盒以消除rna聚合酶iii转录并刺激rna聚合酶ii依赖性mrna转录)。在实施方案中,hna序列与组织特异性控制启动子或诱导型启动子可操作地连接。在实施方案中,组织特异性控制启动子是中枢神经系统(cns)细胞特异性启动子、肺特异性启动子、皮肤特异性启动子、肌肉特异性启动子、肝特异性启动子、眼异性启动子(例如vmd2或mrho启动子)。
[0136]
在实施方案中,启动子可包含、基本上由或由具有seq id no:96(小鼠u1启动子)或seq id no:97(h1启动子)序列的多核苷酸组成。在实施方案中,启动子是u1a或u1b启动子、ef1启动子或cba(鸡β
‑
肌动蛋白)。在实施方案中,启动子可以包含、基本上由或由表5中列出的核酸序列中的任一个,或与表5中列出的核酸序列中的任一个相比具有至多5个、至多10个或至多30个核苷酸变化的序列组成。
[0137]
表5:
[0138][0139]
在实施方案中,hna序列与另外的调节元件可操作地连接。所述额外的调节元件可以是土拨鼠肝炎病毒转录后调节元件(“wpre”)。在实施方案中,aav载体可包含适于载体在细菌宿主中生长和培养的调节组分,用于载体生产目的。例如,载体可以包含抗生素抗性基因,和细菌中质粒的维持,以及控制细菌中蛋白质表达的相关调节元件。
[0140]
在实施方案中,hna序列与poly
‑
a位点可操作地连接。聚腺苷酸化位点包含、基本上由或由mecp2 poly
‑
a位点、视黄醇脱氢酶1(rdh1)poly
‑
a位点、牛生长激素(bgh)poly
‑
a位点、sv40 poly
‑
a位点、spa49 poly
‑
a位点、snrp
‑
tk65 poly
‑
a位点、snrp poly
‑
a位点或tk65 poly
‑
a位点组成。示例性spa49 poly
‑
a序列描述于ostedgaard等,proc.nat’l acad.sci.usa(2005年2月22日)102:2952
‑
2957,其以引用方式并入本文汇中。
[0141]
异源核酸(hna)
[0142]
本文公开的aav载体感染一种或多种异源核酸(hna)并将其递送至靶组织。在实施方案中,hna序列在靶组织的细胞中被转录并且任选地被翻译。
[0143]
在一些情况下,hna编码反义rna、微rna、sirna或引导rna(grna)。crispr技术已经用于靶向活细胞的基因组以进行修饰。cas9蛋白是一种大的酶,其必须被有效地递送至靶组织和细胞以通过crispr系统介导基因修复,并且目前的crispr/cas9基因修正方案具有许多缺点。cas9的长期表达可引发宿主免疫应答。由于包装限制,另外的引导rna可以通过单独的载体递送。在实施方案中,hna编码cas9蛋白或其等同物。
[0144]
在实施方案中,hna包含编码蛋白质的转基因,其可以在受试者的细胞中表达以治疗由天然蛋白质的活性降低或消除引起的疾病或病症。因此,在实施方案中,转基因可编码选自下列的蛋白:囊性纤维化跨膜传导调节蛋白(cftr)、n
‑
乙酰基
‑
α
‑
氨基葡糖苷酶(naglu)、n
‑
磺基葡糖胺磺基水解酶(sgsh)、棕榈酰
‑
蛋白硫酯酶1(ppt1)、运动神经元生存蛋白1、端粒(smn1)、碱性磷酸酶、生物矿化相关蛋白(alpl,也称为tnalp)、神经胶质细胞源性神经营养因子(gdnf)、葡糖神经酰胺酶β(gba1)、艾杜糖苷酸酶α
‑
l
‑
(idua)、细胞色素p450家族4亚家族v成员2(cyp4v2)、视网膜劈裂蛋白1(rs1)、磷酸二酯酶6b(pde6b)、甲基
‑
cpg结合蛋白2(mecp2)、视紫红质(rho)或蜡样质脂褐质沉积症神经元蛋白1(cln1)。
[0145]
在实施方案中,转基因编码cftr。在实施方案中,cftr包含cftr的突变序列、密码子优化序列和/或截短序列。示例性的合适cftr序列公开于美国专利公开号20110035819,其以引用方式整体并入本文中。在实施方案中,cftr包含氨基酸708
‑
759(“cftrδr”)的缺失。参见ostedgaard等,proc.nat’l acad.sci.usa(2005年2月22日)102:2952
‑
2957,其以引用方式整体并入本文中。
[0146]
在实施方案中,转基因包含、基本上由或由具有seq id no:4(密码子优化的cftδr)或seq id no:93(全长密码子优化的cftr)的序列,或与seq id no:4或93的序列相比具有至多5个、至多10个、至多30个核苷酸变化的序列的核酸组成。在实施方案中,转基因编码的蛋白质包含、基本上由或由具有seq id no:95(cftrδr)或seq is no 94(全长cftr)的序列,或具有至多1、2、3、4、5、6、7、8、9或10个不同于seq id no:94或95的氨基酸的序列的氨基酸组成。
[0147]
在实施方案中,转基因编码cln3溶酶体/内体跨膜蛋白、battenin(cln3)蛋白、α
‑
半乳糖苷酶a(gla)或酸性α
‑
葡糖苷酶(gaa)。
[0148]
在实施方案中,gaa蛋白由seq id no:5、6或7的序列,或与seq id no:5、6或7相比具有至多5个、至多10个或至多30个核苷酸变化的序列编码。在实施方案中,gaa蛋白包含seq id no:8的氨基酸序列,或具有至多1、2、3、4、5、6、7、8、9或10个不同于seq id no:8的氨基酸的序列。
[0149]
在实施方案中,gla蛋白由核苷酸序列seq id no:9或10,或与seq id no:9或10相比具有至多5个、至多10个或至多30个核苷酸变化的序列编码。在实施方案中,gla蛋白包含seq id no:11的氨基酸序列,或具有至多1、2、3、4、5、6、7、8、9或10个不同于seq id no:11的氨基酸的序列。
[0150]
在实施方案中,cln3蛋白由seq id no:12或13的核苷酸序列,或与seq id no:12或13相比具有至多5个、至多10个或至多30个核苷酸变化的序列编码。在实施方案中,cln3蛋白包含seq id no:14的氨基酸序列,或具有至多1、2、3、4、5、6、7、8、9或10个不同于seq id no:14的氨基酸的序列。
[0151]
在实施方案中,转基因包含由表4中列出的核酸序列中的任一个,或与由表4中列出的dna序列中的任一个相比具有至多5个、至多10个或至多30个核苷酸变化的序列。在实施方案中,转基因编码表4中列出的氨基酸序列中的任何一个,或具有至多1、2、3、4、5、6、7、8、9或10个不同于表4中列出的氨基酸序列中的任何一个的氨基酸的序列。
[0152]
表4
[0153]
[0154]
[0155][0156]
在实施方案中,转基因包含seq id no:99
‑
133中的任一个所示的核酸序列,或与seq id no:99
‑
133中的任一个相比具有至多5个、至多10个或至多30个核苷酸变化的序列。在实施方案中,转基因包含seq id no:134
‑
151中的任一个所示的氨基酸序列,或具有至多1、2、3、4、5、6、7、8、9或10个不同于seq id no:134
‑
151中的任一个的氨基酸的序列。
[0157]
在实施方案中,异源核酸编码报告蛋白;例如荧光蛋白。
[0158]
制备aav病毒载体的方法
[0159]
多种方法可用于制备aav病毒载体。在实施方案中,通过使用辅助病毒或辅助质粒和细胞系实现包装。辅助病毒或辅助质粒含有促进病毒载体产生的元件和序列。在另一个方面,辅助质粒被稳定地整合到包装细胞系的基因组中,使得包装细胞系不需要用辅助质粒进行额外的转染。
[0160]
在实施方案中,细胞是包装细胞系或辅助细胞系。在方面的实施方案中,辅助细胞系是真核细胞;例如,hek 293细胞或293t细胞。在实施方案中,辅助细胞是酵母细胞或昆虫细胞。
[0161]
在实施方案中,细胞包含编码四环素激活蛋白的核酸;和调节四环素激活蛋白表达的启动子。在实施方案中,调节四环素激活蛋白表达的启动子是组成型启动子。在实施方案中,启动子是磷酸甘油酸激酶启动子(pgk)或cmv启动子。
[0162]
辅助质粒可以包含,例如,至少一种病毒辅助dna序列,其衍生自编码包装复制失能的aav所需的反式全病毒粒子蛋白的复制失能的病毒基因组,和用于产生能够以高滴度包装复制失能的aav而不产生复制失能的aav的病毒粒子蛋白。
[0163]
用于包装aav的辅助质粒是本领域已知的,参见例如美国专利公开号2004/0235174a1,其以引用的方式并入本文中。如文中所述,作为非限制性实例,aav辅助质粒可含有由各自的原始启动子或异源启动子控制的ad5基因e2a、e4和va作为辅助病毒dna序列。aav辅助质粒可另外含有表达盒,用于表达标记蛋白如荧光蛋白,以允许容易地单检测所需靶细胞的转染。
[0164]
本公开提供了产生aav颗粒的方法,包括用本文公开的aav辅助质粒中的任一种;以及本文公开的aav载体中的任一种来转染包装细胞系。在实施方案中,aav辅助质粒和aav载体共转染到包装细胞系中。在实施方案中,细胞系是哺乳动物细胞系,例如人胚肾(hek)293细胞系。本公开提供了包含本文公开的aav载体和/或aav颗粒中的任一种的细胞。
[0165]
药物组合物
[0166]
本公开提供了包含本文所述aav载体、aav衣壳和/或aav颗粒中的任一种的药物组合物。通常,施用aav颗粒以用于疗法。
[0167]
如本文所述,药物组合物可通过药理学领域已知或开发的任何方法配制,所述方法包括但不限于使活性成分(例如病毒颗粒或重组载体)与赋形剂或其它辅助成分接触,将产物划分或包装为剂量单位。本公开的病毒颗粒可以配制为具有期望的特征,例如增加的稳定性、增加的细胞转染、持续或延迟的释放、生物分布或向性、体内编码蛋白的调节或增强的翻译、以及体内编码蛋白的释放特征谱。
[0168]
因此,药物组合物可以进一步包含盐水、类脂质、脂质体、脂质纳米粒子、聚合物、脂质复合物、核
‑
壳纳米粒子、肽、蛋白质、用病毒载体转染的细胞(例如,用于移植到受试者中)、纳米粒子模拟物或其组合。在实施方案中,药物组合物被配制为纳米粒子。在实施方案中,纳米粒子是自组装的核酸纳米粒子。
[0169]
根据本公开的药物组合物可以以单一单位剂量和/或以多个单一单位剂量制备、包装和/或散装销售。活性成分的量通常等于将被施用给受试者的活性成分的剂量和/或这样的剂量的合宜比率,例如这样的剂量的一半或三分之一。本发明的制剂可以包括一种或多种赋形剂,各赋形剂的量一起增加病毒载体的稳定性,增加细胞转染或病毒载体转导,增加病毒载体编码的蛋白质的表达,和/或改变病毒载体编码的蛋白质的释放特征谱。在实施方案中,药物组合物包含赋形剂。赋形剂的非限制性实例包括溶剂、分散介质、稀释剂或其它液体媒介物、分散或悬浮助剂、表面活性剂、等渗剂、增稠剂或乳化剂、防腐剂或其组合。
[0170]
在实施方案中,药物组合物包含冷冻保护剂。术语“冷冻保护剂”是指能够在冷冻期间减少或消除对物质的损害的试剂。冷冻保护剂的非限制性实例包括蔗糖、海藻糖、乳糖、甘油、右旋糖、棉子糖和/或甘露醇。
[0171]
治疗方法
[0172]
本公开提供了预防或治疗病症的方法,包括向受试者施用治疗有效量的本文公开的任一种药物组合物,基本上由其组成或由其组成。
[0173]
在实施方案中,所述病症是cns病症、皮肤病症、肺病症、肌肉病症、肺病症或眼科疾病(或视网膜疾病)。在实施方案中,所述病症是囊性纤维化。
[0174]
在实施方案中,所述病症是低磷酸酯酶症、肌萎缩性侧索硬化(als)、脊髓性肌萎缩(sma)、隐性营养不良性大疱性表皮松解症(rdeb)、溶酶体贮积症(包括杜兴氏肌营养不良和贝克肌营养不良)、青少年巴特氏病(batten disease)、小儿巴特氏病、常染色体显性病症、肌营养不良、bietti晶状体营养不良、视网膜劈裂症(例如变性、遗传、牵拉、渗出性)、血友病a、血友病b、多发性硬化、糖尿病、法布里病(fabry disease)、庞皮病(pompe disease)、神经元蜡样质脂褐质沉积症1(cln1)、cln3病(或青少年神经元蜡样质脂褐质沉积症)、戈谢病、癌症、关节炎、肌肉消瘦、心脏病、内膜增生、rett综合征、癫痫、亨延顿氏舞蹈病(huntington's disease)、阿尔茨海默病、自身免疫性疾病、囊性纤维化、地中海贫血、
赫尔勒氏综合征(mps ih)、sly综合征、沙伊综合征(scheie syndrome)、胡
‑
射二氏综合征(hurler
‑
scheie syndrome)、亨特综合征、sanfilippo综合征a(粘多糖贮积病iiia或mps iiia)、sanfilippo综合征b(粘多糖贮积病iiib或mps iiib)、sanfilippo综合征c、sanfilippo综合征d、莫基奥综合征(morquio syndrome)、马
‑
兰二氏综合征(maroteaux
‑
lamy syndrome)、克腊比氏病(krabbe's disease)、苯丙酮尿症、脊髓小脑性共济失调、ldl受体缺乏、高血氨症、贫血、关节炎或腺苷脱氨酶缺乏。
[0175]
除了本文公开的特定转基因之外,已知的活性酶序列可以用作转基因以递送功能性酶活性。
[0176]
治疗囊性纤维化的挑战之一是在病毒颗粒中包装cftr基因时的大小限制和病毒颗粒向肺细胞递送的困难。本公开的aav颗粒通过提供有效包装并具有更好的肺向性的cftr转基因构建体解决了这些问题。因此,在实施方案中,本公开提供了用于治疗囊性纤维化的组合物和方法。
[0177]
在实施方案中,所述病症是cln3疾病。cln3疾病或幼年神经元蜡样质脂褐质沉积症是由cln3基因中常染色体隐性遗传突变引起的溶酶体贮积病。cln3疾病是进行性神经变性疾病,其中中枢神经系统(cns)受到极大影响,导致行为问题、视力丧失和其它认知障碍。
[0178]
在实施方案中,所述病症是法布里病。法布里病是由α
‑
半乳糖苷酶a(gla)活性缺乏引起的x
‑
连锁溶酶体贮积症,所述α
‑
半乳糖苷酶a(gla)活性缺乏导致溶酶体中糖脂产物、球形三酰神经酰胺(gb3)和溶血gb3的积累。疾病表现是高度异质性的,但通常包括外周神经营养性疼痛的频繁发作、血管角化病、减少的汗液产生、角膜营养不良和胃肠道并发症。随着疾病的发展,患者患有心肌病、肾功能不全和脑血管疾病,所有这些疾病都是法布里病患者寿命缩短的主要原因。尽管男性是受gla基因突变影响最严重的患者群体,但越来越清楚女性患者也经常出现症状,但经常被误诊。酶替代疗法(ert)是目前唯一fda批准的治疗法布里病的疗法,需要每周两次注射相对大量的重组蛋白。虽然ert可减少gb3在心脏、肾脏和脉管系统中的累积,但其无法完全治疗法布里病(fabry)的所有症状,主要是因为其无法有效进入cns。基因疗法策略已经被研究,虽然许多策略在纠正糖脂累积方面显示出巨大的前景,但是大多数都未能有效地进入cns,并且还遭受在gla替代期间经常看到的免疫应答。
[0179]
在实施方案中,本文公开的aav病毒载体用于治疗对ert无反应或ert未能解决所有症状的患者的法布里病。在实施方案中,本文公开的aav病毒载体用于治疗已施用ert的患者的法布里病。
[0180]
在实施方案中,所述病症是庞皮病。庞皮病是由酸性α
‑
葡糖苷酶(gaa)活性缺乏导致糖原在溶酶体中积累所引起的溶酶体贮积症。该疾病表现为肌营养不良症的形式,其主要影响平滑肌和横纹肌以及中枢神经系统(cns),具有早期死亡率。酶替代疗法(ert)是目前唯一fda批准的治疗庞皮病的疗法,需要每周两次注射相对大量的重组蛋白。虽然ert能显著降低未治疗而典型地死于两岁的幼儿庞皮症患者的死亡率,但它不能完全改善庞皮症的所有症状,主要是由于其不能有效进入cns并导致对gaa蛋白的免疫应答。基因疗法策略已经被研究,并且尽管许多在纠正庞皮病的糖原积累和其它症状方面显显示出很大的前景。大多数患者在gaa替代期间经历了严重的免疫应答。以前的工作已经证明肝特异性表达可以使动物耐受gaa蛋白并显著降低体液应答。
[0181]
在实施方案中,本文公开的aav病毒载体用于治疗已施用ert的患者的庞皮病;例如对ert无反应的患者,或ert不能治疗所有症状的患者。
[0182]
在实施方案中,癌症是实体癌;例如膀胱、乳腺、宫颈、结肠、直肠、子宫内膜、肾、唇、口、肝、黑素瘤、间皮瘤、非小细胞肺、非黑素瘤皮肤、卵巢、胰腺、前列腺、肉瘤、小细胞肺肿瘤或甲状腺。
[0183]
在实施方案中,所述病症是眼科疾病。眼睛是免疫豁免组织。只有非常少量的病毒是治疗益处所必需的。在实施方案中,眼科疾病影响感光细胞和rpe细胞。在一些实施方案中,所述眼科疾病包括、基本上由或由下列各项组成:色素性视网膜炎(例如,常染色体隐性(spata7基因;lrat基因;tulp1基因)、常染色体显性(aipl1基因)和x连锁(rpgr基因))、与斑萎蛋白(bestrophin)
‑
1(best
‑
1)基因中的突变相关的眼病(例如,卵黄状黄斑营养不良、年龄相关性黄斑变性、常染色体显性玻璃体视网膜脉络膜病、青光眼、白内障)、leber先天性黑朦(lca;芳基
‑
烃互作用蛋白样1(aipl1)基因)、视锥
‑
视杆营养不良(crd;abca4基因)、斯特格式病(stargardt's)(abca4基因)、无脉络膜(chm基因)、乌谢尔综合征(usher syndrome)(myo7a基因;cdh23基因;ush2a基因;clrn1基因)、视网膜劈裂症(rs1基因)、bietti晶状体营养不良(cyp4v2基因)或全色盲(cnga3基因、cngb3基因、gnat2基因、pde6c基因或pde6h基因)。组成。
[0184]
在实施方案中,所述受试者是哺乳动物;例如人。在特定方面,所述人是婴儿;例如,3岁以下、2岁以下或1岁以下。
[0185]
本文公开的治疗和预防方法可以与适当的诊断技术组合以鉴定和选择用于疗法或预防的患者。例如,本文公开的治疗或预防病症例如囊性纤维化的方法还可以包括进行遗传测试以鉴定与受试者中的病症相关的基因突变或缺失的步骤。在实施方案中,治疗或预防病症例如囊性纤维化的方法包括向先前已被鉴定为携带与所述病症相关的突变或处于发生所述病症的高风险(例如基于遗传因素)的受试者施用。
[0186]
本公开提供了增加宿主细胞中的蛋白质水平的方法,所述方法包括使所述宿主细胞与本文公开的aav颗粒中的任一种接触,其中所述aav颗粒包含本文公开的aav载体中的任一种,所述aav载体包含编码所述蛋白的hna序列。在实施方案中,蛋白质是治疗性蛋白质。在实施方案中,宿主细胞是体外、体内或离体的。在实施方案中,宿主细胞来源于受试者。在实施方案中,受试者患有病症,与正常受试者中蛋白质的水平和/或功能相比,所述病症导致蛋白质的水平和/或功能降低。
[0187]
在实施方案中,蛋白质的水平在宿主细胞中被提高到约1
×
10
‑7ng、约3
×
10
‑7ng、约5
×
10
‑7ng、约7
×
10
‑7ng、约9
×
10
‑7ng、约1
×
10
‑6ng、约2
×
10
‑6ng、约3
×
10
‑6ng、约4
×
10
‑6ng、约6
×
10
‑6ng、约7
×
10
‑6ng、约8
×
10
‑6ng、约9
×
10
‑6ng、约10
×
10
‑6ng、约12
×
10
‑6ng、约14
×
10
‑6ng、约16
×
10
‑6ng、约18
×
10
‑6ng、约20
×
10
‑6ng、约25
×
10
‑6ng、约30
×
10
‑6ng、约35
×
10
‑6ng、约40
×
10
‑6ng、约45
×
10
‑6ng、约50
×
10
‑6ng、约55
×
10
‑6ng、约60
×
10
‑6ng、约65
×
10
‑6ng、约70
×
10
‑6ng、约75
×
10
‑6ng、约80
×
10
‑6ng、约85
×
10
‑6ng、约90
×
10
‑6ng、约95
×
10
‑6ng、约10
×
10
‑5ng、约20
×
10
‑5ng、约30
×
10
‑5ng、约40
×
10
‑5ng、约50
×
10
‑5ng、约60
×
10
‑5ng、约70
×
10
‑5ng、约80
×
10
‑5ng或约90
×
10
‑5ng的水平。
[0188]
本公开提供了将目标基因导入受试者细胞的方法,包括使细胞与有效量的本文公开的任一种aav病毒载体颗粒接触,其中所述颗粒含有本文公开的任一种包含目标基因的
aav载体。
[0189]
剂量和施用
[0190]
确定最有效的施用方式和剂量的方法是本领域技术人员已知的,并且将随用于治疗的组合物、治疗的目的和被治疗的受试者而变化。可以进行单次或多次施用,剂量水平和模式由治疗医师选择。注意到剂量可能受施用途径的影响。合适的剂量制剂和施用所述试剂的方法是本领域已知的。这种合适剂量的非限制性实例可以是每次施用低至109个载体基因组至至多10
17
个载体基因组。
[0191]
在本文所述方法的实施方案中,施用给受试者的病毒颗粒(例如aav)的数量范围为约109个至约10
17
个。在特定的一些实施方案中,给受试者施用约10
10
至约10
12
、约10
11
至约10
13
、约10
11
至约10
12
、约10
11
至约10
14
、约5
×
l0
11
至约5
×
10
12
或约10
12
至约10
13
个病毒颗粒。对于向人眼的施用,可以使用约1
×
10
10
vg/眼的总剂量,并且可以将5
×
109vg/眼的总剂量用于小鼠的眼。非侵入性体内成像技术可用于监测动物的功效/安全性,其包括但不限于扫描激光检眼镜检查(slo)、光学相干断层扫描(oct)、多光子显微术、荧光素血管造影术。
[0192]
在实施方案中,aav颗粒修复受试者的基因缺陷。在实施方案中,在成功治疗的细胞、组织、器官或受试者中修复的靶多核苷酸或多肽与未修复的靶多核苷酸或多肽的比率为至少约1.5:1、约2:1、约3:1、约4:1、约5:1、约6:1、约7:1、约8:1、约9:1、约10:1、约20:1、约50:1、约100:1、约1000:1、约10,000:1、约100,000:1或约1,000,000:1。修复的靶多核苷酸或多肽的量或比率可以通过本领域已知的任何方法来确定,包括但不限于western印迹、northern印迹、southern印迹、pcr、测序、质谱、流式细胞术、免疫组织化学、免疫荧光、荧光原位杂交、下一代测序、免疫印迹和elisa。
[0193]
在实施方案中,通过静脉内、鞘内、脑内、心室内、鼻内、气管内、耳内、眼内或眼周、口服、直肠、透粘膜、吸入、经皮、肠胃外、皮下、皮内、肌内、胸膜内、局部、淋巴内、脑池内将病毒颗粒引入受试者;这样的引入也可以是动脉内、心脏内、心室下、硬膜外、大脑内、脑室内、视网膜下、玻璃体内、关节内、腹膜内、子宫内或其任何组合。在实施方案中,作为非限制性实例,将病毒颗粒递送至所需靶组织,例如肺、眼或cns。在实施方案中,病毒颗粒的递送是全身性的。脑池内施用途径包括将药物直接施用至脑室的脑脊液中。其可以通过直接注射到大池中或通过永久定位的管来执行。
[0194]
为了眼内治疗眼科疾病(或眼病症),存在本领域技术人员已知的多种施用模式,包括但不限于:泪腺(lg)施用、局部滴眼剂、角膜基质内施用、前房内施用(前房)、玻璃体内施用、视网膜下施用、全身施用或其组合。80%的遗传性眼病发生在感光细胞中。小容量基因疗法的玻璃体内递送可在门诊部进行。
[0195]
本公开的aav载体、aav颗粒或组合物的施用可以在整个治疗过程中以一个剂量、连续或间歇地实现。在实施方案中,本公开的aav载体、aav颗粒或组合物通过注射、输注或植入进行肠胃外施用。
[0196]
在实施方案中,本公开的aav颗粒显示出增强的脑和颈椎向性。在实施方案中,本公开的病毒颗粒可以穿过血脑屏障(bbb)。在实施方案中,本公开的aav颗粒通过视网膜下和玻璃体内注射表现出高视网膜向性。在实施方案中,本公开的aav颗粒靶向多种类型的眼细胞,例如视锥细胞、视杆细胞和视网膜色素上皮细胞(rpe)。在实施方案中,本公开的aav颗粒逃脱针对天然血清型的中和抗体,并因此能够实现潜在的重新给药。在另一方面,本公
开的aav颗粒和组合物可与用于治疗的病症的其它已知治疗组合施用。
[0197]
试剂盒
[0198]
在实施方案中,本文所述的试剂、载体或组合物可以组装成药物或诊断或研究试剂盒以促进它们在治疗、诊断或研究应用中的使用。在实施方案中,本公开的试剂盒包括本文所述的修饰的aav衣壳蛋白、aav载体、aav颗粒、宿主细胞、分离的组织、组合物或药物组合物中的任一种。
[0199]
在实施方案中,试剂盒还包括使用说明书。具体地,这样的试剂盒可以包括一种或多种本文所述的试剂,以及描述这些试剂的预期应用和正确使用的说明书。作为一个实例,在实施方案中,试剂盒可以包括关于混合试剂盒的一种或多种组分和/或分离和混合样品并施用于受试者的说明书。在实施方案中,试剂盒中的试剂是适合于特定应用和试剂的施用方法的药物制剂和剂量。用于研究目的试剂盒可以含有用于进行各种实验的适当浓度或量的组分。
[0200]
试剂盒可以设计成便于使用本文所述的方法,并且可以采取许多形式。在适用的情况下,试剂盒的每种组合物可以以液体形式(例如,在溶液中)或以固体形式(例如,干粉)提供。在某些情况下,一些组合物可以是可构成的或另外可加工的(例如,加工成活性形式),例如,通过添加合适的溶剂或其它物质(例如,水或细胞培养基),其可以或可以不与试剂盒一起提供。在实施方案中,组合物可以在保存溶液(例如,冷冻保存溶液)中提供。保存溶液的非限制性实例包括dmso、多聚甲醛和(stem cell technologies,vancouver,canada)。在实施方案中,保存溶液含有一定量的金属蛋白酶抑制剂。
[0201]
在实施方案中,试剂盒在一个或多个容器中含有本文所述的任何一种或多种组分。因此,在实施方案中,试剂盒可以包括容纳本文所述的试剂的容器。所述试剂可以是液体、凝胶或固体(粉末)的形式。所述试剂可以无菌制备,包装在注射器中并冷冻运输。或者,它们可以容纳在小瓶或其它容器中以便储存。第二容器可以具有无菌制备的其它试剂。或者,试剂盒可以包括预混合的活性剂,并在注射器、小瓶、管或其它容器中运输。试剂盒可以具有将试剂施用于受试者所需的一种或多种或所有组分,例如注射器、局部施用装置或iv针管和袋。
[0202]
应当理解,虽然已经结合上述实施方案描述了本发明,但是上述描述和示例旨在说明而不是限制本发明的范围。本发明范围内的其它方面、优点和修改对于本发明所属领域的技术人员将是显而易见的。
[0203]
另外,在本发明的特征或方面以马库什组的形式描述的情况下,本领域技术人员将认识到本发明也因此以马库什组的任何单独成员或成员的亚组的形式描述。
[0204]
实施例
[0205]
实施例1
[0206]
衣壳生成平台
[0207]
使用图1所示的aav衣壳生成平台生成本文提供的一些aav衣壳序列(例如aav204、aav110)。简言之,该平台包括脱氧核糖核酸酶i片段化步骤,以及组装和扩增步骤,其最终导致嵌合衣壳文库的形成。本文提供的其它aav衣壳序列(例如aav214)通过合理设计产生。
[0208]
通过与已知aav衣壳蛋白的氨基酸序列比对来分析使用这些方法产生的衣壳蛋白。来自aav204(seq id no:2)和aav6(seq id no:63)的vp1蛋白序列的序列比对示出于图
20中。aav 214、aav 214a、aav 214e、aav 214e8、aav 214e9、aav 214e10、aav 214ab和aav itb102_45的vp1氨基酸序列的序列比对在图21中提供。aav 214、aav 214a、aav 214e、aav 214e8、aav 214e9、aav 214e10、aav 214ab和aav itb102_45的vp2氨基酸序列的序列比对在图22中提供。aav 214、aav 214a、aav 214e、aav 214e8、aav 214e9、aav 214e10、aav 214ab和aav itb102_45的vp1氨基酸序列的序列比对在图23中提供。
[0209]
病毒载体可以使用本领域已知的标准三重转染方法制备。简言之,将分别表达病毒衣壳蛋白、辅助蛋白(例如必需病毒rep和cap蛋白)和目的转基因的三个分开的质粒转染到贴壁或悬浮293细胞中,随后使用超速离心或层析,接着渗滤/超滤和末端无菌过滤收获病毒颗粒。参见,例如,guo等,mol.ther.methods clin.dev.第13卷第40
‑
46页中的第44页(2018年11月);wang等,human gene ther.methods,第25卷第261
‑
68页中的第262页;以及gao等,human gene ther.methods,第11卷第2079
‑
91页,其中每篇文献都以引用方式整体并入本文中以用于所有目的。
[0210]
实施例2
[0211]
aav214和aav204病毒载体的表征
[0212]
如下所述评估aav214或aav204载体在不同靶组织中的转导效率。
[0213]
体外评价了包含egfp转基因的aav214病毒载体(aav214
‑
gfp)和包含egfp转基因的aav9病毒载体(aav9
‑
gfp)的转导效率。hek 293细胞以50,000个细胞/孔接种于96孔板中。用5e+5moi的aav214
‑
gfp或aav9
‑
gfp转导细胞。转导后45小时拍摄的图像示出,在hek 293细胞中aav214
‑
gfp的转导效率更高(图2a)。注意到,除非另有说明,本文所用的“gfp”是指egfp(参见,例如zhang等(1996)biochem.biophys.res.commc’n.227(3):707
‑
11)。
[0214]
为了测试体内转导效率,通过静脉内(iv)注射在200μl tmn200(200mm tris
‑
hcl、1mm mgcl2、200mm nacl和0.001%pluronic f68)中的2e+11vg aav214
‑
gfp或aav9
‑
gfp对10周龄的c57bl/6小鼠给药。十三天后,将小鼠安乐死,收集内脏(脑、脊髓(颈和腰)、坐骨神经、眼、心、肾、肝、肺、睾丸、脾和肌肉)的组织样品,分离总dna并使用绝对qpcr方法分析gfp基因拷贝数估计。使用prism软件(graphpad软件)对获得的aav生物分布数据作图,进行统计分析。在大多数测试组织中,对对数变换数据进行的非配对t
‑
检验未显示aav9
‑
gfp和aav214
‑
gfp转导效率之间的统计学显著差异(p<0.05)。然而,在坐骨神经和肌肉的情况下,从给予aav214
‑
gfp的动物分离的每微克总dna中检测到的病毒dna拷贝数的平均值较高,并且在统计学上显著不同于给予aav9
‑
gfp的动物(坐骨神经:4.1倍,p=0.0228;肌肉:3倍,p=0.0125)(图2b)。
[0215]
将脑样品分成两半重复相同的实验。一半用于总dna分离,随后使用绝对qpcr进行生物分布分析。另一半用于总rna分离、脱氧核糖核酸酶处理、转化为cdna和qpcr分析以定量egfp基因表达水平。使用prism软件对获得的aav生物分布和转基因表达数据作图,进行统计分析。对对数变换数据进行的非配对t
‑
检验未显示脑组织中aav9
‑
gfp和aav214
‑
gfp转导效率(p=0.7668)或表达水平(p=0.0709)之间的统计学显著差异(图2c)。
[0216]
通过视网膜下(右眼)和玻璃体内(左眼)注射,给野生型c57bl/6j小鼠施用一组aav病毒载体,包括aav204
‑
gfp、aav110
‑
gfp和aav214
‑
gfp。对于两种施用方法,注射1μl 5e+12vg/ml(5e+9vg/眼)的aav载体,10天后用hra2 spectralis扫描激光检眼镜(heidelberg engineering,carlsbad,ca)对动物成像。从分析中省略了白内障妨碍充分观察的图像。检
眼镜检查成像显示,如果给予到视网膜下腔内,所有测试的病毒都能够转染视网膜细胞。然而,仅aav204和aav110显示出通过玻璃体内递送介导的视网膜细胞的增强的转导(图3a)。玻璃体内给予aav204
‑
gfp的小鼠眼睛的免疫组织化学分析证实gfp在各种类型的视网膜细胞中表达,所述视网膜细胞包括感光细胞、rpe、m
ü
ller胶质细胞、视网膜神经节细胞和双极细胞(图3b)。
[0217]
将aav204
‑
gfp和aav9
‑
gfp鞘内注射(1e+13vg)和/或玻璃体内注射(1.5e+12vg)给予2.5
‑
3岁的食蟹猴(macaca fascicularis),每只体重约2kg。四周后,将动物安乐死,通过rt
‑
qpcr评价gfp表达。数据分析表明aav204
‑
gfp介导的递送导致在大多数被分析的组织中增强的gfp表达,包括脑和脊髓的特定区域。参见图4。玻璃体内给予(每只眼1.5e+12vg aav204
‑
gfp)的食蟹猴的眼睛通过扫描激光检眼镜检查(slo)进行评价,切片并使用常规免疫化学染色方法分析gfp、视紫红质和基因组dna。如图5a和5b所示,aav204
‑
gfp的施用导致载体在眼睛的周边视网膜和中央凹区域中的显著转导。在视网膜细胞包括感光细胞、rpe、双极细胞和神经节细胞中观察到aav204递送的gfp表达增强(图5b)。大量的视杆细胞和视锥细胞被转导到黄斑中(图5c)。
[0218]
aav204载体也可与rpe特异性启动子组合以特异性表达蛋白质。图5d
‑
5f示出由vmd2(卵黄状黄斑变性
‑
2)启动子(seq id no159)驱动的来自aav204的gfp表达。玻璃体内施用2.5
×
10
12
个病毒基因组(vg)载体,并在14天和28天(处死)监测表达。在第14天(图5d)和第28天(图5e)进行扫描激光检眼镜(slo)成像。图5f示出第28天时外周的gfp表达和核(dapi)。
[0219]
还在非人灵长类动物外植体培养物中评价aav204
‑
gfp。在人道安乐死的动物的1小时内从眼睛分离食蟹猴视网膜。将视网膜解剖成~5
×
5mm切片,并在transwell插入培养皿中培养。分离后一天,用培养基中的aav204
‑
gfp转导外植体,并在转导后温育一周。固定外植体,包埋并切片用于标准免疫组织化学。切片用gfp(绿色)和视紫红质(红色)染色,并用荧光显微镜成像。在aav204
‑
gfp转导后,切片在感光细胞层中显示出显著的gfp表达(图6)。
[0220]
使用中和抗体测定法评价aav204载体的免疫原性(图7)。将包含aav9衣壳和萤火虫萤光素酶表达盒的aav9
‑
luc病毒或包含aav204衣壳和萤火虫萤光素酶表达盒的aav204
‑
luc病毒与来自aav9处理的人受试者(处理后60天)的各种血清稀释液在moi为25,000下温育。温育后,将病毒/血清混合物转移至含有20,000个lec2细胞的孔中。将血清处理的细胞温育24小时,然后测量发射的发光,并与来自以相同moi用未处理病毒转导的细胞的对照值进行比较。结果表明,aav204载体颗粒与aav9载体颗粒相比具有降低的免疫原性(参见图8)。
[0221]
实施例3
[0222]
使用由aav204病毒载体递送的cftr转基因改善由囊性纤维化跨膜传导调节蛋白(cftr)基因中的突变引起的缺陷
[0223]
使用从5’到3’具有5’itr、小鼠u1a启动子(seq id no:96)、cftrδr转基因、合成poly
‑
a序列(49bp)和3’itr的pa
‑
cf3质粒(seq id no:89)制备含有编码密码子优化的cftr转基因(即,包含seq id no:4中所示的核酸序列并且编码蛋白质的cftrδr基因缺乏全长cftr的氨基酸708
‑
759)的核酸的aav204载体颗粒。如下所述,将得到的颗粒用于将cftrδr
转基因传递到细胞或小鼠中。
[0224]
体外测定:使用包含cftrδr转基因的aav204病毒载体转导lec2细胞。flipr测定用于测量由aav204
‑
δr病毒载体递送的cftrδr转基因的功能性。结果表明,与用缺乏转基因的对照aav204病毒载体转染的细胞相比,当使用aav204
‑
cftrδr病毒载体转导细胞时,通过用毛喉素(cftr氯化物通道的已知开放子)刺激,人cftr(hcftr)离子通道功能得以恢复。此外,与对照相比,使用aav204
‑
cftrδr病毒载体转导的细胞中的氯离子特异性电流信号与基线相比增加3.5倍。参见图10a,左图。与cftr选择性抑制剂cftrinh
‑
172(4
‑
[[4
‑
氧代
‑2‑
硫代
‑3‑
[3
‑
三氟甲基)苯基]
‑5‑
噻唑烷亚基]甲基]苯甲酸)(tocris bioscience)(通过http://tocris.com/products/cftrinh
‑
172_3430获得)预温育阻止了cftrδr存在时毛喉素诱导的膜电位变化。参见图10b。这些结果证明cftrδr表达盒的功能性。
[0225]
进行膜电位分析以评价cftrδr表达盒的功能性是否依赖于用于转染的aav204
‑
cftrδr病毒的量。参见图10b。结果表明在cftrδr存在下膜电位的变化确实依赖于递送转基因的病毒颗粒的剂量。我们还使用aav204表达全长cftr并获得响应于毛喉素的增加的荧光。(图10c)。我们还通过western印迹证实了aav204的表达导致全长cftr和cftrδr的完全加工(数据未示出)。这些数据证实aav204递送任一蛋白都恢复体外氯离子通道功能。
[0226]
使用小鼠模型的体内测定:气管内给予小鼠包含萤光素酶转基因的aav204病毒载体。生物发光成像(bli)用于评估aav204病毒载体转导肺细胞的能力,如荧光素酶表达所反映,与aav6相比。图9,上图,示出aav204病毒载体介导的萤光素酶表达比aav6病毒载体高约3.5倍。图9下图示出离体bli示出的左肺和右肺中的表达,在肝或肾中很少或没有表达。这些结果证明aav204病毒载体能够促进报告转基因在小鼠特定组织中增强的表达。
[0227]
在称为“f508del”的囊性纤维化小鼠模型中测试包含cftrδr转基因的aav204载体颗粒的效力。这些小鼠携带突变cftr基因,其包含单个氨基酸f508的缺失,这是在人中最常见的cftr突变,影响大约90%的cf患者(参见,例如park等,plos one(feb.10,2016)11(2):e0149131)。将包含cftrδr转基因或萤光素酶转基因的aav204载体颗粒鼻内施用给野生型和f508del小鼠。测定鼻电位差(npd)以确定cftrδr转基因的功能。如图12a所示,与施用含有荧光素酶转基因的对照载体(aav204
‑
luc)的小鼠相比,施用aav204
‑
cftr载体颗粒的小鼠显示出校正的毛喉素刺激电流。
[0228]
使用人患者细胞的测定:评价了包含cftrδr转基因的aav204载体颗粒介导hcftr递送到分离自囊性纤维化患者的人气道细胞中,以及校正这些细胞中氯离子转运的能力。当将包含gfp转基因的aav204载体颗粒应用于顶端和基底外侧区室时,aav204转导从囊性纤维化患者分离的人鼻和支气管上皮(hne和hbe)细胞,并维持在气
‑
液界面培养物中。参见图11a。cftrδr蛋白在这些细胞中是膜定位的;参见图11b,左图。图11b,右图示出阐明膜定位的western印迹。
[0229]
如下所述评价包含cftrδr转基因的aav204载体颗粒的功能性。结果表明,转导包含cftrδr转基因的aav204载体后,cftr电流在来自囊性纤维化患者的人鼻上皮细胞的外植体培养物中恢复。参见图11c。还通过使用本领域技术人员已知的测量离子在极化上皮表面之间运动的using室测量跨膜电导的变化,测试aav颗粒是否能恢复从人囊性纤维化患者分离的鼻和支气管细胞中的cftr功能。简言之,在using室中,上皮的顶面和基底外侧表面面向两个含有对称盐溶液的分开的室。离子穿过上皮的转运在两个室之间产生电位差。通
过施加穿过上皮的短路电流(i
sc
)主动地抵消原本会产生电位差的扩散力。这使得离子在刺激后通过主动转运而移动,如本领域所熟知的,通过该电流的变化(δi
sc
)和囊性纤维化跨膜电导的计算来测量。参见,例如li等,j.cystic fibrosis(2004年7月)3:123
‑
126;park等,plos one(2016年2月10日)11(2):e0149131。如图12b所示,当转导cftrδr时,与载体相比,毛喉素刺激的cftrinh
‑
172抑制电流恢复到6
‑
7μa/cm2。
[0230]
总之,我们的结果表明aav204介导高效递送高表达的功能性cftr,并且进一步在体外细胞、小鼠模型和人类患者细胞的外植体培养物中恢复cftr功能。这些结果证明了包含cftrδr转基因的aav204颗粒在囊性纤维化中的治疗潜力。
[0231]
实施例4:
[0232]
使用由aav214载体递送的优化的cln3转基因改善cln3疾病引起的缺陷
[0233]
开发了全身施用后对cns组织具有增强的向性的aav衣壳(aav214)和用于改善cns和体细胞组织中的生物分布和表达的优化的cln3(包含seq id no:122的核酸序列)转基因盒,并测试了其功能性。使用aav9作为基准来评估aav214的向性和优化的cln3转基因盒在幼年神经元蜡样质脂褐质沉积症的小鼠模型中的生物分布,所述模型在c57bl/6背景中缺少跨越cln3(cln3δex7/8)的外显子7和8的1.02kb区段。该cln3缺失发生在约85%的突变cln3等位基因中,并概括了许多与人类疾病相关的疾病表型,包括运动缺陷、神经胶质活化和溶酶体贮积材料的进行性积累。
[0234]
表6.cln3
δex7/8
小鼠模型的研究设计
[0235][0236]
将各自包含cln3转基因的aav9和aav214病毒载体(分别为aav9
‑
cln3和aav214
‑
cln3)静脉内施用给野生型小鼠,剂量为2.0
×
10
13
vg/kg(病毒载体基因组/千克)。参见表6。30天后,人道地处死动物,收集组织用于生物分布分析,其评价载体颗粒向几个不同器官的递送,包括cns和脊髓的主要区域(颈和腰)。对对数变换数据进行的非配对t
‑
检验未显示aav214
‑
cln3和aav9
‑
cln3之间在大多数测试组织的生物分布值上有统计学显著性差异(见图13)。然而,使用aav214
‑
cln3与aav9相比,坐骨神经统计学上显著地(p=0.0001)高(744%)生物分布,而用aav9
‑
cln3更好转导脾(p<0.0001)。目前在较长时间内评估表达和剂量反应的研究表明aav214
‑
cln3可用于通过全身施用将cln3表达盒有效递送到cns组织。
[0237]
cln3转基因的表达通过rtqpcr使用从左脑半球分离的总rna评估。对对数转化数据的单向anova分析显示给予aav9
‑
cln3与aav214
‑
cln3的动物(p=0.4489)的平均cln3表达值无统计学显著差异。然而,两种测试的病毒载体产生比对照更高的cln3表达水平(p<0.0001;图14)。
[0238]
总之,这些结果表明,如果在cln3疾病的小鼠模型中通过全身施用,包含优化的cln3表达盒的新aav214病毒载体在包括cns的大多数组织中显示出与aav9相当的向性。这些结果表明,包含本文所述优化的cln3转基因的aav214载体可用于预防和治疗cln3疾病。
[0239]
实施例5
[0240]
使用由aav214载体递送的优化的gla转基因改善法布里病引起的缺陷
[0241]
通过iv注射将包含cbh启动子、cba
‑
mvm杂合内含子、天然gla转基因序列和tk65 poly
‑
a位点的aav9和aav214病毒载体施用给野生型c57bl/6小鼠(参见表7)。通过免疫印迹证实血浆样品中预期的转基因gla蛋白的大小(图15)。在评估血浆、脑、脊髓、心脏、肾、肝和眼中的gla酶活性。对log转化的gla酶活性值进行的统计分析表明,所有aav214
‑
gla转导样品与对照相比具有统计学上显著更高的gla活性(p<0.0001)。与aav9
‑
gla相比,在aav214
‑
gla转导的血浆、脑和脊髓组织中gla酶活性也统计学显着更高(图16)。总之,gla酶活性分析表明aav214构建体有效转导进入多个靶组织,特别是cns组织,证明aav214载体在法布里病患者中的治疗益处。
[0242]
表7.动物研究设计
[0243][0244]
在野生型动物中进行10天的研究后,没有观察到通过aav9或aav214病毒载体全身施用gla转基因的急性毒性效应。在本实验中,没有动物显示出任何由于治疗而产生的副作用。全身施用后aav9和aav214有效递送至靶组织,特别是递送至cns、心脏和肾脏证明能安全转导与法布里病相关的关键靶组织。
[0245]
实施例6
[0246]
使用由aav214载体递送的优化gaa转基因改善由pompe病引起的缺陷
[0247]
将包含cbh启动子、cba
‑
mvm杂合内含子、密码子优化的gaa转基因序列和bgh poly
‑
a位点的aav9
‑
gaa和aav214
‑
gaa载体静脉内给予到野生型c57bl/6小鼠中(见表8)。为了确定转基因是否被有效传递到靶组织,在来自治疗小鼠的脑、脊髓、膈膜、二头肌、肝和血浆中测试gaa酶活性蛋白。gaa酶活性的对数转化值的单向anova分析显示,与对照动物相比,给药动物的所有测试组织具有统计学上显著(p<0.002)更高的gaa活性。除了血浆中aav9有轻微优势(p=0.0018)外,给予aav214和aav9的组织之间没有显示出酶活性的统计学显著差异(图19a
‑
e)。gaa酶活性的分析证实aav214构建体有效转导到多个靶组织中,包括穿过血脑屏障的能力,以及转导到对于治疗庞皮病重要的组织,如二头肌和膈膜(图19)。这些结果提示单次静脉内注射包含如本文所述的优化的gaa表达盒的aav214病毒载体可能足以实现将校正的gaa转基因递送至靶组织。在野生型动物中进行10天研究后,没有观察到gaa转基因通过aav9或aav2l4载体全身施用的急性毒性效应。
[0248]
图19f示出aav递送的gaa对潜在分子病理学的修复。来自用包装有密码子优化的
人gaa的aav衣壳静脉内处理的gaa
‑
/
‑
小鼠的糖原分析。糖原含量是通过在淀粉葡糖苷酶处理后释放葡萄糖来间接测量的。用无限葡萄糖试剂(infinity glucose reagent)测量游离葡萄糖,并在spectramax i3x上分析。数据表示为gaa
‑
/
‑
媒介物对照治疗的动物的%。数据显示由aav递送的gaa获得的糖原水平的降低。用aav214在所有靶组织中观察到糖原清除,其表现与aav9一样有效。
[0249]
这些数据证实aav9和aav214的全身递送,特别是具有肌肉和外周神经系统(pns)表达的全身递送,证明了安全转导与庞皮病相关的关键靶组织和恢复gaa功能的能力。
[0250]
表8:动物研究设计
[0251][0252]
实施例7
[0253]
aav110载体颗粒显示出高度特异性的肌肉向性
[0254]
使用编码aav110衣壳蛋白的paav110质粒(也称为itcord1.10质粒)制备aav110颗粒。在c57bl/6野生型小鼠中,以单次注射将包含cbh启动子、cba
‑
mvm杂合内含子、egfp转基因序列和bgh poly
‑
a位点的aav110
‑
gfp病毒载体施用(总共1
×
10
11
vg,相当于5
×
10
12
vg/kg)到每条腿(股二头肌)。另一组动物施用等量的aav9
‑
gfp病毒载体用于比较。
[0255]
通过腿部肌肉荧光成像来评价gfp表达。图24a。数据显示,施用aav110
‑
gfp病毒载体的右腿和左腿均表达高水平的gfp,从而建立aav110衣壳的肌肉向性。相比之下,aav9
‑
gfp载体颗粒提供了显著更少的肌肉表达(图24b)。
[0256]
为了评估通过肌内给予aav110
‑
gfp或aav9
‑
gfp诱导的其它组织中的gfp转基因分布,我们检测了一组器官中的转基因生物分布(bd)。参见图25。数据证实aav110转导主要发生在肌肉中,以及坐骨神经和脾中。与aav9相比,aav110在脑、肾、眼、肺、心、肝和睾丸中显示出极少或没有生物分布。在每种情况下,bd为用aav9肌内递送转基因获得的bd的约3%或更低。
[0257]
肌肉组织的免疫组织化学分析证实,用aav110在肌肉中的gfp表达水平高,而用aav9的gfp表达水平低(图26)。该数据证实aav110的优异肌肉向性和表达。
[0258]
实施例8
[0259]
aav214载体颗粒在im和iv施用后在肌肉中提供高水平的表达
[0260]
产生包含aav214衣壳蛋白和由u1a启动子驱动的萤光素酶表达盒(aav214
‑
luc)的aav病毒载体。我们将aav214
‑
luc给予至成年野生型大鼠的右腿,剂量为每肌肉5
×
10
12
vg/kg,总体积为每肌肉0.1ml。左腿未处理。为了测量表达,我们将肌肉暴露于荧光素并测量发射光。下表中的数据显示注射的肌肉而非未治疗的肌肉在施用后28天显示出高表达。图27示出组织中的荧光素酶活性,表明表达的酶的活性。
[0261][0262]
用cbh启动子驱动的不同的转基因、密码子优化的smn
‑
1(运动神经元生存蛋白1)(其在脊髓性肌肉萎缩(sma)中有缺陷)获得了类似的结果。我们比较了静脉内施用的aav214
‑
smn1病毒载体颗粒与aav9
‑
smn1载体颗粒在静脉内给予时表达smn
‑
1的能力。图28示出感染幼年野生型小鼠后胫骨前肌组织中smn1的表达。数据说明,当静脉内递送时,aav214载体颗粒提供相对于载体至少10%至30%增加的改善的表达,并适于肌肉转导。
[0263]
比较aav214和aav9病毒载体转导肌肉组织显示出im递送的aav214能够比aav9转导更大的肌肉区域。通过im注射后10天的免疫组织化学来分析大鼠全肌(股二头肌)的gfp或mcherry表达。用gfp和mcherry pab探测固定和冷冻切片。与aav9相比,aav214展示出显著更大的转导区域,其主要局限于与注射位点一致的肌肉的上部。(图26b)。
[0264]
实施例9
[0265]
含有源自aav214的衣壳蛋白的aav载体颗粒在iv给予后在肌肉中展示高表达
[0266]
通过用已知aav血清型(aav8、aav9、aavrh10)的氨基酸序列交换aav214 vp1蛋白的n
‑
末端来修饰它们,从而产生下表中所示的变体。然后基本上如实施例1所述,用每种新获得的衣壳蛋白制备aav病毒载体颗粒,并评估它们在静脉内施用后转导肌肉的能力。我们发现每种病毒载体在腿部和心脏中赋予良好的肌肉转导(图29)。对数转化的生物分布数据的单向anova分析没有显示所测试的病毒载体的平均生物分布值的统计学显著差异(p>0.05)。
[0267]
vp1氨基酸seq id novp1核酸seq id noaav衣壳名称3120aav 214e3221aav 214e83322aav 214e93423aav 214e10
[0268]
实施例10
[0269]
衣壳诱导的交叉中和抗体产生
[0270]
aav204和aav214与aav9 nabs具有有限的或非常低的交叉反应性,并且诱导nabs产物与aav9交叉反应的可能性低。
[0271]
我们测试了im给予aav9或aav214的动物产生针对aav9的中和抗体的能力。(图31a)。通过测定动物血清抑制aav9转导的能力进行分析。萤光素酶载体导入允许的细胞类型,lec2。转导后三天测定细胞的萤光素酶活性。每组由2或3只大鼠组成,用于对照,aav9或aav214。有利地,通过im注射aav214的动物未显示出对aav9的交叉反应免疫反应,这可能导
致较大的患者群体,因为包括了对aav9预先存在免疫力的患者,无论是天然存在的还是由于先前给药。
[0272]
在非人灵长类动物(nhp)中获得了类似的数据。aav9鞘内(it)和静脉内(iv)给予的nhp都产生针对aav9的nab(图31b)。it给予的动物血清显示出对其它测试病毒(aav204、aav214和aav6)高得多的交叉反应性。然而,我们相信给药途径对nab的发育差异没有显著影响,因为两只动物通过鞘内加玻璃体内途径(it+iv)给予aav204也显示出交叉反应性的相似差异(图31c;参见nhp
‑
2和nhp
‑
3)。此外,仅玻璃体内(ivt)给予aav204的动物(图31c;参见nhp
‑
4)显示出与it+ivt治疗的动物(nhp
‑
3)相似的交叉反应性。所形成的交叉反应性的差异可能由产生nabs的aav衣壳蛋白表位的同一性来解释。用给予aav9的动物血清样品均显示出对aav204的低反应性(图31b),并且三个aav204治疗的动物中的两个显示出对aav9和aav214的非常低反应性,表明高相容性概率(图31c)。相比之下,aav6在所有给予aav204的动物中示出高交叉反应性(图31b和c)。
[0273]
替代实施方案
[0274]
1.一种编码包含与seq id no:3、30
‑
34、49或84具有至少70%同一性的氨基酸序列的腺相关病毒(aav)衣壳蛋白的多核苷酸,或编码包含与seq id no:1具有至少70%同一性的氨基酸序列的腺相关病毒(aav)衣壳蛋白的多核苷酸的用途。
[0275]
2.根据实施方案1所述的多核苷酸,其中所述氨基酸序列与seq id no:3、30
‑
34、49或84具有至少80%的同一性。
[0276]
3.根据实施方案1所述的多核苷酸,其中所述氨基酸序列与seq id no:3、30
‑
34、49或84具有至少90%的同一性。
[0277]
4.根据实施方案1所述的多核苷酸,其中所述氨基酸序列与seq id no:3、30
‑
34、49或84具有至少95%的同一性。
[0278]
5.根据实施方案1所述的多核苷酸,其中所述氨基酸序列与seq id no:3、30
‑
34、49或84具有至少99%的同一性。
[0279]
6.根据实施方案1所述的多核苷酸,其中所述氨基酸序列包含seq id no:3、30
‑
34、49或84。
[0280]
7.根据实施方案1
‑
6中任一项所述的多核苷酸,其中所述氨基酸序列包含所述aav衣壳蛋白的vp1部分、vp2部分、和vp3部分,并且其中所述vp3部分具有seq id no:41的序列。
[0281]
8.根据实施方案7所述的多核苷酸,其中所述aav衣壳蛋白与seq id no:3、30
‑
34、49或84具有至少70%、80%、90%或99%的同一性。
[0282]
9.根据实施方案1
‑
8中任一项所述的多核苷酸,其中所述多核苷酸包含在质粒、细菌人工染色体、酵母人工染色体、噬菌体或病毒载体内。
[0283]
10.一种宿主细胞,包含根据实施方案1
‑
8中任一项所述的多核苷酸。
[0284]
11.一种aav衣壳蛋白,包含与seq id no:3、30
‑
34、49或84具有至少70%、80%、90%或99%同一性的氨基酸序列。
[0285]
12.一种aav衣壳蛋白,包含具有seq id no2、3、30
‑
34、49或84的序列的氨基酸序列。
[0286]
13.一种aav病毒载体,包含
[0287]
(i)根据实施方案11或12所述的aav衣壳蛋白,和
[0288]
(ii)aav载体。
[0289]
14.根据实施方案13所述的aav病毒载体,其中所述aav载体包含异源核酸。
[0290]
15.根据实施方案14所述的aav病毒载体,其中所述异源核酸是转基因。
[0291]
16.根据实施方案13至15所述的aav病毒载体,其中所述转基因编码囊性纤维化跨膜传导调节蛋白(cftr)、cln3蛋白、α
‑
半乳糖苷酶a(gla)或酸性α
‑
葡糖苷酶(gaa)。
[0292]
17.根据实施方案15所述的aav病毒载体,其中所述转基因包含与seq id no:5、6、7、9、10、12和13中的任一个具有至少70%、80%、90%或99%同一性的序列。
[0293]
18.根据实施方案15所述的aav病毒载体,其中所述转基因编码包含与seq id no:4、5、8、11和14中的任一个具有至少70%、80%、90%或99%同一性的氨基酸序列的蛋白质。
[0294]
19.根据实施方案13至18所述的aav病毒载体,其中所述异源核酸与启动子可操作地连接。
[0295]
20.根据实施方案19所述的aav病毒载体,其中所述启动子是组织特异性控制启动子或组成型启动子。
[0296]
21.根据实施方案20所述的aav病毒载体,其中所述启动子是组成型启动子,所述组成型启动子是劳斯肉瘤病毒(rsv)ltr启动子(任选地与rsv增强子一起)、巨细胞病毒(cmv)启动子、sv40启动子、二氢叶酸还原酶启动子、β
‑
肌动蛋白启动子、磷酸甘油激酶(pgk)启动子、u6启动子、h1启动子、cag启动子、杂合鸡β
‑
肌动蛋白启动子、mecp2启动子、ef1启动子、遍在鸡β
‑
肌动蛋白杂合(cbh)启动子、u1a启动子、u1b启动子、mecp2启动子、mep418启动子、mep426启动子、最小mecp2启动子、vmd2启动子、mrho启动子、efla启动子、ubc启动子、人β
‑
肌动蛋白启动子、tre启动子、ac5启动子、多角体蛋白启动子、camkiia启动子、gal1启动子、tef1启动子、gds启动子、adh1启动子、ubi启动子或α
‑1‑
抗胰蛋白酶(haat)启动子。
[0297]
22.根据实施方案10所述的aav病毒载体,其中所述启动子是组织特异性控制启动子,其是中枢神经系统(cns)细胞特异性启动子、肺特异性启动子、皮肤特异性启动子、肌肉特异性启动子、肝特异性启动子或眼异性启动子。
[0298]
23.根据实施方案14所述的aav病毒载体,其中所述异源核酸编码mrna、sirna、grna或微rna。
[0299]
24.根据实施方案14所述的aav病毒载体,其中所述异源核酸编码多肽。
[0300]
25.根据实施方案14所述的aav病毒载体,其中所述异源核酸编码囊性纤维化跨膜传导调节蛋白(cftr)、cln3蛋白、α
‑
半乳糖苷酶a(gla)或酸性α
‑
葡糖苷酶(gaa)。
[0301]
26.根据实施方案25所述的aav病毒载体,其中所述异源核酸编码cftr。
[0302]
27.根据实施方案26所述的aav病毒载体,其中所述cftr包含seq id no:4编码的氨基酸序列或由其组成。
[0303]
28.根据实施方案15所述的aav病毒载体,其中所述异源核酸编码包含与seq id no:5、8、11和14中的任一个具有至少70%、80%、90%或99%同一性的氨基酸序列的蛋白质。
[0304]
29.根据实施方案15所述的aav病毒载体,其中所述异源核酸包含与seq id no:4、5、6、7、9、10、12和13中的任一个具有至少70%、80%、90%或99%同一性的序列。
[0305]
30.根据实施方案18所述的aav病毒载体,其中所述异源核酸编码报告蛋白。
[0306]
31.一种将目标基因导入受试者细胞的方法,包括使细胞与有效量的根据实施方案13
‑
30中任一项所述的aav病毒载体接触。
[0307]
32.根据实施方案31所述的方法,其中所述aav病毒载体经口服、直肠、透粘膜、吸入、经皮、肠胃外、静脉内、皮下、皮内、肌内、胸膜内、脑内、鞘内、脑内、心室内、鼻内、耳内、眼内、眼周、局部、淋巴内、脑池内、鞘内或玻璃体内引入所述受试者。
[0308]
33.根据实施方案31或32所述的方法,其中所述受试者是哺乳动物。
[0309]
34.根据实施方案31至33所述的方法,其中所述受试者是人。
[0310]
35.根据实施方案31至34所述的方法,其中所述细胞是体细胞。
[0311]
36.根据实施方案35所述的方法,其中所述体细胞是神经细胞、视网膜细胞、肌肉细胞、上皮细胞、肺细胞、肝细胞、干细胞或皮肤细胞。
[0312]
37.一种药物组合物,包含根据实施方案1
‑
8中任一项所述的多核苷酸、根据实施方案11或12所述的aav衣壳蛋白或根据实施方案13
‑
30中任一项所述的aav病毒载体。
[0313]
38.一种治疗病症的方法,其包括向受试者施用治疗有效量的根据实施方案37所述的药物组合物。
[0314]
39.根据实施方案38所述的方法,其中所述病症是cns病症、皮肤病症、肺病症、肌肉病症、肺病症或视网膜病症。
[0315]
40.根据实施方案38或39所述的方法,其中所述病症是肌萎缩性侧索硬化(als)、脊髓性肌萎缩(sma)、法布里病、庞皮病、cln3病(或青少年神经元蜡样质脂褐质沉积症)、隐性营养不良性大疱性表皮松解症(rdeb)、青少年巴特氏病、常染色体显性病症、肌营养不良、血友病a、血友病b、多发性硬化、糖尿病、戈谢病、癌症、关节炎、肌肉消瘦、心脏病、内膜增生、癫痫、亨延顿氏舞蹈病、帕金森病、阿尔茨海默病、囊性纤维化、地中海贫血、赫尔勒综合征、sly综合征、沙伊综合征、胡
‑
射二氏综合征、亨特综合征、sanfilippo综合征a(粘多糖贮积病iiia或mps iiia)、sanfilippo综合征b(粘多糖贮积病iiib或mps iiib)、sanfilippo综合征c、sanfilippo综合征d、莫基奥综合征、马
‑
兰二氏综合征、克腊比氏病、苯丙酮尿症、巴特氏病、脊髓小脑性共济失调、ldl受体缺乏、高血氨症、关节炎、黄斑变性、色素性视网膜炎、神经元蜡样质脂褐质沉积症1(cln1)或腺苷脱氨酶缺乏。
[0316]
41.根据实施方案38所述的方法,其中所述病症是脊髓性肌萎缩(sma)、隐性营养不良性大疱性表皮松解症(rdeb)、法布里病、庞皮病、cln3病(或青少年神经元蜡样质脂褐质沉积症)、mps iiia、mps iiib、青少年巴特氏病和杜兴氏肌营养不良(dmd)或贝克肌营养不良。
[0317]
42.根据实施方案38所述的方法,其中所述病症是癌症,并且所述癌症是膀胱癌、乳腺癌、宫颈癌、结肠癌、直肠癌、子宫内膜癌、肾癌、唇癌、口腔癌、肝癌、黑素瘤、间皮瘤、非小细胞肺癌、非黑素瘤皮肤癌、口腔癌、卵巢癌、胰腺癌、前列腺癌、肉瘤、小细胞肺癌或甲状腺癌。
[0318]
43.根据实施方案37至42所述的方法,其中所述受试者是哺乳动物。
[0319]
44.根据实施方案43所述的方法,其中所述受试者是人。
[0320]
45.一种试剂盒,包含根据实施方案1
‑
8中任一项所述的多核苷酸、根据实施方案10所述的细胞、根据实施方案12或13所述的aav衣壳蛋白和/或根据实施方案13
‑
30中任一
项所述的aav病毒载体。
[0321]
46.一种aav包装系统,包含
[0322]
根据实施方案1
‑
8中任一项所述的多核苷酸,以及辅助细胞。
[0323]
47.根据根据实施方案46所述的aav包装系统,其中所述辅助细胞是酵母细胞、
[0324]
哺乳动物细胞或昆虫细胞。
[0325]
48.一种编码aav衣壳蛋白的核酸,所述aav衣壳蛋白包含在氨基酸129处的亮氨酸残基、在氨基酸586处的天冬酰胺残基和在氨基酸723处的谷氨酸残基,其中所述aav衣壳蛋白中的氨基酸位置相对于seq id no:2的氨基酸序列中的氨基酸位置进行编号。
[0326]
49.根据实施方案48所述的核酸,其中所述编码的aav衣壳氨基酸序列与seq id no:2的氨基酸序列具有至少95%的同一性。
[0327]
50.根据实施方案48所述的核酸,其中所述编码的aav衣壳氨基酸序列与seq id no:2的氨基酸序列具有至少99%的同一性。
[0328]
51.根据实施方案48所述的核酸,其中所述核酸序列与seq id no:15的核苷酸序列具有至少99%的同一性。
[0329]
52.根据实施方案48所述的核酸,其中所述核酸序列与seq id no:15的核苷酸序列具有100%的同一性。
[0330]
53.一种载体,包含根据实施方案48至52所述的核酸。
[0331]
54.一种aav衣壳蛋白,由根据实施方案48至52所述的核酸编码。
[0332]
55.根据实施方案54所述的aav衣壳蛋白,其中所述蛋白包含seq id no:2的氨基酸序列。
[0333]
56.一种aav病毒载体,包含由根据实施方案54或55所述的核酸编码的所述aav衣壳蛋白和aav载体,其中所述aav载体包含异源核酸。
[0334]
57.根据实施方案56所述的aav病毒载体,其中所述异源核酸与组成型启动子可操作地连接。
[0335]
58.根据实施方案56或57所述的aav病毒载体,其中所述异源核酸编码多肽。
[0336]
59.根据实施方案56或57所述的aav病毒载体,其中异源核酸编码反义rna、微rna或rnai。
[0337]
60.根据实施方案56所述的aav病毒载体,其中所述aav衣壳蛋白包含seq id no:2的氨基酸序列。
[0338]
61.一种编码aav衣壳蛋白的核酸,所述aav衣壳蛋白包含vp1部分、vp2部分和vp3部分,其中所述vp3部分包含可变区(vr)i至ix,其中:
[0339]
(a)vr
‑
ii包含氨基酸序列dnngvk(seq id no:54);
[0340]
(b)vr
‑
iii包含氨基酸序列ndgs(seq id no:55);
[0341]
(c)vr
‑
iv包含氨基酸序列ingsgqnqqt(seq id no:56);
[0342]
(d)vr
‑
v包含氨基酸序列rvstttgqnnnsnfawta(seq id no:57);
[0343]
(e)vr
‑
vi包含氨基酸序列hkegedrffplsg(seq id no:58);
[0344]
(f)vr
‑
vii包含氨基酸序列kqnaardnadysdv(seq id no:59);
[0345]
(g)vr
‑
viii包含氨基酸序列adnlqqqntapqi(seq id no:60);以及
[0346]
(h)vr
‑
ix包含氨基酸序列nyykstsvdf(seq id no:61)。
[0347]
62.根据实施方案61所述的核酸,其中所述vr
‑
i区包含sastgas(seq id no:52)。
[0348]
63.根据实施方案61所述的核酸,其中所述vr
‑
i区包含nstsggss(seq id no:53)或sstsggss(seq id no:87)。
[0349]
64.根据实施方案61至63所述的核酸,其中所述vp3部分还包含下列中的一者或多者:
[0350]
(i)在氨基酸223处的天冬酰胺(n);
[0351]
(ii)在氨基酸224处的丙氨酸(a)残基;
[0352]
(iii)在氨基酸410处的苏氨酸(t)残基;
[0353]
(iv)在氨基酸724处的组氨酸残基;以及
[0354]
(v)在氨基酸734处的脯氨酸(p)残基,
[0355]
其中所述aav衣壳蛋白中的氨基酸位置相对于seq id no:3的氨基酸序列中的氨基酸位置进行编号。
[0356]
65.根据实施方案61至64所述的核酸,其中所述编码的aav衣壳氨基酸序列与seq id no:3、30、31、32、33、34、49或84的氨基酸序列具有至少95%的同一性。
[0357]
66.根据实施方案61至65所述的核酸,其中所述编码的aav衣壳氨基酸序列与seq id no:3、30、31、32、33、34、49或84的氨基酸序列具有至少99%的同一性。
[0358]
67.根据实施方案61至66所述的核酸,其中所述核酸序列与选自seq id no:18、19、20、21、22、23、47、82或98的核苷酸序列具有至少99%的同一性。
[0359]
68.根据实施方案61所述的核酸,其中所述核酸序列与选自seq id no:18、19、20、21、22、23、47、82或98的核苷酸序列具有100%的同一性。
[0360]
69.一种载体,包含根据实施方案61至68所述的核酸。
[0361]
70.一种aav衣壳蛋白,由根据实施方案61至68所述的核酸编码。
[0362]
71.根据实施方案70所述的aav衣壳蛋白,其中所述蛋白质包含seq id no:3、30、31、32、33、34、49或84的氨基酸序列。
[0363]
72.一种aav病毒载体,包含由根据实施方案61至68所述的核酸编码的aav衣壳蛋白和aav载体,其中所述aav载体包含异源核酸。
[0364]
73.根据实施方案72所述的aav病毒载体,其中所述异源核酸与组成型启动子可操作地连接。
[0365]
74.根据实施方案72或73所述的aav病毒载体,其中所述异源核酸编码多肽。
[0366]
75.根据实施方案72或73所述的aav病毒载体,其中所述异源核酸编码反义rna、微rna或rnai。
[0367]
76.根据实施方案72至75所述的aav病毒载体,其中所述aav衣壳蛋白包含seq id no:3、30、31、32、33、34、49或84的氨基酸序列。
[0368]
77.一种编码aav衣壳蛋白的核酸,所述aav衣壳蛋白包含vp1部分、vp2部分和vp3部分,其中所述vp3部分包含可变区(vr)i至ix,其中:
[0369]
(a)vr
‑
i包含氨基酸序列sastgas(seq id no:52)
[0370]
(b)vr
‑
ii包含氨基酸序列dnngvk(seq id no:54);
[0371]
(c)vr
‑
iii包含氨基酸序列ndgs(seq id no:55);
[0372]
(d)vr
‑
iv包含氨基酸序列ingsgqnqqt(seq id no:56);
[0373]
(e)vr
‑
v包含氨基酸序列rvstttgqnnnsnfawta(seq id no:57);
[0374]
(f)vr
‑
vi包含氨基酸序列hkegedrffplsg(seq id no:58);
[0375]
(g)vr
‑
vii包含氨基酸序列kqnaardnadysdv(seq id no:59);
[0376]
(h)vr
‑
viii包含氨基酸序列adnlqqqntapqi(seq id no:60);以及
[0377]
(i)vr
‑
ix包含氨基酸序列nyykstsvdf(seq id no:61)。
[0378]
78.根据实施方案77所述的核酸,其中所述vp3部分还包含下列中的一者或多者:
[0379]
(i)在氨基酸223处的天冬酰胺(n);
[0380]
(ii)在氨基酸224处的丙氨酸(a)残基;
[0381]
(iii)在氨基酸410处的苏氨酸(t)残基;
[0382]
(iv)在氨基酸724处的组氨酸残基;以及
[0383]
(v)在氨基酸734处的脯氨酸(p)残基,
[0384]
其中所述aav衣壳蛋白中的氨基酸位置相对于seq id no:3的氨基酸序列中的氨基酸位置进行编号。
[0385]
79.根据实施方案77或78所述的核酸,其中所述vp3部分具有seq id no:41的序列。
[0386]
80.根据实施方案77至79所述的核酸,其中所述编码的aav衣壳氨基酸序列的所述vp1和所述vp2部分与seq id no:3、31、32、33或34的所述vp1和所述vp2部分的氨基酸序列具有至少95%的同一性。
[0387]
81.根据实施方案77至80所述的核酸,其中所述编码的aav衣壳氨基酸序列与seq id no:3、31、32、33或34的氨基酸序列具有至少99%的同一性。
[0388]
82.根据实施方案77至81所述的核酸,其中所述核酸序列与选自seq id no:18、20、21、22或23的核苷酸序列具有至少99%的同一性。
[0389]
83.根据实施方案77至82所述的核酸,其中所述核酸序列与选自seq id no:18、20、21、22或23的核苷酸序列具有100%的同一性。
[0390]
84.一种载体,包含根据实施方案57至83所述的核酸。
[0391]
85.一种aav衣壳蛋白,由根据实施方案77至83所述的核酸编码。
[0392]
86.根据实施方案85所述的aav衣壳蛋白,其中所述蛋白包含seq id no:3、31、32、33或34的氨基酸序列。
[0393]
87.一种aav病毒载体,包含由根据实施方案88所述的核酸编码的aav衣壳蛋白和aav载体,其中所述aav载体包含异源核酸。
[0394]
88.根据实施方案87所述的aav病毒载体,其中所述异源核酸与组成型启动子可操作地连接。
[0395]
89.根据实施方案87或88所述的aav病毒载体,其中所述异源核酸编码多肽。
[0396]
90.根据实施方案87或88所述的aav病毒载体,其中所述异源核酸编码反义rna、微rna或rnai。
[0397]
91.根据实施方案87~90所述的aav病毒载体,其中所述aav衣壳蛋白包含seq id no:3、31、32、33或34的氨基酸序列。
[0398]
92.一种编码aav衣壳蛋白的核酸,所述aav衣壳蛋白包含vp1部分、vp2部分和vp3部分,其中所述vp1部分包含在氨基酸129处的亮氨酸(l)残基,其中所述vp2部分包含在氨
基酸157处的苏氨酸(t)或天冬酰胺(n)残基和在氨基酸162处的赖氨酸(k)或丝氨酸(s)残基,并且其中所述vp3部分包含在氨基酸223处的天冬酰胺(n)残基、在氨基酸224处的丙氨酸(a)残基、在氨基酸272处的组氨酸(h)残基、在氨基酸410处的苏氨酸(t)残基、在氨基酸724处的组氨酸(h)残基和在氨基酸734处的脯氨酸(p)残基,其中所述aav衣壳蛋白衣壳中的氨基酸位置相对于seq id no:3的氨基酸序列中的氨基酸位置进行编号。
[0399]
93.根据实施方案92所述的核酸,其中所述vp3部分包含可变区(vr)i至ix,其中:
[0400]
(a)vr
‑
i包含氨基酸序列sastgas(seq id no:52);
[0401]
(b)vr
‑
ii包含氨基酸序列dnngvk(seq id no:54);
[0402]
(c)vr
‑
iii包含氨基酸序列ndgs(seq id no:55);
[0403]
(d)vr
‑
iv包含氨基酸序列ingsgqnqqt(seq id no:56);
[0404]
(e)vr
‑
v包含氨基酸序列rvstttgqnnnsnfawta(seq id no:57);
[0405]
(f)vr
‑
vi包含氨基酸序列hkegedrffplsg(seq id no:58);
[0406]
(g)vr
‑
vii包含氨基酸序列kqnaardnadysdv(seq id no:59);
[0407]
(h)vr
‑
viii包含氨基酸序列adnlqqqntapqi(seq id no:60);以及
[0408]
(i)vr
‑
ix包含氨基酸序列nyykstsvdf(seq id no:61)。
[0409]
94.根据实施方案92或93所述的核酸,其中所述vp1部分还在氨基酸24处包含天冬氨酸(d)或丙氨酸(a)残基,其中所述aav衣壳蛋白中的氨基酸位置相对于seq id no:3的氨基酸序列中的氨基酸位置进行编号。
[0410]
95.根据实施方案92至94所述的核酸,其中所述vp2部分还包含下列中的一者或多者:
[0411]
(i)在氨基酸148处的脯氨酸(p)残基;
[0412]
(ii)在氨基酸152处插入的精氨酸(r)残基;
[0413]
(iii)在氨基酸168处的精氨酸(r)残基;
[0414]
(iv)在氨基酸189处的异亮氨酸(i)残基;以及
[0415]
(v)在氨基酸200处的丝氨酸(s)残基,
[0416]
其中所述aav衣壳蛋白中的氨基酸位置相对于seq id no:3的氨基酸序列中的氨基酸位置进行编号。
[0417]
96.根据实施方案92至96所述的核酸,其中所述编码的aav衣壳氨基酸序列与seq id no:31、32、33或34的氨基酸序列具有至少95%的同一性。
[0418]
97.根据实施方案92所述的核酸,其中所述编码的aav衣壳氨基酸序列与seq id no:31、32、33或34的氨基酸序列具有至少99%的同一性。
[0419]
98.根据实施方案92所述的核酸,其中所述核酸序列与选自seq id no:20、21、22或23的核苷酸序列具有至少99%的同一性。
[0420]
99.根据实施方案98所述的核酸,其中所述核酸序列与选自seq id no:20、21、22或23的核苷酸序列具有100%的同一性。
[0421]
100.一种载体,包含根据实施方案92至99所述的核酸。
[0422]
101.一种aav衣壳蛋白,由根据实施方案92至99所述的核酸编码。
[0423]
102.根据实施方案101所述的aav衣壳蛋白,其中所述蛋白包含seq id no:31、32、33或34的氨基酸序列。
[0424]
103.一种aav病毒载体,包含由根据实施方案101或102所述的核酸编码的所述aav衣壳蛋白和aav载体,其中所述aav载体包含异源核酸。
[0425]
104.根据实施方案103所述的aav病毒载体,其中所述异源核酸与组成型启动子可操作地连接。
[0426]
105.根据实施方案103或104所述的aav病毒载体,其中所述异源核酸编码多肽、反义rna、微rna或rnai。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1