用免疫检查点抑制剂联合另一种治疗剂治疗癌症的方法与流程
用免疫检查点抑制剂联合另一种治疗剂治疗癌症的方法
1.相关申请的交叉引用
2.本技术要求于2018年12月13日提交的非临时美国申请序列号16/219,203的优先权权益。在先申请的公开内容被认为是本技术公开内容的一部分并通过引用以其整体并入。
技术领域
3.本发明属于肿瘤学领域,具体涉及用免疫检查点抑制剂联合另一种治疗剂治疗癌症患者的方法。
技术背景
4.临床肿瘤学的主要障碍之一是,即使观察到对治疗的初始肿瘤反应,肿瘤也经常对疗法产生抗性。许多研究都集中在肿瘤细胞中突变和遗传畸变的作用,这些突变和遗传畸变促进了耐药性并可以解释肿瘤的再生长。然而,研究表明,宿主响应癌症疗法会产生促肿瘤发生和促转移的作用,这又会促进肿瘤的再生长,从而使药物的抗肿瘤活性无效(评论见katz和shaked,2015;shaked,2016)。
5.宿主介导的对抗癌治疗模式的反应可以是分子和/或细胞反应。在用化疗药物治疗后,宿主骨髓衍生细胞(bmdc)从骨髓区室动员起来,定植治疗的肿瘤并促进肿瘤血管生成和癌症再生长,从而促进疗法抗性(shaked等,2006,2008)。癌症疗法还诱导例如巨噬细胞和抗原递呈细胞的多种免疫细胞的促肿瘤发生激活(beyar
‑
katz等,2016;de palma和lewis,2013;kim等,2012;ma等,2013)。总的来说,上述这些研究表明,宿主介导的分子和细胞对不同抗癌治疗的反应涉及免疫细胞的激活或培养(education)以及多种促肿瘤发生因子的分泌。这些联合作用有助于肿瘤再生长和对疗法抗性。这种相对较新的现象在理解癌症进展和对癌症疗法抗性方面发生了典范转移。
6.最近,一种新的治疗模式——使用免疫检查点抑制剂(ici)的免疫疗法,正在彻底改变癌症疗法。这种免疫调节药物在治疗晚期恶性肿瘤(包括iv期)方面取得了显著的成功,晚期恶性肿瘤例如黑素瘤、前列腺癌、非小细胞肺癌、肾细胞癌以及还有一些血液恶性肿瘤(postow等,2015)。尽管人类免疫系统能够识别并发动(mount)对癌细胞的反应,但这种反应通常会被肿瘤来源的抑制所规避,从而导致免疫耐受。在这方面,已发现肿瘤浸润淋巴细胞(til),例如肿瘤抗原特异性cd8
+
细胞毒性t淋巴细胞(ctl)和自然杀伤(nk)细胞定植于肿瘤微环境(gajewski等,2013)。然而,在肿瘤部位,它们完全缺乏对抗肿瘤细胞的能力(ostrand
‑
rosenberg和sinha,2009)。这是由于癌细胞、基质细胞或其他抑制性免疫细胞例如髓源性抑制细胞(mdsc)和t调节细胞(tregs)分泌的因子的直接抑制作用(makkouk和weiner,2015年)。例如,il
‑
10在多种类型的癌症中经常上调,并被证明抑制免疫系统(sato等,2011)。因此,鉴定对免疫系统对抗肿瘤细胞负调节的分子,将导致开发支持免疫细胞的激活对抗肿瘤的免疫调节药物。
7.特别感兴趣的是免疫检查点蛋白质,例如ctla
‑
4、pd
‑
1及其配体pd
‑
l1。这些检查
点蛋白质由肿瘤细胞或其他免疫细胞表达,并促进ctl耗尽(postow等人,2015;topalian等人,2015)。具体来说,它们可以保持控制免疫反应,并抑制t细胞对肿瘤细胞的杀伤作用。因此,已经开发了检查点抑制剂以便抑制免疫抑制作用。目前,已经开发出阻断免疫检查点、ctla
‑
4和pd
‑
1或其配体pd
‑
l1的抗体(pardoll,2012)。这些ici目前在临床中用于治疗多种恶性肿瘤,并取得了一些有希望和显著的成功(romano和romero,2015)。然而,ici仅对有限部分的癌症患者(约10
‑
20%)显示出疗法益处。例如,来自ctla
‑
4阻断抗体伊匹单抗(ipilimumab)临床研究的汇总数据揭示临床反应的持续时间在3年左右,并且可持续长达10年。然而,这种引人注目的疗法效果仅在患者子集(约20%)中观察到。因此,大多数患者表现出对此类疗法的固有抗性机制。然而,定义对ici有反应的患者亚群的分子方面尚不完全清楚。已表明标志物例如肿瘤细胞的pd
‑
l1表达、突变负荷和淋巴细胞浸润可以预测对ici免疫疗法反应的癌症患者。然而,这些上述生物标志物并不总是与肿瘤对ici免疫疗法的反应或患者对ici的抗性相关。因此,另外可能的机制仍然未知。
8.在申请人于2018年6月4日提交的国际专利申请号pct/il2018/050608和pct/il2018/050609,公开号分别为wo2018/225062和wo2018/225063中——其全部内容通过引用并入本文,通过鉴定响应于所述癌症疗法由癌症患者诱导进入循环的多种因子/生物标志物(“宿主反应”)并确定与参考水平相比的多种因子的一种或多种中的每一种的水平变化如何预测癌症患者对用所述癌症疗法治疗的有利或不利反应,描述了预测对用癌症疗法的癌症治疗的个性化反应的方法。
9.非常需要揭示宿主介导的细胞和分子机制,这些机制有助于肿瘤对癌症疗法的所有模式(包括有希望的ici免疫疗法模式)的抗性。这将允许发展阻止这种不需要的宿主效应的策略,并且将改善疗法结果并延迟对癌症疗法的抗性。
技术实现要素:
10.本发明基于在本技术的
背景技术:
部分中以上提及的先前研究,其表明癌症患者(“宿主”)响应于癌症疗法,可以产生并诱导对用免疫检查点抑制剂(以下简称“ici”)的癌症免疫疗法的一组宿主驱动的抗性因子进入宿主循环,这可能限制或抵消使用ici进行患者治疗的有效性。这些因子的确定允许以个性化的形式预测患者对使用ici治疗的有利或不利反应。这些因子在本文中可互换地称为“因子”或“生物标志物”,主要是如下因子:细胞因子、趋化因子、生长因子、可溶性受体、酶和宿主细胞在不同器官或肿瘤微环境中响应于治疗患者的使用ici的癌症疗法产生的其他分子。
11.因此,一方面,本发明提供用免疫检查点抑制剂(ici)治疗癌症患者的方法,该方法包括以下步骤:
12.(i)对在用所述ici的治疗时段后的时间点从癌症患者获得的选自血浆、全血、血清或外周血单核细胞的血液样本进行分析,以确定响应于用ici治疗由宿主(“癌症患者”)驱动的多种宿主驱动的抗性因子中的一种或多种的水平,所述多种因子的一种或多种以个性化的形式促进癌症患者对用ici治疗的反应性或无反应性;
13.(ii)通过确定在用所述ici的治疗时段之前的时间点从癌症患者获得的步骤(i)的血液样本同一类型的血液样本中的每种所述因子的水平,获得步骤(i)的多种宿主驱动的抗性因子中的一种或多种的每一种的参考水平;
14.(iii)通过将步骤(i)的每种宿主驱动的抗性因子的水平与同一因子的步骤(ii)的参考水平进行比较,确立步骤(i)的多种宿主驱动的抗性因子中的一种或多种的每一种的倍数变化;
15.(iv)基于步骤(iii)中针对步骤(i)的多种宿主驱动的抗性因子中的一种或多种确立的倍数变化,确定癌症患者对用所述ici的治疗具有有利或不利的反应;和
16.(iva)如果基于步骤(iii)中针对多种宿主驱动的抗性因子中的一种或多种确立的倍数变化,癌症患者对用所述ici的治疗具有不利的反应,则在显示出指示所述不利反应的倍数变化的一种或多种宿主驱动的抗性因子中选择主导因子,并且用治疗有效量的ici连同治疗有效量的阻断所选择的主导的宿主驱动的抗性因子(本文为“主导因子”)或其受体的活性的药剂治疗患者;或
17.(ivb)如果基于(iii)中针对多种宿主驱动的抗性因子中的一种或多种确立的倍数变化,癌症患者对用所述ici的治疗具有有利的反应,则继续用单独的ici治疗癌症患者。
18.在某个实施方式中,本发明涉及治疗对用免疫检查点抑制剂(ici)的治疗无反应的癌症患者的方法,该方法包括向癌症患者施用治疗有效量的ici联合治疗有效量的阻断主导因子或其受体的活性的药剂,主导因子在响应于用ici治疗癌症患者产生的多种宿主驱动的抗性因子中选择,多种宿主驱动的抗性因子具有预测癌症患者对用ici治疗的不利反应的倍数变化,其中通过比较以下确立倍数变化:(i)在用ici的治疗时段后从癌症患者获得的选自血浆、全血、血清或外周血单核细胞的血液样本中每种宿主驱动的抗性因子的水平,和(ii)在用所述ici的治疗时段之前从癌症患者获得的与(i)同一类型的血液样本中对于同一因子获得的参考水平。优选地,步骤(i)和(ii)中的血液样本都是血浆。
19.在另一个方面,本发明涉及免疫检查点抑制剂(ici),其用于治疗对所述治疗无反应的患者中的癌症,包括施用治疗有效量的ici联合治疗有效量的阻断主导因子或其受体的活性的药剂,主导因子在响应于用ici治疗癌症患者产生的多种宿主驱动的抗性因子中选择,多种宿主驱动的抗性因子具有预测癌症患者对用ici治疗的不利反应的倍数变化,其中通过比较以下确定倍数变化:(i)在用ici的治疗时段后从癌症患者获得的选自血浆、全血、血清或外周血单核细胞的血液样本中每种宿主驱动的抗性因子的水平,和(ii)在用所述ici的治疗时段之前从癌症患者获得的与(i)同一类型的血液样本中对于同一因子获得的参考水平。优选地,步骤(i)和(ii)中的血液样本都是血浆。
附图说明
20.图1a
‑
1c显示了在乳腺癌小鼠模型中阻断mmp9对原发性肿瘤生长和存活率的影响。图1a显示,与单独用载体、抗pd
‑
l1或sb
‑
3ct治疗的小鼠相比,用抗pd
‑
l1和mmp
‑
2/mmp
‑
9抑制剂sb
‑
3ct的组合治疗的小鼠表现出肿瘤大小减小。图1b显示了第27天(最后一个实验日)的肿瘤体积。图1c显示了与其他治疗组相比,以联合疗法治疗的小鼠的存活率更佳。
21.图2a
‑
2c显示了在结肠癌小鼠模型中阻断宿主衍生的双调蛋白对原发性肿瘤生长和存活率的影响。图2a
‑
2b显示了用抗pd
‑
l1、抗双调蛋白抗体(抗areg)或抗pd
‑
l1和抗areg联合疗法治疗的小鼠的肿瘤体积。图2c是kaplan
‑
meier曲线,其表明与其他治疗组相比,联合疗法治疗的小鼠存活率更佳。
22.图3显示了用抗pd
‑
l1或抗ctla
‑
4治疗后的il
‑
6表达。
23.图4a
‑
4c显示了阻断用抗pd
‑
l1治疗后诱导的宿主衍生的il
‑
6对原发性肿瘤生长和小鼠存活率的影响。图4a显示了与对照小鼠或单独用抗pd
‑
l1或抗il
‑
6治疗的小鼠相比,用抗pd
‑
l1和抗il
‑
6的组合治疗的小鼠中肿瘤生长的抑制。图4b对应于图4a,但显示了个体动物中的肿瘤生长,和图4c显示了相对于其他治疗组用抗pd
‑
l1和抗il
‑
6二者的组合治疗也导致存活率更佳。
24.图5a
‑
5b显示了阻断用抗ctla
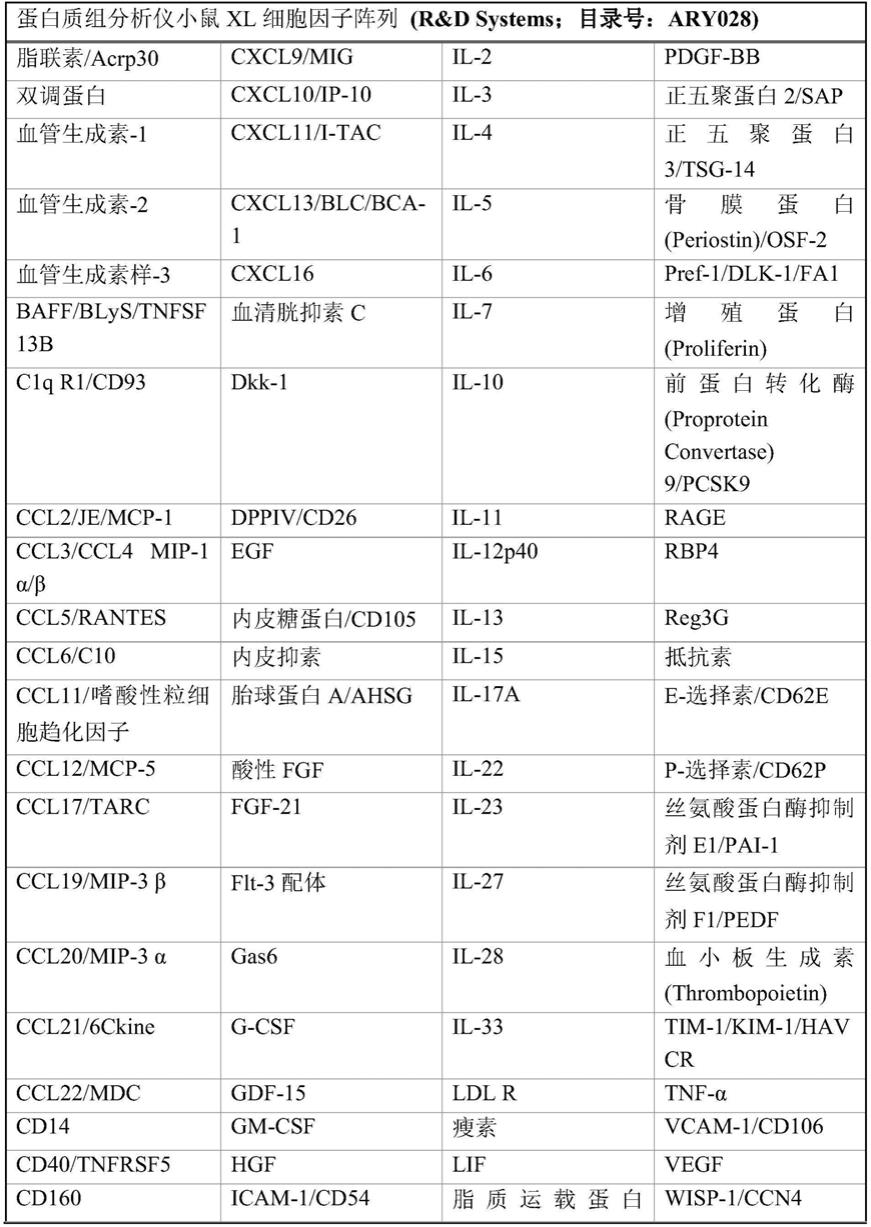
‑
4治疗后诱导的宿主衍生的il
‑
6对原发性肿瘤生长和存活率的影响。与对照小鼠相比,用抗ctla
‑
4治疗balb/c小鼠导致肿瘤生长减少(图5a)和存活率更佳(图5b),并且通过用抗ctla
‑
4和抗il
‑
6抗体二者的组合治疗进一步改善了这些效果(图5a
‑
5b)。
具体实施方式
25.在描述本发明的方法之前,应当理解本发明不限于如本文所述的具体方法和方案。还应理解,本文中使用的术语仅出于描述本发明的具体实施方式的目的,并且如果没有另外定义,则不旨在限制将在所附权利要求中陈述的本发明的范围。
26.还必须注意,如本文和所附权利要求中所使用的,单数形式“一个”、“一种”和“该”包括复数参考,除非上下文另有明确规定。
27.如本文所用,术语“癌症疗法”可与术语“癌症模式疗法”互换使用,包括复数参考,即一种单一模式疗法或两种或更多种模式疗法的组合。
28.如本文所用,术语“诱导”、“驱动”和“产生”可互换使用以表示癌症患者响应于癌症疗法(“宿主反应”)诱导进入循环的因子。
29.在癌症疗法中,治疗周期是指在一个时间点向患者施用药物(例如,在一天或两天内注射),然后有一些时间(例如,1、2或3周)没有治疗。如本文所用,“治疗时段”是指当在治疗周期开始时向患者施用ici时的“一个时间点”。治疗和休息时间组成一个“治疗周期”。当患者到达周期结束时,再次开始下一个周期。一系列治疗周期称为“疗程”。
30.如本文所用,术语“免疫检查点抑制剂(ici)”是指单一ici、ici的组合以及ici与另一种癌症疗法的组合。ici可以是单克隆抗体、人源化抗体、全人抗体、融合蛋白或其组合。
31.一方面,本发明涉及用免疫检查点抑制剂(ici)治疗癌症患者的方法,该方法包括以下步骤:
32.(i)对在用所述ici的治疗时段后的时间点从癌症患者获得的选自血浆、全血、血清或外周血单核细胞的血液样本进行分析,以确定响应于用ici治疗由宿主(“癌症患者”)驱动的多种宿主驱动的抗性因子中的一种或多种的水平,所述多种因子的一种或多种以个性化的形式促进癌症患者对用ici治疗的反应性或无反应性;
33.(ii)通过确定在用所述ici的治疗时段之前的时间点从癌症患者获得的步骤(i)的血液样本同一类型的血液样本中的每种所述因子的水平,获得步骤(i)的多种宿主驱动的抗性因子中的一种或多种的每一种的参考水平;
34.(iii)通过将步骤(i)的每种宿主驱动的抗性因子的水平与同一因子的步骤(ii)的参考水平进行比较,确立步骤(i)的多种宿主驱动的抗性因子中的一种或多种的每一种的倍数变化;
35.(iv)基于步骤(iii)中针对步骤(i)的多种宿主驱动的抗性因子中的一种或多种确立的倍数变化,确定癌症患者对用所述ici的治疗具有有利或不利的反应;和
36.(iva)如果基于步骤(iii)中针对多种宿主驱动的抗性因子中的一种或多种确立的倍数变化,癌症患者对用所述ici的治疗具有不利的反应,则在显示出指示所述不利反应的倍数变化的一种或多种宿主驱动的抗性因子中选择主导因子,并且用治疗有效量的ici连同治疗有效量的阻断所选择的主导的宿主驱动的抗性因子(本文为“主导因子”)或其受体的活性的药剂治疗患者;或
37.(ivb)如果基于(iii)中针对多种宿主驱动的抗性因子中的一种或多种确立的倍数变化,癌症患者对用所述ici的治疗具有有利的反应,则继续用单独的ici治疗癌症患者。
38.癌症患者的“有利反应”表示癌症患者对用ici治疗的“反应性”,即用ici治疗反应性癌症患者将导致期望的临床结果,例如肿瘤消退、肿瘤缩小或肿瘤坏死;免疫系统的抗肿瘤反应;预防或延迟肿瘤复发、肿瘤生长或肿瘤转移。在这种情况下,如以上步骤(ivb)中所限定的,可以继续用单独的ici治疗有反应的癌症患者。
39.癌症患者的“不利反应”表明癌症患者对用ici治疗“无反应性”,这是由于宿主驱动的抗性因子的诱导,这些因子可能是促肿瘤发生的,例如促血管生成、促炎/趋化或增殖性生长因子,或促转移因子,因此用ici治疗无反应的癌症患者不会导致期望的临床结果,而是导致非期望的结果,例如肿瘤扩张、复发和转移。为了实现期望的临床结果,有必要阻断如上步骤(iva)中限定的主导因子,并使用ici和阻断所选主导因子的活性的治疗剂的组合来治疗无反应的癌症患者。
40.因此,在一个实施方式中,本发明涉及治疗对用免疫检查点抑制剂(ici)的治疗无反应的癌症患者的方法,该方法包括向癌症患者施用治疗有效量的ici连同治疗有效量的阻断主导因子或其受体的活性的药剂,主导因子在响应于用ici治疗癌症患者产生的多种宿主驱动的抗性因子中选择,多种宿主驱动的抗性因子具有预测癌症患者对用ici治疗的不利反应的倍数变化,其中通过比较以下确立倍数变化:(i)在用ici的治疗时段后从癌症患者获得的选自血浆、全血、血清或外周血单核细胞的血液样本中每种宿主驱动的抗性因子的水平,和(ii)在用所述ici的治疗时段之前从癌症患者获得的与(i)同一类型的血液样本中对于同一因子获得的参考水平。
41.在优选实施方式中,步骤(i)和(ii)中的血液样本都是血浆。
42.在某些实施方式中,用ici的治疗时段是多个治疗时段之一。在某些实施方式中,用ici的多个治疗时段之一是用所述ici的第一治疗时段,步骤(i)的血液样本在所述第一治疗时段后的约20、24、30、36、40、48、50、60、72小时或更长,包括长达一周或更长、长达两周或更长或长达三周或更长从癌症患者获得,并且步骤(ii)的参考血液样本在包括用ici的所述第一治疗时段前约72小时或更短,包括约60、50、48、40、36、30、24或20小时或就在所述第一治疗时段之前的时间点从癌症患者获得。
43.在某些实施方式中,当用ici的治疗开始时,用ici的癌症患者的多个治疗时段之一是第一治疗时段。在这种情况下,步骤(ii)的参考/基线样本(优选血浆)在包括用ici的所述第一治疗时段前约72小时或更短,包括约60、50、48、40、36、30、24或20小时或就在所述第一治疗时段之前在开始治疗之前的时间点从癌症患者获得。然后在血液样本(优选血浆)中确定的因子的浓度水平之间进行比较,该血液样本是在用ici的所述第一治疗时段之后
约20、24、30、36、40、48、50、60、72小时或更长,包括长达一周或更长、长达两周或更长或长达三周或更长的时间从癌症患者获得。
44.在本发明的某些其他实施方式中,用ici的癌症患者的治疗时段是多个治疗时段之一,它并非用ici的第一治疗时段。在这种情况下,血液样本在用ici的两个连续治疗时段之间的任何时间点从癌症患者获得,并且同时用作步骤(i)的血液样本和用于根据步骤(i)的下一个时段分析的根据步骤(ii)的参考血液样本。两个连续治疗时段之间的时间取决于针对具体ici批准的治疗方案,例如可能为2或3周,这取决于ici,并且可以在两个连续时段之间在第1、2、3、7、14或21天获得血液样本。
45.根据本发明,由宿主/癌症患者响应于用免疫检查点抑制剂的治疗而产生的多种因子的水平在从用ici治疗后患者获得的血液样本(优选血浆)中确定。然后将对每种因子获得的值(因子浓度,以pg/ml表示)与参考水平进行比较,参考水平是先前从同一癌症患者获得的血液样本(优选血浆)(以下称为“参考/基线样本”)中确定的同一因子浓度的基线水平。与参考/基线水平相比,从用ici治疗后的癌症患者获得的血液样本中鉴定的一种或多种因子水平的变化由每种因子的倍数变化限定。每种因子的倍数变化是通过计算该因子的治疗:参考/基线值的比率来确定的。
46.如果多种宿主驱动的抗性因子中的一种或多种的每一种的倍数变化的值为约1.5或更高——表示因子的上调,则其倍数变化被认为是显著的,并且预测癌症患者对用ici治疗的不利反应,或如果其值是约0.5或更低——表示因子的下调,则其倍数变化被认为是显著的并且预测癌症患者对用所述ici治疗的有利反应。
47.根据本发明,癌症患者对用ici治疗的有利或不利反应的预测基于一种或更多种,任选地两种或更多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种、七种或更多种、八种或更多种、九种或更多种、十种或更多种、十一种或更多种、十二种或更多种、十三种或更多种、十四种或更多种、或十五种或更多种、二十种或更多种或二十五种或更多种的宿主驱动的抗性因子的显著倍数变化。
48.响应于用ici治疗而引入癌症患者的循环中的因子/生物标志物包括分子因子,例如细胞因子、趋化因子、生长因子、酶和可溶性受体。因子可能是促肿瘤发生或促转移因子。促肿瘤发生因子可以是促血管生成、促炎/趋化或增殖性生长因子。
49.在某些实施方式中,当治疗开始时,治疗时段是癌症患者的多个治疗时段中的第一时段。在这种情况下,比较是在首次开始用ici治疗后从癌症患者获得的血液样本(优选血浆)中确定的因子与在开始用ici治疗之前从癌症患者获得的参考/基线血液样本(优选血浆)中发现的同一因子之间进行的。结果可以帮助治疗患者的医学肿瘤学家决定是否或如何继续癌症患者的治疗。
50.在某些实施方式中,进行本发明的方法监测正在用ici治疗的癌症患者的治疗反应。在这种情况下,治疗时段是数个治疗时段的时段之一,但不是第一时段。结果将帮助医学肿瘤学家决定是否或如何继续治疗。
51.在某些实施方式中,针对促肿瘤发生因子确定的倍数变化预测患者对癌症疗法的有利反应,并且决定可以是按计划用相同的ici继续治疗。
52.在某些实施方式中,针对促肿瘤发生因子确定的倍数变化预测患者对ici的不利反应。在这种情况下,根据促肿瘤发生因子的具体生物学活性,决定可以是用相同的ici继
续治疗,但添加阻断肿瘤发生因子的生物学活性的药物,例如,如果因子是促炎的,则通过在治疗中加入抗炎药,或者如果因子是促血管生成的,则通过在治疗中加入抗血管生成药物。
53.免疫检查点是免疫激活的调节剂。它们在维持免疫稳态和预防自身免疫方面发挥着关键作用。在癌症中,免疫检查点机制经常被激活以抑制新生的抗肿瘤免疫反应。免疫检查点分子被认为是癌症免疫治疗的良好靶标。导致免疫检查点分子阻断的免疫检查点抑制剂(ici)被认为是开发癌症免疫疗法药物的良好候选,其具有用于多种类型癌症的潜力,并且已经在使用或正在开发中。
54.免疫检查点的实例——其作为用于开发免疫检查点抑制剂(ici)药物的靶标的候选,包括具有两个配体pd
‑
l1和pd
‑
l2的pd
‑
1(程序性死亡
‑
1);ctla
‑
4(细胞毒性t淋巴细胞相关蛋白4);a2ar(腺苷a2a受体),也称为adora2a;bt
‑
h3,也称为cd276;bt
‑
h4,也称为vtcn1;bt
‑
h5;btla(b和t淋巴细胞衰减蛋白),也称为cd272;ido(吲哚胺2,3
‑
双加氧酶);kir(杀伤细胞免疫球蛋白样受体);lag
‑
3(淋巴细胞活化基因
‑
3);tdo(色氨酸2,3
‑
双加氧酶);tim
‑
3(t细胞免疫球蛋白结构域和粘蛋白结构域3);vista(t细胞活化的v域ig抑制因子)。
55.在本发明的某些实施方式中,ici是中和/阻断pd
‑
1途径的针对pd
‑
1或pd
‑
l1的单克隆抗体(mab)。在某些实施方式中,抗pd
‑
1mab是派姆单抗(可瑞达(keytruda);以前称为兰洛利珠单抗(lambrolizumab)),批准或测试用于治疗晚期或不可切除的黑素瘤、转移性非小细胞肺癌(nsclc)、肾细胞癌(rcc)和复发性头颈部鳞状细胞癌(scch)。在某些实施方式中,抗pd
‑
1mab是纳武单抗(欧狄沃(opdivo)),批准或测试用于nsclc、rcc、黑素瘤和结肠直肠癌(crc)。在某些实施方式中,抗pd
‑
1mab是匹地利珠单抗(ct0011),批准或测试用于非霍奇金淋巴瘤、慢性淋巴细胞白血病、霍奇金淋巴瘤、多发性骨髓瘤和急性髓性白血病。在某些实施方式中,抗pd
‑
1mab是regn2810、amp
‑
224、medi0680或pdr001。
56.在本发明的某些其他实施方式中,免疫检查点抑制剂是针对pd
‑
l1的mab。在某些实施方式中,抗pd
‑
l1 mab是阿替利珠单抗(tecentriq)、阿维鲁单抗(bavencio)或度伐利尤单抗(imfinzi),批准用于多种癌症。对于多种癌症,阿替利珠单抗正在与一种或两种其他癌症药剂联合进行测试,如贝伐单抗、吉西他滨、顺铂、多烯紫杉醇、紫杉醇、长春氟宁恩提诺特、达雷妥尤单抗、mpdl3280a、卡铂、nab
‑
紫杉醇、二氯化镭
‑
223、阿托珠单抗(obinutuzumab)。
57.在本发明的某些其他实施方式中,ici是针对ctla
‑
4的mab抗体。在某些实施方式中,抗ctla
‑
4是伊匹单抗(yervoy),批准或测试用于晚期/转移性黑素瘤和去势抵抗性前列腺癌。在某些其他实施方式中,抗ctla
‑
4mab是曲美木单抗(tremelimumab)(原名替西木单抗(ticilimumab))。
58.在某些实施方式中,ici是抑制剂,其包括:(i)抗
‑
b7
‑
h3,例如mga271;(ii)抗ido,例如艾卡哚司他(epacadostat);(iii)抗kir,例如lirilumab;(iv)抗lag
‑
3,例如瑞拉利单抗(relatlimab)(bms
‑
986016)、lag 525、regn3767;(v)抗tim
‑
3,例如tsr022或mbg453;和(vi)抗vista,例如jnj 61610588。
59.在某些实施方式中,根据本发明使用两种ici的组合。在某些实施方式中,组合包括抗pd
‑
1和抗ctla
‑
4,例如纳武单抗
‑
伊匹单抗和regn2810
‑
伊匹单抗。在某些实施方式中,
组合包括抗pd
‑
l1和抗ctla
‑
4,例如度伐利尤单抗(durvalumab)
‑
曲美木单抗(tremelimumab)。在某些实施方式中,组合包含抗pd
‑
1和抗pd
‑
l1,例如纳武单抗
‑
阿替利珠单抗(atezolimumab)。在某些实施方案中,组合包含抗lag
‑
3和抗pd
‑
1,例如瑞拉利单抗(relatlimab)
‑
纳武单抗或regn3767
‑
regn2810。在某些实施方式中,组合包括抗pd
‑
1和ido抑制剂,例如派姆单抗和艾卡哚司他和纳武单抗
‑
艾卡哚司他。
60.例如cd137(4
‑
1bb)、cd134(ox40)、糖皮质激素诱导的tnfr(gitr;cd357)和cd40等共刺激分子由活化的t细胞、活化的自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、tregs和其他免疫细胞表达。免疫检查点pd
‑
1的抑制和由激动剂抗体对共刺激分子的刺激是增强免疫反应的互补策略,并因此为联合使用提供了强有力的理由。因此,在某些实施方式中,本发明包括ici与针对t细胞共刺激分子的激动性mab的组合,所述激动性mab包括抗icos mab,例如medi
‑
570或bms
‑
986226;抗ox40 mab,例如moxr0916、khk4083、medi0562或medi6469;抗cd40 mab;和抗cd137(4
‑
ibb)mab,例如乌瑞鲁单抗(urelumab)或utomilumab。
61.在本发明的某些实施方式中,ici与包括化疗、靶向癌症疗法和放疗的一种或多种常规癌症疗法联合施用。已在多项临床试验中研究了ici和放疗的联合。
62.在某些实施方式中,ici与化疗联合使用,其可以使用单一化疗药物或化疗药物的组合,或节拍化疗。派姆单抗+卡铂+紫杉醇、派姆单抗+吉西他滨+多烯紫杉醇、纳武单抗+吉西他滨+顺铂、伊匹单抗+卡铂+紫杉醇的组合,并且其他组合已经过测试或正在临床试验中进行测试。
63.在某些实施方式中,ici疗法与靶向癌症疗法联合使用,靶向癌症疗法有时称为“分子靶向疗法”。在某些实施方式中,靶向疗法药物是小分子,例如硼替佐米(velcade)、舒尼替尼(sutent)。在某些实施方式中,靶向疗法药物是单克隆抗体,如贝伐单抗(avastin)、帕尼单抗(vectibix)、达雷妥尤单抗(darzalex)。在某些实施方式中,抗pd
‑
1与舒尼替尼(sutent)或帕唑帕尼(votrient)——用于治疗rcc——联合使用,或与抗ctla
‑
4伊匹单抗和braf抑制剂达拉非尼(tafinlar)的组合联合使用。
64.在某些实施方式中,ici疗法与抗血管生成疗法联合使用,例如与靶向vegf的mab联合使用。因此,组合可能是伊匹单抗和贝伐单抗的组合。
65.在某些实施方式中,ici疗法与其他免疫疗法联合使用,例如癌症疫苗、免疫调制剂、免疫刺激性细胞因子,例如gm
‑
csf、ifn
‑
α、tgf
‑
β、il
‑
10、il
‑
2、il
‑
12、il
‑
15、il
‑
18和il
‑
21,或溶瘤病毒。在某些实施方式中,抗ctla
‑
4伊匹单抗或抗pd
‑
1派姆单抗与溶瘤病毒talimogene laherparepvec(t
‑
vec)联合使用。
66.根据本发明,癌症疗法涉及疾病的所有阶段的所有类型的癌症(原发性或转移性),包括但不限于原发性或转移性癌症,其包括膀胱癌、骨癌、乳腺癌、脑癌、宫颈癌、结肠癌、结直肠癌、食道癌、胃癌、胃肠道癌、恶性胶质瘤、头颈癌、头颈鳞状细胞癌、肝细胞癌、肾癌、肝癌、肺癌(包括小细胞肺癌和非小细胞肺癌(nsclc))、黑素瘤、鼻咽癌、卵巢癌、胰腺癌、阴茎癌、前列腺癌、皮肤癌、睾丸癌、胸腺癌、甲状腺癌、泌尿生殖癌或子宫癌、白血病、淋巴瘤、多发性骨髓瘤和肉瘤。
67.在某些实施方式中,癌症是白血病——一种身体造血组织的癌症,包括骨髓和淋巴系统。在某些实施方式中,白血病选自是急性淋巴细胞白血病(all)、急性髓细胞白血病(aml)、慢性淋巴细胞白血病(cll)或慢性髓细胞白血病(cml)。在某些实施方式中,癌症是
多发性骨髓瘤。
68.在某些实施方式中,癌症是非小细胞肺癌(nsclc)。在某些实施方式中,癌症是晚期(iii期或iv期)或转移性nsclc。
69.在某些实施方式中,癌症是转移性黑素瘤、肾细胞癌(rcc)、经典霍奇金淋巴瘤(hl)、膀胱癌、默克尔细胞癌、头颈癌或具有错配修复缺陷的实体瘤。
70.在对癌症患者施用免疫检查点抑制剂之后,通过本发明的方法鉴定的宿主驱动的因子/生物标志物特定于:(i)癌症患者;和(ii)免疫检查点抑制剂。这是“宿主反应”,其提供有关癌症患者的具体信息,并允许以个性化形式进行预测,以帮助诊断、计划治疗、找出治疗效果如何或做出预后。
71.如果治疗是使用一种单一ici,则宿主/患者产生的因子是特定于该特定ici的。如果使用两种ici进行治疗,则宿主/患者产生的因子特定于ici的这种组合。如果治疗是使用ici联合另一种癌症治疗,则宿主/患者产生的因子特定于这种组合。
72.在某些实施方式中,生物标志物是分子因子,例如细胞因子、趋化因子、生长因子、酶或可溶性受体。这些因子中的一些诱导影响肿瘤的细胞并促进肿瘤血管生成和癌症再生长,从而促进对所用疗法的抗性。此类细胞的实例包括骨髓衍生细胞(bmdc),其通过细胞因子和生长因子(例如g
‑
csf和sdf
‑
1α)从骨髓区室动员,随后定植于治疗的肿瘤并促进癌症疗法抗性,具体地,但不仅限于,化疗抗性。其他细胞是免疫细胞,如巨噬细胞和抗原递呈细胞,或肿瘤微环境中的基质细胞,它们在肿瘤进展中起关键作用。
73.有助于肿瘤对癌症疗法的抗性的宿主介导的细胞和分子机制基于具体癌症疗法在宿主中产生的因子和/或细胞的生物学功能。每种因子可能表现出一种或多种生物学功能或活性。
74.在某些实施方式中,这些因子是肿瘤发生的并有助于肿瘤生长。在某些实施方式中,肿瘤发生因子是促血管生成的。在其他实施方式中,肿瘤发生因子是促炎/趋化性的。在仍其他实施方式中,肿瘤发生因子是增殖性生长因子。
75.在某些实施方式中,促血管生成因子包括但不限于ang(血管生成素);血管生成素
‑
1;血管生成素
‑
2;bngf(碱性神经生长因子);组织蛋白酶s;半乳糖凝集素
‑
7;gcp
‑
2(粒细胞趋化蛋白,cxcl6);g
‑
csf(粒细胞集落刺激因子);gm
‑
csf(粒细胞
‑
巨噬细胞集落刺激因子,又称集落刺激因子2,csf2);pai
‑
1(纤溶酶原激活物抑制剂
‑
1);pdgf(血小板衍生生长因子),其选自pdgf
‑
aa、pdgf
‑
bb、pdgf
‑
ab;plgf(或plgf,胎盘生长因子);plgf
‑
2;scf(干细胞因子);sdf
‑
1(cxcl12,基质细胞衍生因子
‑
1);tie2(或tie
‑
2,内皮受体酪氨酸激酶);vegf(血管内皮生长因子),其选自vegf
‑
a、vegf
‑
c和vegf
‑
d;vegf
‑
r1;vegf
‑
r2;vegf
‑
r3。
76.在某些实施方式中,促炎和/或趋化因子包括但不限于6ckine(ccl21,exodus
‑
2);血管生成素
‑
1;血管生成素
‑
2;blc(cxcl13,b淋巴细胞趋化因子或b细胞趋化因子1(bca
‑
1);brak(cxcl14);cd186(cxcr6);ena
‑
78(cxcl5,上皮细胞衍生的中性粒细胞激活肽78);嗜酸性粒细胞趋化因子
‑
1(ccl11);嗜酸性粒细胞趋化因子
‑
2(ccl24);嗜酸性粒细胞趋化因子
‑
3(ccl26);epcam(上皮细胞粘附分子);gdf
‑
15(生长分化因子15,也称为巨噬细胞抑制性细胞因子
‑
1,mic
‑
1);gm
‑
csf;gro(生长调节致癌基因);hcc
‑
4(ccl16,人cc趋化因子4);i
‑
309(ccl1);ifn
‑
γ;il
‑
1α;il
‑
1β;il
‑
1r4(st2);il
‑
2;il
‑
2r;il
‑
3;il
‑
3rα;il
‑
5;il
‑
6;il
‑
6r;il
‑
7;il
‑
8;il
‑
8rb(cxcr2,白细胞介素8受体,β);il
‑
11;il
‑
12;il
‑
12p40;il
‑
12p70;il
‑
13;il
‑
13r1;il
‑
13r2;il
‑
15;il
‑
15rα;il
‑
16;il
‑
17;il
‑
17c;il
‑
17e;il
‑
17f;il
‑
17r;il
‑
18;il
‑
18bpa;il
‑
18rα;il
‑
20;il
‑
23;il
‑
27;il
‑
28;il
‑
31;il
‑
33;ip
‑
10(cxcl10,干扰素γ诱导蛋白10);i
‑
tac(cxcl11,干扰素诱导t细胞α趋化因子);lif(白血病抑制因子);lix(cxcl5,脂多糖诱导cxc趋化因子);lrp6(低密度脂蛋白(ldl)受体相关蛋白
‑
6);madcam
‑
1(粘膜地址素细胞粘附分子1);mcp
‑
1(ccl2,单核细胞趋化蛋白1);mcp
‑
2(ccl8);mcp
‑
3(ccl7);mcp
‑
4(ccl13);m
‑
csf(巨噬细胞集落刺激因子,也称为集落刺激因子1(csf1);mif(巨噬细胞迁移抑制因子);mig(xcl9,γ干扰素诱导的单核因子(monokine));mip
‑
1γ(ccl9,巨噬细胞炎性蛋白
‑
1γ);mip
‑
1α(ccl3);mip
‑
1β;mip
‑
1δ(ccl15);mip
‑
3α(ccl20);mip
‑
3β(ccl19);mpif
‑
1(ccl23,骨髓祖细胞抑制因子1);parc(ccl18,肺部活化调节趋化因子);pf4(cxcl4,血小板因子4);rantes(ccl5,调节激活正常t细胞表达和分泌);抵抗素;scf;scyb16(cxcl16,小诱导细胞因子b16);taci(跨膜激活剂和caml相互作用分子);tarc(ccl17,cc胸腺和激活相关趋化因子);tslp(胸腺基质淋巴细胞生成素);tnf
‑
α(肿瘤坏死因子
‑
α);tnf r1;trail
‑
r4(tnf
‑
相关凋亡诱导配体受体4);trem
‑
1(髓系细胞表达的触发受体1)(triggering receptor expressed on myeloid cells 1)。
77.在某些实施方式中,增殖因子包括但不限于激活素a;双调蛋白;axl(axl,受体酪氨酸激酶);bdnf(脑源性神经营养因子);bmp4(骨形态发生蛋白4);组织蛋白酶s;egf(表皮生长因子);fgf
‑
1(成纤维细胞生长因子1);fgf
‑
2(也称为bfgf、碱性fgf);fgf
‑
7;fgf
‑
21;卵泡抑素(fst);半乳糖凝集素
‑
7;gas6(生长停滞特异性基因6);gdf
‑
15;hb
‑
egf(肝素结合egf);hgf;igfbp
‑
1(胰岛素样生长因子结合蛋白
‑
1);igfbp
‑
3;lap(潜在相关肽(latency
‑
associated peptide));ngf
‑
r(神经生长因子受体);nrcam(神经细胞粘附分子);nt
‑
3(神经营养因子
‑
3);nt
‑
4;pai
‑
1;tgf
‑
α(转化生长因子
‑
α);tgf
‑
β;和tgf
‑
β3;trail
‑
r4(tnf相关凋亡诱导配体受体4)。
78.在某些实施方式中,促转移因子包括但不限于adamts1(具有血小板反应蛋白基序的解聚素和金属蛋白酶1);组织蛋白酶s;fgf
‑
2;卵泡抑素(fst);半乳糖凝集素
‑
7;gcp
‑
2;gdf
‑
15;igfbp
‑
6;lif;mmp
‑
9(基质金属肽酶9,也称为92kda明胶酶或明胶酶b(gelb);pro
‑
mmp9;rantes(ccl5);sdf
‑
1(基质细胞衍生因子1,也称为cxcl12)及其受体cxcr4。
79.这些因子也可以是抗肿瘤发生因子,例如抗血管发生、抗炎和/或抗增殖生长因子。
80.在某些实施方式中,指示宿主对ici反应的循环因子包括但不限于adamts1;双调蛋白;axl;ccl5/rantes;ccl17/tarc;egf;嗜酸性粒细胞趋化因子
‑
2;fgf
‑
21;gas6;g
‑
csf;gm
‑
csf;hgf;ifn
‑
γ;il
‑
1rα;il
‑
2;il
‑
6;il
‑
7;il
‑
10;il
‑
12p40;il
‑
13;il
‑
33;i
‑
tac;madcam
‑
1;mcp
‑
5;taci;m
‑
csf;mmp
‑
9;pdgf
‑
bb;pro
‑
mmp9;或scf。
81.根据本发明,响应于抗pd
‑
1治疗而上调的许多因子是促肿瘤发生和促转移过程例如血管生成、炎症、趋化性和增殖中的关键参与者。上调的促血管生成因子包括:g
‑
csf;gm
‑
csf;和pdgf
‑
bb。上调的促炎和/或趋化因子包括:ccl17/tarc;ccl5/rantes;g
‑
csf;gm
‑
csf;ifn
‑
γ;il
‑
1rα;il
‑
2;il
‑
6;il
‑
7;il
‑
10;il
‑
12p40;il
‑
13;il
‑
33和m
‑
csf。上调的增殖性生长因子包括:fgf
‑
21;gas6;和hgf。上调的促转移因子包括:mmp
‑
9。
82.根据本发明,响应于抗pd
‑
l1治疗而上调的许多因子是促肿瘤发生和促转移过程例如炎症;趋化性和增殖中的关键参与者。上调的促血管生成因子包括:g
‑
csf和scf。上调
的促炎和/或趋化因子包括:嗜酸性粒细胞趋化因子
‑
2;g
‑
csf;il
‑
1ra;il
‑
6;il
‑
7;il
‑
33;i
‑
tac;madcam
‑
1;mcp
‑
5;scf和taci。上调的增殖性生长因子包括:双调蛋白;axl;egf和hgf。上调的促转移因子包括:adamts1和pro
‑
mmp9。
83.如本文所用,术语“主导因子”表示可能位于影响对活细胞和活生物体至关重要的生物学过程的信号传导通路上游的有效因子。这些生物学过程包括增殖、炎症、转移等,并且由数种最终导致生物学过程激活或抑制的信号传导通路组成。“信号传导通路”是同一通路中的蛋白质相互传递信号的一系列事件。在通路中的第一蛋白质收到信号后,它激活另一种蛋白质,进而激活另一种蛋白质,依此类推,最终导致一种或多种细胞功能的激活。
[0084]“主导因子”也可能是与许多其他因子/蛋白质高度相互作用和高度影响许多其他因子/蛋白质的关键因子。根据本发明,基于根据文献鉴定因子的蛋白质
‑
蛋白质相互作用的算法来选择主导因子。当一个因子有更多的相互作用时,它就作为一个枢纽(hub),因此它是主导因子。术语“蛋白质
‑
蛋白质相互作用”是指两种或更多种蛋白质之间的物理相互作用或相互干扰,导致信号转导或蛋白质活性的激活或抑制。术语“蛋白质枢纽”是指高度连接的蛋白质,它们在生物学过程中发挥核心和重要作用,因此可能赋予宿主抗性、限制或抵消用癌症疗法模式治疗癌症患者的有效性。
[0085]
术语“阻断”、“中和”或“抑制”在本文中可互换使用,是指药剂防止所选的主导因子发挥其功能/生物学活性的能力。
[0086]
主导因子的实例包括但不限于双调蛋白、egf、egfr、fgf、ifn
‑
γ、il
‑
1β、il
‑
2、il
‑
6、mmp
‑
9、pdgf、tnf
‑
α和vegf
‑
a。
[0087]
为了表明它们作为主导因子的资格,本文提供了这些因子中的一些的性质。白细胞介素
‑
1β(il
‑
1β,il
‑
1b)是il
‑
1家族的细胞因子成员,其由包括巨噬细胞在内的不同免疫细胞产生。它是炎症反应的有效介质(mediator),也已知涉及数种生物学过程,如细胞增殖和凋亡,以及细胞分化。il
‑
1b主要被作为启动促炎级联反应的蛋白质进行研究。它与例如casp1、il1ra、il1r1、cma1、il1rb、il1a、il1r2的酶物理相互作用;与mapk8ip2、znf675和uben2n遗传相互作用;并与a2m、cxcl8、il18、caasp1、il1r1等共表达。因此,il
‑
1b作为与大量蛋白质相互作用的枢纽,这些蛋白质影响包括细胞增殖、凋亡和分化以及炎症和血管生成的多种生物学通路。
[0088]
另一种主导因子是白细胞介素
‑
6(il
‑
6),它是一种细胞因子,主要作为促炎因子,但有时也作为肌肉细胞产生的抗炎因子,并从而下调例如il
‑
1、il
‑
10和tnf
‑
α的许多促炎蛋白。il
‑
6参与许多生物学过程,包括骨形成、血脑屏障的破坏、巨噬细胞活化和先天免疫系统贡献、刺激中性粒细胞和b细胞的合成,还参与神经活动,如紊乱、压力和沮丧。il6与大量蛋白质相互作用并影响大量蛋白质:它与hrh1、osm、il6st、il6r和zbtb16物理相互作用,并被发现与例如ptpre、csf3、ccl2、cxcl8、cxcl3、icam1 sele、nfkbiz等等的许多蛋白质共表达。il6参与由蛋白质介导的多条通路,所述蛋白质例如lrpprc、osm、ptpre、pias1和il6r。因此,il6是作为参与免疫细胞活性、细胞发生和细胞
‑
细胞相互作用的许多生物学过程的主导因子。
[0089]
又一个主导因子,血管内皮生长因子a(vegf
‑
a),是刺激新血管形成的生长因子。它参与血管生成(内皮细胞增殖)和血管发生(骨髓衍生内皮细胞前体及其分化)。vegf对胎儿的胚胎细胞发育和神经元发育很重要,并且参与白细胞增殖和分化、炎症和数种疾病,如
年龄相关性黄斑变性和大多数的癌症。vegf
‑
a与例如nrp1、nrp2、kdr、flt1、pgf、thbs1、sparc、gcp1和vegfc的大量蛋白质物理相互作用;它与sema3f、shb、thbs1、flt1和vegfc共表达;它涉及多种通路的蛋白质,包括pgf、cd2ap、iqgap1、nedd4;并且它影响许多生物学过程,如血管生成、肿瘤发生、细胞活力、增殖和分化。因此,vegf
‑
a被认为是在正常生理条件以及疾病状态下多种生物学过程的主导因子和重要因子。
[0090]
在某些实施方式中,所选的主导因子显示出≥1.5的倍数变化,表明癌症患者对用ici治疗的不利反应,和可以用所述ici联合阻断所述主导因子或其受体的药剂进行患者的治疗。
[0091]
在某些实施方式中,主导因子选自包括双调蛋白、egf、egfr、fgf、ifn
‑
γ、il
‑
1β、il
‑
2、il
‑
6、mmp9、pdgf、tnf
‑
α和vegf
‑
a的因子。
[0092]
在某些实施方式中,主导因子是mmp9,ici是抗pd
‑
1或抗pd
‑
l1单克隆抗体,并且用ici联合包括sb
‑
3ct的mmp
‑
9抑制剂治疗癌症患者。
[0093]
在某些实施方式中,主导因子是双调蛋白,ici是抗pd
‑
1或抗pd
‑
l1单克隆抗体,并且用ici联合抗双调蛋白抗体治疗癌症患者。
[0094]
现在将通过以下非限制性实施例说明本发明。
[0095]
实施例
[0096]
引言
[0097]
如上文中所述,最近的临床研究报道,患者有时可能会对ici产生抗性,或者可能对ici疗法无反应(sharma等,2017)。我们在本文中描述了癌症患者,即宿主,响应于ici疗法产生促肿瘤发生因子,其又有助于肿瘤的再生长、进展和对疗法的抗性。为了鉴定促成这种机制的因素,我们在无荷瘤和荷瘤免疫活性小鼠中执行了体内实验。这种方法使我们能够区分ici的治疗性抗肿瘤活性和这些药物对宿主细胞的影响。我们专注于临床广泛使用的ici,包括抗pd1、抗pd
‑
l1和抗ctl
‑
4单克隆抗体,并使用已知对具体ici有反应或抗性的鼠肿瘤模型。例如,ct26结肠癌和emt
‑
6乳腺癌细胞系分别对抗ctla
‑
4和抗pd
‑
l1有反应(duraiswamy等人,2013年;swart等人,2013年),而mc38结肠癌和4t1乳腺癌细胞系对一些ici(包括抗pd
‑
1)具有抗性或仅适度有反应(de henau等人,2016年;kodumudi等人,2016年),我们实验室也进行了测试(未显示)。
[0098]
材料和方法
[0099]
材料
[0100]
以下抗体购自bioxcell,西黎巴嫩,新罕布什尔州(west lebanon,nh),美国:invivomab抗小鼠ctla
‑
4(目录号be0131);invivomab抗小鼠il
‑
6(目录号be0046);invivomab抗小鼠
‑
pd
‑
1(目录号beo146);invivoplus抗小鼠pd
‑
l1(目录号beo101);和invivomab同种型对照igg2b抗体(目录号be0090)。sb
‑
3ct(iupac名称:2
‑
(((4
‑
苯氧基苯基)磺酰基)甲基)硫杂丙环)购自medkoo biosciences inc(目录号406563)。抗双调蛋白(目录号af989)购自r&d systems。在100%dmso(sigma)中制备10mm sb
‑
3ct储备溶液。对于体内实验,将储备溶液在生理盐水中的10%dmso中稀释至1.25mg/ml的最终浓度。
[0101]
(i)癌症细胞培养物:鼠emt6乳腺癌和ct26鼠结肠癌细胞购自美国菌种保藏中心(atcc,usa)。这些细胞在从真实原种中解冻后培养使用不超过4个月,并定期检测和发现无支原体(ez
‑
pcr支原体检测试剂盒,biological industries,以色列)。emt6细胞在杜氏改
良的伊格尔培养基(dmem)中培养,ct26细胞在rpmi 1640培养基中培养,两者均补充有10%胎牛血清(fbs)、1%l
‑
谷氨酰胺、1%丙酮酸钠和1%青霉素
‑
链霉素(biological industries,以色列)。细胞在37℃下在5%的co2中培养。
[0102]
(ii)动物治疗方案和肿瘤模型:在本研究中使用了未试验过的8
‑
10周龄雌性balb/c、scid或nod
‑
scid小鼠(harlan,以色列)。实验根据technion(海法,以色列)的动物伦理委员会进行。给小鼠腹腔内注射抗pd
‑
1或无关的igg大鼠抗小鼠抗体(bioxcell,西黎巴嫩,新罕布什尔州,美国)。
[0103]
在其他实验中,未试验过的8
‑
10周龄雌性和雄性balb/c或c57bl/6小鼠(harlan,以色列)腹腔内注射抗pd
‑
l1或无关的igg大鼠抗小鼠抗体(bioxcell,西黎巴嫩,新罕布什尔州,美国)。在所有情况下,在1周的时间段内每隔一天以200μg/20gr小鼠的剂量施用抗体(总共注射3次)。
[0104]
为了研究抑制宿主衍生的il
‑
6是否改善抗ctla
‑
4治疗的疗效,将emt6鼠乳腺癌细胞(5
×
105个)原位植入8
‑
10周龄balb/c小鼠的乳腺脂肪垫中。使用公式宽度2×
长度
×
0.5,用游标卡尺定期评估肿瘤大小。在一些实验中,小鼠通过尾静脉注射emt6细胞(25
×
103个)以形成实验性肺转移。每天监测小鼠存活率。当肿瘤达到140mm3的大小时,每三天一次向小鼠(n=5)腹腔内(ip)注射200μg抗ctla
‑
4、200μg抗il
‑
6或两种抗体的组合(总共注射7次)。对照小鼠(n=8)未治疗。定期监测肿瘤生长,并且当肿瘤大小达到1500mm3时,处死小鼠。
[0105]
为了研究抑制宿主衍生的mmp
‑
9是否改善抗pd
‑
l1疗法的疗效,将0.5
×
106个emt6gfp鼠乳腺癌细胞(一种高选择性转移性克隆,称为emt6
‑
f2,之前在munoz等人2006年中对其他细胞系进行描述)原位植入8周龄雌性balb/c小鼠(n=7)的乳腺脂肪垫中。当肿瘤达到100mm3的大小时,给小鼠ip注射200μg抗pd
‑
l1、50μg sb
‑
3ct(mmp
‑
2/mmp
‑
9选择性抑制剂)(kr
ü
ger a.,2005,bonfil rd.,2006年);或抗pd
‑
l1和sb
‑
3ct的组合。用载体对照(25%dmso/65%peg
‑
200/10%pbs)注射对照小鼠或用抗pd
‑
l1单一疗法治疗的小鼠。监测肿瘤生长和小鼠存活率,并在终点(当肿瘤达到约1500mm3大小,或在最大第27天时)处死小鼠。
[0106]
为了确定抑制宿主衍生的双调蛋白是否改善抗pd
‑
l1疗法的疗效,将2
×
106个ct26细胞皮下植入8
‑
10周龄balb/c小鼠的右肋。当肿瘤达到50mm3大小时,每三天给小鼠ip注射200μg抗pd
‑
l1、5μg抗areg(如之前在fujiu k.,2017年中证明的)或抗pd
‑
l1和抗areg的组合。对照小鼠不进行治疗。监测肿瘤生长和小鼠存活率。
[0107]
(iii)通过elisa进行il
‑
6定量:每三天对7周龄的未试验过的雌性balb/c小鼠(n=4)进行腹腔内注射200μg的抗pd
‑
l1或抗ctla
‑
4,总共注射3次。对照小鼠(n=4)未经治疗。最后一次注射后一天,处死小鼠,通过心脏穿刺将血液收集到edta包被的管中。通过在室温下以1300g离心全血10分钟来分离血浆。收集上清液(代表血浆层),并根据制造商的说明通过elisa(il
‑
6小鼠elisa试剂盒,100712abcam)测定il
‑
6的水平。
[0108]
(iv)血浆样本和条件培养基制备:通过心脏穿刺将来自对照igg、抗pd
‑
1或抗pd
‑
l1治疗的小鼠的血液收集到edta包被的管中。随后,通过将全血以1000g、4℃离心20分钟来分离血浆。血浆以等分试样储存在
‑
80℃中直至进一步使用。从igg或抗pd
‑
1治疗的小鼠的股骨冲洗骨髓衍生细胞。将骨髓细胞(1
×
106个细胞/ml)在无血清dmem中培养24小时以产生条件培养基(cm)。
[0109]
(v)抗体阵列:进行了三个蛋白质概况分析实验。在第一实验中,对于每个治疗组
(每组n=5),从igg或抗pd
‑
1治疗的雌性balb/c小鼠中提取的血浆样本被汇集。根据制造商的说明,将样品应用于基于膜的蛋白质组分析仪小鼠xl细胞因子阵列(proteome profiler mouse xl cytokine array)(r&d systems;目录号:ary028)以筛选总共111种因子。在第二实验中,对于每组(每组n=7),从igg或抗pd
‑
l1治疗的雌性或雄性balb/c或c57bl/6小鼠中提取的血浆样本被汇集。根据制造商的说明,将样品应用于基于载玻片的quantibody小鼠细胞因子阵列(quantibody mouse cytokine array)(raybiotech,目录号:qam
‑
caa
‑
4000)以筛选总共200种因子。在第三实验中,对于每组(每组n=7),从igg或抗pd
‑
1治疗的雌性balb/c或scid小鼠中提取的血浆样本被汇集。根据制造商的说明,将样品应用于基于载玻片的quantibody小鼠细胞因子阵列(raybiotech,目录号:qam
‑
caa
‑
4000)以筛选总共200种因子。对于基于膜的阵列,使用透射模式密度计(transmission mode densitometer)和图像分析软件分析显影的x射线胶片上的像素密度。对于基于载玻片的阵列,荧光读数由激光荧光扫描仪检测。在所有情况下,数据都被归一化,阵列上的每种因子的倍数变化通过计算治疗值:对照值的比率来确定。
[0110]
(vi)统计分析:数据表示为平均值
±
标准差(sd)。通过单向方差分析评估差异的统计显著性,然后使用graphpad prism 5软件(la jolla,加利福尼亚州)进行tukey事先(ad hoc)统计检验。当仅比较两组时,在一些实验中使用了学生t检验。将所有组之间的差异相互比较。对于通过elisa进行的il
‑
6定量,通过双尾未配对t检验评估差异的统计显著性。对于肿瘤生长实验,通过多重t检验评估统计显著性。对于存活分析,通过对数秩mantle
‑
cox评估差异。在p值低于0.05时,差异被认为是显著的。
[0111]
实施例1.免疫检查点抑制剂疗法对循环的宿主衍生因子的影响——小鼠中蛋白质概况分析方法
[0112]
先前的实验表明,抗pd
‑
1疗法诱导循环中因子的上调,其最终促进肿瘤细胞的侵袭性。这种影响可能会响应于其他类型的免疫检查点抑制剂疗法而发生。为了鉴定其水平响应于抗pd
‑
1和抗pd
‑
l1疗法而变化的宿主衍生的循环因子,我们使用未试验过(无荷瘤)的小鼠进行了3次基于蛋白质阵列的筛选。使用未试验过的小鼠允许我们鉴定宿主响应于疗法特定产生的因子,而与肿瘤无关。
[0113]
在第一筛选中,在1周时间段内每隔一天向未试验过的8
‑
10周龄的雌性balb/c小鼠(n=3)腹腔内注射200μg/20gr小鼠的剂量的抗pd
‑
1大鼠抗小鼠抗体(bioxcell,西黎巴嫩,新罕布什尔州,美国)(共注射3次)。对照小鼠(n=3)同样地注射相同剂量的大鼠抗小鼠igg抗体。第一次注射后一周,处死小鼠,通过心脏穿刺将血液收集到edta包被的管中。在室温下通过将全血以1300g离心10分钟来分离血浆。每组收集并汇集上清液(代表血浆样品)。在
‑
80℃下储存等分试样直至进一步使用。将血浆样本应用于基于膜的蛋白质组分析仪小鼠xl细胞因子阵列(r&d systems;目录号:ary028)以筛选总共111种因子。阵列检测到的细胞因子、酶和生长因子的完整列表显示在表1中。使用透射模式密度计和图像分析软件分析显影的x射线胶片上的像素密度。分析归一化的数据以鉴定其循环水平响应于抗pd
‑
1治疗而变化的因子。具体而言,通过计算治疗值:对照值的比率来确定每种因子的倍数变化。显示倍数变化大于1.5或小于0.5的因子被分别定义为响应于抗pd
‑
1治疗上调或下调。这些因子及其各自的倍数变化列于表2中。响应于抗pd
‑
1治疗而上调的许多因子是促肿瘤发生和促转移过程(例如血管生成、炎症、趋化性和增殖)中的关键参与者。上调的促血管生成因子
包括:g
‑
csf;gm
‑
csf;和pdgf
‑
bb。上调的促炎和/或趋化因子包括:ccl17/tarc;ccl5/rantes;g
‑
csf;gm
‑
csf;ifn
‑
γ;il
‑
1α;il
‑
2;il
‑
6;il
‑
7;il
‑
10;il
‑
12p40;il
‑
13;il
‑
33;和m
‑
csf。上调的增殖性生长因子包括:fgf
‑
21;gas6;和hgf。上调的促转移因子包括:mmp
‑
9。
[0114]
在第二筛选中,在1周时间段内每隔一天对未试验过的8
‑
10周龄的雌性balb/c、雄性balb/c、雌性c57bl/6或雄性c57bl/6小鼠(每组n=7只小鼠)腹腔内注射200μg/20gr小鼠/注射的剂量的抗pd
‑
l1或对照igg抗体(bioxcell,西黎巴嫩,新罕布什尔州,美国)(共注射3次)。最后一次施用后24小时,处死小鼠,抽血并制备血浆。汇集每组的血浆样本,并根据制造商的说明,应用于基于载玻片的quantibody小鼠细胞因子阵列(raybiotech,目录号:qam
‑
caa
‑
4000)以筛选总共200种因子。阵列检测到的细胞因子、酶和生长因子的完整列表显示在表3中。通过计算治疗值:对照值的比率,确定蛋白质阵列上的每种因子的倍数变化。显示倍数变化大于1.5或小于0.5的因子分别被定义为响应于抗pd
‑
l1治疗上调或下调。这些因子及其各自的倍数变化列于表4中。数据表明,当在不同小鼠品系之间进行比较或在同一品系的雄性和雌性之间进行比较时,上调和下调因子的概况并不完全重叠。这表明对抗pd
‑
l1治疗的反应是基因型依赖性的。这可能反映了已知癌症患者之间也存在的差异,因此为以个性化方式测试患者体内宿主的反应提供了依据。响应于抗pd
‑
l1疗法而上调的许多因子是促肿瘤发生和促转移过程(例如炎症、趋化性和增殖)中的关键参与者。上调的促血管生成因子包括:g
‑
csf;和scf。上调的促炎和/或趋化因子包括:嗜酸性粒细胞趋化因子
‑
2;g
‑
csf;il
‑
1ra;il
‑
6;il
‑
7;il
‑
33;i
‑
tac;madcam
‑
1;mcp
‑
5;scf;和taci。上调的增殖性生长因子包括:双调蛋白;axl;egf;和hgf。上调的促转移因子包括:adamts1和pro
‑
mmp9。
[0115]
为了洞察哪些宿主细胞类型分泌这些促肿瘤发生因子,我们进行了类似的筛选,比较了用抗pd
‑
1或对照igg抗体治疗的balb/c和scid小鼠。scid小鼠在balb/c背景下携带严重联合免疫缺陷(scid)突变,因此缺乏功能性适应性免疫细胞类型(b细胞和t细胞)。在1周时间段内每隔一天对未试验过的8
‑
10周龄的雌性balb/c或scid小鼠(每组n=7只小鼠)腹腔内注射200μg/20gr小鼠/注射的剂量的抗pd
‑
1或对照igg抗体(bioxcell,西黎巴嫩,新罕布什尔州,美国)(共注射3次)。最后一次施用后二十四小时,处死小鼠,抽血并制备血浆。汇集每组的血浆样本,并根据制造商的说明,应用于基于载玻片的quantibody小鼠细胞因子阵列(raybiotech,目录号:qam
‑
caa
‑
4000),以筛选总共200种因子。阵列检测到的细胞因子、酶和生长因子的完整列表显示在表3中。通过计算治疗值:对照值的比率,确定蛋白质阵列上的每种因子的倍数变化。显示倍数变化大于1.5或小于0.5的因子分别被定义为响应于抗pd
‑
1治疗上调或下调。这些因子及其各自的倍数变化列于表5中。发现了响应于抗pd
‑
1治疗而上调的数种因子,其中一些对balb/c具有特异性而对于scid小鼠没有特异性,例如adamts1;双调蛋白、i
‑
tac和scf。这些结果表明,这些具体因子是由适应性免疫系统的细胞响应于抗pd
‑
1治疗而分泌的。
[0116]
总的来说,这些结果表明,抗pd
‑
1和抗pd
‑
l1治疗在宿主中诱导了支持肿瘤进展的反应,这抵消了免疫检查点抑制剂疗法的期望治疗效果。
[0117]
实施例2.在原发性乳腺肿瘤模型中降低宿主衍生的mmp
‑
9水平对ici疗法的影响
[0118]
基质金属蛋白酶9(mmp9)是属于参与细胞外基质降解的锌金属蛋白酶家族的酶。mmp
‑
9参与多种生物学过程,其中有促肿瘤发生和组织再生生物学过程(包括上皮间质转化、细胞增殖、血管生成、骨形成和伤口愈合)。mmp
‑
9是参与侵袭和转移的关键因子之一。由
于其参与癌症中的多种关键优势生物学途径,针对其已开发药物作为抗癌药剂,mmp
‑
9作为响应于ici疗法诱导的主导因子,其抑制可能会改善治疗结果。
[0119]
在用抗pd
‑
1或抗pd
‑
l1治疗后,发现mmp
‑
9在balb/c小鼠中被诱导,这表明:i)mmp
‑
9由未试验过的balb/c小鼠的骨髓衍生细胞响应于抗pd
‑
1治疗而分泌;ii)在未试验过的balb/c小鼠中,响应于抗pd
‑
1治疗,mmp9的血浆水平增加了5.4倍(表2);iii)在未试验过的balb/c小鼠中响应于抗pd
‑
l1治疗pro
‑
mmp
‑
9的血浆水平增加了2
‑
3倍(表4)。为了研究抑制宿主衍生的mmp9是否改善抗pd
‑
1或抗pd
‑
l1疗法的疗效,mmp2/mmp9选择性抑制剂sb
‑
3ct联合抗pd
‑
1或抗pd
‑
l1抗体使用。emt6鼠乳腺癌细胞(5
×
105个)原位植入8周龄balb/c小鼠的乳腺脂肪垫中(harlan,以色列)。使用公式宽度2×
长度
×
0.5,用游标卡尺定期评估肿瘤大小。当肿瘤达到100mm3大小时,将小鼠随机分配到以下治疗组(每组n=6只小鼠):i)对照;ii)抗pd
‑
1单一疗法;iii)抗pd
‑
l1单一疗法;iv)mmp2/mmp9选择性抑制剂sb
‑
3ct单一疗法;v)抗pd
‑
1和sb
‑
3ct联合疗法;和vi)抗pd
‑
l1和sb
‑
3ct联合疗法。抗pd
‑
1、抗pd
‑
l1和igg对照抗体通过每3天以200μg/20g小鼠的剂量腹腔内注射施用。sb
‑
3ct通过每3天以1mg/20g小鼠的剂量腹腔内注射施用。对照小鼠注射igg抗体和载体(生理盐水中10%dmso)。接受抗pd
‑
1或抗pd
‑
l1单一疗法的小鼠也注射了载体(生理盐水中10%dmso)。接受sb3
‑
ct单一疗法的小鼠也注射了igg对照抗体。监测肿瘤生长和小鼠存活率。在终点(当肿瘤达到约1500mm3的大小或直到实验达到27天),处死小鼠。
[0120]
结果表明,如图1a和1b(分别随时间和在第27天(最后一个实验日)的肿瘤体积)所示,与单独用载体、抗pd
‑
l1或sb
‑
3ct治疗的小鼠相比,用抗pd
‑
l1和mmp
‑
2/mmp
‑
9抑制剂sb
‑
3ct的组合治疗的小鼠表现出减小的肿瘤大小。组合治疗优于单独使用抗pd
‑
l1治疗的优势通过个体小鼠的更好反应率证明(图1c,分别为黑色与灰色),其中清楚地表明,以组合治疗进行治疗的8只小鼠中的3只相比于其他小鼠在终点(第27天)表现出减小的肿瘤大小。此外,组合治疗不仅抑制了肿瘤生长,还改善了小鼠的存活率(图1d)。也就是说,与对照小鼠、用抗pd
‑
l1治疗的小鼠或用sb
‑
3ct治疗的小鼠相比,用联合疗法治疗的小鼠表现出更高的存活率。这些结果表明,抑制mmp
‑
2/mmp
‑
9连同抗pd
‑
l1治疗可能会改善治疗效果。
[0121]
实施例3.在原发性乳腺肿瘤模型中降低宿主衍生的双调蛋白水平对ici疗法的影响
[0122]
双调蛋白是表皮生长因子受体(egfr)的配体之一。研究已经证明了双调蛋白在肿瘤发生的数个方面中的功能作用。根据上述实施例1中所述的我们的发现选择双调蛋白,这表明在未试验过的balb/c和c57/bl/6小鼠中,响应于抗pd
‑
l1治疗,双调蛋白的血浆水平增加了2
‑
3倍(表4),以及在balb/c小鼠中响应于抗pd
‑
1治疗,其增加了3.7倍(表5)。
[0123]
已知双调蛋白参与许多对肿瘤发展至关重要的生物学过程,例如增殖、侵袭、血管生成、转移和对细胞凋亡的抗性,这表明它的表达指示对癌症治疗无反应。此外,双调蛋白是重要的促癌受体表皮生长因子受体(egfr)的配体之一。因此,它被认为是具有促肿瘤发生活性的主导因子,其抑制作用可能会改善治疗效果。
[0124]
为了研究抑制宿主衍生的双调蛋白(在balb/c小鼠中响应于抗pd
‑
1或抗pd
‑
l1治疗而上调)是否改善抗pd
‑
l1疗法的疗效,将ct26结肠癌细胞皮下植入balb/c小鼠中。当肿瘤达到50mm3大小时,小鼠用抗pd
‑
l1、抗areg或抗pd
‑
l1和抗areg联合疗法治疗,而对照小鼠则不进行治疗。监测肿瘤生长和小鼠存活率。
[0125]
如图2a所示,与对照小鼠和抗areg治疗的小鼠相比,抗areg联合抗pd
‑
l1治疗表现出较低的肿瘤生长。虽然观察到联合疗法和抗pd
‑
l1治疗的小鼠的平均肿瘤体积之间没有重大差异,但联合疗法在25%的治疗小鼠中表现出完全反应(肿瘤消失),而用抗pd
‑
l1治疗的小鼠没有小鼠表现出这种现象(图2b;垂直虚线代表治疗施用的天数)。组合治疗的更高功效与小鼠的存活率直接相关(图2c)。因此,与对照小鼠、抗pd
‑
l1治疗的小鼠或抗areg单一疗法的小鼠相比,用双调蛋白抑制剂联合抗pd
‑
l1治疗的小鼠显示出更好的存活率。
[0126]
实施例4.响应于ici治疗诱导il
‑
6表达
[0127]
il
‑
6是另一个主导因子,上面已经证明它响应于ici疗法而被高度诱导。如所呈现的,在balb/c小鼠中,il
‑
6响应于抗pd
‑
1治疗增加了15.6倍(表2),在未试验过的balb/c和c57/bl/6小鼠中响应于抗pd
‑
l1治疗增加了1.7
‑
1.8倍(表4)和在scid小鼠中响应于抗pd
‑
1治疗增加了1.8倍(表5)。
[0128]
使用elisa进一步验证了ici治疗后il
‑
6表达的诱导。使用elisa(il
‑
6小鼠elisa试剂盒,ab 100712,abcam)分析注射了抗pd
‑
l1、抗ctla
‑
4或未治疗(对照小鼠)的小鼠血浆中的il
‑
6水平。如图4所示,与其中il
‑
6无法检测(p值分别为0.03和0.02)的对照小鼠相比,用抗pd
‑
l1和抗ctla
‑
4治疗的小鼠表现出明显的il
‑
6浓度诱导(分别为13.4和6.15pg/ml)。由于该实验是使用未试验过的小鼠进行的,它表明il
‑
6是由宿主细胞响应于免疫检查点抑制剂疗法产生的,与肿瘤的存在与否无关。
[0129]
实施例5.阻断抗pd
‑
l1诱导的宿主衍生的il
‑
6抑制原发性肿瘤生长并改善小鼠存活
[0130]
已知il
‑
6参与许多对肿瘤发展至关重要的生物学过程,包括增殖、血管生成、炎症、分化和对细胞凋亡的抗性。此外,il
‑
6是促炎细胞因子,其已被描述为癌症的预后因子。由于il
‑
6位于促炎级联反应的顶部并且已被证明与转移相关,因此它被认为是具有促肿瘤发生和促转移活性的主导因子。
[0131]
出于这个原因,我们测试了阻断宿主衍生的il
‑
6是否会改善抗pd
‑
l1治疗的功效。balb/c小鼠被皮下注射ct26鼠结肠癌细胞。当肿瘤达到50mm3大小时,小鼠被ip注射抗pd
‑
l1、抗il
‑
6或两种抗体的组合,而对照小鼠则不进行治疗。定期监测肿瘤生长,当达到约2000mm3大小时处死小鼠。如图5a所示,与对照、抗pd
‑
l1或抗il
‑
6治疗的小鼠相比(p值分别为0.003、0.192和0.009),用抗pd
‑
l1和抗il
‑
6的组合治疗的小鼠表现出降低的肿瘤生长。当比较单只小鼠中的肿瘤生长时,组合治疗与抗pd
‑
l1或抗il
‑
6治疗相比在抑制肿瘤生长方面的优势更加突出。如图5b所示,用抗pd
‑
l1联合抗il
‑
6治疗的六只小鼠中的四只(57%)显示出对治疗的完全反应并且它们的肿瘤消失,而在抗pd
‑
l1治疗组中六只小鼠中只有一只(16.7%)显示完全反应和肿瘤消失。
[0132]
如图5c所示,与对照、抗pd
‑
l1或抗il
‑
6治疗相比(中位存活分别为31、39.5和31天)(p值分别为0.0026、0.3552和0.0386),抗pd
‑
l1和抗il
‑
6的组合治疗不仅减少了肿瘤生长,而且改善了小鼠的存活(未定义的中位存活),其中40天后的存活率约为70%,相比之下,单独抗pd
‑
l1组的存活率为50%。
[0133]
实施例6.阻断抗ctla
‑
4诱导的宿主衍生的il
‑
6抑制原发性肿瘤生长并改善小鼠存活
[0134]
为了研究阻断响应于抗ctla
‑
4治疗上调的宿主衍生的il
‑
6(如图4所示)是否能改
善治疗功效,将emt6鼠乳腺癌细胞原位注射到balb/c小鼠的乳腺脂肪垫中。当肿瘤达到100mm3大小时,每三天一次给小鼠ip注射抗ctla
‑
4、抗il
‑
6或抗ctla
‑
4和抗il
‑
6的组合(共注射4次)。对照小鼠不进行治疗。定期监测肿瘤生长,当达到1500mm3大小时,处死小鼠。
[0135]
图5a清楚地表明,与对照、单独的抗ctla
‑
4或抗il
‑
6治疗的小鼠相比(p值分别为0.002、0.137和<0.001),组合治疗(抗ctla
‑
4和抗il
‑
6)的抗肿瘤作用增强。此外,用抗ctla
‑
4和抗il
‑
6组合治疗进行治疗的五只小鼠中的三只(60%)显示出对治疗的完全反应,并且它们的肿瘤在约第35天完全消失,相比之下在抗ctla
‑
4组中为一只小鼠,这显示组合治疗不仅抑制肿瘤生长,而且根除肿瘤。
[0136]
阻断宿主衍生的il
‑
6联合抗ctla
‑
4也改善了小鼠的存活。如图5b所示,与用抗ctla
‑
4、抗il
‑
6治疗的小鼠或对照小鼠相比(中位存活分别为49、27和27天)(p值分别为0.076、0.0008和0.0005),用抗ctla
‑
4联合抗il
‑
6治疗的小鼠表现出提高的存活率(未限定中位存活)。
[0137]
附录
[0138]
表1:
[0139]
参与用接受免疫检查点抑制剂抗pd
‑
1疗法的小鼠的血浆进行抗体阵列筛选的111种因子列表
[0140]
[0141][0142]
表2:
[0143]
抗pd
‑
1治疗的vs对照balb/c小鼠中的循环因子水平的倍数变化的总结
[0144]
[0145][0146]
表3:
[0147]
参与用接受免疫检查点抑制剂(抗pd
‑
1和抗pd
‑
l1)疗法的小鼠的血浆进行的抗体阵列筛选的200种因子列表
[0148]
[0149]
表4:
[0150]
抗pd
‑
1治疗的vs对照balb/c和c57bl/6小鼠中的循环因子水平的倍数变化的总结
[0151]
[0152][0153]
表5:
[0154]
抗pd
‑
1治疗的vs对照balb/c和scid小鼠中的循环因子水平的倍数变化的总结
[0155]
chemosensitizing agents.cancer cell.2008;14(3):263
‑
73.
[0181]
sharma p,hu
‑
lieskovan s,wargo ja,ribas a.primary,adaptive,and acquired resistance to cancer immunotherapy.cell.2017;168(4):707
‑
23.
[0182]
swart m,verbrugge i,beltman jb.combination approaches with immune
‑
checkpoint blockade in cancer therapy.frontiers in oncology.2016;6:233.
[0183]
topalian sl,drake cg,pardoll dm.immune checkpoint blockade:a common denominator approach to cancer immunotherapy.cancer cell 2015;27(4):450
‑
61.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1