基于超细氧化铁纳米颗粒的磁共振成像T1造影剂的制作方法
基于超细氧化铁纳米颗粒的磁共振成像t1造影剂
技术领域
1.本发明涉及一种基于超细氧化铁纳米颗粒的磁共振成像(magnetic resonance imaging,mri)t1造影剂,更具体地说,涉及一种基于表面亲水化的均匀尺寸的氧化铁纳米颗粒的磁共振成像t1造影剂。
背景技术:
2.磁共振成像(magnetic resonance imaging,mri)是一种利用氢原子的自旋在磁场中弛豫的现象,将身体的解剖信息、生理信息和生化信息作为图像获取的方法。mri是当前用于对活的人和动物的身体器官进行实时成像的非侵入性诊断工具之一。
3.由于其在生物科学和医学领域的多样化和精确应用,mri是通过将异物引入体内以增加图像对比度来进行的。这些材料称为造影剂。超顺磁性和顺磁性材料被用作造影剂,以对比来自身体部位的信号以通过mri成像,从而可以清楚地区分身体部位与其周围环境。mri图像上的组织之间的对比度是由于组织中的不同弛豫而产生的。弛豫是组织中水分子的核自旋恢复到平衡状态的现象。造影剂影响弛豫以在组织之间产生大的弛豫程度差异并引起mri信号的变化以使组织之间的对比度更清晰。
4.使用造影剂增强对比度会提高或降低来自特定活体器官和组织相对于其周围环境的图像信号强度,以提供更清晰的器官和组织成像。阳性造影剂(或t1造影剂)是指提高mri成像的身体部位的图像信号强度相对于周围环境的造影剂。阴性造影剂(或t2造影剂)是指降低mri成像的身体部位的图像信号强度相对于周围环境的造影剂。更具体地说,mri造影剂分为使用高自旋顺磁性材料的t1造影剂和使用铁磁性或超顺磁性材料的周围磁性不均匀性的t2造影剂。
5.t1造影剂与纵向弛豫有关。纵向弛豫是一种现象,其中自旋z轴方向的磁化分量mz吸收了从x轴施加的rf能量冲击,在xy平面上与y轴对齐,并在能量释放到外部时,返回到其原始值。这种现象也表示为「t1弛豫」。mz恢复到其初始值的63%的时间称为「t1弛豫时间」。t1弛豫时间越短,mri信号越大,显示图像采集时间越短。
6.t2造影剂与横向弛豫有关。自旋z轴方向的磁化分量mz吸收x轴施加的rf能量冲击,在xy平面上与y轴对齐,并在衰减能量或释放能量到周围的自旋的同时返回到其原始值。此时,xy平面上均匀加宽的自旋分量my作为指数函数衰减。这种现象被表示为「t2弛豫」。my恢复到其初始值的37%的时间称为「t2弛豫时间」。my作为时间的函数减小,并由安装在y轴上的接收器线圈测量。测量值称为「自由感应衰减(free induction decay,fid)信号」。具有短t2弛豫时间的组织在mri上显得更暗。
7.目前市售的正mri造影剂、负mri造影剂分别使用顺磁性化合物和超顺磁性纳米颗粒。氧化铁纳米颗粒,例如超顺磁性氧化铁(superparamagnetic iron oxide,spio)纳米颗粒,目前用于t2造影剂。t2对比是一种负对比度,它使目标区域比其周围环境更暗。t2对比的造影效果不是很显着。t2对比的另一个缺点是由于晕染效应,晕染区域比实际区域更大。同时,t1造影剂基于正对比,其优势在于所需部位的图像显得明亮。高自旋材料,通常是在
4f轨道中具有7个孔自旋的钆配合物,高自旋材料用于t1造影剂。
8.基于钆(gadolinium,gd)的造影剂已于1970年代开发出来。然而,从那时起,造影剂的发展就没有显着的技术进步。最近,有报道称,由于游离钆的毒性,基于钆的造影剂会引起不可逆的皮肤和器官硬化等副作用。另一份近期的报告显示,钆永久留存在注射了mri造影剂的患者的脑组织中。在这种情况下,钆造影剂的风险就出现了。尽管慢性肾功能衰竭患者血管疾病的患病率和死亡率很高,但由于存在引起肾源性系统性纤维化的风险,因此gd造影剂被禁止使用。因此,迫切需要开发可安全用于慢性肾功能衰竭患者的mri造影剂。
9.用于超顺磁性材料的氧化铁根据其粒径可分为两种类型:粒径为50nm或更大的超顺磁性氧化铁(superparamagnetic iron oxides,spios)和粒径小于spio的超小超顺磁性氧化铁(ultrasmall superparamagnetic iron oxides,uspios)。较小的uspio往往会在血管中停留更长的时间,因为它不太容易受到血管中巨噬细胞的吞噬作用。基于这种趋势,可以使用uspio来判断血管是否正常。与spio相比,uspio的注射量小,注射速度快。uspio将t1和t2降低到相似的程度,导致t1加权图像中的信号强度增加,且t2加权图像中的信号强度降低。许多造影剂如feridex已被临床使用。大多数这些造影剂是通过共沉淀方法合成的,并且存在结晶度差等局限性,导致其磁性较差和尺寸不均匀。
10.自1990年代后期以来,热解方法得到了新的发展,以合成具有5nm至20nm均匀尺寸的氧化铁纳米颗粒。尽管有报道称通过热解方法合成的氧化铁纳米颗粒比通过共沉淀方法开发的纳米颗粒具有更好的mri t2造影效果,但与t2加权图像相比,t1加权图像优先用于临床应用,因为t1加权图像更准确,且t2加权图像受到严重的信号干扰。由于这些原因,需要开发出t1造影效果与钆基造影剂相当或更好,并且可以替代钆基造影剂的纳米颗粒。
技术实现要素:
11.本发明的一个目的是提供基于均匀核合成技术和表面亲水化技术相结合制备的超细氧化铁纳米颗粒,具有均匀的造影效果,同时在体内保持其均匀的尺寸,因此适用于用于生产有潜力取代传统钆造影剂的t1造影剂。
12.本发明的另一个目的是提供一种使用超细氧化铁纳米颗粒进行多重分析的平台。
13.本发明的另一个目的是提供一种生产用于多重分析的纳米颗粒的方法,其表面用亲水化材料和功能化材料改性。
14.根据本发明的一个方面,提供了一种用于磁共振成像的t1造影剂,包括细氧化铁纳米颗粒核和包封核颗粒的胶束,其中胶束包含非离子表面活性剂,该非离子表面活性剂由含有至少两条链的亲水部分和含有至少一条烃链的疏水部分组成。
15.在本发明的一个实施例中,核可以具有6nm或更小的直径,和0.2或更小的多分散指数(polydispersity index,pdi)。
16.在本发明的另一个实施例中,亲水部分可以包含聚亚烷基二醇链。
17.在本发明的另一个实施例中,非离子表面活性剂可以是聚山梨醇酯表面活性剂。
18.在本发明的另一个实施例中,造影剂可以具有10nm或更小的总直径和0.2或更小的pdi。
19.本发明提供了一种用于多重分析且具有磁共振成像t1造影效果的平台,包括细氧化铁纳米颗粒核和包封核颗粒的胶束,其中在核表面引入接头化合物,並且胶束包括非离
子表面活性剂,该非离子表面活性剂包含至少两条链的亲水部分和含有至少一条烃链的疏水部分。
20.在本发明的一个实施例中,接头可以是诱导点击反应的化合物。
21.在本发明的另一个实施例中,接头可以是在其一端含有疏水部分并且在其另一端含有与点击反应材料结合的亲水部分的两亲化合物。
22.本发明还提供了一种生产用于多重分析的纳米颗粒的方法,包括:提供细氧化铁纳米颗粒核;用诱导点击反应的化合物改性核颗粒;提供包含非离子表面活性剂的胶束溶液,所述非离子表面活性剂由包含至少两条链的亲水部分和包含至少一条烃链的疏水部分组成;将改性核颗粒分散在胶束溶液中,通过配体包封使改性核颗粒具有亲水性;将含有点击反应部分的功能化材料结合到核颗粒的表面以改性核颗粒的表面。
23.在本发明的一个实施例中,可以以核表面上的疏水材料15至25倍摩尔的量过量地使用非离子表面活性剂进行亲水化处理。
24.在本发明的另一个实施例中,功能化材料可以选自由疾病靶向剂、螯合剂、荧光材料及其混合物组成的基团。
25.在本发明的另一个实施例中,该方法还可以包括密度梯度离心。
26.根据本发明的另一方面,提供了一种生产用于多重分析的纳米颗粒的方法,包括:提供细氧化铁纳米颗粒核;提供胶束溶液,其中由含有至少两条链的亲水部分和含有至少一条烃链的疏水部分组成的非离子表面活性剂与含有官能化基团的两亲材料混合;并且将核颗粒分散在胶束溶液中,使得通过配体包封的核颗粒的水解和用功能化材料对核颗粒的表面改性同时进行。
27.在本发明的一个实施例中,该方法还可以包括密度梯度离心。
28.根据本发明的基于超细氧化铁纳米颗粒的mri t1造影剂可以替代现有的钆mri t1造影剂。此外,亲水化确保了纳米颗粒的均匀性,使mri t1造影剂在血液中快速分布,并从体内快速排泄mri t1造影剂。
29.此外,根据用于多重分析的平台和用于生产用于多重分析的纳米颗粒的方法,将含有点击反应部分的功能化材料偶联到氧化铁纳米颗粒平台的表面以改性纳米颗粒平台的表面和表面改性的纳米颗粒平台通过用胶束封装而亲水化。
附图说明
30.图1说明了本发明的氧化铁纳米颗粒的亲水化原理。
31.图2示意性地显示了根据本发明的亲水化氧化铁纳米颗粒的反应。
32.图3示意性地显示了根据本发明的点击反应诱导化合物的应用和亲水化氧化铁纳米颗粒的反应。
33.图4显示了亲水化氧化铁纳米颗粒的储存稳定性,其在实验实施例1中进行了评估。
34.图5显示了亲水化氧化铁纳米颗粒在血清中的储存稳定性,其在实验实施例1中被评估。
35.图6显示了亲水化氧化铁纳米颗粒和剩余胶束的溶液,它们由于密度差异而分离以形成层。
36.图7是显示大规模制备时根据本发明的亲水化氧化铁纳米颗粒的产率的表。
37.图8显示了(a)当大规模制备时根据本发明的亲水化氧化铁纳米颗粒的尺寸和(b)含有亲水化纳米颗粒(b)的溶液的照片。
38.图9显示了证实根据本发明的亲水化氧化铁纳米颗粒的体内分布的图像。
39.图10显示了根据本发明的亲水化氧化铁纳米颗粒的放射性标记、储存稳定性和放射性标记稳定性的结果,证实了亲水化纳米颗粒的体内分布。
40.图11显示了使用本发明的亲水化氧化铁纳米颗粒的大血管的pet和mri的量化数据。
41.图12为实验实施例5中通过蒸发除去所有液体成分后的固相亲水化氧化铁纳米颗粒的照片。
42.图13显示了dls对制备后重新分散预定时间的本发明亲水氧化铁纳米颗粒的结果,以评估亲水氧化铁纳米颗粒对试剂盒的适用性。
43.图14显示了使用本发明亲水化氧化铁纳米颗粒的动物实验结果,以确定在注射亲水化纳米颗粒后,亲水化纳米颗粒在兔子的肝脏、下腔静脉(inferior vena cava,ivc)、左心室(left ventricle,lv)、主动脉、肾脏及肾髓质中的造影效果。
44.图15显示了使用本发明的亲水化氧化铁纳米颗粒的动物实验结果,以比较在注射亲水化纳米颗粒与钆基造影剂后,亲水化纳米颗粒在兔子的肝脏、下腔静脉(inferior vena cava,ivc)、左心室(left ventricle,lv)、主动脉、肾脏及肾髓质中的对比强度。
具体实施方式
45.钆和锰是人体中不自然存在的元素。钆和锰用作造影剂材料残留在体内后会引起永久性沉积和硬皮病等副作用。铁是血红蛋白的中心原子,是人体红血球细胞中与氧结合的重要分子,並且是构成人体的主要元素之一。缺铁性贫血是由缺铁引起的。因此,即使用作造影剂的材料,铁也不太可能对人体产生副作用。特别是,氧化铁纳米颗粒已在临床上用于诊断t2造影剂以诊断肝癌,并且是用于贫血治疗剂和mri造影剂的高度生物相容性材料。
46.用于mri t1造影剂的超细氧化铁纳米颗粒的开发需要一种合成具有均匀尺寸的核的技术和一种在保持其均匀尺寸的同时使核纳米颗粒亲水化的技术。本发明提供了一种基于超细氧化铁纳米颗粒的mri t1造影剂,可以替代现有的钆mri t1造影剂。此外,本发明采用亲水化技术确保纳米颗粒的均匀性,使mri t1造影剂在血液和血管造影中的快速分布至少1小时。现在将详细描述本发明。
47.本文所用的术语「超细氧化铁纳米颗粒」与术语「细氧化铁纳米颗粒」具有相同的含义。如本文所用,术语「亲水化氧化铁纳米颗粒」与术语「亲水氧化铁纳米颗粒」具有相同含义。
48.具体地,本发明提供了一种用于磁共振成像的t1造影剂,包括细氧化铁纳米颗粒核和包封核颗粒的胶束,其中胶束包含非离子表面活性剂,该非离子表面活性剂由含有至少两条链的亲水部分和含有至少一条烃链的疏水部分组成。
49.优选地,核具有6nm或更小的直径和0.2或更小的pdi。当核的尺寸控制在6nm或更小,优选地为4nm至1nm,更优选地为3nm至1.5nm时,分布在纳米颗粒表面的铁离子之间的磁相互作用减弱,结果是纳米颗粒的磁性变为类似于钆的顺磁性。当纳米颗粒的磁性从超顺
磁性转变为顺磁性时,t1造影效果对t2造影效果的干扰消失,使得铁纳米颗粒能够有效地用于t1造影剂。氧化铁纳米颗粒的直径为6nm或更小,优选地为4nm至1nm,更优选地为3nm至1.5nm,并且pdi为0.2或更小,优选地为0.01至0.2,更优选地为0.1至0.2。在这些范围内,可以表现出更好的t1加权造影效果,并且纳米颗粒的尺寸可以在储存过程中保持恒定。
50.核可以通过包括铁作为中心铁原子和c
4-c
25
有机酸基团(羧酸盐)作为与中心原子结合的配体、c
4-c
25
脂肪酸和c
4-c
25
脂肪醇或胺。具体地,核纳米颗粒可以通过以下程序制备。首先,将作为原料的铁络合物、脂肪酸和脂肪醇(或脂肪胺)混合。使混合物能够反应。以5℃/分钟或更高的速率将反应温度从室温升高至150℃至350℃,然后在150℃至350℃下保持5至60分钟。核的大小可以通过改变作为原料的c
4-c
25
脂肪酸与c
4-c
25
脂肪醇或胺的摩尔比来控制。由于细氧化铁纳米颗粒核具有6nm或更小的直径,均匀的尺寸,0.2或更小的pdi以及均匀的分布,因此可以获得恒定的造影效果。
51.优选地,铁络合物包括铁原子和c
4-c
25
有机酸基团作为与中心铁原子结合的配体。配体的实例包括硬脂酸、油酸、亚油酸、棕榈酸、棕榈油酸、肉豆蔻酸、月桂酸、花生四烯酸和山萮酸。优选地,铁络合物可以是油酸铁。c
4-c
25
脂肪酸可以是例如硬脂酸、油酸、亚油酸、棕榈酸、棕榈油酸、肉豆蔻酸、月桂酸、花生四烯酸、蓖麻油酸或山萮酸。c
4-c
25
脂肪醇可以是例如硬脂醇(十八烷醇)、油醇、亚油醇、十六烷醇、棕榈油醇、十四烷醇、十二烷醇、花生四烯醇、二十烷醇、二十二烷醇或十六烷二醇。c
4-c
25
脂肪胺可以是例如硬脂胺(十八胺)、油胺、十六胺、棕榈油胺、十四胺、十二胺或花生四烯胺。最优选地,脂肪酸是油酸,脂肪醇是油醇,脂肪胺是油胺。
52.将氧化铁纳米颗粒用于t1造影剂需要将细氧化铁纳米颗粒亲水化以分散在溶液中,因为氧化铁纳米颗粒核的表面是疏水的,并且需要控制细氧化铁纳米颗粒的尺寸。亲水化可以通过合适的方法完成,例如取代或涂覆。取代过程是指用亲水材料交换纳米颗粒表面的疏水部分的过程,而涂覆过程是指用亲水材料(例如,聚合物或二氧化硅)覆盖纳米颗粒表面的过程。根据常用的取代工艺,配体在有机溶剂中被诸如聚乙二醇-磷酸酯(polyethylene glycol-phosphate,po-peg)之类的材料取代,然后再分散在水中作为新的分散溶剂。po-peg大量用于亲水化。氧化铁纳米颗粒的纯化作为功能化的附加过程是必不可少的,但它会导致产量和过程稳定性方面的问题。另一个问题是在多步反应中可能发生聚集,这取决于末端官能团的极性。此外,在获得最终材料之前,许多批次之间的差异是不可避免的。还已知在亲水化过程中,与核尺寸相比,水合半径变大。总之,传统的取代工艺难以在保持纳米颗粒的超细尺寸的同时使纳米颗粒亲水化。
53.这些问题通过用胶束包封核颗粒以使核颗粒的表面亲水化来解决。胶束包含非离子表面活性剂,该非离子表面活性剂由含有至少两条链的亲水部分和含有至少一条烃链的疏水部分组成。根据本发明,小而均匀的核颗粒与胶束的包封能够使纳米颗粒稳定亲水化而不会聚集,即使在亲水化后也能防止水合半径显着增加,并使核颗粒具有0.2或更小的pdi。因此,纳米颗粒适用于t1造影剂,并且可以大规模制备。
54.非离子表面活性剂可以具有a-o-c(o)-b结构(其中a是亲水部分,b是疏水部分)。亲水部分可以包括两条或更多条链,每条链具有一个或多个末端-oh基团并且包括-o-(ch2)
n-或c
3-c5脂环烃基团。这些基团中的两个或更多个可以任选地彼此结合以形成链结构。链结构可以支化使得端基的数目为2或更多,优选地为2至10,更优选地为2至8。端基可
以是-oh基团。当末端基团的数量在上述范围内时,可以实现改进的亲水性。
55.每个脂环烃基团优选地被能够与溶剂形成氢键的氧、硫或氮原子间断。作为另一个例子,一个或多个双键可以存在于每个脂环烃环中。
56.在每个-o-(ch2)
n-嵌段中,n是1至10,优选地为2至8,更优选地为2至5范围内的整数。在该范围内,可以实现改进的亲水性。每个-o-(ch2)
n-嵌段可以是例如聚乙二醇、聚丙二醇或聚丁二醇。
[0057]-o-(ch2)
n-嵌段可以占部分a的至少80重量%或至少90重量%。部分a在它的链式结构可以包括c
10-c
60
烃基,优选地为c
20-c
50
烃基。当烃基中的碳原子数在上述范围内时,由于空间位阻效应和高亲水性,可以确保纳米颗粒在水溶液中的良好分散稳定性。
[0058]
疏水部分b可以是至少一个烃链,优选地为c
6-c
30
烃链,优选地为c
10-c
20
烃链。烃链可包括具有2个或更多碳原子的脂肪族烃基(例如,烷基、烯基或炔基),具有6个或更多碳原子的芳族烃基(例如,苯基、萘基或芳烷基)或中间或一端具有5个或更多碳原子的脂环烃基(例如,环己基或降冰片烯基)。或者,烃链可包括支链烃链。烃链可以任选地在中间包括一个或多个双键。这种烃链的具体实例可包括单月桂酸酯、单棕榈酸酯、单硬脂酸酯和单油酸酯。
[0059]
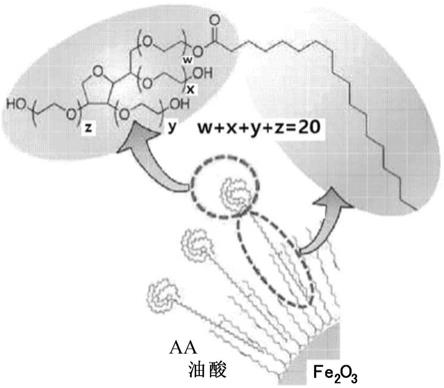
非离子表面活性剂优选地为聚山梨醇酯表面活性剂。具体地,聚山梨醇酯表面活性剂可以是聚山梨醇酯20(聚氧乙烯(20)山梨糖醇单月桂酸酯,吐温(tween)20)、聚山梨醇酯40(聚氧乙烯(20)山梨糖醇单棕榈酸酯,吐温40)、聚山梨醇酯60(聚氧乙烯(20)山梨糖醇单硬脂酸酯,吐温60)或聚山梨醇酯80(聚氧乙烯(20)脱水山梨糖醇单油酸酯,吐温80)。
[0060]
作为非离子表面活性剂的聚山梨醇酯60(聚氧乙烯(20)脱水山梨糖醇单硬脂酸酯,吐温60)具有由式1表示的结构:
[0061]
[式1]
[0062][0063]
其中w、x、y和z是整数。
[0064]
分散稳定的原理可以认为是由于纳米颗粒表面脂肪酸的疏水链与非离子表面活性剂的疏水基团之间的疏水-疏水相互作用,非离子表面活性剂的亲水基团与周围水分子之间的氢键,以及空间位阻效应。
[0065]
图1为以聚山梨醇酯表面活性剂为非离子表面活性剂的氧化铁纳米颗粒分散稳定的原理图。参考图1,聚山梨醇酯非离子表面活性剂的疏水基团与存在于氧化铁纳米颗粒表面上的脂肪酸的疏水基团相互作用并形成键。与周围水分子相互作用的非离子表面活性剂的亲水基团基本上具有聚亚烷基二醇嵌段,优选2个或更多个聚亚烷基二醇嵌段,更优选3个或更多个聚亚烷基二醇嵌段,每个嵌段都具有末端-oh基团。聚亚烷基二醇嵌段形成庞大
的末端亲水基团。例如,式1的吐温60具有其中具有三个末端-oh基团的支化亲水链和c
17
疏水链与酯基键合的结构。结果,由于空间位阻效应和高亲水性,即使在包封氧化铁纳米颗粒后,胶束结构也可以保持稳定而不会聚集。
[0066]
通过将核颗粒加入到含有非离子表面活性剂的胶束溶液中并通过超声处理均匀分散核颗粒,可以用胶束包封核心。优选地以核表面上的疏水材料15至25倍摩尔的量过量地使用非离子表面活性剂进行亲水化处理。如果非离子表面活性剂的量低于下限(即亲水化材料的量少),则亲水化在纳米颗粒没有充分分散和聚集的状态下进行,导致收率低。同时,如果非离子表面活性剂的用量超过上限,则纳米颗粒在亲水化过程中可能会直径增大或发生聚集,从而影响纳米颗粒的后续分离。因此,在核亲水化过程中加入的非离子表面活性剂的量是一个重要因素,需要根据纳米颗粒的尺寸适当调整到上述范围。例如,由于纳米颗粒的表面积随着纳米颗粒尺寸的减小而增加,因此核表面上脂肪酸的疏水基团的数量增加。因此需要加入更大量的与脂肪酸反应的亲水材料。
[0067]
亲水化纳米颗粒的总直径为10nm或更小,优选为8nm至1nm,更优选为8nm至1.5nm,并且pdi为0.2或更小,优选为0.01至0.2,更优选为0.1至0.2。如果直径和pdi超过各自的上限,则不会出现显着的t1加权造影效果,并且难以在人体中获得均匀分布。本发明的造影剂具有与钆基造影剂相似的造影效果,在血液中分布迅速,可用于血管成像至少1小时,并可在对比后通过肾脏和肝脏排泄。
[0068]
本发明还提供了一种用于多重分析且具有磁共振成像t1造影效果的平台,包括细氧化铁纳米颗粒核和包封核颗粒的胶束,其中在核的表面引入了接头化合物,胶束包括非离子表面活性剂,该非离子表面活性剂由含有至少两条链的亲水部分和含有至少一条烃链的疏水部分组成。
[0069]
用点击化合物对核进行表面改性为能够进行多重标记的多重分析提供了平台。接头优选地是诱导点击反应的化合物,更优选地在其一端含有疏水部分并且在其另一端含有与点击反应材料结合的亲水部分的两亲性化合物。接头可以是例如其中具有单链(c
12-c
18
)官能团的化合物,例如氮杂-二苯并环辛炔化合物(例如,adibo或dbco)。这种官能团的例子包括adibo-peg4-c18、adibo-peg2000-dspe、dbco-peg4-c18、dbco-peg2000-dspe、dbco-sa、n3-peg4-c18和n3-peg2000-dspe。特别是,使用dbco-peg2000-dspe的胶束减少了肝脏对纳米颗粒的吸收,并使纳米颗粒在血液中循环长达2小时。
[0070]
可通过将分散在有机溶剂中的纳米颗粒的1至15摩尔%、优选为1至10摩尔%、更优选为1至8摩尔%与具有官能团的点击化合物混合来将接头化合物引入核表面。点击化学反应条件简单,不需要高温、催化剂、酸碱条件等,收率和转化率非常高。
[0071]
本发明还提供了一种生产用于多重分析的纳米颗粒的方法,包括:提供细氧化铁纳米颗粒核;用诱导点击反应的化合物改性核颗粒;提供包含非离子表面活性剂的胶束溶液,所述非离子表面活性剂由包含至少两条链的亲水部分和包含至少一条烃链的疏水部分组成;将改性核颗粒分散在胶束溶液中,通过配体包封使改性核颗粒具有亲水性;将含有点击反应部分的功能化材料结合到核颗粒的表面以改性核颗粒的表面。
[0072]
根据本发明的方法,细氧化铁纳米颗粒核的表面用诱导点击反应的化合物改性,亲水化,并与含有点击反应部分的功能化材料结合,以产生用于多重分析的纳米颗粒,其中采用各种官能团介绍。优选地过量使用相对于核表面上的疏水材料的非离子表面活性剂进
行亲水化15至25倍摩尔。功能化材料选自由疾病靶向剂、螯合剂、荧光材料及其混合物组成的基团。
[0073]
期望该方法进一步包括密度梯度离心。密度梯度离心是将样品置于密度梯度溶液中,离心得到所需颗粒的过程。密度梯度离心能够有效分离不同尺寸的颗粒,这与低产量的柱分离和导致不同尺寸颗粒共沉淀的分级离心不同。密度梯度离心是一种基于密度分离高纯度颗粒的过程。密度梯度离心利用密度梯度溶液分离亲水化纳米颗粒和非亲水化纳米颗粒,选择性分离具有所需尺寸和pdi的纳米颗粒,纯化大量亲水化纳米颗粒。
[0074]
在本发明的方法中,这些步骤可以同时进行,而不是依次进行。
[0075]
本发明还提供了一种生产用于多重分析的纳米颗粒的方法,包括:提供细氧化铁纳米颗粒核;提供胶束溶液,其中由含有至少两条链的亲水部分和含有至少一条烃链的疏水部分组成的非离子表面活性剂与含有官能化基团的两亲材料混合;并且将核颗粒分散在胶束溶液中,使得通过配体包封的核颗粒的水解和用功能化材料对核颗粒的表面改性同时进行。根据本发明的方法,可以通过将诱导点击反应的化合物和功能化材料加入并混合的一步法,用亲水化材料和功能化材料对核纳米颗粒的表面进行改性。在核亲水化过程中胶束溶液,无需单独执行这些步骤。因此,本发明的方法以简单的方式进行,使得能够合成用于大规模多重分析的纳米颗粒。
[0076]
根据本发明的方法,用胶束包封的细氧化铁纳米颗粒核细小且尺寸均匀,并且具有0.2或更小的均匀pdi。通过用包括非离子表面活性剂的胶束封装使核具有亲水性。使用非离子表面活性剂包封核使纳米颗粒的尺寸均匀,即使在亲水化后水合直径也没有显着增加,并使核具有0.2或更低的均匀pdi。此外,纳米颗粒在体外和体内几乎不聚集,表明它们具有良好的储存稳定性。根据本发明的用于磁共振成像的t1造影剂是一种基于细氧化铁纳米颗粒的新型造影剂,可以替代传统的钆基t1造影剂。本发明的基于细氧化铁纳米颗粒的t1造影剂对人体无害,在血液中分布迅速,尺寸均匀,保证了其均匀的造影效果。此外,本发明的t1造影剂能够进行至少1小时至最多2小时的图像观察。均匀大小(100nm或更小)纳米颗粒的亲水化减少了纳米颗粒进入肝脏网状内皮系统的摄取,从而使t1造影剂在血流中停留很长时间,不会在人体中积聚,并通过肾脏和肝脏排泄。因此,本发明的t1造影剂避免了传统钆基造影剂所遇到的问题。
[0077]
如上所述,亲水化可有效减少纳米颗粒进入肝脏网状内皮系统的摄取。纳米颗粒的尺寸决定了发生纳米颗粒吸收的器官以及纳米颗粒在人体中的分布这一事实在本领域中是众所周知的。大小为50nm或更大的纳米颗粒通过肝脏中的库普弗细胞(kupffer cells)在体内迅速积累。即使是小的核纳米颗粒也会聚集,除非它们被充分分散。这种聚集增加了核纳米颗粒进入网状内皮系统的吸收。
[0078]
本发明还提供了用于多重测定的平台和用于多重测定的纳米颗粒的生产方法,其中核用亲水化材料和功能化材料进行表面改性,实现t1造影效果,并且引入了各种官能团。根据本发明,纳米颗粒核的表面可以用亲水化材料和功能化材料通过一步法进行改性,其中在核的亲水化过程中将点击反应诱导化合物和功能化材料添加到胶束溶液中并与其混合。因此,本发明的方法以简单的方式进行。此外,纳米颗粒可以以简单的方式分离和纯化,并且可以高产率制备。因此,本发明的方法适用于用于多重分析的纳米颗粒的大规模生产。
[0079]
以下实施例可以变更为其他几种形式,并不用于限制本发明的范围。提供这些实
施例是为了向本领域技术人员更充分地解释本发明。
[0080]
实施例1-1:3nm超细氧化铁纳米颗粒的制备
[0081]
将1.8克(2毫摩尔)油酸铁、0.57克(2毫摩尔)油酸和1.61克(6毫摩尔)油醇与10克二苯醚混合。将混合物置于圆底烧瓶中。在80℃下将烧瓶抽真空约1小时以除去空气。此后,在氩气流下产生惰性环境。在以10℃/min的速率将温度升高至250℃的同时进行反应。随着反应的进行,反应混合物的颜色变成黑色。在250℃下反应30分钟,得到3nm纳米颗粒,将其快速冷却并用过量丙酮洗涤。将所得沉淀物分散在作为有机溶剂的氯仿或己烷中。
[0082]
实施例1-2:5nm超细氧化铁纳米粒子的制备
[0083]
将1.8克(2毫摩尔)油酸铁和0.28克(1毫摩尔)油酸与10克十八烯混合。将混合物置于圆底烧瓶中。在80℃下将烧瓶抽真空约1小时以除去空气。此后,在氩气流下产生惰性环境。在以10℃/min的速率将温度升高至317℃的同时进行反应。随着反应的进行,反应混合物的颜色变成黑色。在317℃下反应30分钟,得到约5nm纳米颗粒,将其快速冷却并用过量丙酮洗涤。将所得沉淀物分散在作为有机溶剂的氯仿或己烷中。
[0084]
实施例1-3:10nm超细氧化铁纳米颗粒的制备
[0085]
将1.8克(2毫摩尔)油酸铁和0.28克(1毫摩尔)油酸与10克十八烯混合。将混合物置于圆底烧瓶中。在80℃下将烧瓶抽真空约1小时以除去空气。在氩气流下产生惰性环境。在以10℃/min的速率将温度升高至315℃的同时进行反应。随着反应的进行,反应混合物的颜色变成黑色。在315℃下反应30分钟,得到约10nm纳米颗粒,将其快速冷却并用过量丙酮洗涤。将所得沉淀物分散在作为有机溶剂的氯仿或己烷中。
[0086]
实施例2:超细氧化铁纳米颗粒的亲水化
[0087]
通过以下步骤将实施例1-1至1-3中制备的超细氧化铁纳米颗粒(ionps)亲水化。
[0088]
(1)固体ionp:将实施例1-1至1-3中合成的固体ionp进行干燥、称重、分散于氯仿中至20mg/ml的浓度。
[0089]
(2)将1.5、2.2、3、5和10nm超细氧化铁纳米颗粒(ionps)用吐温60和油酸进行亲水化处理,按表1所示的比使用。
[0090]
[表1]
[0091]
比率值t60/oa19.5625(约20倍)
[0092]
在表1中,“oa”是纳米颗粒表面油酸的摩尔数,“t60”是吐温60的摩尔数。摩尔比“t60/oa”为约20,同样适用于所有纳米颗粒。计算出的比率表明,相对于ionp的干重,较小尺寸的纳米颗粒会导致更大量的oa,表明应使用更大量的吐温60。
[0093]
引入到铁纳米颗粒核之一的表面上的oa的量可通过因子f计算,其可从实施例1-1至1-3中的每一个中合成的纳米颗粒的实验值确定。f值如表2所示。
[0094]
[表2]
[0095]
f1.5nm2.2nm3nm5nm10nmm
core
/m
total
0.3989360.4932740.5703420.6887050.815661
[0096]
在表2中,“m
core”代表相对于所有铁纳米颗粒的总干质量的铁组分的质量,“m
total”代表总干质量。也就是说,纯铁的质量可以通过将总质量乘以因子f来计算。表面附着配体的质量可以通过从总质量中减去纯铁的质量来计算,以确定oa的摩尔数。
[0097]
(3)使用(2)中确定的吐温60的量制备胶束溶液。将吐温60溶解在蒸馏水中以制备500-1000ml 5-10%(v/v)的吐温60水溶液,并在60℃超声处理10分钟,直至溶液透明。或者,胶束溶液可以在60℃的恒温器中在搅拌下制备。
[0098]
(4)纳米颗粒用5-10%(v/v)胶束溶液亲水化,并使用超声波仪(ultra-sonicator)均匀分散。将100mg(5ml)的3nm纳米颗粒分散在氯仿中至20mg/ml的浓度后,加入40ml 10%(v/v)胶束溶液中,并在60℃下超声处理10分钟,不透明的棕色(拿铁色)悬浮液变得清澈并变成透明的棕色(美式咖啡色)。此时,将发生反应的溶液置于60℃的搅拌器上,然后再搅拌10分钟以完全去除可能残留的有机溶剂。
[0099]
实施例3:用点击化合物对亲水化超细氧化铁纳米颗粒进行表面改性
[0100]
在本实施例中,亲水化的超细氧化铁纳米颗粒通过以下步骤用点击化合物进行表面改性。
[0101]
(1)固体ionp:将实施例1-1至1-3中合成的固体ionp进行干燥、称重、分散于氯仿中至20mg/ml的浓度。
[0102]
(2)1.5,2.2,3,5,10nm ionp用吐温60和油酸亲水化,按表3所示比例使用,表面用点击化合物(dbco)的官能团改性,其与吐温60的比率如表3所示。
[0103]
[表3]
[0104]
比率值t60/oa19.5625(约20倍)dbco/t600.20754717
[0105]
在表3中,“oa”是纳米颗粒表面油酸的摩尔数,“t60”是吐温60的摩尔数。摩尔比“t60/oa”为约20,同样适用于所有纳米颗粒。计算出的比率表明,相对于ionp的干重,较小尺寸的纳米颗粒会导致更大量的oa,表明应使用更大量的吐温60。
[0106]
1-10mol%dspe-peg2000-dbco用于功能化和表面改性,点击化合物和胶束封装。oa的摩尔数如实施例2中所述计算。
[0107]
(3)使用(2)中确定的tween 60和点击化合物的量制备胶束溶液。将吐温60溶解在蒸馏水中,制备500-1000ml的吐温60的5-10%(v/v)水溶液,在胶束溶液中加入1-10mol%的dspe-peg2000-dbco,超声处理60℃10min至溶液透明。或者,胶束溶液可以在60℃的恒温器中在搅拌下制备。
[0108]
(4)纳米颗粒用5-10%(v/v)胶束溶液亲水化,并使用超声波仪(ultra-sonicator)均匀分散。当100mg(5ml)3nm纳米颗粒在氯仿中分散至20mg/ml浓度时,加入40ml 10%(v/v)胶束溶液中,2mol%dspe-peg2000-dbco相对将吐温60添加到胶束溶液中,并在60℃下超声处理10分钟,不透明的棕色(拿铁色)悬浮液变得澄清并变成透明的棕色(美式咖啡色)。此时,将发生反应的溶液置于60℃的搅拌器上,然后再搅拌10分钟以完全去除可能残留的有机溶剂。
[0109]
实验例1:亲水化氧化铁纳米颗粒的尺寸依赖性体外和体内稳定性的评价
[0110]
在本实验例中,评价了实施例2中制备的亲水化氧化铁纳米颗粒的尺寸依赖性体外和体内稳定性。
[0111]
使用dls仪器分析亲水化纳米颗粒的流体动力学尺寸。多分散指数(polydispersity index,pdi)用作均匀性的量度。具体而言,在室温下在蒸馏水中储存特
定时间后,再次测量1.5nm、2.2nm、3nm、5nm和10nm亲水化氧化铁纳米颗粒的尺寸,以确定它们的体外稳定性得到了维持。此外,将等量的亲水化纳米颗粒分散在人血清中并冷藏。确定亲水化纳米颗粒在储存期间是否沉淀。
[0112]
对储存期间的稳定性进行了约1个月的测试。结果如图4所示。小尺寸的纳米颗粒非常稳定,但10nm的纳米颗粒显示出尺寸逐渐增加的趋势,如图4所示。据信结果是因为较大的尺寸导致更好的沉淀。
[0113]
如图5所示,即使将2.2、3和5nm纳米颗粒分散在人血清中并储存约20天,肉眼也未观察到沉淀或聚集。
[0114]
以上结果表明,本发明方法制备的亲水化氧化铁纳米颗粒在体外和体内均具有高度稳定性。
[0115]
实验例2:亲水化氧化铁纳米颗粒的分离纯化
[0116]
在本实验例中,从实施例2中亲水化后的澄清溶液中分离和纯化亲水化纳米颗粒和胶束。分离通过密度梯度离心进行。
[0117]
具体而言,将澄清溶液在15000rpm和4℃下离心1小时。结果,未参与亲水化的纳米颗粒和未亲水化的纳米颗粒沉降并在底部形成粘性污泥。上述离心条件适用于≥5nm亲水化氧化铁纳米颗粒。或者,《5nm亲水化氧化铁纳米颗粒在40000rpm和4℃下离心1-2小时。
[0118]
使用碘克沙醇(opti-prep)进行离心纯化。当使用10%、30%、40%和60%(w/v)碘克沙醇溶液(opti-溶液)时,由于密度差异在溶液中形成带状层(图5)。当分离后实际pdi值高于预期时,部分溶液在使用前进行透析以完全去除碘克沙醇(opti-prep)。不参与亲水化的胶束没有通过透析去除。
[0119]
实验例3:亲水化氧化铁纳米颗粒的大规模制备和纯化
[0120]
在本实验例中,对中和大型动物实验或评估亲水化氧化铁纳米颗粒的临床和工业应用进行了大规模亲水化。
[0121]
封装前核纳米颗粒的尺寸固定为3nm,然后在相同条件下重复亲水化以确认亲水化产率并评估亲水化后的尺寸。在严格保持表1和表3中所示的t60/oa比率的情况下,一式五份重复执行与之前使用的相同方法。
[0122]
结果如图7所示。从图7中可以看出,获得了平均≥90%的高产率,表明本发明提供了一种非常有效的亲水化方案。特别是,由于即使在不同规模(使用不同数量的起始核)进行亲水化,每轮的数据都显示出非常高且相似的产率,这被认为为未来工业规模制备亲水化氧化铁纳米颗粒提供了很大的优势。
[0123]
所有亲水化纳米颗粒通过dls分析。结果,不仅收率而且亲水化后的尺寸几乎一致(图8(a))。大规模制备的3nm亲水化纳米颗粒如图8(b)所示。
[0124]
实验例4:亲水化氧化铁纳米颗粒的尺寸依赖性在体内分布的确认
[0125]
在本实验例中,证实了亲水化氧化铁纳米颗粒的尺寸依赖性在体内的分布。为此,对具有不同尺寸的亲水化氧化铁纳米颗粒的体内分布进行成像,并通过核医学量化评估图像的可靠性。
[0126]
将实施例2中制备的2.2、3和5nm亲水化氧化铁纳米颗粒储存约2个月,并一式三份(n=3)或更多次进行实验。在每个实验中,亲水化的氧化铁纳米颗粒用cu-64标记。按照同位素协议,以2周的间隔进行实验。
[0127]
实验结果如图9所示。如图9所示,mri图像和pet图像拟合得非常好,表明亲水化材料在循环的同时与同位素标记的核表面保持良好连接。
[0128]
同位素标记通过tlc进行。这种标记也称为放射性标记。同位素标记的示意图和数据显示在图10中。储存稳定性是衡量亲水化纳米颗粒的尺寸是否保持(最多4周)甚至在同位素标记后的量度。此时,放射性标记的稳定性也得到证实。
[0129]
在这些实验中,即使在总共存储2个月后,也证实了类似的pet/mri数据。尽管未显示,但亲水化材料在制备亲水化纳米颗粒后约1年内稳定结合到核材料上而不会分离。
[0130]
图11中所示的量化数据表明,每个时间点的pet信号都显示出与mri信号相似的趋势。
[0131]
实验例5:亲水化氧化铁纳米颗粒对试剂盒的适用性评价
[0132]
在本实验例中,评估了亲水化氧化铁纳米颗粒对试剂盒的适用性。为此,在水溶液中的纳米颗粒在真空下干燥并重新分散后,比较了它们的尺寸和pdi值。
[0133]
将实施例2中制备的3nm亲水化纳米颗粒部分稀释并转移到小瓶中。蒸发水溶液以除去所有液体组分。从图12中可以看出,形成了清晰的圆形带,并且在小瓶底部形成了固相。将固相再分散在蒸馏水(distilled water,dw)中并转移到更大的小瓶中。亲水化氧化铁纳米颗粒的尺寸和pdi通过dls评估。
[0134]
从3nm亲水化纳米颗粒(共87ml)中取出0.5ml,干燥并重新分散在2.5ml蒸馏水中。图13显示了dls对亲水化纳米颗粒的结果。亲水化纳米颗粒的尺寸与再分散前相比几乎没有变化。发现亲水化纳米粒子具有0.2的pdi。z平均值也非常接近原始平均值,表明即使再分散后仍可保持相同的物理特性。
[0135]
实验例6:动物(兔)药理作用实验
[0136]
在本实验例中,将3nm亲水化氧化铁纳米颗粒和钆给予兔后,兔肝脏、下腔静脉(inferior vena cava,ivc)、左心室(left ventricle,lv)、主动脉、肾脏和肾髓质的造影效果为评估。
[0137]
如图14所示,使用3nm亲水化氧化铁纳米颗粒的对比增强mri显示出大约一半的钆对比增强效果。也就是说,顶部的mri图像,圆形心脏部分和血管显得明亮,表明亲水纳米颗粒的t1效应在给药后没有立即消失,不像现有的造影剂,亲水纳米颗粒在血液中循环良好。
[0138]
图15中的试验1、2和3显示了施用3nm亲水氧化铁纳米颗粒3次后获得的结果。这里,x轴代表时间(秒),y轴代表mri信号。从图15可以看出,钆造影剂在注射初期在血管中显示出强信号。此后,钆造影剂分布在器官中并通过肾脏排出体外。相比之下,亲水化的氧化铁纳米颗粒分布在血管中,几乎不泄漏到细胞外液中,这是通过器官中对比度增强的程度来确定的。这意味着3nm亲水化氧化铁纳米颗粒增强了血管对比度约1-2小时。总之,3nm亲水化氧化铁纳米粒子能够长时间观察图像,预计可用于靶向病变的t1造影剂。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1