抗微生物导管组件的制作方法
抗微生物导管组件
1.优先权
2.本技术要求2018年7月2日提交的美国临时申请号62/693,327 的优先权权益,所述美国临时申请的全部内容通过引用并入本技术。
背景技术:
3.导管属于最常用的医疗装置。例如,中央静脉导管(“cvc”) 被常规地放置在患者的脉管系统内,用于快速地递送包括营养物 (nutrient)或药物(例如,化学治疗剂)的流体或准确地测量中央静脉压力。通常,cvc被长时间地留在适当位置。然而,当cvc被留在适当位置时可能出现并发症,比如导管相关的败血症(“crs”),其在如下情况时被导致:定殖(colonize)在此类导管上的细菌迁移入血液并且引起crs的炎性免疫应答特性。以频繁的间隔更换此类导管是应对crs的一种潜在的解决方案,但是频繁地更换导管通常导致更换无需被更换的无菌导管,并且额外的导管插入伴随有其自身的风险。鉴于前述内容,需要抗微生物(antimicrobial)导管以防止可能迁移入血液的细菌菌落。本文公开了解决上述问题的抗微生物导管组件及其方法。
技术实现要素:
4.本文中公开了一种抗微生物导管组件,其在一些实施方案中包括:衬套(hub);连接至衬套的导管管件(catheter tube);连接至衬套的至少一个延伸支腿(extension leg);和在导管组件的内表面、导管组件的外表面或导管组件的内表面和外表面二者上的非洗脱 (non-eluting)抗微生物涂料。衬套包括至少一个衬套内腔,其限定通过导管组件的流体路径的对应的衬套部分。导管管件包括至少一个导管管件内腔,其限定通过导管组件的流体路径的对应的导管管件部分。延伸支腿包括延伸支腿内腔,其限定通过导管组件的流体路径的对应的延伸支腿部分。抗微生物涂料是两层或更多层的复合物。抗微生物涂料包括基于铜的层(copper-based layer)(其在防腐蚀层与导管组件的内表面或外表面之间)、粘合促进层(其在基于铜的层与导管组件的内表面或外表面之间)或其组合。
5.在一些实施方案中,粘合促进层包括粘合促进金属。
6.在一些实施方案中,粘合促进金属促进基于铜的层粘合至聚合物,该聚合物选自聚氨酯、聚碳酸酯、聚乙烯、聚丙烯、聚氯乙烯和硅酮。
7.在一些实施方案中,粘合促进金属选自金、钯和钛。
8.在一些实施方案中,基于铜的层是:基本上纯的铜;铜与金、钯、锌或锡的铜合金;或铜与钨的铜基质复合物。
9.在一些实施方案中,防腐蚀层包括选自金、钯和钛的耐腐蚀金属。
10.在一些实施方案中,抗微生物涂料包括两层,该两层是粘合促进层和基于铜的层。
11.在一些实施方案中,抗微生物涂料包括两层,该两层是基于铜的层和防腐蚀层。
12.在一些实施方案中,抗微生物涂料包括三层,该三层是粘合促进层、基于铜的层和防腐蚀层。
13.在一些实施方案中,抗微生物涂料在导管组件的内表面上,该内表面包括衬套内腔,该衬套内腔限定通过导管组件的流体路径的对应的衬套部分。
14.在一些实施方案中,抗微生物涂料在导管组件的内表面上,该内表面包括延伸支腿内腔,该延伸支腿内腔限定通过导管组件的流体路径的对应的延伸支腿部分。
15.在一些实施方案中,抗微生物涂料在导管组件的外表面上,该外表面包括延伸支腿的远内腔(abluminal)表面,其至少在延伸支腿的近端部分与远端部分之间。
16.在一些实施方案中,抗微生物涂料在导管组件的外表面上,该外表面包括导管管件的经皮区域的远内腔表面。
17.在一些实施方案中,抗微生物导管组件进一步包括连接至延伸支腿的至少一个鲁尔连接器。抗微生物涂料在导管组件的内表面(其包括与流体路径流体连通的鲁尔连接器的内表面)、导管组件的外表面 (其包括鲁尔连接器的外表面)或其组合上。
18.本文还公开了一种抗微生物导管组件,其在一些实施方案中包括:分叉衬套;连接至衬套的导管管件;连接至衬套的成对的延伸支腿;连接至延伸支腿的成对的鲁尔连接器;和在导管组件的内表面、导管组件的外表面或导管组件的内表面和外表面二者上的非洗脱抗微生物涂料。衬套包括成对的衬套内腔,其限定通过导管组件的成对的流体路径的对应的衬套部分。导管管件包括成对的导管管件内腔,其限定通过导管组件的成对的流体路径的对应的导管管件部分。成对的延伸支腿中的每个延伸支腿包括延伸支腿内腔,其限定通过导管组件的成对的流体路径的对应的延伸支腿部分。抗微生物涂料是两层或更多层的复合物。抗微生物涂料包括在防腐蚀层与导管组件的内表面或外表面之间的基于铜的层、粘合促进层(其在基于铜的层与导管组件的内表面或外表面之间)或其组合。
19.在一些实施方案中,粘合促进层促进基于铜的层粘合至聚合物,该聚合物选自聚氨酯、聚碳酸酯、聚乙烯、聚丙烯、聚氯乙烯和硅酮。粘合促进层包括选自金、钯和钛的金属。
20.在一些实施方案中,基于铜的层是:基本上纯的铜;铜与金、钯、锌或锡的铜合金;或铜与钨的铜基质复合物。
21.在一些实施方案中,防腐蚀层包括选自金、钯和钛的耐腐蚀金属。
22.在一些实施方案中,抗微生物涂料包括两层。两层是粘合促进层和基于铜的层,或基于铜的层和防腐蚀层。
23.在一些实施方案中,抗微生物涂料包括三层。三层是粘合促进层、基于铜的层和防腐蚀层。
24.在一些实施方案中,抗微生物涂料在导管组件的内表面上,该内表面包括衬套内腔,该衬套内腔限定通过导管组件的成对的流体路径的对应的衬套部分。
25.在一些实施方案中,抗微生物涂料在导管组件的内表面上,该内表面包括延伸支腿内腔,该延伸支腿内腔限定通过导管组件的成对的流体路径的对应的延伸支腿部分。
26.在一些实施方案中,抗微生物涂料在导管组件的内表面上,该内表面包括每个鲁尔连接器的内表面,每个鲁尔连接器的内表面限定通过导管组件的成对的流体路径的对应的鲁尔连接器部分。替代性地或另外地,抗微生物涂料在导管组件的外表面上,该外表面包括每个鲁尔连接器的外表面。
27.在一些实施方案中,抗微生物涂料在导管组件的外表面上,该外表面包括至少在每个延伸支腿的近端部分与远端部分之间的成对的延伸支腿的远内腔表面。
28.在一些实施方案中,抗微生物涂料在导管组件的外表面上,该外表面包括导管管件的经皮区域的远内腔表面。
29.本文还公开了一种制造抗微生物导管组件的方法,其在一些实施方案中包括:将非洗脱抗微生物涂料施加至导管组件的一个或多个部件的内表面、外表面或内表面和外表面二者上;和连接导管组件的部件以形成导管组件。抗微生物涂料是两层或更多层的复合物,该两层或更多层包括在防腐蚀层与被施加抗微生物涂料的内表面或外表面之间的基于铜的层、在基于铜的层与被施加抗微生物涂料的内表面或外表面之间的粘合促进层或其组合。
30.在一些实施方案中,施加抗微生物涂料包括将粘合促进层施加至导管组件的一个或多个部件中的任何部件的内表面或外表面。粘合促进层通过金属的物理气相沉积、化学气相沉积、电沉积或化学镀沉积被施加至前述内表面或外表面,该金属选自金、钯和钛。被施加粘合促进层的内表面或外表面包括选自聚氨酯、聚碳酸酯、聚乙烯、聚丙烯、聚氯乙烯和硅酮的聚合物。
31.在一些实施方案中,施加抗微生物涂料包括将基于铜的层施加至导管组件的一个或多个部件中的任何部件的内表面或外表面。基于铜的层通过铜、铜合金或铜基质复合物的物理气相沉积、化学气相沉积、电沉积或化学镀沉积被施加至前述内表面或外表面。被施加基于铜的层的内表面或外表面包括聚合物或粘合促进层,该聚合物选自聚氨酯、聚碳酸酯、聚乙烯、聚丙烯、聚氯乙烯和硅酮。
32.在一些实施方案中,施加抗微生物涂料包括将防腐蚀层施加至导管组件的一个或多个部件中的任何部件的内表面或外表面。防腐蚀层通过金、钯或钛的物理气相沉积、化学气相沉积、电沉积或化学镀沉积被施加至前述内表面或外表面。被施加防腐蚀层的内表面或外表面包括基于铜的层。
33.在一些实施方案中,连接导管组件的部件包括:将导管管件插入衬套;将至少一个延伸支腿插入衬套;和将延伸支腿插入至少一个鲁尔连接器以形成导管组件。导管组件具有由导管管件内腔、衬套内腔和延伸支腿内腔的内表面限定的流体路径。
34.鉴于更详细地描述了概念的特定实施方案的附图和以下描述,本文中提供的这种概念的这些和其他特征对于本领域技术人员将变得更显而易见。
附图说明
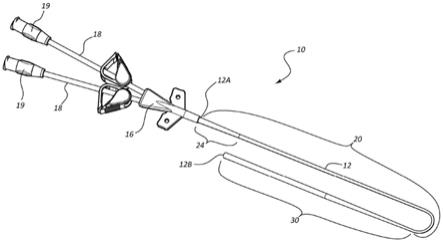
35.图1提供了根据一些实施方案的导管组件的图示。
36.图2提供了图1的导管组件的分叉衬套的图示。
37.图3提供了图1的导管组件的导管管件的经皮区域的图示。
38.图4提供了图1的导管组件的鲁尔连接器的图示。
39.图5展示了根据一些实施方案的导管组件的导管管件的纵向截面。
40.图6展示了根据一些实施方案的连接至导管组件的延伸支腿的鲁尔连接器的截面。
41.图7展示了根据一些实施方案的导管组件的鲁尔连接器的截面。
42.图8展示了根据一些实施方案的导管组件的鲁尔连接器的截面。
43.图9提供了根据一些实施方案的导管组件的图示。
44.图10提供了图9的导管组件的装有阀的(valved)鲁尔连接器的图示。
45.图11展示了在图10的鲁尔连接器的端部上的帽的截面。
46.图12提供了根据一些实施方案的无针连接器的图示。
47.图13提供了根据一些实施方案的可植入进入端口的图示。
48.图14a展示了根据一些实施方案的医疗装置的一部分的纵向截面,该医疗装置在其表面上包括抗微生物涂料。
49.图14b展示了根据一些实施方案的医疗装置的管状部分的横向截面,该医疗装置在其内腔表面上包括抗微生物涂料。
50.图14c展示了根据一些实施方案的医疗装置的管状部分的横向截面,该医疗装置在其远内腔表面上包括抗微生物涂料。
51.图14d展示了根据一些实施方案的导管组件的双内腔导管管件的横向截面,该导管组件在其内腔表面上包括抗微生物涂料。
52.图14e展示了根据一些实施方案的导管组件的双内腔导管管件的横向截面,该导管组件在其远内腔表面上包括抗微生物涂料。
53.图15a展示了根据一些实施方案的医疗装置的一部分的纵向截面,该医疗装置在其表面上包括抗微生物涂料。
54.图15b展示了根据一些实施方案的医疗装置的管状部分的横向截面,该医疗装置在其内腔表面上包括抗微生物涂料。
55.图15c展示了根据一些实施方案的医疗装置的管状部分的横向截面,该医疗装置在其远内腔表面上包括抗微生物涂料。
56.图16a展示了根据一些实施方案的医疗装置的一部分的纵向截面,该医疗装置在其表面上包括抗微生物涂料。
57.图16b展示了根据一些实施方案的医疗装置的管状部分的横向截面,该医疗装置在其内腔表面上包括抗微生物涂料。
58.图16c展示了根据一些实施方案的医疗装置的管状部分的横向截面,该医疗装置在其远内腔表面上包括抗微生物涂料。
59.图17a展示了根据一些实施方案的医疗装置的一部分的纵向截面,该医疗装置在其表面上包括抗微生物涂料。
60.图17b展示了根据一些实施方案的医疗装置的管状部分的横向截面,该医疗装置在其内腔表面上包括抗微生物涂料。
61.图17c展示了根据一些实施方案的医疗装置的管状部分的横向截面,该医疗装置在其远内腔表面上包括抗微生物涂料。
62.图18是针对一组微生物将铜涂覆的鲁尔连接器与氯己定涂覆的鲁尔连接器进行比较的图表。
63.图19是将铜涂覆的鲁尔连接器与未涂覆的无针连接器进行比较的关于来自其的微生物回收(microbial recovery)的图表。
64.图20是对于铜涂覆的鲁尔连接器比较分水层(water-shed layer) 的不同施加的图表。
具体实施方式
65.在更详细地公开一些特定实施方案前,应当理解,本文公开的特定实施方案并不限制本文提供的概念的范围。还应当理解,本文公开的特定实施方案可以具有可以容易地与特定实施方案分离并且可以任选地与本文公开的多个其他实施方案中的任何一个的特征组合或被替代的特征。
66.关于本文中使用的术语,还应当理解,这些术语是出于描述一些特定实施方案的目的,并且这些术语不限制本文提供的概念的范围。序数(例如,第一、第二、第三等)通常被用于区分或标识一组特征或一组步骤中的不同特征或不同步骤,并且不提供序列或数字限制。例如,“第一”、“第二”和“第三”特征或步骤不必按这个顺序出现,并且包括此类特征或步骤的特定实施方案不必局限于这三个特征或步骤。标签比如“左”、“右”、“顶”、“底”、“前”、“后”是为了方便而使用的,并不旨在暗示例如任何特定的固定位置、取向或方向。相反,此类标签被用于反映例如相对位置、取向或方向。单数形式“一种”、“一个”和“该”包括复数引用,除非上下文另有明确指示。
67.例如,关于本文公开的导管的“近侧”、“近侧部分”或“近端部分”包括当导管被用在患者上时预期靠近临床医生的导管部分。同样地,例如,导管的“近侧长度”包括当导管被用在患者上时预期靠近临床医生的导管的长度。例如,导管的“近端”包括当导管被用在患者上时预期靠近临床医生的导管的一端。导管的近侧部分、近端部分或近侧长度可以包括导管的近端;然而,导管的近侧部分、近端部分或近侧长度不需要包括导管的近端。即,除非上下文另有说明,否则导管的近侧部分、近端部分或近侧长度不是导管的末端部分或末端长度。
68.例如,关于本文中公开的导管的“远侧”、“远侧部分”或“远端部分”包括当导管被用在患者上时预期靠近患者或在患者中的导管部分。同样地,例如,导管的“远侧长度”包括当导管被用在患者上时预期靠近患者或在患者中的导管的长度。例如,导管的“远端”包括当导管被用在患者上时预期靠近患者或在患者中的导管的一端。导管的远侧部分、远端部分或远侧长度可以包括导管的远端;然而,导管的远侧部分、远端部分或远侧长度不需要包括导管的远端。即,除非上下文另有说明,否则导管的远侧部分、远端部分或远端长度不是导管的末端部分或末端长度。
69.除非另外定义,否则本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同的含义。
70.如上所述,需要抗微生物导管以防止可能迁移入血液的细菌菌落。本文公开了解决上述问题的抗微生物导管组件及其方法。
71.例如,公开了一种抗微生物导管组件,其在一些实施方案中包括:衬套;连接至衬套的导管管件;连接至衬套的至少一个延伸支腿;和在导管组件的内表面、导管组件的外表面或导管组件的内表面和外表面二者上的非洗脱抗微生物涂料。衬套包括至少一个衬套内腔,其限定通过导管组件的流体路径的对应的衬套部分。导管管件包括至少一个导管管件内腔,其限定通过导管组件的流体路径的对应的导管管件部分。延伸支腿包括延伸支腿内腔,其限定通过导管组件的流体路径的对应的延伸支腿部分。抗微生物涂料是两层或更多层的复合物。抗微生物涂料包括在防腐蚀层与导管组件的内表面或外表面之间的基于铜的层、在基于铜的层与导管组件的内表面或外表面之间的粘合促进层或其组合。
72.鉴于更详细地描述了此类实施方案的附图和以下描述,这些和其他特征对于本领域技术人员将变得更显而易见。
73.抗微生物导管组件
74.首先参考图1和9,每个图描绘了根据一些实施方案的导管组件 (“导管”)10。如所示出的,导管10包括在近端12a与远端12b 之间延伸的细长的导管管件12。导管管件12包括从近端12a向远侧延伸的近侧部分20和从近侧部分的远端向远侧延伸至导管管件12的远端12b的远侧部分30。图1所示的导管10的导管管件12限定配置用于使流体在其中通过的两个导管管件内腔14或成对的导管管件内腔14,而图9所示的导管10的导管管件12限定配置用于使流体在其中通过的一个导管管件内腔14或单个导管管件内腔14。前述导管管件内腔14中的每个导管管件内腔14被指定为图5中的导管管件内腔14,其描绘了导管管件(比如图1或9中的导管10的导管管件12) 的纵向截面。成对的导管管件内腔14中的每个导管管件内腔14被指定为图14d和14e中的导管管件内腔14,其描绘了双内腔医疗装置的管状部分(比如,图1的导管10的导管管件12)的横向截面。在其他类型的导管中,多于两个导管管件内腔14(比如三个导管管件内腔)是可能的。
75.如图3所示,导管管件12包括从衬套16向远侧延伸的近侧部分 20的锥形(tapered)区域24。导管管件12的锥形区域24是导管管件12的在进入患者的静脉或其他脉管前通常在插入部位处穿过患者的皮肤的部分。
76.衬套16被可操作地连接至导管管件12的近端12a和多个延伸支腿18,每个延伸支腿18被指定为图1和9中的延伸支腿18。衬套16 提供了通过衬套16的一定数量的衬套内腔40,该数量等于通过导管管件12的导管管件内腔14的数量和连接至导管10的衬套16的延伸支腿18的数量。图1所示的导管10的衬套16是分叉衬套,在于它限定配置用于使流体在其中通过的两个衬套内腔40或成对的衬套内腔40,而图9所示的导管10的衬套16限定配置用于使流体在其中通过的一个衬套内腔40或单个衬套内腔40。成对的衬套内腔40中的每个衬套内腔40被指定为图2(其描绘了图1中的导管10的分叉衬套 16)或图14d(其描绘了图1的导管10的分叉衬套16的管状远端部分的横向截面)中的衬套内腔40。在其他类型的导管中,多于两个衬套内腔40(比如三个衬套内腔40)是可能的。每个延伸支腿18限定延伸支腿内腔22并且包括连接至其近端的鲁尔连接器19(或另一种合适的连接器),以使得注射器或其他装置能够与导管10可操作地连接。
77.鉴于以上内容,应当理解的是,导管10的各种部件限定一个或多个流体路径,流体可以通过该流体路径行进通过导管10,以借助于导管10将包括营养物或药物的流体输注入静脉、从静脉抽吸血液或其他流体或二者。导管10的流体路径由一个或多个延伸支腿内腔22、衬套16的一个或多个衬套内腔40和导管管件12的一个或多个导管管件内腔14限定。应当理解的是,在其他实施方案中,附加的或其他的部件可以有助于限定导管的流体路径,并且其他侵入式医疗装置可以包括其他类型的流体路径。
78.图2描绘了图1的导管10的分叉衬套16的进一步的细节。如所示出的,分叉衬套16限定其成对的衬套内腔40,成对的衬套内腔40 在导管管件12的成对的导管管件内腔14与成对的延伸支腿18的对应的延伸支腿内腔22之间提供流体连通。同样,图9的导管10的衬套16限定其单个衬套内腔40,单个衬套内腔40在导管管件12的单个导管管件内腔14与单个延伸支腿18的对应的延伸支腿内腔22之间提供流体连通。一个或多个衬套内腔40、一个或多
个导管管件内腔 14和一个或多个延伸支腿内腔22一起限定通过导管10的流体路径的主要(substantial)部分。
79.无论衬套16是图1还是图9的导管10的衬套,衬套16可以由塑料比如热固性塑料或热塑性塑料、硅酮、一种或多种金属、一种或多种陶瓷或玻璃形成。可以形成衬套16的塑料包括聚氨酯、聚碳酸酯、聚氯乙烯(“pvc”)、聚乙烯或聚丙烯。例如,可从俄亥俄州威克利夫的lubrizol公司获得的是可以形成衬套16的热塑性聚氨酯。
80.根据一些实施方案,通过导管10的一个或多个流体路径包括在其内表面44(例如,内腔表面)上或内表面44的一个或多个部分(比如,衬套内腔40、导管管件内腔14、延伸支腿内腔22或其组合的内表面44)上的基本上非洗脱抗微生物涂料42。衬套16的任何衬套内腔40对于传统的抗微生物处理通常是难以实现的。这样,在衬套16 的一个或多个内腔40的内表面44的至少一部分上包括抗微生物涂料 42改进了导管10抵抗微生物定殖的能力。作为前述内容的替代或补充,抗微生物涂料42在导管10的外表面46(例如,远内腔表面)上或外表面46的一个或多个部分(比如,衬套16、导管管件12、延伸支腿18或其组合的外表面46)上。抗微生物涂料42是至少包括基于铜的层的复合物,其配置为提供抗微生物效应,用于抑制微生物在涂覆表面(比如,导管10的一个或多个流体路径的内表面44或导管10 的一个或多个部件的外表面46)上的稳固(establish)或存活。这样,医疗装置(比如,图1或图9的导管10)的各种表面中的任何表面可以被涂覆有抗微生物涂料42,各种表面是导管10的前述内表面44 和外表面46的一部分或独立于导管10的前述内表面44和外表面46。
[0081]“基本上非洗脱”意指仅仅相对小量的金属(比如,铜)从抗微生物涂料42被释放入抗微生物涂料42周围的流体。在一些实施方案中,例如,抗微生物涂料42释放铜颗粒,这引起与抗微生物涂料42 接触的流体(比如,体液)中的铜浓度不超过约1.5ppm。这种释放可以根据各种因素变化,包括医疗装置的表面组成、抗微生物涂料42 被暴露于的流体的类型、抗微生物涂料42的一层或多层的厚度、抗微生物涂料42中外覆层(overcoat)的存在等。
[0082]
图14a、15a、16a和17a各自展示了根据一些实施方案的医疗装置(比如,导管10)的一部分的纵向截面,该医疗装置在其表面上包括抗微生物涂料42。部分医疗装置可以是导管10的导管管件12、衬套16或一个或多个延伸支腿18,并且表面可以是内表面44、外表面46或内表面44和外表面46二者。图14b至14e、15b、15c、16b、 16c、17b和17c展示了根据一些实施方案的医疗装置(比如,导管 10)的管状部分的横向截面,该医疗装置包括抗微生物涂料42。图 14b、14d、15b、16b和17b展示了在显示的医疗装置的管状部分的内表面或内腔表面44上的抗微生物涂料42,而图14c、14e、15c、 16c和17c展示了在显示的医疗装置的管状部分的外表面或远内腔表面46上的抗微生物涂料42。
[0083]
同样,抗微生物涂料42是两层或更多层的复合物。至少,抗微生物涂料42包括基于铜的层102。任选地,抗微生物涂料42包括外覆层108,其中基于铜的层102在医疗装置的表面与外覆层108之间,从而形成图14a中所示的抗微生物涂料42a。图14b展示了在单内腔医疗装置的管状部分的内表面或内腔表面44(比如,图9的导管 10的导管管件12、衬套16的远端部分或延伸支腿18的内腔表面44) 上的抗微生物涂料42a,而图14c展示了在导管10的前述管状部分的外表面或远内腔表面46上的抗微生物涂料42a。图14d展示了在双内腔医疗装置的管状部分的内表面或内腔表面44(比如,图1的导管10的导管管件12或衬套16的远端部分的内腔表面44)上的抗微生物涂料42a,而图14e展示了在导管10的前述管状部分的外表
面或远内腔表面46上的抗微生物涂料42a。虽然未显示,抗微生物涂料42a可以在导管10的前述管状部分的内表面44和外表面46二者上。
[0084]
基于铜的层102是基本上纯的铜、铜合金或铜基质复合物。铜合金包括铜和金(例如,玫瑰金)、钯、锌(例如,黄铜)或锡(例如,青铜)。铜基质复合物包括铜基质和分散在铜基质中的钨。
[0085]
外覆层108被配置为防止抗微生物涂料42由于氧化而锈蚀。外覆层108包括由美国罗得岛州普罗维登斯的technic有限公司制造的
[0086]
除了抗微生物涂料42的基于铜的层102之外,抗微生物涂料42 可以包括粘合促进层104,其中粘合促进层104在医疗装置的内表面或外表面与基于铜的层102之间,从而形成图15a中所示的抗微生物涂料42b。任选地,抗微生物涂料42b包括外覆层108,使得基于铜的层102在粘合促进层104与外覆层108之间。图15b展示了在单内腔医疗装置的管状部分的内表面或内腔表面44(比如,图9的导管 10的导管管件12、衬套16的远端部分或延伸支腿18的内腔表面44) 上的抗微生物涂料42b,而图15c展示了在导管10的前述管状部分的外表面或远内腔表面46上的抗微生物涂料42b。抗微生物涂料42b 在双内腔医疗装置(比如图1的导管10)的管状部分的内表面44或外表面46上未显示,但是应当理解,抗微生物涂料42b可以被施加至此类医疗装置的内表面44或外表面46,导致双内腔医疗装置的横向截面类似于具有抗微生物涂料42b的图14d和14e的横截面。虽然未显示,抗微生物涂料42b可以在导管10的前述管状部分的内表面44和外表面46二者上。
[0087]
粘合促进层104促进将基于铜的层102粘合至医疗装置的内表面 44或外表面46,该表面可以是选自聚氨酯、聚碳酸酯、聚乙烯、聚丙烯、聚氯乙烯和硅酮的聚合物。粘合促进层104包括粘合促进金属,该粘合促进金属包括贵金属(例如,金、钯、银、铱或铂)、具有相对高的耐腐蚀性的金属(例如,钛)或前述金属中的一种的合金。
[0088]
除了抗微生物涂料42的基于铜的层102之外,抗微生物涂料42 可以包括防腐蚀层106,其中基于铜的层102在防腐蚀层106与医疗装置的内表面或外表面之间,从而形成图16a中所示的抗微生物涂料 42c。任选地,抗微生物涂料42c包括外覆层108,使得防腐蚀层106 在基于铜的层102与外覆层108之间。图16b展示了在单内腔医疗装置的管状部分的内表面或内腔表面44(比如,图9的导管10的导管管件12、衬套16的远端部分或延伸支腿18的内腔表面44)上的抗微生物涂料42c,而图16c展示了在导管10的前述管状部分的外表面或远内腔表面46上的抗微生物涂料42c。抗微生物涂料42c在双内腔医疗装置(比如图1的导管10)的管状部分的内表面44或外表面46上未显示,但是应当理解,抗微生物涂料42c可以被施加至此类医疗装置的内表面44或外表面46,导致双内腔医疗装置的横向截面类似于具有抗微生物涂料42c的图14d和14e的横向截面。虽然未显示,抗微生物涂料42c可以在导管10的前述管状部分的内表面 44和外表面46二者上。
[0089]
防腐蚀层106防止基于铜的层102的腐蚀。防腐蚀层106包括耐腐蚀金属,该耐腐蚀金属包括贵金属(例如,金、钯)、具有相对高的耐腐蚀性的金属(例如,钛)或前述金属中的一种的合金。如上所述,基于铜的层102可以包括铜和金或钯的铜合金。由于金和钯是贵金属,这样的基于铜的层102被配置为具有至少一些耐腐蚀性。因此,当基于铜的层是铜和金或钯的铜合金时,抗微生物层42不需要具有防腐蚀层106。
[0090]
抗微生物涂料42可以包括粘合促进层104和防腐蚀层106二者,其中基于铜的层
102在粘合促进层104与防腐蚀层106之间,并且其中粘合促进层104在基于铜的层102与医疗装置的内表面或外表面之间,从而形成图17a中所示的抗微生物涂料42d。任选地,抗微生物涂料42d包括外覆层108,使得防腐蚀层106在基于铜的层102与外覆层108之间。图17b展示了在单内腔医疗装置的管状部分的内表面或内腔表面44(比如,图9的导管10的导管管件12、衬套16的远端部分或延伸支腿18的内腔表面44)上的抗微生物涂料42d,而图 17c展示了在导管10的前述管状部分的外表面或远内腔表面46上的抗微生物涂料42d。抗微生物涂料42d在双内腔医疗装置(比如图1 的导管10)的管状部分的内表面44或外表面46上未显示,但是应当理解,抗微生物涂料42d可以被施加至此类医疗装置的内表面44或外表面46,导致双内腔医疗装置的横向截面类似于具有抗微生物涂料42d的图14d和图14e的横向截面。虽然未显示,抗微生物涂料42d 可以在导管10的前述管状部分的内表面44和外表面46二者上。
[0091]
抗微生物涂料42被配置为基本上不将金属比如铜洗脱入由医疗装置比如导管10承载的流体或暴露于医疗装置的体液。实际上,当抗微生物涂料42被暴露于0.9%盐水和0.157μg乙醇的溶液持续约24 小时的时段时,从鲁尔连接器19的内部流体承载表面上的抗微生物涂料42的基本上铜的基于铜的层102洗脱的铜总计约0.210μg。从鲁尔连接器19洗脱的铜的量占鲁尔连接器上的抗微生物涂料42的总计铜含量的大约0.009%,因此证明基本上非洗脱。
[0092]
包括粘合促进层104、基于铜的层102或防腐蚀层106的抗微生物涂料42的每层通过金属的物理气相沉积、化学气相沉积、电沉积或化学镀沉积被施加至医疗装置的内表面或外表面,以产生抗微生物涂料42的基本上均匀的相对薄层。抗微生物涂料42的每层足够薄,使得在包括抗微生物涂料42的医疗装置的正常使用下不发生抗微生物涂料42的层的剥落或磨掉。抗微生物涂料42的每层可以具有小于约1.0μm的厚度,包括小于约0.8μm的厚度,比如小于约0.6μm的厚度,例如小于约0.5μm的厚度,这为抗微生物涂料42提供了约2.0 μm(对于双层抗微生物涂料42)至约3.0μm(对于三层抗微生物涂料42)范围内的厚度。即便如此,抗微生物涂料42的每层不限于小于约1.0μm,并且抗微生物涂料42不限于小于约2.0μm至约3.0μm 的厚度。实际上,抗微生物涂料42的厚度可以根据多种因素变化,包括抗微生物涂料42的期望有效寿命、抗微生物涂料42的期望抗微生物效力水平、医疗装置的留置时间、防止一个或多个流体路径中的阻塞的一个或多个流体路径的尺寸限制等。
[0093]
可以采用其他施加技术以在医疗装置的内表面或外表面上沉积抗微生物涂料42的一层或多层,包括电镀、离子束沉积或溅射。施加抗微生物涂料42的不同表面受益于特定的施加技术。例如,包括导电聚合物的金属表面和塑料表面受益于在其上电镀基于铜的层 102。陶瓷表面等受益于在其上喷涂基于铜的层102。
[0094]
当存在抗微生物涂料42的外覆层108时,通过将包括抗微生物涂料42的一个或多个其他层的医疗装置的部件浸入包含丁氧基乙醇和丁氧基乙氧基乙醇的溶液中持续预定的时间而施加外覆层108。
[0095]
虽然抗微生物涂料42被配置为通过接触灭杀微生物而维持医疗表面的内表面或外表面基本上没有此类微生物,但是可以结合抗微生物涂料42使用其他抗微生物措施。例如,分叉衬套16的衬套内腔40 的内表面44可以包括抗微生物涂料42,而至少导管管件12的导管管件内腔14的内表面44包括不同的抗微生物涂料比如由抗微生物溶液提供的。这样,
抗微生物涂料42可以与相同或不同的医疗装置位置中的其他抗微生物措施协同作用以提供抗微生物保护。
[0096]
如上所述,在各种医疗装置位置中采用抗微生物涂料42,包括医疗装置(比如,图1或图9的导管10)的内表面或外表面。图2至8 和10至13进一步详述了可以采用抗微生物涂料42的此类医疗装置位置的各种非限制性实施例。
[0097]
如上所述,图2描绘了图1的导管10的分叉衬套16,该分叉衬套提供了其成对的衬套内腔40,用于导管管件12的成对的导管管件内腔14与成对的延伸支腿18的对应的延伸支腿内腔22之间的流体连通。同样,图9的导管10的衬套16提供了其单个衬套内腔40,用于导管管件12的单个导管管件内腔14与单个延伸支腿18的对应的延伸支腿内腔22之间的流体连通。成对的衬套内腔40或单个衬套内腔40可以在其内表面或内腔表面44上包括抗微生物涂料42。
[0098]
在图3中,邻近分叉衬套16的导管管件12的锥形部分24的外表面或远内腔表面46可以包括在其上的抗微生物涂料42。锥形部分 24也被称为“经皮区域”,因为导管管件12的这个部分在插入部位处延伸通过患者的皮肤并且进入患者的静脉或其他脉管。锥形区域24 的外表面的抗微生物涂料42可以用于防止微生物从插入部位处的皮肤迁移至在患者的静脉或其他脉管中的导管管件12的其余部分。应当理解的是,锥形部分24的一个或多个内表面44(例如,内腔表面) (以及导管管件12的其他内表面或外表面)也可以包括抗微生物涂料42。
[0099]
图4、6、7和8示出了鲁尔连接器19可以在鲁尔连接器19的内表面44、外表面46或内表面44和外表面46二者上包括抗微生物涂料42,内表面44与导管10的流体路径的其余部分流体连通。将抗微生物涂料42施加至连接器19有助于防止微生物在包括抗微生物涂料 42的鲁尔连接器的内表面或外表面上的形成和增殖。由于临床医生或导管10的其他使用者的相对广泛的物理接触,连接器比如鲁尔连接器19可以尤其易受微生物污染。这样,抗微生物涂料42可以尤其适合于在鲁尔连接器19或在手术期间经历相对广泛的物理接触的医疗装置的其他部分上。
[0100]
作为抗微生物层42的基于铜的层102的替代方案,图8示出了具有用于内表面44的含铜插入件90的鲁尔连接器19。含铜插入件 90连同上面叙述的抗微生物层42的一个或多个附加层提供基本上非洗脱的抗微生物涂料42,其配置为提供接触杀灭抗微生物效应,从而免于微生物在其中的形成或增殖。各种医疗装置或其部件可以在其一个或多个位置中使用这种含铜插入件,以提供抗微生物层42的基于铜的层102。通过与含铜插入件90一起嵌件模制(insert molding),含铜插入件90可以被引入至医疗器械或其部件(例如,鲁尔连接器 19)。这种含铜插入件也可以被包括在挤压部件中,比如图1的导管 10的成对的延伸支腿18或导管管件12。
[0101]
除了鲁尔连接器19之外,图6还示出了图9的导管10的延伸支腿18的内表面或内腔表面44或图1的导管10的成对的延伸支腿18 的内表面或内腔表面44可以包括抗微生物涂料42。抗微生物涂料42 可以防止微生物从鲁尔连接器19的内表面44通过连接鲁尔连接器19 的导管10的延伸支腿18向远侧迁移。虽然图6中未显示,图9的导管10的延伸支腿18的外表面或远内腔表面46或图1的导管10的成对的延伸支腿18的外表面或远内腔表面可以替代性地或另外地至少在其近端部分与远端部分之间包括抗微生物涂料42。类似于连接器比如
鲁尔连接器19,由于临床医生或导管10的其他使用者的相对广泛的物理接触,类似延伸支腿18的延伸支腿的外表面或远内腔表面可能尤其易受微生物污染。
[0102]
图9和10示出了具有柔性阀60的鲁尔连接器19,其包括在鲁尔连接器19的一个或多个表面上的抗微生物涂料42。鲁尔连接器19 的内表面44、外表面46或内表面和外表面二者包括抗微生物涂料42。如图10中最佳所示的,抗微生物涂料42被布置在仅鲁尔连接器19 的本体的外表面44的近侧半部上,但是外表面46的整体以及内表面 44可以被独立地涂覆。替代性地或另外地,抗微生物涂料42被布置在阀60本身的表面上。
[0103]
图11示出了用于可移除地覆盖鲁尔连接器19的螺纹端的螺纹帽 64可以包括抗微生物涂料42。实际上,帽64的内表面44和外表面 46均可以包括抗微生物涂料42。如此配置,帽64可以有助于防止鲁尔连接器19的微生物污染,帽19被配置为与鲁尔连接器螺纹接合。类似于连接器比如鲁尔连接器19,由于临床医生或导管10的其他使用者的相对广泛的物理接触,帽比如帽64可能尤其易受微生物污染。
[0104]
图12示出了作为医疗装置的另一个实施例的无针连接器110,抗微生物涂料42可以被布置在无针连接器上以便赋予其抗微生物效果。如所示出的,无针连接器110包括内表面44和外表面46,其中内表面44包括抗微生物涂料42。即便如此,无针连接器110的外表面46 可以替代性地或另外地包括抗微生物涂料42。
[0105]
作为抗微生物涂料42的基于铜的层102的替代方案,图13示出了结合入进入端口80的针可穿透隔膜86的材料的含铜物质70。可以通过将成型材料与含铜物质70复合且随后模制(例如,注塑模制) 或挤出所得材料以提供含铜医疗装置或其部件,将含铜物质70结合入医疗装置或其部件(例如隔膜86)的成型材料。施加至前述医疗装置或其部件的上述抗微生物层42的一个或多个附加层提供基本上非洗脱的抗微生物涂料42,其配置为提供接触灭杀的抗微生物效果。例如,端口80的隔膜86可以与硅酮或另一种医学上合适的与含铜物质 70复合的聚合物注塑模制,以提供其中结合有含铜物质70的隔膜86。可以将抗微生物层42的一个或多个附加层施加至隔膜86,从而为隔膜86提供抗微生物层42,隔膜86被配置为保护由端口的本体限定的储器84以及通过端口80连同端口杆的流体路径免受微生物污染。隔膜86只是可以通过这种方式制造的各种医疗装置和部件的一个实施例。在一些实施方案中,端口本体82的整个外表面包括抗微生物涂料42。
[0106]
本文所描述的实施方案仅是可受益于抗微生物涂料42的医疗装置和部件的实施例。应当理解的是,各种医疗装置可以包括本文所描述的抗微生物涂料42,包括外周置入中心静脉导管(“picc”)、中央静脉导管(“cvc”)、血液透析导管、肺动脉导管、动脉导管、导尿管、腹膜透析导管、肠喂食管、胃造口管、鼻胃管、气管内管、气管造口管、脐带导管、无针连接器、中线导管、肠导管、中间留置导管、气囊漂浮(swan-ganz)导管、可植入进入端口或其他可植入装置。
[0107]
应当理解的是,上述抗微生物涂料42可以用于待处理的表面包括相对高硬度的塑料的情况,其通常抵抗对用于战胜病毒、细菌、真菌等典型的抗微生物试剂的吸取。传统上难以处理的导管区域包括衬套(比如,衬套16)、衬套16的任何衬套内腔和鲁尔连接器(比如,鲁尔连接器19),它们通常包括高硬度的塑料。抗微生物涂料42被采用而减少医疗装置的流体承载表面(比如,通过导管或其部分(例如,衬套、鲁尔连接器)的流体路径的内腔表面)上的抗微生物定殖,但是抗微生物涂料42也可以被采用在此类医疗装置的非流体承载
表面上。
[0108]
抗微生物涂料42用作抗微生物表面,其降低微生物在抗微生物表面上的稳固或增殖的可能性。抗微生物涂料42可以使抗微生物表面上存在的微生物产生至少4倍对数减少(4-log reduction),即便在延长的时间段(比如,31天或更长时间)后。抗微生物涂料42是基本上非洗脱的并且用作微生物定殖的被动屏障,该微生物包括耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,“mrsa”)、铜绿假单胞菌(pseudomonas aeruginosa)、产气肠杆菌(enterobacter aerogenes)、耐万古霉素肠球菌(vancomycin-resistantenterococcus,“vre”)和酵母菌比如白色念珠菌(candidaalbicans)。注意,在医疗装置或其部件的内表面或外表面上的抗微生物涂料42的相对正电荷能够用作接触灭杀表面,在接触抗微生物表面之后,微生物立即被灭杀在接触灭杀表面上。
[0109]
图18描绘了示出铜层(比如,基于铜的层102)在被布置在鲁尔连接器(比如,图1中所示的鲁尔连接器19)上时的效力的一个实施例的图(该图的附图标记为120)。图19描绘了示出铜层(比如,基于铜的层102)在被布置在鲁尔连接器(比如,图1中所示的鲁尔连接器19)上并且可操作地连接至未涂覆的无针连接器(比如,图12 中所示的无针连接器110)时的效力的一个实施例的图(该图的附图标记为130)。图20描绘了示出了在将可选的外覆层108施加至包括铜层(比如,基于铜的层102)的鲁尔连接器时实现了合适的抗微生物效力的图(该图的附图标记为140)。关于前述层的另外的公开内容可在2016年10月6日提交的美国专利公开号2016/0287758中获得,该美国专利公开的全部内容通过引用并入本技术。
[0110]
方法
[0111]
一种制造抗微生物导管组件比如图1或图9的导管10的方法包括:将非洗脱抗微生物涂料42施加至导管10的一个或多个部件的内表面44、外表面46或内表面44和外表面46二者;和连接导管10 的部件以形成导管10。抗微生物涂料42是两层或更多层的复合物,该两层或更多层包括在防腐蚀层106与被施加抗微生物涂料42的内表面44或外表面46之间的基于铜的层102、在基于铜的层102与被施加抗微生物涂料42的内表面44或外表面46之间的粘合促进层104 或其组合。
[0112]
施加抗微生物涂料42包括将粘合促进层104施加至导管10的一个或多个部件中的任何部件的内表面44或外表面46。粘合促进层104 通过金属的物理气相沉积、化学气相沉积、电沉积或化学镀沉积被施加至前述内表面44或前述外表面46,该金属选自金、钯和钛。被施加粘合促进层104的内表面44或外表面46包括选自聚氨酯、聚碳酸酯、聚乙烯、聚丙烯、聚氯乙烯和硅酮的聚合物。
[0113]
施加抗微生物涂料42包括将基于铜的层102施加至导管10的一个或多个部件中的任何部件的内表面44或外表面46。基于铜的层102 通过铜、铜合金、或铜基质复合物的物理气相沉积、化学气相沉积、电沉积或化学镀沉积被施加至前述内表面44或前述外表面46。被施加基于铜的层102的内表面44或外表面46包括选自聚氨酯、聚碳酸酯、聚乙烯、聚丙烯、聚氯乙烯和硅酮的聚合物或粘合促进层104。
[0114]
至少关于衬套16,抗微生物涂料42的基于铜的层102可以通过化学镀沉积过程被沉积在衬套16的一个或多个衬套内腔40的内表面 44上,化学镀沉积过程可以在不使用电场的情况下将铜沉积在非导电表面上。化学镀沉积包括在物理掩蔽不应发生沉积的任何其
他表面部分之前清洁将在其上发生沉积的表面。接下来,通过化学或机械地(例如通过碳化硅高压喷砂)蚀刻表面而制备清洁的、未掩蔽的表面。
[0115]
然后可以通过化学镀沉积将铜、镍或另一种合适的金属或材料的预涂料沉积在蚀刻表面上,这可以有助于提高后续涂料(比如,基于铜的层102)的效率。然而,可以省去预涂料。然后将衬套16置于氯化铜浴中,其中作为氧化还原反应的结果,自动催化反应在衬套16 的未掩蔽部分上形成相对薄的均匀的基于铜的层102。
[0116]
应当理解的是,可以采用其他模式而向衬套16或导管10的另一个部件提供基于铜的层102。图5给出了这种情况的一个实施例,其中,导管管件12包括成型材料(比如,热塑性塑料或一些其他合适的聚合物的树脂),成型材料在被挤出成图5中所示的管状形式之前与含铜物质70混合或复合。可以与树脂复合的含铜物质包括氯化亚铜、氯化铜、氧化铜、氢氧化铜、草酸铜、柠檬酸铜、葡萄糖酸铜、醋酸铜、碳酸铜、硫酸铜、磷酸铜、其他合适的铜盐、细分金属铜等。含铜物质70的质量含量按重量计可以在约1%至约40%之间变化,但是可以根据需要和期望结果使用其他百分比。在引入挤出机中之前,可以将含铜物质作为粉末与树脂混合,其中混合和熔融在挤出之前进行。所得的导管管件12或其他挤出物在其中包括足以向内表面或外表面提供期望的抗微生物效果的量的铜。
[0117]
施加抗微生物涂料42包括将防腐蚀层106施加至导管10的一个或多个部件中的任何部件的内表面44或外表面46。防腐蚀层106通过金、钯或钛的物理气相沉积、化学气相沉积、电沉积或化学镀沉积被施加至前述内表面44或前述外表面46。被施加防腐蚀层106的内表面44或外表面46包括基于铜的层102等。
[0118]
连接导管10的部件包括:将导管管件12插入衬套16;将至少一个延伸支腿18插入衬套16;和将延伸支腿18插入至少一个鲁尔连接器19以形成导管10。导管10具有由导管管件内腔14、衬套内腔40 和延伸支腿内腔22的内表面44限定的流体路径。
[0119]
虽然本文中已经公开了一些特定实施方案,并且虽然已经公开了特定实施方案的一些细节,但是这些特定实施方案并不旨在限制本文中提供的概念的范围。对于本领域普通技术人员来说,额外的适应和 /或修改可以是显而易见的,并且在更广泛的方面,这些适应和/或修改也被涵盖。因此,在不偏离本文中提供的概念的范围的情况下,可以偏离本文中公开的特定实施方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1