POU2F1基因表达抑制剂在制备治疗组织纤维化疾病中的应用的制作方法
本发明涉及生物医药技术领域,具体而言,涉及pou2f1基因表达抑制剂在制备治疗组织纤维化疾病中的应用。
背景技术:
心脏纤维化是一种常见的病理过程,在心肌梗死、主动脉狭窄、扩张性心肌病、糖尿病型心脏病的心脏疾病中十分常见。心脏纤维化的主要病理改变为心脏组织的细胞间质的细胞外基质增多,心脏组织硬度增加,实质细胞减少,持续的发展会导致心脏结构损坏以及功能减退,最终导致心力衰竭,严重威胁人类的健康和生命。持续增加的细胞外基质和心脏组织硬度不仅是心脏纤维化的结果,也会进一步加重心脏纤维化。肌成纤维细胞是合成和分泌细胞外基质的主要细胞类型。它主要是由心脏中大量存在的心脏成纤维细胞分化而来的。因此心脏成纤维细胞是控制细胞外基质动态平衡的主要成员。心脏成纤维细胞分化为肌成纤维细胞是以α-平滑肌动蛋白(α-smoothactin)和纤连蛋白(fibronectin)作为标志物。关于心脏纤维化的机制研究以及发现心脏纤维化相关新的重要成员是预防和阻断心脏纤维化诱导的心衰的基础和重要途径。
目前,关于响应心脏纤维化导致的心脏组织硬度变化从而促进纤维化的研究已有不少进展。从细胞结构上分,在心脏成纤维细胞质膜上,整合素(integrin)、toll样受体(toll-likereceptors)以及多配体蛋白聚糖(syndecans)参与对细胞外基质硬度改变的响应;在心脏成纤维细胞的胞质中,tgfb信号通路、rock信号通路、hippo信号通路、mapk信号通路以及age-rage信号通路的许多成员此前均有报道参与了对细胞外基质硬度变化的相应以及对于心脏纤维化的调控。在心脏成纤维细胞的细胞核中,linc复合体(linkerofnucleoskeletonandcytoskeleton)参与对于细胞外机械信号的相应.linc复合体包括nesprin类成员、sunandlamin类的成员。细胞外基质的硬度还可以通过改变染色质的结构从而影响下游基因的表达。例如,定位在核膜上的bromodomain-containingprotein4(brd4)能够与linc复合体的sun蛋白互相作用,利用小干扰rna去敲减brd4能够降低α-平滑肌动蛋白、纤连蛋白以及1型胶原蛋白的蛋白水平。此外,核中的转录因子也能够被细胞外基质硬度影响从而调节心脏纤维化。nesprin-2就是一种可以响应细胞外作用力进而促进转录因子smad3功能的组分。目前关于心脏纤维化的研究已有不少,但是现有发现的组分在临床上的应用并不够理想,因此发现新的能够调节众多心脏纤维化信号通路从而阻止心衰的发生的成员仍是一个重要的研究方向。
转录因子pou2f1(poudomainclass2transcriptionfactor1,pou2f1)pou因子家族的成员,它是该家族中唯一一位能够在各个组织脏器中广泛表达的转录因子。pou2f1能够与不同的辅因子一同参与介导下游基因的激活、抑制以及停滞作用。有报道发现在多种癌症中,pou2f1的mrna水平和蛋白水平均会上升。pou2f1早前报道的作用主要是参与调控与增殖和免疫调节相关的基因的转录。后续的pou2f1相关研究发现它能够调控的下游基因涉及氧化和细胞毒性应激抵抗、代谢调节,干细胞功能调节。在心血管领域,pou2f1还能结合心衰标志物beta-myosinheavychain的启动子并调控其表达,提示pou2f1有可能参与心脏重构的发生发展。
技术实现要素:
为了提供新的治疗组织纤维化疾病的医药,本发明拟采用如下技术方案:
本发明一方面涉及pou2f1基因表达抑制剂在制备治疗组织纤维化疾病中的应用。出人意料的是,本发明的发明人发现干预pou2f1能够明显的减少包括心脏成纤维细胞在内的成纤维细胞的转分化的过程,从而抑制纤维化的发生。
在本发明的一个优选实施方式中,所述的组织纤维化疾病包括心脏纤维化、肺纤维化。
对于本发明的所述的pou2f1基因表达抑制剂没有特别的限定,但优选的pou2f1基因表达抑制剂选自小干扰rna、pou2f1基因敲除试剂。
本发明另一方面还涉及pou2f1基因表达抑制剂在体外抑制细胞纤维化或促进成纤维细胞的转分化中的应用。
本发明另一方面还涉及pou2f1基因表达抑制剂在体外纤维化细胞中促进下游基因il1r2、cd69和/或tgif2的转录中的应用。
在本发明的一个优选实施方式中,对于在体外抑制细胞纤维化或促进成纤维细胞的转分化或在体外纤维化细胞中促进下游基因il1r2、cd69和/或tgif2的转录而言,所述的pou2f1基因表达抑制剂选自小干扰rna、pou2f1基因敲除试剂。
在本发明的一个优选实施方式中,对于在体外抑制细胞纤维化或促进成纤维细胞的转分化或在体外纤维化细胞中促进下游基因il1r2、cd69和/或tgif2的转录而言,所述的细胞为心脏或肺脏细胞。
附图说明
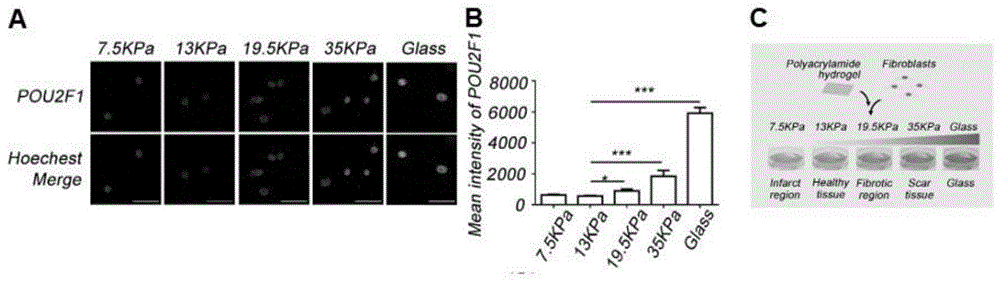
图1a-图1c:免疫荧光染色分析病理细胞外基质硬度对心脏成纤维细胞中pou2f1蛋白表达水平的促进作用。图1a:荧光标记pou2f1蛋白水平。图1b:pou2f1荧光水平的定量及统计分析结果。图1c:体外模拟病理细胞外基质硬度和体内心脏组织病理过程的对应关系。
图2a-图2b:蛋白质印记法验证病理细胞外基质硬度对心脏成纤维细胞中pou2f1蛋白表达水平的促进作用。图2a:蛋白印迹法利用pou2f1抗体检测不同细胞外基质硬度下培养的心脏成纤维细胞中pou2f1蛋白水平,gapdh作为内参。图2b:pou2f1蛋白印记法检测的蛋白含量的定量及统计分析结果。
图3:实时荧光定量pcr检测病理细胞外基质硬度对心脏成纤维细胞中pou2f1mrna水平的促进作用。
图4a-c:蛋白质印记法检测小鼠心梗模型梗死区和远隔区不同时期心脏组织中pou2f1的蛋白水平。图4a:小鼠心肌梗死模型模式图。图4b:蛋白印记法利用pou2f1抗体检测梗死区、远隔区手术后1天、4天、7天时pou2f1蛋白水平。图4c:pou2f1蛋白印记法检测的蛋白含量的定量及统计分析结果。
图5a-图5c:免疫荧光染色检测病理细胞外基质硬度对成纤维细胞转分化的影响。图5a:荧光分别代表肌成纤维细胞标志物fibronectin和αsma蛋白水平受细胞外基质硬度的调节作用。图5b:fibronectin荧光水平的定量及统计分析结果。图5c:αsma荧光水平的定量及统计分析结果。
图6a-图6c:蛋白质印记法检测验证病理细胞外基质硬度对心脏成纤维细胞中fibronectin和αsma蛋白表达水平的促进作用。图6a:蛋白印迹法利用fibronectin和αsma的抗体检测不同细胞外基质硬度下培养的心脏成纤维细胞中fibronectin和αsma蛋白水平,gapdh作为内参。图6b:fibronectin蛋白印记法检测的蛋白含量的定量及统计分析结果。图6c:αsma蛋白印记法检测的蛋白含量的定量及统计分析结果。
图7a-图7f:染色质免疫共沉淀实验检测转录因子pou2f1对其可能的下游基因的启动的的结合能力。图7a-图7c:转录因子pou2f1结合在il1r2、cd69、tgif2的启动子的示意图。图7d-图7f:利用对照igg和pou2g1抗体进行染色质免疫共沉淀实验,检测pou2f1蛋白对il1r2、cd69、tgif2的启动子的结合能力。
图8a-图8c:实时荧光定量pcr检测病理细胞外基质硬度对心脏成纤维细胞中纤维化抑制因子il1r2、cd69、tgif2mrna水平的抑制作用。
图9a-图9f:实时荧光定量pcr检测当细胞内pou2f1减少时对于下游基因mrna水平的影响。图9a:在病理细胞外基质硬度条件下,利用反义寡核苷酸对于心脏成纤维pou2f1mrna水平进行敲减,利用实时荧光定量pcr检测对于pou2f1的mrna水平的敲减效率。图9b:利用蛋白质印记法检测对于pou2f1的蛋白水平敲减效率。图9c:敲减pou2f1后,pou2f1蛋白印记法检测的蛋白含量的定量及统计分析结果。图9d-图f:利用实时荧光定量pcr检测敲减pou2f1后,对于下游基因il1r2、cd69、tgif2mrna水平的调控作用。
图10a-图10f:蛋白质印记法检测当细胞内pou2f1减少时对于下游基因蛋白质水平的影响。图10a-图10c:利用蛋白质印记法,分别使用il1r2、cd69、tgif2抗体,检测敲减pou2f1后,其下游基因il1r2、cd69、tgif2蛋白水平。图10d-图10f:敲减pou2f1后,il1r2、cd69、tgif2蛋白印记法检测的蛋白含量的定量及统计分析结果。
图11a-图11d:免疫荧光染色法检测当心脏成纤维细胞生长在病理细胞外基质硬度条件下,内源pou2f1减少时,对于心脏成纤维转分化所促进的纤维化的影响。图11a、图11c:敲减pou2f1后,分别用荧光代表肌成纤维细胞标志物fibronectin和αsma蛋白水平。图11b、图11c:fibronectin以及αsma荧光水平的定量及统计分析结果。
图12a-图12c:蛋白质印记法检测在病理细胞外基质硬度条件下,当细胞内pou2f1减少时,肌成纤维细胞标志物fibronectin和αsma蛋白水平。图12a:在病理细胞外基质硬度条件下,敲减pou2f1后,分别使用fibronectin以及αsma抗体对fibronectin以及αsma进行免疫印迹,检测其蛋白水平。图12b、图12c:fibronectin以及αsma蛋白水平的定量及统计分析结果。
具体实施方式
下面结合具体实施例进一步阐明本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,按照所属领域的常规操作进行,或按照制造厂商所建议的条件进行。
实施例1、体外实验,利用不同基质硬度模拟不同病理状态下细胞外基质硬度改变对心脏成纤维细胞中转录因子pou2f1以及肌成纤维细胞标志物fibronectin和αsma表达水平的影响。
心脏成纤维细胞的分离和培养:心脏成纤维细胞取自8至10周的雄性c57bl/6小鼠。剪掉心耳的心脏组织剪碎后使用0.1%的ii型胶原酶(300u,17101-015,gibco,carlsbad,ca,usa)在37摄氏度条件下水浴消化分离。之后室温条件1000转/分钟离心5分钟,弃上清,将细胞沉淀用含有10%胎牛血清(15140-122,gibco,carlsbad,ca,usa)的dmem(12800-058,gibco,carlsbad,ca,usa)重悬,后移入10cm培养皿,在37摄氏度,5%二氧化碳条件下培养。此为原代心脏成纤维细胞p0。通常实验使用p2代成纤维细胞进行后续实验。
不同硬度聚丙烯酰胺凝胶的制备:25mm×25mm的玻璃盖玻片先分别用氢氧化钠、氨丙基三甲氧基硅烷、戊二醛处理,之后根据不同的丙烯酰胺、甲叉丙烯酰胺比例配制硬度为7.5kpa(10%丙烯酰胺,0.03%甲叉丙烯酰胺),13kpa(10%丙烯酰胺,0.07%甲叉丙烯酰胺),19.5kpa(10%丙烯酰胺,0.13%甲叉丙烯酰胺),35kpa(10%丙烯酰胺,0.26%甲叉丙烯酰胺)四个硬度,成胶后再在胶表面加交联剂sulfo-sanpah(thermofisherscientific,rockford,il,usa)并用紫外照射促进交联的发生。用pbs稀释的100μg/ml鼠尾胶原(sigma,st.louis,mo,usa)在4摄氏度过夜孵育不同硬度的基底胶。使用前将基底胶放入6孔板,浸泡在无菌得到pbs中使用紫外杀菌。之后在基底胶上铺p2代的心脏成纤维细胞,一天后将细胞固定或收样,进行后续的实验。
免疫荧光染色实验:细胞在37摄氏度条件下,用37摄氏度温热4%多聚甲醛固定15分钟后,使用温热pbs清洗3次,再用0.2%tritonx-100破膜20-30分钟。温热pbs清洗3次后加入封闭液(5%bsa)封闭30分钟。此后使用一抗αsma(ab32575,abcam,cambridge,ma,usa),fibronectin(ab2413,abcam,cambridge,ma,usa),pou2f1(ab178869,abcam,cambridge,ma,usa)在4摄氏度条件下过夜孵育。回收储存一抗后,pbs清洗3次,然后室温孵育二抗alexafluor4881小时。室温条件下使用hoechst(invitrogen,carlsbad,ca,usa)染核8分钟。使用高内涵筛选成像系统cellomicsarrayscanvtihcsreader(thermofisherscientific,rockford,il,usa)的morphologyexplorerbioapplication模块统计和分析荧光强度。使用共聚焦显微镜收集的图像是用20x物镜激发光波长488收集的。图像使用zen2012软件拍摄和处理。
蛋白质印记实验:细胞先用胰酶从基底胶上消化下来,离心后取上清,使用冷pbs清洗三遍,后用细胞裂解液(20mmol/ltris-hclph7.4,150mmol/lnacl,2.5mmol/ledta,50mmol/lnaf,0.1mmol/lna4p2o7,1mmol/lna3vo4,1%tritonx-100,10%glycerol,0.1%sds,1%deoxycholicacid,1mmol/lpmsf,and1mg/mlaprotinin)裂解细胞,超声破碎后在4摄氏度条件下,12000g离心15分钟。收上清。取5微升进行蛋白定量后,其余上清加入5x凝胶上样缓冲液,100摄氏度5分钟确保蛋白变性。使用10%sds-page胶电泳后硝酸纤维素膜转膜,5%脱脂牛奶室温封闭1小时,一抗4摄氏度冷室过夜孵育,一货号分别为:fibronectin(ab2413,abcam,cambridge,ma,usa),αsma(ab32575,abcam,cambridge,ma,usa),pou2f1(ab178869,abcam,cambridge,ma,usa),il1r2(sc-376247,santacruzbiotech,ca,usa),cd69(ab202909,abcam,cambridge,ma,usa),),tgif2(ab190152,abcam,cambridge,ma,usa),gapdh(2118s,cst).tbst洗膜洗三遍后换对应的种属二抗,室温1小时,tbst再洗膜后显影,将膜至于显影液中(milliporecorporation),然后控干放入发光检测机器中曝光。条带强度使用nihimagejsoftware软件定量。
实时荧光定量pcr:实验使用trizolreagent(invitrogen,carlsbad,ca,usa)提取心脏成纤维细胞的总rna。之后使用20μl反转录体系(m-mlvreversetranscriptionsystem,promegacorporation,fitchburg,wi,usa)进行反转录合成cdna,使用sybrgreenmix(transgenbiotech,beijing,china)进行荧光定量pcr,仪器型号为mastercyclereprealplex2real-timepcrsystem(eppendorf)。pou2f1,il1r2,cd69,andtgif2基因的相对表达量由其基因和看家基因gapdh的ct值的比值计算得出。
我们利用体外模拟心脏组织不同病理状态下细胞外基质硬度的方法探究不同病理环境下对转录因子pou2f1的影响。首先直接固定在不停基底硬度上培养的心脏成纤维细胞,利用免疫荧光检测其内源pou2f1蛋白水平。图1a中荧光表示pou2f1的定位和含量以及细胞核的位置,由此能够提示转录因子pou2f1的定位主要是在细胞核内,是符合其行使转录活性生物学功能的细胞定位。pou2f1绿色荧光在13kpa时最弱,7.5kpa和19.5kpa,35kpa以及直接的玻璃上都有不用程度的增强。图1b中pou2f1绿色荧光强度的定量结果显示心脏成纤维细胞在病理细胞外基质硬度较硬的条件下培养时,其细胞内pou2f1含量显著地增长。图1c显示了体外基底胶硬度模拟的对应的心脏病理状态,13kpa对应健康的心脏组织的细胞外基质硬度,7.5kpa对应心肌梗死早起梗死区偏软的细胞外基质硬度,19.5kpa对应发生纤维化事件的心脏区域的细胞外基质硬度,35kpa对应的是心梗的后期梗死疤痕区的细胞外基质硬度。
此后利用在不同基底硬度下培养的心脏成纤维细胞总蛋白进行蛋白质免疫印迹沉淀实验,检测pou2f1的蛋白水平。实验结果如图2所示,实验得到了与免疫荧光实验一致的结果,转录因子pou2f1的蛋白水平在生理细胞外基质硬度下最低,在病理细胞外基质硬度下逐渐升高。定量结果统计分析表明和生理细胞外基质上培养的心脏成纤维细胞内的pou2f1相比较,病理细胞外基质培养的心脏成纤维细胞内的pou2f1均显著地升高。
通过直接使用trizol处理收集不同基底硬度下培养的心脏成纤维细胞,提取rna进行反转录,利用实时荧光定量pcr检测不同基地硬度对pou2f1mrna水平的影响。图3实验结果显示pou2f1的mrna水平也收到基底硬度的影响,并且病理基底硬度的pou2f1的mrna的促进作用具有显著性。
以上内容提示病理细胞外基质硬度对于pou2f1的表达具有促进作用,并且可能是通过促进pou2f1的mrna水平进而影响其蛋白水平。
于此同时我们也检测了不同基底刚度下培养的心脏成纤维细胞中肌成纤维细胞标志物fibronectin和αsma的表达水平。实验结果提示与基底刚度对pou2f1的调节趋势类似,免疫荧光染色分别用抗体标记fibronectin和αsma,图5a的结果显示fibronectin和αsma的绿色荧光也是在生理条件下最暗,后续在病理基底刚度下绿色荧光增强,并且绿色荧光的变化在其后的定量和统计分析中有统计学意义,显著地增高。之后我们使用蛋白质免疫印迹法验证该结果,图6a结果印证了免疫荧光染色观测到的结果,图6b和6c的定量和统计结果提示肌成纤维细胞的标志物fibronectin和αsma的蛋白水平在病理基底硬度下显著升高。以上结果提示病理细胞外基质能够促进成纤维细胞发生转分化,使得肌成纤维细胞增多。然而上述结果还不能确定病理细胞外基质促进的转录因子pou2f1的增多和促进的成纤维细胞转分化之间是否有直接的因果联系。仍与进一步的探索。
实施例2、检测小鼠心梗模型心脏组织手术不同时间点梗死区、远隔区中pou2f1蛋白水平。
10周雄性c57bl/6小鼠用来进行心梗模型的建立手术。小鼠随机的分为心梗组和随机对照组。心梗组利用左冠状动脉狭窄术从而诱发心梗的发生。对照组进行假手术。该手术在气麻的过程中进行,小鼠通过吸入2%的异氟烷进行气体麻醉。实验分别在手术后1天、4天、7天时取小鼠心脏组织的梗死区和远隔区收集心脏组织。
我们通过蛋白质免疫印迹法检测小鼠心梗模型手术后1天、4天、7天梗死区和远隔区心脏组织内源的转录因子pou2f1的蛋白水平。图4a展示了心脏梗死的梗死区和远隔区的具体位置。图4b表示,与假手术组相比较,冠状动脉狭窄术术后一天在心脏的梗死区内的pou2f1水平有所升高,并且在术后4天、7天持续的升高。但是在心脏的远隔区内,术后1天、4天、7天均看不到pou2f1的上升。对免疫印迹的结果进行定量和统计分析得到图4c,定量结果提示转录因子pou2f1的蛋白水平在心梗的远隔区没有明显的变化,然而在梗死区术后1天时显著升高,在4天和7天时有一定程度的回落,但是其蛋白水平和对照假手术组相比较,其增高的水平仍具有显著性差异。此前的研究报道认为心梗的早起心梗区细胞外基质硬度和生理状态相比较,呈现较软的硬度。心梗后期纤维化发生,细胞外基质硬度较生理状态下呈现较硬的硬度。本结果中,心梗模型术后一天梗死区的心脏组织硬度,术后4天、7天的心脏组织硬度分别代表较生理条件下较软和较硬的细胞外基质硬度,在此环境下心脏组织中pou2f1蛋白水平均有所升高。该结果与实施例1中结果互相呼应,无论在体内实验还是体外实验模拟不同的心脏细胞外基质硬度,病理的细胞外基质硬度均会促进转录因子pou2f1蛋白水平的升高。
实施例3、利用染色质免疫共沉淀实验确定转录因子pou2f1对其可能的下游基因的启动子具有结合能力。
染色质免疫共沉淀实验:1%的甲醛用来交联活心脏成纤维细胞中蛋白质和与它们相连的dna。细胞固定后细胞裂解物通过超声破碎,并且用琼脂糖凝胶电泳的方式确定dna片段的大小在500-600个碱基的大小。pou2f1的抗体(ab178869,abcam,cambridge,ma,usa)以及对照的兔单抗igg(ab172730,abcam,cambridge,ma,usa)用来进行免疫结合,后再加入a/g珠子进行免疫沉淀。沉淀离心后用不同盐浓度漂洗液清洗后,再进行洗脱和接交联,之后利用实时定量pcr检测il1r2,cd69,tgif2启动子的水平。
由于体外和体内的结果均提示病理细胞外基质的硬度会促进心脏成纤维细胞中转录因子pou2f1的表达。因此这种升高的pou2f1是否参与细胞外基质硬度改变对心脏成纤维细胞转分化的过程是一个重要的亟需回答的问题。此前我们的生物信息学分析结果预测pou2f1可能在此过程中发挥重要作用。并且预测转录因子pou2f1可能能调控三个重要的纤维化抑制因子il1r2,cd69,tgif2。使用transfac预测的pou2f1的结合位点如图7a-c所示。因此我们设计进行了染色质免疫共沉淀实验,实验的结果如图7d-f所示,使用pou2f1的抗体去免疫沉淀总蛋白中的pou2f1,在使用实时荧光定量pcr检测与pou2f1结合的il1r2、cd69、tgif2的启动子的含量。与对照igg组相比,pou2f1抗体沉淀下的蛋白确实会结合更多的il1r2、cd69、tgif2的启动子。此外我们也使用实时荧光定量pcr比较病理和生理基底刚度下生长的心脏成纤维细胞内的il1r2、cd69、tgif2水平。图8实验结果发现病理基底刚度能够显著地抑制这三个纤维化的抑制因子的mrna的水平。以上结果提示转录因子pou2f1确实能够结合在这三个纤维化抑制因子il1r2、cd69、tgif2的启动子上,但pou2f1对于这三个基因的启动子的结合究竟起到促进还是抑制的作用以及的心脏成纤维转分化的影响仍需要进一步的探究。
实施例4、在病理细胞外基质硬度下,利用小干扰rna敲减心脏成纤维细胞中的pou2f1,从而降低成纤维细胞中pou2f1的mrna、蛋白水平。检测其下游调控基因的表达水平以及肌成纤维细胞标志物的表达水平。
心脏成纤维细胞转染小干扰rna:心脏成纤维细胞p2代由实验转染小干扰rna的前一日晚上由p1代传代到6孔板中,37摄氏度,5%二氧化碳环境下过夜培养,确保成纤维细胞形态铺展,并且尚未产生过得影响转染效率的细胞外基质。转染当日一早实验37摄氏度温热pbs温和清洗6孔板中的成纤维细胞,重复清洗三遍,确保彻底洗去培养液,之后每孔加入500μlopti-mem(opti-memireducedserummedium,31985070,life),再分别加入80nmol/lpou2f1sirna(sc-36120,santacruzbiotech,ca,usa))或者对照sirna(sc-37007,santacruzbiotech,ca,usa)和3μlhiperfect转染试剂(301705,qiagen,beijing,china)。转染6小时后加含10%胎牛血清的dmem培养液培养。检测蛋白的实验使用转染小干扰rna三天时的细胞样品,检测mrna的实验使用转染小干扰rna一天时的样品。
为了明确转录因子pou2f1对于其潜在的下游基因il1r2,cd69,tgif2的作用,以及其在心脏成纤维细胞转分化过程中的功能,因此使用小干扰rna沉默基因表达的技术降低心脏成纤维细胞中pou2f1表达水平,首先利用蛋白质印记实验、实时荧光定量pcr确定pou2f1敲减效率,进而使用免疫荧光染色和蛋白质印记实验明确pou2f1对于下游基因以及心脏成纤维细胞转分化的作用。
由图9a展示了利用小干扰rna转染心脏成纤维细胞敲减pou2f1一天后mrna水平的敲减效率,转染一天后pou2f1的mrna水平为基础水平的30%左右。此后图9b展示了蛋白质免疫印迹实验检测的小干扰rna转染三天后pou2f1的蛋白水平,可以看到pou2f1的蛋白水平也明显下降。定量的结果明确转染三天后pou2f1的蛋白水平约为基础水平的30%。
在明确了小干扰rna转染敲减效率之后,我们利用实时荧光定量pcr检测了转染小干扰rna一天时其潜在下游基因il1r2、cd69、tgif2的表达水平。图9d-9f的结果可以看到在敲减pou2f1后,其下游基因il1r2、cd69、tgif2的mrna水平显著地升高。该结果提示pou2f1对其下游基因il1r2、cd69、tgif2启动子的结合作用通过抑制其转录发挥功能。于此同时我们也使用蛋白质印记实验检测了这三个下游基因的蛋白水平变化。实验结果图10a-10c所示,在敲减pou2f1后,其下游调控基因il1r2、cd69、tgif2的蛋白水平升高。图10d-10f展示了定量的结果,证实敲减pou2f1后,其下游调控基因蛋白升高的程度具有显著性。以上结果提示pou2f1可能通过结合到下游调控基因的启动子上,进而抑制下游基因的转录,从而抑制下游基因行使其功能。
为了证实pou2f1对于心脏成纤维细胞转分化的作用,我们利用免疫荧光染色实验以及蛋白质印记实验检测了敲减pou2f1后,生长在病理基地硬度下的心脏成纤维细胞中肌成纤维标志物fibronectin和αsma的蛋白水平。免疫荧光染色实验的结果如图11所示。在敲减pou2f1三天以后,代表fibronectin和αsma的绿色荧光变弱,荧光定量的结果显示fibronectin的荧光水平下降到敲减前水平的20%左右,αsma的荧光水平降低到敲减前的60%左右。蛋白质印记实验图12也显示fibronectin和αsma的蛋白水平显著地下降。以上实验提示转录因子pou2f1是通过抑制下游基因il1r2、cd69、tgif2的转录,进而抑制这三个纤维化抑制因子发挥其功能,从而促进了心脏成纤维细胞的转分化过程。干预pou2f1能够明显的减少心脏成纤维细胞转分化的过程,从而抑制心脏纤维化的发生。
以上描述了本发明优选实施方式,然其并非用以限定本发明。本领域技术人员对在此公开的实施方案可进行并不偏离本发明范畴和精神的改进和变化。
- 还没有人留言评论。精彩留言会获得点赞!
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程