JAK-1信号通路抑制剂在制备治疗脑损伤药物中的应用的制作方法
本发明涉及生物医学领域,尤其涉及一种jak-1信号通路抑制剂在制备治疗脑损伤药物中的应用。
背景技术:
目前临床上颅脑损伤十分常见,如脑外伤(traumaticbraininjury,tbi)等有很高的死亡率和致残率,且在年轻人中尤为多见,给社会造成极大的负担。脑损伤之后的病情变化较快且复杂,并且持续时间较长。尽管治疗脑损伤的药物和外科手术日渐改进,但是有效的治疗方法和手段相当匮乏,尤其是缺乏药物治疗手段。因此,充分研究脑损伤后的病理变化以期寻求更好的治疗手段已经显得刻不容缓。
以脑外伤为例,其发病机制主要分为两种,一是由外力冲击直接引起的物理损伤,二是由物理损伤引起的继发性损伤,包括神经元损伤、变性,炎症反应和脑水肿等。并且,继发性损伤的破坏显得更为严重和持久。各种类型的细胞死亡方式在脑外伤后的继发性损伤的病理过程中发挥着关键作用。最近的研究表明,除了程序性坏死、凋亡外,焦亡(pyroptosis)也参与脑外伤后的病理变化过程。基于脑外伤发生的无法预测性和神经元的不可再生性,在脑外伤之后,最大程度的减少神经元的死亡,将继发性损伤的损害程度降到最低,应该是保护神经元,减轻神经元损害的可靠措施。焦亡作为一种程序性细胞死亡方式,在各种类型的脑损伤中都发挥着重要的作用。大量的研究已经证明,在不同类型的神经损伤中,包括脑卒中(缺血性和出血性),脓毒血症,穿透性脑损伤,放射性脑损伤,脊髓损伤和阿尔茨海默病中,抑制焦亡都可以起到神经保护作用,从而达到脑保护的效果,最终改善认知、行为和情感。
因此,开发新的用于治疗脑损伤的药物或脑神经保护药物十分必要。
技术实现要素:
为解决上述技术问题,本发明的目的是提供jak-1信号通路抑制剂在制备治疗脑损伤药物中的应用,为临床治疗脑损伤病人提供新的理论与技术手段。
本发明公开了jak-1信号通路抑制剂在制备治疗脑损伤和/或脑神经保护药物中的应用。
进一步地,脑神经保护药物用于治疗或改善脑损伤引起的神经功能损害。
进一步地,jak-1信号通路抑制剂为鲁索替尼(ruxolitinib),其结构式如下:
ruxolitinib作为一种jak-1信号通路高度选择性抑制剂的临床药物,其已经经过美国食品与药物管理局批准上市,是第一个获准的专门治疗骨髓纤维化的药物。但是其在脑损伤中的作用还没有报道。发明人发现ruxolitinib可以通过抑制脑外伤后的神经细胞焦亡过程,从而达到减轻脑水肿的程度,减少皮质神经元的变性程度,改善脑损伤后的运动功能。
进一步地,jak-1信号通路抑制剂用于保护或改善脑损伤引起的运动功能损害。
进一步地,jak-1信号通路抑制剂抑制脑损伤后焦亡的过程。
进一步地,jak-1信号通路抑制剂通过抑制焦亡相关蛋白的表达来抑制焦亡过程。
进一步地,焦亡相关蛋白包括半胱天冬酶1(caspase1),gasdermind蛋白(gsdmd),衔接蛋白asc,白细胞介素18(il-18)和白细胞介素1β(il-1β)。
进一步地,jak-1信号通路抑制剂抑制脑损伤后神经元性炎症小体的形成。
进一步地,炎症小体为nlrp3蛋白。
进一步地,jak-1信号通路抑制剂减轻脑损伤后脑水肿程度。
进一步地,jak-1信号通路抑制剂抑制脑损伤后皮质神经元变性的程度。
进一步地,判断神经元变性的程度为尼氏小体的数量等。
借由上述方案,本发明至少具有以下优点:
本发明公开了jak-1信号通路抑制剂在制备治疗脑损伤和/或脑神经保护药物中的应用。为开发治疗颅脑损伤的药物提供了依据。
本发明明确了jak-1信号通路抑制剂对颅脑损伤具有保护作用及作用的潜在机制,发明人发现其对颅脑损伤引起的神经功能损害具有改善作用;同时jak-1信号通路抑制剂可以减轻颅脑损伤引起的焦亡过程以及减少神经元性炎症小体的形成;并可以减轻颅脑损伤引起的脑水肿;并且可以减轻颅脑损伤引起的神经元变性程度,改善脑损伤后的运动功能。本发明为临床治疗脑损伤病人提供新的理论与技术手段。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细说明如后。
说明书附图
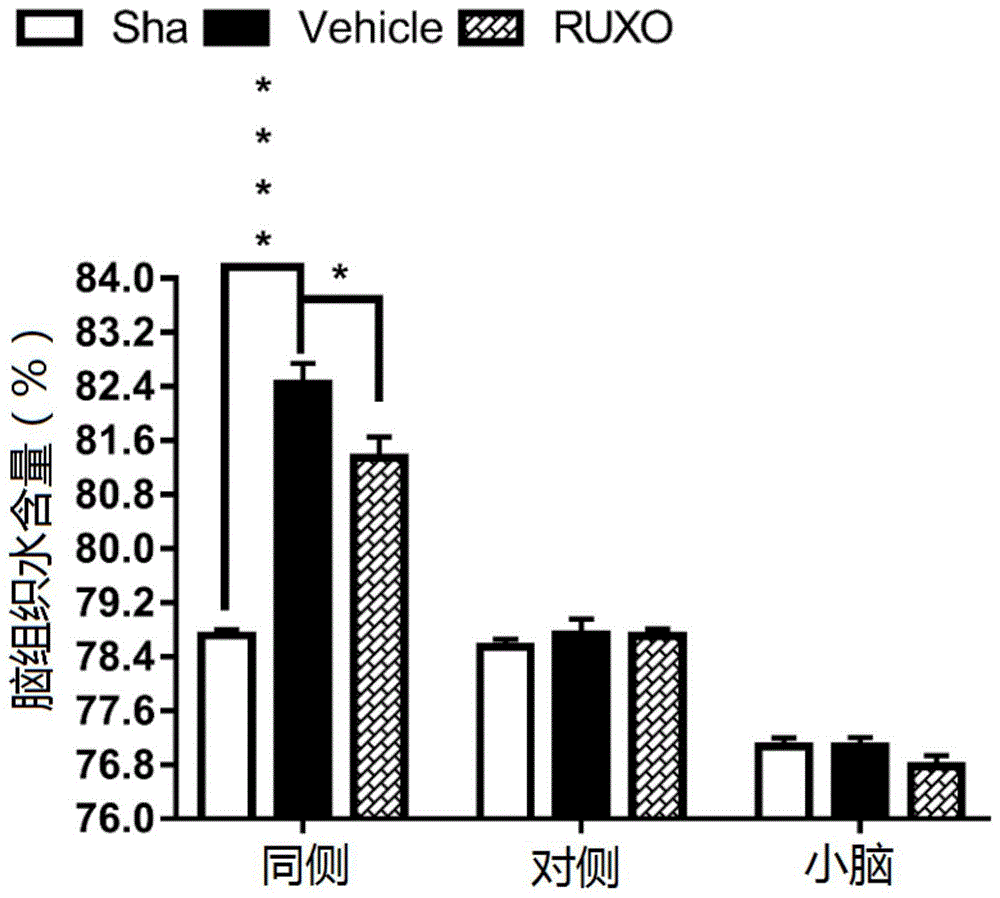
图1是不同实验组小鼠的脑水肿程度的直方图统计结果;
图2是不同实验组小鼠的wiregrip试验的散点图统计结果;
图3是不同实验组小鼠的大脑皮质中焦亡相关蛋白表达水平的测试结果以及相关的直方图统计结果;
图4是不同实验组小鼠脑外伤后神经元性炎症小体表达水平的测试结果以及相关的直方图统计结果;
图5是不同实验组小鼠脑外伤神经元变性程度的测试结果。
具体实施方式
下面结合实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
本发明以下实施例中所涉及的神经反射实验和行为学实验包括:
(1)脑水肿程度测量试验,具体如下:
将小鼠脑组织分成三部分,左半球,右半球以及小脑,称量并且记录三部分的湿重。然后将这三部分分别放入烘箱,100℃,5天,进行彻底烘干,称量并且记录干重。脑水肿程度的计算公式为:[(湿重-干重)/湿重]×100%。
(2)wire-grip试验,具体如下:
将长度为45cm的金属丝横置悬挂在45cm高的框架上,金属丝的下方放置柔软的弹力海绵垫,将小鼠轻置于金属丝上确保小鼠前肢握住金属丝后开始计时,记录小鼠60s以内的运动情况。此实验采用5分制评分系统对其运动功能进行评分:1分,小鼠的前、后爪均不能握住金属丝;2分,小鼠的前、后爪均握住金属丝,但是尾巴不能盘绕金属丝;3分,小鼠前、后爪可以握住金属丝,并且尾巴可以盘绕金属丝;4分,小鼠尾巴可以盘绕金属丝,前、后爪均握住金属丝,并且在金属丝上移动;5分,小鼠尾巴可以盘绕金属丝,前、后爪均握住金属丝,并且在金属丝上移动,而且可以进一步沿着框架爬到地面。如果小鼠不能握住金属丝并且停留30秒,记为0分。该试验可以反应小鼠的运动功能以及平衡能力。
(3)免疫荧光实验(immunofluorescence)
在小鼠脑外伤24h后,将小鼠深麻醉之后,用pbs和4%多聚甲醛对小鼠进行心脏灌流,迅速分离获取整个脑组织,而后进行蔗糖梯度脱水,利用oct包埋,进行冰冻切片,获得小鼠脑切片。将切片孵育在bsa稀释的一抗中,4℃过夜,然后漂洗切片,利用荧光标记的二抗在室温中孵育2h,随后,使用尼康正置荧光显微镜进行观察,利用imagej对所得图片进行合并处理。
(4)免疫印迹实验(westernblotting):
在小鼠脑外伤后24h将小鼠麻醉后分离脑皮质组织,将分离提取的脑组织加入到含有蛋白酶抑制剂的裂解液中超声裂解,离心,匀浆后提取上清液;然后,利用增强型bca测量蛋白浓度,每孔上样等量60ug蛋白样品。利用sds-page凝胶电泳分离各蛋白,然后,将分离胶上的蛋白转到pvdf膜上,随后,将转有蛋白的pvdf膜孵育在bsa稀释的抗体中于4℃过夜,第二天洗膜后,蛋白条带在辣根过氧化物酶链接的二抗中室温孵育2h,随后,应用ecl化学发光系统检测蛋白条带,最后扫描蛋白条带和使用imagej分析蛋白条带的灰度值。
(5)皮质神经元变性程度测量,具体如下:
在小鼠脑外伤24h后,将小鼠深麻醉之后,用pbs和4%多聚甲醛对小鼠进行心脏灌流,迅速分离获取整个脑组织,而后进行蔗糖梯度脱水,利用oct包埋,进行冰冻切片,获得小鼠脑切片。将冰冻切片进行尼氏染色,随后,使用尼康正置荧光显微镜进行观察。
实施例1
将66只体重基本相同6-8周龄雄性c57/bl6j小鼠(20-25g)随机分为三组,每组22只,分别为:对照组(sha组)、vehicle处理颅脑损伤组(vehicle组)、ruxolitinib处理颅脑损伤组(ruxo组)。
对照组小鼠正常饲养不做任何处理。vehicle组和ruxo组建模步骤如下:
将各组小鼠利用立体定位仪进行固定,将小鼠头皮剪开暴露颅骨,已冠状缝与矢状缝切线为两边,在左半球钻一个直径为4mm的圆形小孔,暴露脑组织,然后利用气压冲击定量皮质打击器进行打击,建立颅脑损伤模型。vehicle组在颅脑损伤后30分钟之内通过腹腔注射0.01%dmso(0.2ml),ruxo组在颅脑损伤后30分钟之内通过腹腔注射ruxolitinib(180mg/kg,0.2ml)。三组小鼠饲养条件均相同。
对各组小鼠进行相关试验测试,测试结果分别如图1和图2所示。图1反映了各组小鼠在颅脑损伤后的脑水肿程度变化情况。图2反映了各组小鼠在颅脑损伤以后,连续10天的运动、平衡功能的变化。
对比图1-2中vehicle组和ruxo组的各项试验结果可知,ruxo组小鼠颅脑损伤以后的脑水肿程度减轻,运动、平衡功能增强,说明ruxolitinib改善了颅脑损伤引起的脑水肿和神经行为功能缺损。
对各组小鼠的脑皮质组织进行免疫印迹实验,结果见图3。图3a-f依次为不同实验组小鼠的焦亡相关蛋白疫印迹实验结果、大脑皮质中caspase1/gapdh相对含量(caspase1表达),大脑皮质中gsdmd/gapdh相对含量(gsdmd表达),大脑皮质中asc/gapdh相对含量(asc表达),大脑皮质中il-1β/gapdh相对含量(il-1β表达)和大脑皮质中il-18/gapdh相对含量(il-18表达)直方图统计结果。由测试结果可知,ruxo组小鼠颅脑损伤以后的焦亡相关蛋白表达均降低,说明ruxolitinib对颅脑损伤引起的焦亡过程具有抑制作用。
对各组小鼠脑切片进行免疫荧光实验,结果如图4所示。其中,神经元标注物为neun,细胞核标志物为dapi,炎性小体标注物为nlrp3,第一列为神经元与细胞核荧光实验合并结果,图中的荧光点为神经元标注物neun和细胞核标志物dapi的荧光点。第二列为神经元与细胞核荧光实验合并结果,图中的荧光点为炎性小体标注物nlrp3的荧光点。第三列为第一列和第二列各自合并结果。图d为鼠脑外伤后神经元性炎症小体表达水平的直方图统计结果。由测试结果可知,ruxo组小鼠颅脑损伤以后的神经元性炎症小体表达降低,说明ruxolitinib对颅脑损伤引起的神经元性炎性小体的表达具有抑制作用。
对各组小鼠脑切片进行尼氏染色,结果见图5,图5a、b、c依次为sham(假手术)组、vehicle(平行对照)组和ruxo(鲁索替尼)组小鼠脑切片测试结果,图5d、e、f依次对应图5a、b、c中方框处的放大图。由测试结果可知,ruxo组小鼠颅脑损伤以后的神经元变性程度降低,说明ruxolitinib对颅脑损伤引起的神经元变性具有衰减作用。
以上仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!