组织缺陷修复剂及其制备方法和使用方法与流程
本发明涉及生物医用材料领域,特别涉及一种组织缺陷修复剂及其制备方法和使用方法。
背景技术:
人体组织缺陷是由于发育和衰老造成组织变化而导致。最常见人体组织缺陷是面部皱纹,人的年龄增长至25岁后,皮肤开始老化、表皮层与真皮层变薄且含水量下降以及胶原蛋白的弹性变低等因素引发皮肤细纹;通过防晒和补充营养物质可进行皮肤细纹的修复,或采用磁光波、脉冲光等方法也可消除皮肤细纹。
如进一步发展,变薄的皮肤经表情肌肉过度收缩,当表情变化时出现动态皱纹,如抬头纹、皱眉纹、鱼尾纹等;此时,常用局部注射肉毒杆菌毒素阻断乙酰神经胆碱的释放,使神经肌肉连接发生麻痹来达到除皱目标。但是,最终轴突可形成新的运动终板,同时无功能的运动单位被吸收,肌肉功能逐渐得以恢复,因此,临床疗效仅能维持3~6个月。当然,注射血小板源生长因子、表皮生长因子、血管生长因子、自体皮肤成纤维细胞等生物除皱方法也可达到一定疗效,但价格昂贵并有一定潜在风险。
随着人体衰老的自然发展规律,皮肤会更进一步老化松弛,真皮层的胶原纤维与弹性纤维变少,皱纹加深而形成不可逆的静态皱纹;此时,常用治疗方法是皮下填埋法和注射法。填埋法是将非常细的金线嵌入皮下层中,通过异物反应使金线周围生长出新组织;注射法是将材料(硅胶、玻尿酸、胶原蛋白、自体脂肪颗粒、羟基磷灰石、聚己内酯、聚甲基异丁烯酸甲酯、聚乳酸等)注射填充凹陷处,从内部支撑起塌陷的皮肤。其中,硅胶不会被皮肤吸收,使用不当会造成肉芽肿和持续性发炎,反而使组织变形;玻尿酸会被组织代谢降解,其使用时效一般为6~12个月。另外,爱贝芙是一种新型的可注射的医学整形美容材料,由pmma(聚甲基异丁烯酸甲酯)微球和胶原组成,表面光滑的pmma微球的直径为32微米~40微米,以质量比3.5%的胶原溶液为载体,将pmma微球悬浮溶液注射进入整形部位;pmma微球进入整形部位后,迅速被纤维组织包裹,使得不会有任何移动和降解,pmma微球的特性既保证了其不被巨噬细胞所消化吸收,也保证了其对组织的刺激性降到最小,且pmma微球能刺激纤维细胞合成和分泌胶原蛋白;1~3个月后,注入的胶原逐渐降解并被人体自身胶原所代替,而pmma微球不会降解,留在整形部位,起到永久效果。总之,无论是填埋法还是注射填充法都不能控制植入材料在皮肤内的分布,例如,对皮肤凹陷的填充情况不能控制,或者不能对皮肤表面平整度再次调控,而且,材料注入后不能再次抽出,只能等待其被生物体代谢分解。
因此,作为一种理想的人体组织缺陷修复材料,除必备良好的生物相容性和安全性外,还必须具备:(1)材料的可注射性和可塑性,以利于微创治疗;(2)对组织生长和反应可调控,使局部组织能有效增生;(3)材料植入后的形态可调控,材料可塑形和固定成形,实现临床治疗所需的初始目标;(4)材料降解性能可调控,根据治疗部位和目标的需要可分为非降解、慢降解和快降解多种类型;(5)材料的生物活性可调控,避免再生组织过早吸收或过度增生,影响临床疗效。那么,为了使得组织修复材料具备上述的性能,需要提出一种新的组织修复材料的制备方法。
技术实现要素:
本发明的目的在于提供一种组织缺陷修复剂及其制备方法和使用方法,使得所述组织缺陷修复剂具备良好的生物相容性、可注射性和可塑性,且对组织生长和反应、材料降解性能以及材料生物活性可调控,能广泛应用于生物医学和兽医领域。
为实现上述目的,本发明提供了一种组织缺陷修复剂的制备方法,包括:
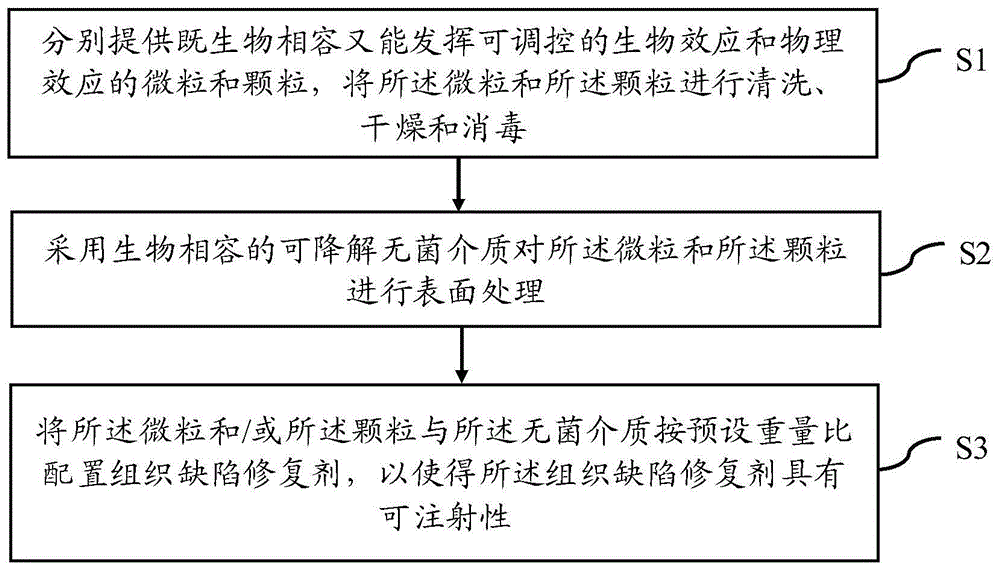
步骤s1,分别提供既生物相容又能发挥可调控的生物效应和物理效应的微粒和颗粒,将所述微粒和所述颗粒进行清洗、干燥和消毒;
步骤s2,采用生物相容的可降解无菌介质对所述微粒和所述颗粒进行表面处理;
步骤s3,将所述微粒和/或所述颗粒与所述无菌介质按预设重量比配置组织缺陷修复剂,以使得所述组织缺陷修复剂具有可注射性。
可选的,所述组织缺陷修复剂的制备方法还包括:步骤s4,将所述组织缺陷修复剂装入无菌容器内,并进行包装和消毒处理。
可选的,所述微粒和所述颗粒的材质包括无机材料和/或有机材料;所述微粒和所述颗粒的材质包括可降解材料和/或非降解材料;所述微粒和所述颗粒的形状包括规则形和/或不规则形;所述无菌介质的材质包括胶原蛋白、透明质酸钠、几丁糖和海藻酸中的至少一种。
可选的,所述可降解材料包括磷酸三钙、硫酸钙、生物玻璃、聚乳酸、几丁质、胶原蛋白、透明质酸钠、几丁糖和海藻酸中的至少一种;所述非降解材料包括羟基磷灰石、氧化铝、氧化锆、聚甲基异丁烯酸甲酯、尼龙、聚乙烯和己内酯中的至少一种;所述规则形包括球形。
可选的,所述微粒的粒度为0.01μm~50μm;所述颗粒的粒度为50μm~2000μm;所述无菌介质的质量浓度为0.1%~99.99%。
可选的,在所述步骤s1中,根据所述微粒和所述颗粒的理化性能不同,选用不同清洗介质清洗所述微粒和所述颗粒,所述干燥方法为冷冻干燥,所述消毒方法为加热、高压和射线辐照中的至少一种;在所述步骤s2中,所述表面处理的方法为物理涂层、化学接枝和交联中的至少一种;在所述步骤s3中,通过控制所述无菌介质的分子量、粘度和浓度中的至少一种来实现所述组织缺陷修复剂的可注射性。
可选的,在所述步骤s3中,将重量比为1%~99%的所述颗粒与重量比为1%~99%的所述无菌介质配置所述组织缺陷修复剂,所述组织缺陷修复剂具有可调控的物理效应;将重量比为0.01%~50%的所述微粒与重量比为50%~99.99%的所述无菌介质配置成所述组织缺陷修复剂,所述组织缺陷修复剂具有可调控的生物效应;将重量比为1%~99%的所述颗粒、重量比为0.1%~10%的所述微粒与重量比为1%~99.89%的所述无菌介质配置所述组织缺陷修复剂,所述组织缺陷修复剂具有可调控的物理效应和可调控的生物效应。
可选的,根据所述颗粒的降解性能、粒度大小、浓度高低以及植入方式,来调控所述组织缺陷修复剂的物理效应的时效性;根据所述微粒的降解性能、粒度大小、浓度高低以及植入方式,来调控所述组织缺陷修复剂的生物效应的时效性。
本发明还提供了一种组织缺陷修复剂,采用本发明提供的所述组织缺陷修复剂的制备方法制备。
本发明还提供了一种本发明提供的所述组织缺陷修复剂的使用方法,将所述组织缺陷修复剂装入注射器或特制工具中,并注射到组织缺陷部位。
与现有技术相比,本发明的技术方案具有以下有益效果:
1、本发明的组织缺陷修复剂的制备方法,通过分别提供既生物相容又能发挥可调控的生物效应和物理效应的微粒和颗粒,将所述微粒和所述颗粒进行清洗、干燥和消毒;然后,采用具有生物相容性且可降解的无菌介质对所述微粒和所述颗粒进行表面处理;接着,将所述微粒和/或所述颗粒与所述无菌介质按预设的重量比配置成组织缺陷修复剂,使得制备的所述组织缺陷修复剂具备良好的生物相容性、可注射性和可塑性,且对组织生长和反应、材料降解性能以及材料生物活性可调控,能广泛应用于生物医学和兽医领域。
2、本发明的组织缺陷修复剂,由于采用本发明提供的所述组织缺陷修复剂的制备方法制备,使得所述组织缺陷修复剂具备良好的生物相容性、可注射性和可塑性,且对组织生长和反应、材料降解性能以及材料生物活性可调控,能广泛应用于生物医学和兽医领域。
3、本发明的组织缺陷修复剂的使用方法,通过将本发明提供的所述组织缺陷修复剂装入注射器或特制工具中,并注射到组织缺陷部位,使得所述组织缺陷修复剂注射到组织缺陷部位之后,能够对缺陷部位起到很好的修复作用。
附图说明
图1是本发明一实施例的组织缺陷修复剂的制备方法的流程图。
具体实施方式
为使本发明的目的、优点和特征更加清楚,以下结合附图1对本发明提出的组织缺陷修复剂及其制备方法和使用方法作进一步详细说明。需说明的是,附图均采用非常简化的形式且均使用非精准的比例,仅用以方便、明晰地辅助说明本发明实施例的目的。
本发明一实施例提供一种组织缺陷修复剂的制备方法,参阅图1,图1是本发明一实施例的组织缺陷修复剂的制备方法的流程图,所述组织缺陷修复剂的制备方法包括:
步骤s1:分别提供既生物相容又能发挥可调控的生物效应和物理效应的微粒和颗粒,将所述微粒和所述颗粒进行清洗、干燥和消毒;
步骤s2:采用生物相容的可降解无菌介质对所述微粒和所述颗粒进行表面处理;
步骤s3:将所述微粒和/或所述颗粒与所述无菌介质按预设重量比配置组织缺陷修复剂,以使得所述组织缺陷修复剂具有可注射性。
下面更为详细的介绍本实施例提供的组织缺陷修复剂的制备方法:
按照步骤s1,分别提供既生物相容又能发挥可调控的生物效应和物理效应的微粒和颗粒,将所述微粒和所述颗粒进行清洗、干燥和消毒。所述微粒和所述颗粒的材质生物相容,且二者引起的生物效应和物理效应可调控,使得二者能够很好地应用于生物医学和兽医领域。所述微粒和所述颗粒的材质包括无机材料或有机材料,或同时包括无机材料和有机材料。并且,所述微粒和所述颗粒的材质包括可降解材料或非降解材料,或同时包括可降解材料和非降解材料。所述可降解材料可以包括磷酸三钙、硫酸钙、生物玻璃、聚乳酸、几丁质、胶原蛋白、透明质酸钠、几丁糖和海藻酸中的至少一种;所述非降解材料可以包括羟基磷灰石、氧化铝、氧化锆、聚甲基异丁烯酸甲酯、尼龙、聚乙烯和己内酯中的至少一种。需要说明的是,所述可降解材料和非降解材料不仅限于上述的材料种类。
所述微粒和所述颗粒的形状均包括规则形或不规则形,或者同时包括规则形和不规则形。所述规则形包括球形、椭圆形等。所述微粒的粒度可以为0.01μm~50μm(例如为0.1μm、1μm、10μm等);所述颗粒的粒度可以为50μm~2000μm(例如为100μm、500μm、1000μm等)。需要说明的是,所述微粒和所述颗粒的粒度不仅限于上述范围,可以根据所述组织缺陷修复剂的性能需求选择合适粒度。
提供了所述微粒和所述颗粒之后,可以对所述微粒和所述颗粒进行清洗、干燥和消毒处理,以备后续使用。其中,根据所述微粒和所述颗粒的理化性能的不同,可以选用不同的清洗介质(例如纯水、乙醇等)清洗所述微粒和所述颗粒;所述干燥的方法可以为冷冻干燥,所述冷冻干燥的工艺条件可以为:冷冻温度为-90℃~-20℃(例如为-80℃、-50℃、-30℃等),冷冻时间为1h~72h(例如为10h、30h、60h等);所述消毒的方法可以为加热、高压和射线辐照中的至少一种。
按照步骤s2,采用生物相容的可降解无菌介质对所述微粒和所述颗粒进行表面处理。所述无菌介质的生物相容使得其能够很好地应用于生物医学和兽医领域;通过所述无菌介质对所述微粒和所述颗粒进行表面处理,使得所述微粒和所述颗粒在后续与所述无菌介质配置成组织缺陷修复剂时,所述微粒和所述颗粒能够与所述无菌介质之间具有很好的结合性,配置成的所述组织缺陷修复剂具有很好的稳定性,进而使得所述组织缺陷修复剂能够更好地应用于生物医学和兽医领域。
所述无菌介质的材质可以包括胶原蛋白、透明质酸钠、几丁糖和海藻酸中的至少一种;需要说明的是,所述无菌介质的材质不仅限于上述的种类,可以包括任何生物相容的可降解材料。所述无菌介质的质量浓度可以为0.1%~99.99%(例如为1%、10%、50%等);需要说明的是,所述无菌介质的质量浓度不仅限于上述的范围,可以根据所述组织缺陷修复剂的性能需求选择合适的浓度。
采用所述无菌介质对所述微粒和所述颗粒进行表面处理的方法可以为物理涂层、化学接枝和交联中的至少一种。其中,物理涂层即是采用物理的方法将所述无菌介质涂覆在所述微粒和所述颗粒的表面,可以实现对所述微粒和所述颗粒的包裹;化学接枝即是利用所述微粒和所述颗粒上的反应基团与所述无菌介质中的分子链发生化学反应;交联即是所述无菌介质中的分子链分别与所述微粒和所述颗粒中的分子链间以共价键连接成网状或体型高分子聚合物。
按照步骤s3,将所述微粒和/或所述颗粒与所述无菌介质按预设重量比配置组织缺陷修复剂,以使得所述组织缺陷修复剂具有可注射性。所述无菌介质具有可注射性,可以通过控制所述无菌介质的分子量、粘度和浓度中的至少一种参数来实现所述组织缺陷修复剂的可注射性。由于所述组织缺陷修复剂具有可注射性,使得所述组织缺陷修复剂能够注射到治疗部位,即时发挥充盈、填塞、挤压、推移等作用,进而实现治疗目标。
配置所述组织缺陷修复剂的步骤可以包括:将重量比为1%~99%(例如为10%、50%、90%等)的所述颗粒与重量比为1%~99%(例如为10%、50%、90%等)的所述无菌介质配置成所述组织缺陷修复剂,所述组织缺陷修复剂具有可调控的物理效应,例如,将重量比30%的磷酸三钙颗粒与重量比70%的胶原蛋白液配置所述组织缺陷修复剂;或者,将重量比为0.01%~50%(例如为0.1%、1%、10%等)的所述微粒与重量比为50%~99.99%(例如为60%、90%等)的所述无菌介质配置成所述组织缺陷修复剂,所述组织缺陷修复剂具有可调控的生物效应,例如,将重量比20%的羟基磷灰石微粒与重量比80%的透明质酸钠液配置成所述组织缺陷修复剂;或者,将重量比为1%~99%(例如为10%、50%、90%等)的所述颗粒、重量比为0.1%~10%(例如为1%、5%等)的所述微粒与重量比为1%~99.89%(例如为10%、50%、80%等)的所述无菌介质配置成所述组织缺陷修复剂,所述组织缺陷修复剂具有可调控的物理效应和可调控的生物效应,即具有双重效应,例如,将重量比20%的磷酸三钙颗粒、重量比5%的羟基磷灰石微粒与重量比75%的胶原蛋白液配置成所述组织缺陷修复剂。其中,可以通过调整所述颗粒、所述微粒以及所述无菌介质中的至少一种所占的重量比来获得所需的所述组织缺陷修复剂;也可以根据治疗需要,选择配置合适配比的所述组织缺陷修复剂。重量比为所述颗粒、微粒、无菌介质的各自重量占总混合物(即配置的所述组织缺陷修复剂)的比重。
在所述组织缺陷修复剂被注射到治疗部位之后,由于所述无菌介质具有可降解性,在所述无菌介质被降解吸收之后,所述微粒和所述颗粒在治疗部位仍维持着增加容量的物理效应,继续发挥着治疗作用;且所述微粒在治疗部位能够刺激纤维细胞增殖以及胶原蛋白分泌,形成纤维组织增生的生物效应,进而发挥治疗作用。并且,当所述组织缺陷修复剂同时具有所述颗粒和所述微粒时,则所述物理效应和所述生物效应共同发挥治疗作用。
另外,可以根据所述颗粒的降解性能(即所述颗粒的材质包括可降解材料和/或非降解材料)、粒度大小、浓度高低以及植入方式,来调控所述组织缺陷修复剂的物理效应的时效性;也可以根据所述微粒的降解性能(即所述微粒的材质包括可降解材料和/或非降解材料)、粒度大小、浓度高低以及植入方式,来调控所述组织缺陷修复剂的生物效应的时效性。其中,可降解材料的所述微粒能够发挥时限性组织刺激作用,材料降解之后会失去填充和组织刺激作用;非降解材料的所述微粒能够发挥长效性填充和组织刺激作用,也可被组织包裹固定后,不再发挥组织刺激作用,但仍保持充盈作用。
另外,所述组织缺陷修复剂的制备方法还包括:步骤s4,将所述组织缺陷修复剂装入无菌容器内,并进行包装和消毒处理。也可以将所述组织缺陷修复剂直接装入注射器中,并进行包装和消毒处理。
根据上述步骤s1至步骤s4可知,所述组织缺陷修复剂的制备方法简单,且制备的所述组织缺陷修复剂除了具备良好的生物相容性和安全性外,还具备如下优异的性能:(1)材料的可注射性和可塑性,以利于微创治疗;(2)对组织生长和反应可调控,使局部组织能有效增生;(3)材料植入后的形态可调控,材料可塑形和固定成形,实现临床治疗所需的初始目标;(4)材料降解性能可调控,根据治疗部位和目标的需要可分为非降解、慢降解和快降解多种类型;(5)材料的生物活性可调控,避免再生组织过早吸收或过度增生,影响临床疗效。因此,所述组织缺陷修复剂的制备方法的简单性以及性能的优异性,使得所述组织缺陷修复剂能够广泛应用于生物医学和兽医领域。
综上所述,本发明的组织缺陷修复剂的制备方法,包括:步骤s1,分别提供既生物相容又能发挥可调控的生物效应和物理效应的微粒和颗粒,将所述微粒和所述颗粒进行清洗、干燥和消毒;步骤s2,采用生物相容的可降解无菌介质对所述微粒和所述颗粒进行表面处理;步骤s3,将所述微粒和/或所述颗粒与所述无菌介质按预设重量比配置组织缺陷修复剂,以使得所述组织缺陷修复剂具有可注射性。本发明的组织缺陷修复剂的制备方法使得制备的所述组织缺陷修复剂具备良好的生物相容性、可注射性和可塑性,且对组织生长和反应、材料降解性能以及材料生物活性可调控,能广泛应用于生物医学和兽医领域。
本发明一实施例提供一种组织缺陷修复剂,采用本发明提供的所述组织缺陷修复剂的制备方法制备。由于采用本发明提供的所述组织缺陷修复剂的制备方法制备所述组织缺陷修复剂,使得所述组织缺陷修复剂除了具备良好的生物相容性和安全性外,还具备如下优异的性能:(1)材料的可注射性和可塑性,以利于微创治疗;(2)对组织生长和反应可调控,使局部组织能有效增生;(3)材料植入后的形态可调控,材料可塑形和固定成形,实现临床治疗所需的初始目标;(4)材料降解性能可调控,根据治疗部位和目标的需要可分为非降解、慢降解和快降解多种类型;(5)材料的生物活性可调控,避免再生组织过早吸收或过度增生,影响临床疗效。因此,所述组织缺陷修复剂的性能的优异性,使得所述组织缺陷修复剂能广泛应用于生物医学和兽医领域。
本发明一实施例提供一种组织缺陷修复剂的使用方法,将本发明提供的所述组织缺陷修复剂装入注射器或特制工具中,并注射到组织缺陷部位。由于所述组织缺陷修复剂采用本发明提供的所述组织缺陷修复剂的制备方法制备,使得所述组织缺陷修复剂具备优异的性能,进而使得所述组织缺陷修复剂注射到组织缺陷部位之后,能够对缺陷部位起到很好的修复作用。
上述描述仅是对本发明较佳实施例的描述,并非对本发明范围的任何限定,本发明领域的普通技术人员根据上述揭示内容做的任何变更、修饰,均属于权利要求书的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!