柔性生物电干电极及制作方法、柔性基底薄膜
本发明涉及生物电干电极的技术领域,尤其是涉及柔性生物电干电极及制作方法、柔性基底薄膜。
背景技术:
生理电是人体在进行生理活动时,由于细胞内外的自由离子穿越细胞壁所产生电位差的宏观表现。心电、脑电以及肌电等是临床上常见的生理电信号,这些有规律的电信号与生命状态密切相关,人体组织或器官的生理和病理特征能够通过生理电信号被解析出来。通过采集心电图、脑电图以及肌电图分别对心脏疾病、癫痫以及肌肉故障进行检测是目前临床上普遍采用的方式。利用生理电信号实现手势动作的检测识别、运动过程中姿势、训练强度及肌肉疲劳状态的监测、假肢手和运动机械的各种动作驱动以及人脑与外部设备相互通信等的可穿戴设备逐渐步入市场。因此,生理电信号在医疗健康、运动监测、人机交互和仿生控制等领域极具价值。
生物电电极能够对这些人体表面的生理电信号进行拾取和传输。传统的测量方法是通过将含有电解质凝胶的湿式ag/agcl电极粘贴到皮肤表面上。为了确保与皮肤表面能够紧密粘附,通常会在电极表面的涂覆医用粘合剂层。但湿式ag/agcl凝胶电极的安装位置限制在相对较大、较为平坦的身体区域,如前额、背部、胸部、前臂或大腿等,而手指、面部、颈部以及其它曲率明显、皮肤松弛或触觉敏感程度高的区域难以设置湿式电极进行检测。而且,在信号测量结束后或是需要更换电极时,医用粘合剂与皮肤之间的超高粘附力在剥离过程中会给人带来疼痛感。更为重要的是,凝胶在佩戴过程中逐渐变得干燥,这会造成急剧变化的接触阻抗,进而导致测量信号的准确性降低。此外,由于凝胶对于人体皮肤具有一定程度的刺激性,长时间佩戴这类ag/agcl凝胶电极会带来皮肤过敏和接触性皮炎。
因此,无需电解质凝胶的干电极的开发备受研究人员的青睐。但现有技术中大多数干电极的厚度较大,与皮肤之间的机械模量不匹配,造成干电极与皮肤之间的接触面积过小、接触阻抗过大以及后续较差的信号质量;这些厚度过大的干电极延展性较差,在待测皮肤进行拉伸和弯曲时其电阻会发生明显的变化从而对生物电信号的采集造成干扰;而且这些厚度过大的干电极的透气性差,限制了待测皮肤的表面水分及汗液的及时排出,长期佩戴会导致皮肤炎症反应。这类干电极粘附性较差,它们与皮肤表面的结合依赖于传统的医用粘合剂、尼龙搭扣带或弹力绷带等进行固定,这同样也会给用户带来不舒适感。
因此,有必要提出其他改进方案来解决上述问题。
技术实现要素:
有鉴于此,为了解决上述问题,本发明采用了如下的技术方案:
本发明提供了一种柔性生物电干电极的柔性基底薄膜,所述柔性基底薄膜包括:向柔性基底材料的溶液中充入气体,以形成所述柔性基底材料的气泡;将所述气泡的气泡膜从溶液分离,使所述气泡膜固化为柔性基底薄膜。
优选地,向柔性基底材料的溶液中充入气体的方法包括:采用注射器插入到柔性基底材料的溶液中并注入气体。
优选地,所述柔性基底材料为聚合物,所述柔性基底材料的溶液盛放在底面平整的容器中。
优选地,将所述气泡的气泡膜从溶液分离的方法包括:采用带有空心区域的片材与所述气泡的气泡膜接触,使所述气泡膜粘附在所述片材的空心区域处。
优选地,所述片材为聚对苯二甲酸乙二醇酯片材。
本发明还提供了一种柔性生物电干电极,所述柔性生物电干电极包括:采用如上所述的柔性基底薄膜制作柔性基底薄膜;将导电金属薄膜材料溶液喷涂到衬底上,以形成导电金属薄膜;使所述柔性基底薄膜和所述导电金属薄膜结合,获得柔性生物电干电极。
优选地,所述导电金属薄膜材料溶液为金属纳米线分散液,所述导电金属薄膜为金属纳米线相互交织形成的网络状薄膜。
优选地,所述衬底上覆设有预设图案的掩膜版,将导电金属薄膜材料溶液喷涂到衬底上以形成导电金属薄膜的方法包括:将导电金属薄膜材料溶液喷涂到所述衬底上由所述掩膜版所露出区域;在所述衬底上由所述掩膜版所露出区域处形成导电金属薄膜,再从所述衬底上移除所述掩膜板。
优选地,使所述柔性基底薄膜和所述导电金属薄膜结合的方法包括:使所述柔性基底薄膜和所述导电金属薄膜接触,以使所述导电金属薄膜粘附到所述柔性基底薄膜上并从所述衬底上分离。
本发明还提供了一种柔性生物电干电极,所述柔性生物电干电极采用如上所述制作。
与现有技术相比,本发明的有益效果包括:
制作完成的柔性生物电干电极的厚度极小,能达到80nm的超薄水平,其具备良好的透明度;
柔性生物电干电极能够实现与皮肤表面的共形接触;
柔性生物电干电极的电阻不会受到皮肤拉伸和弯曲等变形的影响;
柔性生物电干电极的电极-皮肤间的接触阻抗足够低,能够保证后续的生物电信号能够被采集;
柔性生物电干电极的透气性良好,能够为用户提供更加舒适的佩戴体验;
柔性生物电干电极在无需医用粘合剂就能与皮肤表面实现良好贴合的前提下可降低剥离过程中给人带来的疼痛感以及皮肤刺激;
制作方法所采用的工艺简易,成本低廉。
附图说明
图1是本发明实施例所提供的柔性生物电干电极的流程框图;
图2是所述柔性生物电干电极中制作柔性基底薄膜的流程示意图;
图3是所述柔性生物电干电极中制作导电金属薄膜和构成柔性生物电干电极的流程示意图;
图4是本发明实施例所制得的柔性生物电干电极放置在印有示例文字的纸上的图;
图5是所制得的柔性生物电干电极直接贴附在人体皮肤表面上的图;
图6是对应图5的柔性生物电干电极的边缘贴附在人造皮肤上的sem图;
图7是所制得的柔性生物电干电极贴附在ecoflex衬底时在不同拉伸倍率下得到的相对电阻变化图;
图8是所制得的柔性生物电干电极和湿式ag/agcl凝胶电极采集的电极-皮肤接触阻抗对比图;
图9是所制得的柔性生物电干电极和湿式ag/agcl凝胶电极在相同的环境湿度和温度下放置一周过程中的水蒸气透过速率(wvtr)对比图;
图10是在相同的测试条件下所制得的柔性生物电干电极和湿式ag/agcl凝胶电极测得的剥离强度对比图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面结合附图对本发明的具体实施方式进行详细说明。这些优选实施方式的示例在附图中进行了例示。附图中所示和根据附图描述的本发明的实施方式仅仅是示例性的,并且本发明并不限于这些实施方式。
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明,在附图中仅仅示出了与根据本发明的方案密切相关的结构和/或处理步骤,而省略了关系不大的其他细节。
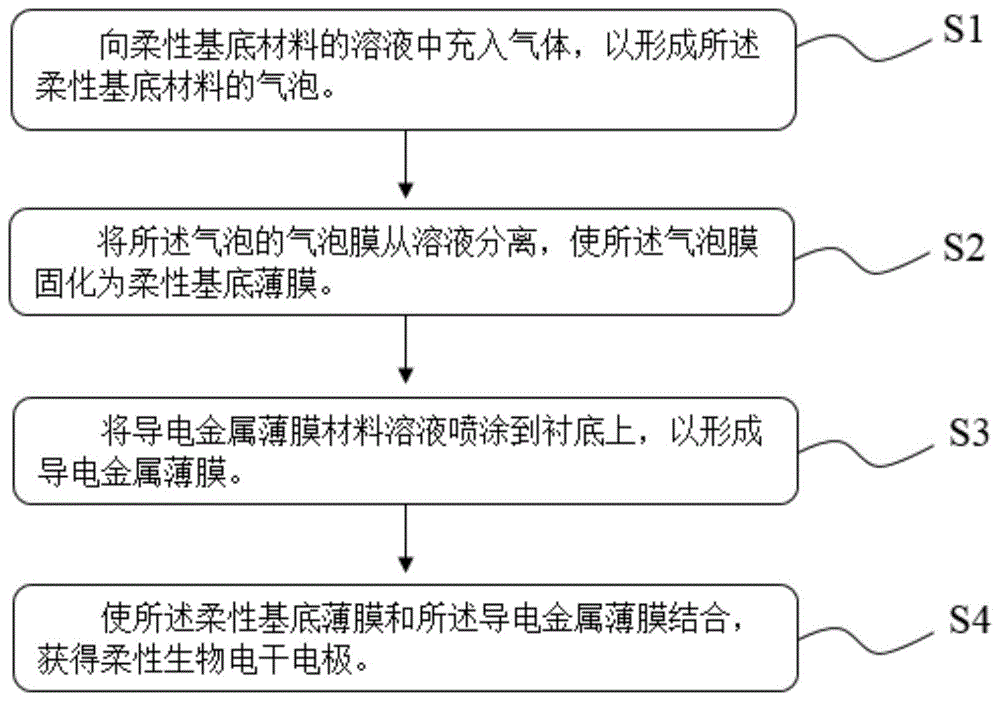
结合图1至图3所示,本发明提供了一种柔性生物电干电极,所述柔性生物电干电极包括:
第一部分,柔性基底薄膜:
s1、向柔性基底材料的溶液中充入气体,以形成所述柔性基底材料的气泡;
s2、将所述气泡的气泡膜从溶液分离,使所述气泡膜固化为柔性基底薄膜;
第二部分,导电金属薄膜:
s3、将导电金属薄膜材料溶液喷涂到衬底上,以形成导电金属薄膜;
第三部分,柔性基底薄膜和导电金属薄膜构成柔性生物电干电极:
s4、使所述柔性基底薄膜和所述导电金属薄膜结合,获得柔性生物电干电极。
本发明的上述柔性生物电干电极中,创造性地提供了一种简便制备出厚度极小的柔性基底薄膜的方法,为膨胀吹泡法。通过获得柔性基底材料溶液中所形成的气泡膜,固化为柔性基底薄膜,而通过将导电金属薄膜材料溶液喷涂到衬底上以形成导电金属薄膜,最终制作完成的柔性生物电干电极的厚度也随之变得极小。在本实施例中,所述柔性基底薄膜的厚度能达到50~2000nm的厚度范围水平,所述导电金属薄膜的厚度能达到30~120nm的厚度范围水平。由此,利用所述柔性生物电干电极制得的柔性基底薄膜能够具有优异的透明性、透气性、弹性以及生物相容性,制得的导电金属薄膜材料在保持良好导电性的同时具有优越的透气性和透明性,使得构成的柔性生物电干电极能够自动与皮肤表面微结构共形贴附,可以贴附在人体的各种部位的皮肤表面,不会发生干电极与皮肤之间的接触面积过小、接触阻抗过大以及后续较差的信号质量的情况;其适应皮肤运动而不会引起电阻发生明显的变化从而对生物电信号的采集造成干扰;其优良的透气性允许体表汗液和水分及时透过,避免出现因长期佩戴导致皮肤炎症反应;而且相比于现有技术中通过微纳加工技术、化学镀法、静电纺丝法以及旋涂法等工艺制作柔性生物电干电极,本发明的所述柔性生物电干电极的工艺简单,无需采用专用设备,制备便捷迅速并且成本低廉,十分有利于柔性生物电干电极的技术发展。
当然,以上所述仅为所述柔性生物电干电极所需的基本步骤,结合图2和图3所示,在此基础上,所述柔性生物电干电极还有着以下的进一步限定或改进:
如图2的(a)部分所示,在本实施例的步骤s1中,所述柔性基底材料为聚合物,所述柔性基底材料的溶液盛放在底面平整的容器中。示例性地,将聚合物溶液倒入底面平整的玻璃表面皿中,待其在室温下自然流平。更具体地,所述聚合物可以选用热塑性弹性体(tpe)、聚二甲基硅氧烷(pdms)以及铂催化硅橡胶(ecoflex)等聚合物,所述柔性基底材料的溶液的粘度优选在200~12000mpa·s范围内。
如图2的(b)部分所示,在本实施例中,向柔性基底材料的溶液中充入气体的方法包括:采用注射器插入到柔性基底材料的溶液中并注入气体。通过注射器插入到柔性基底材料的溶液中,气体的注入集中,容易产生所需的柔性基底材料的气泡。示例性地,所述步骤s1关于该部分具体为:将装有气体的医用注射器插入到所述柔性基底材料的溶液中,并往所述柔性基底材料的溶液中注入一定体积的气体,形成半固化状态的三维气泡结构;其中,注入的气体可以选用空气、氮气、氧气以及二氧化碳等,注入气体的体积优选在5~50ml范围内。
如图2的(c)和(d)部分所示,进一步地,所述步骤s2中,将所述气泡的气泡膜从溶液分离的方法包括:采用带有空心区域的片材与所述气泡的气泡膜接触,使所述气泡膜粘附在所述片材的空心区域处。在本实施例中,所述片材选择为聚对苯二甲酸乙二醇酯(pet)片材,所述聚对苯二甲酸乙二醇酯片材的中心处被切割成具有特定直径的空心圆图案,所述步骤s2关于该部分具体为:将预先切割好的聚对苯二甲酸乙二醇酯片材与步骤s1中得到的气泡膜进行接触,该气泡膜将立即被粘附在所述聚对苯二甲酸乙二醇酯片材的空心圆图案区域,此时还可以用剪刀将所述气泡膜未粘附的部分剪去,最终将成为柔性基底薄膜的所述气泡膜被成功地沉积到所述聚对苯二甲酸乙二醇酯片材的空心圆处。然后将上述得到的处于半固化状态的聚合物薄膜置于空气中自然干燥,本实施例中干燥时间选择为约5min,得到厚度进一步变薄的完全固化的所述柔性基底薄膜,为自支撑聚合物超薄膜。其中,所述聚对苯二甲酸乙二醇酯片材的空心圆直径选择为1~5cm;所述聚对苯二甲酸乙二醇酯片材的长度选择为4~10cm,宽度选择为2~6cm,厚度选择100~1000μm,根据以上数据的实施例中所制得的柔性基底薄膜的厚度在50~2000nm范围内,可以看出其厚度极小。
如图3的(a)和(b)部分所示,进一步地,所述步骤s3中,所述衬底上覆设有预设图案的掩膜版,将导电金属薄膜材料溶液喷涂到衬底上以形成导电金属薄膜的方法包括:将导电金属薄膜材料溶液喷涂到所述衬底上由所述掩膜版所露出区域;在所述衬底上由所述掩膜版所露出区域处形成导电金属薄膜,再从所述衬底上移除所述掩膜板。更具体地,本实施例中的衬底一般选用光滑洁净的硬质衬底,通过在光滑洁净的硬质衬底表面贴上掩模版,将金属纳米线分散液喷涂在掩模版暴露的区域;待形成的导电金属薄膜在室温下干燥后,将掩模版揭去,获得所述导电金属薄膜。示例性地,所述导电金属薄膜材料溶液为金属纳米线分散液,所述导电金属薄膜为金属纳米线相互交织形成的网络状薄膜。金属纳米线不仅有着尺寸小的优点,其导电性能优异,生物相容性良好。本实施例中具体选用银纳米线、金纳米线以及铜纳米线中的任一种。所述硬质衬底可以选用为硅片、玻璃以及石英,所述金属纳米线分散液的浓度选择为1~10mg·ml-1的浓度范围。根据以上数据的实施例中所制得的导电金属薄膜的厚度在30~120nm范围内,同样可以得到所述导电金属薄膜的厚度极小的结论。
如图3的(c)和(d)部分所示,进一步地,所述步骤s4中,使所述柔性基底薄膜和所述导电金属薄膜结合的方法包括:使所述柔性基底薄膜和所述导电金属薄膜接触,以使所述导电金属薄膜粘附到所述柔性基底薄膜上并从所述衬底上分离。该步骤为压印转移的方法,是利用了所述导电金属薄膜对于分别与所述柔性基底薄膜和所述衬底的黏附性差异,实现了所述导电金属薄膜从所述衬底上分离。
更进一步地,所述柔性基底薄膜和所述导电金属薄膜结合的过程中,在所述柔性基底薄膜和所述导电金属薄膜接触面处加入氮气,其能使所述柔性基底薄膜与所述导电金属薄膜的结合更为紧密,有利于所述导电金属薄膜从所述衬底上的分离,有利于所述柔性生物电干电极结构的稳定性。
下面给出采用上述制作方法实际制作柔性生物电干电极的实际示例:
首先进行第一部分的柔性基底薄膜的制备,即执行上述步骤s1和s2,具体地,先将15ml浓度为0.433g·ml-1(对应的柔性基底材料的溶液粘度为1000mpa·s)的热塑性弹性体(tpe)溶液倒入底面平整的玻璃表面皿(直径选为6cm)中,待其在室温下自然流平;
然后将装有空气的医用注射器插入到该溶液中,并往其中注入40ml的气体,形成半固化状态的三维气泡结构;
将预先切割好的聚对苯二甲酸乙二醇酯(pet)片材(聚对苯二甲酸乙二醇酯片材的长度选择为10cm,宽度选择为5cm,厚度选择为1000μm,片材中心处的空心圆直径选择为2.5cm)与上述得到的气泡膜进行接触,该气泡膜立即被粘附在聚对苯二甲酸乙二醇酯片材的空心圆区域,用剪刀将未粘附的部分剪去,最终聚合物薄膜被成功地沉积到聚对苯二甲酸乙二醇酯片材的空心圆处;
将上述得到的处于半固化状态的聚合物薄膜置于空气中自然干燥约5min,得到厚度进一步变薄的完全固化的柔性基底薄膜,最终根据以上数据获得的柔性基底薄膜的厚度实际上约为90nm。
进行第二部分的导电金属薄膜的制备,即执行上述步骤s3,具体地,将矩形聚酰亚胺掩模版(1cm×2cm)贴在干净光滑的硅片上,随后将浓度为1mg·ml-1、体积为50μl的银纳米线(agnws)分散液喷涂在掩模版暴露的区域;
待形成的导电金属薄膜在室温下干燥后,将掩模版揭去。最终根据以上数据获得的导电金属薄膜的厚度为60nm。
进行第三部分的柔性基底薄膜和导电金属薄膜构成柔性生物电干电极,即执行上述步骤s4,具体地,将上述得到的柔性基底薄膜与该导电金属薄膜进行接触,并施加少量的氮气使两者结合地更加紧密,由于黏附性差异,最终导电金属薄膜从硬质衬底表面被转移到柔性基底薄膜上。最终根据以上数据得到的柔性生物电干电极的厚度为150nm,完全符合厚度要求。
以下通过各类实验证明以上实际所制得的柔性生物电干电极具备对应的优点:
如图4所示,所制得的柔性生物电干电极放置在印有示例文字为“sinano”的a4纸上,从该图可以观察到,即使透过所述柔性生物电干电极,示例文字“sinano”仍然清晰可见,说明所制得的柔性生物电干电极具有良好的透明度。
如图5所示,所制得的柔性生物电干电极直接贴附在人体皮肤表面上,从该图可以观察到,所述柔性生物电干电极能够紧密贴合皮肤表面的细纹。再参照图6所示的将所述柔性生物电干电极的边缘(图像左侧)贴附在人造皮肤(图像右侧)上的sem图,这进一步说明了所述柔性生物电干电极能够实现与皮肤表面的共形接触。
本发明还对所述柔性生物电干电极贴附在ecoflex衬底时,其在拉伸状态下的电阻稳定性进行了研究,在实验中,所述柔性生物电干电极被贴附在为弹性体的预先拉伸了15%的ecoflex衬底上,接着执行一个释放过程,形成类似于皮肤表面的褶皱结构。然后采用拉伸试验机对弹性体进行拉伸,并测量柔性生物电干电极在拉伸过程中的电阻变化。不同拉伸倍率下得到的所述柔性生物电干电极的相对电阻变化如图7所示,可以观察到在15%的应变范围内,所述柔性生物电干电极的电阻变化可忽略不计,这说明皮肤拉伸和弯曲等变形对所述柔性生物电干电极的电阻是没有影响的。
如图8示出的在相同的测试条件下,由所述柔性生物电干电极和湿式ag/agcl凝胶电极采集的电极-皮肤接触阻抗对比。ag/agcl凝胶电极由于电解质凝胶的存在,能够使得其与皮肤的贴附程度、导电性能明显提高,并且电极-皮肤之间的接触阻抗显著降低。而根据电化学工作站的测试结果,所制得的上述柔性生物电干电极在1~106hz的测试频率范围内,具有与ag/agcl凝胶电极相当的接触阻抗。证明了所述柔性生物电干电极的电极-皮肤间的接触阻抗足够低,能够保证后续的生物电信号能够被采集。
以下通过测量水蒸气透过速率(wvtr)来进行对所述柔性生物电干电极的透气性进行评估,通过将所述柔性生物电干电极和湿式ag/agcl凝胶电极在相同的环境湿度和温度下放置一周,根据每天的失水量计算得到的水蒸气透过速率(wvtr)如图9所示。其中,所述柔性生物电干电极的水蒸气透过速率(wvtr=580.18g·m-2d-1)明显优于湿式ag/agcl凝胶电极(wvtr=117.46g·m-2d-1),说明所述柔性生物电干电极能够有效地改善透气性,并提供更加舒适的佩戴体验。
最后还过剥离力测量系统(mark-10)定量地进行了对所述柔性生物电干电极关于电极-皮肤间的粘附性的检测,图8示出了相同的测试条件下,基于柔性生物电干电极和湿式ag/agcl凝胶电极测得的剥离强度。由于医用粘合剂的存在,湿式ag/agcl凝胶电极的平均剥离强度为2210mn·cm-1,而无需医用粘合剂就能与皮肤表面完美贴合的所述柔性生物电干电极的平均剥离强度仅为210mn·cm-1,这种轻柔的剥离强度可降低剥离过程中给人带来的疼痛感以及皮肤刺激。
由此,逐一证明了由上述制作方法制得的所述柔性生物电干电极的各个优点。
本发明还提供了一种柔性生物电干电极,所述柔性生物电干电极采用如上所述制作。
综上所述,本发明所提供的柔性生物电干电极以及柔性基底薄膜,通过膨胀吹泡法制得柔性基底薄膜,而以导电金属薄膜材料溶液喷涂到衬底上以形成导电金属薄膜的方式制备导电金属薄膜材料,最终制作完成的柔性生物电干电极的厚度极小,能达到80nm的超薄水平,其具备良好的透明度;能够实现与皮肤表面的共形接触;其电阻不会受到皮肤拉伸和弯曲等变形的影响;其电极-皮肤间的接触阻抗足够低,能够保证后续的生物电信号能够被采集;其透气性良好,能够为用户提供更加舒适的佩戴体验;在无需医用粘合剂就能与皮肤表面实现良好贴合的前提下可降低剥离过程中给人带来的疼痛感以及皮肤刺激。
需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
以上所述仅是本申请的具体实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!