益母草碱用于预防急性肝损伤以及促进肝组织修复与再生的制作方法
本发明涉及益母草碱的新用途,具体涉及益母草碱用于制备预防急性肝损伤药物和促进肝组织修复与再生的药物中的应用。
背景技术:
随着人类生活环境与方式的演变,全球急慢性肝病的发病率逐年提高。根据文献报道,sars(severeacuterespiratorysyndrome,sars)-cov和sars-cov-2能够直接与ace2阳性胆管细胞结合,损伤肝组织。病毒(sars-cov、sars-cov-2)感染、全身性炎症因子风暴、药物(诸如:马兜铃酸、对乙酰氨基酚等)诱导所引起的急性肝损伤事件不断发生。肝纤维化(liverfibrosis,lf)是所有慢性肝病必然发生的病理过程,也是多种原因(如病毒感染、代谢或者自身免疫性疾病)所引起的慢性肝损伤殊途同归的病理状态。肝纤维化是指肝细胞被反复破坏后,胶原、糖蛋白等细胞外基质在肝脏中弥漫性沉积与异常分布。肝纤维化是肝脏对慢性损伤的病理性反应,也是各种慢性肝病向肝硬化发展过程中的关键步骤和影响肝病预后的重要环节。肝纤维化进一步发展,可引起肝组织结构紊乱,肝细胞结节样再生,形成假小叶,即肝硬化;部分患者甚至引起肝癌的发生。一旦肝纤维化发展为肝硬化,则疾病不可逆转,唯一有效的治疗手段为肝移植,而短缺的肝脏供体,以及高额的医疗费用限制了临床应用。friedman在国际肝病权威期刊《hepatology》上指出,动物的肝纤维化可以逆转,在人类上也得到证实。所以,如何有效抗肝纤维化成为慢性肝病治疗的关键。
益母草碱(scm-198)是中华人民共和国药典(2000年版)记载的唇形科植物益母草中的主要生物活性单体成分。目前的用途仅限于宫血、心肌缺血、动脉粥样硬化以及糖尿病中的应用。
技术实现要素:
本发明的目的是提供益母草碱的新用途。
根据本发明的一个方面,提供了益母草碱在制备用于预防急性肝损伤及其相关疾病的药物中的应用。
根据本发明的又一个方面,提供了益母草碱在制备用于促进肝组织修复与再生的药物中的应用。
根据本发明的又一个方面,提供了益母草碱在制备用于预防肝纤维化及其相关疾病的药物中的应用。
根据本发明的又一个方面,提供了益母草碱在制备用于治疗肝纤维化及其相关疾病的药物中的应用。
其中,所述益母草碱用于阻断轻度肝纤维化形成。
其中,所述益母草碱用于抑制中度肝纤维化进展。
其中,所述益母草碱用于减轻重度肝纤维化程度。
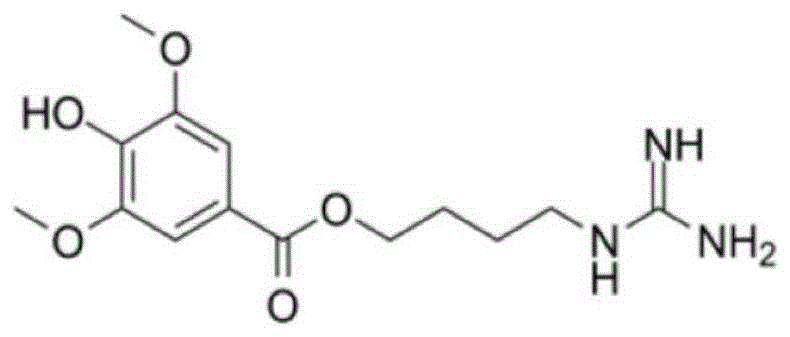
在本发明中,所述益母草碱的化学结构为
所述益母草碱对肝组织具有保护作用,能够预防急性肝损伤并能促进肝组织修复与再生。
应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本说明书。
附图说明
此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本说明书的实施例,并与说明书一起用于解释本说明书的原理。
图1a是显示scm-198的化学结构的图;
图1b是显示l02细胞乳酸脱氢酶含量检测结果的图;
图1c是显示l02细胞活性cck-8检测结果的图;
图1d是显示l02细胞caspase-3蛋白活性检测结果的图;
图1e是显示l02细胞凋亡tunel染色实验结果的图;
图2a是显示腹腔注射taa后的1.5小时内急性肝损伤生存率的图;
图2b是显示腹腔注射taa后的2.5小时内急性肝损伤生存率的图;
图2c是显示急性肝损伤小鼠体重的图;
图2d是显示急性肝损伤病理切片的图;
图2e是显示急性肝损伤小鼠血清生化指标水平的图;
图3a是显示lx-2细胞迁移检测结果的图;
图3b是显示lx-2细胞edu染色结果的图;
图3c是显示lx-2细胞α-sma蛋白含量测定结果的图;
图4a是显示轻度肝纤维化小鼠超声数字影像活体检测的图;
图4b是显示轻度肝纤维化病理切片的图;
图4c是显示轻度肝纤维化小鼠血清生化指标水平的图;
图4d是显示轻度肝纤维化小鼠体重的图;
图5a是显示中度肝纤维化小鼠数字超声影像活体检测的图;
图5b是显示中度肝纤维化小鼠病理切片的图;
图5c是显示中度肝纤维化小鼠血清生化指标水平的图;
图5d是显示中度肝纤维化小鼠体重的图;
图6a是显示重度肝纤维化小鼠超声数字影像活体检测的图;
图6b是显示重度肝纤维化小鼠病理切片的图;
图6c是显示重度肝纤维化小鼠血清生化指标水平的图;
图6d是显示重度肝纤维化小鼠体重的图;
图7a是显示重度肝纤维化小鼠肝组织再生病理切片的图;
图7b是显示重度肝纤维化小鼠肝组织再生edu染色结果的图;
图7c是显示重度肝纤维化小鼠血清白蛋白含量检测结果的图;
图8a是显示未造模小鼠超声数字影像活体检测的图;
图8b是显示未造模小鼠病理切片的图;
图8c是显示未造模小鼠血清生化指标水平的图。
具体实施方式
病毒(sars-cov、sars-cov-2)感染、全身性炎症因子风暴、药物(诸如:马兜铃酸、对乙酰氨基酚等)诱导所引起的急性肝损伤,临床上还没有特效的保肝药物。慢性肝病的治疗主要分为针对原发病和抗纤维化两方面。从治疗原发病的角度来说,不仅病因多样(病毒、代谢和免疫等),而且,大量的基础与临床实践证明,即使去除病因后,肝纤维化仍然在进展,甚至发展成肝硬化或者肝癌。原因是肝脏损伤时,肝星状细胞受到旁分泌的刺激作用,转化成为肌成纤维细胞,合成细胞外机制增多。即使去除病因后,旁分泌作用逐渐消失,但是,肝星状细胞仍然可以通过自分泌,以及邻近的肝星状细胞的旁分泌而自我活化,促进肝纤维化的持续和进展。从抗纤维化的角度来说,尚无特效的治疗肝纤维化的药物。肝纤维化一旦进展为肝硬化,则疾病不可逆转。除肝移植外,还没有有效的治疗药物与治疗策略,而短缺的肝脏供体及高额的医疗费用限制肝移植的临床应用。
针对上述问题,本发明提供了益母草碱(scm-198)用于预防急性肝损伤和促进肝组织修复与再生的新用途。
在本发明中,通过体外细胞药效学实验和体内动物药效学实验展开的药效学实验证明,scm-198能够有效预防急性肝损伤以及显著促进实验动物肝组织修复与再生。
scm-198是基于中草药益母草的主要生物活性单体成分益母草碱的化学结构合成的化合物,其分子式为:c14h21n3o5;其分子量为:311,其结构式如图1a所示。
本发明通过体外细胞模型和体内动物模型进行药效学实验。首先,应用3%的过氧化氢(hydrogenperoxide,h2o2)损伤人肝实质细胞系l02细胞,制备急性肝损伤细胞模型。急性肝损伤细胞模型实验结果显示,scm-198能够显著促进l02细胞生存,表现为提高l02细胞的生存率,抑制半胱氨酸天冬氨酸蛋白酶-3(cysteinylaspartate-specificproteinase-3,caspase-3)的活性,抑制l02细胞凋亡。应用人转化生长因子-β1(transforminggrowthfactor-β1,tgf-β1)刺激人肝星状细胞系lx-2细胞,制备肝纤维化细胞模型。肝纤维化细胞模型实验结果显示,scm-198能够明显抑制lx-2细胞活化,表现为抑制lx-2细胞迁移、增殖,并促进lx-2细胞凋亡,以及下调α-肌动蛋白(alpha-smoothmuscleactin,α-sma)表达。应用腹腔注射硫代乙酰胺(thioaceylamide,taa)损伤小鼠肝组织,制备急慢性肝损伤动物模型。体内动物模型研究结果显示,scm-198能够有效预防急性肝损伤,明显阻断肝纤维化的进展,降低肝实质细胞外基质的异常沉积,避免肝硬化的发生,并且显著促进肝组织再生。体外和体内实验结果证明,scm-198对肝组织具有显著的保护作用。因此,scm-198可以用作预防急性肝损伤及其相关疾病的药物。scm-198还可以用作促进肝组织修复与再生的药物。具体地,scm-198可以用作预防和治疗肝纤维化及其相关疾病的药物。
所述药物可以仅包含作为活性成分的scm-198,也可以含有scm-198和其他具有同类功效的药物成分,还可以含有作为活性成分的scm-198以及药学上可以接受的辅助剂。
所述药物可通过口服或静脉注射给药。本领域技术人员可根据实际情况确定给药剂量。
所述药物可以制成注射剂、片剂、丸剂、分散剂、软胶囊、滴丸、颗粒剂、溶液、悬浮剂、乳剂等形式。
为了便于理解,以下将通过具体实施例结合附图对本发明进行详细地描述。需要特别指出的是,具体实施例和附图仅是为了说明目的。
主要试剂
scm-198安徽博美生物化工公司;硫代乙酰胺生工生物(上海)公司;edta抗原修复液武汉谷歌生物公司;柠檬酸抗原修复液武汉谷歌生物公司;hrp标记的抗iggperkinelmer公司;dapiinvitrogen公司;多聚甲醛国药集团化学试剂公司;抗体稀释液perkinelmer公司;无水乙醇国药集团化学试剂公司;二甲苯国药集团化学试剂公司;细胞培养级pbs北京索莱宝科技公司;封闭液perkinelmer公司;防荧光淬灭封片剂美国vectorlabs;人tgf-β1mec公司;0.5%tritonx-100北京索莱宝公司;tbst北京索莱宝公司。
实验试剂的配制
1、多聚甲醛溶液(4%)配制:ddh2o(900ml)+naoh(500mg),加热至65℃-70℃,并不断搅拌,添加40g多聚甲醛,持续加热并搅拌至溶解后室温冷却,加100ml,10×pbs,hcl调至ph值7.3,室温保存。
2、硫代乙酰胺(taa)配制:实验前均现配现用,用生理盐水溶解taa,使taa的剂量为200mg/kg,并充分混匀后备用。
主要实验仪器及设备
移液器eppendorf;普通光学显微镜olympus公司;激光扫描共聚焦显微镜leica(sp5);精密电子天平sartoriusla310s;多功能酶标仪tecan(infinitem200);低温离心机eppendorf;全自动智能切片分析系统perkinelmer(vectra);石蜡切片机lecia公司;电热恒温鼓风干燥箱上海福玛实验设备有限公司;4℃冷藏冰箱中国海尔公司;-80℃超低温冷冻冰箱美国thermo公司;超纯水仪美国millex公司;洗板机美国biotek公司。
实验方法
一、细胞模型的建立
1、细胞培养:人肝实质细胞系l02细胞和人肝星状细胞系lx-2细胞购自中国科学院上海生命研究所。用细胞培养级pbs清洗培养皿,加入胰蛋白酶消化细胞,加入新鲜的完全培养基终止消化细胞,吹打细胞后,转移至新的细胞培养皿中,置于37℃,5%co2的培养箱内继续培养。
2、急性肝损伤细胞模型:将处于对数生长期的l02细胞用胰蛋白酶消化收集,按5×104细胞/ml种于12孔板,培养48小时后,细胞分组如下:
正常组:正常培养细胞,不添加任何药物。
安慰剂组:使用3%h2o2处理细胞2小时来构建l02细胞急性氧化损伤模型。当使用3%h2o2处理细胞2小时后,细胞致死率大约50%。再使用安慰剂(用于溶解scm-198的溶剂)处理24小时。
scm-198组:使用3%h2o2处理细胞2小时来构建l02细胞急性氧化损伤模型,再使用scm-198处理24小时。
3、肝纤维化细胞模型:将处于对数生长期的lx-2细胞用胰蛋白酶消化,收集,按5×104细胞/ml接种于12孔板,培养48小时后,细胞分组如下:
正常组:正常培养细胞,不添加任何药物。
安慰剂组:tgf-β1(5ng)和安慰剂(用于溶解scm-198的溶剂)共同处理24小时。
scm-198单独组:scm-198单独处理24小时。
scm-198组:tgf-β1(5ng)和scm-198共同处理24小时。
4、乳酸脱氢酶含量检测
(1)细胞收集:待检测细胞用pbs悬浮,匀浆,离心,收取上清液;
(2)加入待检测细胞和试剂:向待检测上清液中添加试剂(与待检测上清液体积相同的无水乙醇、3ml硫代巴比妥酸、1ml三甲川)之后,漩涡混匀,试管口用保鲜膜扎紧,用针头刺一小孔,沸水浴40分钟;
(3)冷却,12000rpm,离心5分钟;
(4)取上清液,再次12000rpm,离心2分钟;
(5)取上清液,在532nm处,测各管吸光度值。
5、细胞迁移检测
(1)细胞培养至融合;
(2)用pbs清洗后,更换1%血清饥饿过夜;
(3)在细胞上制造划痕,用pbs清洗细胞一次,显微镜下拍摄照片;
(4)添加所需浓度药物之后,继续培养24小时;
(5)将24小时后所拍摄的图像与24小时前同一视野拍的图像做对比。
6、细胞增殖(edu法)检测
(1)细胞培养:取对数生长期细胞,以每孔5×104细胞接种于12孔板中,培养至正常生长阶段;
(2)药物处理:根据实验需要进行药物处理;
(3)edu标记:用pbs按1:1000的比例稀释edu溶液。细胞或组织切片短时间孵育(<2小时)采用高浓度10~50μm,而长时间孵育(>24小时)采用低浓度1~10μm;
(4)细胞或组织切片固定;
(5)细胞或组织切片dapi染色;
(6)拍摄图像。
7、cck-8细胞活性检测
(1)在96孔板中接种细胞悬浮液,细胞毒性实验每孔约5000个细胞;
(2)根据实验需要,确定特定药物刺激浓度以及时间。
(3)药物处理细胞后,每孔加入10μlcck-8试剂(使用相应量的细胞培养基和cck-8试剂,但不添加细胞的孔作为空白对照;使用相应量的细胞培养液和cck-8试剂,但不添加药物的孔作为不加药对照);
(4)在细胞培养箱内继续孵育4小时。
(5)用酶标仪测定在450nm处的吸光值。
8、caspase-3蛋白活性检测
(1)用胰蛋白酶消化细胞,收集细胞培养液。1000rpm,4℃离心5分钟,去上清。加入20μl细胞裂解液,重悬沉淀,冰浴裂解细胞15分钟;
(2)12000rpm,4℃离心15分钟;
(3)将上清转移到预冷的离心管中;
(4)取出ac-devd-ρna(2mm),置于冰浴上备用;
(5)加入ac-devd-ρna(2mm),混匀,37℃孵育2小时。
(6)待测样本的a405(吸光度)扣除空白对照的a405,即为样品中caspase-3催化产生的ρna产生的吸光度。
9、细胞免疫荧光检测
(1)培养好的待检测细胞的细胞载破片用pbs浸洗3次,每次3分钟;
(2)4%多聚甲醛固定细胞载破片15分钟,pbs溶液浸洗细胞载破片3次,每次3分钟;
(3)0.5%tritonx-100室温通透20分钟;
(4)用pbs浸洗细胞载破片3次,每次3分钟,吸干pbs,在细胞载破片上滴加山羊血清,室温封闭30分钟;
(5)去封闭液,滴加一抗(1:200稀释)后放入湿盒4℃孵育过夜;
(6)tbst浸洗细胞载破片3次,每次3分钟,去多余液体,滴加荧光二抗(1:1000稀释)后,室温孵育1小时,tbst浸洗3次,每次3分钟;
(7)滴加dapi避光孵育5分钟,tbst浸洗4次,每次5分钟;
(8)吸干细胞载破片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察,并采集图像。
10、细胞凋亡(tunel法)检测
(1)将接种于24孔板的细胞或组织切片用pbs漂洗5分钟。用预冷的4%多聚甲醛于4℃固定30分钟,pbs漂洗3次,每次5分钟,加入含0.5%tritonx-100的pbs冰浴5分钟;
(2)向细胞或石蜡切片滴加50μl的3%h2o2,室温避光静置10分钟;
(3)将细胞或石蜡切片浸入pbs,室温避光放置5分钟;
(4)阳性对照(即安慰剂tunel/dapi):滴加50μl阳性对照缓冲液(5μl10×dnasei与45μl1×dnasei缓冲液混合),室温静置10分钟,浸入pbs,室温放置5分钟;
(5)阴性对照(即正常tunel/dapi):滴加不含10×enzymereagent的tunel反应缓冲液(45μl1×labelingsubstrate与5μl去离子水混合),37℃避光孵育90分钟;
(7)浸入pbs,室温放置5分钟;
(8)荧光显微镜观察:细胞或组织切片用dapi复染细胞核5分钟,用抗荧光淬灭剂封片,488nm波长激发,立刻进行观察。
二、小鼠急慢性肝损伤模型的建立
急慢性肝损伤动物模型对于研究与该疾病相关的潜在机制和治疗都有十分重要的作用。目前,急慢性肝损伤模型应用肝毒素,如四氯化碳(ccl4)或taa腹腔注射,和利用胆总管结扎术(cbdl)等手段来制作急慢性肝损伤模型。taa损伤肝组织实质细胞的机制为:taa是包含硫羟-硫的化合物,经过进一步代谢为乙酰胺和taa-s-氧化物。乙酰胺无肝坏死作用,而taa-s-氧化物则继续由细胞色素p450单加氧酶进一步代谢,生成包括称作“异磺胺甲基嘧啶(sulfene)”极性产物(taa-s-氧化钛),化学性质非常活泼。这种代谢产物能够与肝细胞内大分子结合,产生大量的氧自由基(ros),干扰线粒体活性,以致肝细胞凋亡、坏死,以及血清细胞因子水平升高。首先,制备胆总管结扎模型过程中会带来创伤,而且在这个模型中可能引起的肝纤维化不明显或微乎其微,且cbdl模型是在短期(一般为3-5天)下完成的,而肝纤维化是慢性肝损伤的结果。相比之下,肝纤维化引起的肝毒素一旦形成则非常稳定,循环肝毒素不良影响可以通过简单地停止造模药腹腔注射四周以上而被最小化。其次,与ccl4相比,taa诱发的肝纤维化具有较低的死亡率,肝损伤更加明显,再生结节更加突出,其组织学与人类慢性肝损伤组织学更加接近。因此,在本实施例中,采用国际学术公认的造模方法,即连续/隔日腹腔注射taa的方法制备急慢性肝损伤模型。使用的taa的剂量为200mg/kg。在制备急性肝损伤模型中,腹腔注射taa每天一次,持续一周。在制备慢性肝损伤模型中,腹腔注射taa隔天一次,分别按照不同的实验周期,持续四周、八周和十二周。
实验动物:c57bl/6小鼠,8周龄,重量20-22g;购自上海灵畅生物科技有限公司。饲养条件:分别为5只/笼,spf级,25℃恒温,光照/黑暗12小时循环,食物与饮水随机喂食。饲养地点:同济大学沪北校区动物实验中心。动物管理及使用:严格按照同济大学医学院伦理委员会制定的实验室动物管理与使用条例。
1、急性肝损伤实验动物模型
在世界范围内,病毒感染、炎症因子风暴、或药物诱导所引起的急性肝衰竭事件不断发生。n-乙酰基半胱氨酸(n-acetylcysteine,nac),一种抗氧化剂,是临床上最常用的肝解毒药物。
c57bl/6小鼠,8周龄,重量20-22g,随机分成4组:
(ⅰ)正常组:正常饲养,不做任何药物处理。
(ⅱ)安慰剂组:腹腔注射taa之后的1.5小时内和2.5小时内附加腹腔注射安慰剂(用于溶解scm-198的溶剂)。
(ⅲ)nac组:腹腔注射taa之后的1.5小时内和2.5小时内附加腹腔注射nac(250mg/kg)。
(ⅳ)scm-198组:腹腔注射taa之后的1.5小时内和2.5小时内附加腹腔注射scm-198(2mg/kg)。
急性肝损伤经每天腹腔注射一次taa(200mg/kg)诱导,持续到实验结束。第一次实验是生存性实验,用于小鼠生存分析。第二次实验是病理性实验,用于小鼠病理分析。在第二次实验的过程中,taa诱导4天后,剩余小鼠全部处死,收取所有处死小鼠的肝组织进行病理分析。
2、慢性肝损伤实验动物模型
(1)制备肝纤维化实验动物模型
轻度肝纤维化实验动物模型:小鼠接受隔日腹腔注射taa,造模四周后,从中央静脉或汇管区扩大到周边地区,均出现了明显的纤维组织增生,观察到汇管区-汇管区桥接(p-p桥接)和汇管区-中央静脉区桥接(p-c桥接)。肝纤维化分期ishak指数为3,属于s1期轻度肝纤维化。因此,小鼠轻度肝纤维化造模成功。
中度肝纤维化实验动物模型:小鼠接受隔日腹腔注射taa,造模八周后,从中央静脉或汇管区扩大到周边地区,均出现了明显的纤维组织增生,p-p桥接和p-c桥接明显可见。肝纤维化分期ishak指数为4,属于s2期中度肝纤维化。因此,小鼠中度肝纤维化造模成功。
重度肝纤维化实验动物模型:小鼠接受隔日腹腔注射taa,造模十二周后,肝组织可见大量的纤维间隔形成,并分隔破坏肝小叶,导致小叶结构紊乱,但尚无肝硬化出现,部分小鼠出现门静脉高压。肝纤维化分期ishak指数为5,属于s3期重度肝纤维化。因此,小鼠重度肝纤维化造模成功。
(2)慢性肝损伤实验动物模型分组
根据各造模周期的肝纤维化实验动物,随机分成3组:
(ⅰ)正常组:正常饲养,不做任何药物处理;
(ⅱ)安慰剂组:根据不同的实验周期,经腹腔注射taa造模成功后,再腹腔注射安慰剂(用于溶解scm-198的溶剂);
(ⅲ)scm-198组:根据不同的实验周期,经腹腔注射taa造模成功后,再腹腔注射scm-198(2mg/kg)。
三、小鼠血液及肝组织标本的收集
1、血液标本收集:异氟烷麻醉小鼠,眼球摘除法取血。1.5毫升离心管收集好全血后,室温静置6小时。10000g,4℃离心10分钟,收集上层淡黄色液体,-80℃冰箱保存。
2、肝组织收集:将小鼠全身浸泡于75%乙醇片刻。暴露腹腔,用剪刀和镊子将整块肝脏取下后,在4%多聚甲醛中室温放置。
四、血清生化检测
小鼠血清生化指标谷丙转氨酶(alaninetransaminase,alt)、谷草转氨酶(aspartatetransaminase,ast)、碱性磷酸酶(alkalinephosphatase,alp)和白蛋白(albumin,alb)检测分别采用:丙氨酸转氨酶检测试剂盒(bioassaysystems,cat#:ealt-100);谷草转氨酶检测试剂盒(bioassaysystems,cat#:eastr-100);碱性磷酸酶检测试剂盒(bioassaysystems,cat#:dalt-250);白蛋白检测试剂盒(bioassaysystems,cat#:diag-250)。根据上述试剂盒操作手册进行。
五、肝组织标本病理分析
1、病理切片:
(1)固定样本:4%多聚甲醛室温固定24小时后,置于4℃冰箱备用。
(2)脱水:组织样本清洗后置于梯度乙醇进行脱水,即:75%、85%、90%、95%乙醇,各浸泡30分钟、10分钟、5分钟、30分钟,并重复3次。最后一次,纯乙醇浸泡60分钟。
(3)透明:样本置于二甲苯中浸泡20分钟,使组织变为透明。
(4)石蜡包埋组织样本:将样本依次在石蜡中浸泡30分钟、45分钟、60分钟,最后在熔点58℃的石蜡中进行包埋。包埋完成后,用切片机切成厚度约4nm的薄片,附在载玻片上,置60℃孵育2小时常温过夜,4℃保存。
2、免疫组织化学染色:将切好的切片在75℃烤箱150分钟,至蜡滴状。依次进行脱蜡处理。先用二甲苯脱蜡10分钟×2次,再通过100%、90%、70%酒精各处理5分钟。去离子水浸润1分钟去除过氧化物酶干扰。
3、he染色:石蜡切片脱蜡后苏木素染色10分钟,1%盐酸乙醇分化5秒钟,去离子水冲洗切片变蓝为止,然后依次经过乙醇、二甲苯脱水。最后中性树胶封片。
4、苦味酸天狼星红染色:先用预染液染色1小时,自来水漂洗。再用95%、100%乙醇分别浸泡3分钟,二甲苯透明30分钟。最后用树胶封片。
5、pas染色:先用高碘酸37℃浸泡60分钟后冲洗。再用希夫试剂37℃浸泡60分钟。接着用乙醇梯度脱水,二甲苯透明。最后中性树胶封片。
6、马松染色:
(1)苏木素染细胞核:先用苏木素染色5分钟,用温水冲洗10分钟;1%盐酸乙醇分化5秒钟,去离子水冲洗切片变蓝为止。
(2)丽春红染色:用丽春红溶液染色10分钟,去离子水漂洗数3次。
(3)磷钼酸分化:磷钼酸溶液分化15分钟,使胶原染色不再呈红色。
(4)苯胺蓝染色:将切片直接转移到苯胺蓝溶液中复染色5分钟,在蒸馏水中冲洗5秒钟后,1%冰醋酸处理1分钟。
(5)脱水封片:将切片依次放入95%乙醇、无水乙醇、二甲苯各5分钟脱片至透明。最后,中性树胶封片。
7、结果分析:根据ishak系统评分规则进行评估肝纤维化(表1.1)。根据“北京标准”对有纤维间隔ishak≥3期做进一步分析细化(表1.2)。
表1.1ishak系统评分规则
表1.2肝纤维化分期标准(1995年,北京)
六、统计分析
石蜡切片免疫化学染色的阳性细胞和阳性染色面积的定量,使用imagg软件进行分析。生存分析通过时间等级检验(log-ranktest)与wilcoxontest检验进行。实验结果使用双尾t检验,p<0.05表示统计学显著差异,实验数据表示平均值±标准差。统计图由graphpadprism7.0绘制完成。
实施例1、scm-198在预防急性肝损伤方面的作用
scm-198促进人肝实质细胞系l02细胞的生存
急性肝损伤细胞模型实验结果显示,scm-198对l02细胞具有明显的保护作用,具体表现为:根据乳酸脱氢酶含量检测结果,如图1b所示,scm-198能够有效降低3%h2o2诱导的氧化应激损伤,scm-198组l02细胞的生存率较安慰剂组相比提高65.76%;根据细胞活性cck-8检测结果,如图1c所示,scm-198能够有效维持l02细胞原有的细胞功能,scm-198组l02细胞的活性较安慰剂组相比提升127.46%;根据凋亡蛋白caspase-3的活性检测结果,如图1d所示,scm-198能够有效抑制凋亡蛋白caspase-3的活性,scm-198组l02细胞的凋亡蛋白caspase-3活性较安慰剂组相比下降92.04%;根据tunel染色结果,如图1e所示,scm-198能够有效抑制3%h2o2诱导的l02细胞凋亡,scm-198组l02细胞的细胞凋亡率较安慰剂组相比降低74.86%。
scm-198提高急性肝损伤小鼠的生存率
急性肝损伤小鼠(连续腹腔注射硫代乙酰胺(taa)后的1.5小时内)生存率的实验中,如图2a所示,安慰剂组(taa+安慰剂)小鼠在连续腹腔注射taa后的第七天全部死亡;nac(n-乙酰半胱氨酸)组(taa+nac)小鼠在连续腹腔注射taa的第十天后的成活率为40%;scm-198(益母草碱)组(taa+scm198)小鼠在连续腹腔注射taa的第十天后的成活率是100%。扩大实验的时间窗口,急性肝损伤小鼠(连续腹腔注射taa后的2.5小时内)生存率的实验中,如图2b所示,安慰剂组小鼠在连续腹腔注射taa后的第六天全部死亡;nac组小鼠在连续腹腔注射taa后的第七天全部死亡;scm-198组小鼠在连续腹腔注射taa的第十天后的成活率仍然是100%。因此,扩大实验的时间窗口后,即连续腹腔注射taa后的2.5小时内,scm-198仍然可以有效保护小鼠由taa诱导的急性肝损伤,且成活率为100%;然而,在连续腹腔注射taa后的1.5小时后,nac的保护效力与安慰剂组相比没有明显的统计学差异。
scm-198保护急性肝损伤小鼠肝糖原合成功能
糖原代谢是成熟的肝实质细胞的一个重要功能,利用糖原pas染色分析糖原在小鼠肝组织中的分布,如图2d所示,pas染色实验显示,安慰剂组小鼠肝组织大面积呈现灰白,染色面积平均百分比为12.68%,说明小鼠肝脏肝糖原合成功能受到taa的严重破坏。相比之下,scm-198组小鼠肝组织小面积呈现灰白,大部分区域呈粉红色阳性染色,染色面积平均百分比52.12%,结果具有显著差异。因此,pas染色说明,scm-198能够保护急性肝损伤小鼠的肝糖原合成功能,有效预防由taa诱导的急性肝损伤。
scm-198抑制急性肝损伤小鼠的肝组织细胞凋亡
小鼠肝组织石蜡切片he染色和组织细胞凋亡tunel染色进行肝组织病理学分析,如图2d所示,he染色和tunel染色结果显示,scm-198组小鼠肝组织细胞凋亡率较安慰剂组相比下降27.06%,显著促进炎症的消失。
scm-198降低急性肝损伤小鼠血清alt、ast和alp的水平
血清生化指标alt、ast和alp是反映小鼠肝组织损伤程度的三个重要指标。血清生化指标检测显示,如图2e所示,在taa连续腹腔注射后的2.5小时之内,scm-198组小鼠血清生化指标alt、ast和alp的水平较安慰剂组相比分别降低86.33%、52.95%和73.78%。
scm-198明显改善急性肝损伤小鼠的体重减轻现象
每日监测各实验组小鼠的体重,如图2c所示,与安慰剂组相比,scm-198能够明显改善小鼠由taa诱导的急性肝损伤而引起的体重减轻现象,显著提高了小鼠对taa的耐受性。
体外细胞和体内小鼠实验结果证明,scm-198能够有效预防由taa诱导的急性肝损伤,避免小鼠急性肝衰竭的发生,提高小鼠的生存率,具有较高的保护效力,且保护效力明显优于临床上较为常用的保肝药物nac。
实施例2、scm-198在促进肝组织修复与再生方面的作用
scm-198抑制人肝星状细胞系lx-2细胞的活化
肝纤维化细胞模型实验结果显示,scm-198对lx-2细胞活化具有明显的抑制作用,具体表现为:根据细胞迁移检测结果,如图3a所示,scm-198组lx-2细胞迁移率较安慰剂组相比降低20.61%。根据edu染色结果,如图3b所示,scm-198组lx-2细胞增殖率较安慰剂组相比降低80.97%。根据细胞α-sma蛋白表达检测结果,如图3c显示,scm-198组lx-2细胞α-sma蛋白表达较安慰剂组相比降低25.71%。
scm-198阻断轻度肝纤维化的形成
超声数字影像活体检测scm-198对小鼠轻度肝纤维化的阻断效果,如图4a所示,scm-198组小鼠肝区回声密度较安慰剂组相比降低30.92%。病理切片分析,如图4b所示,scm-198组小鼠p-p桥接和p-c桥接消失;苦味酸天狼星红染色面积为3.95%。肝纤维化分期ishak指数为0-1,属于s0期无纤维化。与之形成鲜明对比的是,安慰剂组小鼠肝纤维化没有任何改善。苦味酸天狼星红染色面积为8.05%,肝纤维化分期ishak指数为3,仍然属于s1期轻度肝纤维化。小鼠血清生化指标检测显示,如图4c所示,scm-198组小鼠血清生化指标alt、ast和alp的水平较安慰剂组相比分别降低89.96%、66.87%和80.73%。每日监测各实验组小鼠的体重,如图4d所示,与安慰剂组相比,scm-198能够有效改善小鼠由taa诱导的轻度肝纤维化而引起的体重减轻现象。
scm-198抑制中度肝纤维化进展
超声数字影像活体检测scm-198对小鼠中度肝纤维化的抑制效果,如图5a所示,scm-198组小鼠肝区回声密度较安慰剂组相比降低73.48%。病理切片分析,如图5b所示,scm-198组小鼠p-p桥接和p-c桥接减少;苦味酸天狼星红染色面积为5.95%。肝纤维化分期ishak指数为0-1,属于s0期无纤维化。与之形成鲜明对比的是,安慰剂组小鼠肝纤维化没有任何改善。苦味酸天狼星红染色面积为9.06%,肝纤维化分期ishak指数为4,仍然属于s2期中度肝纤维化。小鼠血清生化指标检测显示,如图5c所示,scm-198组小鼠血清生化指标alt、ast和alp的水平较安慰剂组相比分别降低72.91%、55.43%和63.52%。每日监测各实验组小鼠的体重,如图5d显示,与安慰剂组相比,scm-198能够有效改善小鼠由taa诱导的中度肝纤维化而引起的体重减轻现象。
scm-198减轻重度肝纤维化程度
超声数字影像活体检测scm-198对小鼠重度肝纤维化的减轻效果,如图6a所示,scm-198组小鼠肝区回声密度较安慰剂组相比降低67.26%。病理切片分析,如图6b所示,scm-198组小鼠p-p桥接和p-c桥接减少;苦味酸天狼星红染色面积为7.95%。肝纤维化分期ishak指数为2,属于s1期轻度纤维化。与之形成鲜明对比的是,安慰剂组小鼠肝纤维化没有任何改善。苦味酸天狼星红染色面积为12.08%,肝纤维化分期ishak指数为5,仍然属于s3期重度肝纤维化。小鼠血清生化指标检测显示,如图6c所示,scm-198组小鼠血清生化指标alt、ast和alp的水平较安慰剂组分别降低62.83%、44.06%和48.75%。但是,每日监测各实验组小鼠的体重,如图6d所示,与安慰剂组相比,scm-198不能有效改善小鼠由taa诱导的重度肝纤维化而引起的体重减轻现象。
scm-198促进肝组织再生
基于肝脏在体内代谢中的主导地位,肝脏在长期进化中具备独特的再生能力,使得肝组织能够在损伤后修复,维持重要的生理功能。尽管如此,在肝脏疾病中,尤其在肝纤维化过程中,肝脏再生的能力丧失,不能有效地恢复生理功能,出现严重的肝功能衰竭。因此,如何更好地促进肝脏在慢性肝损伤后再生,加速肝脏结构与功能的恢复具有非常重要的意义。
我们评估scm-198在治疗重度肝纤维化的过程中,促进肝组织修复与再生的能力。石蜡切片免疫组织化学染色检测与肝组织内肝实质细胞增殖相关的关键蛋白pcna和ki67的表达,如图7a所示;肝组织内肝实质细胞edu染色,如图7b所示;进行肝组织修复与再生程度分析。石蜡免疫组化和edu染色结果显示,在重度肝纤维化模型中,scm-198组小鼠肝组织内的肝实质细胞pcna和ki67蛋白表达水平较安慰剂组相比分别上升53.16%和40.71%。scm-198组小鼠肝组织内的肝实质细胞edu染色阳性率较安慰剂组相比上升302%。小鼠血清白蛋白检测结果,如图7c所示,scm-198组小鼠血清白蛋白较安慰剂组相比上升129.31%。上述结果表明,scm-198在改善慢性肝损伤的过程中,也积极促进肝组织再生。
scm-198在体内无明显肝毒性作用
各实验组小鼠在接受scm-198连续腹腔注射的过程中,均无发生死亡现象。在非造模给药的过程中,小鼠接受scm-198连续腹腔注射四周,超声数字影像检测结果显示,如图8a所示,scm-198组小鼠肝区回声较正常组相比无明显异常。病理切片结果显示,如图8b所示,scm-198组小鼠肝组织较正常组相比无明显异常。tunel染色结果显示,如图8b所示,scm-198组小鼠肝组织较正常组相比无明显损伤。血清生化指标检测结果显示,如图8c所示,scm-198组小鼠血清生化指标较正常组相比均无明显升高。上述实验结果证明,scm-198对小鼠肝组织无明显肝毒性作用。
- 还没有人留言评论。精彩留言会获得点赞!