氟比洛芬钠凝胶及其制备方法与流程
本申请针对以下中国专利申请提出优先权请求:
申请号:201910134586.3
申请日:2019年02月23日
申请名称:一种氟比洛芬盐的经皮给药制剂及其制备方法
本发明属于医药制剂领域,特别涉及一种氟比洛芬钠凝胶及其制备方法。
背景技术:
氟比洛芬(flb)为芳基丙酸类非甾体抗炎药,为非选择性环氧化酶抑制剂,具备较强的消炎、止痛和退热功能。氟比洛芬的药用化合物主要为氟比洛芬、氟比洛芬钠和氟比洛芬酯。根据给药途径及制剂特点等,分别选择不同药用化合物开发成制剂产品上市销售。国内外氟比洛芬上市剂型有:片剂、颗粒剂、胶囊剂、凝胶贴膏和贴剂。氟比洛芬钠上市剂型为滴眼液和眼用凝胶。氟比洛芬酯仅上市注射液。
口服氟比洛芬的副作用主要为胃肠道不良反应,易引起消化道溃疡和出血。经皮给药则能有效的避免胃肠道的不良反应,凝胶贴膏的不良反应率约为7.38%,主要为瘙痒、发红、皮疹、斑疹和疼痛感,分析原因主要为膏体基质及凝胶膏的透气性较差引起。
凝胶剂为稠厚半固体制剂,具有吸收速度快、生物相容性好,且质地均匀、易于涂展和洗除、使用方便、患者依从性好等优点,且水凝胶制剂的主要成分为水,少量凝胶基质、保湿剂和抑菌剂等,由基质引起不良反应的可能性显著降低。故研究开发氟比洛芬凝胶,可以迅速发挥药效,增强其顺应性,降低不良反应率。
目前市场上已上市的氟比洛芬钠眼用凝胶,浓度为0.03%,无法满足经皮给药的局部镇痛作用。
因此,开发合适浓度的氟比洛芬凝胶制剂用于抗炎、止痛和退热很有必要。
技术实现要素:
本发明的目的在于提供一种透皮吸收效果好的氟比洛芬钠凝胶制剂处方,该处方制备成分和工艺简单,与直接使用氟比洛芬制备水凝胶相比,不仅透皮性能增强,且有机溶剂用量少,环境友好,适合工业化大生产,产品质量稳定,符合药用要求。
氟比洛芬水溶性较差,室温下纯水中的饱和溶解度约0.033mg/ml,而氟比洛芬钠水溶性明显提高,饱和溶解度约36mg/ml,比氟比洛芬高1000余倍。通过试验结果可知,以氟比洛芬为原料药制备凝胶,需消耗大量有机溶剂,制备1%规格需使用约40%异丙醇作为溶剂,而氟比洛芬钠水溶性显著提高,不使用有机溶剂即可制备约3%(以氟比洛芬计)规格水凝胶。
为对比氟比洛芬和氟比洛芬钠的透皮能力,以40%异丙醇为溶剂,使用相同处方工艺分别制备1%(以氟比洛芬计)规格的氟比洛芬凝胶和氟比洛芬钠凝胶,采用大鼠腹部皮肤经franz扩散试验证明,氟比洛芬钠透皮释放较快,透皮能力更强。
通过实验的摸索,本发明提供一种透皮吸收效率高,有机溶剂使用少的氟比洛芬钠凝胶制剂,所述药物制剂包括:按药物制剂总重量计,活性成分氟比洛芬钠为0.5-5%,基质为0.5-5%,溶剂为50-95%,防腐剂为0.1-1.0%。
进一步,该药物制剂包括:按药物制剂总重量计,活性成分氟比洛芬钠为0.1-3%,基质为0.5-5%,溶剂为70-95%,防腐剂为0.1-1.0%。
进一步,该药物制剂还包括:ph调节剂,按药物制剂总重量计,ph调节剂为0-5%。
进一步,该药物制剂还包括:经皮吸收促渗剂,按药物制剂总重量计,经皮吸收促渗剂为0.1-20%。
进一步,上述基质为卡波姆、羟丙甲纤维素和羧甲基纤维素钠中的一种或几种,优选卡波姆。
进一步,上述溶剂为异丙醇、甘油、丙二醇、乙醇、纯化水中的一种或多种,优选纯化水、丙二醇、异丙醇和乙醇中的一种或多种。
进一步,上述防腐剂为羟苯甲酯、羟苯乙酯、羟苯丙酯、苯甲酸、苯甲酸钠、醋酸氯己定、硫柳汞、苯氧乙醇一种或几种,优选羟苯甲酯、羟苯乙酯、羟苯丙酯中的一种或多种。
进一步,上述ph调节剂为三乙醇胺、二乙醇胺、氨丁三醇、氢氧化钠、三乙胺中的一种或多种,优选三乙醇胺和氨丁三醇中的一种或多种。
进一步,上述经皮吸收促渗剂为薄荷脑、薄荷素油、月桂氮卓酮、n-甲基吡咯烷酮、肉豆蔻酸异丙酯、克罗米通中的一种或多种,优选薄荷脑、肉豆蔻酸异丙酯和克罗米通中的一种或多种。
本发明还提供一种氟比洛芬钠凝胶的制备方法,该方法包括但不局限于:
1)将基质加入水中充分溶胀,制备凝胶基质。
2)将防腐剂、经皮吸收促进剂、活性成分加入溶剂中,溶解后加入凝胶基质中搅拌均匀即得。
本发明的一个具体实施例,取卡波姆130g,加至4900g水中,充分溶胀后,加入250g三乙醇胺和1500g丙二醇,搅拌30分钟,得凝胶基质。取异丙醇1000g,加10g羟苯乙酯和10g薄荷脑,搅拌10分钟,加入2000g水,再加入200g氟比洛芬钠,溶解后加至凝胶基质中,搅拌30分钟,即得。
本发明还包括了使用本发明制备的氟比洛芬钠凝胶用于消炎、解热和镇痛的用途。
采用本发明制备的氟比洛芬钠凝胶有如下优势:
1、本发明方法制备的氟比洛芬钠凝胶经皮肤给药,可避免口服氟比洛芬制剂引起的胃肠道不良反应,患者依从性好;
2、本发明处方成分和工艺简单,显著减少有机溶剂用量,环境友好,适合工业化大生产;
3、本发明制备的氟比洛芬钠凝胶透皮吸收效果好,产品质量稳定,符合药用要求。
附图说明
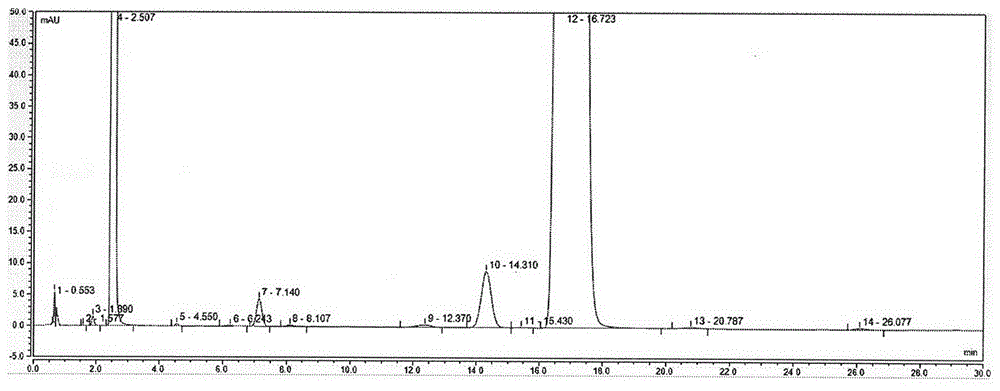
图1为加速试验6月稳定性样品的有关物质检测图谱;
图2为长期试验6月稳定性样品的有关物质检测图谱。
具体实施方式
下面通过具体实施例对本申请作进一步详细说明。以下实施例仅对本申请进行进一步说明,不应理解为对本申请的限制。
本发明所用的试剂和原辅料均市售可得。
实施例1透皮吸收效果对比实验
1%氟比洛芬凝胶配方及制备方法:
取20g羟丙甲纤维素k100m,加至570g水中,充分溶胀,得凝胶基质,备用;取10g氟比洛芬,加至400g异丙醇中,溶解后加至凝胶基质,搅拌均匀即得,规格:1%(以氟比洛芬计)。
1%氟比洛芬钠凝胶配方及制备方法:
取20g羟丙甲纤维素k100m,加至567.6g水中,充分溶胀,得凝胶基质,备用;取12.4g氟比洛芬钠,加至400g异丙醇中,溶解后加至凝胶基质,搅拌均匀即得,规格:1%(以氟比洛芬计)。
对比透皮能力的试验方法:将离体大鼠腹部皮肤固定在立式franz扩散池上,皮肤接收面积3.14cm2,取凝胶约0.3g,均匀涂抹至皮肤上,以32℃ph7.4磷酸盐缓冲液为接收液,分别于0.5、1、2、4、6小时将接收液完全取出测定含量,并补加32℃接收液,计算各时间点的累积透过量;
表1:1%(以氟比洛芬计)规格的氟比洛芬凝胶和氟比洛芬钠凝胶经大鼠腹部皮肤的累积透过量(mcg/cm2)
由表1实验结果可知,氟比洛芬钠的透皮性能较好,氟比洛芬钠凝胶经大鼠皮肤0.5h和1h的累积透过量分别为氟比洛芬的约1.5和1.6倍,4h和6h两者的累积释放度均大于80%。
实施例2
配方及及制备方法:
取卡波姆150g,加至6210g水中,充分溶胀。取60g氢氧化钠加至1000g水中,溶解,加至卡波姆溶液中,搅拌30分钟,得凝胶基质。取乙醇1000g,丙二醇500g,加10g苯甲酸、10g肉豆蔻酸异丙酯和10g薄荷素油,搅拌10分钟,加入1000g水,再加入50g氟比洛芬钠,溶解后加至凝胶基质中,搅拌30分钟,即得。
实施例3
配方及及制备方法:
取羧甲基纤维素钠300g,加至6560g水中,充分溶胀,加入1000g甘油,搅拌均匀,备用。取乙醇2000g,加5g羟苯甲酯、15g羟苯乙酯、10g月桂氮卓酮和10g薄荷脑,搅拌10分钟,再加入100g氟比洛芬钠,溶解后加至凝胶基质中,搅拌30分钟,即得。
实施例4
配方及及制备方法:
取卡波姆130g,加至5000g水中,充分溶胀后,加入250g三乙醇胺和1500g丙二醇,搅拌30分钟,得凝胶基质。取异丙醇1000g,加10g羟苯乙酯和10g薄荷脑,搅拌10分钟,加入2000g水,再加入100g氟比洛芬钠,溶解后加至凝胶基质中,搅拌30分钟,即得。
实施例5
配方及及制备方法:
取卡波姆130g,加至4900g水中,充分溶胀后,加入250g三乙醇胺和1500g丙二醇,搅拌30分钟,得凝胶基质。取异丙醇1000g,加10g羟苯乙酯和10g薄荷脑,搅拌10分钟,加入2000g水,再加入200g氟比洛芬钠,溶解后加至凝胶基质中,搅拌30分钟,即得。
实施例6
配方及及制备方法:
取卡波姆130g,加至4800g水中,充分溶胀后,加入250g三乙醇胺和1500g丙二醇,搅拌30分钟,得凝胶基质。取异丙醇1000g,加10g羟苯乙酯和10g薄荷脑,搅拌10分钟,加入2000g水,再加入300g氟比洛芬钠,溶解后加至凝胶基质中,搅拌30分钟,即得。
实施例7
配方及及制备方法:
取卡波姆120g,加至4270g水中,充分溶胀。取300g氨丁三醇加至1000g水中,溶解,加至卡波姆溶液中,搅拌30分钟,得凝胶基质。取异丙醇2000g,加10g羟苯乙酯,搅拌10分钟,加入2000g水,再加入300g氟比洛芬钠,溶解后加至凝胶基质中,搅拌30分钟,即得。
实施例8
配方及及制备方法:
取卡波姆150g,加至5820g水中,充分溶胀后,加入300g三乙醇胺,搅拌30分钟,得凝胶基质。取异丙醇1000g,加5g羟苯乙酯、5g羟苯丙酯和10g薄荷脑和10g月桂氮卓酮,搅拌溶解后,加至凝胶基质中,搅拌10分钟;另取1700g水,加500g聚山梨酯80,搅拌均匀,再加入500g氟比洛芬钠,溶解后加至凝胶基质中,搅拌30分钟,即得。
实施例9氟比洛芬钠凝胶透皮吸收效果测定
分别测定实施例4、实施例5和实施例6经大鼠皮肤的透皮吸收效果。
将离体大鼠腹部皮肤固定在立式franz扩散池上,皮肤接收面积3.14cm2,取凝胶约0.3g,均匀涂抹至皮肤上,以32℃ph7.4磷酸盐缓冲液为接收液,分别于0.5、1、2、4、6小时将接收液完全取出测定含量,并补加32℃接收液,计算各时间点的平均累积透过量,n=6。
表2:氟比洛芬钠凝胶经大鼠腹部皮肤的累积透过量(mcg/cm2)
透皮结果表明,实施例4、实施例5和实施例6制剂透皮性能均较好,各时间点的累积透过量随着制剂规格的升高而增加。
实施例10氟比洛芬钠凝胶药效学研究、皮肤刺激性和局部过敏性试验
1、药效学研究
对实施例4、实施例5和实施例6进行药效学试验:健康雄性wistar大鼠60只,随机分为正常对照组、模型对照组、空白对照组、氟比洛芬钠凝胶-1组、氟比洛芬钠凝胶-2组和氟比洛芬钠凝胶-3组,每组10只,正常对照组经后肢膝关节注射生理盐水,其他组经后肢膝关节注射4%的木瓜蛋白酶溶液。膝关节注射后,正常对照组和模型对照组涂抹约0.1g生理盐水,空白对照组涂抹约0.1g空白凝胶,氟比洛芬钠凝胶-1组、氟比洛芬钠凝胶-2组和氟比洛芬钠凝胶-3组分别涂抹约0.1g实施例4、实施例5或实施例6的氟比洛芬钠凝胶,给药次数:一日一次,连续给药7天,每日记录大鼠关节肿胀度和后肢支撑力,并于第7天时测定各大鼠足趾关节组织冲洗液中cox-1和cox-2含量。结果表明,模型对照组和空白对照组随着造模时间的延长,关节出现了重度红肿现象,后肢支撑力显著减弱,且两组检测指标无显著性差异;正常对照组关节无任何异常变化;与空白对照组和模型对照组相比,氟比洛芬钠凝胶-1组、氟比洛芬钠凝胶-2组和氟比洛芬钠凝胶-3组的红肿程度明显较弱;氟比洛芬钠凝胶-2组和氟比洛芬钠凝胶-3的肿胀程度无显著性差异,均为轻度红肿;给予氟比洛芬钠凝胶的3组大鼠后肢支撑力均显著大于模型对照组和空白对照组,且cox-1和cox-2含量显著低于模型对照组和空白对照组。证明氟比洛芬钠凝胶经皮吸收后可显著抑制cox-1和cox-2,降低关节炎肿胀度和疼痛感,发挥疗效,且具有一定的量效关系。
2.皮肤刺激性和局部过敏性试验
对实施例5进行了局部过敏性试验:使用白化豚鼠18只(雌雄各半),随机分空白对照组、氟比洛芬钠凝胶组和阳性对照组(2,4-二硝基氯苯),每组6只(雌雄各半),于试验第1天、8天和15天,右侧背部局部给药致敏;于试验第15天,左侧肋腹部给药激发,激发后6h、24h和48h观察皮肤过敏反应情况。结果:氟比洛芬钠凝胶组及空白对照组激发反应平均值为0,即均无过敏反应,而阳性对照组激发反应平均值为1.3、致敏率为100%,具有极强的致敏性。
对实施例5进行了皮肤刺激性试验:使用新西兰白兔6只(雌雄各半),采用同体左右侧自身对比法,左侧给予本品,右侧给予对照品(空白凝胶)涂抹给药,给药期间及未次给药后3天内,给药单位均未见红斑和水肿,由此证明:此试验条件下,本品对家兔皮肤无刺激作用。
实施例11氟比洛芬钠凝胶稳定性研究
按实施例5处方工艺进行中试放大样品制备,批量:100kg,将凝胶灌装至药用铝质软管中,20g/支,封尾,进行加速和长期稳定性试验,加速试验条件:40℃±2℃、rh75%±5%,长期试验条件:25℃±2℃、rh60%±5%,分别取样检验性状、ph值、黏度、有关物质和含量,加速试验6月稳定性样品的有关物质检测图谱如图1、长期试验6月稳定性样品的有关物质检测图谱如图2。结果见下表:
加速试验结果(条件40℃±2℃、rh75%±5%)
长期试验结果(条件25℃±2℃、rh60%±5%)
以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属技术领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!