预后预测方法、系统及设备与流程
本发明属于风险预测技术领域,具体涉及一种预后预测方法、系统及设备。
背景技术:
胃癌是全球最常见的恶性肿瘤之一,死亡率高,严重威胁人类健康。中国是胃癌高发国家,发病例数和死亡例数分别占全球胃癌发病和死亡的42.6%和45.0%,在全球183个国家中排名发病率第5位、死亡率第6位。
腹膜转移是影响胃癌患者长期生存的首要原因,是进展期胃癌临床诊治面临的最大挑战。原发或继发于腹膜表面的恶性肿瘤被统称为腹膜癌,胃癌来源腹膜转移癌即称为胃癌腹膜癌(gastriccancerwithperitonealcarcinomatosis,gcpc),包括初诊即合并的同时性gcpc和术后复发转移的异时性gcpc,主要表现为大小、数量不等的肿瘤结节弥漫分布于腹膜和肠系膜表面,导致难治性腹水、进行性肠梗阻和顽固性腹痛。既往认为,gcpc是疾病终末期表现,预后极差。
目前,基于对腹膜癌发病机制的深入研究,国际肿瘤学界已将部分腹膜转移癌定义为一种区域性癌转移,而非广泛转移,并发展探索出了一套以肿瘤细胞减灭术(cytoreductivesurgery,crs)加腹腔热灌注化疗(hyperthermicintraperitonealchemotherapy,hipec)为核心的综合治疗新策略。该治疗策略的主要优势是通过crs切除肉眼可见的病灶,通过hipec清除腹盆腔内微转移灶和游离癌细胞。对于部分经谨慎选择的病例,该综合治疗体系不但能够有效控制病情进展,并有可能达到临床治愈。
但是,crs+hipec治疗gcpc,部分患者预后极差,而部分患者疗效显著,临床症状得以缓解,生活质量得以提高,生存期得以延长。目前,影响crs+hipec治疗gcpc的独立预后因子尚无定论,对于gcpc患者接受crs+hipec后的生存预后预测仅限于单中心经验的单因子独立评估,尚未建立完善的预后预测模型。因此,如何精准预测crs+hipec治疗gcpc的预后情况,成为现有技术中亟待解决的问题。
技术实现要素:
为了至少解决现有技术存在的问题,本发明提供了一种预后预测方法、系统及设备。
本发明提供的技术方案如下:
一方面,一种预后预测方法,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,包括:
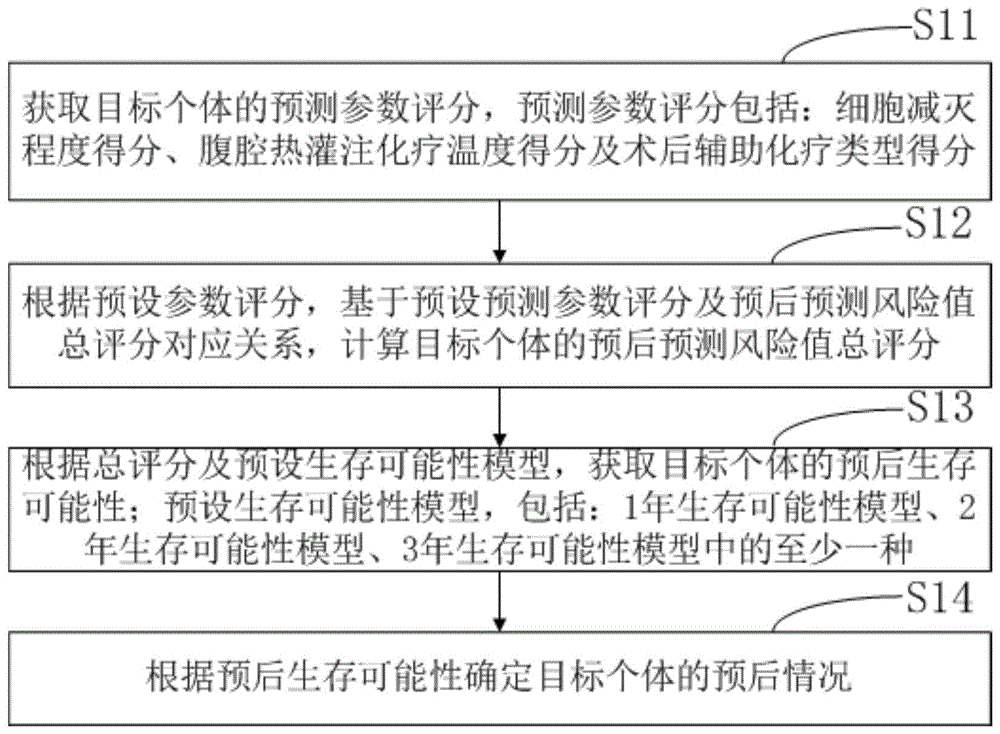
获取目标个体的预测参数评分,所述预测参数评分包括:细胞减灭程度得分、腹腔热灌注化疗温度得分及术后辅助化疗类型得分;
根据所述预设参数评分,基于预设预测参数评分及预后预测风险值总评分对应关系,计算所述目标个体的预后预测风险值总评分;
根据所述总评分及预设生存可能性模型,获取所述目标个体的预后生存可能性;所述预设生存可能性模型,包括:1年生存可能性模型、2年生存可能性模型、3年生存可能性模型中的至少一种;
根据所述预后生存可能性确定所述目标个体的预后情况。
可选地,所述1年生存可能性模型的计算规则包括:1年生存可能性=7.1e-8*points3+-3.357e-5*points2+0.00117126*points+0.761542472;
所述2年生存可能性模型的计算规则包括:2年生存可能性=6.5e-8*points3-1.1193e-5*points2-0.003450861*points+0.625968581;
所述3年生存可能性模型的计算规则包括:3年生存可能性=6.5e-8*points3-1.956e-6*points2-0.00407139*points+0.445047904;
其中,生存可能性points为所述预后预测风险值总评分。
可选地,所述预设预测参数评分及预后预测风险值总评分对应关系,包括:
预后预测风险值总评分=细胞减灭程度得分+腹腔热灌注化疗温度得分+术后辅助化疗类型得分。
可选地,细胞减灭程度得分规则包括:完全肿瘤细胞减灭,分数为0分;不完全肿瘤细胞减灭,分数为100分;
腹腔热灌注化疗温度得分规则,包括:腹腔热灌注化疗温度为43℃,分数为0分;腹腔热灌注化疗温度为42℃,分数为56分;
术后辅助化疗类型得分规则,包括:无辅助化疗,分数为79分;仅腹腔化疗,分数为25分;仅静脉化疗,分数为18分;静脉化疗联合腹腔化疗,分数为0分。
可选地,所述细胞减灭程度得分规则包括:肿瘤细胞减灭程度评分为0分时,分数为0分;肿瘤细胞减灭程度评分为1分、2分、3分时,分数为100分;
所述肿瘤细胞减灭程度评分规则为:crs后未见肿瘤组织,0分;残余瘤直径<2.5mm,1分;残余瘤直径2.5mm~2.5cm,2分;残余肿瘤直径>2.5cm,或残留无法切除或姑息切除病灶,3分。
可选地,所述细胞减灭程度得分的获取,包括:不完全肿瘤细胞减灭概率;
所述不完全肿瘤细胞减灭概率的获取,包括:
获取目标个体的细胞减灭参数,所述细胞减灭参数包括:术前肿瘤标志物、腹膜癌时相及术前腹膜癌指数;
基于预设的细胞减灭参数获取不完全肿瘤细胞减灭总评分;
基于所述不完全肿瘤细胞减灭总评分及预设不完全肿瘤细胞减灭模型,获取所述目标个体的不完全肿瘤细胞减灭概率;
其中,所述不完全肿瘤细胞减灭总评分=术前肿瘤标志物得分+腹膜癌时相得分+术前腹膜癌指数得分;
其中,术前肿瘤标志物得分规则为:术前肿瘤标志物正常,分数为0分;术前肿瘤标志物异常,分数为13分;
腹膜癌时相得分规则为:同时性腹膜癌,分数为0分;异时性腹膜癌,分数为19分;
术前腹膜癌指数(pci)得分规则为:pci得分=2.631578947*pci-2.631578947。
可选地,所述预设不完全肿瘤细胞减灭模型的计算规则,包括:
不完全肿瘤细胞减灭概率=-4.05e-0.5*points3+0.005065098*points2-0.175357667*points+1.941888182;
其中,points为所述不完全肿瘤细胞减灭总评分。
又一方面,一种预后预测系统,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,包括:获取模块、计算模块、预测模块和确定模块;
所述获取模块,用于获取目标个体的预测参数评分,所述预测参数评分包括:细胞减灭程度得分、腹腔热灌注化疗温度得分及术后辅助化疗类型得分;
所述计算模块,用于根据所述预设参数评分,基于预设预测参数评分及预后预测风险值总评分对应关系,计算所述目标个体的预后预测风险值总评分;
所述预测模块,用于根据所述总评分及预设生存可能性模型,获取所述目标个体的预后生存可能性;所述预设生存可能性模型,包括:1年生存可能性模型、2年生存可能性模型、3年生存可能性模型中的至少一种;
所述确定模块,用于根据所述预后生存可能性确定所述目标个体的预后情况。
可选地,所述预测模块依据的所述1年生存可能性模型的计算规则包括:1年生存可能性=7.1e-8*points3+-3.357e-5*points2+0.00117126*points+0.761542472;
所述2年生存可能性模型的计算规则包括:2年生存可能性=6.5e-8*points3-1.1193e-5*points2-0.003450861*points+0.625968581;
所述3年生存可能性模型的计算规则包括:3年生存可能性=6.5e-8*points3-1.956e-6*points2-0.00407139*points+0.445047904;
其中,生存可能性points为所述预后预测风险值总评分;
所述预后预测风险值总评分=细胞减灭程度得分+腹腔热灌注化疗温度得分+术后辅助化疗类型得分;其中,细胞减灭程度得分规则包括:完全肿瘤细胞减灭,分数为0分;不完全肿瘤细胞减灭,分数为100分;腹腔热灌注化疗温度得分规则,包括:腹腔热灌注化疗温度为43℃,分数为0分;腹腔热灌注化疗温度为42℃,分数为56分;术后辅助化疗类型得分规则,包括:无辅助化疗,分数为79分;仅腹腔化疗,分数为25分;仅静脉化疗,分数为18分;静脉化疗联合腹腔化疗,分数为0分。
又一方面,一种预后预测设备,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,包括:处理器,以及与所述处理器相连接的存储器;
所述存储器用于存储计算机程序,所述计算机程序至少用于执行上述任一项所述的预后预测方法;
所述处理器用于调用并执行所述存储器中的所述计算机程序。
本发明的有益效果为:
本发明实施例提供的预后预测方法、系统及设备,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,通过获取目标个体的预测参数,对预测参数进行评分,从而获取的目标个体的预后预测风险值总评分,通过总评分与预设的生存可能性模型,从而得到目标个体的1年生存可能性、2年生存可能性或3年生存可能性,从而通过生存可能性来判断目标个体的预后情况,生存可能性越高则表示该目标个体的预后良好、生成期长的可能性越大。从而使得患者或医护人员较为精确地了解到肿瘤细胞减灭术加腹腔热灌注化疗治疗胃癌腹膜癌的预后风险,从而做出选择。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例提供的一种预后预测方法流程示意图;
图2为本发明实施例提供的一种预后预测系统结构示意图;
图3为本发明实施例提供的一种预后预测设备结构示意图;
图4为115例gcpc患者总生存曲线图;
图5为1年、2年、3年生存可能性预测列线图;
图6为1年(a)、2年(b)、3年(c)生存可能性预测校准曲线;
图7为预测不完全肿瘤细胞减灭程度概率的列线图;
图8为预测不完全肿瘤细胞减灭列线图的校准曲线。
附图标记:
21-获取模块;22-计算模块;23-预测模块;24-确定模块;31-处理器;32-存储器。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
腹膜转移是影响胃癌患者长期生存的首要原因,是进展期胃癌临床诊治面临的最大挑战。原发或继发于腹膜表面的恶性肿瘤被统称为腹膜癌,胃癌来源腹膜转移癌即称为胃癌腹膜癌(gastriccancerwithperitonealcarcinomatosis,gcpc),包括初诊即合并的同时性gcpc和术后复发转移的异时性gcpc,主要表现为大小、数量不等的肿瘤结节弥漫分布于腹膜和肠系膜表面,导致难治性腹水、进行性肠梗阻和顽固性腹痛。
crs+hipec治疗gcpc,在全球肿瘤学界广泛研究,规范化crs+hipec可延长gcpc患者中位总生存期至13个月,或较传统治疗方法总生存期延长近一倍,且部分患者可实现长期生存或达到临床治愈。crs+hipec安全性可接受,围手术期死亡率低于6%,3-4级不良事件发生率低于20%,与常规普外科大手术相比无显著差异。因此,如何精准预测预后风险,使得crs+hipec的应用最大化,成为当前亟待解决的问题。
基于此,本发明实施例提供了一种预后预测方法,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,以完成对预后风险的预测。
图1为本发明实施例提供的一种预后预测方法流程示意图,请参阅图1,本发明实施例提供的预后预测方法,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,可以包括以下步骤:
s11、获取目标个体的预测参数评分,预测参数评分包括:细胞减灭程度得分、腹腔热灌注化疗温度得分及术后辅助化疗类型得分。
s12、根据预设参数评分,基于预设预测参数评分及预后预测风险值总评分对应关系,计算目标个体的预后预测风险值总评分;
s13、根据总评分及预设生存可能性模型,获取目标个体的预后生存可能性;预设生存可能性模型,包括:1年生存可能性模型、2年生存可能性模型、3年生存可能性模型中的至少一种;
s14、根据预后生存可能性确定目标个体的预后情况。
在一个具体的预测过程中,可以定义待预测患者为目标个体,获取目标个体的预测参数,从而对目标个体的预测参数按照一定规则进行评分,并计算目标个体的预后预测风险值总评分,通过总评分及预设生存可能性模型,确定目标个体的预后生存可能性。获取预后预测死亡概率值。
例如,当肿瘤患者在不确定crs(肿瘤细胞减灭术,以下简称crs)+hipec(腹腔热灌注化疗,以下简称hipec)后的死亡风险时,可以通过本实施例提供的预后预测方法来进行预后风险值的预测。
可选地,1年生存可能性模型的计算规则包括:1年生存可能性=7.1e-8*points3+-3.357e-5*points2+0.00117126*points+0.761542472;
2年生存可能性模型的计算规则包括:2年生存可能性=6.5e-8*points3-1.1193e-5*points2-0.003450861*points+0.625968581;
3年生存可能性模型的计算规则包括:3年生存可能性=6.5e-8*points3-1.956e-6*points2-0.00407139*points+0.445047904;
其中,生存可能性points为预后预测风险值总评分。
可选地,预设预测参数评分及预后预测风险值总评分对应关系,包括:
预后预测风险值总评分=细胞减灭程度得分+腹腔热灌注化疗温度得分+术后辅助化疗类型得分。
其中,细胞减灭程度得分规则包括:完全肿瘤细胞减灭,分数为0分;不完全肿瘤细胞减灭,分数为100分。
腹腔热灌注化疗温度得分规则,包括:腹腔热灌注化疗温度为43℃,分数为0分;腹腔热灌注化疗温度为42℃,分数为56分。
术后辅助化疗类型得分规则,包括:无辅助化疗,分数为79分;仅腹腔化疗,分数为25分;仅静脉化疗,分数为18分;静脉化疗联合腹腔化疗,分数为0分。
细胞减灭程度得分规则包括:肿瘤细胞减灭程度评分为0分时,分数为0分;肿瘤细胞减灭程度评分为1分、2分、3分时,分数为100分;
根据获取到的目标个体的实际参数,进行评分。
在目标个体进行肿瘤细胞减灭术完成后,按照sugarbaker标准,进行肿瘤细胞减灭程度(completenessofcytoreduction,cc)评分。评分标准为:cc0分,crs后未见肿瘤组织;cc1分,残余瘤直径<2.5mm;cc2分,残余瘤直径2.5mm~2.5cm;cc3分,残余肿瘤直径>2.5cm,或残留无法切除或姑息切除病灶。
可选地,细胞减灭程度评分的获取,细胞减灭程度得分的获取,包括:不完全肿瘤细胞减灭概率;不完全肿瘤细胞减灭概率的获取,包括:
获取目标个体的细胞减灭参数,细胞减灭参数包括:术前肿瘤标志物、腹膜癌时相及术前腹膜癌指数;基于预设的细胞减灭参数获取不完全肿瘤细胞减灭总评分;基于不完全肿瘤细胞减灭总评分及预设不完全肿瘤细胞减灭模型,获取目标个体的不完全肿瘤细胞减灭概率。
其中,不完全肿瘤细胞减灭总评分=术前肿瘤标志物得分+腹膜癌时相得分+术前腹膜癌指数得分。
其中,术前肿瘤标志物得分规则为:术前肿瘤标志物正常,分数为0分;术前肿瘤标志物异常,分数为13分;
腹膜癌时相得分规则为:同时性腹膜癌,分数为0分;异时性腹膜癌,分数为19分;
术前腹膜癌指数(pci)得分规则为:pci得分=2.631578947*pci-2.631578947。即pci=1时,分数为0;pci=2时,分数为3;pci=3时,分数为4;pci=4时,分数为8;pci=5时,分数为11;pci=6时,分数为13;pci=7时,分数为16;pci=8时,分数为18;pci=9时,分数为21;pci=10时,分数为24;pci=11时,分数为26;pci=12时,分数为29;pci=13时,分数为32;pci=14时,分数为34;pci=15时,分数为37;pci=16时,分数为39;pci=17时,分数为42;pci=18时,分数为45;pci=19时,分数为47;pci=20时,分数为50;pci=21时,分数为53;pci=22时,分数为55;pci=23时,分数为58;pci=24时,分数为61;pci=25时,分数为63;pci=26时,分数为66;pci=27时,分数为68;pci=28时,分数为71;pci=29时,分数为74;pci=30时,分数为76;pci=31时,分数为79;pci=32时,分数为82;pci=33时,分数为84;pci=34时,分数为87;pci=35时,分数为89;pci=36时,分数为92;pci=37时,分数为95;pci=38时,分数为97;pci=39时,分数为100。
可选地,预设不完全肿瘤细胞减灭模型的计算规则,包括:
不完全肿瘤细胞减灭概率=-4.05e-0.5*points3+0.005065098*points2-0.175357667*points+1.941888182;
其中,points为不完全肿瘤细胞减灭总评分。。
其中,术前腹膜癌指数(peritonealcancerindex,pci),用于判断腹膜转移程度及完全肿瘤细胞减灭可行性,可以在术前检查中通过影像学检查获得。术前肿瘤标志物、腹膜癌时相均可以在检查和治疗中获得。
本发明实施例提供的预后预测方法,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,通过获取目标个体的预测参数,对预测参数进行评分,从而获取的目标个体的预后预测风险值总评分,通过总评分与预设的生存可能性模型,从而得到目标个体的1年生存可能性、2年生存可能性或3年生存可能性,从而通过生存可能性来判断目标个体的预后情况,生存可能性越高则表示该目标个体的预后良好、生存期长的可能性越大。从而使得患者或医护人员较为精确地了解到肿瘤细胞减灭术加腹腔热灌注化疗治疗胃癌腹膜癌的预后风险,从而做出选择。
基于一个总的发明构思,本发明实施例还提供一种预后预测系统。
图2为本发明实施例提供的一种预后预测系统结构示意图,请参阅图2,本发明实施例提供的预后预测系统,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,可以包括:获取模块21、计算模块22、预测模块23和确定模块24;
获取模块21,用于获取目标个体的预测参数评分,预测参数评分包括:细胞减灭程度得分、腹腔热灌注化疗温度得分及术后辅助化疗类型得分。
计算模块22,用于根据预设参数评分,基于预设预测参数评分及预后预测风险值总评分对应关系,计算目标个体的预后预测风险值总评分。
预测模块23,用于根据总评分及预设生存可能性模型,获取目标个体的预后生存可能性;预设生存可能性模型,包括:1年生存可能性模型、2年生存可能性模型、3年生存可能性模型中的至少一种。
确定模块24,用于根据预后生存可能性确定目标个体的预后情况。
可选地,预测模块23依据的1年生存可能性模型的计算规则包括:1年生存可能性=7.1e-8*points3+-3.357e-5*points2+0.00117126*points+0.761542472;
2年生存可能性模型的计算规则包括:2年生存可能性=6.5e-8*points3-1.1193e-5*points2-0.003450861*points+0.625968581;
3年生存可能性模型的计算规则包括:3年生存可能性=6.5e-8*points3-1.956e-6*points2-0.00407139*points+0.445047904;
其中,生存可能性points为预后预测风险值总评分;
预后预测风险值总评分=细胞减灭程度得分+腹腔热灌注化疗温度得分+术后辅助化疗类型得分;其中,细胞减灭程度得分规则包括:完全肿瘤细胞减灭,分数为0分;不完全肿瘤细胞减灭,分数为100分;腹腔热灌注化疗温度得分规则,包括:腹腔热灌注化疗温度为43℃,分数为0分;腹腔热灌注化疗温度为42℃,分数为56分;术后辅助化疗类型得分规则,包括:无辅助化疗,分数为79分;仅腹腔化疗,分数为25分;仅静脉化疗,分数为18分;静脉化疗联合腹腔化疗,分数为0分。
关于上述实施例中的系统,其中各个模块执行操作的具体方式已经在有关该方法的实施例中进行了详细描述,此处将不做详细阐述说明。
本发明实施例提供的预后预测系统,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,通过获取目标个体的预测参数,对预测参数进行评分,从而获取的目标个体的预后预测风险值总评分,通过总评分与预设的生存可能性模型,从而得到目标个体的1年生存可能性、2年生存可能性或3年生存可能性,从而通过生存可能性来判断目标个体的预后情况,生存可能性越高则表示该目标个体的预后良好、生存期长的可能性越大。从而使得患者或医护人员较为精确地了解到肿瘤细胞减灭术加腹腔热灌注化疗治疗胃癌腹膜癌的预后风险,从而做出选择。
基于一个总的发明构思,本发明实施例还提供一种预后预测设备。
图3为本发明实施例提供的一种预后预测设备结构示意图,请参阅图3,本发明实施例提供的预后预测设备,应用于肿瘤细胞减灭术加腹腔热灌注化疗预后预测,可以包括:处理器31,以及与处理器31相连接的存储器32。
存储器32用于存储计算机程序,计算机程序至少用于执行上述任一项实施例记载的预后预测方法。处理器31用于调用并执行存储器中的计算机程序。
为了对本发明实施例提供的技术方案进行验证说明,本实施例提供了一验证实施例:
(一)实验验证过程
1、临床资料:研究对象为2005年1月~2017年12月,于某医院接受crs+hipec治疗的gcpc患者。纳入患者均满足以下纳入和排除标准。
纳入标准:(1)经病理组织学和/或细胞学证实为gcpc;(2)年龄20~75岁;(3)卡氏评分(karnofskyperformancestatusscore,kps)>60分,预期生存期超过3个月;(4)外周血白细胞≥3,500/mm3、血小板≥80,000/mm3;(5)适宜肝功能:总胆红素、天冬氨酸转氨酶(aspartateaminotransferase,ast)、谷丙转氨酶(alanine-transaminase,alt)≤2×正常值上限(upperlimitofnormal,uln);(6)适宜肾功能:血肌酐值<1.2×uln;(7)心、肝、肺、肾功能及其他主要脏器能够耐受长时间大手术。
排除标准:(1)年龄<20岁或>75岁;(2)术前常规检查发现肺、脑、骨、肝脏等远处转移及明显腹膜后淋巴结转移;(3)肝功能转氨酶≥2×uln;(4)血肌酐值≥1.2×uln;(5)影像学诊断明显肠系膜挛缩;(6)机体衰竭、恶病质病人及主要脏器不能耐受大手术病人。
研究对象的年龄处于20-75岁之间,年龄跨度大,符合研究的全面性;研究对象的纳入标准与排除标准涵盖范围大,符合研究的全面性。
研究中收集2005年~2017年间于该医院接受肿瘤细胞减灭术加腹腔热灌注化疗综合治疗的115例胃癌腹膜癌患者临床资料与预后信息建立数据库,以主要临床病理特征及手术相关指标划分亚组进行相关统计分析。
2、患者治疗
所有患者均按《细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识》推荐行术前检查、crs+hipec及术后辅助治疗。
1)术前检查
所有拟接受crs+hipec治疗的患者都必须经过严格的术前检查及术前评估,包括血清学检查、影像学检查、腹腔镜探查(必要时)及腹水脱落细胞学检查。
血清学检查:常规血清学检查包括血常规、肝肾功能、心肌酶谱、凝血功能、血清肿瘤标志物、血型、肝炎抗体、艾滋病抗体、梅毒抗体检查。当患者年龄大于50岁,且合并高血压、糖尿病、冠心病、高脂血症时,检测心肌损伤标志物、脑钠肽。血清肿瘤标志物首选癌胚抗原(carcino-embryonicantigen,cea)+糖类抗原125(carbohydrateantigen125,ca125)+糖类抗原19-9(carbohydrateantigen19-9,ca19-9)联合检测。
影像学检查:术前影像学检查包括静态影像学和动态影像学检查两部分。腹、盆腔多层螺旋ct增强扫描+多平面重建,可估算术前腹膜癌指数(peritonealcancerindex,pci),用于判断腹膜转移程度及完全肿瘤细胞减灭可行性。当影像学检查无法明确是否能实现完全肿瘤细胞减灭时,应慎重选择crs+hipec,必要时行腹腔镜探查及镜下pci评分,预估是否可以达到完全肿瘤细胞减灭,然后再决定是否行crs+hipec。
还可以进行腹腔镜探查及腹水脱落细胞学检查。
2)crs
在术前检查完成后,进行crs。
肿瘤细胞减灭术完成后,按照sugarbaker标准,行肿瘤细胞减灭程度(completenessofcytoreduction,cc)评分。评分标准为:cc0分,crs后未见肿瘤组织;cc1分,残余瘤直径<2.5mm;cc2分,残余瘤直径2.5mm~2.5cm;cc3分,残余肿瘤直径>2.5cm,或残留无法切除或姑息切除病灶。评估完成后即刻行hipec。
本实验中,腹腔热灌注化疗仪采用武汉一海数字工程有限公司研制的es-6001型腹腔热灌注化疗仪或广州保瑞医疗技术有限公司生产的br-trg-ii型体腔热灌注治疗系统,仪器具有通用性,因此,治疗结果可以作为实验数据。设定灌注温度为42℃或43℃,灌注时间为60分钟或90分钟,流速为400ml/h。
辅助治疗:手术患者恢复后,根据病理学报告检查结果,进行常规辅助化疗,包括全身(folfox、folfiri为主)化疗或全身化疗联合腹腔化疗(铂类),通常化疗6周期。
3、数据采集
本研究数据均源自该医院建立的腹膜癌前瞻性数据库。数据采集主要包括基本临床病理特征、crs+hipec手术相关信息、术后辅助治疗、安全性、生存相关随访信息。基本临床病理特征包括:年龄、性别、kps评分、临床分期、病理诊断、基础疾病、是否接受新辅助化疗、同时/异时性腹膜癌等;crs+hipec相关信息包括腹水量、pci、器官切除与腹膜切除、hipec方案、cc评分、手术时长、出入量等;术后辅助治疗情况及安全性包括:术后生命体征变化、主要脏器功能指标变化、消化道功能恢复时间、术后化疗方式、化疗周期、不良事件等;围手术期不良事件按照美国国立癌症研究所通用术语标准(nationalcancerinstitutecommonterminologycriteria,nci-ctc),i~iii级为不良事件,经过对症治疗后恢复正常;4~5级为严重不良事件(seriousadverseevent,sae),主要包括与本治疗直接相关死亡、严重感染、肠瘘或吻合口漏等危及生命的并发症。生存相关随访信息包括:生存状态、总生存期等。总生存期定义为从明确诊断gcpc至gcpc相关死亡或随访截止时间。术前肿瘤标志物cea、ca19-9、或ca125任一指标超出正常范围,即认定为术前肿瘤标志物异常,否则为术前肿瘤标志物正常。
所有患者通过门诊、电话进行随访信息检查,随访包括:体格检查、血清肿瘤标志物检查(cea、ca125、ca19-9)、胸腹盆腔ct、胃肠碘水造影。随访记录主要包括生存状态、死亡时间,末次统一电话随访日期为2018年12月31日,随访率为100%。
4、数据分析--统计学方法
采用microsoftexcel2013、spss20.0、r3.5.1(https://www.r-project.org/)软件进行数据分析和图表绘制,使用的r包为“rms”、“survival”。计数资料以频数表示,分析组距和中位数,假设检验采用χ2检验,当20%以上理论频数小于5时,采用fisher确切概率法。计量资料以实测数据表示,分析平均值和标准差,假设检验采用t检验或非参数检验;部分临床计量指标分析中位数和组距,假设检验采用非参数检验(mann-whitneyu检验),比较分布情况。p<0.05为差异有统计学意义。
总生存及亚组生存分析采用kaplan-meier生存函数,log-rank检验比较生存曲线,生存曲线截点时间为60个月。单因素生存分析结果提示p<0.1的预后预测因子纳入多因素cox比例风险回归模型,筛选影响患者生存的独立预后因素。
肿瘤细胞减灭程度相关危险因子单因素分析中,计数参数采用χ2检验,计量参数采用非参数检验(mann-whitneyu检验),比较分布情况;单因素分析中p<0.1的因子纳入多因素逻辑回归模型,采用最大偏似然估计似然比检测向前选择法,筛选独立危险因素。。
利用多因素逻辑回归模型和cox比例风险回归模型结果绘制列线图。从原始数据中随机抽样(bootstrap)1000次组成内部验证数据集,使用该数据集进行列线图内部验证,用一致性系数(consistencyindex,c-index)评估该模型预测性能,用校准曲线判断预测符合度。c-index值的范围为0.5~1.0,当c-index值为0.5时,表示模型完全没有预测能力;c-index值为0.5~0.7时,表示模型具有预测准确度较低;c-index值为0.70~0.9时,表示模型预测准确度较高;c-index值为大于0.9时,表示模型预测准确度高。校准曲线是预测风险和患者真实风险的图像比较,预测风险越接近于标准曲线,则模型的符合度越好。
5、分析结果
1)基本临床病理学特征
本研究纳入115例gcpc患者,共接受crs+hipec治疗121次,其中1例患者行3次crs+hipec,4例患者行2次crs+hipec。详细临床病理特征见表1。
表1.115例gcpc患者基本临床病理特征
a5例患者病理类型数据缺失
b3例患者术前肿瘤标志物检测结果缺失
2)crs+hipec相关参数
115例gcpc患者手术相关参数详见表2。
表2.crs+hipec相关参数
a1u=200ml
b1u=25ml
3)总生存分析
图4为115例gcpc患者总生存曲线图。
115例gcpc患者中位随访时间为10.9月(0.7-141.6月),死亡103例(89.6%),中位总生存期为13.1月(95%ci:11.3-15.0月),1年、2年、3年、5年生存率分别为:56.5%、25.3%、12.6%、8.1%。4例患者总生存时间超过5年,且目前均仍无病生存,总无病生存时间分别为141.6月、85.3月、73.1月和65.5月(图4)。
影响总生存期的单因素分析:
以基本临床病理特征和术中相关参数分组,行生存亚组分析,结果见表3。
表3.影响总生存期的主要预后因子单因素生存分析
影响总生存期的多因素分析:
将性别、术前肿瘤标志物、腹膜癌时相、hipec温度、hipec时长、cc评分、严重不良事件、辅助化疗类型、pci纳入多因素cox比例风险回归模型进行多因素分析。
多因素分析结果显示(表4),cc评分(p<0.001)、hipec温度(p=0.006)、辅助化疗类型(p<0.001)为影响总生存期的独立预后因子。cc1-3患者死亡风险是cc-0患者的3.071倍(hr=3.071,95%ci:1.941-4.861,p<0.001)。hipec温度为43℃的患者死亡风险是hipec温度为42℃者的0.530倍(hr=0.530,95%ci:0.338-0.832,p=0.006),术后行系统化疗、系统+腹腔化疗与未行术后化疗的患者相比,死亡风险分别是后者的0.494倍(hr=0.494,95%ci:0.298-0.819,p<0.001)、0.417倍(hr=0.417,95%ci:0.244-0.711,p<0.001)。
表4.影响总生存期的多因素分析
6、预测风险值的验证
在本申请中,构建了1年生存可能性模型的计算规则包括:1年生存可能性=7.1e-8*points3+-3.357e-5*points2+0.00117126*points+0.761542472;
所述2年生存可能性模型的计算规则包括:2年生存可能性=6.5e-8*points3-1.1193e-5*points2-0.003450861*points+0.625968581;
所述3年生存可能性模型的计算规则包括:3年生存可能性=6.5e-8*points3-1.956e-6*points2-0.00407139*points+0.445047904;
其中,生存可能性points为预后预测风险值总评分;预后预测风险值总评分=细胞减灭程度得分+腹腔热灌注化疗温度得分+术后辅助化疗类型得分。
细胞减灭程度得分规则:完全肿瘤细胞减灭,分数为0分;不完全肿瘤细胞减灭,分数为100分。
腹腔热灌注化疗温度得分规则:腹腔热灌注化疗温度为43℃,分数为0分;腹腔热灌注化疗温度为42℃,分数为56分。
术后辅助化疗类型得分规则:无辅助化疗,分数为79分;仅腹腔化疗,分数为25分;仅静脉化疗,分数为18分;静脉化疗联合腹腔化疗,分数为0分。
细胞减灭程度得分规则:肿瘤细胞减灭程度评分为0分时,分数为0分;肿瘤细胞减灭程度评分为1分、2分、3分时,分数为100分。
肿瘤细胞减灭程度评分规则为:crs后未见肿瘤组织,0分;残余瘤直径<2.5mm,1分;残余瘤直径2.5mm~2.5cm,2分;残余肿瘤直径>2.5cm,或残留无法切除或姑息切除病灶,3分。
基于此,图5为1年、2年、3年生存可能性预测列线图;图6为1年(a)、2年(b)、3年(c)生存可能性预测校准曲线。
根据cc评分、hipec温度、术后辅助化疗类型三个独立预测因子绘制列线图,预测gcpc预后情况(图5)。根据列线图结果,cc评分为1-3分,被分配的分值为100分,hipec温度为42℃被分配的分值为56分,系统化疗被分配的分值为18分,腹腔化疗被分配的分值为25分,未行化疗被分配的分值为79分。预测1年生存可能性时,总分238分,生存可能性为10%;总分为180分,生存可能性为30%;总分为131分,生存可能性为50%;总分为71分,生存可能性为70%。预测2年生存可能性时,总分为205分,生存可能性为1%;总分为141分,生存可能性为10%;总分为83分,生存可能性30%;总分为34分,生存可能性为50%。预测3年生存可能性时,总分为156分,生存可能性为1%;总分为94分,生存可能性为10%;总分为36分,生存可能性为30%。
该列线图c-index为0.725(95%ci:0.672-0.778),提示通过此列线图所得预测与实际观察的一致性符合标准,列线图具有较高准确度。经过1000次bootstrap的自抽样内部验证,绘制校准曲线,分别比较1年(图6a)、2年(图6b)、3年(图6c)列线图生存可能性预测值与实际值,结果显示1年、2年、3年生存可能性预测值接近实际值,符合度好。
因此,参阅图6,根据实验数据与代入模型后的结果相比,可知,1年生存可能性模型、2年生存可能性模型、3年生存可能性模型可行。
7、影响肿瘤细胞减灭程度的单因素和多因素分析
比较完全肿瘤细胞减灭组及不完全肿瘤细胞减灭组基本临床特征及手术相关指标的差异,进行影响完全/不完全肿瘤细胞减灭的单因素分析。
完全肿瘤细胞减灭组和不完全肿瘤细胞减灭组在年龄(p=0.032)、kps评分(p=0.006)、术前肿瘤标志物(p<0.001)、腹膜癌时相(p<0.001)、pci评分(p<0.001)、腹水量(p<0.001)上的差异有统计学意义;而在性别(p=0.060)、原发瘤位置(p=0.290)、病理类型(p=0.813)、新辅助化疗(p=0.155)、受累器官切除术(p=0.140)、受累腹膜切除数(p=0.058)上的差异无统计学意义(表5)。
表5.影响完全/不完全肿瘤细胞减灭的单因素分析
以完全/不完全肿瘤细胞减灭为因变量,将年龄、kps评分、术前肿瘤标志物、腹膜癌时相、pci评分、腹水量、性别、受累腹膜切除数纳入多因素逻辑回归模型分析,结果显示术前肿瘤标志物(p=0.034)、腹膜癌时相(p=0.012)和pci(p<0.001)为独立预测因子。术前肿瘤标志物异常者无法实现完全肿瘤细胞减灭的风险是正常者的7.100倍(or=7.100,95%ci:1.157-43.584)。异时性腹膜癌无法实现完全肿瘤细胞减灭的风险是同时性腹膜癌的16.316倍(or=16.316,95%ci:1.860-143.145)。pci每增加1分,无法实现完全肿瘤细胞减灭的风险为之前的1.623倍(or=1.623,95%ci:1.180-2.234)(表6)。
表6.影响完全/不完全肿瘤细胞减灭的多因素分析
8、细胞减灭参数确定不完全肿瘤细胞减灭概率的估测模型的验证
本申请中,预设不完全肿瘤细胞减灭模型:
不完全肿瘤细胞减灭概率=-4.05e-0.5*points3+0.005065098*points2-0.175357667*points+1.941888182;其中,points为不完全肿瘤细胞减灭总评分。
不完全肿瘤细胞减灭总评分=术前肿瘤标志物得分+腹膜癌时相得分+术前腹膜癌指数得分;其中,术前肿瘤标志物正常,分数为0分;术前肿瘤标志物异常,分数为13分。腹膜癌时相得分规则为:同时性腹膜癌,分数为0分;异时性腹膜癌,分数为19分。术前腹膜癌指数(pci)得分规则为:pci得分=2.631578947*pci-2.631578947。
基于此,图7为预测不完全肿瘤细胞减灭程度概率的列线图;图8为预测不完全肿瘤细胞减灭列线图的校准曲线。
将腹膜癌时相、术前肿瘤标志物、pci三个独立预测因子引入列线图模型,预测gcpc患者无法实现完全肿瘤细胞减灭的概率(图7)。根据列线图模型结果,异时性腹膜癌被分配的分值为19分,术前肿瘤标志物异常被分配的分值为13分,pci从1至39被分配的分值依次为0分、3分、5分、8分、11分、13分、16分、18分、21分、24分、26分、29分、32分、34分、37分、39分、42分、45分、47分、50分、53分、55分、58分、61分、63分、66分、68分、71分、74分、76分、79分、82分、84分、87分、89分、92分、95分、97分、100分。总分为27分时,不完全肿瘤细胞减灭可能性为10%,32分时为20%,36分时为30%,39分时为40%,42分时为50%,44分时为60%,47分时为70%,51分时为80%,57分时为90%。例如,一位术前肿瘤标志物异常的同时性腹膜癌患者,pci为14,则总分为47分(术前肿瘤标志物异常13分+同时性腹膜癌0分+pci为34分),不完全肿瘤细胞减灭的可能性为70%。
该列线图c-index为0.984(95%ci:0.968-1.000),提示通过此列线图所得预测与实际观察的一致性符合标准,列线图具有高准确度。经过1000次bootstrap的自抽样内部验证,校准曲线见图8,预测值与真实值之间的符合度的平均误差为0.024,预测概率接近实际发生率,符合度好。
因此,根据实验数据与代入模型后的结果相比,可知,预设不完全肿瘤细胞减灭模型可行。
(二)实验验证结果
本实验分析了115例接受crs+hipec综合治疗的gcpc患者信息,得出如下结论:crs+hipec可延长gcpc患者生存期,部分患者可临床治愈,且安全性可接受;完全肿瘤细胞减灭术、43℃-hipec和术后系统化疗或系统化疗联合腹腔化疗是gcpc获得最大生存受益的关键;术前肿瘤标志物正常且pci小于13的同时性gcpc最适合接受crs+hipec治疗。
上述1年生存可能性模型、2年生存可能性模型、3年生存可能性模型可行,预设不完全肿瘤细胞减灭模型准确可行,根据本申请提出的预后预测方法,可以精准地获得目标个体的1年生存可能性预后情况、2年生存可能性预后情况、3年生存可能性预后情况。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!